葡萄(Vitis vinifera spp.)是多年生落叶藤本植物,栽培历史悠久。中国是葡萄生产大国,2020 年我国葡萄产量为1 431.4 万t,居世界前列[1]。休眠是落叶果树的典型特征,是植物应对外界环境变化和季节变化的一种生物适应性,是植物生长发育过程中的一个周期性时期[2]。葡萄作为一种典型的落叶果树,萌芽整齐度与产量密切相关[3]。南方地区是近年来发展最快的葡萄产区之一,但在南方地区,由于树形培养管理(1 年生枝条的培养)不当和需冷量积累不足,导致萌芽不整齐,造成在后期冬季修剪和盛花期花果管理上更加费时费工等问题。目前,单氰胺虽广泛应用于打破葡萄休眠,但其本身具有很强的毒性,使用过程中需要戴口罩、手套等,操作不便。因此,寻找一种可以有效打破休眠且理想安全的破眠方法尤为重要。
多年生落叶植物芽休眠是一种十分复杂的过程,受到多个通路基因的综合调控[4]。当植物芽开始进入休眠阶段时,可以抵御外界不良的环境条件,暂时停止生长,当外界环境适宜时,植物可恢复正常生长,是一种对植物有利的生物学特征。1987 年,Lang[2]等根据休眠的诱因把芽休眠分为内休眠、类休眠和生态休眠三大类,并将休眠的整个过程分为五个阶段:类休眠、类休眠-内休眠、内休眠、内休眠-生态休眠和生态休眠。内休眠(生理休眠,endodormancy)发生在冬季,是由植物内部原发性反应引起的生长停滞现象,这种原发性反应由休眠组织内部信号独自诱导引发[5]。处于内休眠阶段的芽,即使在有利的环境条件下,且没有附近器官的限制,也不能萌动,只有达到一定的低温积累后才能解除休眠。类休眠(paradormancy)是由分生组织外的因子引起的植物生长暂停现象,本质上是一个器官对另一个器官的影响,如芽的顶端优势[6]。处于类休眠阶段的芽,即使在环境条件有利时仍保持休眠,但若除去相邻器官的限制,则休眠结构会迅速恢复生长。生态休眠(ecodormancy)是指冬芽从生理休眠中释放后,由于环境因子限制暂未萌发,环境条件适宜时即可迅速恢复生长的现象[5]。
休眠和萌发是两个连续的生物学过程,芽休眠是温带落叶果树的一种适应机制[5]。葡萄的内休眠需要在经历一定的低温积累后才能自然打破,这种特性称为“需冷量”(chilling requirement),葡萄的需冷量一般需要0~7.2 ℃的低温积累600~1000 h。为使落叶果树能够在低纬度地区正常生长发育,人们通常通过使用氰氨类、硝酸盐类、植物生长调节剂(GA3、6-BA、TDZ 等)、大蒜汁、乙烯、破眠剂1 号等化学物质来代替部分低温的作用,提早打破休眠,使休眠芽提前萌发。
植物激素在芽休眠的形成与解除过程中发挥重要的调节作用,不同的植物激素以不同的作用方式来诱导和解除芽休眠。ABA 对萌芽有显著的抑制作用。在梨[7]、蓝莓[8]等多年生落叶果树中,外源ABA 可以促进芽的休眠而抑制芽的萌发。在桃花芽的休眠过程中,ABA 含量在生态休眠期逐渐降低并达到最低水平[9]。杨博等[10]研究表明,由Ppy‐ERF060、PpyABF3 和PpyMADS71 构成的互作网络可整合乙烯与脱落酸的信号通路进而调控梨芽休眠进程。玉米分蘖芽发生过程中,叶片与基部茎节中ABA 含量较低且呈下降的趋势,当生长停止时,ABA 含量上升[11]。在杨树上,转录因子SVL 可以通过促进CALS1(胼胝质合酶基因)的表达,抑制赤霉素的合成,控制自然休眠[12]。在桃中,外施GA 可以促进桃叶内休眠的解除[13]。梨花芽可能通过下调miR159 表达,提高GA 含量,促进花芽冬季休眠解除[14]。乙烯对葡萄芽休眠解除起一定的促进作用。在葡萄的研究中发现,外源乙烯处理使葡萄芽的萌发率显著提高,而抑制乙烯合成和信号转导后,葡萄芽的萌发受到抑制,推测乙烯可以作为刺激信号,促进葡萄芽休眠提前解除[15]。Khalil-Ur-Rehman 等[16]的研究结果表明,ABA、乙烯、赤霉素、生长素和细胞分裂素均参与了葡萄芽类休眠和内休眠的调控。
笔者对处于两种冬芽休眠阶段(类休眠阶段和内休眠阶段)的阳光玫瑰葡萄冬芽进行不同破眠处理,以未处理作为对照,进行单氰胺涂芽处理和石硫合剂+1-氨基环丙烷羧酸(ACC)涂芽处理。记录和观察处理后阳光玫瑰葡萄冬芽的生长发育动态,并统计其萌芽率、成花率及花穗质量。基于RNA-seq分析,筛选不同休眠阶段阳光玫瑰葡萄冬芽破眠的相关基因,通过对差异表达基因进行KEGG 代谢通路分析,探索不同休眠阶段阳光玫瑰葡萄冬芽休眠解除的关键影响基因。
1 材料和方法
1.1 试验材料
试验于2022—2023 年在湖南农业大学教学基地内进行,供试品种为4年生阳光玫瑰葡萄。栽培方式为起高垄式根域限制栽培,喷灌方式为微喷。试验所用试剂:石硫合剂(有效成分含量29%,山东东信生物农药有限公司);单氰胺(有效成分含量50%,宁夏大荣化工冶金有限公司);1-氨基环丙烷羧酸(ACC,纯度98%,上海源叶生物科技有限公司)。
1.2 试验方法
1.2.1 冬季(内休眠阶段)冬芽破眠处理与样品采集 2022年1月16日,对阳光玫瑰基部留2芽修剪,收集基部起第3节位以上的枝条78根在室外进行埋沙贮藏。于2022 年2 月28 日选取3~11 节位(9 个冬芽)的枝条在自然条件下进行涂芽处理(表1),每个处理26 根枝条。分别在0 h、处理后24 h 和72 h 收集冬芽。样品收集标准:每个处理随机取4根枝条,收集每根枝条全部的冬芽,并迅速放入液氮中速冻,随后保存在-80 ℃超低温冰箱备用。
表1 内休眠阶段离体枝条冬芽破眠处理
Table 1 Breaking dormancy treatment of winter buds in detached branches during endodormancy stage

处理Treatment T1 T2 CK药剂Medicament 2%单氰胺2%H2CN2 5°Bé石硫合剂+0.25 mg·mL-1ACC 5°Bé lime sulfur mixture+0.25 mg·mL-1ACC空白对照Control
2023 年2 月16 日,在6 年生“飞鸟”架活体阳光玫瑰葡萄树上重复上述试验,验证结果。
1.2.2 夏季(类休眠阶段)冬芽破眠处理与样品采集 2022 年8 月13 日,将平棚架“一”字形阳光玫瑰采收后的1年生主梢进行摘叶处理,将主梢进行第7节位短截后对其第5~7节位上的冬芽进行不同破眠剂处理(处理方法同表1),每个处理53 根枝条。分别在0 h、处理后24 h和72 h收集冬芽。样品收集标准:每个处理随机取10根枝条,每根枝条上取5~7节位上的3 个芽,并迅速放入液氮中速冻,随后保存在-80 ℃超低温冰箱备用。
1.2.3 观测指标与方法 以花芽出现明显膨大、鳞片松动、露绿较多作为萌发指标,进行冬芽萌芽率的统计。花穗长度分级标准:一级花穗长度≤3 cm;二级花穗长度为3~10 cm;三级花穗长度≥10 cm。
萌芽率/%=已萌动的冬芽数/调查的冬芽数×100。
成花率/%=有花穗新梢数/已萌动冬芽数×100。
1.2.4 RNA 提取、文库构建和转录组测序 将2022年2 月28 日、3 月1 日、3 月3 日和8 月13 日、8 月14日、8 月16 日收集的冬芽样品(表2)的RNA 提取以及转录组测序委托百迈客生物科技有限公司(北京)完成。使用Nanodrop2000(赛默飞,Nanodrop2000)对提取的RNA 进行浓度检测,并使用Agient2100,LabChip GX(厂家铂,型号铂金埃尔默LabChip GX)对完整性进行检测。样品检测合格后,进行文库构建:用带有Oligo(dT)的磁珠富集真核生物mRNA,加入Fragmentation Buffer 将mRNA 进行随机打断;以mRNA 为模板,进行逆转录合成第一条cDNA 链及其互补链,并经过纯化步骤去除;纯化的双链cDNA 再进行末端修复、加A 尾并连接测序接头,然后用AMPure XP beads 进行片段大小选择;最后通过PCR 富集得到cDNA 文库。经库检合格后,使用Illumina NovaSeq6000 测序平台进行PE150模式测序。
表2 送测样品情况
Table 2 Status of samples sent for testing
2022年2月February 2022处理Treatment CK CK CK T1 T1 T2 T2取样时间(处理后)Time of sampling(after processing)/h 0 24 72 24 72 24 72样品名称Name of sample W-CK-0 W-CK-24 W-CK-72 W-HC-24 W-HC-72 W-ACC-24 W-ACC-72 2022年8月August 2022处理Treatment CK CK CK T1 T1 T2 T2取样时间(处理后)Time of sampling(after processing)/h 0 24 72 24 72 24 72样品名称Name of sample S-CK-0 S-CK-24 S-CK-72 S-HC-24 S-HC-72 S-ACC-24 S-ACC-72
1.2.5 差异表达基因的筛选和分析 首先对样品中Mapped Reads的数目和转录本长度进行归一化处理,根据FPKM 值判定基因的相对表达量。不同样本中表达水平存在显著差异的基因称之为差异表达基因(DEGs)。根据不同样品之间表达水平的相对高低,差异表达基因可以分为上调基因(up-regulated gene)和下调基因(down-regulated gene)。使用edgeR 软件进行差异分析,将|log2Fold Change|≥1 且FDR<0.01 作为差异表达基因的筛选标准。使用百迈客分析平台,导出基因在不同样品中的功能注释和相关代谢通路等信息,差异表达基因基于GO 数据库和KEGG 数据库进行功能注释并按照生物学过程、细胞组分和分子功能对其富集分析,找出差异基因显著富集的GO term和KEGG term。
1.2.6 数据分析 所有数据的采集和计算均设3 个生物学重复。采用Excel 整理数据,采用GraphPad Prism8 和R 语言聚类程序作图;采用SPSS26.0 进行单因素ANOVA分析,多重比较采用LSD法。
2 结果与分析
2.1 不同破眠处理对不同休眠阶段葡萄萌芽和开花的影响
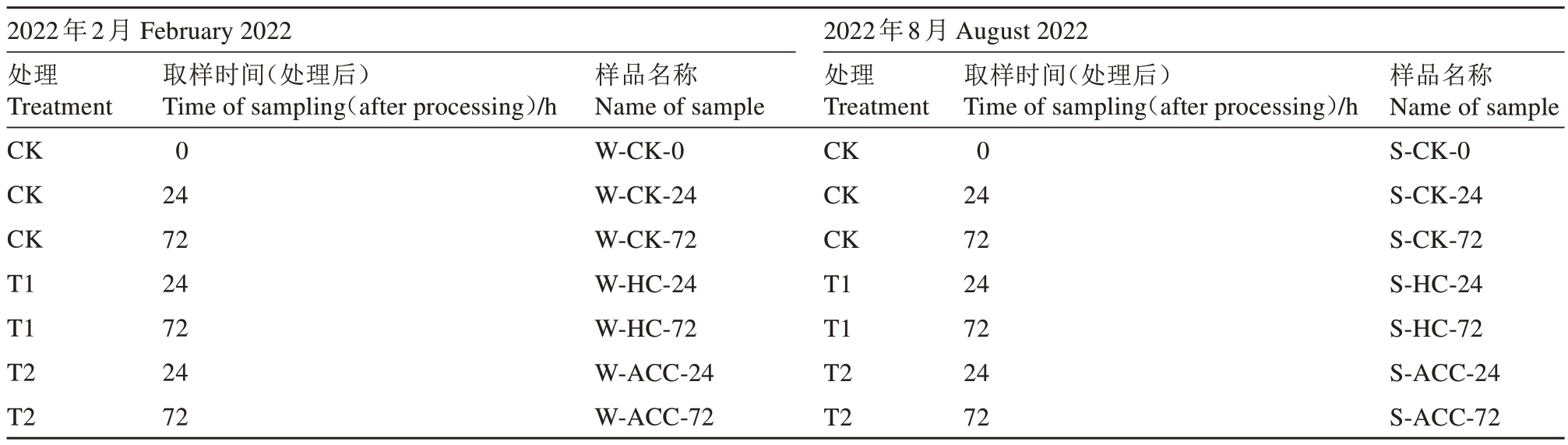
不同破眠处理对不同休眠阶段的阳光玫瑰葡萄芽的萌芽率、萌芽速度均会产生一定影响。内休眠阶段进行不同破眠处理后的葡萄离体枝条冬芽萌芽率结果(图1-A)表明,T1 处理萌芽最早,其次是T2处理,最后是CK,各处理萌芽整体速度呈先慢后快的趋势。2022 年4 月10 日,T1、T2 处理后的萌芽率与CK 相比开始出现显著差异,其中T2 处理的萌芽率最高。2022 年4 月15 日,T1 处理与T2 处理的萌芽率分别为81.48%和85.80%,均显著高于CK(66.05%)。类休眠阶段进行不同破眠处理后的葡萄冬芽萌芽率结果(图1-B)表明,T1处理萌芽最早,2022 年9 月3 日,T1、T2 处理后的萌芽率与CK 相比开始出现显著差异,其中T2 处理的萌芽率最高。2022 年9 月9 日,T1 与T2 处理的萌芽率分别为65.66%和69.70%,均显著高于CK(41.41%)。内休眠阶段进行不同破眠处理后的葡萄冬芽萌芽率结果(图1-C)表明,处理后25 d,T1、T2 处理的萌芽率与CK 相比开始出现显著差异,2023 年4 月3 日,T1 与T2 处理的萌芽率分别为96.43%和97.22%,均显著高于CK(76.19%)。
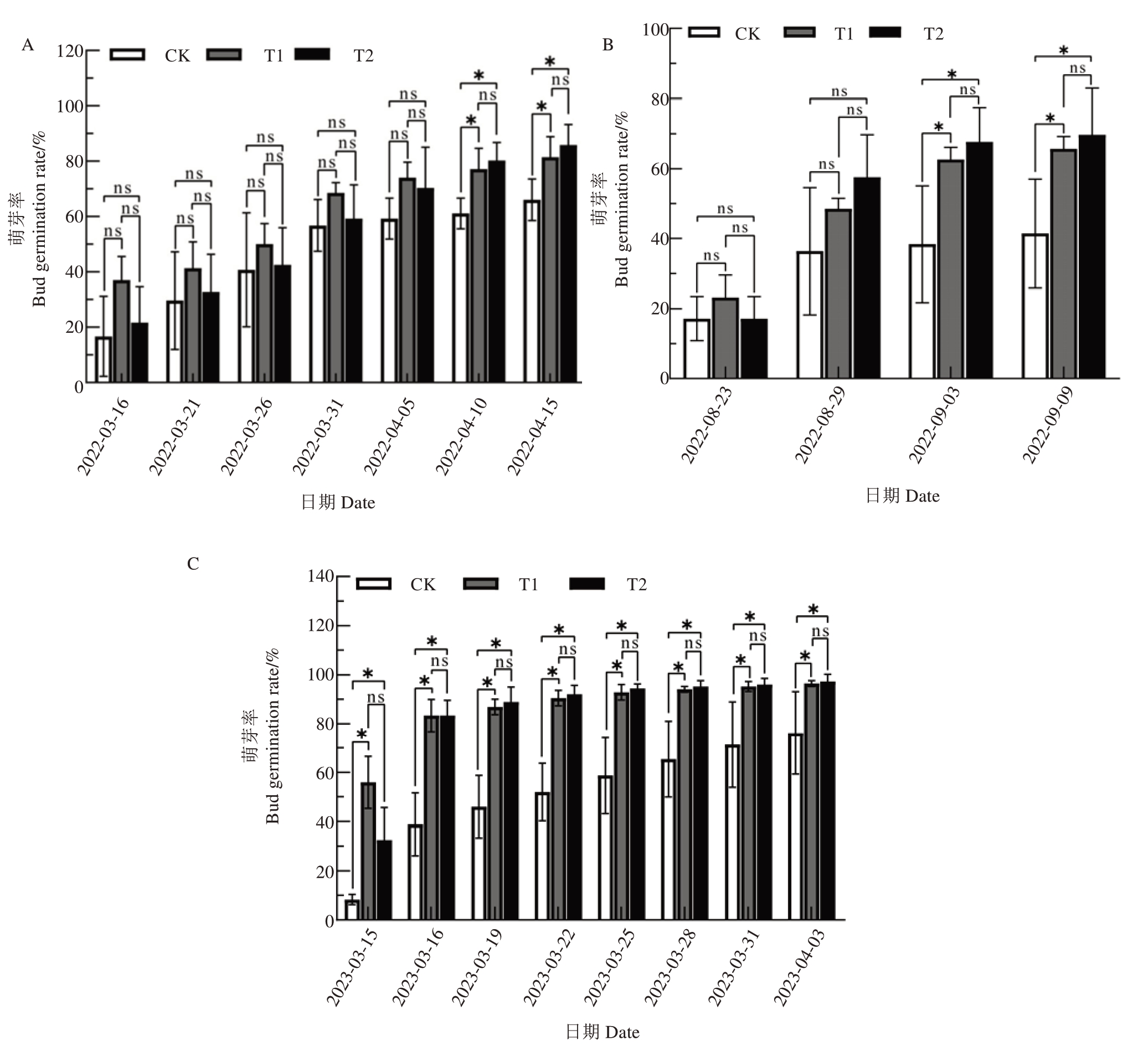
图1 不同时期不同破眠剂处理不同休眠阶段阳光玫瑰葡萄冬芽萌芽率比较
Fig.1 Shine Muscat grape winter bud germination rate comparison of different breaking dormancy treatments at different periods of dormant stages
A.对内休眠阶段离体枝条冬芽进行不同破眠处理后不同时间点的萌芽率比较;B.对类休眠阶段冬芽进行不同破眠处理后不同时间点的萌芽率比较;C.对内休眠阶段冬芽进行不同破眠处理后不同时间点的萌芽率比较。“*”表示两者之间有显著差异(p<0.05);“ns”表示两者之间无显著差异。
A.Comparison of germination rates at different time points after different dormancy-breaking treatments for winter buds of isolated branches in the internal dormancy stage;B.Comparison of germination rates at different time points after different dormancy-breaking treatments for winter buds in class dormancy stage;C.Comparison of germination rates at different time points after different dormancy-breaking treatments for winter buds in the internal dormancy stage.Asterisks“*”indicate a significant difference between the two treatments(p<0.05);“ns”indicates that there is no significant difference between the two treatments.
破眠处理后离体枝条上葡萄芽的生长发育动态如图2 所示,T1、T2 处理的葡萄芽提早解除休眠,均在2022 年3 月21 日出现2~3 枚新叶。T1 处理在2022年3月15日已经开始萌芽,萌芽开始时间最早,萌芽较为整齐;T2 处理的葡萄芽在3 月21 日左右开始萌芽,萌芽较为整齐。CK的葡萄芽在2022年4月2日出现2~3枚新叶,生长相对缓慢,萌芽不整齐。
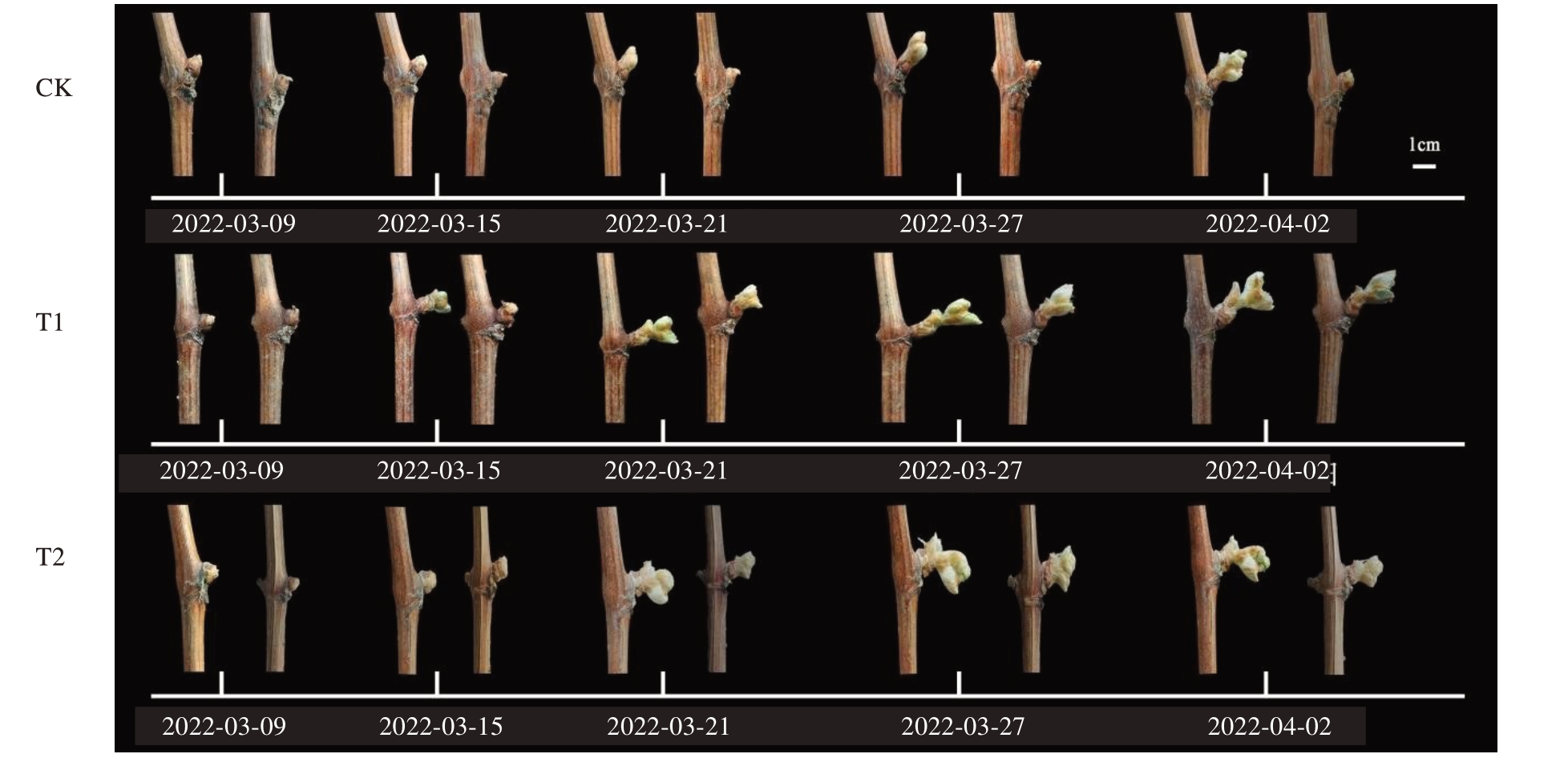
图2 不同破眠处理后阳光玫瑰葡萄代表芽发育动态图
Fig.2 Dynamic map of representative bud development of Shine Muscat grape treated with different breaking dormancy treatments
破眠处理后葡萄枝条生长状态如图3 所示,与CK 相比,2023 年4 月3 日,T1 处理后的叶片生长速度最快,其次是T2 处理。2023 年4 月29 日,T1、T2处理后的叶片生长速度、叶片大小、节间长度与CK相比无显著差异。

图3 不同破眠处理后阳光玫瑰葡萄枝条生长状态
Fig.3 Growth status of Shine Muscat grape branches treated with different breaking dormancy treatments
A-C.CK、T1、T2 处理后枝条萌芽时的状态(2023 年4 月3 日),五根代表枝条为一组;D-F.CK、T1、T2 处理后枝条开花前的状态(2023 年4 月29 日),一根典型枝条为代表。
A-C.state of branches at germination after CK,T1 and T2 treatments(April 3,2023),the five representative branches are a group;D-F.Pre-flowering state of branches after CK,T1 and T2 treatments(April 29,2023),a typical branch is represented.
为了解不同破眠处理对葡萄花穗的影响,笔者统计了不同破眠处理后所有1 年生枝条的成花情况。如图4所示,T1、T2处理对葡萄1年生枝条的成花率相比于CK 没有出现显著差异,同时也不影响花序长度。
图4 不同破眠处理对阳光玫瑰葡萄成花情况的影响
Fig.4 Effect of different dormant breaking on the flower formation of Shine Muscat grape
A.不同时期不同破眠处理后的冬芽成花率比较(2023 年4 月28 日);B.不同破眠剂处理对阳光玫瑰葡萄花穗长度的影响(2023 年4 月28 日)。
A.Comparison of flowering rate of winter buds at endodormant stage within different dormancy breaking treatments at different periods of time(April 28, 2023); B.Effects of different dormant breaker treatments on inflorescence length in Shine Muscat grapes during the endodormancy stage(April 28,2023).
2.2 转录组测序数据质量分析及序列比对
利用Illuminate 平台,完成14 个样本的转录组测序。为保证后续分析的准确性,笔者通过对原始数据进行一系列严格的质量控制后得到高质量的Clean Data。经过测序质量控制后,共得到92.92 Gb Clean Data,各样品Clean Data 均达到5.89 Gb,Q30碱基百分比在94.21%以上,GC 含量为45.72%~47.50%。以上结果表明测序质量较好,可以用于后续的比对分析。通过使用HISAT2 将Clean Reads与参考基因组进行比对后发现,各样本的Reads 与指定的参考基因组的比对率在85.18%~90.91%(表3)。
表3 测序数据统计
Table 3 Sequencing data statistics

样品Sample S-ACC-24 S-ACC-72 S-CK-0 S-CK-24 S-CK-72 S-HC-24 S-HC-72 W-ACC-24 W-ACC-72 W-CK-0 W-CK-24 W-CK-72 W-HC-24 W-HC-72 Clean Data中pair-end Reads总数Clean reads 19 660 592 24 317 732 24 443 483 20 285 727 19 999 122 20 085 597 21 245 632 22 053 492 22 983 903 20 664 079 20 255 830 24 043 851 23 857 734 26 531 972 Clean Data总碱基数Clean bases 5 885 287 322 7 279 063 052 7 315 405 780 6 072 872 052 5 987 578 370 6 012 439 936 6 359 799 698 6 600 951 608 6 876 720 830 6 185 916 612 6 063 390 850 7 196 458 108 7 141 020 722 7 940 293 774 GC含量GC content/%47.02 47.01 46.79 47.12 46.88 46.67 47.43 46.31 47.50 45.93 46.65 47.28 46.07 45.72质量值≥30的碱基所占的百分比≥Q30/%94.68 95.03 94.92 95.03 95.09 94.96 95.32 94.58 95.46 94.21 94.92 94.76 94.79 94.74比对到参考基因组上的Reads数目及在Clean Reads中占的百分比Mapped Reads/%34 032 669(86.55)42 031 824(86.42)42 399 364(86.73)35 067 880(86.43)34 730 332(86.83)35 978 055(89.56)37 000 056(87.08)37 934 294(86.01)40 315 932(87.70)36 587 320(88.53)34 507 028(85.18)41 278 536(85.84)40 671 417(85.24)48 238 630(90.91)
2.3 差异表达基因的筛选
以|log2fold changes|≥1、FDR<0.01 为标准筛选差异表达基因。通过差异表达基因韦恩图(图5)分析发现,在内休眠阶段,6 个处理中全部共有的差异基因为177 个,W-CK-72-vs-W-ACC-72 与W-CK-72-vs-W-HC-72 有大量相同的差异基因,为3598 个;WCK-24-vs-W-ACC-24 和W-CK-72-vs-W-ACC-72 共有差异基因536 个;W-CK-24-vs-W-HC-24 和W-CK-72-vs-W-HC-72 共有差异基因2678 个;W-CK-24-vs-W-ACC-24 和W-CK-24-vs-W-HC-24 共有差异基因较少,仅554 个。在类休眠阶段,6 个处理组中全部共有的差异基因为86 个,S-CK-24-vs-S-HC-24 和SCK-72-vs-S-HC-72 有大量相同的差异基因,为5796个;S-CK-72-vs-S-ACC-72和S-CK-72-vs-S-HC-72共有差异基因985 个;S-CK-24-vs-S-ACC-24 和S-CK-24-vs-S-HC-24 共有差异基因724 个;S-CK-24-vs-SACC-24 和S-CK-72-vs-S-ACC-72 共有差异基因较少,仅283个。

图5 不同破眠处理不同时期的葡萄冬芽基因表达数目韦恩图
Fig.5 Venn Map of the number of genes expressed in grape winter buds at different times for different breaking dormancy treatments
A.不同时期不同破眠处理内休眠阶段葡萄冬芽基因表达数目韦恩图;B.不同时期不同破眠处理类休眠阶段葡萄冬芽基因表达数目韦恩图。
A.Venn map of the number of genes expressed in winter buds of endodormant stage grapes of different breaking dormancy treatments at different periods;B.Venn map of the number of genes expressed in winter buds of paradormant stage grapes of different dormancy-breaking treatments at different periods.
2.4 休眠期间差异表达基因模式变化
笔者研究了不同休眠阶段不同破眠处理后葡萄芽在2 个时期的基因表达模式,鉴定的不同时期样本之间的DEGs数量如图6所示。结果表明,在类休眠阶段,T1 处理后24 h 有3662 个基因显著上调,2935 个基因显著下调;T1 处理后72 h 有4375 个基因显著上调,3486 个基因显著下调;T2 处理后24 h有1636 个基因显著上调,1301 个基因显著下调;T2处理后72 h有1559个基因显著上调,1464个基因显著下调。在内休眠阶段,T1处理后24 h有2780个基因显著上调,1842个基因显著下调;T1处理后72 h有3230 个基因显著上调,2071 个基因显著下调;T2 处理后24 h 有661 个基因显著上调,1137 个基因显著下调;T2 处理后72 h 有3279 个基因显著上调,2218个基因显著下调。
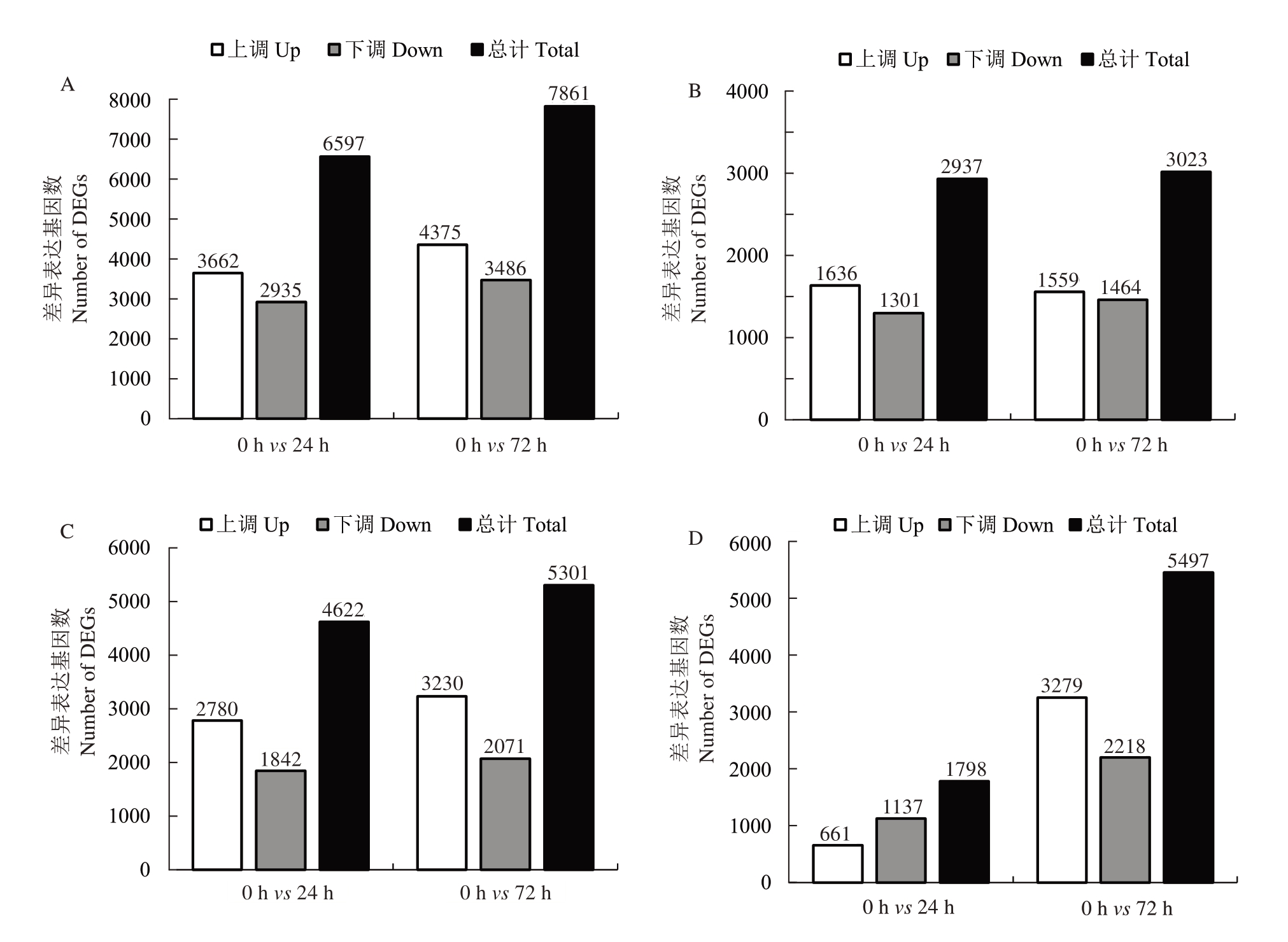
图6 不同休眠阶段不同破眠处理冬芽差异表达基因模式变化
Fig.6 Changes in differentially expressed gene patterns in winter buds treated with different dormancy stages and breaking dormancy treatments
A~B.类休眠阶段T1、T2 处理冬芽后差异表达基因数量;C~D.内休眠阶段T1、T2 处理冬芽后差异表达基因数量。
A-B.The number of differentially expressed genes after treatment of winter buds at paradormancy stage T1 and T2;C-D.Number of differentially expressed genes after treatment of winter buds at endodormancy stage T1 and T2.
2.5 休眠期间差异基因的聚类分析
表达模式相似的基因通常具有相似的功能,为了解不同休眠阶段不同破眠处理后不同时期芽的差异表达基因的表达模式,笔者利用R 语言中的聚类程序对12 组样本的显著差异基因进行等级聚类分析(图7)。结果表明,4399 个基因被分成8 组,最多的一组(Class 8)包含了1161 个DEGs,DEGs 的表达模式呈现为在W-HC-24 样本、W-HC-72 样本上调表达,其他样本基本下调表达,这些基因显著富集在转移酶活性,转移氨基酰基以外的酰基、生物合成进程、UPD-糖基转移酶活性、苯丙氨酸解氨酶活性、解氨酶活性等途径。
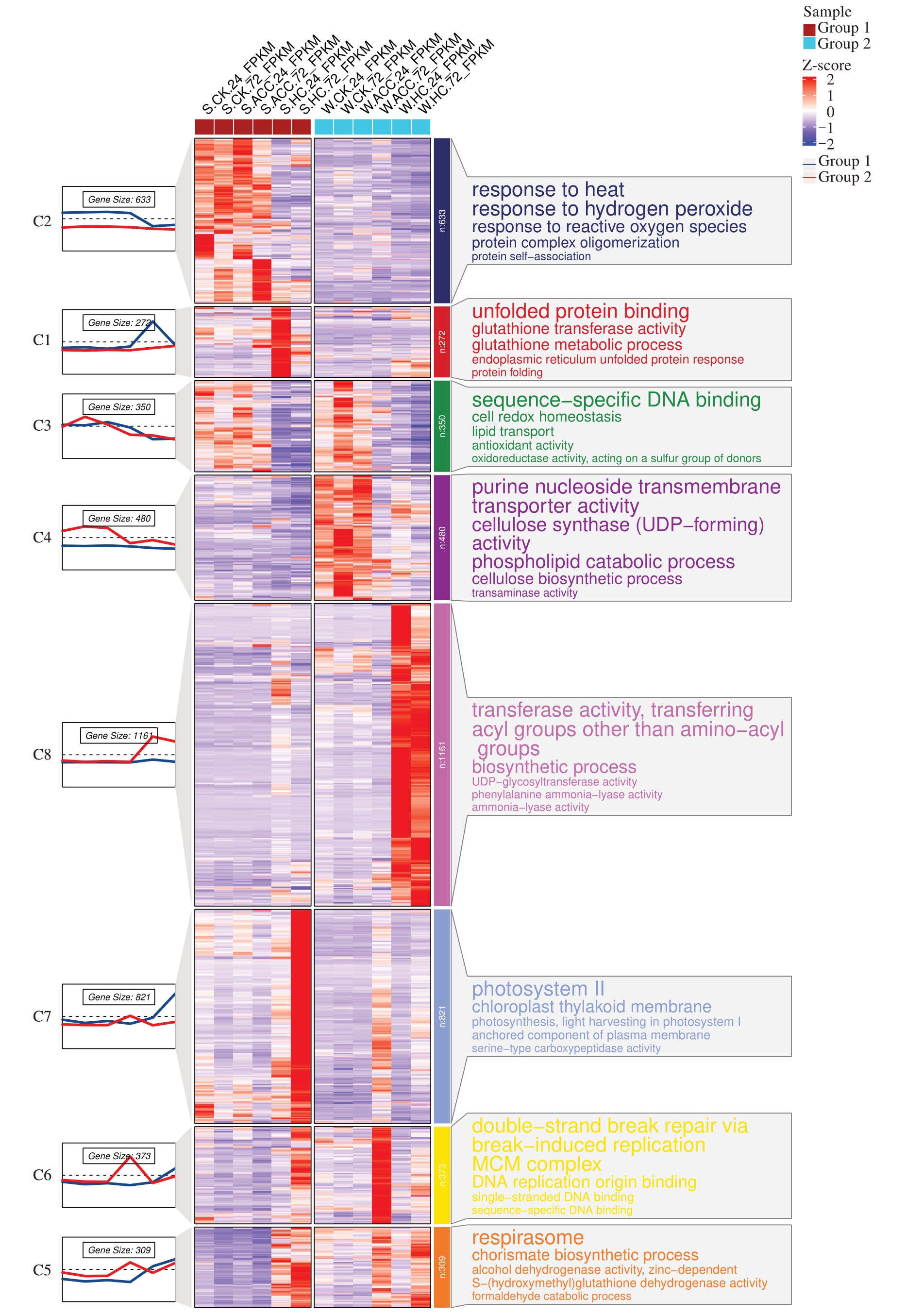
图7 不同休眠阶段不同破眠处理冬芽差异表达基因聚类
Fig.7 Cluster analysis of differentially expressed genes in winter buds treated with different dormancy stages and breaking dormancy treatments
第二大组(Class 7)包含821 个基因,DEGs 的表达模式呈现为在S-HC-72 样本上调表达,其他样本基本下调表达,这些基因主要富集在光系统Ⅱ、叶绿体类囊体膜、光合作用,光系统Ⅰ的捕光天线复合体、膜的锚固成分、丝氨酸型羧肽酶活性等途径。
第三大组(Class 2)包含633 个基因,DEGs 的表达模式呈现为在S-CK-24 样本、S-CK-72 样本、SACC-24样本、S-ACC-72样本上调表达,其他样本基本下调表达,这些基因主要富集在响应热休克、响应过氧化氢、响应活性氧、蛋白质复合物寡聚化、蛋白质自聚集等途径。
第四大组(Class 4)包含480 个基因,DEGs 的表达模式呈现为在W-CK-24 样本、W-CK-72 样本、WACC-24 样本上调表达,其他样本基本下调表达,这些基因主要富集在嘌呤核苷跨膜转运蛋白活性、纤维素合酶(UDP-forming)活性、磷脂代谢过程、纤维素生物合成过程、转氨酶活性等途径。
在Class 6 中,373 个基因在S-HC-72 样本、WACC-72 样本中上调表达,其他样本基本下调表达,这些基因主要富集在通过断裂诱导复制进行DNA双链断裂修复、微小染色体维持蛋白复合物、DNA复制起点结合、单链DNA 结合、序列特异性DNA 结合等途径。
在Class 3中,350个基因在S-CK-24样本、S-CK-72 样本、S-ACC-24 样本、S-ACC-72 样本、W-CK-24样本、W-CK-72样本、W-ACC-24样本上调表达,其他样本基本下调表达,这些基因主要富集在序列特异性DNA 结合、细胞氧化还原稳态、脂质转运、抗氧化活性、氧化还原酶活性、作用于硫基供体等途径。
在Class 5 中,309 个基因在S-HC-24 样本、SHC-72 样本、W-ACC-72 样本、W-HC-72 样本上调表达,其余样本基本下调表达,这些基因主要富集在呼吸链、分枝酸生物合成过程、锌离子依赖的乙醇脱氢酶活性、S-羟甲基谷胱甘肽脱氢酶活性、甲醛分解代谢过程等途径。
在Class 1中,272个基因在S-HC-24样本中上调表达,其余样本基本下调表达,这些基因主要富集在未折叠蛋白反应、谷胱甘肽转移酶活性、谷胱甘肽代谢过程、内质网未折叠蛋白反应、蛋白质折叠等途径。
2.6 与休眠相关的差异表达基因筛选
在使用不同破眠剂打破葡萄芽休眠的过程中会引起植物体内一系列生理生化变化,同时会诱导破眠相关基因的表达。在内休眠阶段W-CK-72 样本与W-HC-72样本相比的差异表达基因中(表4)有10个被注释为转录因子编码基因,其中上调的转录因子有3个,包括MYB4、ERF073、HSF A-4a;下调的转录因子有7 个,包括ERF023-like、ERF011-like、TT2、MYB44、HSF C-1、Nuclear transcription factor Y、HSF30。另外,有10 个被注释为参与生长素(auxin,AUX)、赤霉素(gibberelli acid,GA)、脱落酸(abscisic acid,ABA)、油菜素甾醇(brassinosteroids,BR)等激素的生物合成或介导的信号转导过程。在ABA信号通路中,PYL4基因上调表达;4个与蛋白磷酸酶2C(PP2C)家族相关的基因被注释,PP2C24、PP2C8、PP2C37 均下调表达,PP2C25 上调表达;与Snrk2 家族相关的SAPK2 基因下调表达。其他差异基因与氧化应激、谷胱甘肽S-转移酶等有关。
表4 与休眠相关的差异表达基因
Table 4 Differential expression genes related to dormancy
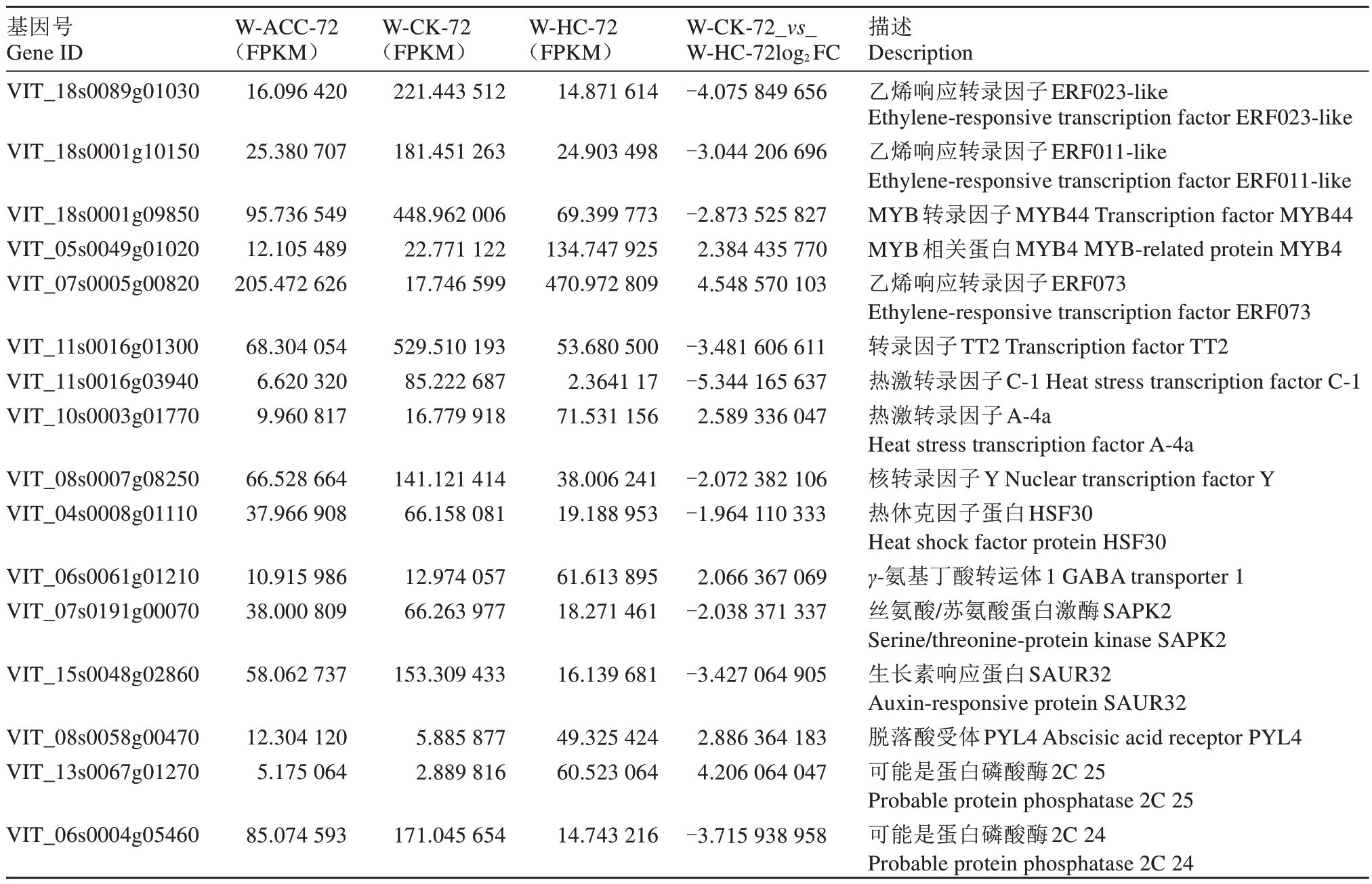
基因号Gene ID W-ACC-72(FPKM)W-CK-72(FPKM)W-HC-72(FPKM)W-CK-72_vs_W-HC-72log2FC描述Description VIT_18s0089g01030 VIT_18s0001g10150 16.096 420 221.443 512 25.380 707 181.451 263 14.871 614 24.903 498-4.075 849 656-3.044 206 696 VIT_18s0001g09850 VIT_05s0049g01020 VIT_07s0005g00820 95.736 549 12.105 489 205.472 626 448.962 006 22.771 122 17.746 599 69.399 773 134.747 925 470.972 809-2.873 525 827 2.384 435 770 4.548 570 103 VIT_11s0016g01300 VIT_11s0016g03940 VIT_10s0003g01770 68.304 054 6.620 320 9.960 817 529.510 193 85.222 687 16.779 918 53.680 500 2.3641 17 71.531 156-3.481 606 611-5.344 165 637 2.589 336 047 VIT_08s0007g08250 VIT_04s0008g01110 66.528 664 37.966 908 141.121 414 66.158 081 38.006 241 19.188 953-2.072 382 106-1.964 110 333 VIT_06s0061g01210 VIT_07s0191g00070 10.915 986 38.000 809 12.974 057 66.263 977 61.613 895 18.271 461 2.066 367 069-2.038 371 337 VIT_15s0048g02860 58.062 737 153.309 433 16.139 681-3.427 064 905 VIT_08s0058g00470 VIT_13s0067g01270 12.304 120 5.175 064 5.885 877 2.889 816 49.325 424 60.523 064 2.886 364 183 4.206 064 047 VIT_06s0004g05460 85.074 593 171.045 654 14.743 216-3.715 938 958乙烯响应转录因子ERF023-like Ethylene-responsive transcription factor ERF023-like乙烯响应转录因子ERF011-like Ethylene-responsive transcription factor ERF011-like MYB转录因子MYB44 Transcription factor MYB44 MYB相关蛋白MYB4 MYB-related protein MYB4乙烯响应转录因子ERF073 Ethylene-responsive transcription factor ERF073转录因子TT2 Transcription factor TT2热激转录因子C-1 Heat stress transcription factor C-1热激转录因子A-4a Heat stress transcription factor A-4a核转录因子Y Nuclear transcription factor Y热休克因子蛋白HSF30 Heat shock factor protein HSF30 γ-氨基丁酸转运体1 GABA transporter 1丝氨酸/苏氨酸蛋白激酶SAPK2 Serine/threonine-protein kinase SAPK2生长素响应蛋白SAUR32 Auxin-responsive protein SAUR32脱落酸受体PYL4 Abscisic acid receptor PYL4可能是蛋白磷酸酶2C 25 Probable protein phosphatase 2C 25可能是蛋白磷酸酶2C 24 Probable protein phosphatase 2C 24
表4 (续) Table 4 (Continued)
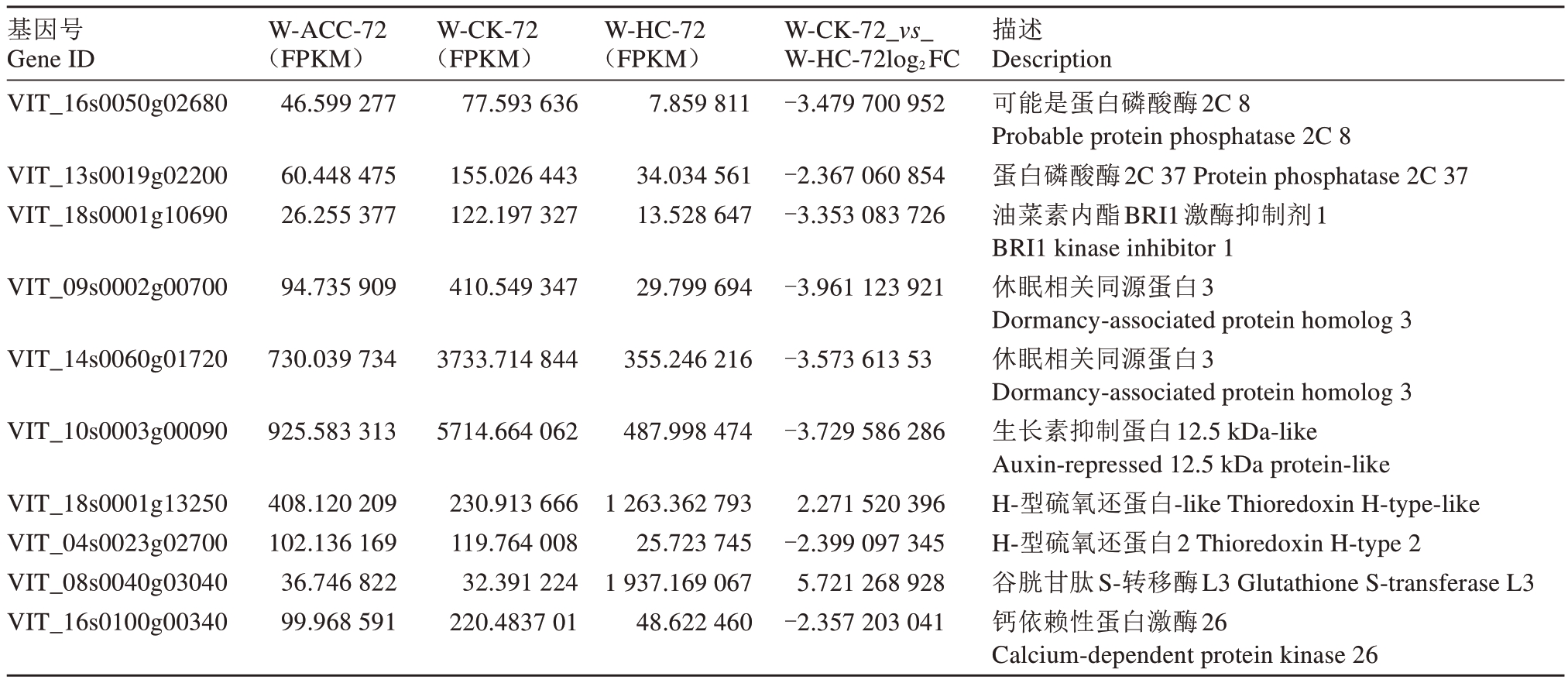
基因号Gene ID W-ACC-72(FPKM)W-CK-72(FPKM)W-HC-72(FPKM)W-CK-72_vs_W-HC-72log2FC描述Description VIT_16s0050g02680 46.599 277 77.593 636 7.859 811-3.479 700 952 VIT_13s0019g02200 VIT_18s0001g10690 60.448 475 26.255 377 155.026 443 122.197 327 34.034 561 13.528 647-2.367 060 854-3.353 083 726 VIT_09s0002g00700 94.735 909 410.549 347 29.799 694-3.961 123 921 VIT_14s0060g01720 730.039 734 3733.714 844 355.246 216-3.573 613 53 VIT_10s0003g00090 925.583 313 5714.664 062 487.998 474 1 263.362 793 25.723 745 1 937.169 067 48.622 460-3.729 586 286 VIT_18s0001g13250 VIT_04s0023g02700 VIT_08s0040g03040 VIT_16s0100g00340 408.120 209 102.136 169 36.746 822 99.968 591 230.913 666 119.764 008 32.391 224 220.4837 01 2.271 520 396-2.399 097 345 5.721 268 928-2.357 203 041可能是蛋白磷酸酶2C 8 Probable protein phosphatase 2C 8蛋白磷酸酶2C 37 Protein phosphatase 2C 37油菜素内酯BRI1激酶抑制剂1 BRI1 kinase inhibitor 1休眠相关同源蛋白3 Dormancy-associated protein homolog 3休眠相关同源蛋白3 Dormancy-associated protein homolog 3生长素抑制蛋白12.5 kDa-like Auxin-repressed 12.5 kDa protein-like H-型硫氧还蛋白-like Thioredoxin H-type-like H-型硫氧还蛋白2 Thioredoxin H-type 2谷胱甘肽S-转移酶L3 Glutathione S-transferase L3钙依赖性蛋白激酶26 Calcium-dependent protein kinase 26
3 讨 论
生长期和休眠期是葡萄生长发育过程中较为明显的两个时期。在内休眠阶段,通过对葡萄冬芽采取物理或化学等破眠措施可使冬芽提前萌发[6]。前人在不同品种葡萄上均已试验证明单氰胺可以提前打破葡萄休眠[17],在我国南方地区,萌芽前一个月对葡萄冬芽进行单氰胺处理破眠效果最佳,可明显提高萌芽率,从而在一定程度上能够提高葡萄产量。乙烯是五大植物激素之一,广泛参与到植物生长发育的各个进程中。前人研究表明,植物器官本身能生成乙烯,并提出了乙烯具有促进植物成熟衰老的作用[18]。乙烯是气体,在实际生产中主要使用乙烯利对香蕉[19]、菠萝蜜[20]等进行催熟;浙江、上海地区常用乙烯利对葡萄进行催熟。ACC 是乙烯合成的前体,在1-氨基环丙烷-1-羧酸氧化酶(ACC 氧化酶,ACO)的氧化作用下生成乙烯[21]。因此,笔者推测ACC可能对芽的萌发有一定的促进作用。
Keilin 等[22]在构建单氰胺(HC)诱导表达的EST文库后,利用比较基因组学发现氧化应激、钙信号传导等生化过程中的功能基因可能参与休眠解除过程。Halaly 等[23]研究表明,HC 和热击(heaat shock,HS)两种方式均可解除生理休眠,触发细胞生化水平暂时性呼吸和氧化应激,诱导CAT、ADH 和PDC等相关基因瞬时上调表达,破眠处理还诱导抗坏血酸过氧化物酶、谷胱甘肽还原酶、硫氧还蛋白h、谷胱甘肽S-转移酶和蔗糖合成酶编码基因表达。单氰胺处理休眠芽后,通过释放氰化物抑制有氧呼吸和过氧化氢酶活性,导致细胞缺氧的同时诱导过氧化氢产生,进而导致植物体内活性氧含量升高[24]。Pacey-Miller 等[25]报道了葡萄休眠芽中活性氧相关的Cu/Zn 超氧化物歧化酶、谷胱甘肽过氧化物酶、谷胱甘肽硫转移酶、谷胱甘肽还原酶和过氧化氢酶基因表达量升高。在本研究中,MYB、ERF、MADSbox 等转录因子都与芽萌发有关,这些转录因子通过共同调控多种途径从而影响葡萄萌芽,其中一些与氧化应激有关,钙信号传导等基因也对葡萄活性氧代谢进行调控。
植物激素与芽休眠密切相关,尤其是ABA 和GA 在调控芽休眠和萌发的过程中发挥着重要作用。Khalil-Ur-Rehman 等[16]认为ABA 和GA 信号通路作为开关调节葡萄芽休眠。ABA 可以促进杨树SVL 基因的表达[12],而内源ABA 可通过激活Ppy‐ABF3 调控梨PpyDAM3 的转录,从而调控休眠进程[26]。在梨芽内休眠解除后观察到较低水平的NCEDs 表达,PpyCYB8 和Ppy707A3 的表达上调,同时ABA 含量降低[26]。李可等[27]研究表明,外源ABA可抑制蓝莓花芽萌芽。在本研究中,鉴定出与激素合成相关的基因,如GABA 转运蛋白1、生长素反应蛋白、生长素抑制蛋白、脱落酸受体、BRI1激酶抑制剂1、蛋白磷酸酶、丝氨酸/苏氨酸蛋白激酶等可能参与了植物激素信号转导。
本试验对不同休眠阶段的阳光玫瑰葡萄冬芽进行破眠试验,用萌芽率、成花率及花穗质量作为衡量葡萄破眠效果优劣的三个指标。试验结果表明,在类休眠阶段和内休眠阶段,单氰胺处理、石硫合剂+ACC 处理均对阳光玫瑰葡萄萌芽产生积极影响,石硫合剂+ACC 处理后的萌芽率略高于单氰胺处理,两种处理均能使阳光玫瑰葡萄冬芽萌发时间提前,显著提升植株萌芽率,对后续成花率及花穗长度均无影响,且不会引起药害。在本研究中,还有一些与环境响应相关的差异基因,如热击蛋白(Heat shock protein,HSP)基因、光敏色素(phytochrome)基因、水孔蛋白(aquaporin,AQP)等水分代谢相关的基因、蔗糖合酶(sucrose synthase)等能量与物质代谢相关的基因、细胞周期蛋白(cyclin,CYC)基因、细胞周期蛋白依赖激酶(cyclin-dependent protein kinase,CDK)等细胞发育相关的基因,可能也参与了葡萄芽休眠解除的调控。
4 结 论
5°Bé 石硫合剂+0.25 mg·mL-1ACC 处理能提早打破葡萄休眠,且不影响后续成花率及花穗质量,对操作人员较为安全。石硫合剂+ACC 的混合溶液是阳光玫瑰葡萄打破休眠的一种安全、理想的药剂。单氰胺处理、石硫合剂+ACC 处理均诱导了PYL4、PP2C24、PP2C8、PP2C37、PP2C25、SAPK2 等基因的表达,这些基因可能通过参与激素信号传导、氧化应激等反应打破芽的休眠,促进萌芽。
[1] 刘凤之.我国葡萄产业现状与高质量发展方向[J].农业知识,2023(10):10-14.LIU Fengzhi.Present situation and high-quality development direction of grape industry in China[J].Agriculture Knowlege,2023(10):10-14.
[2] LANG G A.Dormancy:A new universal terminology[J].Hort-Science,1987,22(5):817-820.
[3] 郭松涛,张亚红,李琴,张晓丽,付玉芳,刘帅.宁夏地区设施葡萄需冷量和需热量研究[J].果树学报,2020,37(7):997-1007.GUO Songtao,ZHANG Yahong,LI Qin,ZHANG Xiaoli,FU Yufang,LIU Shuai.Chilling and heat requirements of grape cultivars under protected culture in Ningxia area[J].Journal of Fruit Science,2020,37(7):997-1007.
[4] 董阳.转录和蛋白质组学联合分析单氰胺(HC)打破葡萄芽休眠分子机制研究[D].南京:南京农业大学,2020.DONG Yang.Combined transcription and proteomics analysis of molecular mechanism of hydrogen cyanamide (HC) breaking grape bud dormancy[D].Nanjing:Nanjing Agricultural University,2020.
[5] 樊绍刚,吴胜,朱明涛,余俊,白描,杨国顺.葡萄冬芽生理休眠机理研究进展[J].东北农业大学学报,2019,50(10):88-96.FAN Shaogang,WU Sheng,ZHU Mingtao,YU Jun,BAI Miao,YANG Guoshun.Progress research on mechanism of grape bud dormancy[J].Journal of Northeast Agricultural University,2019,50(10):88-96.
[6] LAMELA C S P,REZEMINI F,BACINO M F,MALGARIM M B,HERTER F G,DA SILVEIRA PASA M.Dormancy dynamics of‘Tannat’grapes in warm-winter climate conditions[J].Agricultural and Forest Meteorology,2020,288/289:108016.
[7] 李建召.脱落酸及相关激素调控梨芽休眠的分子机制研究[D].杭州:浙江大学,2019.LI Jianzhao.Studies on the molecular mechanism of ABA and related phytohormones-regulated pear bud dormancy[D].Hangzhou:Zhejiang University,2019.
[8] 安爽,高玉迪,麦迪努尔·玉苏普,潘益娜,邵婉,宗宇,陈文荣,杨莉,郭卫东,李永强.外源脱落酸抑制蓝莓早花及相关基因表达特性研究[J].果树学报,2021,38(3):325-334.AN Shuang,GAO Yudi,Maidinuer·Yusupu,PAN Yina,SHAO Wan,ZONG Yu,CHEN Wenrong,YANG Li,GUO Weidong,LI Yonggiang.Research on application exogenous abscisic acid in inhibiting early flowering and associated genes expression characteristics in blueberry[J].Journal of Fruit Science,2021,38(3):325-334.
[9] WANG Q J,XU G X,ZHAO X H,ZHANG Z J,WANG X X,LIU X,XIAO W,FU X L,CHEN X D,GAO D S,LI D M,LI L.Transcription factor TCP20 regulates peach bud endodormancy by inhibiting DAM5/DAM6 and interacting with ABF2[J].Journal of Experimental Botany,2020,71(4):1585-1597.
[10] 杨博,魏佳,李坤峰,王程亮,倪隽蓓,滕元文,白松龄. Ppy‐ERF060-PpyABF3-PpyMADS71 调控乙烯信号通路介导的梨芽休眠进程[J].园艺学报,2022,49(10):2249-2262.YANG Bo,WEI Jia,LI Kunfeng,WANG Chengliang,NI Junbei,TENG Yuanwen,BAI Songling. PpyERF060- PpyABF3-PpyMADS71 regulates ethylene signaling pathway- mediated pear bud dormancy process[J].Acta Horticulturae Sinica,2022,49(10):2249-2262.
[11] DONG Z B,XIAO Y G,GOVINDARAJULU R,FEIL R,SIDDOWAY M L,NIELSEN T,LUNN J E,HAWKINS J,WHIPPLE C,CHUCK G.The regulatory landscape of a core maize domestication module controlling bud dormancy and growth repression[J].Nature Communications,2019,10:3810.
[12] SINGH R K,MAURYA J P,AZEEZ A,MISKOLCZI P,TYLEWICZ S,STOJKOVIČ K,DELHOMME N,BUSOV V,BHALERAO R P.A genetic network mediating the control of bud break in hybrid aspen[J].Nature Communications,2018,9:4173.
[13] LI S,WANG Q J,WEN B B,ZHANG R,JING X L,XIAO W,CHEN X D,TAN Q P,LI L.Endodormancy release can be modulated by the GA4-GID1c-DELLA2 module in peach leaf buds[J].Frontiers in Plant Science,2021,12:713514.
[14] 刘瑾航,沈炳荣,李宜轩,梁沁,冯宇,林晓洁,沈茂芬,吴少华,李亮,李永裕.砂梨miR159 家族进化特性及在冬季休眠的表达模式分析[J].果树学报,2022,39(11):2007-2018.LIU Jinhang,SHEN Bingrong,LI Yixuan,LIANG Qin,FENG Yu,LIN Xiaojie,SHEN Maofen,WU Shaohua,LI Liang,LI Yongyu.Molecular evolution of miR159 family and their expression profiling during dormancy of Pyrus pyrifolia in the winter[J].Journal of Fruit Science,2022,39(11):2007-2018.
[15] 施招婉.葡萄芽休眠解除过程中乙烯合成与信号途径关键基因的筛选与功能分析[D].广州:华南农业大学,2022.SHI Zhaowan.Screening and functional analysis of key genes involved in ethylene biosynthesis and signaling pathways during grape bud dormancy release[D].Guangzhou:South China Agricultural University,2022.
[16] KHALIL-UR-REHMAN M,DONG Y,FAHEEM M,ZENG J J,WANG W,TAO J M.Expression profiling of ABA and GA signaling cascades regulating bud dormancy in grape[J].Scientia Horticulturae,2019,246:44-50.
[17] 谭一婷.单氰胺对不同葡萄品种休眠解除生理特性及综合品质的影响[D].太谷:山西农业大学,2021.TAN Yiting.Effects of cyanamide on physiological characteristics of dormancy release and comprehensive quality of different grape[D].Taigu:Shanxi Agriculture University,2021.
[18] 黎家,李传友.新中国成立70 年来植物激素研究进展[J].中国科学:生命科学,2019,49(10):1227-1281.LI Jia,LI Chuanyou.Seventy-year major research progress in plant hormones by Chinese scholars[J].Scientia Sinica (Vitae),2019,49(10):1227-1281.
[19] 李芬芳,李奕星,袁德保,洪克前,陈娇.不同乙烯利浓度及贮藏温度对“南天黄”香蕉果实后熟品质的影响[J].中国南方果树,2022,51(2):72-77.LI Fenfang,LI Yixing,YUAN Debao,HONG Keqian,CHEN Jiao.Effects of different concentrations of ethrel and storage temperatures on post-ripening quality of‘Nantianhuang’banana[J].South China Fruits,2022,51(2):72-77.
[20] 任雪岩,刘光财,李国鹏,叶春海,丰锋,王俊宁.乙烯利和1-MCP 对菠萝蜜果实中AheAAT 和AheERF 表达的影响[J].中国农业科学,2019,52(21):3890-3902.REN Xueyan,LIU Guangcai,LI Guopeng,YE Chunhai,FENG Feng,WANG Junning.Effects of ethephon and 1-MCP on the expression of AheAAT gene and AheERF transcription factors in jackfruit fruit[J].Scientia Agricultura Sinica,2019,52(21):3890-3902.
[21] YANG S F,HOFFMAN N E.Ethylene biosynthesis and its regulation in higher plants[J].Annual Review of Plant Physiology,1984,35:155-189.
[22] KEILIN T,PANG X Q,VENKATESWARI J,HALALY T,CRANE O,KEREN A,OGRODOVITCH A,OPHIR R,VOLPIN H,GALBRAITH D,OR E.Digital expression profiling of a grape-bud EST collection leads to new insight into molecular events during grape-bud dormancy release[J].Plant Science,2007,173(4):446-457.
[23] HALALY T,PANG X Q,BATIKOFF T,CRANE O,KEREN A,VENKATESWARI J,OGRODOVITCH A,SADKA A,LAVEE S,OR E.Similar mechanisms might be triggered by alternative external stimuli that induce dormancy release in grape buds[J].Planta,2008,228(1):79-88.
[24] SUDAWAN B,CHANG C S,CHAO H F,KU M S B,YEN Y F.Hydrogen cyanamide breaks grapevine bud dormancy in the summer through transient activation of gene expression and accumulation of reactive oxygen and nitrogen species[J].BMC Plant Biology,2016,16(1):202.
[25] PACEY-MILLER T,SCOTT K,ABLETT E,TINGEY S,CHING A,HENRY R.Genes associated with the end of dormancy in grapes[J].Functional & Integrative Genomics,2003,3(4):144-152.
[26] YANG Q S,GAO Y H,WU X Y,MORIGUCHI T,BAI S L,TENG Y W.Bud endodormancy in deciduous fruit trees:Advances and prospects[J].Horticulture Research,2021,8:139.
[27] 李可,申朦晓,潘炜浩,章诗渲,毛欣烨,尹亚红,李永强,朱友银,郭卫东.蓝莓C2H2 家族基因在花芽休眠解除中的作用初探[J].园艺学报,2023,50(4):737-753.LI Ke,SHEN Mengxiao,PAN Weihao,ZHANG Shixuan,MAO Xinye,YIN Yahong,LI Yongqiang,ZHU Youyin,GUO Weidong.Preliminary investigation of C2H2 family genes in blueberry flower bud dormancy release[J].Acta Horticulturae Sinica,2023,50(4):737-753.