果实大小是一种外观品质,也是判定果实品级的重要农艺性状,直接影响果实的经济价值[1]。果实大小受自身遗传背景、栽培条件和植物激素等因素的影响。生产上常采用环剥、疏花疏果等措施来增大果实[2-4],或者通过喷施生长调节剂来达到疏花疏果的目的,激素调节剂还能配合环剥技术来改变果实大小[4-6]。此外,植物激素调节剂还能单独用于果实发育早期来促进果实膨大,如生长素[7-11]、细胞分裂素[12-14]。
果实大小是受多个基因调控的数量性状。研究表明,果实大小涉及多种植物激素的调控,尤其是生长素和细胞分裂素。Su 等[15]发现,沉默SlIAA17 后得到的果实变大,与野生型相比,沉默系番茄果皮内细胞数量增多、果皮厚度增加。Peng 等[16]的研究表明,EjSAUR22-TRV2 植株果实变小,石蜡切片结果显示EjSAUR22-TRV2果肉细胞变小。目前,生长素调控果实大小的信号通路已有少量报道。Zhao等[17]研究认为CsFUL1A通过结合PIN1和PIN7启动子来抑制他们的转录水平,使黄瓜果实内生长素的积累量减少,黄瓜变短。Zhang等[18]的研究表明,CsMYB77结合在PIN5启动子上并上调其表达,通过降低游离ⅠAA的含量来参与调控柑橘果实大小。细胞分裂素促进细胞分裂,在果实发育早期起重要作用。细胞色素氧化酶(cytokinin oxidase,CKX)是细胞分裂素代谢通路上的关键酶。Gan 等[19]研究表明,与野生型相比,AtCKX2超表达植株的番茄果实变小。除生长素和细胞分裂素外,其他激素如赤霉素[20]、油菜素内酯[21]均参与果实大小发育过程。这些激素相关基因多通过影响细胞数量和细胞大小来改变果实大小。
柑橘属于芸香科柑橘属,在中国已有4000多年的栽培历史,是中国南方种植面积最大、产量最高的经济果树。柑橘销售价格一方面受自身品种影响,另一方面也受果实大小调控。栽培管理技术的优化是目前提升柑橘优果率的主要措施,但存在着生产成本高、不受控因素多等问题。转录组测序技术在植物性状控制基因挖掘方面具有重要作用[22-23]。笔者课题组前期发现锦红冰糖橙的芽变材料,该芽变成熟果实的大小约是锦红冰糖橙的1.5 倍。笔者以锦红冰糖橙大果芽变为材料,通过石蜡切片技术、植物激素含量测定和转录组测序来解释大果芽变的形成机制,并筛选出冰糖橙果实大小相关基因,为柑橘果实大小分子设计育种提供理论基础。
1 材料和方法
1.1 试验材料
供试材料是锦红[C. sinensis(L.)Osbeck‘Jinhong’]及其大果芽变。每个材料各挑选3株树龄一致、长势健壮的样本树。在盛花后30、50、70、90、120、150、170、190 和250 d 取样。每次取样均从树冠中上部外围随机采摘10 个果实。采集大果芽变的幼嫩叶片进行染色体倍性检测。并将盛花后70、120 和170 d 汁胞保存在-80 ℃冰箱中,以备植物激素测定和转录组测序。
1.2 果实质量、囊瓣数、汁胞数及其体积测定
用分析天平测定锦红和大果芽变成熟期的果实质量。用游标卡尺测量锦红和大果芽变果实发育过程的果肉横径,并统计果实内囊瓣数目和囊瓣内汁胞数量。采用浸水法估算单个汁胞体积,即向容器中加入水,此时体积记为V1,再将已知数量(S)的汁胞放入容器内,并记下体积V2,则单个汁胞体积的计算方式是V 汁胞=(V2-V1)/S。
1.3 汁胞组织切片
对锦红和大果芽变成熟期的汁胞进行石蜡切片。用FAA 固定液固定囊瓣中部的汁胞后,依次在70%、80%、90%和100%乙醇溶液中脱水,每次10 min,再用二甲苯清洗1 h 后包埋在石蜡中。使用Lei-ca RM2265切片机获取薄切片。依次将切片放入环保型脱蜡液Ⅰ、Ⅱ中,各20 min。用无水乙醇Ⅰ、无水乙醇Ⅱ和75%乙醇依次清洗5 min 后用蒸馏水清洗。将清洗好的切片依次放入番红、固绿染色液中,并用95%乙醇清洗,经脱水、透明、封片后进行图像采集。
1.4 植物激素测定
用液氮将样品研磨成粉末,称取1 g 粉末放入10 mL 乙腈溶液中,并加入8 μL 内标母液,然后在4 ℃条件下提取过夜。4 ℃,12 000 r·min-1离心5 min,抽取上清液,随后在沉淀中再次加入5 mL 乙腈溶液,并过夜提取,2 次重复后合并3 次所得上清液。在上清液中加入适量C18 和GCB 净化其中杂质。4 ℃,12 000 r·min-1离心5 min,抽取上清液,并用氮气吹干,以400 μL 甲醇复溶,过0.22 μm 有机相滤膜,上机检测。标准品为D-ⅠAA、D-JA、D-GA4、DZeatin(Sigma)。使用终质量浓度为0.1、0.2、0.5、2、5、20、50、200 ng·mL-1绘制标准曲线。
1.5 转录组测序和差异基因鉴定
利用Trizol方法提取锦红冰糖橙和大果芽变汁胞的基因组总RNA。使用Nanodrop 2000检测RNA的浓度和纯度来评估RNA质量,合格后进行文库构建。用Oligo(dT)的磁珠富集有polyA 尾巴的mRNA,用打断buffer把获得的RNA片段化后,再用随机的N6引物进行反转录,合成cDNA二链形成双链DNA,把合成的双链DNA 末端补平并5’端磷酸化,3’端形成突出一个个 “A” 的黏末端,再连接一个3’端有凸出 “T” 的鼓泡状的接头,连接产物通过特异的引物进行PCR 扩增,PCR 产物热变性成单链,再用一段桥式引物将单链DNA环化,得到单链环状DNA文库。文库检测合格后,使用MGⅠ高通量测序仪进行测序。
对各样本raw reads进行过滤,得到clean reads,与甜橙参考基因组(http://citrus.hzau.edu.cn/download.php Citrus sinensis v3.0)比对。利用RSEM,调用bowtie2的比对结果进行统计,得到每个样品比对到每个转录本上的reads数目,并将其换算为FPKM(Fragments Per Kilobase per Million bases),每个基因或转录本的表达水平用FPKM 值来表示。以|log2(FoldChange)|>1&FDR<0.05 为筛选阈值获得差异基因。使用Blast2GO程序和KOBAS软件进行GO 和KEGG 富集分析,使用维恩图获得不同发育时期共有的差异基因,使用GraphPad Prism 8 软件绘制表达热图。
1.6 数据分析
采用Microsoft Excel 2019软件完成数据处理和绘图,采用SPSS软件进行差异显著性分析。
2 结果与分析
2.1 大果芽变的倍性鉴定
染色体数目加倍会引起果实变大。如图1 所示,流式细胞仪结果表明,该大果芽变是二倍体,同锦红的倍性相同。说明大果型不是由染色体加倍造成的。
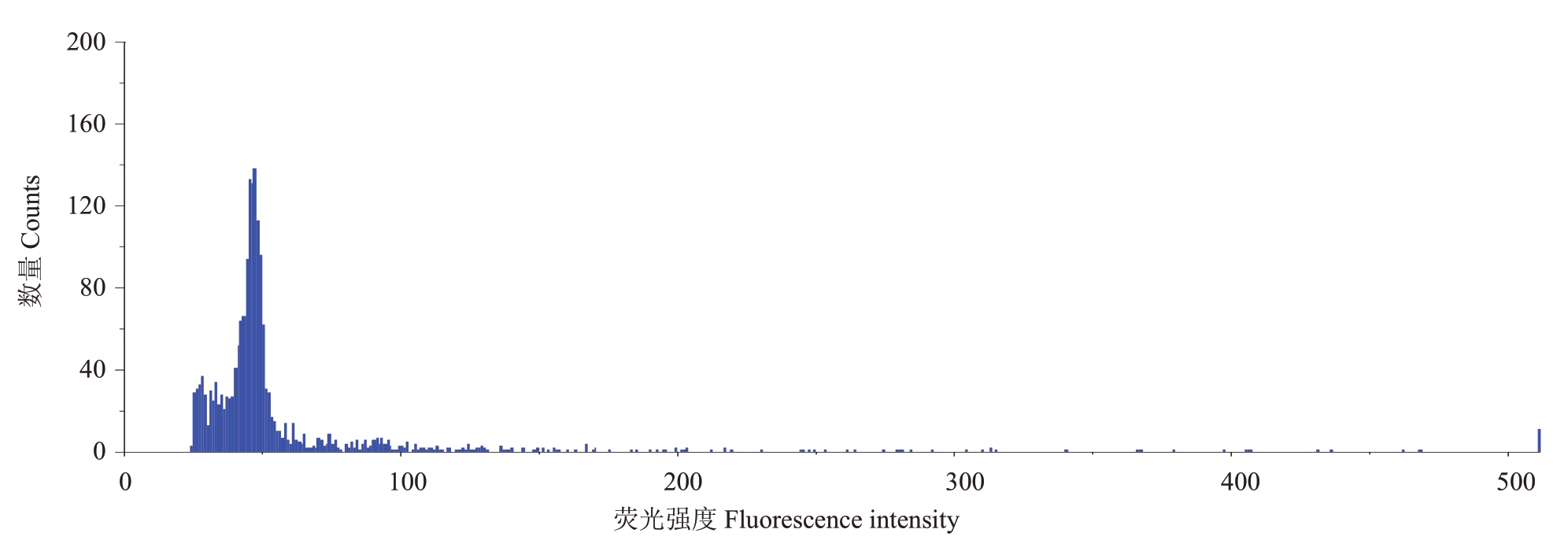
图1 大果芽变的倍性鉴定
Fig.1 Ploidy determination of large-fruit mutant
2.2 大果芽变的果实发育
如图2 所示,锦红和大果芽变的果实逐渐增大。与锦红相比,自盛花后70 d(70 DAB),大果芽变的果实更大、果肉更厚。为探究大果芽变果肉增厚的原因,统计并测量锦红和大果芽变120 DAB、170 DAB和250 DAB时的囊瓣数量、汁胞数量和体积。结果表明,同一时期锦红和大果芽变之间的囊瓣和汁胞数目没有显著差异,但大果芽变果实内汁胞数目都略高于锦红果实内的汁胞数目,并且汁胞体积显著大于锦红的汁胞体积(表1)。石蜡切片的结果表明,大果芽变汁胞内细胞数量多于锦红(图3)。
表1 锦红和大果芽变囊瓣数量、汁胞数量及体积
Table 1 The number of carpels,number of juice sacs and volumes of juice sacs of Jinhong and the large-fruit mutant
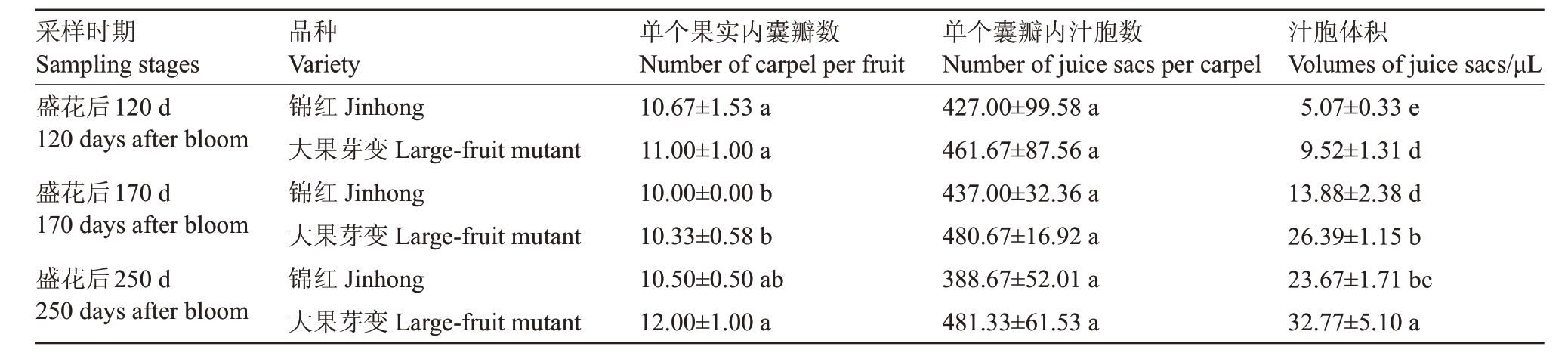
注:同一列不同小写字母表示差异显著(p<0.05)。
Note:Different small letters in the same column indicate significant difference at p<0.05.
采样时期Sampling stages盛花后120 d 120 days after bloom盛花后170 d 170 days after bloom盛花后250 d 250 days after bloom汁胞体积Volumes of juice sacs/μL 5.07±0.33 e 9.52±1.31 d 13.88±2.38 d 26.39±1.15 b 23.67±1.71 bc 32.77±5.10 a品种Variety锦红Jinhong大果芽变Large-fruit mutant锦红Jinhong大果芽变Large-fruit mutant锦红Jinhong大果芽变Large-fruit mutant单个果实内囊瓣数Number of carpel per fruit 10.67±1.53 a 11.00±1.00 a 10.00±0.00 b 10.33±0.58 b 10.50±0.50 ab 12.00±1.00 a单个囊瓣内汁胞数Number of juice sacs per carpel 427.00±99.58 a 461.67±87.56 a 437.00±32.36 a 480.67±16.92 a 388.67±52.01 a 481.33±61.53 a

图2 锦红和大果芽变的果实表型
Fig.2 Fruit phenotype of Jinhong and its large-fruit mutant
*表示差异显著(t 检验,p<0.05),**表示差异极显著(t 检验,p<0.01)。误差线表示标准差。下同。
*indicates significance difference at p<0.05,**indicates extremely significant difference at p<0.01 using a student’s t-test.Bars indicate standard error.The same below.

图3 锦红和大果芽变汁胞形态及其石蜡切片(横切面)
Fig.3 Morphology and paraffin section of juice sacs of Jinhong and large-fruit mutant(transverse section)
2.3 锦红及其大果芽变汁胞内源激素含量分析
对锦红和大果芽变70 DAB、120 DAB 和170 DAB 的汁胞进行内源激素测定。结果如图4 所示,在70 DAB 和120 DAB,大果芽变中ⅠAA 含量显著高于锦红,而在临近转色期的170 DAB,两者ⅠAA含量均下降,且大果芽变中ⅠAA含量下降幅度高于锦红(图4-A)。在70 DAB、120 DAB 和170 DAB,锦红和大果芽变中GA3含量均逐步下降,且大果芽变中GA3含量始终高于锦红(图4-B);两者ZT 含量(ρ)较低,不足0.5 ng·mL-1,在70 DAB、120 DAB 和170 DAB,大果芽变中ZT 含量都显著低于锦红(图4-C);在70 DAB,大果芽变中JA 含量显著高于锦红,随后两者JA含量均下降,到170 DAB,大果芽变中JA 含量显著低于锦红(图4-D)。综上所述,大果芽变和锦红之间汁胞发育差异是受多激素调控的,而且生长素和赤霉素可能是引起两者汁胞发育不同的关键激素。
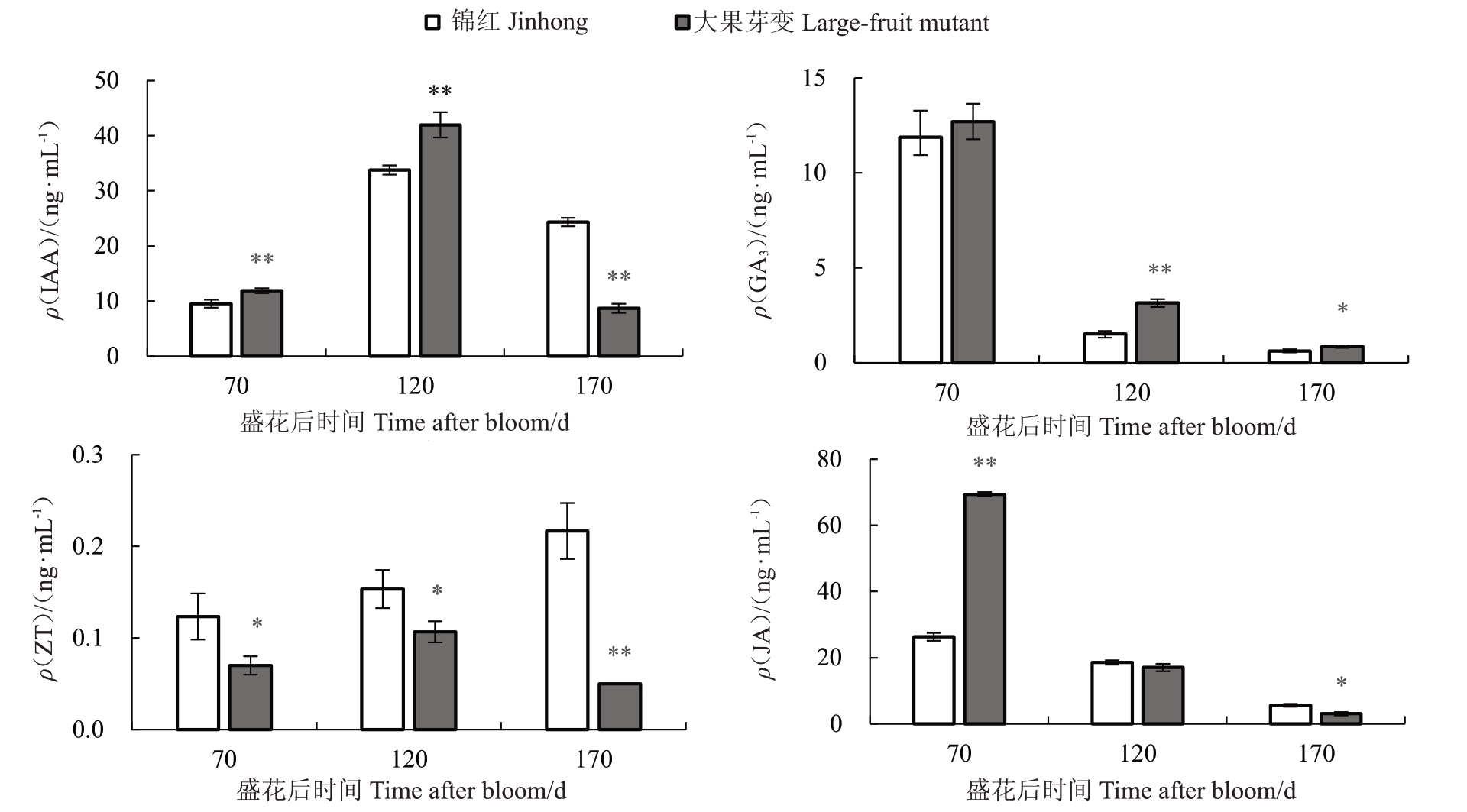
图4 锦红和大果芽变果实发育过程中内源激素含量的变化
Fig.4 Changes in hormone contents in fruits of Jinhong and the large-fruit mutant during development process
ⅠAA.生长素;GA3.赤霉素;ZT.玉米素;JA.茉莉酸。
ⅠAA.Ⅰndole-3-actic acid;GA3.Gibberellin;ZT.Zeatin;JA.Jasmonic acid.
2.4 锦红及其大果芽变盛花后170 d内汁胞转录组测序质量评估
为了进一步探究大果芽变形成的分子机制,对锦红和大果芽变盛花后3个时间点的汁胞进行转录组测序。锦红记为WT,大果芽变记为MT。从表2可以看出,18个样品的原始数据经过严格的质量过滤后共得到201.74×106个clean_reads,各样品的Q20含量都高于97%,Q30含量高于91.5%,GC含量高于44%,说明测序结果真实可信。
表2 盛花后70、120 和170 d 锦红和大果芽变汁胞转录组数据的评估结果
Table 2 Transcriptomic analysis of juice sacs of Jinhong and the large-fruit mutant at 70,120 and 170 days after bloom
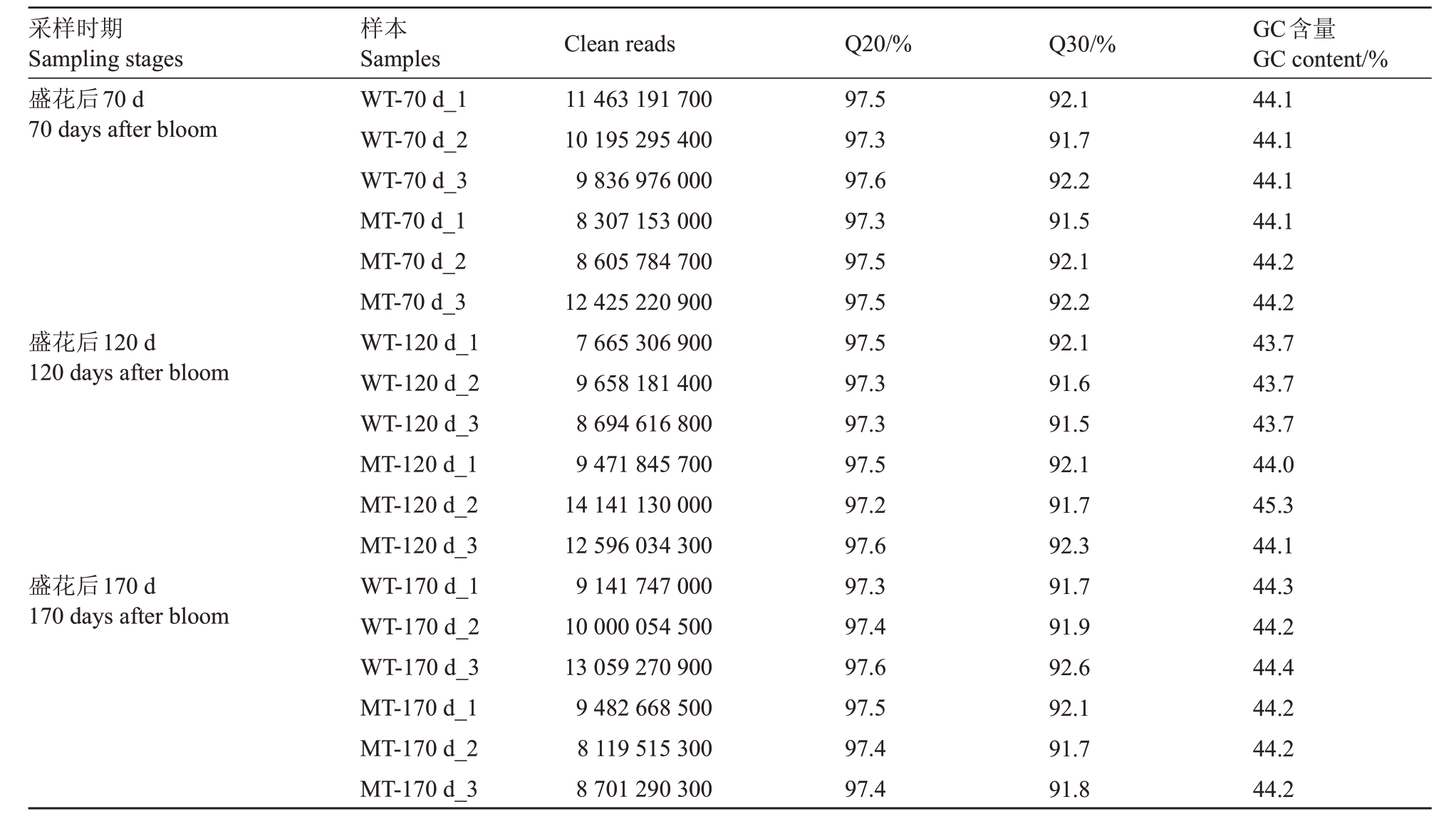
采样时期Sampling stages盛花后70 d 70 days after bloom盛花后120 d 120 days after bloom盛花后170 d 170 days after bloom样本Samples WT-70 d_1 WT-70 d_2 WT-70 d_3 MT-70 d_1 MT-70 d_2 MT-70 d_3 WT-120 d_1 WT-120 d_2 WT-120 d_3 MT-120 d_1 MT-120 d_2 MT-120 d_3 WT-170 d_1 WT-170 d_2 WT-170 d_3 MT-170 d_1 MT-170 d_2 MT-170 d_3 Clean reads 11 463 191 700 10 195 295 400 9 836 976 000 8 307 153 000 8 605 784 700 12 425 220 900 7 665 306 900 9 658 181 400 8 694 616 800 9 471 845 700 14 141 130 000 12 596 034 300 9 141 747 000 10 000 054 500 13 059 270 900 9 482 668 500 8 119 515 300 8 701 290 300 Q20/%97.5 97.3 97.6 97.3 97.5 97.5 97.5 97.3 97.3 97.5 97.2 97.6 97.3 97.4 97.6 97.5 97.4 97.4 Q30/%92.1 91.7 92.2 91.5 92.1 92.2 92.1 91.6 91.5 92.1 91.7 92.3 91.7 91.9 92.6 92.1 91.7 91.8 GC含量GC content/%44.1 44.1 44.1 44.1 44.2 44.2 43.7 43.7 43.7 44.0 45.3 44.1 44.3 44.2 44.4 44.2 44.2 44.2
2.5 差异基因分析
对WT与MT(WT vs MT)同一阶段的差异表达基因(DEGs)(|log2(Fold Change)|>1,FDR<0.05)进行统计。DEGs 数量随着汁胞发育而减少,其中70 DAB 时的DEGs 最多,有1549 个上调基因,1569个下调基因;170 DAB 时的DEGs 最少,有372 个上调基因,239 个下调基因(图5-A)。维恩图结果表明,70 DAB、120 DAB 和170 DAB 三个时间点存在88个DEGs重叠(图5-B)。
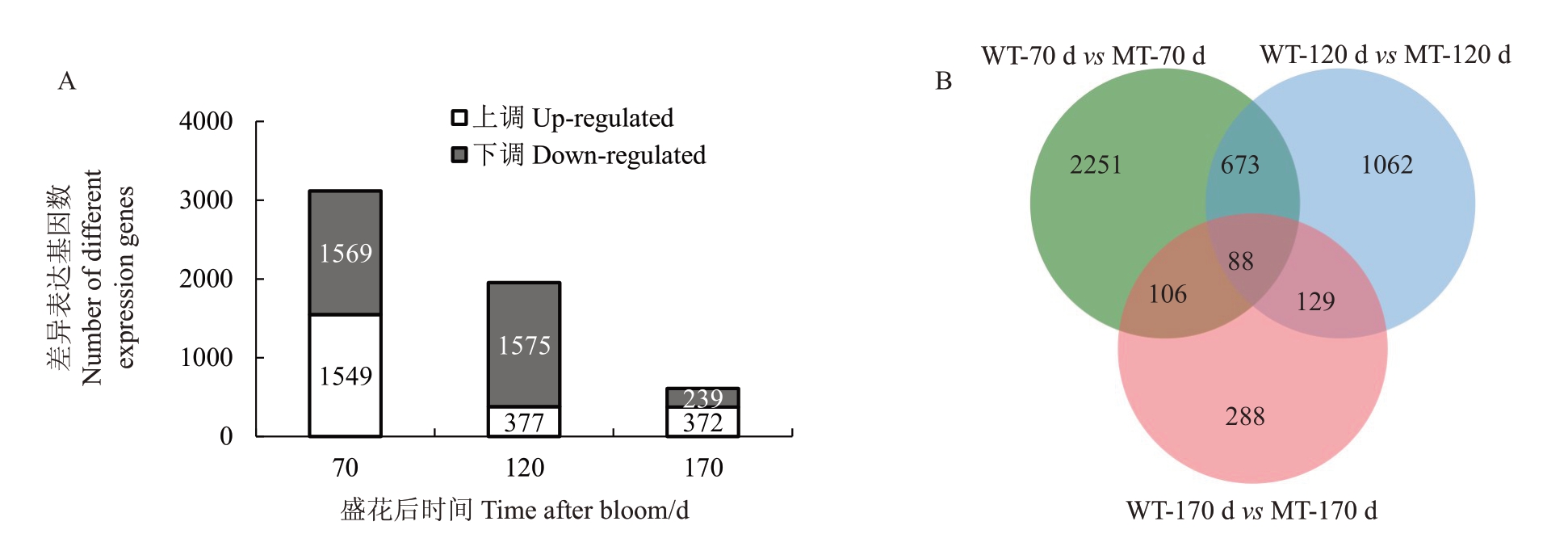
图5 锦红及其大果芽变在盛花后70 d、120 d 和170 d 时差异基因分析
Fig.5 Analysis of differentially expressed genes between Jinhong and its large-fruit mutant at 70,120 and 170 days after bloom
A.差异基因数量统计;B.3 个时期差异基因的维恩图。
A.The number of differentially expressed genes;B.Venn diagram of differentially expressed genes under three developmental stages.
2.6 差异基因注释
通常情况下,不同时期共有的差异基因可能为关键基因。对70 DAB、120 DAB 和170 DAB 的88个共有差异基因进行GO 和KEGG 分析。GO 注释结果表明,差异基因参与的生物学过程为细胞和代谢过程,分子功能体现在结合和催化活性方面(图6-A)。参与的KEGG 通路是脂肪酸延长、光合作用-天线蛋白、角质、木栓质和蜡质生物合成、苯丙烷代谢和植物激素信号传导(图6-B)。

图6 盛花后70 d、120 d 和170 d 时锦红及其大果芽变间共有差异基因的基因注释
Fig.6 Gene annotation of the common differentially expressed genes at 70,120 and 170 days after bloom
A.GO 分析;B.KEGG 分析。
A.GO analysis;B.KEGG analysis.
分别对同一阶段下的DEGs 进行GO 和KEGG分析。GO 富集结果表明,在70 DAB、120 DAB 和170 DAB,DEGs参与的生物学过程都是细胞和代谢过程,参与的细胞组分都是细胞解剖实体,参与的分子功能多集中在结合和催化活性两方面(图7-A~C)。KEGG 分析结果表明,在70 DAB,DEGs 主要富集在植物激素信号传导、MAPK 信号通路、植物-病原菌互作、色氨酸代谢以及苯丙烷代谢(图7-D);在120 DAB,DEGs 主要富集在光合作用-天线蛋白、植物-病原菌互作、MAPK信号通路、植物激素信号传导、光合作用的碳固定和苯丙烷代谢(图7-E);在170 DAB,DEGs主要富集在光合作用-天线蛋白、苯丙烷代谢、角质、木栓质和蜡质生物合成、类黄酮生物合成和MAPK信号通路上(图7-F)。三个时期的差异基因都富集到植物激素信号传导、MAPK信号通路、苯丙烷代谢、光合作用-天线蛋白通路上,但富集到信号通路上的基因和显著性存在差异。

图7 盛花后70 d、120 d 和170 d 时锦红及其大果芽变间差异基因的基因注释
Fig.7 Gene annotation of differentially expressed genes between Jinhong and its large-fruit mutant at 70,120 and 170 days after bloom
A~C.GO 分析;D~F.KEGG 分析。A、D.盛花后70 d;B、E.盛花后120 d;C、F.盛花后170 d。
A-C.GO analysis;D~F.KEGG analysis.A,D.70 days after bloom;B,E.120 days after bloom;C、F.170 days after bloom.

图7 (续) Fig.7 (Continued)
2.7 植物激素信号传导基因的表达分析
激素分析结果表明,植物激素影响汁胞发育(图4)。KEGG 分析结果表明,在70 DAB、120 DAB 和170 DAB,分别有61、38 和12 个DEGs 富集到植物激素信号传导途径上。24个DEGs在两个及以上时期差异表达,包括19 个已知功能的DEGs 和5 个未知功能的DEGs。笔者对19个DEGs进行热图分析,结果表明,它们分布在生长素(ⅠAA)、脱落酸(ABA)、细胞分裂素(CTK)、油菜素内酯(BR)等7种激素途径上。
如图8 所示,在脱落酸信号中,蛋白磷酸酶基因PP2C56、PP2C24 和PP2C8 的表达模式相同,在70 DAB 和120 DAB 时上调表达;脱落酸受体PYL2在70 DAB和170 DAB上调表达。在生长素信号中,GH3.6、GH3.1 和SAUR36 及IAA27 在生长素生物合成途径上起重要作用。其中,GH3.6 在大果芽变果实发育早期上调表达;IAA27 在大果芽变果实发育过程中上调表达,且呈上升趋势;SAUR36 和GH3.1在70 DAB时上调表达。生长素促进蛋白6B和22D的表达模式不同,生长素促进蛋白6B 在120 DAB上调表达,而生长素促进蛋白22D 在70 DAB 上调表达。细胞分裂素信号上的差异基因是双组分响应调节基因ARR2和ARR5。这2个基因在70 DAB时的表达趋势相反,但在120 DAB 时均下调表达;茉莉酸信号上的基因TIFY10A和水杨酸信号上的基因TGA9在大果芽变中下调表达。细胞周期D3和木葡聚糖内转葡萄糖基酶XTH23 属于油菜素内酯信号途径上的基因,细胞周期D3 基因在120 DAB 的大果芽变中显著下调表达,但在170 DAB时显著上调表达。XTH23的2个成员在70 DAB时上调表达,在120 DAB及170 DAB时下调表达。

图8 19 个差异基因的表达模式
Fig.8 Expression patterns of 19 differentially expressed genes involved in phytohormone signal transduction
log2FC(大果芽变/锦红)>0 表示差异基因在大果芽变中上调表达,log2FC(大果芽变/锦红)<0 表示差异基因在大果芽变中下调表达。
log2FC(Large-fruit mutant/Jinhong)>0 indicates up-regulated expression in large-fruit mutant;log2FC(Large-fruit mutant/Jinhong)<0 indicates down-regulated expression in large-fruit mutant.
3 讨 论
3.1 大果芽变果实变大的因素
果实大小是评价果实外观的重要性状,直接影响果实的经济效益。果实大小变异的产生方式主要有两种,一种是染色体加倍产生的大果型变异,另一种是体细胞变异产生的大果型芽变。在本研究中,流式细胞仪的鉴定结果表明,大果锦红的倍性仍是二倍体,说明大果锦红的产生不是由染色体数目加倍造成的。同时,大果芽变的果实质量是锦红的1.7倍,且自盛花后70 d,大果芽变的果肉横径均显著大于锦红。对果肉进一步分析发现,与锦红相比,大果芽变汁胞数量多且体积大,说明大果芽变的果实变大主要归于果肉厚度的变化,这与EⅠ-Otmani等[10]的结果相一致。果实的最终大小受细胞分裂和细胞膨大控制。芽变产生的大果型基本是由果肉细胞变大和细胞数量增多所产生的。蒋爽等[24]的研究表明,大翠冠果实变大的原因是果肉细胞变大。舒莎珊等[25]的研究表明,潘庄大翠冠的果实增大是由细胞数量增多引起的。在本研究中,通过石蜡切片技术分析锦红和大果芽变汁胞内细胞形态,结果发现大果芽变汁胞薄壁细胞层数多于锦红,说明细胞数量增多导致大果芽变汁胞变大,从而使柑橘果肉增厚,果实变大。
在生产上,人们采用2, 4-DP[10,26]、3, 5, 6-TPA[9]等生长素调节剂来增大柑橘果实。研究发现他们可通过细胞大小影响汁胞发育,从而改变果肉厚度[10]。本研究中,在70 DAB 和120 DAB,大果芽变中生长素含量显著高于锦红,说明生长素可能是引起大果芽变和锦红汁胞发育不同的重要激素。而在170 DAB 时两者体内生长素含量有所下降,这与冯贵芝[27]的研究结果相同,原因可能是此时果实膨大速率开始减慢,逐步进入成熟期,果实体内各激素水平发生改变。赤霉素控制细胞的伸长,并与果实大小和果实质量呈正相关[28]。在本研究中,大果芽变内GA3含量在各发育时期均高于锦红,这表明大果芽变果实大小的变异可能与赤霉素有关。玉米素是一种嘌呤类的细胞分裂素。Gan 等[19]研究表明,细胞分裂素参与调控番茄果皮厚度和果实大小。在本研究中,大果芽变中玉米素含量始终显著低于锦红,同石蜡切片的结果相矛盾,原因可能有两个,一是玉米素只是细胞分裂素的一种,不能代表汁胞内细胞分裂素含量;二是采样时间不对,细胞分裂素大多在果实发育早期起作用,而70 DAB 及之后两个时期已进入膨大阶段。
3.2 大果芽变汁胞的转录组分析
本研究中对锦红和大果芽变70 DAB、120 DAB和170 DAB 汁胞进行转录组分析,发现3 个时期的差异基因数量相差较大,其中70 DAB 时差异基因最多,170 DAB 时差异基因最少,说明在70 DAB 锦红和大果芽变之间的基因表达差异性更显著,该时期可能是引起两者最终果实大小差异的重要时期。KEGG 结果表明,差异基因富集在植物激素信号传导途径,并且24个差异基因在两个及以上时期差异表达,其中19个已知功能的差异基因多是花后70和120 d 时在锦红和大果芽变汁胞内差异显著。19 个基因中,生长素类的差异基因数目最多,同时激素测定结果也显示生长素在几种激素内含量偏高,说明生长素合成相关基因在锦红和大果芽变汁胞发育过程中表达活跃并存在显著差异,造成两者汁胞内生长素含量不同,使他们汁胞发育存在差异,从而导致果实大小不同。GH3.6 和IAA27 在大果芽变中的表达量均显著高于锦红,Su 等[15]的研究表明,SlIAA17通过影响细胞大小来参与调控果实大小。Yang等[29]发现,茉莉酸可能是影响蓝莓果实发育早期大小的关键植物激素,并协调其他植物激素共同促进果实生长发育,并指出茉莉酸信号相关基因TIFY9、TIFY10A 表达量显著高于其他激素信号上的基因。这一发现同本研究结果类似。
此外,本研究中还发现油菜素内酯、细胞分裂素等激素相关基因在锦红和大果芽变汁胞内差异表达。双组分响应调节基因ARR 能被细胞分裂素诱导并调节生长发育。在本研究中,ARR 基因在锦红和大果芽变中表达水平存在差异,且汁胞内玉米素含量不同,说明他们可能受到细胞分裂素的诱导参与调控果实大小。CycD3 是细胞周期蛋白基因,通过参与BR 激素信号传导刺激细胞分裂[30]。在本研究中,锦红和大果芽变的CycD3 表达量在花后70 d时差异不显著,而在花后120 d 和170 d 差异显著。同时,XTH23 作为BR 信号传导途径上的另一个重要基因,在锦红和大果芽变间表达量差异显著,说明油菜素内酯可能也参与柑橘果实大小的发育,但其基因功能还需进一步验证。
4 结 论
笔者通过对锦红和大果芽变果实内囊瓣数量、汁胞数量及体积进行测量和统计,初步明确汁胞发育是大果芽变的变异原因,石蜡切片进一步表明,细胞数量可能是引起汁胞变大的细胞学因子。通过对两者间激素含量的比较分析,认为植物激素能影响汁胞发育。通过分析锦红和大果芽变在盛花后70、120和170 d的转录组数据,筛选出IAA27、TIFY10A、CycD3等激素合成相关基因。
[1] 常平凡,宗颖生,李玉萍,解晓悦,刘永兰.不同等级富士苹果价格差别分析[J].山西农业大学学报(社会科学版),2002,1(1):27-28.CHANG Pingfan,ZONG Yingsheng,LⅠYuping,XⅠE Xiaoyue,LⅠU Yonglan. Analysis of the price difference of Fuji apple of various varying grade[J]. Journal of Shanxi Agricultural University(Society Science Edition),2002,1(1):27-28.
[2] GOFFⅠNET M C,ROBⅠNSON T L,LAKSO A N.A comparison of‘Empire’apple fruit size and anatomy in unthinned and handthinned trees[J]. Journal of Horticultural Science,1995,70(3):375-387.
[3] GUARDⅠOLA J L,GARCÍA-LUⅠS A. Ⅰncreasing fruit size in Citrus. Thinning and stimulation of fruit growth[J]. Plant Growth Regulation,2000,31(1):121-132.
[4] MOSTAFA E,SALEH M.Response of balady mandarin trees to girdling and potassium sprays under sandy soil conditions[J].Research Journal of Agriculture and Biological Sciences,2006,2(3):137-141.
[5] ASÍN L,VⅠLARDELL P,BONANY J,ALEGRE S.Effect of 6-BA,NAA and their mixtures on fruit thinning and fruit yield in‘Conference’and‘Blanquilla’pear cultivars[J].Acta Horticulturae,2010,884:379-382.
[6] STERN R A,BEN-ARⅠE R. GA3 inhibits flowering,reduces hand-thinning,and increases fruit size in peach and nectarine[J].The Journal of Horticultural Science and Biotechnology,2009,84(2):119-124.
[7] AGUSTⅠM,ALMELA V,ANDREU Ⅰ,JUAN M,ZACARⅠAS L. Synthetic auxin 3,5,6-TPA promotes fruit development and climacteric in Prunus persica L.Batsch[J].The Journal of Horticultural Science and Biotechnology,1999,74(5):556-560.
[8] AGUSTÍ M,GARⅠGLⅠO N,CASTⅠLLO A,JUAN M,ALMELA V,MARTÍNEZ-FUENTES A,MESEJO C. Effect of the synthetic auxin 2,4-DP on fruit development of loquat[J]. Plant Growth Regulation,2003,41(2):129-132.
[9] AGUSTÍ M,ZARAGOZA S,ⅠGLESⅠAS D J,ALMELA V,PRⅠ-MO-MⅠLLO E,TALÓN M.The synthetic auxin 3,5,6-TPA stimulates carbohydrate accumulation and growth in citrus fruit[J].Plant Growth Regulation,2002,36(2):141-147.
[10] EL-OTMANⅠM,AGUSTÍ M,AZNAR M,ALMELA V. Ⅰmproving the size of‘Fortuneâ’mandarin fruits by the auxin 2,4-DP[J].Scientia Horticulturae,1993,55(3/4):283-290.
[11] STERN R A,FLAⅠSHMAN M,APPLEBAUM S,BEN-ARⅠE R. Effect of synthetic auxins on fruit development of‘Bing’cherry (Prunus avium L.)[J]. Scientia Horticulturae,2007,114(4):275-280.
[12] STERN A R,BEN-ARⅠE R,APPLEBAUM S,FLAⅠSHMAN M. Cytokinins increase fruit size of‘Delicious’and‘Golden Delicious’(Malus domestica) apple in a warm climate[J]. The Journal of Horticultural Science and Biotechnology,2006,81(1):51-56.
[13] 陈双双,钟嵘,黄春辉,徐小彪,贾东峰,陶俊杰.不同浓度氯吡脲对‘东红’猕猴桃果实品质的影响[J].江西农业大学学报,2022,44(3):549-559.CHEN Shuangshuang,ZHONG Rong,HUANG Chunhui,XU Xiaobiao,JⅠA Dongfeng,TAO Junjie. Effects of different concentrations of chlorfenuron on fruit quality of‘Donghong’kiwifruit[J]. Acta Agriculturae Universitatis Jiangxiensis,2022,44(3):549-559.
[14] 郭淑萍,杨顺林,杨玉皎,张永辉,孟富宣,何建军,张俊松,金杰.GA3和CPPU 对无核翠宝葡萄果实品质的影响[J].果树学报,2022,39(10):1834-1844.GUO Shuping,YANG Shunlin,YANG Yujiao,ZHANG Yonghui,MENG Fuxuan,HE Jianjun,ZHANG Junsong,JⅠN Jie. Effect of GA3 and CPPU treatments on fruit quality of Wuhe Cuibao grape[J].Journal of Fruit Science,2022,39(10):1834-1844.
[15] SU L Y,BASSA C,AUDRAN C,MⅠLA Ⅰ,CHENⅠCLET C,CHEVALⅠER C,BOUZAYEN M,ROUSTAN J P,CHERVⅠN C. The auxin Sl-ⅠAA17 transcriptional repressor controls fruit size via the regulation of endoreduplication-related cell expansion[J].Plant and Cell Physiology,2014,55(11):1969-1976.
[16] PENG Z,LⅠW X,GAN X Q,ZHAO C B,PAUDEL D,SU W B,LV J,LⅠN S Q,LⅠU Z L,YANG X H.Genome-wide analysis of SAUR gene family identifies a candidate associated with fruit size in loquat(Eriobotrya japonica Lindl.)[J].Ⅰnternational Journal of Molecular Sciences,2022,23(21):13271.
[17] ZHAO J Y,JⅠANG L,CHE G,PAN Y P,LⅠY Q,HOU Y,ZHAO W S,ZHONG Y T,DⅠNG L,YAN S S,SUN C Z,LⅠU R Y,YAN L Y,WU T,LⅠX X,WENG Y Q,ZHANG X L.A functional allele of CsFUL1 regulates fruit length through repressing CsSUP and inhibiting auxin transport in cucumber[J]. The Plant Cell,2019,31(6):1289-1307.
[18] ZHANG L,XU Y,LⅠY T,ZHENG S S,ZHAO Z M,CHEN M L,YANG H J,YⅠH L,WU J X.Transcription factor CsMYB77 negatively regulates fruit ripening and fruit size in citrus[J].Plant Physiology,2024,194(2):867-883.
[19] GAN L J,SONG M Y,WANG X C,YANG N,LⅠH,LⅠU X X,LⅠY. Cytokinins are involved in regulation of tomato pericarp thickness and fruit size[J]. Horticulture Research,2022,9:uhab041.
[20] WANG X C,ZHAO M Z,WU W M,KORⅠR N K,QⅠAN Y M,WANG Z W. Comparative transcriptome analysis of berry-sizing effects of gibberellin (GA3) on seedless Vitis vinifera L.[J].Genes&Genomics,2017,39(5):493-507.
[21] SU W B,SHAO Z K,WANG M,GAN X Q,YANG X H,LⅠN S Q. EjBZR1 represses fruit enlargement by binding to the EjCYP90 promoter in loquat[J]. Horticulture Research,2021,8:152.
[22] 朱凯杰. 脐橙果皮色泽变异及番茄红素β-环化酶的调控研究[D].武汉:华中农业大学,2020.ZHU Kaijie.Color variation of navel orange flavedo and regulatory analysis of lycopene β-cyclase[D].Wuhan:Huazhong Agricultural University,2020.
[23] 卜海东.‘龙丰’苹果大果变异形成机制解析[D].沈阳:沈阳农业大学,2021.BU Haidong. Formation mechanism analysis of the‘Longfeng’apple large fruit variation[D]. Shenyang:Shenyang Agricultural University,2021.
[24] 蒋爽,骆军,王晓庆,李水根,周博强.翠冠梨大果芽变果实组织切片、激素变化及转录组分析[J].果树学报,2022,39(10):1737-1747.JⅠANG Shuang,LUO Jun,WANG Xiaoqing,LⅠ Shuigen,ZHOU Boqiang. Tissue sections,hormone changes,and transcriptomes analysis of the large-fruited bud mutation of Pyrus pyrifolia‘Cuiguan’[J]. Journal of Fruit Science,2022,39(10):1737-1747.
[25] 舒莎珊,李鑫,骆军,白松龄,滕元文.‘翠冠’梨大果型芽变的细胞学及相关基因表达研究[J].果树学报,2017,34(6):660-669.SHU Shashan,LⅠXin,LUO Jun,BAⅠSongling,TENG Yuanwen. Studies on cytology and related gene expression pattern of a large-fruited bud mutant from‘Cuiguan’pear (Pyrus pyrifolia)[J].Journal of Fruit Science,2017,34(6):660-669.
[26] YⅠLDⅠRⅠM B,YEŞⅠLOĞLU T,İNCESU M,KAMⅠLOĞLU M U,ÇⅠMEN B,TAMER Ş. Effects of 2,4-DP (2,4-dichlorophenoxypropionic acid) plant growth regulator on fruit size and yield of Valencia oranges (Citrus sinensis Osb.)[J]. New Zealand Journal of Crop and Horticultural Science,2012,40(1):55-64.
[27] 冯贵芝.基于时空转录组的脐橙果实发育和成熟调控机理的研究[D].武汉:华中农业大学,2021.FENG Guizhi. Research on regulating mechanism of navel orange development and maturation based on spatiotemporal transcriptome[D]. Wuhan:Huazhong Agricultural University,2021.
[28] ROKAYA P R,BARAL D R,GAUTAM D M,SHRESTHA A K,PAUDYAL K P.Effect of pre-harvest application of gibberellic acid on fruit quality and shelf life of mandarin(Citrus reticulata Blanco)[J].American Journal of Plant Sciences,2016,7(7):1033-1039.
[29] YANG L,LⅠU L M,WANG Z Y,ZONG Y,YU L,LⅠY Q,LⅠAO F L,CHEN M M,CAⅠK L,GUO W D.Comparative anatomical and transcriptomic insights into Vaccinium corymbosum flower bud and fruit throughout development[J]. BMC Plant Biology,2021,21(1):289.
[30] HU Y X,BAO F,LⅠJ Y.Promotive effect of brassinosteroids on cell division involves a distinct CycD3-induction pathway in Arabidopsis[J].The Plant Journal,2000,24(5):693-701.