甜瓜(Cucumis melo L.)是世界十大鲜食水果之一,深受国内外消费者喜爱[1-2]。随着生物技术的快速发展,植物育种技术正从驯化育种、杂交育种、分子标记辅助选择到依赖于前沿生物技术的人工智能育种变革。转基因育种、分子设计育种必将成为未来育种的重要手段。根癌农杆菌介导的植物遗传转化是验证基因功能和分子设计育种最为直接的手段,已在拟南芥、烟草、番茄和黄瓜等模式植物中广泛应用,其中黄瓜通过浸泡侵染25 min转化率超过23%[3-5],且具有较高的基因编辑效率。尽管甜瓜与黄瓜进化关系较近,但甜瓜遗传转化方法发展相对滞后,仍缺乏较为完善、高效的遗传转化体系[6-8],使甜瓜重要性状相关基因的功能研究受到严重制约[9]。Liu 等[10]和Nonaka 等[11]建立了甜瓜遗传转化和编辑体系,通过CRISPR/Cas9 编辑CmNAC 和CmACO1,使甜瓜果实成熟延迟,货架期延长,且不影响果实质量,可实现甜瓜品质定向改良。以上说明甜瓜遗传转化体系建立的必要性。
无菌苗培养条件及苗龄、子叶节创伤方式、侵染方式和筛选剂浓度等都会影响甜瓜遗传转化的效率,因此,系统探究遗传转化关键影响因子对转化效率的影响,对建立较为完善的遗传转化体系具有重要意义。不同生长环境及苗龄的无菌苗影响细胞分化程度、方向及子叶节外植体遗传转化能力。多项研究表明,正常培养3~5 d和暗培养1 d是甜瓜遗传转化最佳无菌苗的苗龄;正常培养3~5 d 子叶颜色正由淡黄转为淡绿色[12-16],光合作用为子叶节提供充足的能量[17-18];暗培养1 d能保持细胞的原始状态、细胞分裂旺盛、分化程度低,可提高阳性率[19-22]。在细胞分裂过程中只有少数细胞分化为芽原基,通过创伤增大农杆菌与细胞的接触范围,可提高侵染效率[2,23-24]。对于甜瓜子叶节,目前常用的创伤方式有创伤、微刷和超声,不同基因型和外植体类型应综合考虑选择恰当的创伤方式[7,25-27]。此外,侵染方式和时长对遗传转化效果影响较大,浸泡侵染和真空渗透均能取得良好效果,不同的基因型浸泡时间以15~25 min为宜[8,28]。一般真空侵染压力以80 kPa为宜,时间一般为10 min左右,可提升侵染效果,提高阳性率,为防止子叶节因长时间处于高压、缺氧造成损伤甚至死亡,真空侵染以分段进行为宜[12-13]。与侵染方式一样重要的是筛选,为降低假阳性苗概率,甜瓜遗传转化过程中可以使用Kan及Basta为筛选剂,不同基因型筛选剂使用浓度不同[2,18,29]。前人研究认为,75 mg·L-1的Kan 可用于筛选薄皮转基因甜瓜苗,阳性率可高达84.2%[15],但对厚皮甜瓜效果并不理想。
总体而言,目前关于甜瓜的遗传转化体系尚不完善,不同基因型或材料间遗传转化体系和效率差别极大。笔者在本研究中以厚皮甜瓜B8为材料,以子叶节为外植体,构建甜瓜遗传转化体系;采用根癌农杆菌介导法,对影响遗传转化的无菌苗苗龄、子叶节创伤方式、侵染方式、筛选剂浓度等关键因素进行探究,以期建立一种稳定性较强、重复性较好、阳性率较高的厚皮甜瓜遗传转化体系,为甜瓜基因功能验证和种质资源改良提供技术支撑和理论依据。
1 材料和方法
1.1 材料与培养基
试验于中国农业科学院郑州果树研究所遗传转化实验室进行。B8 材料(甜瓜种厚皮亚种,多代自交系)由中国农业科学院郑州果树研究所甜瓜遗传育种课题组提供。植物表达载体pBSE4011v-35SeYGFPuv(pQY002005)受赠于青岛清原农冠公司,载体携带GFP基因和BIPR基因(图1)。
图1 pBSE4011v-35S-eYGFPuv 载体主要元件
Fig.1 The elements of pBSE4011v-35S-eYGFPuv vector
GFP 为绿色荧光蛋白基因;BIPR 为Basta 抗性基因。
GFP is the Green Fluorescent Protein gene;BIPR is the Basta Resistance gene.
试验所用不定芽诱导培养基为:MS+1 mg·L-1 6-BA+1 mg·L-1 ABA;伸长培养基为MS+0.1 mg·L-1 6-BA;生根培养基为:1/2 MS + 0.5 mg·L-1 IAA(本文培养基pH 值均为5.8);抑菌剂特美汀(Tim)及质量浓度为:300 mg·L-1。所有处理均设置3 个重复,每个重复30个外植体。
1.2 试验方法与处理
1.2.1 种子处理、消毒 挑选健康饱满的B8 种子,无菌水浸泡30 min 后剥去外种皮,先用75%乙醇浸泡30 s,然后用2%的次氯酸钠浸泡15 min,最后用无菌水冲洗4~5遍,无菌滤纸吸除多余水分。
1.2.2 无菌苗苗龄筛选 消毒后的种子种植于1/2 MS培养基上获取无菌苗。设置1~5 d苗龄,黑暗和正常光周期组合(D 代表暗培养,L 代表正常光周期,光照16 h·d-1,黑暗8 h·d-1;如D1L0 表示暗培养1 d,正常光周期培养0 d)分别用于培养无菌苗,观察、统计外植体荧光芽率、变态率,确定适宜遗传转化的苗龄。
荧光芽率/%=(荧光芽数量/接种外植体个数)×100。
荧光芽变态率/%=(变态荧光芽数量/荧光芽数量)×100。
1.2.3 子叶节外植体获取、培养及创伤方式筛选 将无菌苗去除生长点和胚根,选择近胚轴端子叶节作为外植体。为探究创伤对侵染的影响,设置无创伤、超声、微刷+超声3 种创伤方式,结合D1L0 和D0L3无菌苗,共6个处理。超声处理为100 Hz,处理10 s。微刷处理是用纳米微刷轻刷子叶正面。无菌苗、子叶节外植体和不定芽培养均在光照16 h·d-1,黑暗8 h·d-1,26 ℃恒温条件下进行。后期统计再生芽和芽丛荧光率以确定最佳处理。
芽丛荧光率/%=(芽丛荧光数/芽丛总数)×100。
1.2.4 侵染方式筛选 制备侵染菌液,侵染菌液OD为0.6,用手术刀在子叶节表面划出两道划痕,按不同方式侵染。侵染结束后于28 ℃黑暗共培养3 d。设置4种处理,共培养7 d后观察荧光情况,8周后观察荧光芽状态、统计芽丛数、芽丛荧光率及荧光芽率来确定最佳侵染方式。
芽丛获得数=芽丛总数/外植体总数。
1.2.5 筛选剂浓度确定 以草铵膦(glufosinate ammonium,Basta)为抗性筛选剂,设置0、2、4、6、8、12 mg·L-1共6 个质量浓度梯度,对外植体进行抗性筛选、诱导不定芽。通过统计外植体出芽率、黄化率和死亡率,确定适宜的筛选剂浓度。
出芽率/%=(出芽外植体个数/接种外植体个数)×100。
黄化率/%=(黄化外植体个数/接种外植体个数)×100。
死亡率/%=(死亡外植体个数/接种外植体个数)×100。
1.2.6 不定芽诱导、伸长及不定根诱导 切下芽丛,转移至伸长培养基上进行伸长诱导。待不定芽伸长2~3 cm、具有3~4枚叶片时,进行不定根诱导。
1.2.7 阳性苗鉴定 利用Blak-Ray B-100AP,High Intensity UV Lamp(2.0 Amps,230V/50 Hz)紫外灯照射筛选GFP荧光苗。PCR扩增检测目标条带,检测引物序列为eYGFP-F:CTACATGTCTCTTGGGGCGCT,eYGFP-R:ATGACAACCTTCAAAATCGAGTCCCG。通过PCR扩增确定转化阳性苗,统计生根苗的阳性率。
阳性苗率/%=(生根阳性苗数量/总生根苗数量)×100。
荧光苗率/%=(生根荧光苗数量/接种外植体个数)×100。
1.3 数据统计
分别采用Excel Office 2016和SPSS Statistics 26进行数据统计和显著性分析,同一列间进行差异分析,不同小写字母代表两组数据存在显著差异(p<0.05)。
2 结果与分析
2.1 苗龄对遗传转化的影响
无菌苗的培养方式影响苗状态和遗传转化,对无菌苗培养方式进行探究,以期达到高荧光芽获得率、较低变态率。结果(表1)表明,子叶节先暗培养、再经光培养处理玻璃化较为严重,不适合作为转化苗龄;仅进行暗培养处理均能获得荧光芽,但D2L0、D3L0、D4L0 处理下,荧光芽变态率分别达到42.9%、61.5%和66.7%,显著高于其他处理,不适于转化。D1L0 和D0L3 处理,荧光芽获得率相对较高,分别为25.6%和26.7%,且荧光芽变态率相对较低。以上结果表明,暗培养时间越长,再生芽变态率越高;正常光周期下D0L3或D1L0是较合适的无菌苗培养方式。
表1 不同苗龄遗传转化后再生能力的分析
Table 1 The ability of different seedling age on regeneration after transformation
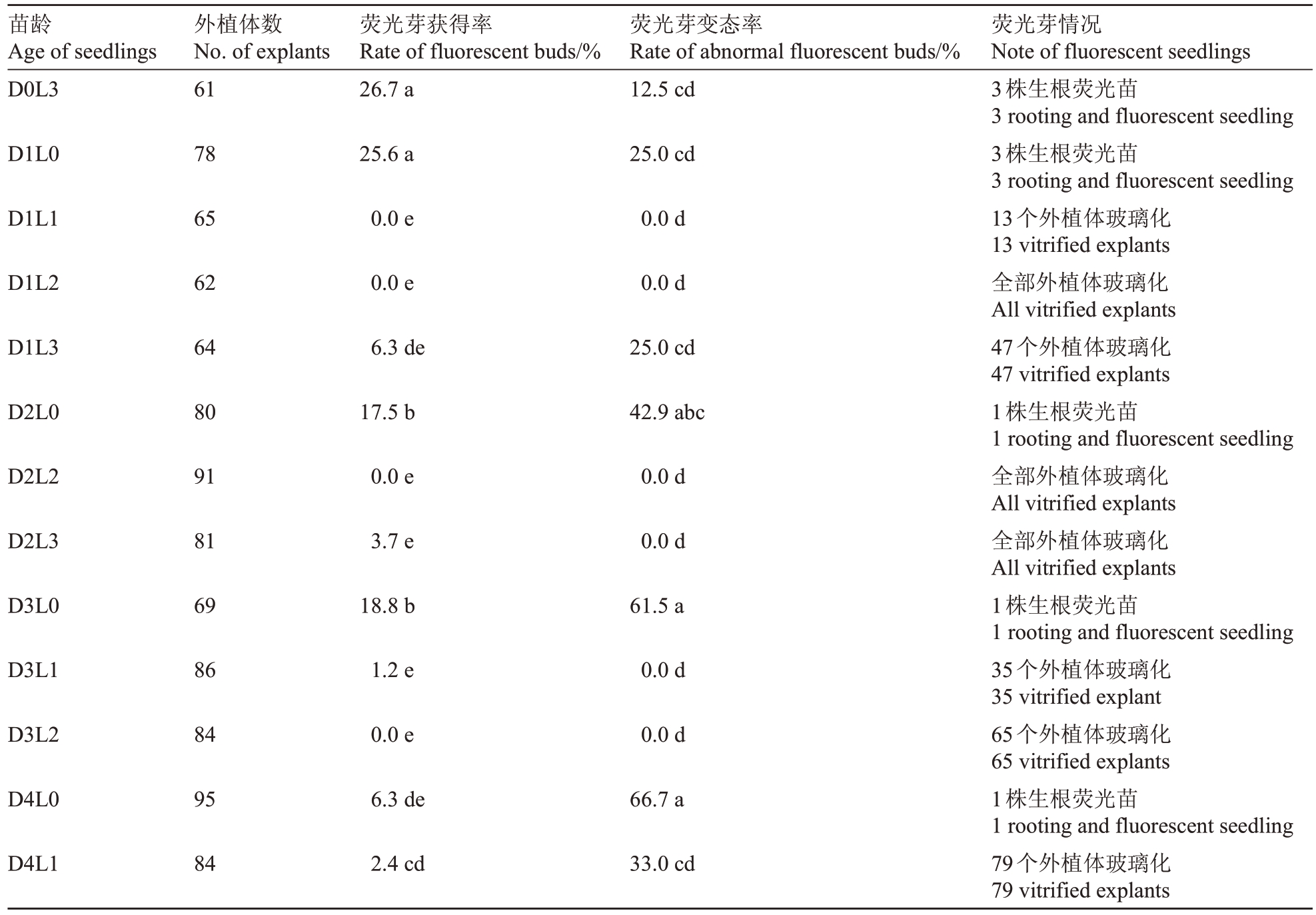
注:不同小写字母表示差异显著(p<0.05)。下同。
Note:Different small letters repesent significant differerence(p<0.05).The same below.
?
2.2 创伤方式对遗传转化的影响
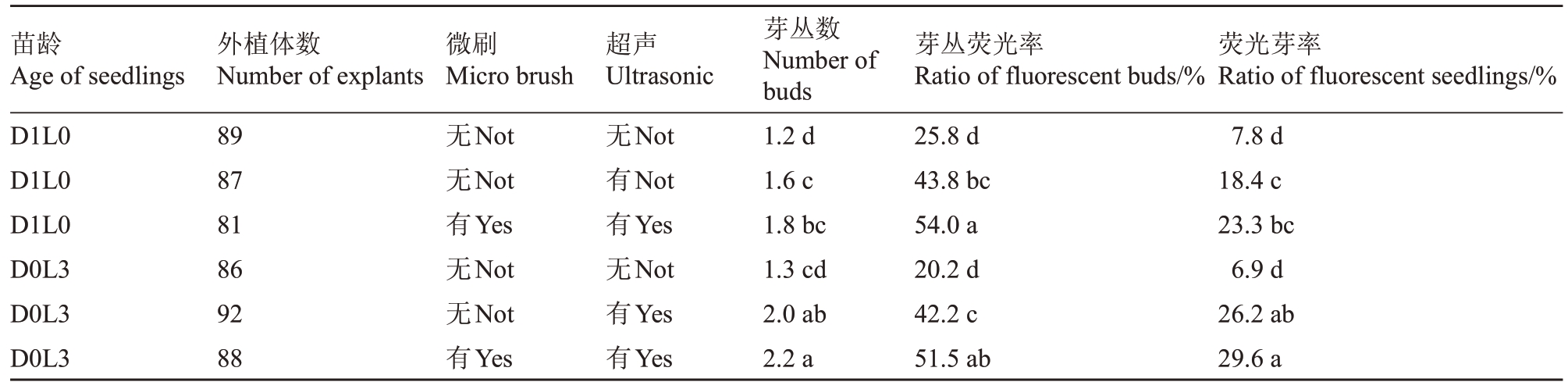
为了探究创伤对子叶节的影响,通过微刷和超声结合不同方式培养的无菌苗来筛选能够有效促进侵染的创伤方式。表2表明,苗龄一致时,无创伤处理的芽丛数、芽丛荧光率、荧光芽率均显著低于其他处理,说明创伤可以促进农杆菌侵染,增加不定芽数目。超声和微刷+超声处理D1L0的子叶节,芽丛荧光率显著提升,但二者芽丛数、荧光芽率分别为1.6和18.4%、1.8 和23.3%,均无显著差异,说明微刷尽管增加了植物的创伤面积,促进了农杆菌的侵染,但可能因细胞损伤最终未能提高荧光芽率。而D0L3超声处理芽丛数为2.2,荧光芽率为29.6%,均显著高于D1L0,因此确定子叶节最佳创伤处理为微刷+超声处理。
表2 创伤方式对遗传转化的影响
Table 2 Analysis the effect of different treatment and seedlings on genetic transformation
?
2.3 侵染方式对遗传转化的影响
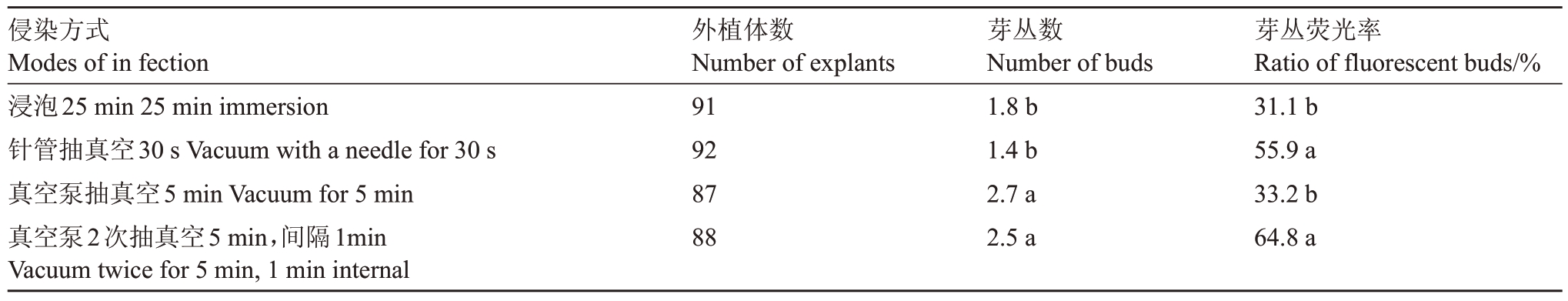
侵染方式影响遗传转化效率,因此利用不同侵染方式对外植体处理后进行观察及统计,筛选相对高效的侵染方式。结果(表3)表明,浸泡25 min(图2-A)外植体荧光面积相对较大,表明浸泡25 min侵染程度高,但芽丛数、芽丛荧光率、荧光芽率均显著低于真空泵85 kPa 抽真空5 min(图2-C)和真空泵85 kPa 抽真空5 min 2 次,间隔1 min(图2-D),且存在嵌合、变态、玻璃化等问题,说明浸泡侵染25 min农杆菌停留在外植体表层,影响外植体出芽,不适宜侵染。针管抽真空30 s(图2-B)荧光面积较大,芽丛荧光率较高(55.9%),说明针管抽真空30 s农杆菌能到达深层细胞,但芽丛数、荧光芽获得率最低,仅为1.4和4.3%,显著低于真空泵85 kPa抽真空5 min,因此针管抽真空30 s不适合侵染。2次5 min有间隔的抽真空处理,芽丛荧光率达64.8%,显著高于一次抽真空(33.2%),外植体荧光面积也大于一次抽真空处理,荧光芽长势较好(图3)。
表3 不同侵染方式对遗传转化效率的影响
Table 3 Effect of different infection modes on genetic transformation
?

图2 不同侵染后共培养7 d 后荧光检测情况
Fig.2 Fluorescence detection after 7 days co-cultured with different infection methods
A.浸泡侵染25 min 处理;B.针管抽真空30 s;C.真空泵抽真空5 min;D.真空泵抽真空5 min 2 次,间隔1 min。
A.Immersion and infection for 25 min;B.Vacuum the needle tube for 30 s;C.The explants were vacuumed for 5 min;D.The explants were vacuumed for 5 min twice at intervals of 1 min.

图3 荧光芽的筛选与鉴定
Fig.3 Identification and selection of fluorescent buds
综上所述,对于B8子叶外植体,真空泵进行2次5 min,中间间隔1 min 的真空负压处理为较适宜的侵染方式。
2.4 抗性筛选剂浓度的明确
抗性筛选剂有助于筛选阳性苗,减轻鉴定工作量。因此,通过观察、统计不同浓度的Basta 对出芽状况的影响,以期筛选到较适宜的Basta质量浓度。结果(表4)表明,不添加筛选剂,B8出芽能力较强;当Basta 质量浓度为2 mg·L-1时,出芽时间较晚、出芽量少,出芽率仍高达78.7%,因此2 mg·L-1的Basta 不能有效抑制阴性芽丛;当Basta 质量浓度为4 mg·L-1时,外植体出芽晚、芽丛数量少、出芽率为14.3%,显著低于2 mg·L-1处理,表明添加4 mg·L-1 Basta可有效筛选抗性不定芽,同时外植体黄化率和死亡率较低,分别为8.8%和3.3%;而当Basta质量浓度为6、8、12 mg·L-1时,外植体出芽率分别为5.5%、1.1%、0,显著低于其他质量浓度处理,且外植体黄化率、死亡率较高,表明Basta 质量浓度大于6 mg·L-1对外植体造成严重影响。以上结果表明,4 mg·L-1的Basta是较为合适的抗性芽筛选质量浓度。
表4 不同Basta 浓度处理下外植体分化情况统计分析
Table 4 The statistics analysis of explants under different Basta concentration

?
2.5 遗传转化体系的建立及阳性苗鉴定
以上述最优结果进行试验,通过侵染、再生和筛选(图4)等过程,从120 个外植体中获得荧光芽31个,荧光芽获得率达25.8%,生根无菌苗17株。对生根苗进行PCR检测,发现8株阳性苗,其中红色标记编号2、6、9、12、13、14、16、17 为阳性苗(图5),生根率为58.8%,阳性苗率达6.7%(600 bp 大小条带为GFP,最下面条带为引物二聚体),成功创建了以厚皮甜瓜B8基因型为受体材料的较为完善、高效的遗传转化体系。

图4 甜瓜遗传转化流程
Fig.4 The genetic transformation process of melon
A.无菌苗的培养;B.将无菌子叶剪至合适大小的外植体进行侵染和共培养;C、D.不定芽的诱导和伸长;E、F.抗性芽的筛选;G.不定根的诱导;H.抗性苗。
A. Culture of sterile seedlings; B. Sterile cotyledons are sheared to appropriately sized explants for infection and co-culture; C, D. Induction and elongation of adventitious buds;E,F.Screening of resistant buds;G.Induction of adventitious roots;H.Resistant seedling selection.
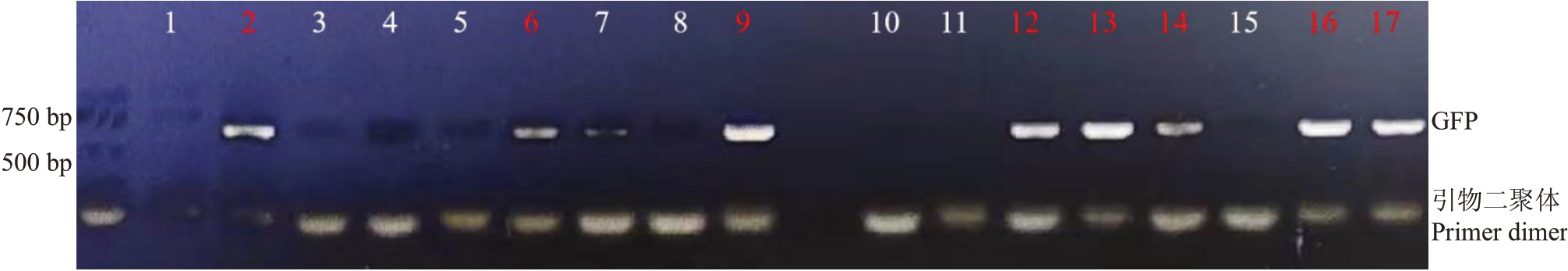
图5 琼脂糖凝胶电泳鉴定GFP 阳性植株
Fig.5 Gel electrophoresis detection of GFP positive seedlings
1~17 为PCR 扩增产物样品编号,其中2,6,9,12,13,14,16,17 为阳性扩增。
1-17 is the sample number of PCR amplification products,of which 2,6,9,12,13,14,16,17 are positive amplification.
3 讨 论
高效遗传转化体系是进行基因功能验证最直接、最广泛、最有效的方法。甜瓜遗传转化体系尚不完善,存在重复性差、转化率低、基因型依赖性强等问题。笔者在本研究中通过对苗龄、创伤、侵染、筛选等影响甜瓜遗传转化的重要因素进行探究,建立了一个相对完善的甜瓜遗传转化体系,为基因功能验证和种质精准改良提供技术支撑。
不同发育阶段的子叶细胞全能性不同,不定芽出芽效率差异较大,无菌苗的培养条件及苗龄尤为重要。有学者认为,暗培养的无菌苗可降低细胞的光形态建成,保持细胞的未分化状态,增高侵染后不定芽的诱导率[20]。也有研究表明,正常光周期生长3 d 的无菌苗,子叶不定芽再生率较高,且能成功获得阳性转化植株[16,30-32]。相较之前的研究,笔者在本研究中发现对厚皮甜瓜B8 进行暗培养在一定程度上增加阳性芽的数量,但暗培养时间越长不定芽变态率越高,暗培养1 d时,侵染效果相对较好。此外,正常光周期下培养3 d,待子叶由淡黄色转淡绿色时获取外植体,再生芽状态好、变态率较低。笔者认为对甜瓜苗龄的选择应该根据受体材料类型进行调整。另外,厚皮甜瓜种子较大,1 d 苗龄子叶节外植体状态较好;种子较小、子叶薄的薄皮甜瓜,建议培养至子叶黄转绿时切割外植体,可有效减少对细胞的伤害,在保证再生苗阳性率的同时降低不定芽的变态率。
另外,适当的创伤可提高外植体不定芽再生率及遗传转化效率,而创伤过重则会降低阳性率[16,33-34]。人为创伤、微刷和超声等方式在葫芦科作物遗传转化中被广泛应用[7,25,27,35],而笔者发现,人为创伤对外植体伤害较大,微刷+超声10 s对子叶外植体的处理较为理想,且结合正常光周期3 d的苗龄能获得更佳的侵染效果。相比之下,Wan 等[35]使用微刷和超声处理20 s,在-1.0 kPa 下真空浸泡90 s,产生的绿色荧光蛋白信号较强,侵染效率较高,不同的受体材料,调整微刷+超声时间都能取得较好的转化效果。
此外,不同侵染方式影响不定芽的诱导率及阳性率。笔者在本研究中发现,浸泡侵染只能到达表层细胞,不定芽阳性率低,抽真空侵染可使农杆菌到达外植体的深层细胞,但压力过大会损伤植物细胞,抑制不定芽的生长,在压力为85 kPa 的真空泵中抽真空2次,每次5 min,间隔1 min侵染B8子叶,结果与Hooghvorst 等[12]的研究一致,具有较高的侵染效率。遗传转化除了创伤,不定芽的抗性筛选也尤为重要,再生芽的阳性筛选可大大减轻后续鉴定的工作量。筛选剂的使用主要由双元载体上抗性基因决定,常用的筛选基因有NPTⅡ、BIPR和HYG,对应的筛选剂主要是Kan、Basta和Hyg。对于甜瓜,Kan的筛选通常有很高的假阳性率,并不能降低筛选难度[35-36]。Hyg的筛选假阳性率相对较低,但更容易导致不定芽畸形[37]。Basta 筛选剂的使用对甜瓜不定芽生长影响较小,笔者在本研究中添加4 mg·L-1的Basta筛选效果较好,在其作用下能稳定进行甜瓜遗传转化,并且通过上述转化方法,笔者课题组已成功获得T1代株系,鉴定到GFP能够稳定遗传。
笔者在本研究中以厚皮甜瓜B8为材料,通过对苗龄、侵染方式等影响因素的筛选和验证,建立了较为完善且高效的根癌农杆菌介导的厚皮甜瓜遗传转化体系。即以正常光周期下生长3 d子叶为外植体,对外植体进行微刷+10 s 超声处理;再经2 次5 min压力为85 kPa的抽真空侵染,其间间隔1 min之后共培养2 d,挑选状态较好的外植体进行不定芽诱导和筛选,Basta 筛选质量浓度为4 mg·L-1。生根苗阳性率为58.8%,阳性苗获得率为6.7%,成功建立了较为完善、高效的厚皮甜瓜遗传转化体系,为重要性状调控基因的功能验证提供技术支撑和理论依据。
4 结 论
笔者在本研究中以厚皮甜瓜B8 为材料,通过农杆菌介导转化、侵染B8 子叶并诱导再生,通过探究影响甜瓜遗传转化过程中的重要因子,建立以B8 为基础的甜瓜遗传转化体系。研究发现,以正常光周期培养3 d 的无菌苗子叶为外植体,对其进行微刷+10 s 超声处理可提高农杆菌侵染效率,荧光芽获得率达26.2%;压力85 kPa 的2 次5 min 的抽真空(其间间隔1 min)侵染效果较佳;4 mg·L-1的Basta 较适宜筛选抗性植株。通过以上方法,转化120 个外植体,可获得31 个再生荧光芽,17 株生根苗,通过PCR 检测确定8 株阳性苗,阳性率达58.8%,阳性植株获得率为6.7%。综上所述,笔者在本研究中成功建立了以B8 为材料的较为完善的甜瓜遗传转化体系,为关键基因功能验证和种质改良提供技术支撑和理论依据。
[1] HE Z Q,DUAN Z Z,LIANG W,CHEN F J,YAO W,LIANG H W,YUE C Y,SUN Z X,CHEN F,DAI J W. Mannose selection system used for cucumber transformation[J]. Plant Cell Reports,2006,25(9):953-958.
[2] VENGADESAN G,ANAND R P,SELVARAJ N,PERL-TREVES R,GANAPATHI A. Transfer and expression of NPT II and BAR genes in cucumber(Cucumis satavus L.)[J].In Vitro Cellular&Developmental Biology-Plant,2005,41(1):17-21.
[3] 万旭花,陈书霞,申晓青,陈为峰,张然然,成思琼.黄瓜高频再生体系的建立[J].西北农林科技大学学报(自然科学版),2014,42(8):162-168.WAN Xuhua,CHEN Shuxia,SHEN Xiaoqing,CHEN Weifeng,ZHANG Ranran,CHENG Siqiong. Establishment of a high-frequency regeneration system for cucumber[J]. Journal of Northwest A & F University (Natural Science Edition),2014,42(8):162-168.
[4] WANG S,TANG L,CHEN F.In vitro flowering of bitter melon[J].Plant Cell Reports,2001,20(5):393-397.
[5] ZHAO Z Y,QI Y G,YANG Z M,CHENG L Y,SHARIF R,RAZA A,CHEN P,HOU D,LI Y H.Exploring the Agrobacteriummediated transformation with CRISPR/Cas9 in cucumber(Cucumis sativus L.)[J]. Molecular Biology Reports,2022,49(12):11481-11490.
[6] FENG Q,XIAO L,HE Y Z,LIU M,WANG J F,TIAN S J,ZHANG X,YUAN L. Highly efficient,genotype-independent transformation and gene editing in watermelon (Citrullus lanatus) using a chimeric ClGRF4-GIF1 gene[J]. Journal of Integrative Plant Biology,2021,63(12):2038-2042.
[7] TRICK H N,FINER J J.Sonication-assisted Agrobacterium-mediated transformation of soybean[Glycine max(L.)Merrill]embryogenic suspension culture tissue[J].Plant Cell Reports,1998,17(6):482-488.
[8] 肖守华.西瓜、甜瓜遗传转化体系的建立及转基因植株的抗病性分析[D].泰安:山东农业大学,2006.XIAO Shouhua. Establishment of watermelon and melon genetic transformation system and analysis of disease-resistance in transgenic plants[D].Tai’an:Shandong Agricultural University,2006.
[9] 高鹏,刘识,崔浩楠,张泰峰,王学征,刘宏宇,朱子成,栾非时.甜瓜基因组学、功能基因定位及基因工程育种研究进展[J].园艺学报,2020,47(9):1827-1844.GAO Peng,LIU Shi,CUI Haonan,ZHANG Taifeng,WANG Xuezheng,LIU Hongyu,ZHU Zicheng,LUAN Feishi. Research progress of melon genomics,functional gene mapping and genetic engineering[J]. Acta Horticulturae Sinica,2020,47(9):1827-1844.
[10] LIU B,SANTO DOMINGO M,MAYOBRE C,MARTÍNHERNÁNDEZ A M,PUJOL M,GARCIA-MAS J. Knock-out of CmNAC- NOR affects melon climacteric fruit ripening[J].Frontiers in Plant Science,2022,13:878037.
[11] NONAKA S,ITO M,EZURA H.Targeted modification of CmACO1 by CRISPR/Cas9 extends the shelf-life of Cucumis melo var. reticulatus melon[J]. Frontiers in Genome Editing,2023,5:1176125.
[12] HOOGHVORST I,LÓPEZ-CRISTOFFANINI C,NOGUÉS S.Efficient knockout of phytoene desaturase gene using CRISPR/Cas9 in melon[J].Scientific Reports,2019,9:17077.
[13] HU B W,LI D W,LIU X,QI J J,GAO D L,ZHAO S Q,HUANG S W,SUN J J,YANG L. Engineering non-transgenic gynoecious cucumber using an improved transformation protocol and optimized CRISPR/Cas9 system[J]. Molecular Plant,2017,10(12):1575-1578.
[14] 陶兴林.甜瓜高效再生体系、转化体系的建立与优化[D].兰州:甘肃农业大学,2005.TAO Xinglin.Establisment and optimize of high effective regeneration system and transformation system in melons (Cucumis melo L.)[D].Lanzhou:Gansu Agricultural University,2005.
[15] 肖守华,李国生,焦自高,王崇启,董玉梅,李圣辉.西瓜高效再生体系的建立[J].中国瓜菜,2010,23(3):11-14.XIAO Shouhua,LI Guosheng,JIAO Zigao,WANG Chongqi,DONG Yumei,LI Shenghui.Establishment of high frequency regeneration system in watermelon[J]. China Cucurbits and Vegetables,2010,23(3):11-14.
[16] ZHANG Y Y,ZHANG D M,ZHONG Y,CHANG X J,HU M L,CHENG C Z.A simple and efficient in planta transformation method for pommelo (Citrus maxima) using Agrobacterium tumefaciens[J].Scientia Horticulturae,2017,214:174-179.
[17] 王吉明,尚建立,李娜,周丹,马双武.我国西瓜甜瓜种质资源收集、保存与利用研究进展[J].中国瓜菜,2018,31(2):1-6.WANG Jiming,SHANG Jianli,LI Na,ZHOU Dan,MA Shuangwu. Collection,preservation,and utilization of germplasm resources of watermelon and melon in China[J]. China Cucurbits and Vegetables,2018,31(2):1-6.
[18] WANG S L,KU S S,YE X G,HE C F,KWON S Y,CHOI P S.Current status of genetic transformation technology developed in cucumber(Cucumis sativus L.)[J].Journal of Integrative Agriculture,2015,14(3):469-482.
[19] AKASAKA-KENNEDY Y,TOMITA K O,EZURA H. Efficient plant regeneration and Agrobacterium-mediated transformation via somatic embryogenesis in melon(Cucumis melo L.)[J].Plant Science,2004,166(3):763-769.
[20] NANASATO Y,KONAGAYA K I,OKUZAKI A,TSUDA M,TABEI Y. Improvement of Agrobacterium-mediated transformation of cucumber (Cucumis sativus L.) by combination of vacuum infiltration and co-cultivation on filter paper wicks[J]. Plant Biotechnology Reports,2013,7(3):267-276.
[21] SU Y H,ZHOU C,LI Y J,YU Y,TANG L P,ZHANG W J,YAO W J,HUANG R F,LAUX T,ZHANG X S. Integration of pluripotency pathways regulates stem cell maintenance in the Arabidopsis shoot meristem[J]. Proceedings of the National Academy of Sciences of the United States of America,2020,117(36):22561-22571.
[22] WEHNER T C,LOCY R D. In vitro adventitious shoot and root formation of cultivars and lines of Cucumis sativus L.[J]. Hort-Science,1981,16(6):759-760.
[23] KARTHIK S,PAVAN G,PRASANTH A,SATHISH S,APPUNU C,MANICKAVASAGAM M. Improved in planta genetic transformation efficiency in bitter gourd (Momordica charantia L.)[J]. In Vitro Cellular & Developmental Biology-Plant,2021,57(2):190-201.
[24] SUBBAN P,KUTSHER Y,EVENOR D,BELAUSOV E,ZEMACH H,FAIGENBOIM A,BOCOBZA S,TIMKO M P,REUVENI M. Shoot regeneration is not a single cell event[J].Plants,2020,10(1):58.
[25] CHEN X J,HE S T,JIANG L N,LI X Z,GUO W L,CHEN B H,ZHOU J G,SKLIAR V.An efficient transient transformation system for gene function studies in pumpkin(Cucurbita moschata D.)[J].Scientia Horticulturae,2021,282:110028.
[26] XIN T X,TIAN H J,MA Y L,WANG S H,YANG L,LI X T,ZHANG M Z,CHEN C,WANG H S,LI H Z,XU J T,HUANG S W,YANG X Y.Targeted creation of new mutants with compact plant architecture using CRISPR/Cas9 genome editing by an optimized genetic transformation procedure in cucurbit plants[J].Horticulture Research,2022,9:uhab086.
[27] YAMADA T,WATANABE S,ARAI M,HARADA K,KITAMURA K.Cotyledonary node pre-wounding with a micro-brush increased frequency of Agrobacterium-mediated transformation in soybean[J].Plant Biotechnology,2010,27(2):217-220.
[28] 钟俐.根癌农杆菌介导的雪花莲凝集素基因转入新疆甜瓜的研究[D].乌鲁木齐:新疆农业大学,2001.ZHONG Li.A study on transferring of snowdrop Galanthus nivalis agglutinin (GNA) gene in Cucumis melo L. of Xinjiang[D].Urumqi:Xinjiang Agricultural University,2001.
[29] GABA V,ZELCER A,GAL-ON A. Cucurbit biotechnology-the importance of virus resistance[J]. In Vitro Cellular & Developmental Biology-Plant,2004,40(4):346-358.
[30] CHOI P S,SOH W Y,KIM Y S,YOO O J,LIU J R. Genetic transformation and plant regeneration of watermelon using Agro-bacterium tumefaciens[J]. Plant Cell Reports,1994,13(6):344-348.
[31] GABA V,SCHLARMAN E,ELMAN C,SAGEE O,WATAD A A,GRAY D J. In vitro studies on the anatomy and morphology of bud regeneration in melon cotyledons[J]. In Vitro Cellular &Developmental Biology-Plant,1999,35(1):1-7.
[32] ZHANG H J,GAO P,WANG X Z,LUAN F S.An efficient regeneration protocol for Agrobacterium-mediated transformation of melon (Cucumis melo L.)[J]. Genetics and Molecular Research,2014,13(1):54-63.
[33] 李蕾,孟永娇,张璐,娄群峰,李季,钱春桃,陈劲枫.黄瓜遗传转化体系优化的研究[J].华北农学报,2015,30(5):115-121.LI Lei,MENG Yongjiao,ZHANG Lu,LOU Qunfeng,LI Ji,QIAN Chuntao,CHEN Jinfeng. Study on optimization of Agrobacterium-mediated transformation system of cucumber[J].Acta Agriculturae Boreali-Sinica,2015,30(5):115-121.
[34] 栾非时,白晶,朱子成,高鹏,刘识,吴川,樊超,吕双雪.农杆菌介导薄皮甜瓜遗传转化体系建立[J]. 东北农业大学学报,2019,50(1):11-18.LUAN Feishi,BAI Jing,ZHU Zicheng,GAO Peng,LIU Shi,WU Chuan,FAN Chao,LÜ Shuangxue. Establishment of Agrobacterium mediated genetic transformation system of muskmelon[J].Journal of Northeast Agricultural University,2019,50(1):11-18.
[35] WAN L L,WANG Z R,ZHANG X J,ZENG H X,REN J,ZHANG N,SUN Y H,MI T. Optimised Agrobacterium-mediated transformation and application of developmental regulators improve regeneration efficiency in melons[J]. Genes,2023,14(7):1432.
[36] DU C X,CHAI L A,LIU C,SI Y Y,FAN H F. Improved Agrobacterium tumefaciens-mediated transformation using antibiotics and acetosyringone selection in cucumber[J]. Plant Biotechnology Reports,2022,16(1):17-27.
[37] PARK S M,LEE J S,JEGAL S,JEON B Y,JUNG M,PARK Y S,HAN S L,SHIN Y S,HER N H,LEE J H,LEE M Y,RYU K H,YANG S G,HARN C H.Transgenic watermelon rootstock resistant to CGMMV(cucumber green mottle mosaic virus) infection[J].Plant Cell Reports,2005,24(6):350-356.