叶色变异是植物界一种正常的生命现象。在植物育种工作中,叶色变化既可以作为标记性状,简化选择过程,也可以像花色、果色一样作为观赏元素,培育出多样的彩叶植物[1]。叶色变化受多种遗传与生理机制调控。王建玉等[2]对甜瓜芽黄材料进行遗传分析,发现甜瓜芽黄突变性状可稳定遗传,属于隐性基因控制的细胞核遗传。杨莎等[3]将辣椒野生型材料与叶色黄化突变体材料杂交,并将F1自交,通过观察分离性状计算分离比,发现辣椒叶色黄化性状是由一对核基因控制的隐性性状。王亚玲等[4]对番茄黄绿叶突变体进行了遗传分析,结果表明,黄绿叶性状受隐性单基因控制。叶色变化会影响植物的光合作用,并产生一系列生理生化反应。因此叶色突变体也成为研究植物光合作用、激素代谢等一系列生理过程的重要材料[5]。邵勤[6]在甜瓜中发现了黄化的叶色突变体,对黄化突变体和野生型材料的叶绿素含量进行对比研究,结果表明,突变体的叶色黄化与叶绿素含量有着直接的关系。曹稳[7]对黄瓜的花斑叶突变体进行研究,测定突变体与野生型材料的光合参数和叶绿素含量,发现突变体的光合能力、叶绿素含量都低于野生型。李万青等[8]对黄瓜黄化突变体和普通叶片在幼苗期的光合参数进行测定,结果表明,叶色黄化突变体的净光合速率与胞间CO2浓度均显著低于普通的黄瓜叶片。Ma等[9]在山茶中发现了花斑叶突变体,通过对突变体与野生型材料的叶绿体解剖结构进行观察,发现突变体的叶绿体数量有所减少。
西瓜是重要的园艺作物,研究西瓜叶色变化具有重要意义。任艺慈等[10]在对西瓜黄化突变体进行研究时发现黄化性状伴随整个生育期,植株黄化是由总叶绿素缺乏导致的。徐铭等[11]对西瓜后绿突变体的光合特性进行研究,得出Ⅰ期(第三节位)由于光合色素含量低导致幼叶黄化,Ⅱ期(第九节位)光合色素含量大幅提高,叶色也逐渐由黄转绿。但是对西瓜带有黄色斑点叶片与普通叶片生理特性、解剖结构差异及遗传规律的研究未见报道。
西瓜自交系TNY1201 叶片具有不规则黄色斑点,能正常开花结实,1182 是普通的西瓜自交系。笔者将TNY1201 与1182 的叶片表型、生理特性、解剖结构进行比较,有助于阐明形成黄色斑点的生理机制及其对叶片生理、结构特性造成的影响。笔者以TNY1201 和1182 作为亲本构建六世代群体(P1、P2、F1、F2、BC1P1、BC1P2),分析叶片斑点的遗传倾向,可为后续进行基因定位与克隆提供参考依据,也为利用西瓜叶片斑点标记辅助育种奠定基础。
1 材料和方法
1.1 材料
本试验供试的西瓜材料TNY1201 和1182 由天津市桑田梓地农业科技有限公司提供。TNY1201为黄色斑点叶片西瓜,子叶无斑点,从第一片真叶开始,所有叶片均带有黄色斑点(图1-A);1182为普通西瓜,所有叶片均无斑点(图1-B)。
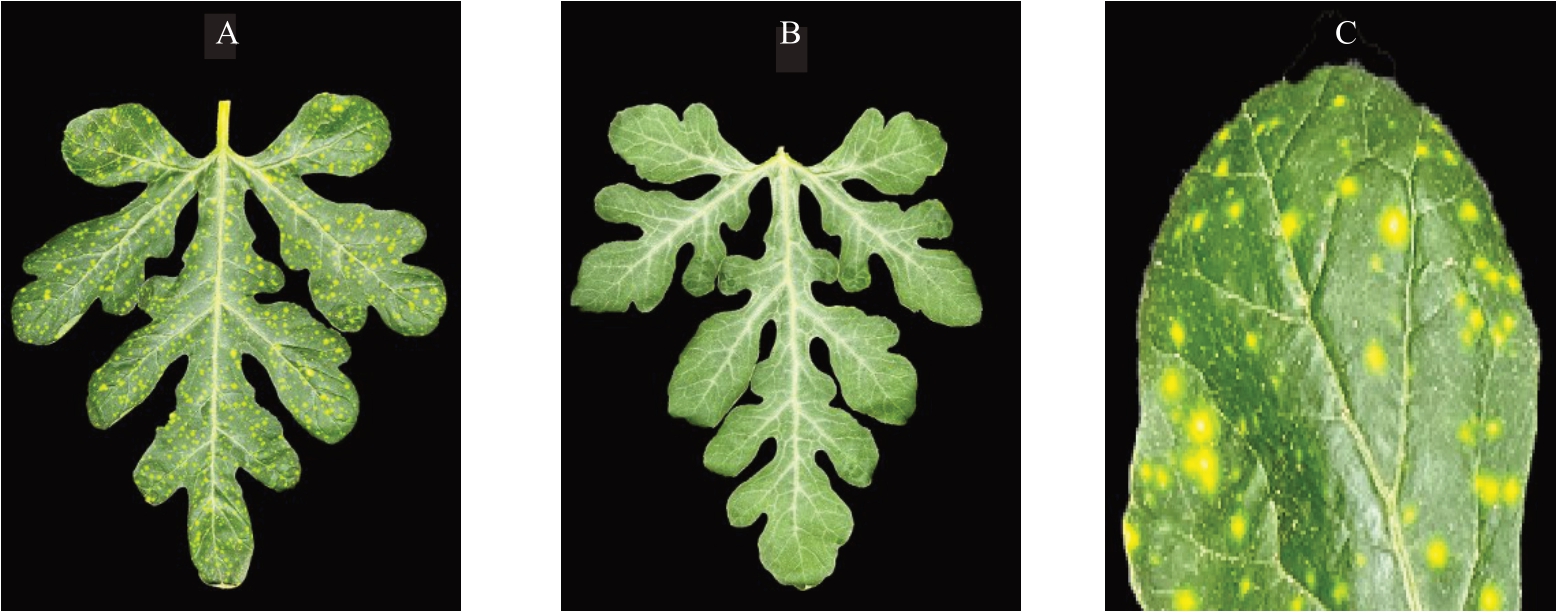
图1 斑点叶片西瓜TNY1201 与普通西瓜1182 的叶片表型比较
Fig.1 Comparison of leaf phenotypes between spotted leaf watermelon TNY1201 and ordinary watermelon 1182
A. 黄色斑点叶;B. 普通叶;C. 斑点部分。A.Spotted leaf;B.Ordinary leaf;C.Spotted part.
1.2 方法
1.2.1 斑点叶片的生理特性测定 2022 年3 月5 日将1182 和TNY1201 两份材料播种育苗,4 月1 日定植于天津农学院西校区玻璃温室,正常管理。定植40 d时,在两个品种的10个不同个体上分别采集健康、阳生且无破损的材料,其中TNY1201 选取黄绿混合部分,将两种取样材料编号密封于封口袋内,带回实验室进行叶片表型、解剖结构、光合色素含量等指标的测定。
利用直尺测定叶长、叶宽等叶片表型。利用指甲油印迹法[12]和测微尺测定气孔密度、气孔大小。利用石蜡切片法[13]和测微尺测定上表皮厚度、下表皮厚度、栅栏组织厚度、海绵组织厚度。栅海比=栅栏组织厚度/海绵组织厚度。组织疏密度=海绵组织厚度/叶片厚度。采用95%乙醇提取法测定光合色素含量[14]。采用蒽酮比色法测定可溶性糖含量[15],采用考马斯亮蓝G-250染色法测定可溶性蛋白含量[15]。在盛花期,选择晴朗无风的天气,在上午10:00使用GFS-3000光合仪测定叶片的光合参数。
1.2.2 斑点叶片的斑点遗传分析 2022年将1182、TNY1201 进行正反交,得到正反交的F1 代种子。2023 年3 月将两个亲本与正反交F1播种,进行人工授粉得到BC1P1、BC1P2和F2种子。2023 年7 月将六世代群体播种,调查群体苗期(三叶一心)的无斑叶片和有斑叶片的单株数量,对所得数据进行卡方检验,确定遗传倾向。
1.3 数据分析
采用SPSS26.0 软件进行试验数据处理及差异显著性分析,应用ImageJ软件进行试验图片处理。
2 结果与分析
2.1 斑点叶片西瓜与普通西瓜叶片表型比较
从表1可以看出,两种材料的叶长无显著差异,TNY1201 叶片宽度、叶片面积和叶片厚度分别为20.88 cm、247.08 cm2和176.12 μm,均显著高于1182。
表1 斑点叶片西瓜TNY1201 与普通西瓜1182 的叶片性状比较
Table1 Comparison of leaf traits between spotted leaf watermelon TNY1201 and ordinary watermelon 1182
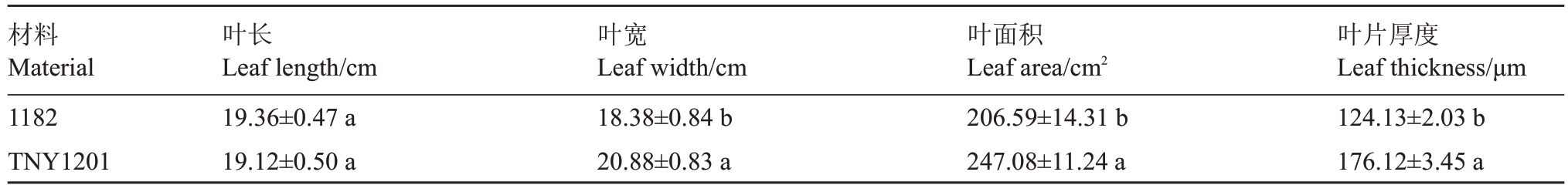
注:同列数据后不同小写字母表示在0.05 水平差异显著。下同。
Note:After the same column of data,different lowercase letters indicate significant difference at 0.05 level.The same below.
?
2.2 斑点叶片西瓜与普通西瓜叶片结构比较
由表2 可知,TNY1201 的叶片单个气孔面积平均为467.97 μm2,显著大于1182。1182 叶片气孔密度为137.36 个·mm-2,显著大于TNY1201。综上所述,1182 的叶片气孔单个面积小但密度大,而TNY1201 的叶片则相反,单个气孔面积大但密度小。
表2 斑点叶片西瓜TNY1201 与普通西瓜1182 叶片气孔参数的比较
Table 2 Comparison of leaf stomatal parameters between spotted leaf watermelon TNY1201 and ordinary watermelon 1182

?
从图2可以看出,西瓜的叶片为典型的异面叶,叶片由上下表皮细胞、栅栏组织和海绵组织构成,海绵组织由3~5层排列疏松的细胞组成。TNY1201叶片与普通叶片的解剖结构存在很大差别。1182 的叶片组织结构清晰,上下表皮细胞完整,有明显的栅栏组织和海绵组织,栅栏组织排列紧密。TNY1201斑点叶的叶片上下表皮细胞形状不规则,栅栏组织和海绵组织排列松散。

图2 斑点叶片西瓜TNY1201 与普通西瓜1182 的叶片解剖结构
Fig.2 Anatomical structure of the leaves of spotted leaf watermelon TNY1201 and ordinary watermelon 1182
Ue. 上表皮;Pt.栅栏组织;St. 海绵组织;Le. 下表皮。
Ue.Upper epidermis;Pt.Palisade tissue;St.Sponge tissue;Le.Lower epidermis.
由表3可以看出,TNY1201叶片和1182的叶片解剖结构参数之间存在显著差异。TNY1201 的上下表皮厚度显著大于1182,分别为1182的1.33倍和1.39 倍,栅栏组织厚度和海绵组织厚度也都显著大于1182,分别为66.24 μm 和69.54 μm。1182 叶肉组织紧密度和栅海比显著大于TNY1201。TNY1201的叶肉组织疏密度为0.40%,显著大于1182。
表3 斑点叶片西瓜TNY1201 与普通西瓜1182 叶片解剖结构参数的比较
Table 3 Comparison of leaf anatomical structural parameters between spotted leaf watermelon TNY1201 and ordinary watermelon 1182

注:UET. 上表皮厚度;LET. 下表皮厚度;PT. 栅栏组织厚度;ST. 海绵组织厚度;LT. 叶片厚度。
Note:UET.Upper skin thickness;LET.Lower skin thickness;PT.Palisade tissue thickness;ST.Sponge tissue thickness;LT.Leaf thickness.
?
2.3 斑点叶片西瓜与普通西瓜叶片光合生理参数比较
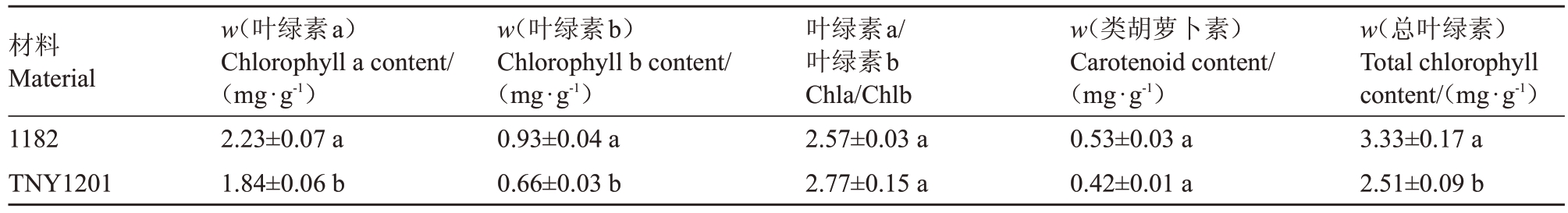
从表4 可以看出,TNY1201 叶片的叶绿素a、叶绿素b 和总叶绿素的含量都显著低于1182 叶片。1182 的叶绿素a、叶绿素b 和总叶绿素含量分别是TNY1201的1.21倍、1.39倍和1.33倍。TNY1201叶片类胡萝卜素含量和叶绿素a/b值与1182叶片无显著差异。
表4 斑点叶片西瓜TNY1201 与普通西瓜1182 光合色素含量的比较
Table 4 Comparison of photosynthetic pigment content between spotted leaf watermelon TNY1201 and ordinary watermelon 1182
?
从表5 可以看出,1182 叶片的净光合速率为7.90 μmol·m-2·s-1,显著高于TNY1201,是TNY1201叶片净光合速率的1.13 倍。TNY1201 叶片的气孔导度、胞间CO2浓度都显著高于1182,蒸腾速率之间无显著差异。
表5 斑点叶片西瓜TNY1201 与普通西瓜1182 叶片光合参数的比较
Table 5 Comparison of leaf photosynthetic parameters between spotted leaf watermelon TNY1201 and ordinary watermelon 1182

?
从表6 可以看出,1182 叶片可溶性总糖含量显著高于TNY1201,是TNY1201的1.75倍。TNY1201叶片可溶性蛋白含量为22.70 μg·g-1,显著高于1182。
表6 斑点叶片西瓜TNY1201 与普通西瓜1182 叶片可溶性总糖和可溶性蛋白含量的比较
Table 6 Comparison of total soluble sugar and soluble protein content in leaves of spotted leaf watermelon TNY1201 and ordinary watermelon 1182

?
2.4 西瓜叶片斑点的遗传倾向分析
从表7 可以看出,亲本1182 叶片全部无斑,亲本TNY1201、正反交F1都有黄色斑点,表明叶片斑点为细胞核遗传。BC1P2植株叶片也全都有黄色斑点。F2群体共188 株,其中146 株叶片有斑,42 株叶片无斑。BC1P1群体共142 株,其中74 株叶片有斑,68株叶片无斑。F2植株叶片有斑、无斑的比例符合3∶1 的分离比,BC1P1植株叶片有斑、无斑的比例符合1∶1 的分离比。以上结果表明TNY1201 叶片的斑点性状受一对显性核基因控制。
表7 六世代群体表型及F2和BC1P1群体分离比适合性检验
Table 7 Phenotype of spotted to non-spotted trait in six-generation family and chi-square goodness-fit ratios of segregation in F2 and BC1P1 populations
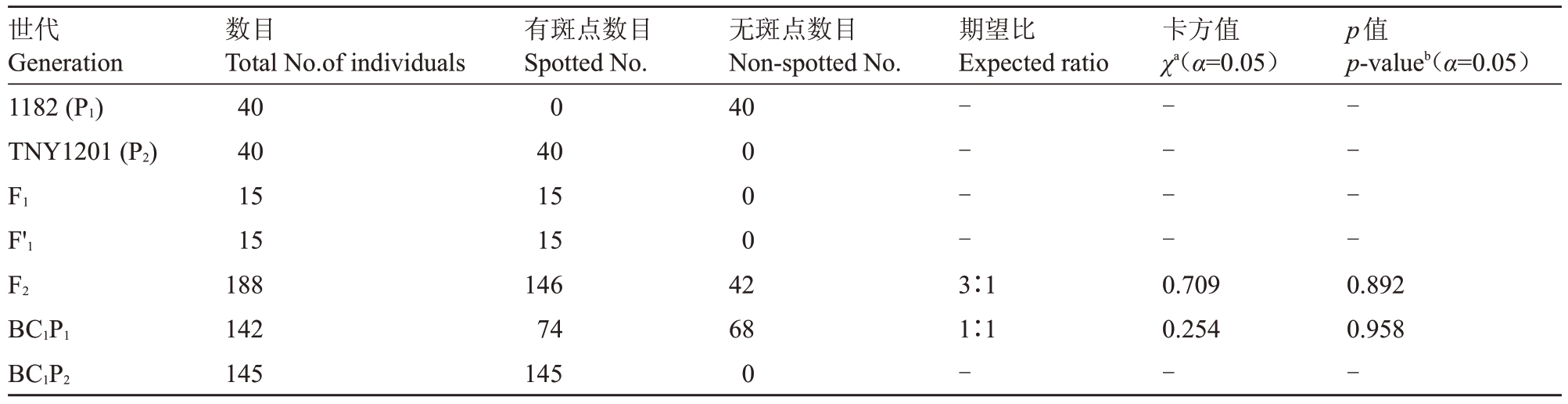
注:a.χ2>χ20.05=3.814 表明差异显著;b.p<0.05 表明差异显著。
Note:a.χ2>χ20.05=3.814 is considered significant;b.p<0.05 is considered significant.
?
3 讨 论
叶片是植物与外界进行气体交换和光合作用的重要器官,叶片的结构形态直接影响植物的光合作用、蒸腾作用等[16]。TNY1201 的栅栏组织排列松散,叶肉组织紧密度显著低于1182,而叶绿体大部分位于栅栏组织中[17],推断TNY1201的叶绿体含量低于1182,这与叶绿素含量的测定结果相符合。本试验中TNY1201的叶绿素含量显著低于1182,叶色改变是光合色素含量变化的外在表现[5]。由此可以推断叶片在进行光合作用时,在缺少叶绿素的情况下,叶绿素a和叶绿素b间的转换受到阻碍。综上所述,可能是叶绿素的合成陷入停滞状态,致使叶绿素含量降低,从而使叶片出现黄色斑点[1]。崔丽朋等[18]在研究番茄叶色黄化突变体时,测定了两种材料的叶绿素含量,结果表明叶色黄化突变体的叶绿素含量显著低于野生型,与本试验研究结果相似。
气孔是叶片进行光合作用所需的CO2进入植物体内的主要通道,因此气孔的密度以及面积是植物正常生长的基础[19]。张艳萍等[17]对观赏桃叶片的气孔参数与光合速率进行测定,发现气孔小而密集的叶片光合速率较高。本试验中,TNY1201气孔面积大密度小,可能导致其叶片光合速率低于普通西瓜,这与叶片净光合速率测定的结果相符合。光合色素含量直接或间接地影响植物的光合能力,具体表现在净光合速率、蒸腾速率、胞间CO2浓度等指标发生变化方面[19]。胡亮亮等[20]在对黄瓜叶色突变体进行研究时发现,突变体的净光合速率显著低于野生型,胞间CO2浓度显著高于野生型,推测突变体光合能力较低并非仅受气孔大小和密度的影响,而且也受CO2的利用率较低影响。本试验中TNY1201的净光合速率显著低于1182,胞间CO2浓度和气孔导度显著高于1182,蒸腾速率之间差异不显著,与上述推论相符合。
可溶性糖是主要的能量代谢中间产能物,在一定程度上可以反映植物体内能量代谢的快慢[5]。可溶性蛋白是重要的渗透调节物质和营养物质,其大多数是参与各种代谢的酶类[5]。当叶片中叶绿素缺失时,会导致可溶性糖和可溶性蛋白含量产生变化。在本试验中,TNY1201叶片的可溶性糖含量显著低于1182,是1182 的56.82%,可溶性蛋白含量显著高于1182,是1182的1.22倍。推断叶片的可溶性糖含量较低,是由光合能力下降导致的,而可溶性蛋白含量较高,可能是由大量的特异性蛋白表达所导致的,与陈星旭[21]对花烛叶色黄化突变体的研究结果类似。
西瓜叶色遗传规律有不同的报道。Poole[22]对斑点叶西瓜‘Sun,Moon and Stars’的遗传规律进行研究,基于回交和F2群体的观察数据(原文中未详细列出),认为斑点叶是由一种细胞质基因控制的叶绿体缺陷造成的。本试验对两份材料进行正反交、回交并建立F2群体,对性状结果的分离比进行卡方检测,分离比均符合孟德尔遗传定律,显示TNY1201叶片斑点由核基因控制。两种结果不同,可能是试验材料不同造成的。Kidanemariam[23]对西瓜后绿突变体的遗传规律进行研究,通过自交、回交试验,推测该突变体受隐性基因控制。本试验初步推断影响叶片黄色斑点形成的是细胞核基因,但要阐明其机制,仍需要进一步深入研究。
4 结 论
斑点叶片西瓜TNY1201 与1182 相比,叶片上下表皮细胞形状不规则,栅栏组织和海绵组织排列松散,叶片紧密度较小,具有面积大而密度小的气孔。TNY1201 叶片的叶绿素含量、净光合速率、可溶性糖含量均显著低于1182,可溶性蛋白含量显著高于1182。遗传特性分析表明,TNY1201叶片斑点属于细胞核遗传,叶片有斑对无斑为显性。
综上所述,笔者在本文中研究的TNY1201是一种重要的资源材料,可以作为西瓜常规育种中选择的表型标记,也可以作为观赏西瓜品种选育的种质资源。研究结论为西瓜叶片光合生理研究及斑点性状在育种实践中的应用提供了理论依据,丰富了葫芦科植物叶色突变机制的理论基础。
[1] 李音音.叶色黄化突变体甜瓜生物学特性研究[D].哈尔滨:东北农业大学,2014.LI Yinyin. Study on biological characters of xantha mutant in melon[D].Harbin:Northeast Agricultural University,2014.
[2] 王建玉,王志鹏,段祥坤.甜瓜芽黄标记性状的发现与遗传分析[J].中国瓜菜,2019,32(2):15-17.WANG Jianyu,WANG Zhipeng,DUAN Xiangkun. Discovery and genetic analysis of yellow markers in melon buds[J]. China Cucurbits and Vegetables,2019,32(2):15-17.
[3] 杨莎,张竹青,陈文超,刘周斌,周书栋,邹学校,马艳青.辣椒叶色黄化突变体的遗传及生理特性[J].湖南农业大学学报(自然科学版),2020,46(1):48-52.YANG Sha,ZHANG Zhuqing,CHEN Wenchao,LIU Zhoubin,ZHOU Shudong,ZOU Xuexiao,MA Yanqing. Genetic analysis and physiological characteristics of yellow leaf mutant in pepper[J]. Journal of Hunan Agricultural University (Natural Sciences),2020,46(1):48-52.
[4] 王亚玲,李小寒,宫方林,梁佳佳,李金华.一个新的番茄黄绿叶突变体表型鉴定与遗传分析[J].植物遗传资源学报,2019,20(1):215-220.WANG Yaling,LI Xiaohan,GONG Fanglin,LIANG Jiajia,LI Jinhua. Phenotypic identification and genetic analysis of a novel tomato yellow green leaf mutant[J].Journal of Plant Genetic Resources,2019,20(1):215-220.
[5] 李燕.黄瓜叶色突变体的生理生化及遗传特性研究[D].雅安:四川农业大学,2016.LI Yan. Physiological characteristics and genetic analysis of leaf color mutant in cucumber[D].Ya’an:Sichuan Agricultural University,2016.
[6] 邵勤.一个新的甜瓜叶色黄化突变体研究[D].哈尔滨:东北农业大学,2013.SHAO Qin. Characterization and proteomics of a novel xantha mutant in muskmelon[D]. Harbin:Northeast Agricultural University,2013.
[7] 曹稳.黄瓜花斑叶突变体及候选基因鉴定[D].哈尔滨:东北农业大学,2019.CAO Wen. Identification of variegated leaf mutant and candidate gene in cucumber (Cucumis sativus L.)[D]. Harbin:Northeast Agricultural University,2019.
[8] 李万青,高波,杨俊,陈鹏,李玉红.一个新的黄瓜叶色黄化突变体的生理特性分析[J].西北农业学报,2015,24(7):98-103.LI Wanqing,GAO Bo,YANG Jun,CHEN Peng,LI Yuhong.Physiological characteristic analysis of a new leaf color yellow mutant in cucumber[J]. Acta Agriculturae Boreali-Occidentalis Sinica,2015,24(7):98-103.
[9] MA C Y,CAO J X,LI J K,ZHOU B,TANG J C,MIAO A Q.Phenotypic,histological and proteomic analyses reveal multiple differences associated with chloroplast development in yellow and variegated variants from Camellia sinensis[J].Scientific Reports,2016,6:33369.
[10] 任艺慈,朱迎春,孙德玺,邓云,安国林,李卫华,刘君璞.一个西瓜叶色黄化突变体的生理特性分析[J].果树学报,2020,37(4):565-573.REN Yici,ZHU Yingchun,SUN Dexi,DENG Yun,AN Guolin,LI Weihua,LIU Junpu. Physiological characteristic analysis of a leaf-yellowing mutant in watermelon[J]. Journal of Fruit Science,2020,37(4):565-573.
[11] 徐铭,高美玲,郭宇,包秀萍,刘秀杰,刘继秀,高越.西瓜后绿突变体光合特性分析[J].西北农林科技大学学报(自然科学版),2022,50(3):91-96.XU Ming,GAO Meiling,GUO Yu,BAO Xiuping,LIU Xiujie,LIU Jixiu,GAO Yue. Photosynthetic characteristics of virescent mutant in watermelon[J].Journal of Northwest A&F University(Natural Science Edition),2022,50(3):91-96.
[12] 张亚,杨石建,孙梅,曹坤芳.基部被子植物气孔性状与叶脉密度的关联进化[J].植物科学学报,2014,32(4):320-328.ZHANG Ya,YANG Shijian,SUN Mei,CAO Kunfang.Stomatal traits are evolutionarily associated with vein density in basal angiosperms[J].Plant Science Journal,2014,32(4):320-328.
[13] 李琪,贺晓,贺一鸣,吴敏,孟刚,郭刚.豆科3 属6 种植物叶片特征比较研究[J]. 干旱区资源与环境,2017,31(11):148-153.LI Qi,HE Xiao,HE Yiming,WU Min,MENG Gang,GUO Gang.Comparative study of leaf characters in 6 species of Leguminosae[J]. Journal of Arid Land Resources and Environment,2017,31(11):148-153.
[14] 闫晓丽,王书柔,丁新宇,刘兴菊,梁海永.异源三倍体榆树叶片形态及光合特性[J].林业科技,2023,48(4):1-5.YAN Xiaoli,WANG Shurou,DING Xinyu,LIU Xingju,LIANG Haiyong. Leaf morphology and photosynthetic characteristics of allotriploid elm[J].Forestry Science&Technology,2023,48(4):1-5.
[15] 刘萍,李明军.植物生理学实验[M].2 版.北京:科学出版社,2016:80.LIU Ping,LI Mingjun. Plant physiology experiments[M]. 2nd ed.Beijing:Science Press,2016:80.
[16] 徐艳芳,贺雅萍,王梦瑶,张琪,周杰,兰琳英,艾叶.16 个建兰品种叶片解剖结构研究[J].热带作物学报,2022,43(10):2099-2105.XU Yanfang,HE Yaping,WANG Mengyao,ZHANG Qi,ZHOU Jie,LAN Linying,AI Ye. Leaf anatomical structure of 16 Cymbidium ensifolium varieties[J]. Chinese Journal of Tropical Crops,2022,43(10):2099-2105.
[17] 张艳萍,刘卫东,龙达,张雕,曾广辉.5 种观赏桃F1代叶片解剖结构与光合性能研究[J].南方林业科学,2021,49(1):1-5.ZHANG Yanping,LIU Weidong,LONG Da,ZHANG Diao,ZENG Guanghui. Study on leaf anatomical structure and photosynthetic performance of five ornamental peach F1 generations[J].South China Forestry Science,2021,49(1):1-5.
[18] 崔丽朋,宋丽华,黄泽军,高建昌,国艳梅,杜永臣,王孝宣.番茄黄化基因Netted Viresce(NV)的遗传定位及生理特性研究[J].中国蔬菜,2017(7):29-36.CUI Lipeng,SONG Lihua,HUANG Zejun,GAO Jianchang,GUO Yanmei,DU Yongchen,WANG Xiaoxuan. Physiological characteristics and genetic mapping of tomato yellow leaf gene netted viresce(NV)[J].China Vegetables,2017(7):29-36.
[19] 薛黎.遮阴对5 种珍贵树种幼苗光合及叶片解剖特性的影响[D].长沙:中南林业科技大学,2020.XUE Li.Photosynthetic characteristics and leaf anatomical structure of five precious tree species under shading condition[D].Changsha:Central South University of Forestry & Technology,2020.
[20] 胡亮亮,赵子瑶,张海强,陈菲帆,张朝文,戎福喜,陈鹏,李玉红.一个新的黄瓜叶色突变体的光合特性分析[J].西北农业学报,2018,27(11):1622-1628.HU Liangliang,ZHAO Ziyao,ZHANG Haiqiang,CHEN Feifan,ZHANG Chaowen,RONG Fuxi,CHEN Peng,LI Yuhong.Photosyntheic characteristics analysis of a new leaf color mutant in cucumber[J]. Acta Agriculturae Boreali-occidentalis Sinica,2018,27(11):1622-1628.
[21] 陈星旭. 花烛叶色嵌合体及突变体叶色形成机理及保持特征[D].南京:南京农业大学,2009.CHEN Xingxu. Formative mechanism and maintenance characteristics of leaf color chimera and mutants of Anthurium andreaeanum‘Sonate’[D].Nanjing:Nanjing Agricultural University,2009.
[22] POOLE C F. Genetics of cultivated cucurbits[J]. Journal of Heredity,1944,35(4):122-128.
[23] KIDANEMARIAM G H.西瓜叶色后绿和植株短蔓性状的遗传与分子机制研究[D].北京:中国农业科学院,2020.KIDANEMARIAM G H. Genetic and molecular mechanisms of delayed green leaf color and short internode length in watermelon(Citrullus lanatus)[D].Beijing:Chinese Academy of Agricultural Sciences,2020.