我国盐渍土面积大、分布广、类型多,在江苏、山东、河北、辽宁等省的盐渍土面积就超过1.00×106 hm2,并有逐年增加的趋势[1]。盐胁迫是影响植物生长和发育的重要环境因子之一[2]。若植株内过量的盐离子积聚,则会产生离子拮抗效应,抑制并损害正常的新陈代谢功能,从而造成植株严重畸形甚至死亡[3]。植物受到盐胁迫时会产生一系列生理生化代谢物变化,包括细胞抗氧化酶、渗透调节物质和膜质过氧化产物的变化[4]。有研究表明,盐胁迫下植物根系首先感知并发出信号,同时改变其形态结构、生理化学性质、解剖结构,进而抑制植物生长,导致植株死亡[5-6]。植物自身的形态结构变化比较复杂,但植物的结构是基础,只有明确植物结构在盐胁迫下的变化,才能更好地认识植物耐盐机制[7]。因此,笔者在本研究中的重点是探究盐胁迫下幼苗内部结构的改变,从显微结构和生理生化的层面解释东部黑核桃幼苗的耐盐机制。
东部黑核桃(Juglans nigra)属于胡桃科(Juglandaceae)、核桃属(Juglans),原产地是美国[8]。东部黑核桃属优良种源家系,生长势旺盛,抗逆性强,适应范围广,20 世纪80 至90 年代引入我国,主要作为果材兼用、园林绿化和核桃嫁接砧木树种,在辽宁、河北、北京、河南、山东、山西、陕西、甘肃和新疆均有栽培,也是国家战略储备林的首选经济林树种之一。选择弱盐碱地种植核桃,可以扩大其种植面积,获得更多的经济效益。因此,研究核桃在盐胁迫条件下的生长和生理反应,明确核桃的耐盐生理机制,对盐碱地区发展核桃产业具有非常重要的现实意义。
1 材料和方法
1.1 试验材料
2021 年10 月采集河南省洛宁县中国林业科学研究院核桃种质资源库(34°21′ N,111°28′ E,海拔581 m)20 年生东部黑核桃优良种源家系的实生种子作为试验材料。在中国林业科学研究院的温室(40°000′ N,116°140′ E,海拔61 m)进行试验,温室平均温度24.47 ℃,白天温度不高于30.00 ℃,夜间不低于14.00 ℃,透光度为50%~60%。2022 年4 月25 日,将沙藏3 个月的种子播于规格为250 mm ×180 mm 的塑料花盆中,每盆1粒。花盆配置的托盘可有效收集其渗出液并及时回浇至盆中,以避免土壤盐分的流失。幼苗生长期间,对其进行正常管理。
1.2 盐处理
2022 年7 月24 日,幼苗平均株高26.2 cm,平均地径7.5 mm,选取长势一致的60 株幼苗进行NaCl处理,设置浓度分别为:0、50、100、200 mmol·L-1,每个梯度设置3组重复,每个重复5株。为防止盐溶液对苗木的冲击效应,各梯度的NaCl 溶液分3 次加入,每次300 mL,共计900 mL,在7 d 内结束。所用盐溶液为相应质量的NaCl 溶于1/2 Hoagland 营养液。试验期间,每隔7 d用不加NaCl的1/2 Hoagland营养液浇灌1 次,以保证营养供应。NaCl 处理结束后的14、28、42 d,在09:00—10:00,采集植株的功能叶、茎和地下一级侧根,进行相关生理生化和营养器官解剖结构指标的测定。
1.3 指标测定及方法
1.3.1 生理指标的测定 叶片相对含水量(relative water content,RWC)采用滕元旭等[9]的方法测定;丙二醛(malonaldehyde,MDA)含量采用硫代巴比妥酸法[10]测定;脯氨酸(proline,Pro)含量采用试剂盒-微量法测定;可溶性蛋白(soluble protein,SP)含量采用考马斯亮蓝法[11]测定;可溶性糖(soluble sugar,SS)含量采用硫代巴比妥酸法[12]测定;超氧化物歧化酶(superoxide dismutase,SOD)活性采用氮蓝四唑(nitroblue tetrazolium,NBT)光化学还原法[13]测定;抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性采用紫外吸收法[14]测定;总多酚含量采用Folin酚法[15]测定;总黄酮含量采用亚硝酸钠-硝酸铝比色法[16]测定。
1.3.2 解剖结构观测 叶片解剖结构观测:盐处理14、28、42 d,摘取幼苗中上部东南西北四个方向、顶端往下第1~3 复叶的第2~5 枚小叶,从叶片中部主脉两侧剪取2 mm×2 mm 的方块,置于FAA(70%乙醇90 mL+甲醛5 mL+乙酸5 mL)中固定,于4 ℃冰箱中保存。材料经FAA 固定24 h 以上,乙醇和二甲苯系列脱水透明,浸蜡,包埋,切片(切片厚度为8 μm),甲苯胺蓝O(TBO)染色,在光学显微镜下观察照相[17]。每个处理观测15个视野,测定叶片叶表皮、叶肉、叶脉等结构参数,结果取平均值,并计算以下指标[18]。
栅海比=栅栏组织厚度/海绵组织厚度。
叶片组织结构紧密度(CTR)/%=栅栏组织厚度/叶片厚度×100。
叶片组织结构疏松度(SR)/%=海绵组织厚度/叶片厚度×100。
茎、根解剖结构观测:盐处理14、28、42 d,摘取幼苗茎尖约2 cm 的茎段和距主根3 cm 处的一级侧根,采用改良后的石蜡切片法[19]进行切片制作,将材料放入改进后的固定液(70%叔丁醇85 mL+35%~40%甲醛5 mL+丙酸5 mL+丙三醇5 mL)中,4 ℃下保存48 h以上,通过软化、脱水、透明一系列步骤后进行切片,切片厚度为10 μm,甲苯胺蓝O(TBO)染色,在光学显微镜下观察照相。每个处理观测15个视野,测定韧皮部、木质部、皮层等结构参数,结果取平均值。叶片、茎、根的解剖结构指标中、英文名称、英文缩写及测量放大倍数如下:栅栏组织厚度(palisade tissue thickness,PT,10×10);海绵组织厚度(spongy tissue thickness,ST,10×10);上表皮细胞厚度(thickness of upper epidermis,UE,10×10);下表皮细胞厚度(thickness of lower epidermis,LE,10×10);叶片厚度(leaf lamina thickness,TL,10×10);叶片组织结构紧密度(cell tightness ratio,CTR%,10×10);叶片组织结构疏松度(cell porosity ratio,SR%,10×10);栅海比(ratio of palisade tissue and spongy tissue,PT/ST,10×10);主脉厚度(main vein thickness,MVT,10×4);主脉凸起度(midrib protuberant degree,MPD,10×4);主脉维管束厚度(thickness of vascular bundle,VBT,10×4);茎木质部厚度(steam xylem thickness,SXT,10×10);茎韧皮部厚度(steam phloem thickness,SPhT,10×10);茎皮层厚度(steam cortical thickness,SCT,10×10);茎周皮厚度(steam pericarp thickness,SPT,10×10);根直径(root diameter,RD,10×4);根维管束直径(root diameter of vascular bundle,RVBT,10×4);根皮层厚度(root cortical thickness,RCT,10×20);根皮厚度(root pericarp thickness,RPT,10×20)。
1.4 数据分析
原始数据采用微软Excel 2021 进行分析,并导入SPSS 26.0 软件进行单因素ANOVA 和Duncan 多重比较。所有统计效应在p<0.05 时均被认为是显著性效应,结果以平均值±标准差表示,由Origin 2022分析并绘制了相关系数图与主成分变化图。
2 结果与分析
2.1 盐胁迫对东部黑核桃叶片相对含水量(RWC)和丙二醛(MDA)含量的影响
2.1.1 相对含水量(RWC)由图1-A 可知,随着盐浓度的增加和胁迫时间的延长,RWC 呈下降趋势。在胁迫14、28 d时,50、100 mmol·L-1处理的RWC没有差异,都显著低于对照,在200 mmol·L-1处理达到85.70%、72.31%,较对照降低8.33%、19.30%,均显著低于对照、50和100 mmol·L-1处理的RWC。在胁迫42 d 时,50 mmol·L-1 处理与对照没有差异,100、200 mmol·L-1处理之间没有差异,都显著低于对照,在200 mmol·L-1处理达到最小值56.15%,较对照降低了33.91%。

图1 盐处理对东部黑核桃幼苗叶片相对含水量(RWC)和丙二醛(MDA)含量的影响
Fig.1 The effect of salt treatment on relative water content and Malondialdehyde in the leaves of J.nigra L.seedlings
不同小写字母表示同一时间不同处理之间差异显著(p<0.05)。下同。
Different small letters indicate significant difference between different treatments(p<0.05).The same below.
2.1.2 丙二醛(MDA)由图1-B表明,在胁迫第14天,随着盐浓度的增加,MDA 含量显著增加,在200 mmol·L-1 处理达到最大值0.014 μmol·g-1。胁迫第28 天,100、200 mmol·L-1处理的MDA 含量与50 mmol·L-1相比下降,50 mmol·L-1处理显著高于对照。胁迫第42 天,MDA 含量随着盐浓度的增加呈先增加后降低的趋势,盐处理之间没有差异,但都显著高于对照。
2.2 盐胁迫对东部黑核桃叶片渗透调节物质含量的影响
2.2.1 脯氨酸(Pro)图2-A表明,随着盐浓度的增加,盐胁迫第14 天的Pro 含量呈先降低后增加的趋势,胁迫28 d 和42 d 的Pro 含量呈上升趋势。在胁迫14 d时,50 mmol·L-1达到最小值186.51 μg·g-1,较对照显著降低了6.97%,与100 mmol·L-1处理没有差异,在200 mmol·L-1处理下的Pro 含量又显著升高。在胁迫28 d,50 mmol·L-1与对照没有差异,但100与200 mmol·L-1处理之间有显著差异,都显著高于对照。在胁迫42 d时,50、100 mmol·L-1处理之间没有差异,都显著高于对照组,在200 mmol·L-1处理达到最大值507.70 μg·g-1,是对照的2.12倍。
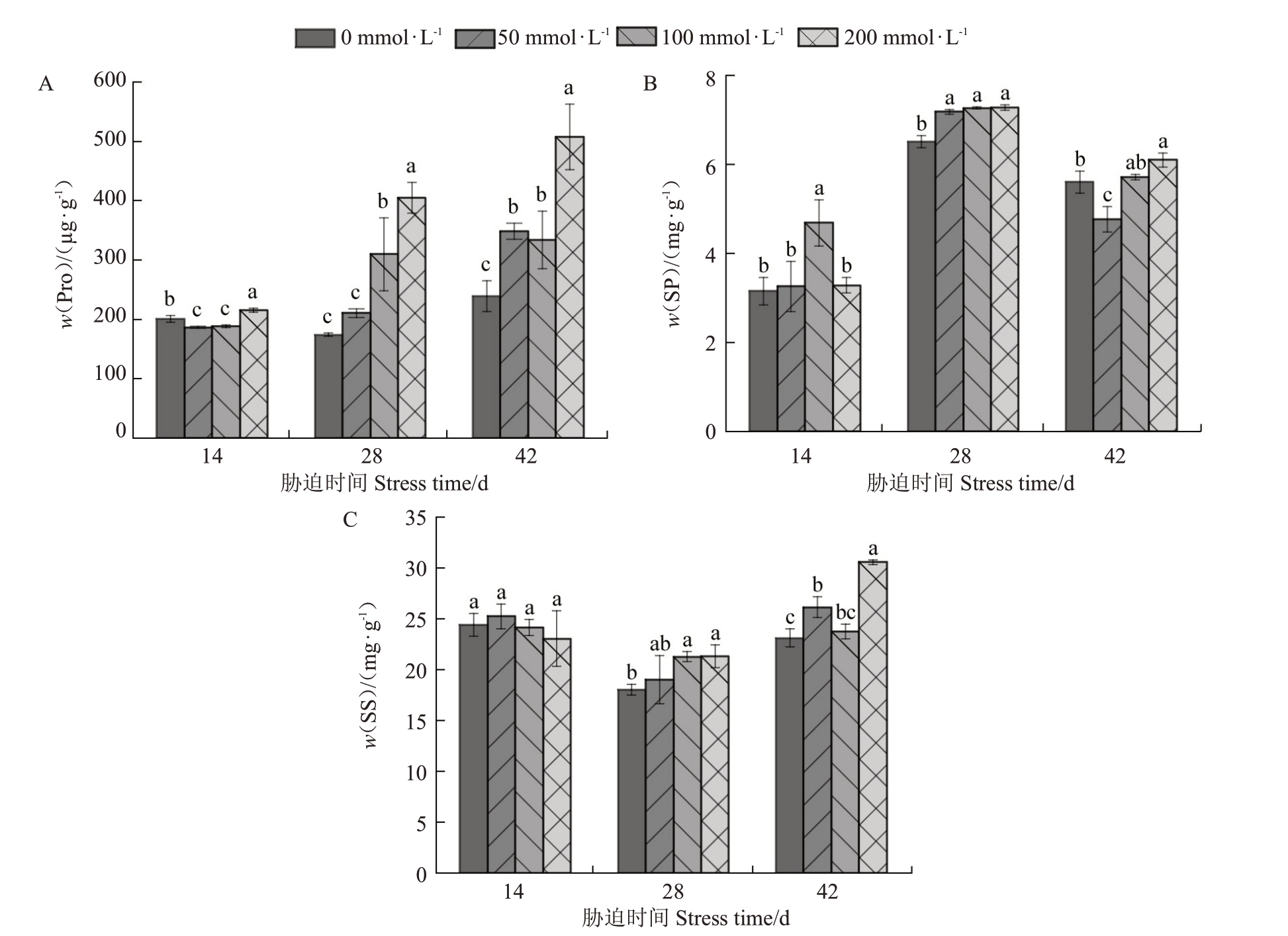
图2 盐处理对东部黑核桃幼苗叶片脯氨酸(Pro)、可溶性蛋白(SP)和可溶性糖(SS)含量的影响
Fig.2 The effect of salt treatment on the content of proline,soluble protein and soluble sugar in the leaves of J.nigra L.seedlings
2.2.2 可溶性蛋白(SP)图2-B 可以看出,在胁迫14 d,SP 含量随着盐浓度的增加呈先增加后降低的趋势,100 mmol·L-1处理显著高于对照,是对照的1.48 倍,其他盐处理与对照没有差异。在胁迫28 d 时,盐处理下的SP 含量显著高于对照,但处理之间没有差异,在200 mmol·L-1处理下达到最大值7.28 mg·g-1。在胁迫42 d 时,SP 含量随着盐浓度的增加呈先降低后升高的趋势,50 mmol·L-1处理下的SP 含量显著低于对照,较对照降低了14.86%,100 mmol·L-1处理与对照、200 mmol·L-1处理之间没有差异,200 mmol·L-1处理显著高于对照,较对照增加了8.79%。
2.2.3 可溶性糖(SS)由图2-C 可知,在胁迫14 d时,SS 含量变化并不显著,各处理之间没有差异。在胁迫28 d时,SS含量随着盐浓度的增加呈增加趋势,各盐处理之间没有差异,但100、200 mmol·L-1处理下地SS 含量显著高于对照。在盐胁迫42 d时,50 mmol·L-1处理下的SS含量显著高于对照,与100 mmol·L-1处理没有差异,在200 mmol·L-1下达到最大值30.56 mg·g-1,是对照的1.32倍。
2.3 盐胁迫对东部黑核桃叶片抗活性氧物质含量的影响
2.3.1 超氧化物歧化酶(SOD)图3-A 表明,SOD活性随盐浓度的增加呈先增加后降低的趋势。胁迫第14天,50、200 mmol·L-1处理之间没有差异,都显著高于对照,100 mmol·L-1处理显著高于其他处理,达到166.35 U·g-1。胁迫第28 天,盐处理之间没有差异,显著高于对照,在50 mmol·L-1处理下SOD 活性达到最大值177.69 U·g-1,是对照的2.24倍。胁迫第42天,在50 mmol·L-1处理下达到218.50 U·g-1,是对照的3.34倍,100与200 mmol·L-1处理之间没有差异。

图3 盐处理对东部黑核桃幼苗叶片超氧化物歧化酶(SOD)活性、抗坏血酸过氧化物酶(APX)活性、总酚(TFC)含量、总黄酮(TPC)含量的影响
Fig.3 The effect of salt treatment on SOD activity,APX activity,the content of total polyphenol content and total flavonoids content in the leaves of J.nigra L.seedlings
2.3.2 抗坏血酸过氧化物酶(APX)由图3-B 可知,盐处理下的APX活性显著高于对照,其中胁迫第14天在100 mmol·L-1处理下达到最大值1.37 U·g-1,50、200 mmol·L-1处理之间没有差异。胁迫第28 天在50 mmol·L-1处理下达到最大值4.32 U·g-1,是对照的3.14倍,100、200 mmol·L-1处理之间没有差异,但50 mmol·L-1处理显著高于100 mmol·L-1处理。胁迫第42 天在100 mmol·L-1 处理下达到最大值5.20 U·g-1,是对照的5.14倍,盐处理之间没有差异。
2.3.3 总多酚(TFC)图3-C表明,胁迫第14天,TFC含量随着盐浓度的增加呈先降低后增加的趋势,50、100 mmol·L-1 处理显著低于对照,在50 mmol·L-1处理下达到最小值12.17 mg·g-1,较对照降低了31.20%,200 mmol·L-1处理与对照没有差异。胁迫28、42 d,总多酚含量随着盐浓度的增加呈先增加后降低的趋势,分别在50、100 mmol·L-1下达到最大值38.17、47.09 mg·g-1,是对照的3.09倍、3.33倍。
2.3.4 总黄酮(TPC)由图3-D 可以看出,TPC 含量随着盐浓度的增加呈显著增加趋势,各处理之间差异显著,在胁迫第14 天,在200 mmol·L-1处理下达到最大值32.02 mg·g-1,是对照的5.18倍。
2.4 盐胁迫对东部黑核桃叶片解剖结构和参数的影响
由图4 可以看出,50 mmol·L-1处理对核桃叶片的影响并不明显,但100 mmol·L-1处理的叶片叶尖焦枯,叶脉四周发黄,200 mmol·L-1处理的叶片大部分面积焦枯,皱缩,叶片受胁迫严重。东部黑核桃叶片为异面叶,有明显的栅栏组织和海绵组织的分化。海绵组织排列疏松且无规则,有较大的细胞间隙。栅栏组织为2 层结构,排列紧密,细胞形状为长柱形,含有较多叶绿体,且叶绿体位于细胞的边缘。表皮由单层上下表皮细胞构成,排列紧密;表皮细胞外壁具有较厚的角质层。叶脉突起处的角质层较其两侧的角质层厚;主脉发达,叶脉在叶片的近轴面微凸,远轴面则显著突出,其内含有一个维管束;主脉由厚角组织细胞、厚壁组织细胞、维管组织和薄壁细胞组成(图4-I);在50 mmol·L-1处理下叶片变厚,海绵组织厚度明显增加,栅栏组织紧密度增加,叶片结构仍保持完整(图4-F),叶脉维管束并未受到损伤(图4-J),表现了其对盐胁迫的适应性。在100 mmol·L-1时,叶片表现出严重的盐害症状,细胞轮廓开始模糊,部分结构开始解体,海绵组织、栅栏组织的完整性遭到不同程度的损坏(图4-G),叶脉、维管束直径显著变小,厚角组织细胞中存在晶簇(图4-K)。在200 mmol·L-1处理下上下表皮细胞受到严重伤害,海绵组织和栅栏组织解体,叶片整体皱缩(图4-H),叶脉表皮细胞受损,形状不规则,壁收缩,边缘不整齐,厚角组织面积减少,叶脉、维管束直径显著变小(图4-L)。
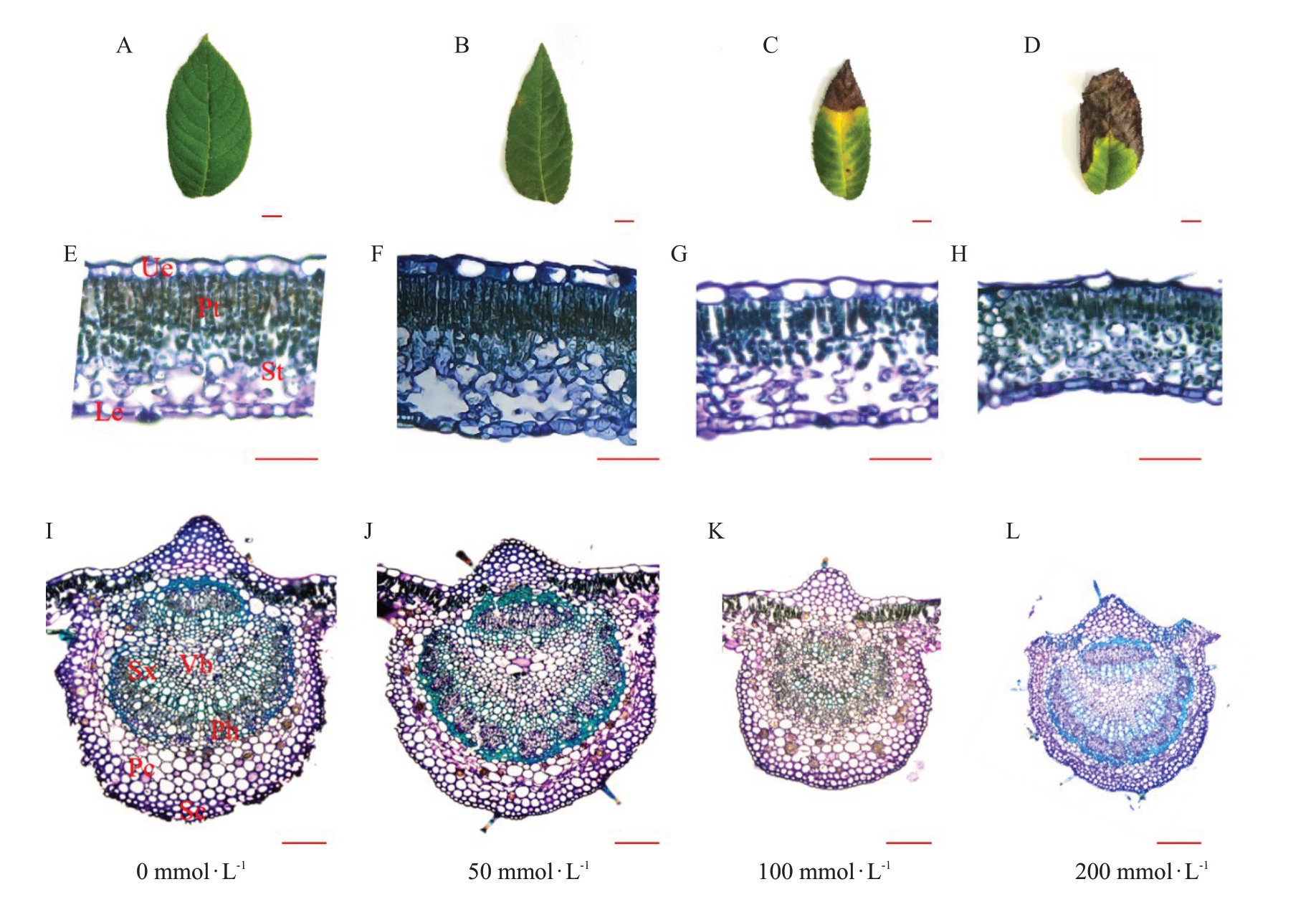
图4 盐胁迫第42 天时东部黑核桃叶片外部形态和组织结构横切面
Fig.4 Cross section of leaf external morphology and tissue structure of J.nigra L.at 42nd day of salt stress
Ue.上表皮细胞;Le.下表皮细胞;Pt.栅栏细胞;St.海绵细胞;Vb.维管束;Sx.次生木质部;Ph.韧皮部;Sc.厚壁细胞;Pc.薄壁细胞。A~D 比例尺为1 cm;E~H 放大倍数为10×10,比例尺为50 μm;I~L 放大倍数为10×4,比例尺为100 μm。
Ue.Upper epidermis;Le.Lower epidermis;Pt.Palisade cell;St.Sponge cells;Vb.Vascular bundle;Sx.Secondary xylem;Ph.Phloem;Sc.Sclerenchyma cell;Pc.Parenchymal cells.A-D scale is 1 cm;E-H magnification is 10×10,the scale is 50 μm;I-L magnification is 10×4,the scale is 100 μm.
2.4.1 栅栏组织(PT)由表1可知,叶片PT随着盐浓度的增加呈先增加后降低的趋势。50 mmol·L-1处理下的PT 显著高于对照,在胁迫第42 天达到最大值52.04 μm,是对照的1.45 倍。在胁迫第28天、42 天,100 mmol·L-1 处理与对照有显著差异。200 mmol·L-1处理下的PT显著低于对照,在胁迫第28天达到最小值28.09 μm,较对照降低了23.60%。
表1 盐胁迫下东部黑核桃叶表皮及叶肉结构参数
Table 1 Leaf epidermis and mesophyll structure parameters of J.nigra L.under salt stress
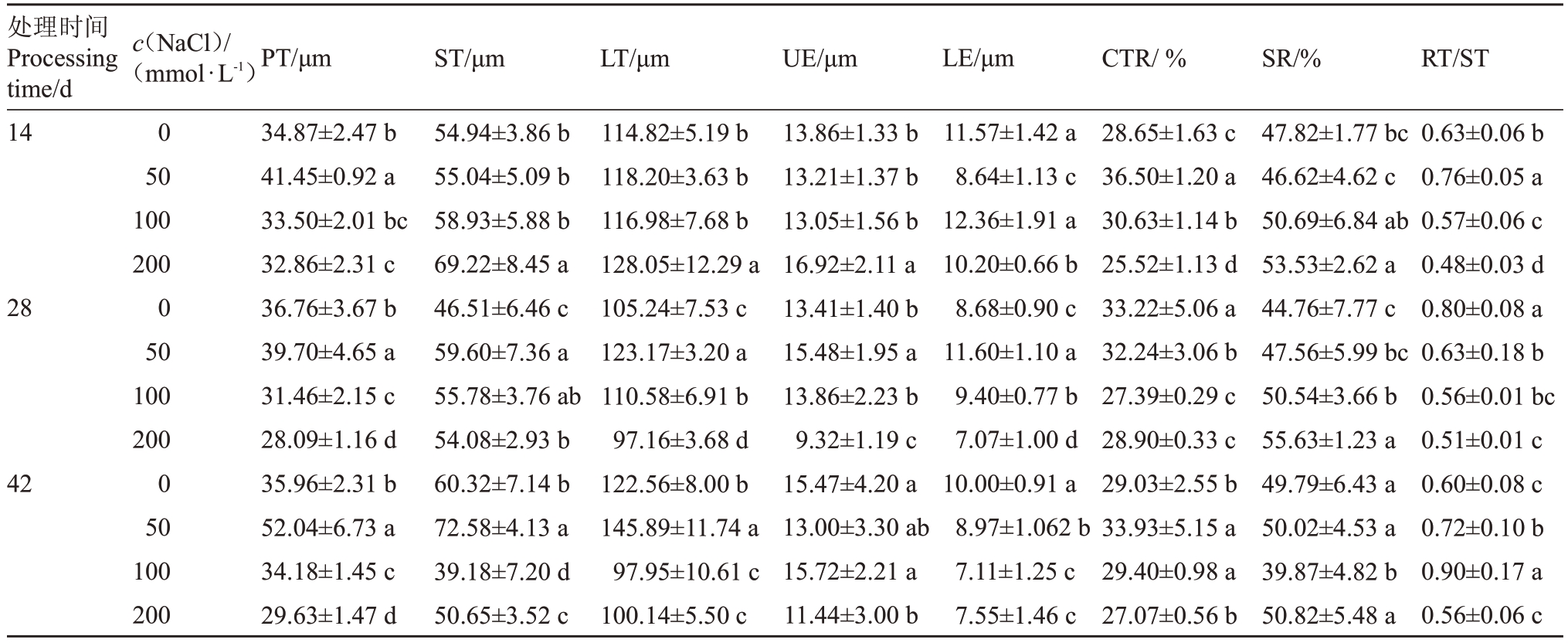
注:数据为平均值±标准误;同列数据后不同字母表示处理间显著差异(p<0.05)。下同。
Note:Values are means±standard error;The different small letters in the same column indicate the significant difference(p<0.05).The same below.
2.4.2 海绵组织(ST)和叶片(LT)由表1 可以看出,胁迫第14 天,ST 和LT 随着盐浓度的增加呈增加趋势。50、100 mmol·L-1处理与对照没有差异,200 mmol·L-1处理ST和LT显著高于对照,分别达到了69.22 μm 和128.05 μm,是对照的1.26 倍和1.12倍。胁迫第28 天,ST 和LT 随着盐浓度的增加呈先增加后降低的趋势。盐处理下的ST显著高于对照,在50 mmol·L-1处理下达到59.60 μm,是对照的1.28倍,各处理之间的LT 有显著差异,200 mmol·L-1处理达到最小值97.16 μm,显著低于0、100 mmol·L-1处理,较对照显著降低了7.67%。胁迫第42 天,ST和LT的各处理之间有显著差异,50 mmol·L-1处理下分别达到最大值72.58、145.89 μm,是对照的1.20倍、1.19 倍,在100、200 mmol·L-1处理下的ST 和LT都显著低于对照,ST在100 mmol·L-1处理下达到最小值39.18 μm,较对照降低了35.05%,LT 较对照降低了20.08%。
2.4.3 上表皮(UE)和下表皮(LE)由表1可知,胁迫第14 天,UE 随着盐浓度的增加呈先降低后升高的趋势,但50、100 mmol·L-1与对照之间没有差异,200 mmol·L-1处理达到最大值16.92 μm,较对照显著增加了22.08%。50 mmol·L-1处理下的LE显著低于对照,较对照降低了25.31%,但100 mmol·L-1处理与对照没有差异,200 mmol·L-1处理下较对照显著降低了11.84%。胁迫第28 天,UE 和LE 随着盐浓度的增加呈先增加后降低趋势,UE 和LE 都在50 mmol·L-1处理下显著高于对照,分别是对照的1.16倍和1.33倍,在200 mmol·L-1处理下分别达到最小值9.32、7.07 μm,显著低于对照,是对照的69.50%和81.45%。胁迫第42天,UE在50、100 mmol·L-1与对照之间没有差异,但200 mmol·L-1处理下的UE显著低于对照,较对照降低了26.06%。LE随着盐浓度的增加呈下降趋势,盐处理与对照差异显著,但100、200 mmol·L-1处理之间没有差异,较对照降低了28.90%、24.50%。
2.4.4 组织结构紧密度(CTR)和栅海比(PT/ST)表1 表明,胁迫第14 天,CTR、PT/ST 随着盐浓度的增加呈先增加后降低的趋势,各处理之间差异显著。在50 mmol·L-1处理下CTR达到最大值36.50%,是对照的1.27 倍,PT/ST 较对照增加了20.63%。在200 mmol·L-1处理下的CTR、PT/ST 分别达到最小值25.52%、0.48,是对照的89.08%、76.19%。胁迫第28 天,CTR、PT/ST 随着盐浓度的增加呈下降的趋势,盐处理与对照之间差异显著,100 mmol·L-1与200 mmol·L-1 之间没有差异。胁迫第42 天,CTR、PT/ST 随着盐浓度的增加呈先增加后降低的趋势,50 mmol·L-1处理下的CTR较对照显著增加了16.88%,而200 mmol·L-1处理下的CTR 较对照显著降低了6.73%,在100 mmol·L-1处理下PT/ST达到最大值0.90,较对照显著增加了50.00%,200 mmol·L-1处理较对照显著降低。
2.4.5 组织结构疏松度(SR)胁迫第14 天,SR随着盐浓度的增加呈先降低后增加的趋势,50、100 mmol·L-1与对照差异不显著,在200 mmol·L-1处理下SR 达到53.53%,是对照的1.12 倍。胁迫第28 天,SR 随着盐浓度的增加呈上升的趋势,除50 mmol·L-1 处理外,各处理之间有显著差异,在200 mmol·L-1处理下达到最大值55.63%,是对照的1.24倍。胁迫第42天,在100 mmol·L-1处理下的SR达到最小值39.87%,显著低于对照,是对照的80.08%,其他处理之间没有显著差异(表1)。
2.4.6 叶脉维管束(VBT)表2表明,胁迫第14天,VBT 随着盐浓度的增加呈下降的趋势,盐处理之间没有差异,但都显著低于对照。胁迫第28 天,VBT 随着盐浓度的增加呈先增加后降低的趋势,各处理之间差异显著,且盐处理下的VBT 都高于对照,在50 mmol·L-1处理下达到485.46 μm,是对照的1.58倍。胁迫第42天,VBT随着盐浓度的增加呈下降趋势,50 mmol·L-1与对照之间没有差异,100、200 mmol·L-1处理之间没有差异,都显著低于对照,在100 mmol·L-1处理下达到最小值257.60 μm,是对照的57.28%。
表2 盐胁迫下东部黑核桃叶片主脉结构参数
Table 2 Vein anatomical structure parameters of J.nigra L.under salt stress

2.4.7 叶脉(MVT)和主脉凸起度(MPD)胁迫第14 天,MVT 和MPD 的各处理之间差异显著,盐处理下都低于对照,在200 mmol·L-1处理下MVT和MPD分别达到最小值386.47 μm、3.16,较对照降低了47.43%、48.11%。胁迫第28 天,MVT 和MPD 随着盐浓度的增加呈先增加后降低的趋势,都在50 mmol·L-1处理下达到最大值843.99 μm、7.02,是对照的1.32倍、1.23倍,200 mmol·L-1处理下MVT较对照显著降低了21.98%,MPD 较对照降低了7.89%。胁迫第42 天,MVT 和MPD 随着盐浓度的增加呈下降趋势,分别在200 mmol·L-1处理下较对照降低了46.41%、40.14%,各处理下的MVT差异显著,但盐处理下的MPD 与对照差异显著,100、200 mmol·L-1处理之间没有差异(表2)。
2.5 盐胁迫对东部黑核桃茎解剖结构和参数的影响
茎呈典型的次生结构由外而内分别为:周皮、皮层、维管束和髓(图5)。在0、50 mmol·L-1处理下茎的解剖结构在盐胁迫过程中均保持完整,变化较小,皮层薄壁细胞小且排列致密,厚角组织细胞层数较多且细胞壁增厚(图5-A、B),但随着盐浓度的增加薄壁细胞增大且排列疏松,细胞间隙增大(图5-C),特别是在200 mmol·L-1处理下皮层厚度显著增加,形状不规则,壁收缩,边缘不整齐(图5-D)。0 mmol·L-1处理下的木质部的导管小且密度大,厚度较小,木质化程度较高(图5-E),随着盐浓度的增加,厚度增加,导管直径增大(图5-F、G),在200 mmol·L-1处理下木质部存在许多微裂缝,表明在高盐条件下受胁迫程度较重(图5-H)。
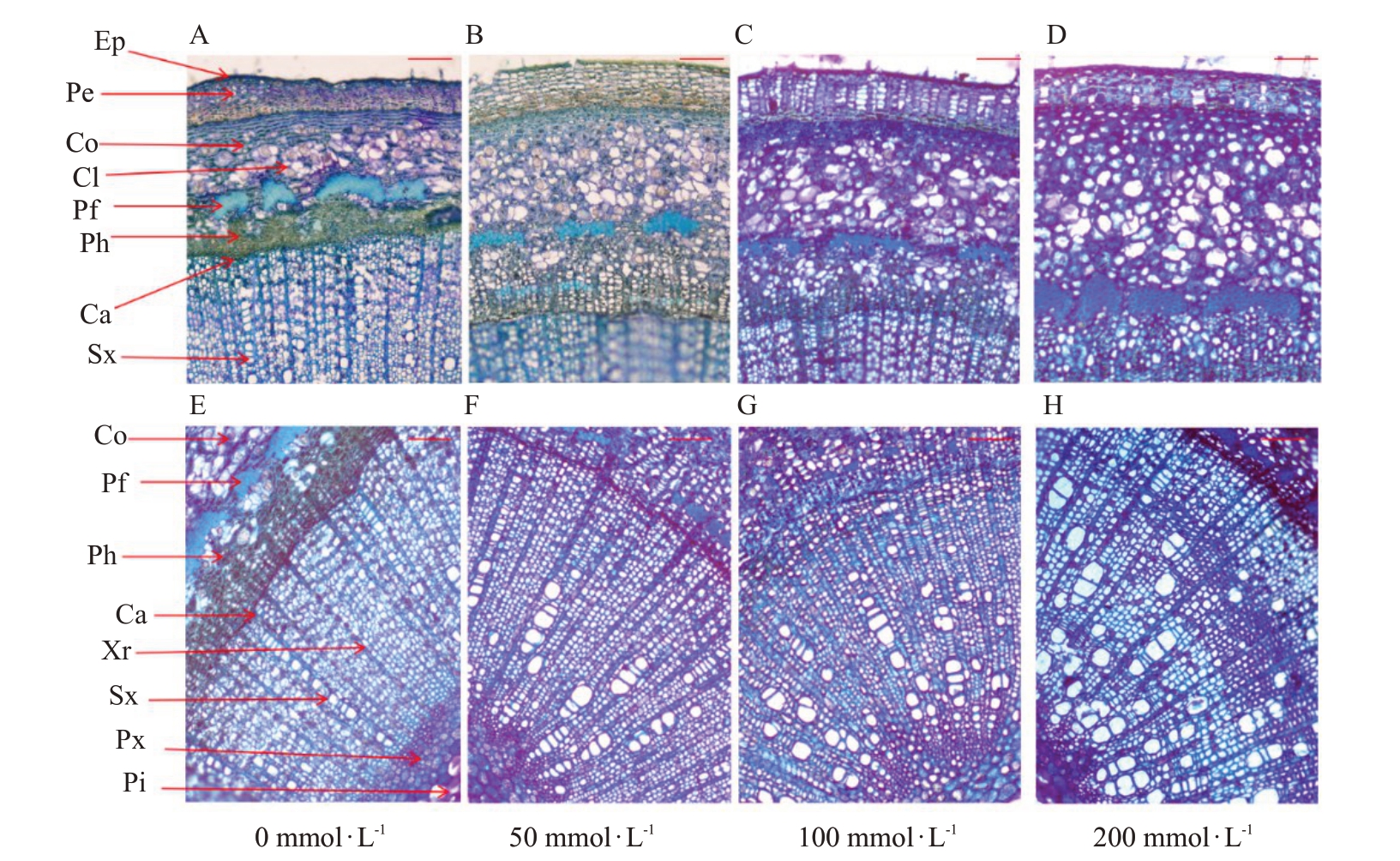
图5 盐胁迫第42 天时东部黑核桃茎组织结构横切面光学显微观察
Fig.5 Cross sectional light microscopy images of stem apex structure of J.nigra L.at 42nd day of salt stress
Ep.表皮细胞;Pe.周皮细胞;Co.皮层细胞;Cl.晶簇;Pf.韧皮纤维;Ph.韧皮部;Ca.形成层;Xr.木射线;Sx.次生木质部;Px.初生木质部;Pi.髓。放大倍数为10×10;比例尺为100 μm。
Ep.Epidermal cells;Pe.Peridermal cells;Co.Cortex cells;Cl.Crystals;Pf.Phloem fibers;Ph.Phloem;Ca.Cambium;Xr.Xylem rays;Sx.Secondary xylem;Px.Primary xylem;Pi.Pith.The magnification is 10×10;The scale is 100 μm.
2.5.1 茎木质部(SXT)表3表明,胁迫第14天、28天,SXT随着盐浓度的增加呈先增加后降低的趋势,盐处理下的SXT 显著高于对照,各处理差异显著,都在100 mmol·L-1处理下达到270.12、464.40 μm,分别是对照的1.67 倍、2.01 倍。胁迫第42 天,SXT 随着盐浓度的增加呈上升趋势,在200 mmol·L-1处理下达到最大值522.88 μm,较对照增加了68.11%。
表3 盐胁迫下东部黑核桃茎结构参数
Table 3 Shoot tips anatomical structure parameters of J.nigra L.under salt stress

2.5.2 茎韧皮部(SPhT)由表3 可知,胁迫第14天,SPhT 随着盐浓度的增加呈增加趋势,各处理差异显著,在200 mmol·L-1达到151.69 μm,是对照的2.74 倍。胁迫第28 天,SPhT 随着盐浓度的增加呈先增加后降低的趋势,盐处理下的SPhT 显著高于对照,各处理差异显著,在100 mmol·L-1达到最大值170.22 μm,是对照的1.87 倍。胁迫第42 天,SPhT的变化趋势与第28天变化趋势一致,但在100、200 mmol·L-1处理下的SPhT 显著低于对照,且在200 mmol·L-1处理下达到最小值91.26 μm,较对照降低了23.86%。
2.5.3 茎皮层(SCT)由表3 可以看出,胁迫第14天、第28 天,SCT 随着盐浓度的增加呈先增加后降低的趋势,盐处理下的SCT 显著高于对照。第14天,在50 mmol·L-1处理下SCT达到169.10 μm,是对照的1.63倍,第28天,在100 mmol·L-1处理下SCT达到251.30 μm,是对照的2.27 倍。胁迫第42 天,SCT随着盐浓度的增加呈上升趋势,各处理显著高于对照,在200 mmol·L-1处理下达到最大值327.84 μm,较对照增加了73.71%。
2.5.4 茎周皮(SPT)表3 表明,随着盐浓度的增加,SPT 呈先增加后降低的趋势。胁迫第14 天,50 mmol·L-1处理下的SPT显著高于对照,是对照的1.17倍,200 mmol·L-1处理显著低于对照,是对照的83.11%。胁迫第28 天,盐处理的SPT 显著高于对照,在100 mmol·L-1 处理下的SPT 达到最大值100.31 μm,较对照增加了41.80%。胁迫第42 天,50 mmol·L-1处理下的SPT显著高于对照,较对照增加了8.14%,但100、200 mmol·L-1处理下的SPT显著低于对照,分别较对照降低了23.33%、39.40%。
2.6 盐胁迫对东部黑核桃根解剖结构和参数的影响
根横切面从外到内分别为周皮、皮层、次生韧皮部、形成层、木质部(图6)。在50 mmol·L-1处理下,根直径与对照相比显著减小,周皮组织皱缩,皮层细胞中含有晶体,导管大小不均匀,各组织受损情况较轻(图6-B、F、J)。在100 mmol·L-1处理下,周皮组织破碎、皱缩,皮层组织细胞破损,解体,排列疏松,出现较大的细胞间隙,同时皮层厚度增加,导管数量增加(图6-C、G、K)。在200 mmol·L-1处理下,根的解剖结构出现细胞解体,细胞形态模糊、破碎、皱缩,各组织受到严重损坏,皮层薄壁组织细胞形状发生了改变,彼此堆积挤压呈不规则形状,木质部表现不正常,导管大小不均匀,呈无规则分布,细胞壁出现破损(图6-D、H、L)。
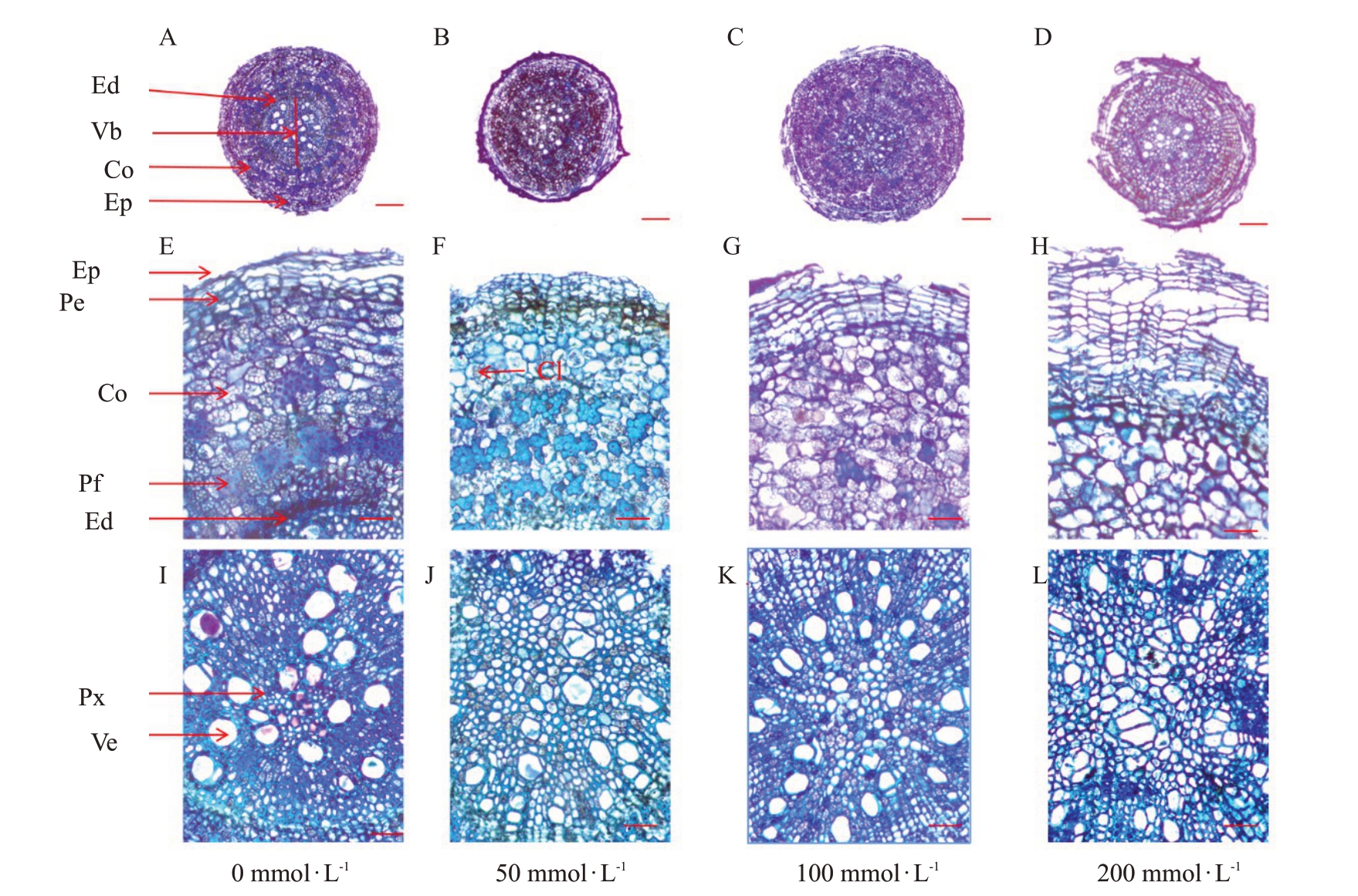
图6 盐胁迫第42 天时东部黑核桃根组织结构横切面光学显微观察
Fig.6 Cross sectional light microscopy images of root structure of J.nigra L.at 42nd day of salt stress
Ed.内皮层;Vb.维管束;Co.皮层细胞;Ep.表皮细胞;Pe.周皮细胞;Pf.韧皮纤维;Px.初生木质部;Ve.导管;Cl.晶簇。A~D 放大倍数为4×10,比例尺为200 μm;E~L 放大倍数为20×10,比例尺为50 μm。
Ed.Endothelium;Vb.Vascular bundles;Co.Cortex cells;Ep.Epidermal cells;Pe.Periderm cells;Pf.Phloem fibers;Px.Primary xylem;Ve.Vessels;Cl.Crystals.A-D magnification is 4×10,the scale is 200 μm;E-L magnification is 20×10,the scale is 50 μm.
2.6.1 根直径(RD)和根皮层(RCT)表4 表明,胁迫第14 天、第28 天,RD 和RCT 随着盐浓度的增加呈先增加后降低的趋势。胁迫第14 天,RD 各处理间差异显著,50、100 mmol·L-1处理的RD高于对照,分别较对照增加了27.43%、11.90%,但200 mmol·L-1处理的RD和RCT低于对照,较对照降低了20.11%、47.29%。胁迫第28天,50 mmol·L-1处理的RD显著高于对照,达到最大值786.04 μm,较对照增加了13.82%,但100、200 mmol·L-1 RD 显著降低,较对照降低了5.55%、4.51%。RCT 在50 mmol·L-1处理下显著高于对照,达到177.86 μm,较对照增加了153.04%。胁迫第42天,盐处理下的RD显著低于对照,在200 mmol·L-1处理下达到最小值447.62 μm,较对照降低了34.18%。50 mmol·L-1处理下的RCT降低到46.02 μm,但100 mmol·L-1处理下的RCT 升高到91.72 μm,与对照差异显著。
表4 盐胁迫下东部黑核桃根结构参数
Table 4 Roots anatomical structure parameters of J.nigra L.under salt stress
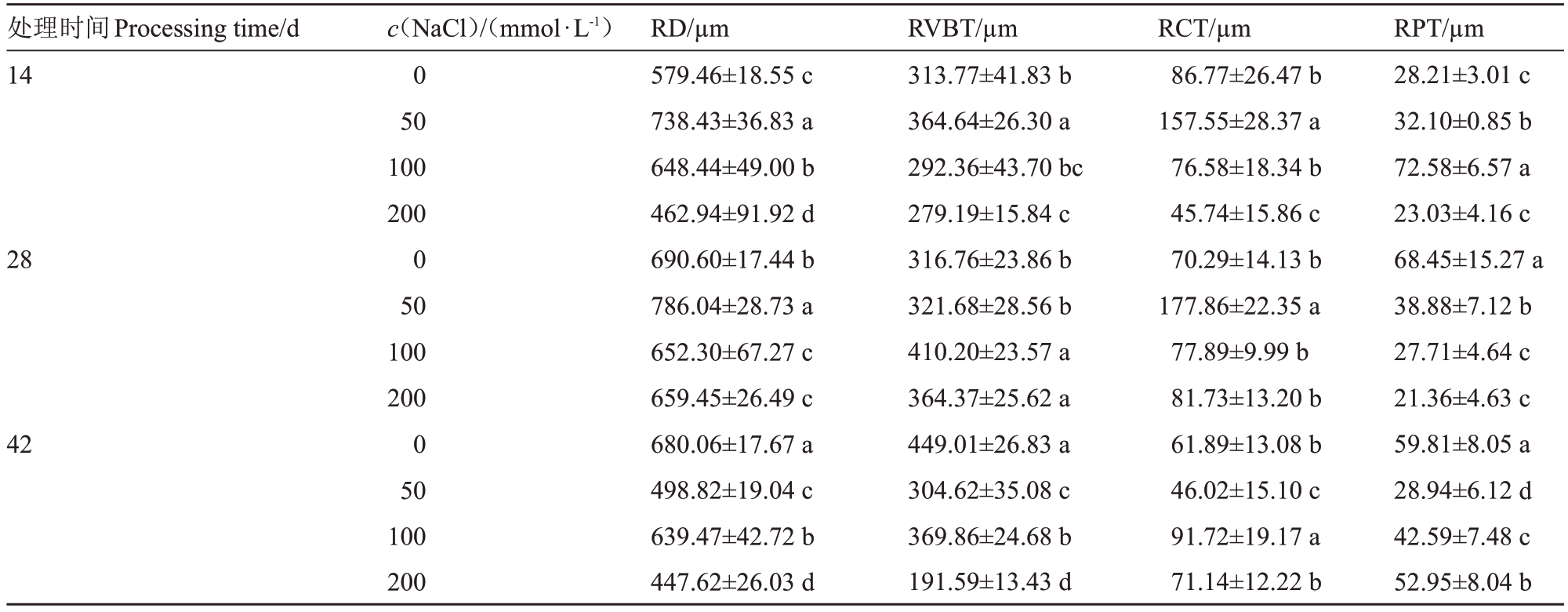
2.6.2 根维管束(RVBT)由表4 可知,胁迫第14天,RVBT 随着盐浓度的增加呈先增加后降低的趋势,在50 mmol·L-1时达到364.64 μm,较对照显著增加了16.21%,200 mmol·L-1处理较对照显著降低了11.02%。胁迫第28 天,RVBT 随着盐浓度的增加呈上升趋势,但50 mmol·L-1处理下的RVBT与对照没有差异,100、200 mmol·L-1处理显著高于对照,较对照增加了29.50%、15.03%。胁迫第42 天,RVBT 随着盐浓度的增加呈下降趋势,各处理差异显著,在200 mmol·L-1处理下RVBT 达到最小值191.59 μm,较对照降低了57.33%。
2.6.3 根周皮(RPT)表4 表明,胁迫第14 天,RPT 随着盐浓度的增加呈先增加后降低的趋势,50、100 mmol·L-1处理与对照差异显著,在100 mmol·L-1处理下达到最大值72.58 μm,是对照的2.57 倍。胁迫第28 天,RPT 随着盐浓度的增加呈下降趋势,盐处理的RPT 与对照差异显著,在200 mmol·L-1处理下达到最小值21.36 μm,较对照降低了68.79%。胁迫第42天,RPT随着盐浓度的增加呈先下降后增加的趋势,盐处理下的RPT显著低于对照,在50 mmol·L-1处理下的RPT较对照降低了51.61%。
2.7 综合分析
2.7.1 相关性分析 从图7 可以看出,SXT 和SCT与RWC 呈显著负相关,与MDA、APX、TFC、Pro 和SP 呈显著正相关,茎的解剖结构与RWC、抗活性氧物质和渗透调节物质具有较强的相关关系。TPC与CTR、PT/ST、MVT、MPD、RD呈显著负相关,TPC与叶肉、叶脉、根粗关系紧密。SPT与SP、VBT、MVT、MPD 呈显著正相关,SPT 与叶脉具有较强的相关性。说明盐胁迫下营养器官结构的变化与渗透调节物质和抗活性氧物质相互影响。

图7 盐处理下东部黑核桃幼苗生理生化指标、解剖参数的相关性分析
Fig.7 Correlation analysis of physiological and biochemical indexes and anatomical parameters in J.nigra L.of salt treatment
*p≤0.05,**p≤0.001.
2.7.2 解剖结构参数的主成分分析 由图8可以看出,分别对3 个胁迫时间段的东部黑核桃幼苗叶、茎、根的解剖参数进行主成分分析,结果表明,在不同胁迫时间对营养器官的响应特征不同。胁迫第14 天、28 天、42 天前两个主成分的累计贡献率分别为63.79%、70.53%、69.06%,但第1 主成分组成有明显差异。胁迫第14 天的第1 主成分主要是RD、PT/ST、RCT、SPT、CTR,胁迫第28天的第一主成分主要是PT/ST、SCT、RPT、SXT、SPT,胁迫第42天的第一主成分主要是VBT、SPT、SXT、MVT、SPhT。
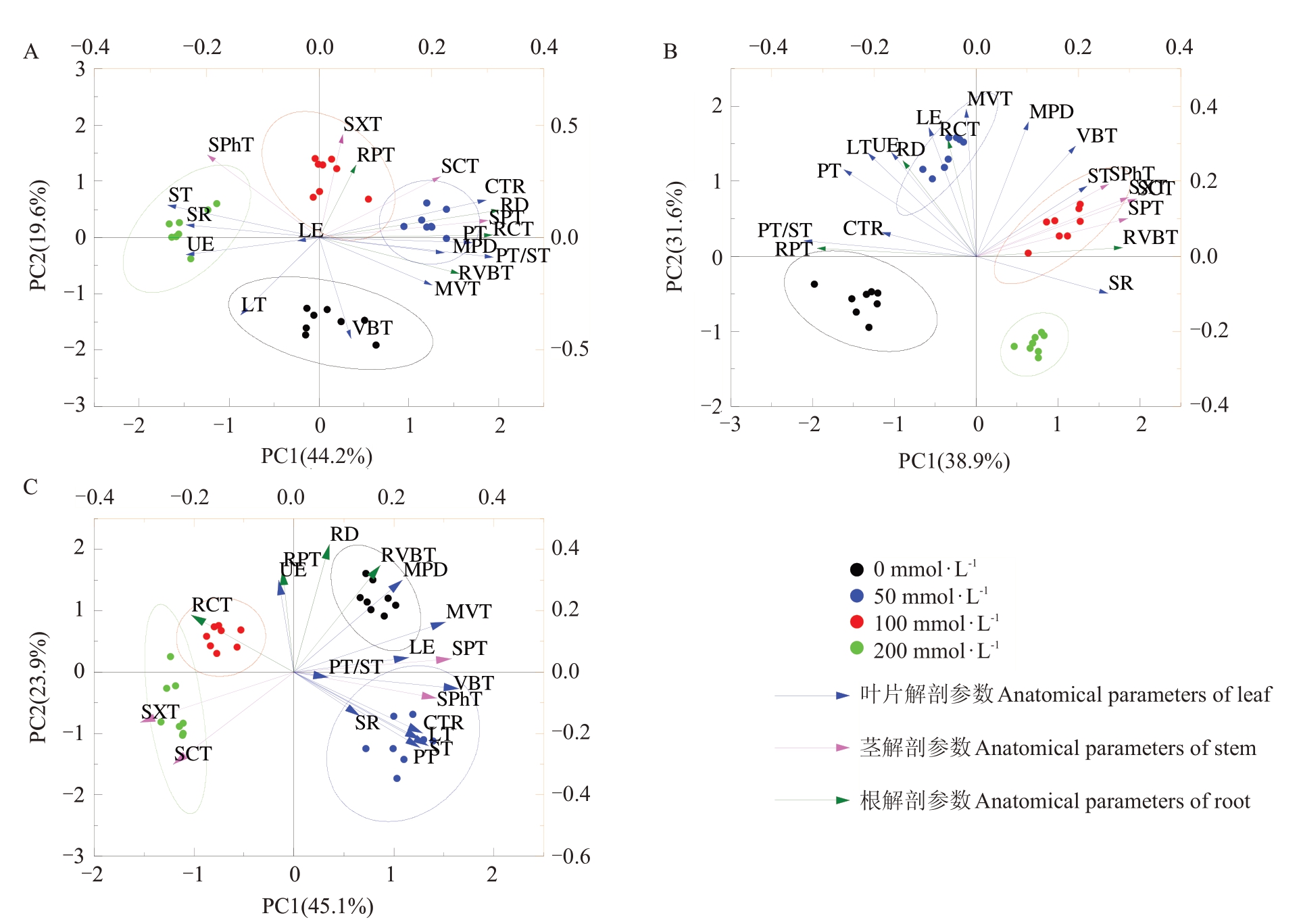
图8 盐处理下东部黑核桃幼苗解剖结构参数的主成分分析(PCA)
Fig.8 Principal component analysis(PCA)of anatomical parameters of J.nigra L.seedling under salt treatment
3 讨论
3.1 盐胁迫对叶片生理生化的影响
叶片RWC 是反映胁迫条件下植物受害程度的重要指标,叶片RWC反映叶片水分状况[20]。本研究表明,长期高盐浓度下大幅度降低了幼苗叶片的RWC,这与郭雁君等[21]对砂糖橘叶片的研究结果相类似。在胁迫后期,高盐浓度下RWC 高于胁迫中期,可能因为胁迫后期叶片厚度大于胁迫中期。有研究表明低盐浓度下叶片厚度的增加有利于防止水分的过分蒸腾[22],增强其吸收、储存大量水分的能力[23]。盐胁迫会损害细胞膜,导致膜脂过氧化,MDA作为膜脂过氧化反应的主要产物之一,其含量的高低在一定程度上反映出细胞膜损伤程度的大小[24-25]。本研究表明,胁迫前期幼苗叶片中MDA含量均随着盐浓度增加呈上升趋势。原因是盐胁迫造成活性氧代谢失衡,破坏膜结构完整性,导致MDA含量增加[26]。在伽师瓜的研究中也发现盐处理使叶片中积累大量的MDA[27]。在盐胁迫中期,高盐浓度下MDA含量低于盐胁迫初期,可能与APX酶活性、总酚含量大幅度升高有关,但由于幼苗抗活性氧系统对活性氧的清除存在一定限度,导致胁迫后期MDA含量高于胁迫中期。在胁迫后期,高盐浓度下的MDA 含量有所下降,原因可能是幼苗在高盐浓度下,胁迫时间超过幼苗耐盐范围后植物叶片受害严重并导致MDA 分解[28-29],这与在海巴戟[6]、银杏[30]中的研究结果相类似。
盐胁迫下,植物体内的酶促反应和非酶促反应两类活性氧清除系统对维持细胞膜的稳定性、保障植物正常生理代谢具有重要意义,酶促反应中SOD、APX 等酶起重要作用[24]。本研究表明,SOD活性随着盐胁迫程度的增加呈先上升后下降的趋势,这与对罗汉松[31]、葡萄砧木[32]的研究结果类似。胁迫初期SOD活性上升的原因是低浓度盐胁迫下,植物可通过提高保护酶活性加强耐盐性[33],但在盐浓度过高或胁迫时间延长,产生了大量的活性氧,细胞内保护酶系统受到破坏,导致酶活性降低[34]。本研究表明,胁迫前期APX活性在盐胁迫下上升幅度较小,胁迫后期盐胁迫下的APX 活性大幅度增强。对元宝枫的盐碱胁迫研究表明,在长时间低盐胁迫下元宝枫主要通过提高APX活性来清除H2O2,防止膜脂过氧化作用加剧[35]。
前人研究表明,当植物处于非生物胁迫下,会形成高浓度的酚类物质[36],植物会产生次生代谢物来抵消应激源,适应条件并存活[37]。在本研究中,胁迫前期,TFC 在低盐环境下含量降低。李娜娜等[38]在对NaCl胁迫下菥蓂的研究中也发现相似结果,并认为盐胁迫后叶片中总酚的合成明显受到抑制。胁迫第28 天后,盐处理下的多酚浓度增加,但在高盐胁迫下多酚含量增幅减小,可能是严重的胁迫会将多酚类物质转化成其他物质[39]。在对葡萄[40]等的研究中也得出了类似结果。与酚类化合物类似,盐胁迫刺激了黄酮的产生。笔者的结果表明,黄酮含量随着盐浓度的增加显著增加。这与对青钱柳[41]、金叶银杏[42]、沙枣[43]等的研究结果相似。
逆境条件下,植物通过积累Pro、SS、SP作为重要的有机渗透调节物质来平衡调节渗透压进行自我保护,是植物抗逆性强弱的体现[24,33]。在本研究中,胁迫前期低盐处理下Pro含量低于对照。在胁迫后期,随着胁迫时间的延长和胁迫浓度的增加,Pro含量显著增加,这与对八棱海棠的研究结果类似[44]。这可能是由于在盐胁迫初期可以通过较低的Pro含量维持细胞渗透势,而随着盐浓度增加和胁迫时间的延长,可通过提高体内Pro含量达到降低细胞渗透势的目的[45]。Wang 等[46]发现枸杞在75 mmol·L-1处理下的Pro生物合成基因下调,可能是处理温和而无法触发Pro生物合成,因为与合成有机化合物的代谢成本相比,Na+的积累成本较低[47]。在本研究中,胁迫前期SP 含量在100 mmol·L-1处理下有大幅度的增加,但200 mmol·L-1处理下的SP 含量有所降低,原因可能是胁迫初期会合成SP 来抵御逆境条件,这与张娅等[48]对小麦的研究结果相类似。在胁迫后期,50 mmol·L-1处理下SP含量显著降低,同时盐处理下的SP 含量低于盐处理中期,原因可能是蛋白质分解,导致SP含量减少,蛋白质被分解成各种氨基酸,从而引起Pro含量持续增加[49],另一种可能是盐胁迫抑制了RNA 转录和翻译[30]。SS 在逆境中既可作为渗透调节物质,同时还能作为有机物以供应植物正常生长所需[6]。在本研究中,胁迫中期SS含量低于盐胁迫初期,可能是因为大量的SS作为碳源参与了植物的代谢活动,修复盐胁迫造成的损伤。胁迫后期高盐浓度下SS含量显著增加。研究表明,盐胁迫下小果白刺[50]、甜樱桃砧木[51]、白榆[52]幼苗中SS含量均逐渐增加。越橘盐碱胁迫表明,叶片会通过增加体内的渗透调节物质和提高抗氧化酶活性来抵御胁迫环境,提高其对不同盐碱环境的适应能力[53]。这与本研究结果相类似,渗透调节物质与抗氧化酶活性呈正相关,其中Pro 与抗活性氧物质的活性呈显著正相关。
3.2 盐胁迫对叶片解剖结构的影响
叶片是植物对外界环境变化感受最灵敏的器官,是植物同化功能的发生地,其解剖结构与植物的环境有着千丝万缕的联系[54]。在本研究中低盐浓度下栅栏组织增厚,栅海比、CTR增大,叶片会变得更为紧密,能够更好地锁住水分,防止盐胁迫引起生理干旱[6]。有研究表明叶肉细胞中栅栏组织纵向伸长可增加叶片对光能的捕获机会,从而适应盐胁迫环境[22-23]。Boughalleb 等[55]研究发现NaC(l100~300 mmol·L-1)丰富了木本苜蓿叶片的解剖学特征,包括叶片,上表皮、下表皮,栅栏和海绵组织的厚度。但在本研究中,高盐浓度下栅栏组织厚度、海绵组织、叶片厚度、表皮厚度降低,CTR、栅海比减小,说明可能是高浓度盐胁迫引起叶片失水所致[56]。这与罗达等[57]在平欧杂种榛中的研究结果相似。在本研究中,海绵组织、叶片厚度在短时间内增厚,随着胁迫时间的延长,低盐浓度下依旧增厚。Yao 等[22]研究发现随着盐浓度的增加,枸杞叶片厚度逐渐增大,同时表明栅栏组织比海绵组织对叶肉的贡献更大。叶片增厚可以在一定程度上抑制叶片蒸腾作用,增强其吸收、贮存大量水分的能力,降低植物体内盐浓度,进而提高植物本身对盐胁迫的抗性[23]。这与卢倩倩[58]在葡萄中的研究结果相似。表皮细胞越厚,越有利于水分的贮藏,耐盐能力就越强[59]。本研究中,胁迫初期低盐浓度下上表皮厚度变化不显著,高盐浓度下增厚,但随着胁迫时间的延长上表皮厚度呈先增加后降低的趋势,这与在大豆中的研究结果类似[60]。CTR反映了叶片内部海绵组织的发育程度,在高盐量土壤中能够诱导叶片海绵组织的退化[61]。在本研究中,高盐浓度下SR 显著增加,而CTR显著降低。说明NaCl处理造成水分供应不足,阻碍叶片的水分代谢,导致叶肉细胞分裂受阻,限制了植物叶片的正常生长[17]。叶脉直径、叶脉维管束直径、叶脉凸起度随着盐浓度的增加呈下降趋势。Ibrahim等[62]对葡萄藤的研究发现,高盐度降低了中脉的厚度,比对照的中脉厚度减少54.01%。此外,笔者在本研究中发现,盐胁迫下叶片的厚角组织以及茎、根的皮层中产生大量晶簇。毛桂莲等[63]在对枸杞的研究中发现随着盐碱胁迫加剧,晶体个数呈先增后减的趋势,同时指出在低浓度盐胁迫下晶体(草酸钙)数目的增加,使叶片可以积累大量渗透调节物质降低叶片渗透势,来维持叶片的保水和吸水能力。笔者在本研究中也发现茎皮层厚度与渗透调节物质呈正相关,与Pro呈显著正相关。
3.3 盐胁迫对茎解剖结构的影响
茎是植物营养物质运输的重要器官,在应对逆境时采用多种策略共同作用、彼此协调达到保护植物的目的[64]。木质部是植物纵向运输水分的复合组织,其比例上升大大提高了水分运输效率,皮层的增厚能够强化保水功能[65],同时能够在植株缺水时提供支撑功能防止植物萎蔫[66]。在本研究中,盐胁迫下,茎木质部、皮层厚度增厚,显著提高植株茎的储水、水分运输的能力,保证在生理性干旱缺水时植株的正常生长发育[67]。茎韧皮部厚度在胁迫前中期增厚,在胁迫后期100、200 mmol·L-1 处理下厚度降低。有研究发现盐胁迫下棉花[68]、甜菜[69]的韧皮部厚度显著减小。茎周皮外层主要为不透水不透气的木栓质组成,周皮可减少茎表面水分的散失,具有保水作用,是对盐胁迫的适应[67]。在本研究中,低盐浓度下周皮厚度增厚,高盐浓度下周皮厚度减小。在对胀果甘草的研究发现,高盐度会促进耐盐性强的胀果甘草的茎周皮提前发育,会抑制耐盐性较弱的光果甘草茎周皮的形成[70]。
3.4 盐胁迫对根解剖结构的影响
根系能感知周围环境变化,并与植物的地上部分相互作用、共同协调,使其能够在逆境中正常生长发育。面对盐碱胁迫时,根系是最先感知并作出适应性调整的器官[71]。在本研究中,根直径、根维管束直径在胁迫前中期呈先增加后降低的趋势,在胁迫后期呈下降趋势。在对苜蓿的研究中发现随着盐浓度加大,根系直径显著加粗,从而增强根的吸收作用[72]。Cipriano 等[73]对凤梨的研究表明根横截面直径的减小可能是由于细胞的大小和数量的减少,Terletskay 等[74]认为较小的细胞可以表明增加水势的基本反应,这有助于在缺水的情况下更有效地维持膨压。根对土壤盐分浓度变化反应敏感,一定浓度的盐分处理有利于根部的生长发育,而超过某阈值,则会表现出抑制作用[75]。低盐胁迫主要通过维管组织的加强提高其水分输导能力,以保证盐胁迫下植物体内细胞的湿润环境以及正常的生长代谢[6]。根皮层的功能是横向运输及贮存水和盐离子,加厚的皮层不仅延长了水和盐离子的横向运输至中柱的路径,提高对盐离子过滤和阻隔效果,也使皮层具有更多的贮水细胞,稀释截留在细胞内的盐离子,避免盐害[76]。在本研究中,根皮层厚度在低盐浓度下胁迫前期大幅度增厚,在高盐浓度下随着胁迫时间的延长逐渐增厚。这与陆嘉慧[70]在3种药用甘草中的研究结果类似。周皮厚度增加有利于抵御外界较低渗透势造成的体内水分外渗,避免根系生理干旱的发生[77],同时万长贵等[78]指出周皮的形成进一步加强阻止盐、碱离子进入根部导管。在本研究中,胁迫前期周皮厚度呈先增加后降低的趋势,随着胁迫时间的延长周皮厚度显著降低。
4 结论
盐胁迫下幼苗的生理生化和解剖结构响应结果表明,当盐浓度为50 mmol·L-1时,东部黑核桃可以通过提高抗氧化物质(SOD、APX、TPC、TFC)活性、增加渗透物质(Pro、SP、SS)含量,改变植物形态解剖结构(栅栏组织、海绵组织、木质部、皮层、维管束直径增厚)等方式适应盐胁迫环境;而当盐浓度达到200 mmol·L-1时,东部黑核桃的结构与生理机能受到损伤,MDA 含量大幅度增加,RWC 含量显著降低,PT、ST、RVBT、RD 显著降低,调节能力下降,影响其存活率。同时通过相关性分析和主成分分析综合考虑筛选出PT/ST、SPT、SXT、RD 作为幼苗耐盐评价的4个指标。
[1] 张衡锋,杨绮,韦庆翠,张焕朝.盐胁迫对10 个品种紫薇的影响及其耐盐性综合评价[J].东北林业大学学报,2023,51(9):34-40.ZHANG Hengfeng,YANG Qi,WEI Qingcui,ZHANG Huanchao.Effects of salt stress and salt tolerance on ten Lagerstroemia indica varieties[J].Journal of Northeast Forestry University,2023,51(9):34-40.
[2] 亓正聿,毕泽楷,彭福田.果树耐盐机制研究进展[J].种子科技,2021,39(11):8-11.QI Zhengyu,BI Zekai,PENG Futian.Research progress on salt tolerance mechanism of fruit trees[J].Seed Science&Technology,2021,39(11):8-11.
[3] 常斌川,张娟,郝志龙,冯圣杰,王梦圆.樱桃砧木耐盐适应性研究进展[J].果树资源学报,2023,4(3):81-84.CHANG Binchuan,ZHANG Juan,HAO Zhilong,FENG Shengjie,WANG Mengyuan.Research progress on salt tolerance adaptability of cherry rootstocks[J].Journal of Fruit Resources,2023,4(3):81-84.
[4] 练冬梅,李洲,姚运法,张少平,林碧珍,洪建基,赖正锋.干旱和盐胁迫对冰菜生长及光合特性的影响[J].中国瓜菜,2023,36(4):118-123.LIAN Dongmei,LI Zhou,YAO Yunfa,ZHANG Shaoping,LIN Bizhen,HONG Jianji,LAI Zhengfeng.Effect of drought and saline stress on the growth and photosynthetic characteristics of Mesembryanthemum crystallinum Linn.[J].China Cucurbits and Vegetables,2023,36(4):118-123.
[5] 陈旭.山东省滨海盐碱地主要造林树种根叶解剖性状与土壤理化性质的相关性[D].泰安:山东农业大学,2019.CHEN Xu.Correlation between anatomical characteristics of roots and leaves and soil physical and chemical properties of major afforestation tree species in coastal saline-alkali land in Shandong Province[D].Tai’an:Shandong Agricultural University,2019.
[6] 金贇.水盐胁迫对海刀豆幼苗生长及生理特性的影响[D].南宁:广西大学,2022.JIN Yun.Effects of water and salt stress on the growth and physibiological characteristics of Canavalia maritima seedlings[D].Nanning:Guangxi University,2022.
[7] 谷俊,耿贵,李冬雪,於丽华.盐胁迫对植物各营养器官形态结构影响的研究进展[J].中国农学通报,2017,33(24):62-67.GU Jun,GENG Gui,LI Dongxue,YU Lihua.Effect of salt stress on plant nutritional organs’morphology and structure:Research progress[J].Chinese Agricultural Science Bulletin,2017,33(24):62-67.
[8] 刘辰乾.美国黑核桃引种及嫁接栽培技术研究[D].杨凌:西北农林科技大学,2016.LIU Chenqian.The introduction of the American black walnut and the research of its grafting-cultivation techniques[D].Yangling:Northwest A&F University,2016.
[9] 滕元旭,骆霞,张雪蒙,崔辉梅.外源CO 供体高铁血红素对盐胁迫下加工番茄苗期根系形态及生理特性的影响[J].西南农业学报,2023,36(9):1906-1914.TENG Yuanxu,LUO Xia,ZHANG Xuemeng,CUI Huimei.Effects of exogenous hemin of exogenous CO on root morphology and physiological characteristics of processed tomato seedlings under salt stress[J].Southwest China Journal of Agricultural Sciences,2023,36(9):1906-1914.
[10] 汪晓丽.大叶榉新品种‘恨天高’对盐碱胁迫的生理生化响应[D].长沙:中南林业科技大学,2016.WANG Xiaoli.Physiological and biochemical responses of the new cultivar of Zelkova schneideriana‘Hentiangao’under saline-alkalinity stress[D].Changsha:Central South University of Forestry&Technology,2016.
[11] 王治华.印度梨形孢(Piriformospora indica)对黑麦草(Lolium perenne)耐盐响应机理研究[D].济南:山东建筑大学,2023.WANG Zhihua.Studies on Piriformospora indica to salt resistance response mechanism of Lolium perenne[D].Jinan:Shandong Jianzhu University,2023.
[12] 屈燕.冻融及盐碱胁迫下添加青蒿素和黄腐酸钾对青稞幼苗的生理影响[D].长春:吉林大学,2022.QU Yan.Physiological responses of highland barley seedlings to freeze-thaw and saline-alkali stress with addition of artemisinin and potassium fulvic acid[D].Changchun:Jilin University,2022.
[13] 王学奎,黄见良.植物生理生化实验原理与技术[M].3 版.北京:高等教育出版社,2015:286.WANG Xuekui,HUANG Jianliang.Principles and techniques of plant physiological biochemical experiment[M].3rd ed.Beijing:Higher Education Press,2015:286.
[14] 李世玉.26 份甜瓜材料耐盐性评价及外源NO 对甜瓜盐胁迫的缓解效应[D].杨凌:西北农林科技大学,2022.LI Shiyu.Evaluation of 26 melon varieties against salt tolerance and study of mitigating effects by exogenous NO application[D].Yangling:Northwest A&F University,2022.
[15] 朱文华,杨为海.澳洲坚果花发育过程中抗氧化物质含量及抗氧化活性的变化[J].经济林研究,2023,41(1):63-70.ZHU Wenhua,YANG Weihai.Changes in the antioxidant substance content and antioxidant capacity during flower development of macadamia[J].Non-Wood Forest Research,2023,41(1):63-70.
[16] 任园宇,魏东伟,王中伟,周亚萍.亚硝酸钠-硝酸铝比色法测定干旱胁迫前后玉米幼苗的总黄酮含量[J].农学学报,2020,10(5):15-20.REN Yuanyu,WEI Dongwei,WANG Zhongwei,ZHOU Yaping.Total flavonoids in maize seedlings before and after drought stress:Determination with sodium nitrite-aluminum nitrate colorimetry[J].Journal of Agriculture,2020,10(5):15-20.
[17] 张德,王双成,张仲兴,王延秀.盐胁迫对2 种抗性苹果砧木叶片生理及解剖结构的影响[J].果树学报,2021,38(8):1275-1284.ZHANG De,WANG Shuangcheng,ZHANG Zhongxing,WANG Yanxiu.Effects of salt stress on leaf physiology and anatomical structure of two resistant apple rootstocks[J].Journal of Fruit Science,2021,38(8):1275-1284.
[18] 闫淼,熊韬,黄全生,吴婷,吴海波,赵准,胡国智.外源水杨酸对单盐胁迫下哈密瓜叶片解剖结构的影响[J].新疆农业科学,2022,59(9):2123-2129.YAN Miao,XIONG Tao,HUANG Quansheng,WU Ting,WU Haibo,ZHAO Zhun,HU Guozhi.Effect of exogenous salicylic acid (SA) on the leaf anatomical structure of Hami melon under NaCl stress[J].Xinjiang Agricultural Sciences,2022,59(9):2123-2129.
[19] 周乃富.核桃芽接成活的组织学和转录调控机制研究[D].北京:中国林业科学研究院,2019.ZHOU Naifu.Histological and transcriptional regulation mechanisms of the survival of walnut bud grafting[D].Beijing:Chinese Academy of Forestry,2019.
[20] 张钰,陈慧,王改萍.外源ABA 对楸树幼苗NaCl 胁迫的缓解效应及其生长生理响应特征[J].西北植物学报,2023,43(6):996-1005.ZHANG Yu,CHEN Hui,WANG Gaiping.Alleviating effects of exogenous ABA on Catalpa bungei seedlings under NaCl stress and growth physiological response characteristics[J].Acta Botanica Boreali-Occidentalia Sinica,2023,43(6):996-1005.
[21] 郭雁君,吉前华,杜鹏飞,尚荷斌,钟雅玲.盐碱胁迫对砂糖橘叶片水分亏缺、气体交换及矿质元素微域分布的影响[J].果树学报,2022,39(6):1029-1041.GUO Yanjun,JI Qianhua,DU Pengfei,SHANG Hebin,ZHONG Yaling.Effect of saline-alkali stress on leaf water deficit,gas exchange and micro-distribution of eight mineral elements in Shatangju mandarin(Citrus reticulata)[J].Journal of Fruit Science,2022,39(6):1029-1041.
[22] YAO X C,MENG L F,ZHAO W L,MAO G L.Changes in the morphology traits,anatomical structure of the leaves and transcriptome in Lycium barbarum L.under salt stress[J].Frontiers in Plant Science,2023,14:1090366.
[23] 岑湘涛,沈伟,牛俊乐,吴伟兰.基于植物叶片解剖结构的抗逆性评价研究进展[J].北方园艺,2021(18):140-147.CEN Xiangtao,SHEN Wei,NIU Junle,WU Weilan.Research progress of stress resistance evaluation based on the anatomy of plant leaves[J].Northern Horticulture,2021(18):140-147.
[24] 郭林繁,毕春竹,宋振琪,王秀军,耿红凯,李子航,罗春燕,李庆卫.碱性盐胁迫对不同种源沙枣幼苗的生理影响[J].西北林学院学报,2023,38(4):51-60.GUO Linfan,BI Chunzhu,SONG Zhenqi,WANG Xiujun,GENG Hongkai,LI Zihang,LUO Chunyan,LI Qingwei.Physiological response of alkaline salt stress on Elaeagnus angustifolia seedlings from different provenances[J].Journal of Northwest Forestry University,2023,38(4):51-60.
[25] METWALLY R A,SOLIMAN S A.Alleviation of the adverse effects of NaCl stress on tomato seedlings (Solanum lycopersicum L.)by Trichoderma viride through the antioxidative defense system[J].Botanical Studies,2023,64(1):4.
[26] 王征宏,戴凌峰,赵威,郭秀璞,吕淑芳.盐胁迫对玉米根、芽主要渗透调节物质的影响[J].河南农业科学,2013,42(6):21-23.WANG Zhenghong,DAI Lingfeng,ZHAO Wei,GUO Xiupu,LÜ Shufang.Effects of salt stress on main osmotic adjustment substance in root and shoot of maize[J].Journal of Henan Agricultural Sciences,2013,42(6):21-23.
[27] 谢志明,宋刚,马刘峰,陈芸,方志刚.伽师瓜幼苗响应盐胁迫的生理特性及耐盐性评价[J].中国瓜菜,2023,36(10):42-51.XIE Zhiming,SONG Gang,MA Liufeng,CHEN Yun,FANG Zhigang.Physiological characteristics and salt tolerance evaluation of Jiashi melon seeding’s response to salt stress[J].China Cucurbits and Vegetables,2023,36(10):42-51.
[28] 蔡亚南.6 种园林植物的耐盐性研究[D].北京:北京林业大学,2020.CAI Yanan.Study on salt tolerance of six species of landscape plants[D].Beijing:Beijing Forestry University,2020.
[29] 刘行.金露梅耐盐生理特性研究[D].保定:河北农业大学,2009.LIU Hang.Study of salt stress on the physiological characteristics in Potentilla fruticosa L.[D].Baoding:Hebei Agricultural University,2009.
[30] 赵海燕.银杏幼树耐盐生理机制的研究[D].北京:北京林业大学,2020.ZHAO Haiyan.Physiological mechanism in salt tolerance of Ginkgo biloba L.seedling[D].Beijing:Beijing Forestry University,2020.
[31] 黄有军,王正加,郑炳松,黄胜利,吴家森,黄坚钦.盐胁迫下罗汉松生长和生理变化的研究[J].中南林业科技大学学报,2007,27(5):58-61.HUANG Youjun,WANG Zhengjia,ZHENG Bingsong,HUANG Shengli,WU Jiasen,HUANG Jianqin.Growth and physiological changes of Podocarpus macrophyllus under salt stress[J].Journal of Central South University of Forestry &Technology,2007,27(5):58-61.
[32] 陈泽平,史晓敏,王瑞,吴轩,王宁,王振平.盐胁迫下不同葡萄砧木的渗透调节及抗氧化能力[J].西北植物学报,2022,42(11):1880-1891.CHEN Zeping,SHI Xiaomin,WANG Rui,WU Xuan,WANG Ning,WANG Zhenping.Osmotic regulation and antioxidant capacity of different grapevine rootstocks under salt stress[J].Acta Botanica Boreali-Occidentalia Sinica,2022,42(11):1880-1891.
[33] 徐宠然,赵鑫,贾袭伟,王惠珍,曾翠云,陈红刚,杜弢.半夏对盐胁迫的生理生化响应及耐盐机理研究[J].中药材,2023,46(7):1617-1623.XU Chongran,ZHAO Xin,JIA Xiwei,WANG Huizhen,ZENG Cuiyun,CHEN Honggang,DU Tao.Physiological and biochemical responses of Pinellia ternata to salt stress and mechanism of salt tolerance[J].Journal of Chinese Medicinal Materials,2023,46(7):1617-1623.
[34] 李悦,蔡亚南,任安琦,韦淋馨,张钰晗,张若溪,李庆卫.盐碱胁迫对元宝枫幼苗生长和生理特性的影响[J].东北林业大学学报,2022,50(8):5-14.LI Yue,CAI Yanan,REN Anqi,WEI Linxin,ZHANG Yuhan,ZHANG Ruoxi,LI Qingwei.Effects of saline-alkali stress on growth and physiological characteristics of Acer truncatum seedlings[J].Journal of Northeast Forestry University,2022,50(8):5-14.
[35] CHIAPPERO J,DEL ROSARIO C L,SOSA ALDERETE L G,PALERMO T B,BANCHIO E.Plant growth promoting rhizobacteria improve the antioxidant status in Mentha piperita grown under drought stress leading to an enhancement of plant growth and total phenolic content[J].Industrial Crops and Products,2019,139:111553.
[36] SHARMA A,SHAHZAD B,REHMAN A,BHARDWAJ R,LANDI M,ZHENG B S.Response of phenylpropanoid pathway and the role of polyphenols in plants under abiotic stress[J].Molecules,2019,24(13):2452.
[37] LIM J H,PARK K J,KIM B K,JEONG J W,KIM H J.Effect of salinity stress on phenolic compounds and carotenoids in buckwheat(Fagopyrum esculentum M.)sprout[J].Food Chemistry,2012,135(3):1065-1070.
[38] 李娜娜,徐欣宇,刘东玲,郑宝江,张玉红.外源NO 对NaCl胁迫下菥蓂生理生化及次生代谢产物的响应[J].中国草地学报,2023,45(8):88-99.LI Nana,XU Xinyu,LIU Dongling,ZHENG Baojiang,ZHANG Yuhong.Effects of exogenous nitric oxide on physio-biochemistry characteristics and secondary metabolites of Thlaspi arvense under sodium chloride stress[J].Chinese Journal of Grassland,2023,45(8):88-99.
[39] LUNGOCI C,MOTRESCU I,FILIPOV F,RIMBU C M,JITAREANU C D,GHITAU C S,PUIU I,ROBU T.Salinity stress influences the main biochemical parameters of Nepeta racemosa Lam[J].Plants,2023,12(3):583.
[40] EL-BANNA M F,AL-HUQAIL A A,FAROUK S,BELAL B E A,EL-KENAWY M A,ABD EL-KHALEK A F.Morpho-physiological and anatomical alterations of salt-affected thompson seedless grapevine (Vitis vinifera L.) to brassinolide spraying[J].Horticulturae,2022,8(7):568.
[41] 张雷.青钱柳不同基因型对盐胁迫响应的生理及分子机制[D].南京:南京林业大学,2022.ZHANG Lei.Physiological and molecular mechanisms of different Cyclocarya paliurus genotypes in response to salt stress[D].Nanjing:Nanjing Forestry University,2022.
[42] 徐宁焘.盐胁迫对银杏幼苗生长及叶片类黄酮合成的影响[D].扬州:扬州大学,2021.XU Ningtao.The effects of salt stess on seedling development and flavonoid bisoysynthesis in Ginkgo biloba[D].Yangzhou:Yangzhou University,2021.
[43] 陈春晓,谢秀华,王宇鹏,李俊朋,信健,朱婷婷,刘静,陈敏.盐分和干旱对沙枣幼苗生理特性的影响[J].生态学报,2019,39(12):4540-4550.CHEN Chunxiao,XIE Xiuhua,WANG Yupeng,LI Junpeng,XIN Jian,ZHU Tingting,LIU Jing,CHEN Min.Effects of salt and drought on the physiological characteristics of Elaeagnus angustifolia L.seedlings[J].Acta Ecologica Sinica,2019,39(12):4540-4550.
[44] 胡爱双,张小栋,王文成,李凯超,孙宇.盐胁迫对不同耐盐性八棱海棠株系生理特性的影响[J].果树学报,2021,38(3):335-343.HU Aishuang,ZHANG Xiaodong,WANG Wencheng,LI Kaichao,SUN Yu.Effects of salt stress on physiological characteristics of two strains of Malus micromalus Mak.with different salt tolerance[J].Journal of Fruit Science,2021,38(3):335-343.
[45] 张焕仕,宰学明,陈洋,何河,马艳,隋德宗.海水胁迫对两种乌桕叶片保护系统的影响[J].中国野生植物资源,2022,41(11):29-34.ZHANG Huanshi,ZAI Xueming,CHEN Yang,HE He,MA Yan,SUI Dezong.Effects of seawater stress on two kinds of Sapium sebiferum (L.) Roxb.Leaf protection systems[J].Chinese Wild Plant Resources,2022,41(11):29-34.
[46] WANG H B,GUO J L,TIAN Z P,LI J,DENG L F,ZHENG Y,YUAN Y Z.Transcriptome profiling of mild-salt responses in Lycium ruthenicum early seedlings to reveal salinity-adaptive strategies[J].Acta Physiologiae Plantarum,2020,42(4):63.
[47] LI W N,RAO S P,DU C,LIU L P,DAI G L,CHEN J H.Strategies used by two goji species,Lycium ruthenicum and Lycium barbarum,to defend against salt stress[J].Scientia Horticulturae,2022,306:111430.
[48] 张娅,施树倩,李亚萍,高天鹏,杨颖丽.不同盐胁迫下小麦叶片渗透性调节和叶绿素荧光特性[J].应用生态学报,2021,32(12):4381-4390.ZHANG Ya,SHI Shuqian,LI Yaping,GAO Tianpeng,YANG Yingli.Osmotic regulation and chlorophyll fluorescence characteristics in leaves of wheat seedlings under different salt stresses[J].Chinese Journal of Applied Ecology,2021,32(12):4381-4390.
[49] 李海燕,邵金彩,王静,肖可,李庆卫.NaCl 胁迫对5 年生蜡梅生长及生理特性的影响[J].东北林业大学学报,2021,49(3):31-38.LI Haiyan,SHAO Jincai,WANG Jing,XIAO Ke,LI Qingwei.Effects of NaCl stress on the growth and physiological characteristics of five-year Chimonanthus praecox[J].Journal of Northeast Forestry University,2021,49(3):31-38.
[50] 李焕勇,杨秀艳,唐晓倩,张华新.NaCl 处理对小果白刺叶片主要渗透调节物质和激素水平的影响[J].东北林业大学学报,2019,47(5):30-35.LI Huanyong,YANG Xiuyan,TANG Xiaoqian,ZHANG Huaxin.Effects of NaCl stress on main osmoregulation substance and hormones contents of Nitraria sibirica Pall.leaves[J].Journal of Northeast Forestry University,2019,47(5):30-35.
[51] 高英,伍柳芬,刘昊,田翁由,甘超林,杨丽芳.盐胁迫下ABA对樱桃幼苗光合及生理特性的影响[J].天津农业科学,2023,29(3):8-13.GAO Ying,WU Liufen,LIU Hao,TIAN Wengyou,GAN Chaolin,YANG Lifang.Effects of ABA on photosynthetic and physiological characteristics of cherry seedlings under salt stress[J].Tianjin Agricultural Sciences,2023,29(3):8-13.
[52] 高明远,甘红豪,李清河,李斌,褚建民.外源水杨酸对盐胁迫下白榆生理特性的影响[J].林业科学研究,2018,31(6):138-143.GAO Mingyuan,GAN Honghao,LI Qinghe,LI Bin,CHU Jianmin.The effect of exogenous salicylic acid on the physiological characteristics of Ulmus pumila plantlet under NaCl stress[J].Forest Research,2018,31(6):138-143.
[53] 贾文飞,魏晓琼,聂小兰,王颖,李金英,吴林.盐碱胁迫对越橘生理特性及叶片解剖结构的影响[J].西北农林科技大学学报(自然科学版),2022,50(5):115-126.JIA Wenfei,WEI Xiaoqiong,NIE Xiaolan,WANG Ying,LI Jinying,WU Lin.Effects of saline-alkali stress on physiological characteristics and anatomic structure of blueberry leave[J].Journal of Northwest A &F University (Natural Science Edition),2022,50(5):115-126.
[54] 张瑞.垂丝海棠响应盐碱胁迫的生理特性及基于转录组学分析的MhPR1 功能基因验证[D].兰州:甘肃农业大学,2021.ZHANG Rui.Response of Malus halliana to saline-alkali stress and verification of MhPR1 functional based on transcriptomic[D].Lanzhou:Gansu Agricultural University,2021.
[55] BOUGHALLEB F,DENDEN M,BEN TIBA B.Anatomical changes induced by increasing NaCl salinity in three fodder shrubs,Nitraria retusa,Atriplex halimus and Medicago arborea[J].Acta Physiologiae Plantarum,2009,31(5):947-960.
[56] 张霞,孙旭春,钟小仙,杨杰,顾洪如,李晟.海盐胁迫下苏牧2号象草叶片解剖结构的适应性变化[J].江苏农业科学,2014,42(4):162-164.ZHANG Xia,SUN Xuchun,ZHONG Xiaoxian,YANG Jie,GU Hongru,LI Sheng.The adaptive changes of leaf anatomical structure of weevil sumu 2 under sea salt stress[J].Jiangsu Agricultural Sciences,2014,42(4):162-164.
[57] 罗达,吴正保,史彦江,宋锋惠.盐胁迫对3 种平欧杂种榛幼苗叶片解剖结构及离子吸收、运输与分配的影响[J].生态学报,2022,42(5):1876-1888.LUO Da,WU Zhengbao,SHI Yanjiang,SONG Fenghui.Effects of salt stress on leaf anatomical structure and ion absorption,transportation and distribution of three Ping’ou hybrid hazelnut seedlings[J].Acta Ecologica Sinica,2022,42(5):1876-1888.
[58] 卢倩倩.引入新疆的10 个鲜食葡萄品种苗期耐盐碱性初步研究[D].乌鲁木齐:新疆农业大学,2022.LU Qianqian.Preliminary study on saline-alkali tolerance of 10 table grape varieties introduced into Xinjiang at seedling stage[D].Urumqi:Xinjiang Agricultural University,2022.
[59] 韦存虚,张军,王建军,孙国荣.星星草营养器官适应盐胁迫的结构特征[J].植物资源与环境学报,2006,15(1):51-56.WEI Cunxu,ZHANG Jun,WANG Jianjun,SUN Guorong.Observation on structural characters of vegetative organs of Puccinellia tenuiflora under salt stress[J].Journal of Plant Resources and Environment,2006,15(1):51-56.
[60] DA SILVA B R S,LOBATO E M S G,DOS SANTOS L A,PEREIRA R M,BATISTA B L,ALYEMENI M N,AHMAD P,DA SILVA L A K.How different Na+concentrations affect anatomical,nutritional physiological,biochemical,and morphological aspects in soybean plants:A multidisciplinary and comparative approach[J].Agronomy,2023,13(1):232.
[61] CHANG Y L,FAN Y X,LI Z K,LV G H.Relationship between photosynthetic characteristics,anatomical structure,and physiological indexes of two halophytes in different habitats[J].Forests,2022,13(12):2189.
[62] IBRAHIM S,ABO-ELWAFA T.Alleviation harmful impacts of salinity using some antioxidants substances on Thompson seedless grapevines seedlings[J].Journal of Plant Production,2018,9(1):39-49.
[63] 毛桂莲,梁文裕,王盛,许兴,郑蕊,朱志明.碱性盐胁迫对宁夏枸杞生长、结构及光合参数的影响[J].干旱地区农业研究,2017,35(4):236-242.MAO Guilian,LIANG Wenyu,WANG Sheng,XU Xing,ZHENG Rui,ZHU Zhiming.Effects of alkali stress on growth,structure and photosynthetic parameters of Lycium barbarum L.[J].Agricultural Research in the Arid Areas,2017,35(4):236-242.
[64] 张般般,刘婷,杨静慧,刘艳军,武春霞,李冰.4 个树莓品种茎解剖结构与抗旱性的关系[J].西南大学学报(自然科学版),2018,40(5):53-58.ZHANG Banban,LIU Ting,YANG Jinghui,LIU Yanjun,WU Chunxia,LI Bing.The relationship between stem anatomical structure and drought resistance in 4 varieties of raspberry[J].Journal of Southwest University (Natural Science Edition),2018,40(5):53-58.
[65] 严子柱,满多清,李得禄.沙葱(Allium mongolicum)解剖结构与抗旱性[J].中国沙漠,2015,35(4):890-894.YAN Zizhu,MAN Duoqing,LI Delu.The relationship between drought-resistance and anatomical structure of Allium mongolicum’s vegetative organs[J].Journal of Desert Research,2015,35(4):890-894.
[66] 赵红梅,邓素芳,杨艳君,冀爱青,李洪燕.干旱胁迫对藜麦幼苗组织解剖结构和生理特性的影响[J].核农学报,2021,35(6):1476-1483.ZHAO Hongmei,DENG Sufang,YANG Yanjun,JI Aiqing,LI Hongyan.Effect of drought stress on anatomical structure and physiological characteristics of quinoa seedlings[J].Journal of Nuclear Agricultural Sciences,2021,35(6):1476-1483.
[67] 王跃,徐影,陆嘉惠.胀果甘草解剖结构对盐胁迫的响应及其适应研究[J].石河子大学学报(自然科学版),2021,39(3):335-340.WANG Yue,XU Ying,LU Jiahui.Anatomical response and adaptability of Glycyrrhiza inflata to salt stress[J].Journal of Shihezi University(Natural Science),2021,39(3):335-340.
[68] 江丹.盐胁迫下外源褪黑素对棉花幼苗形态结构及生理性状的调控效应[D].保定:河北农业大学,2021.JIANG Dan.Effects of exogenous melatonin on morphological structure and physiological traits of cotton seedlings under salt stress[D].Baoding:Hebei Agricultural University,2021.
[69] 於丽华,王宇光,康杰,杨瑞瑞,吕春华,耿贵.盐胁迫对甜菜植株显微结构影响的初步研究[J].中国农学通报,2018,34(34):14-19.YU Lihua,WANG Yuguang,KANG Jie,YANG Ruirui,LÜ Chunhua,GENG Gui.The microscopic structure of sugarbeet under salinity stress:A preliminary study[J].Chinese Agricultural Science Bulletin,2018,34(34):14-19.
[70] 陆嘉惠.三种药用甘草耐盐性及耐盐机制研究[D].石河子:石河子大学,2014.LU Jiahui.Salt tolerant mechanisms of three Glycyrrhiza species[D].Shihezi:Shihezi University,2014.
[71] 毛爽,周万里,杨帆,狄小琳,蔺吉祥,杨青杰.植物根系应答盐碱胁迫机理研究进展[J].浙江农业学报,2021,33(10):1991-2000.MAO Shuang,ZHOU Wanli,YANG Fan,DI Xiaolin,LIN Jixiang,YANG Qingjie.Research progress on mechanism of plant roots response to salt-alkali stress[J].Acta Agriculturae Zhejiangensis,2021,33(10):1991-2000.
[72] 田晨霞,张咏梅,王凯,张万.紫花苜蓿组织解剖结构对NaHCO3盐碱胁迫的响应[J].草业学报,2014,23(5):133-142.TIAN Chenxia,ZHANG Yongmei,WANG Kai,ZHANG Wan.The anatomical structure responses in alfalfa to salinity-alkalinity stress of NaHCO3[J].Acta Prataculturae Sinica,2014,23(5):133-142.
[73] CIPRIANO R,MARTINS J P R,CONDE L T,DA SILVA M M,SILVA D M,GONTIJO A B P L,FALQUETO A R.Anatomical and physiological responses of Aechmea blanchetiana (Bromeliaceae) induced by silicon and sodium chloride stress during in vitro culture[J].PeerJ,2023,11:e14624.
[74] TERLETSKAYA N,DUISENBAYEVA U,RYSBEKOVA A,KURMANBAYEVA M,BLAVACHINSKAYA I.Architectural traits in response to salinity of wheat primary roots[J].Acta Physiologiae Plantarum,2019,41(9):157.
[75] 梁培鑫.混合盐碱胁迫对油莎豆生长发育及离子吸收的影响[D].石河子:石河子大学,2022.LIANG Peixin.Effect of mixed salinity stress on growth and ion absorption of Cyperus esculentus L.[D].Shihezi:Shihezi University,2022.
[76] 肖雯,张振霞,贾恢先.几种盐地植物根解剖结构的研究[J].甘肃农业大学学报,1998,33(1):90-93.XIAO Wen,ZHANG Zhenxia,JIA Huixian.Study on root anatomic structure of some halophytes[J].Journal of Gansu Agricultural University,1998,33(1):90-93.
[77] 侯江涛,高启明,克热木·伊力.NaCl 胁迫对两种扁桃幼苗根系K+、Na+、Cl-含量和超微结构的影响[J].北方园艺,2014(23):1-5.HOU Jiangtao,GAO Qiming,Karim·Ali.Effect of salt stress on the content of K+,Na+,Cl-and variations of ultra structures in roots of two species of Amygdalus communis L.[J].Northern Horticulture,2014(23):1-5.
[78] 万长贵,邹琇莹.碱茅草耐盐和脱盐机理初探[J].草业科学,1990,7(3):3-8.WAN Changgui,ZOU Xiuying.A study on salt tolerance of Puccinellia chinampoensis and its’desalinizing effect on the soil[J].Pratacultural Science,1990,7(3):3-8.