西北黄土高原作为典型的雨养农业区,因具有适宜的海拔、温度、光照等条件,成为我国苹果最大优势产区之一[1]。盐胁迫抑制植物生长发育,是对园艺作物最具破坏性的非生物威胁之一。据联合国粮农组织统计,全球范围内,4500万hm2耕种土地已经受到盐胁迫的破坏[2],导致苹果受到盐碱胁迫危害,盐碱胁迫已成为制约西北地区苹果高质量种植和规模化发展的重要影响因子。前人研究发现,盐碱胁迫可导致植物生长发育缓慢,渗透调节系统失衡,活性氧(ROS)和有毒代谢物产生,从而导致细胞,甚至整个植物死亡[3]。Yan等[4]发现盐碱胁迫可提高植物的丙二醛(MDA)含量、ROS含量,造成氧化损伤。也有研究发现,鲜质量和净光合速率(Pn)在不同浓度盐胁迫下受到的抑制作用显著[5]。盐碱胁迫下,苹果植株细胞内光合色素含量、叶绿体的超微结构、胞间二氧化碳浓度(Ci)以及气孔导度(Gs)等均发生变化,进而导致光合受阻、光合速率降低[6]。大量研究表明,外源物质(如一氧化氮[7]、有机酸[8]和褪黑素[9])可通过调节光合特性、渗透作用、离子分布及活性氧代谢等多种生理机制,以缓解盐碱胁迫对植物造成的伤害。因此,筛选适宜缓解胁迫的外源物质对西北黄土高原干旱地区苹果生产具有重要意义。
柠檬酸是绝大多数植物都会分泌的一种天然化合物,主要存在于末端氧化代谢系统中,该系统也被称为Krebs循环、三羧酸循环或柠檬酸循环[10]。研究表明,外源喷施柠檬酸(CA)可显著提高干旱下中国石竹幼苗过氧化氢酶活性[11]。靳琇等[12]发现柠檬酸可缓解低磷胁迫对番茄造成的氧化损伤,提高磷素吸收率,维持正常生长代谢,从而增强番茄幼苗对低磷胁迫的抵抗能力。闫峰等[13]发现柠檬酸处理能有效减缓低温胁迫下小叶藜可溶性蛋白(SP)、可溶性糖(SS)的损失。杨洪兵等[14]对荞麦的研究表明,外源柠檬酸能显著增强荞麦叶片超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性,从而提高荞麦抵抗盐胁迫的能力。也有研究表明,外源喷施柠檬酸能有效缓解盐碱胁迫下水稻幼苗根系中铝毒对作物生理特性、生长发育等方面的影响[15]。近些年,外源柠檬酸在增强果树抗盐碱能力方面的研究较少,且以单一中性盐或碱性盐研究为主,对于盐碱胁迫的研究极为鲜见。
M9-T337 作为我国新引进的苹果矮化砧木,近几年在西北产区应用广泛[16],因此笔者在本试验中以1 年实生苗M9-T337 为试验材料,探讨盐碱胁迫下喷施不同浓度CA对M9-T337实生苗生理特性的影响,旨在筛选出缓解盐碱胁迫对M9-T337伤害的最适CA 浓度,以期为西北产区利用生化手段调控作物耐受性提供理论依据。
1 材料和方法
1.1 材料及试验处理
试验于2023 年4—8 月在甘肃农业大学避雨棚(E 103°34′,N 36°10′)中进行,选取生长一致的1 年生M9-T337营养系自根砧苗80株,移入3.5 kg盛装基质(20%蛭石,20%珍珠岩,60%泥炭)、质量为0.65 kg的花盆(内径25 cm,深38 cm)中,每盆1株,并置于甘肃农业大学园艺学院避雨棚中进行统一管理30 d。定期除草,浇水。
筛选盐碱(nNaCl∶nNaHCO3=1∶1)浓度:分别设置100、150、200和250 mmol·L-1盐碱浓度,从植株萎蔫状态及叶片的黄化程度筛选适宜的浓度。
以200 mmol·L-1 NaCl+NaHCO3溶液为盐碱胁迫,设置6 个处理,即清水浇灌(CK1)、盐碱胁迫(CK2)、盐碱胁迫+0.2 mmol·L-1 CA(T1)、盐碱胁迫+0.6 mmol·L-1 CA(T2)、盐碱胁迫+1.0 mmol·L-1 CA(T3)、盐碱胁迫+1.4 mmol·L-1 CA(T4)。CK2-T4处理每天浇50 mL盐碱溶液,CK1浇清水,共浇灌3 d。盐碱胁迫3 d 后,T1~T4处理于每日08:00—09:00进行喷施相应浓度的CA 溶液,直至叶片滴水为止。CK1和CK2处理每天喷50 mL蒸馏水,每隔3 d喷施1次,共喷施3次。
1.2 测定指标及方法
1.2.1 光合参数、叶绿素荧光参数及叶绿素含量的测定 胁迫至45 d,选取M9-T337的功能叶片,采用LI-6400(LI-COR,Lincoln,NE,USA)便携式光合仪于当日09:00左右开始测定植物气体交换参数,测定净光合速率(Pn)、蒸腾速率(Tr)、胞间二氧化碳浓度(Ci)、气孔导度(Gs),3 次重复。光合仪系统控制叶片温度25 ℃,测定系统采用开放式气路,叶室内空气流量设定为500 mL·min-1,室内二氧化碳体积分数为(385±10)μL·L-1。
采用IMAGING-PAM叶绿素荧光仪和Imaging-WinGegE软件(Walz,Effeltrich,德国)测定初始荧光(F0),最大光化学效率(Fm),PSⅡ最大光能转化率(Fv/Fm),光化学猝灭系数(qP)。参考《植物生理学实验指导》测定叶绿素含量[17]。
1.2.2 相对电导率的测定 相对电导率(REC)采用电导法测定[18]。
1.2.3 叶片相对含水量的测定 胁迫至45 d,将M9-T337 叶片从植株上分离下来,称取叶片质量后装入叠好的纸袋,105 ℃下杀青1 h。后在80 ℃下烘干至恒质量后再进行称质量。根据计算公式计算:叶片含水量(WC)/%=(第一次称质量-第二次称质量)/叶片鲜质量×100。
1.2.4 根系活力和根鲜质量比的测定 将M9-T337根系剪下洗净,滤纸吸干水分,称取0.5 g 的根尖组织,用氯化三苯基四氮唑(TTC)法测定根系活力[19];根据壮苗指数计算公式计算:壮苗指数/%=(根干质量/根鲜质量)×100。
1.2.5 抗氧化酶活性、渗透调节物质含量的测定采用氮蓝四唑光化还原法测定SOD活性[20];采用愈创木酚法测定POD 活性[20];参照高俊凤[22《]植物生理学实验指导》,方法略作修改,测定CAT 活性;用硫代巴比妥酸(thiobarbituric acid,TBA)比色法测定MDA 含量[21]。游离脯氨酸(Pro)含量采用酸性茚三酮法测定[22]。采用蒽酮比色法测定SS 含量,采用考马斯亮蓝(G-250)法测定SP 含量[23]。过氧化氢和超氧阴离子染色采用DAB和NBT进行组织染色。
1.2.6 Na+、K+含量的测定 Na+、K+含量的测定采用火焰分光光度计法[23]。
1.2.7 活性氧含量的测定 使用苏州科铭生物技术有限公司试剂盒测定超氧阴离子(O2-)和过氧化氢(H2O2)含量。H2O2含量测定在415 nm的吸光值,用标准曲线推出对应H2O2浓度;O2-含量测定在530 nm处的吸光度,用线性NaNO3标准曲线得出O2-浓度;代入对应公式计算H2O2和O2-的含量。
1.2.8 荧光定量的测定 盐碱胁迫对植物的伤害主要集中于渗透脱水、离子毒害、ROS 以及高pH 伤害等方面。而关键基因或转录因子能通过调节渗透调节物质含量、Na+和K+转运、抗氧化酶活性和诱导植物激素信号转导过程来响应盐碱胁迫。因此,选择参与编码K+转运基因(MdSKOR 和MdNHX4)、Na+转运基因(MdCHX15 和MdSOS1)、抗氧化酶基因(MdSOD、MdPOD 和MdCAT),逆向转运蛋白/通道离子的离子转运相关基因(MdALT1),柠檬酸合成酶相关基因(MdCS2),H+-ATPase 相关基因(MdAHA2、MdAHA4 和MdAHA8)以及关键转录因子(MdWRKY64、MdMYB108 和MdERF11)进行qRT-PCR。
以GDAPDH 为内参基因,利用Roche 的Light Cycler®96 Instrument PCR 仪进行PCR 反应,引物见表1。Real-time PCR 扩增体系为:2×SYBR®Premix Ex TaqTMⅡ10 μL,10 μmol·L-1上游引物1 μL,10 μmol·L-1 下游引物0.8 μL,cDNA 模板2 μL,ddH2O 6 μL。扩增程序为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,循环40次,3次重复。采用2-ΔΔCT法对定量所得数据进行分析。
表1 qRT-PCR 所用的引物序列
Table 1 Primer sequences for qRT-PCR

1.3 数据处理
运用Excel 2018 整理统计数据,使用软件SPSS22.0 分析数据,使用软件Origin 2018 作图,采用单因素ANOVA 的Duncan 法进行多重比较,差异显著水平为0.05。
2 结果与分析
2.1 不同盐碱浓度M9-T337实生苗表型
由图1可知,100 mmol·L-1和150 mmol·L-1的盐碱浓度对M9-T337 实生苗影响较小,200 mmol·L-1处理后出现明显黄化并开始萎蔫,250 mmol·L-1处理后植物萎蔫现象严重,甚至死亡。因此,选用200 mmol·L-1浓度的盐碱胁迫对M9-T337 植株进行后续盐碱胁迫处理。

图1 不同盐碱浓度对M9-T337 营养系自根砧苗表型的影响
Fig.1 The phenotype of M9-T337 clones of root anvil with different saline-alkali concentrations
2.2 外源CA 对盐碱胁迫下M9-T337 营养系自根砧苗生长表型及根系形态参数的影响
200 mmol·L-1浓度的盐碱胁迫至45 d,均出现不同程度的黄化现象(图2)。随CA浓度的增加,黄化现象均有所缓解,其中T3减缓效果最为显著。

图2 外源CA 对盐碱胁迫下M9-T337 营养系自根砧苗生长表型的影响
Fig.2 Effect of exogenous CA on the growth phenotype of M9-T337 clones of root anvil under saline-alkali stress
表2 和图3 结果显示,盐碱胁迫下,M9-T337 营养系自根砧苗的总根长、根系平均直径、总根表面积、总根体积、根尖数、根鲜质量比和根系活力相较于CK1 显著降低。施加外源CA 后,各指标均呈现不同程度的提升,其中,T3 效果最佳,分别增加了32.11%、17.64%、26.98%、82.10%、71.00%、25.93%、71.68%。说明盐碱胁迫下,添加适宜浓度的外源CA能够促进根系的形态建成。

图3 外源CA 对复合盐碱胁迫下M9-T337 营养系自根砧苗根系形态的影响
Fig.3 Effect of exogenous CA on root morphology of M9-T337 clones of root anvil under combined salt and alkali stress
表2 外源CA 对复合盐碱胁迫下M9-T337 总根长、总根表面积、根系平均直径、总根体积、根尖数、根鲜质量比和根系活力的影响
Table 2 Effects of exogenous CA on total root length,total root surface area,average root diameter,total root volume,number of root tips,root fresh-mass ratio and root activity of M9-T337 under combined salt-alkali stress
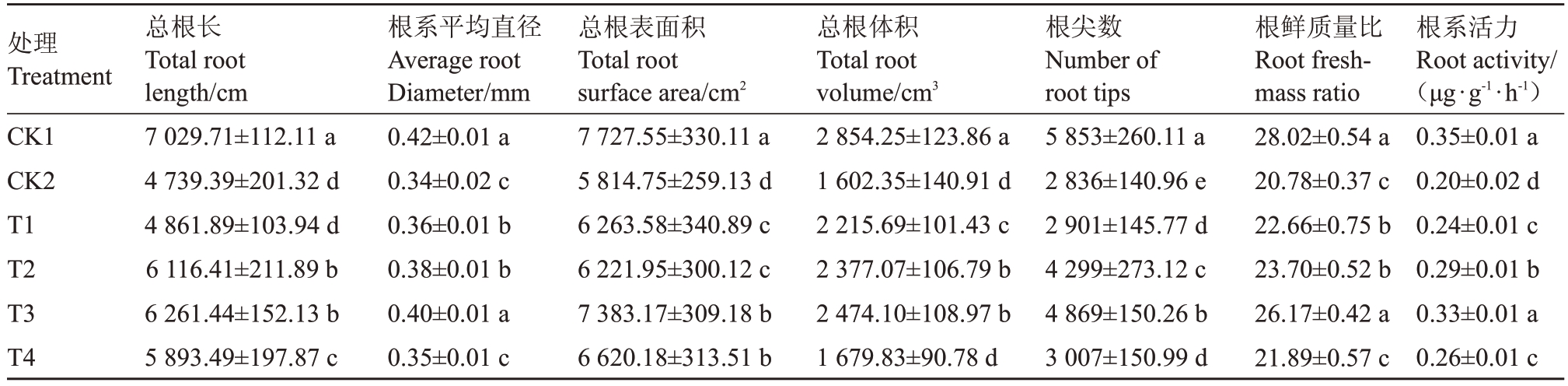
注:不同小写字母表示不同处理下M9-T337 在p<0.05 水平差异显著。
Note:Different small letters indicate significant differences at p<0.05 for M9-T337 under different treatments.
2.3 外源CA 对盐碱胁迫下M9-T337 叶片光合特性及叶绿素荧光参数的影响
由图4-A、B、C 可知,盐碱胁迫下(CK2),M9-T337 实生苗叶片的Pn、Gs、Tr 较CK1 分别降低了170.00%、200.00%、145.16%,而Ci显著提高,较CK1提高了63.22%。添加外源CA处理后,T1~T4的Pn、Gs、Tr均显著高于CK2,显著低于CK1。其中T3 相较于CK2 上升幅度最大,分别较CK2 提升了76.92%、78.57%、58.33%。可见,胁迫下外施CA 处理可提高M9-T337营养系自根砧苗功能叶片的Pn、Gs、Tr,使气孔开放。由图4-E、G、H 可得,盐碱胁迫下,T1~T4 的F0、PSⅡ、qP 均显著低于CK1,显著高于CK2(p<0.05)。由图4-F 可知,处理T1、T2和T4的Fm显著低于CK1。T1~T4 中,T3 各指标值最高,较CK2 分别升高了199.37%、323.81%、307.41%、95.16%。
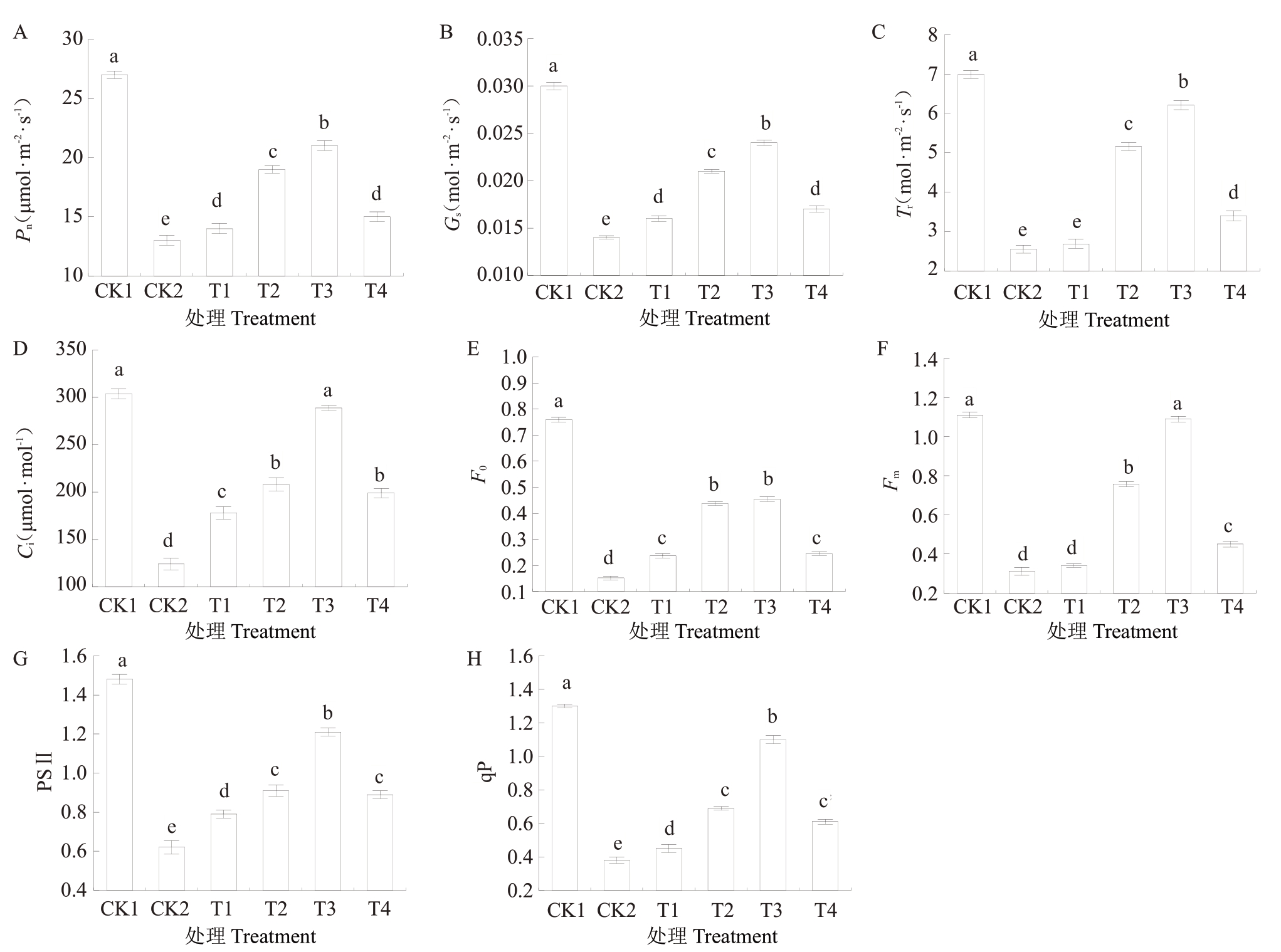
图4 外源CA 对盐碱胁迫下M9-T337 叶片光合特性及叶绿素荧光参数的影响
Fig.4 Effects of exogenous CA on leaf photosynthetic characteristics and chlorophyll fluorescence parameters of M9-T337 under saline-alkali stress
2.4 外源CA 对盐碱胁迫下M9-T337 营养系自根砧苗叶绿素含量的影响
由图5-A 可知,随着CA 浓度的增加,各处理的Chl a含量呈先上升后下降趋势。其中,各处理分别为3.86 mg·g-(1T1)、6.68 mg·g-(1T2)、7.91 mg·g-1(T3)、3.60 mg·g(-1T4),显著高于CK2(3.91 mg·g-1),低于CK1(11.86 mg·g-1)。其中,T3处理下降幅度最小,为CK2的49.43%。

图5 外源CA 对盐碱胁迫下M9-T337 营养系自根砧苗光合色素含量的影响
Fig.5 Effect of exogenous CA on photosynthetic pigment contents of M9-T337 clones of root anvil under saline-alkali stress
从图5-B可知,随CA浓度的增加,Chl b含量呈先上升后下降的趋势。在CA处理下,T1~T4各处理显著低于CK1(44.31 mg·g-1),高于CK2(14.00 mg·g-1),其中,T3处理升幅最大,为CK2的58.82%。
从图5-C可知,在盐碱胁迫下,各处理的Chl a+b变化趋势及含量与Chl b 相似,显著低于CK1(55.86 mg·g-1),较CK1 降低59.41%,CA 处理下,其中T3的Chl a+b含量降幅最小。
图5-D 显示,随CA 浓度的增加,M9-T337 叶片的Chl a/b呈先上升后下降的变化趋势,有显著的浓度效应。CA浓度处理下T3的Chla/b含量达最高值,T1~T4叶片的Chl a/b含量显著高于CK(23.15 mg·g-1),其中T3较CK2提高46.98%。
2.5 外源CA 对盐碱胁迫下M9-T337 叶片相对电导率及叶片相对含水量的影响
由图6-A 可得,随着CA 浓度的增加,M9-T337叶片相对电导率呈先降后升的趋势,与CK2 相比,T3处理降至最低,比CK2降低47.42%。

图6 外源CA 对盐碱胁迫下M9-T337 叶片相对电导率及叶片相对含水量的影响
Fig.6 Effects of exogenous CA on the relative electrical conductivity and water content of M9-T337 leaves under saline-alkali stress
由图6-B可以看出,随CA浓度的增加,CK2-T4的叶片相对含水量呈先升后降的趋势,显著低于CK1;其中T3 升幅最显著,较CK2 提高50.91%。由此可得,CA 可减缓盐碱胁迫对植物造成的伤害。
2.6 外源CA 对盐碱胁迫下M9-T337 植株活性氧含量及抗氧化酶活性的影响
由图7 可知,CK1 处理下叶片的深棕色和蓝色聚合物明显少于CK2 处理,各处理染色程度均比CK2 处理轻。CK1 和T3 处理的叶片在染色程度上接近,无明显差异,说明盐碱胁迫虽加深了M9-T337叶片中的染色程度,但外施CA可缓解盐碱胁迫,减轻染色程度,抑制叶片中活性氧的积累。这与H2O2和O2-含量测定结果相一致。

图7 外源CA 对盐碱胁迫下M9-T337 营养系自根砧苗活性氧及抗氧化酶活性的染色程度
Fig.7 Staining of reactive oxygen species and antioxidant enzyme activities by exogenous CA in M9-T337 clones of root anvil under saline-alkali stress
图8表明,盐碱胁迫下,M9-T337实生苗植株中POD、CAT活性和SOD活性显著降低,外源施加CA可显著提高其活性,其中T3相较于CK2上升幅度最大,SOD、POD和CAT活性上升幅度分别为33.86%、35.71%、12.00%。以上结果表明,外源CA可以通过调节SOD、POD和CAT的活性缓解M9-T337实生苗植株受到的氧化损伤。
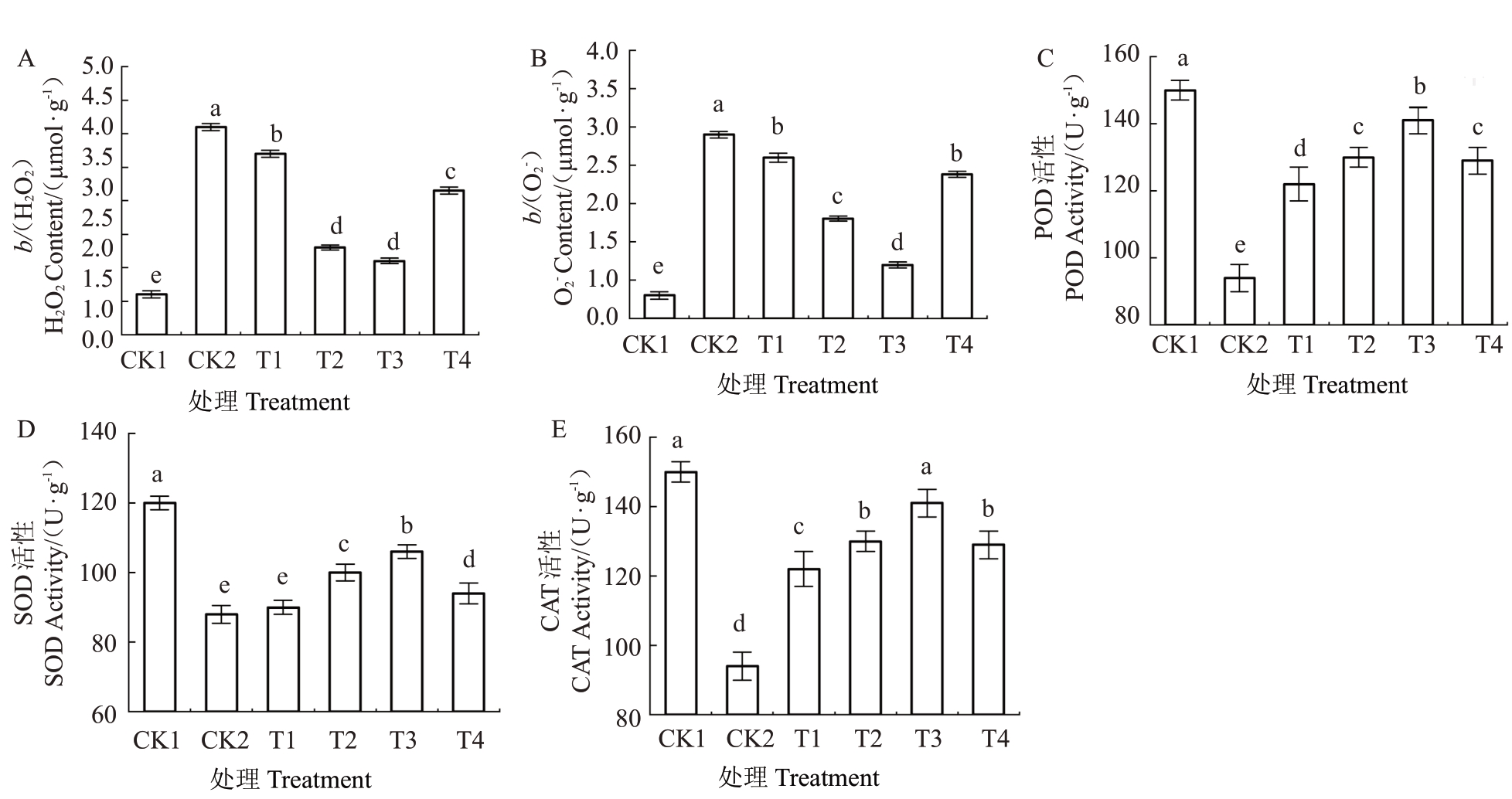
图8 外源CA 对盐碱胁迫下M9-T337 营养系自根砧苗活性氧含量及抗氧化酶活性的影响
Fig.8 Effects of exogenous CA on active oxygen content and antioxidant enzyme activity of M9-T337 clones of root anvil under saline-alkali stress
2.7 外源CA 对盐碱胁迫下M9-T337 幼苗植株渗透物质含量的影响
随CA浓度增加,SS、SP和Pro含量均呈先上升后下降的变化趋势(图9-A~C)。SS 含量分别为1.90 mg·g-1(CK2),1.92 mg·g-1(T1)、2.19 mg·g-1(T2)、2.71 mg·g-1(T3)、2.06 mg·g-1(T4),T3相较于CK2上升幅度最大,为42.6%(图9-A)。此外,SP 和Pro 含量也有类似的结果,T3 较CK2 分别升高了172.22%(图9-B)、72.97%(图9-C)。
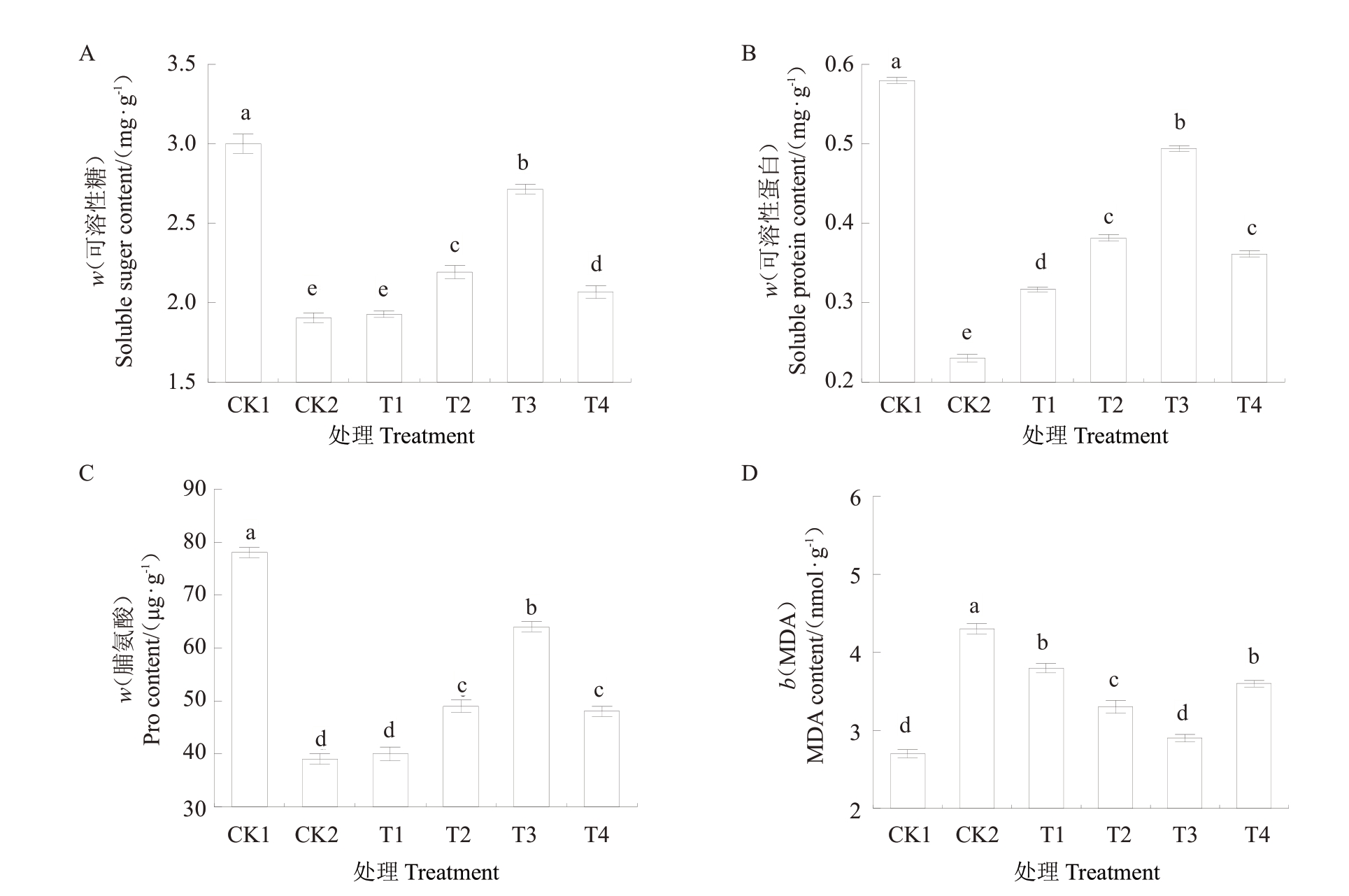
图9 外源CA 对复合盐碱胁迫下M9-T337 营养系自根砧苗叶片可溶性糖(A)、可溶性蛋白(B)、脯氨酸(C)和MDA(D)含量的影响
Fig.9 Effect of exogenous CA on soluble sugars(A),soluble proteins(B),proline(C)and MDA(D)contents of leaves of M9-T337 clones of root anvil under combined saline-alkali stress
随CA 浓度的增加,MDA 含量呈先降后升的变化趋势。外施CA 处理后,T1~T4 的MDA 含量均显著低于CK1,且显著高于CK2,其中T3 相较于CK2下降幅度最大,比盐碱胁迫处理下降69.56%(图9-D)。以上结果表明,外源施加柠檬酸可显著缓解植株在盐碱胁迫下受到的氧化损伤。
2.8 外源CA 对盐碱胁迫下M9-T337 营养系自根砧苗Na+、K+含量的影响
图10-A可得,T1、T2、T4的Na+含量均显著高于CK1,T3 与CK1 无显著差异,T1~T4 显著低于CK2。其中T3相较于CK1上升幅度最小(57.21%);T1~T4的K+含量均显著低于CK1(图10-B),显著高于CK2,其中T3 较CK1 的下降幅度最小,较CK1 降低了16.10%。
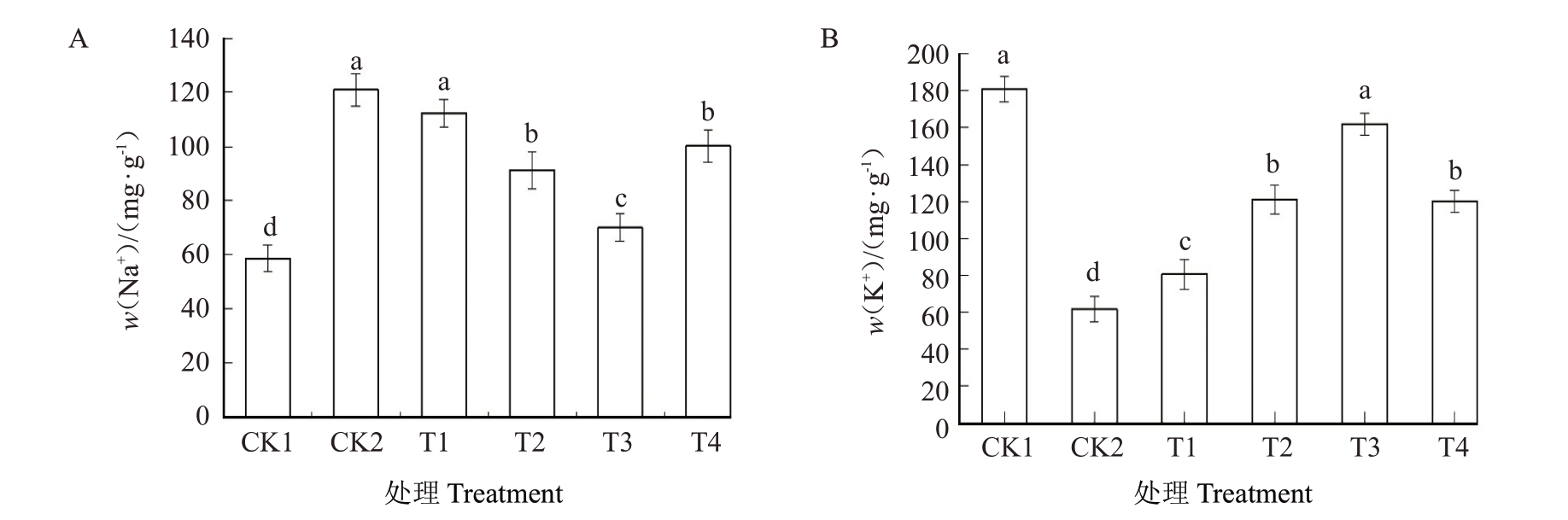
图10 外源CA 对盐碱胁迫下M9-T337 营养系自根砧苗中Na+、K+含量影响
Fig.10 Effect of exogenous CA on Na+and K+contents in M9-T337 clones of root anvil under saline-alkali stress
2.9 外源CA 对M9-T337 营养系自根砧苗植株盐碱胁迫应答基因表达的影响
盐碱处理和盐碱+CA 处理后,挑选出15 个应答盐碱胁迫的基因进行表达水平检测。从图11 中可以看出,K+转运基因(MdSKOR1 和MdNHX4)表达量受盐碱胁迫显著诱导,而盐碱+CA 处理,MdSKOR1 基因的表达量下降,MdNHX4 基因的表达量上升。相反,在盐碱胁迫下,两个Na+转运基因Md-CHX15 和MdSOS1 的表达量下降,而盐碱+CA 处理显著上调这两个基因的表达。另外,盐碱胁迫可显著诱导抗氧化酶基因MdSOD、MdPOD 和MdCAT的表达,添加CA 处理MdCAT 的表达显著受抑。MdWRKY64、MdMYB108 和MdERF11 在盐碱胁迫下转录因子的表达量下降,而盐碱+CA 处理显著上调这3 个基因的表达。同时,发现MdAHA2 和MdAHA8 等2 个H+-ATPase 相关基因在盐碱胁迫下表达量显著降低,柠檬酸合成酶相关基因MdCS2的表达量显著升高。因此,外施CA 其表达量均显著提高。
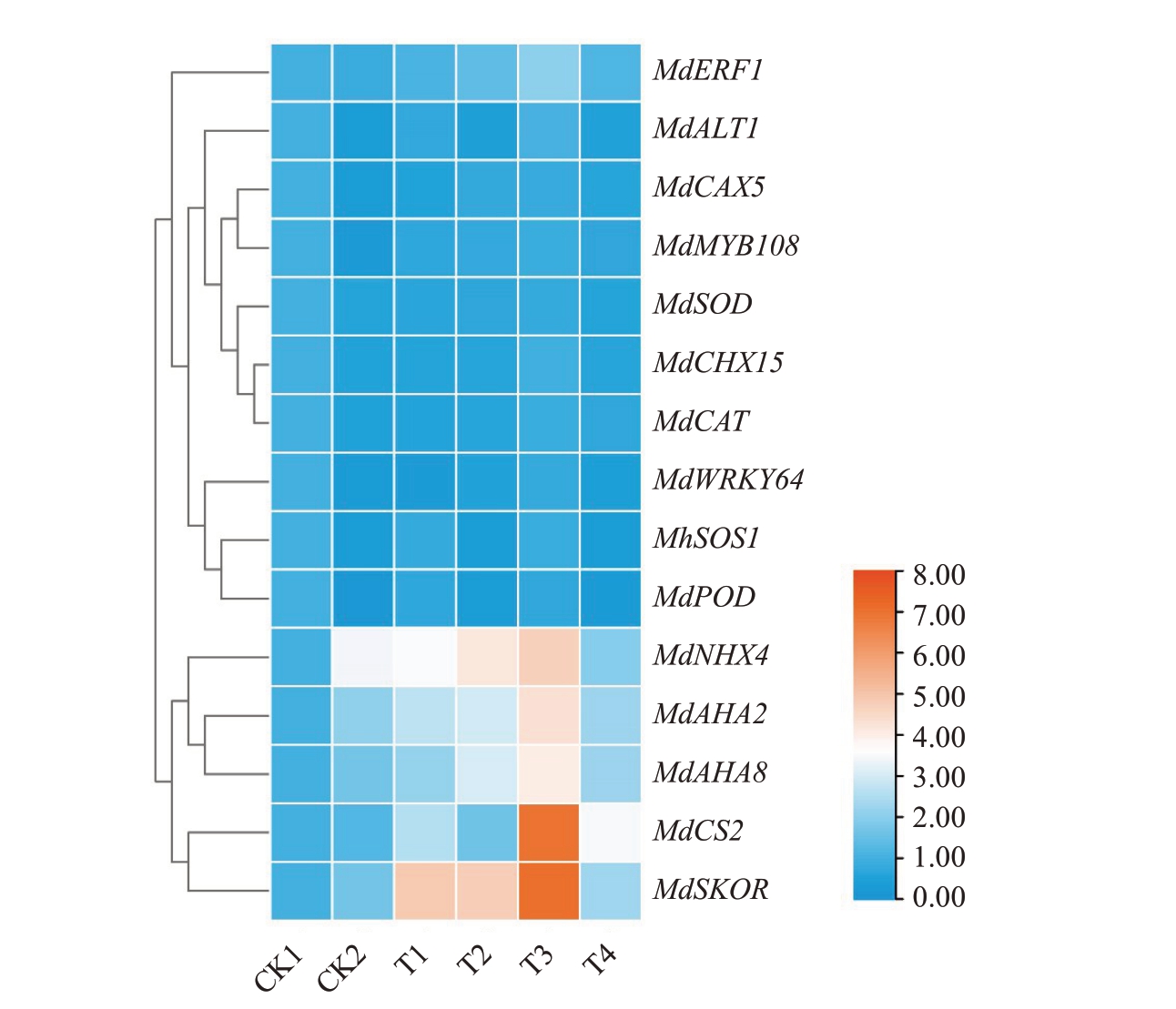
图11 外源CA 对M9-T337 营养系自根砧苗盐碱胁迫应答基因表达的影响
Fig.11 Effect of exogenous CA on the expression of saline-alkali response genes in M9-T337 clones of root anvil
2.10 外源CA对盐碱胁迫下M9-T337营养系自根砧苗综合评价
为评价CA 响应盐碱胁迫下苹果砧木M9-T337的生理效应,将盐碱胁迫后M9-T337的叶片所有指标进行主成分分析,分析结果如下,提取特征值大于1 的2 个主成分,其特征值为23.249 和1.175(表3),第1 和第2 主成分的方差贡献率分别为92.998%和4.702%,累计方差贡献率达97.700%,符合分析要求。综合得分(F)为每个主成分得分与对应贡献率之和。由表4可知,不同处理下的得分排名为:CK1>T3>T2>T4>T1>CK2。
表3 主成分分析方差解释
Table 3 Variance interpretation of principal component analysis
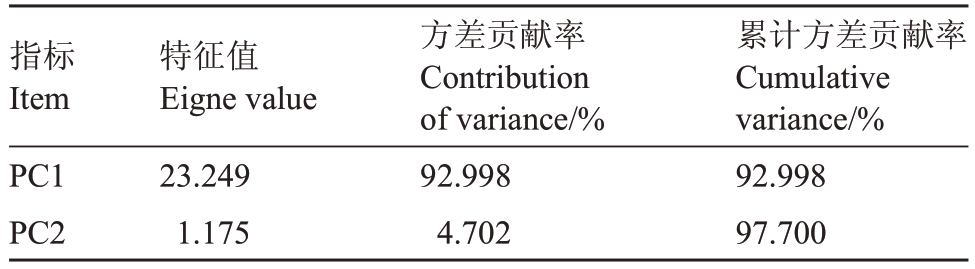
表4 不同处理的综合得分及排名
Table 4 Comprehensive scores and rankings of different treatments
3 讨论
0.05 %柠檬酸喷施处理下柠檬的单果质量与产量均为最高,瓦伦西亚橙的最适浓度则为0.1%[24],而400 mg·kg-1柠檬酸喷施可显著促进脐橙叶片生长与单株产量增加。邵微等[25]提出5%柠檬酸、草酸与氮磷钾配施均可增加梨的单果质量,显著提高红宝石梨产量。而柠檬酸喷施最佳的浓度与果树的树种密切相关。
盐碱胁迫严重影响着植物的生长发育过程,生理指标可作为衡量植物抗盐碱能力强弱的重要指标[26]。光合色素是植物在光合作用中参与吸收、传递光能或引起原初反应的光化学色素[27]。本研究结果表明,外源CA 处理可显著提高M9-T337 实生苗叶片的Pn、Gs、Tr,降低Ci,这与李峻安[28]试验结果一致,可能是外源柠檬酸可促进叶片光合电子的转递,升高光合过程关键酶活性[29]。叶绿素荧光参数作为光合诱导的探针,能够快速无损地检测PSⅡ光系统对逆境的响应机制,间接反映光合作用的光能吸收传递情况和光合诱导能量的利用耗散过程[30]。在本试验中,喷施CA 后,F0、Fm、PSⅡ、qP 均显著高于盐碱胁迫,说明外源CA 对盐碱胁迫下各处理对植株的光合作用有显著的促进作用,这与吴雪霞等[31]在番茄幼苗上外喷NO的研究结果一致。根系是植物吸收水分、传输养分和贮存有机物质的器官,其活力与植物生长发育、形态建成和新陈代谢等生长生理活动密切相关[32]。笔者在本研究中发现,盐碱胁迫下,外源CA 明显提高了植株的根长、根表面积、根体积、根系平均直径、根尖数等参数值,这与柠檬酸对Pb 胁迫下马蔺根试验结果类似[33]。这说明有机酸可以有效减缓盐碱胁迫对植株的伤害。
适宜水平的Pro、MDA、SS 和SP 等渗透调节物质可以调节植物免受外界的胁迫伤害[34]。笔者在本研究中发现,喷施CA,各处理叶片的Pro、MDA、SS和SP 含量均有所提高。史智勇等[35]对库尔勒香梨喷施外源过氧化氢,果皮可溶性糖、淀粉等渗透调节物质含量也显著增加,本研究与其过氧化氢效果一致。植物在应对各种逆境胁迫的过程中,细胞内活性氧代谢的平衡被破坏[36],增加活性氧的积累,而ROS 积累会启动或加剧膜脂质过氧化的危害[37-38],造成细胞代谢紊乱,这可能导致细胞膜系统的损害,严重情况下致使植物体死亡。张林[39]在复合盐碱胁迫对百合影响的研究中得出盐碱地栽培苗期的樟子松生成ROS 从而抑制生长的结论。笔者在本研究中发现,外源施加CA 后明显抑制盐碱胁迫下M9-T337实生苗ROS的上升,H2O2和O2-含量显著减少,这可能与植物的氧化应激防御有关,清除大量过氧化物来保护植物免受氧化损伤。
在植物衰老和抗性生理研究中,REC 和MDA含量能够代表细胞膜脂过氧化程度,两者均加剧细胞膜损伤,间接反映植物组织抗氧化能力强弱[40]。杨雨华等[41]研究发现,盐碱胁迫会导致百合幼苗REC和MDA含量上升,抑制其正常的生长发育,这与本试验结果相互印证,即盐碱处理下M9-T337幼苗REC和MDA 含量的增加,造成细胞的氧化损伤,而外源CA 显著缓解盐碱胁迫的危害,抑制叶片中REC 和MDA 含量的增幅水平,降低细胞膜通透性,减轻膜的损伤,从而提高M9-T337幼苗的抗氧化能力。
盐碱胁迫会对植物产生离子毒害,大量的Na+进入细胞质中,造成细胞质中Na+/K+失衡,引起离子毒害[42-43]。笔者在本研究中发现,盐碱胁迫下M9-T337 植株体内Na+/K+含量显著升高,而外源CA 可使其显著降低。吴鹏等[44]在黄瓜幼苗上的研究结果也进一步佐证了本文观点,可能是由于高浓度的Na+会抑制K+的吸收,进而导致植物枯萎死亡。SKOR是定位在质膜上负责K+外排的基因,而NHX4是定位在液泡膜上负责K+液泡区隔化的关键基因[45]。外源施加CA可显著抑制盐碱胁迫下的MdSKOR 的表达和促进MdNHX4 的表达,表明CA 可以通过抑制K+外排和促进K+的液泡区隔化,使更多K+留在细胞质中,维持盐碱胁迫下细胞质中的Na+/K+平衡,这与前人的研究结果相吻合。此外,SOS途径是植物应答盐胁迫最重要的途径之一[46],SOS1是定位在质膜上负责Na+外排的基因。而外源CA 可显著诱导盐碱胁迫下的Na+外排基因MdCHX15和Md-SOS1 的表达,表明CA 可以促进盐碱胁迫下Na+的外排。综合来看,外源施加CA可以通过促进Na+外排,抑制K+外排并促进K+的液泡区隔化,来维持盐碱胁迫下细胞质中的Na+、K+平衡,从而减缓离子毒害。
综上所述,外源CA 对盐胁迫下M9-T337 营养系自根砧苗叶片的影响是多种生理活动综合作用的结果,通过测定25 个指标并进行主成分解析,再通过综合排名得出,盐碱胁迫下不同浓度外源CA对M9-T337 营养系自根砧苗叶片生理特征的影响,按顺序排名依次为:T3>T2>T4>T1>CK2,即1.0 mmol·L-1 CA(T3)处理效果最明显。
4 结论
盐碱胁迫下,外源CA 可缓解盐碱胁迫下M9-T337营养系自根砧苗光合作用的减弱、叶绿素降解及氧化损伤,维持抗氧化酶系统的稳定,减轻膜透性损害,并具有浓度效应,1.0 mg·L-1为最佳浓度。
[1] 张仲兴,程丽,王双成,张德,刘兵,王延秀.垂丝海棠Mh-MYB114-Like 的克隆及其在苹果愈伤组织中的抗缺铁功能鉴定[J].园艺学报,2021,48(1):127-136.ZHANG Zhongxing,CHENG Li,WANG Shuangcheng,ZHANG De,LIU Bing,WANG Yanxiu.Cloning of Mh-MYB114-like from Malus halliana and its functional identification of iron deficiency tolerance in apple callus[J].Acta Horticulturae Sinica,2021,48(1):127-136.
[2] 陈楠,张维,张晓明.褪黑素调控辣椒幼苗响应盐胁迫下的叶片生理特性[J].中国瓜菜,2023,36(5):84-90.CHEN Nan,ZHANG Wei,ZHANG Xiaoming.Melatonin regulates physiological characteristics of pepper seedlings in response to salt stress[J].China Cucurbits and Vegetables,2023,36(5):84-90.
[3] 费伟,陈火英,曹忠,刘杨.盐胁迫对番茄幼苗生理特性的影响[J].上海交通大学学报(农业科学版),2005,23(1):5-9.FEI Wei,CHEN Huoying,CAO Zhong,LIU Yang.Effects of salininty stress on phsiological characteristics of tomato seedling[J].Journal of Shanghai Jiaotong University (Agricultural Science),2005,23(1):5-9.
[4] YAN Y Q,CHE D D,SHI X C,LIU X L.Effects of salt-alkali stress on active oxygen metabolism in roots of Spiraea×bumalda‘Gold Mound’and Spiraea × bumalda‘Gold Flame’[J].Journal of Forestry Research,2011,22(1):59-64.
[5] 司鹏,邵微,徐国益,于会丽,谢宁,杜国强.柠檬酸与草酸不同施用浓度对葡萄产量、品质及养分吸收的影响[J].果树学报,2023,40(8):1606-1614.SI Peng,SHAO Wei,XU Guoyi,YU Huili,XIE Ning,DU Guoqiang.Effects of different concentrations of citric acid and oxalic acid on yield,quality and nutrient absorption of grape[J].Journal of Fruit Science,2023,40(8):1606-1614.
[6] 高博文,孙德玺,刘君璞,袁高鹏,安国林,李卫华,司文静,朱迎春.盐胁迫对西瓜幼苗生理生化特性的影响[J].中国瓜菜,2022,35(8):35-41.GAO Bowen,SUN Dexi,LIU Junpu,YUAN Gaopeng,AN Guolin,LI Weihua,SI Wenjing,ZHU Yingchun.Salt stress affects physiological and biochemical characteristics of watermelon seedlings[J].China Cucurbits and Vegetables,2022,35(8):35-41.
[7] 滕元旭,骆霞,张雪蒙,崔辉梅.外源CO 供体高铁血红素对盐胁迫下加工番茄苗期根系形态及生理特性的影响[J].西南农业学报,2023,36(9):1906-1914.TENG Yuanxu,LUO Xia,ZHANG Xuemeng,CUI Huimei.Effects of exogenous hemin of exogenous CO on root morphology and physiological characteristics of processed tomato seedlings under salt stress[J].Southwest China Journal of Agricultural Sciences,2023,36(9):1906-1914.
[8] ASKARI M,HAMID N,ABIDEEN Z,ZULFIQAR F,MOOSA A,NAFEES M,EL-KEBLAWY A.Exogenous melatonin application stimulates growth,photosynthetic pigments and antioxidant potential of white beans under salinity stress[J].South African Journal of Botany,2023,160:219-228.
[9] LIU G D,JIN T,XU Y M,YAO F X,GUAN G,ZHOU G F.Exogenous citrate restores the leaf metabolic profiles of navel orange plants under boron deficiency[J].Plant Physiology and Biochemistry,2022,192:101-109.
[10] KARAFFA L,KUBICEK C P.Aspergillus niger citric acid accumulation:Do we understand this well working black box?[J].Applied Microbiology and Biotechnology,2003,61(3):189-196.
[11] 高亚南,薛慧,贺学勤.SNP、柠檬酸和苹果酸对干旱下中国石竹幼苗形态及生理指标的影响[J].内蒙古农业大学学报(自然科学版),2022,43(4):7-11.GAO Yanan,XUE Hui,HE Xueqin.Effects of SNP,citric acid,and malic acid on morphological and physiological indexes of Dianthus chinensis L.seedlings under drought stress[J].Journal of Inner Mongolia Agricultural University (Natural Science Edition),2022,43(4):7-11.
[12] 靳琇,陈浩婷,石玉,白龙强,侯雷平,张毅.柠檬酸浸种引发对低磷胁迫下番茄幼苗生长及生理特性的影响[J].中国生态农业学报(中英文),2021,29(7):1159-1170.JIN Xiu,CHEN Haoting,SHI Yu,BAI Longqiang,HOU Leiping,ZHANG Yi.Effect of citric acid seed priming on the growth and physiological characteristics of tomato seedlings under low phosphorus stress[J].Chinese Journal of Eco-Agriculture(In Chinese and English),2021,29(7):1159-1170.
[13] 闫峰,常丽新,刘鑫峰.柠檬酸与Vc 协同处理对野菜小叶藜低温贮存品质的影响[J].安徽农业科学,2007,35(22):6905-6906.YAN Feng,CHANG Lixin,LIU Xinfeng.Effects of synergistic treatment with citric acid and Vc on storage quality of potherb Chenopodium aLbum L.at low temperature[J].Journal of Anhui Agricultural Sciences,2007,35(22):6905-6906.
[14] 杨洪兵,杨世平.外源有机酸对盐胁迫下荞麦幼苗抗氧化酶活性的影响[J].河南农业科学,2013,42(10):8-11.YANG Hongbing,YANG Shiping.Effect of exogenous organic acids on antioxidant enzyme activity of buckwheat seedlings under salt stress[J].Journal of Henan Agricultural Sciences,2013,42(10):8-11.
[15] 师瑞红,谢国生,曾汉来,张端品.外源有机酸缓解水稻幼苗根系铝毒的生理机制[J].中国生态农业学报,2007,15(4):97-101.SHI Ruihong,XIE Guosheng,ZENG Hanlai,ZHANG Duanpin.Physiological mechanism of alleviating aluminum toxicity in rice seedling root by exogenous organic acids[J].Chinese Journal of Eco-Agriculture,2007,15(4):97-101.
[16] 高登涛.苹果矮化砧木M9T337 对干旱胁迫响应机制及预警指标体系建立[D].石河子:石河子大学,2022.GAO Dengtao.Response of apple dwarf rootstock M9T337 to drought stress and the establishment of drought forewarning index system[D].Shihezi:Shihezi University,2022.
[17] 陈建勋,王晓峰.植物生理学实验指导[M].2 版.广州:华南理工大学出版社,2006.CHEN Jianxun,WANG Xiaofeng.Experimental guidance for plant physiology[M].2nd ed.Guangzhou:South China University of Technology Press,2006.
[18] 刘霞,侯乐峰,郝兆祥,毕润霞,李昭慧,马敏,张立华.以电导法评价12 个石榴品种的抗寒性[J].经济林研究,2015,33(3):150-153.LIU Xia,HOU Lefeng,HAO Zhaoxiang,BI Runxia,LI Zhaohui,MA Min,ZHANG Lihua.Evaluation of cold resistances of 12 Punica granatum cultivars by conductivity method[J].Non-Wood Forest Research,2015,33(3):150-153.
[19] 张志勇,卜晶晶,王素芳,胡根海,王清连.冠菌素对不同钾水平下TTC 法测定的棉花根系活力的影响[J].植物生理学报,2015,51(5):695-701.ZHANG Zhiyong,BU Jingjing,WANG Sufang,HU Genhai,WANG Qinglian.Effect of coronatine on cotton root activity determined by TTC assay at different levels of potassium[J].Plant Physiology Journal,2015,51(5):695-701.
[20] 郑国琦,许兴,徐兆桢,刘振荣.盐胁迫对枸杞光合作用的气孔与非气孔限制[J].西北农业学报,2002,11(3):87-90.ZHENG Guoqi,XU Xing,XU Zhaozhen,LIU Zhenrong.The effect of salt stress on the stomatal and non-stomatal limitation of photosynthesis of wolf berry[J].Acta Agriculturae Boreali-occidentalis Sinica,2002,11(3):87-90.
[21] 赵世杰,许长成,邹琦,孟庆伟.植物组织中丙二醛测定方法的改进[J].植物生理学通讯,1994,30(3):207-210.ZHAO Shijie,XU Changcheng,ZOU Qi,MENG Qingwei.Improvement of method for malondialdehyde in plant tissues[J].Plant Physiology Communications,1994,30(3):207-210.
[22] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.GAO Junfeng.Experimental guidance for plant physiology[M].Beijing:Higher Education Press,2006.
[23] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007:54-76.CAO Jiankang,JIANG Weibo,ZHAO Yumei.Guidelines for postharvest physiological and biochemical experiments on fruits and vegetables[M].Beijing:China Light Industry Press,2007:54-76.
[24] ABD EL-RAHMAN M M A.Yield and fruit quality of Washington navel oranges as influenced by foliar application of fenugreek and rocket seed sprouts[J].World Rural Observations,2015,7(2):99-104.
[25] 邵微,徐国益,于会丽,高登涛,刘远,司鹏.低分子有机酸水溶肥提升梨叶片光合、养分吸收及果实品质[J].果树学报,2022,39(6):992-1003.SHAO Wei,XU Guoyi,YU Huili,GAO Dengtao,LIU Yuan,SI Peng.Low molecular weight organic acid water-soluble fertilizer improves leaf photosynthesis,nutrient absorption and fruit quality of pear[J].Journal of Fruit Science,2022,39(6):992-1003.
[26] 郭雁君,吉前华,杜鹏飞,尚荷斌,钟雅玲.盐碱胁迫对砂糖橘叶片水分亏缺、气体交换及矿质元素微域分布的影响[J].果树学报,2022,39(6):1029-1041.GUO Yanjun,JI Qianhua,DU Pengfei,SHANG Hebin,ZHONG Yaling.Effect of saline-alkali stress on leaf water deficit,gas exchange and micro-distribution of eight mineral elements in Shatangju mandarin (Citrus reticulata)[J].Journal of Fruit Science,2022,39(6):1029-1041.
[27] WU Y,HU L L,LIAO W B,MUJITABA DAWUDA M,LYU J,XIE J M,FENG Z,CALDERÓN-URREA A,YU J H.Foliar application of 5-aminolevulinic acid (ALA) alleviates NaCl stress in cucumber(Cucumis sativus L.)seedlings through the enhancement of ascorbate-glutathione cycle[J].Scientia Horticulturae,2019,257:108761.
[28] 李峻安.酸铝环境下外源有机酸对马尾松铝毒害的缓解作用及调控机制[D].重庆:西南大学,2021.LI Jun’an.Alleviation and regulation of exogenous organic acids on aluminum toxicity of Pinus massoniana[D].Chongqing:Southwest University,2021.
[29] YANG X H,CHEN X Y,GE Q Y,LI B,TONG Y P,ZHANG A M,LI Z S,KUANG T Y,LU C M.Tolerance of photosynthesis to photoinhibition,high temperature and drought stress in flag leaves of wheat:A comparison between a hybridization line and its parents grown under field conditions[J].Plant Science,2006,171(3):389-397.
[30] 王海琪,王荣荣,蒋桂英,尹豪杰,晏世杰,车子强.施氮量对滴灌春小麦叶片光合生理性状的影响[J].作物学报,2023,49(1):211-224.WANG Haiqi,WANG Rongrong,JIANG Guiying,YIN Haojie,YAN Shijie,CHE Ziqiang.Effect of amount of nitrogen fertilizer applied on photosynthetic physiological characteristics of drip irrigated spring wheat leaves[J].Acta Agronomica Sinica,2023,49(1):211-224.
[31] 吴雪霞,朱月林,朱为民,陈建林,刘正鲁.外源一氧化氮对NaCl 胁迫下番茄幼苗生理影响[J].中国农业科学,2006,39(3):575-581.WU Xuexia,ZHU Yuelin,ZHU Weimin,CHEN Jianlin,LIU Zhenglu.Physiological effects of exogenous nitric oxide in tomato seedlings under NaCl stress[J].Scientia Agricultura Sinica,2006,39(3):575-581.
[32] MARSCHNER H.Marschner’s mineral nutrition of higher plants[M].3rd ed.New York,USA:Academic Press,2011.
[33] 王鸿燕,佟海英,黄苏珍,原海燕.柠檬酸和草酸对Pb 胁迫下马蔺生长和生理的影响[J].生态学杂志,2010,29(7):1340-1346.WANG Hongyan,TONG Haiying,HUANG Suzhen,YUAN Haiyan.Effects of citric acid and oxalic acid on the growth and physiology of Iris lactea var.chinensis under Pb stress[J].Chinese Journal of Ecology,2010,29(7):1340-1346.
[34] 姬海月,胡本祥,杨冰月,罗瑶,颜永刚,彭亮.芸苔素对铅胁迫下远志种子萌发和幼苗生长生理特征的影响[J].西北植物学报,2022,42(12):2093-2102.JI Haiyue,HU Benxiang,YANG Bingyue,LUO Yao,YAN Yonggang,PENG Liang.Effects of brassinolide on seed germination and seedling growth and physiological characteristics of Polygala tenuifolia under lead stress[J].Acta Botanica Boreali-Occidentalia Sinica,2022,42(12):2093-2102.
[35] 史智勇,艾沙江·买买提,仙米斯娅·塔依甫,曹艺洁,玉苏甫·阿不力提甫.摘叶和喷施外源过氧化氢对库尔勒香梨粗皮果形成的影响[J].新疆农业科学,2023,60(4):889-896.SHI Zhiyong,Aisajan·Mamat,Xianmisiya·Tayifu,CAO Yijie,Yusuf·Ablitif.Study on the induction of rough-skinned fruit formation in Korla fragrant pear[J].Xinjiang Agricultural Sciences,2023,60(4):889-896.
[36] PESSARAKLI M.Handbook of plant and crop stress[M].4th ed.Florida,USA:CRC Press,2019.
[37] 吕艳伟,何文慧,陈雨鸥,张咪咪.盐胁迫对小麦幼苗光合色素含量和细胞膜的影响[J].江苏农业科学,2013,41(6):74-76.LÜ Yanwei,HE Wenhui,CHEN Yuou,ZHANG Mimi.Effects of salt stress on photosynthetic pigment content and cell membrane in wheat seedlings[J].Jiangsu Agricultural Sciences,2013,41(6):74-76.
[38] SUN Y L,HONG S K.Effects of citric acid as an important component of the responses to saline and alkaline stress in the halophyte Leymus chinensis (Trin.)[J].Plant Growth Regulation,2011,64(2):129-139.
[39] 张林.盐碱胁迫对樟子松苗期活性氧代谢生理的影响[J].辽宁林业科技,2021(6):17-20.ZHANG Lin.Effects of saline-alkali stress on physiology of reactive oxygen metabolism in Pinus sylvestris var.mongolica seedlings[J].Liaoning Forestry Science and Technology,2021(6):17-20.
[40] 杜蕾,杨建宁,王星星,张德,赵婷,张瑞,王延秀.外源H2O2对盐碱胁迫下苹果矮化砧木幼苗生理特性的影响[J].西北植物学报,2021,41(10):1700-1710.DU Lei,YANG Jianning,WANG Xingxing,ZHANG De,ZHAO Ting,ZHANG Rui,WANG Yanxiu.Effect of exogenous H2O2 treatment on physiological characteristics of salt-alkali stressed seedlings of apple dwarf rootstock[J].Acta Botanica Boreali-Occidentalia Sinica,2021,41(10):1700-1710.
[41] 杨雨华,鉴晶晶,邱小蝶,王贵娇,宗建伟.复合盐碱胁迫对OT 百合生长和生理特性的影响[J].南京林业大学学报(自然科学版),2022,46(4):117-126.YANG Yuhua,JIAN Jingjing,QIU Xiaodie,WANG Guijiao,ZONG Jianwei.Effects of combined saline-alkali stress on physiological and biochemical characteristics of OT hybrid lily[J].Journal of Nanjing Forestry University (Natural Sciences Edition),2022,46(4):117-126.
[42] ASHRAF M,AHMAD R,BHATTI A S,AFZAL M,SARWAR A,MAQSOOD M A,KANWAL S.Amelioration of salt stress in sugarcane (Saccharum officinarum L.) by supplying potassium and silicon in hydroponics[J].Pedosphere,2010,20(2):153-162.
[43] 王晚霞,高立杨,张瑞,赵婷,张仲兴,王双成,王延秀.2,4-表油菜素内酯对盐碱胁迫下垂丝海棠光合及生理特性的影响[J].果树学报,2021,38(9):1479-1490.WANG Wanxia,GAO Liyang,ZHANG Rui,ZHAO Ting,ZHANG Zhongxing,WANG Shuangcheng,WANG Yanxiu.Effects of 2,4 epbrassinolide on photosynthetic and physiological characteristics of Malusa halliana under saline-alkali stress[J].Journal of Fruit Science,2021,38(9):1479-1490.
[44] 吴鹏,吕剑,郁继华,刘娜,李金武,金莉,金宁,王舒亚.褪黑素对盐碱复合胁迫下黄瓜幼苗光合特性和渗透调节物质含量的影响[J].应用生态学报,2022,33(7):1901-1910.WU Peng,LÜ Jian,YU Jihua,LIU Na,LI Jinwu,JIN Li,JIN Ning,WANG Shuya.Effects of melatonin on photosynthetic properties and osmoregulatory substance contents of cucumber seedlings under salt-alkali stress[J].Chinese Journal of Applied Ecology,2022,33(7):1901-1910.
[45] MARTIN L,VILA H,BOTTINI R,BERLI F.Rootstocks increase grapevine tolerance to NaCl through ion compartmentalization and exclusion[J].Acta Physiologiae Plantarum,2020,42(9):145.
[46] FANG S M,HOU X E,LIANG X L.Response mechanisms of plants under saline-alkali stress[J].Frontiers in Plant Science,2021,12:667458.