南红梨(Pyrus ussuriensis‘Nanhong’)为南果梨(P.ussuriensis‘Nanguo’)红色芽变品种,相比南果梨具有果皮着色面积显著增加,果实花青苷含量较高、果肉细腻多汁、可溶性固形物含量高、石细胞含量低等特点[1]。由于其较高的经济效益,因此在辽宁地区的栽培面积逐年扩大,但近年来,由于土壤养分大量消耗,果园营养管理不足,树体养分失衡,致使果实整体品质逐年下滑[2]。相比于其他品种,南红梨在色泽、口感、营养成分等方面的竞争力降低,导致果实商品价格一降再降,果农收益减少。因此,提高南红梨果实品质是振兴南红梨产业的重中之重。
稀土是我国极为重要的战略资源,自20世纪70年代开始应用于农业。经历数十年的深入发展,稀土已广泛应用于现代农业、现代工业等诸多方面。稀土元素又称镧系元素,由15种镧系元素和钇元素构成[3]。有研究表明,氯化镧处理缺钙黄瓜幼苗后,幼苗根系活性明显提高[4]。稀土元素可与细胞膜上一些酶发生反应,从而影响酶功能改变膜的渗透性,促进营养物质的吸收和利用。适当浓度的La3+能够促进番红花愈伤组织中番红花素的合成[5]。水稻在生长发育过程中,适当浓度的镧元素能够提高水稻幼苗中防御性酶的活性,提高水稻的抗病性[6]。在柠檬的栽培中稀土元素也有着重要作用,研究表明,柠檬果实品质与土壤中稀土元素含量呈正相关[7]。前人研究表明,低浓度的镧元素能够促进油菜种子萌发[8]。在光照下,铕元素处理红叶石楠后,其色素含量明显增加[9]。
稀土微肥是以镧、铈元素为主,包括少量镨和钕元素在内的轻稀土元素无机盐或有机盐。作为一种新型的植物生长调节剂,在农业生产中得到广泛应用。在果树上,稀土微肥能提高苹果果实产量和品质[10]。研究表明,喷施稀土后烟草叶片中的总糖、总氮和蛋白质含量都有所提高[11]。用稀土元素浸种处理后的水稻幼苗体内的还原性糖含量及过氧化酶、苯丙氨酸转氨酶、多酚氧化酶活性明显提高[6]。大豆施用稀土镧和铈可显著提高株高,并且叶片中可溶性固形物含量明显提高[12]。适当浓度的稀土微肥能够明显提高烤烟的品质并促进其生长,对质体色素和多酚类的合成和积累有着重要作用[13]。
南红梨果皮的着色程度是果实外观品质的主要指标之一,直接影响着消费者的购买意愿,主要由果皮中花青苷含量决定。花青苷是一种水溶性类黄酮物质,是天然的植物色素。首先苯丙氨酸在苯丙氨酸裂解酶(PAL)等酶的催化下形成对香豆酰辅氨酶A,再由查尔酮合成酶(CHS)催化形成查尔酮,然后由查尔酮异构酶(CHⅠ)催化形成黄烷酮,再由黄烷酮-3-羟化酶(F3H)和类黄酮-3’-羟化酶(F3’H)的催化形成二氢黄酮醇,进而由二氢黄酮醇-4-还原酶(DFR)的催化生成无色花青素,经花色素合成酶(ANS)催化合成花青素,最后在类黄酮-3-O-葡糖基转移酶(UFGT)的作用下形成稳定的花青苷[14]。
笔者在本研究中以南红梨为试验材料,通过不同浓度稀土微肥叶面喷施,对果实外观品质和内在品质进行测定,最终筛选出最适稀土微肥浓度,为今后探究稀土元素影响南红梨着色调控机制提供理论基础。
1 材料和方法
1.1 试验材料和处理
试验于2022年5—12月在沈阳农业大学果树发育生物学实验室和鞍山市唐家房镇农业技术推广服务站进行。所用试验材料为南红梨树。稀土微肥为内蒙古蒙邦益农生物科技有限公司的超纯稀土和稀土多元螯合肥,具体成分见表1。
表1 超纯稀土及稀土多元螯合肥成分
Table 1 Composition of ultrapure rare earth and rare earth multicomponent chelates%

超纯稀土Ultrapure rare earth w[磁酶稀土(La、Se、Pr)]≥38 w(As)≤0.000 5 w(Cd)≤0.001 w(Pb)≤0.005 w(Cl-)≤1其他Other≤0.5稀土多元螯合肥Rare earth multicomponent chelates w[磁酶稀土(La、Se、Pr)]≥38 w(氨基酸Amino acid)≥10 w(As)≤0.000 5 w(Cd)≤0.001 w(Pb)≤0.005 w(Cl-)≤1其他Other≤0.5
1.2 试验设计
试验根据稀土微肥在苹果树及其他作物的应用效果,设计6 个不同浓度梯度,具体浓度见表2。选取树龄为5 年且生长势一致的南红梨果树,每个浓度处理果树3 株,于花后70、100、130 d 进行叶面喷施。果实于花后145 d 采收,采收后测定贮藏0、5、10、15 d果实的外观指标和内在品质,并将果肉和果皮分别用液氮速冻,保存于-80 ℃冰箱备用。
表2 稀土微肥浓度
Table 2 Rare earth trace fertilizer concentration
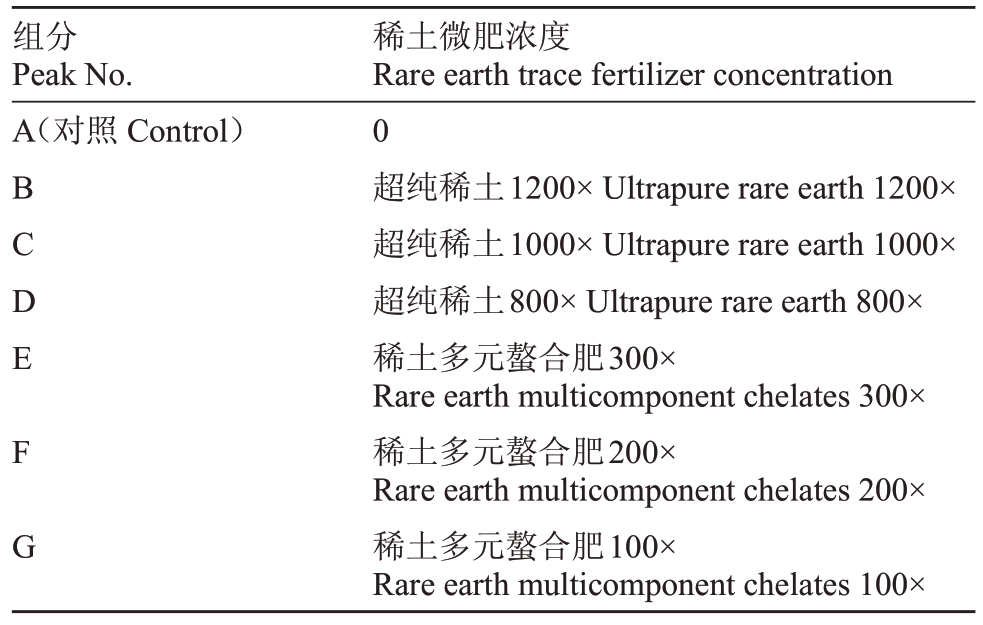
组分Peak No.A(对照Control)BCDE F G稀土微肥浓度Rare earth trace fertilizer concentration 0超纯稀土1200×Ultrapure rare earth 1200×超纯稀土1000×Ultrapure rare earth 1000×超纯稀土800×Ultrapure rare earth 800×稀土多元螯合肥300×Rare earth multicomponent chelates 300×稀土多元螯合肥200×Rare earth multicomponent chelates 200×稀土多元螯合肥100×Rare earth multicomponent chelates 100×
1.3 果实硬度的测定
使用手持硬度计测定果实硬度。
1.4 可溶性固形物含量的测定
采用糖度计(PAL-1,ATAGO,日本)测定可溶性固形物含量。
1.5 可滴定酸含量的测定
参照阮方毅等[10]的方法测定可滴定酸含量。利用酸碱中和原理,根据下列公式计算可滴定酸含量:可滴定酸含量/%=VNaOH×0.1×K×C/(M×D)。
式中VNaOH为消耗NaOH体积(mL);K为苹果酸=0.067;C 为定容体积(mL);M 为样品质量(g);D 为提取液体积(mL)。
1.6 抗坏血酸含量的测定
参照王海佳[15]的方法稍有改进测定抗坏血酸含量。每个处理5个生物学重复,每个果实切取0.1 g果肉,迅速将其置入加有0.5 mL 6%三氯乙酸的2 mL离心管中,用玻璃棒挤压果肉,4 ℃条件下10 000 r∙min-1离心10 min;吸取0.1 mL上清液至5 mL离心管中,随后加入pH=7.5的磷酸缓冲液0.25 mL,蒸馏水1 mL,室温静置10 min;静置结束后,在上述混合液中,依次加入10%三氯乙酸、44%正磷酸、0.3% FeCl3、4%联吡啶各0.2 mL,颠倒混匀后,在40 ℃水浴锅中水浴40 min,水浴后取出待降到室温后,测定525 nm波长处吸光值,记录数值,根据下列公示计算抗坏血酸的含量。
w(抗坏血酸)/(μg∙g-1)=Y×V1/M/V2。
式中Y为标曲中的Y值;V1为浸提液体积(mL);M为样品质量(g);V2为上清液体积(mL)。
1.7 乙烯生成量的测定
参照李通[16]的方法测定乙烯生成量。每个处理5个生物学重复,称取果实质量并记录,将每个果实置于密闭容器中静置1 h,然后用1 mL 注射器从密闭容器中抽取3 管气体,作为3 次技术重复。将气相色谱仪(Agilent,7890A)打开,待温度升至200 ℃且火焰打开时,将注射器中的气体迅速打入气相色谱仪中测定乙烯生成量,记录对应峰面积,并计算单位质量果实在单位时间内的乙烯生成量。色谱柱型号为HP-AL/S(Cat.No.19095P-S25,Agilent),进样口温度为180 ℃、检测器温度为120 ℃、柱箱温度为110 ℃,尾吹气和载气分别为N2、H2,流速均为40 mL∙min-1。
1.8 果实光泽参数的测定
采用Minolta∙CR-400型色差仪测量果面的L*、a*、b*值,每个处理5 个生物学重复,在每个果实阳面赤道部位均匀选取四处,测量4 次,取平均值,该平均值代表当天果实表面的颜色特征。果实色泽色差值用CCⅠ(citrus color index)来评估,CCⅠ是一个综合指标,正值为红色、负值为蓝绿色,0为红色、黄色、蓝绿色的混合色,CCⅠ=1000×a*/(L*×b*)。
1.9 花青苷含量的测定
参照安建平[14]的方法测定花青苷含量,取梨果实表皮用液氮速冻,研磨后称取3 g 放入10 mL离心管中,加入8 mL 提取液(95%无水乙醇+5%1.5 mol∙L-1 HCl),黑暗条件静置12 h,之后4 ℃条件下10 000 r∙min-1离心5 min,吸上清液,利用分光光度计测定波长在530 nm、620 nm 和650 nm 处的吸光值并记录。花青苷含量的计算公式:
花青苷光密度:ODλ=(A530-A620)-0.1×(A650-A620);b(花青苷)/(nmol∙g-1)=ODλ/ξλ×V/M×106。
式中ξλ为4.62×104;V 是提取液体积;M 是果皮质量。
1.10 丙二醛含量的测定
参照梁爽[17]的方法稍有改进测定丙二醛含量,取梨果肉用液氮速冻,研磨后取0.1 g 加入3 mL 的10%三氯乙酸(TCA),震荡20~30 min,之后4 ℃条件下12 000 r∙min-1离心10 min,取2 mL 上清液于10 mL 离心管中,加入2 mL 的0.6%硫代巴比妥酸(TBA),混匀后将离心管在沸水中水浴15 min,然后迅速置于冰中冷却,之后4 ℃条件下12 000 r∙min-1离心10 min。利用分光光度计测定波长在450 nm、532 nm 和600 nm 处的吸光值并记录。丙二醛含量计算公式:c(丙二醛)/(μmol ∙L-1)=[6.425×(A532-A600)-0.559×A450]×4×V/V1。式中:V 是提取液的体积;V1是测定提取液的体积。
1.11 石细胞含量的测定
参照张伟等[18]的方法测定石细胞含量。
1.12 基因表达分析
采用CTAB 法提取梨果实及表皮的RNA。参照反转录试剂盒(PrimeScriptTM reagent Kit with gDNA Eraser, cat.no.RR047Q,TaKaRa,Japan)说明书中提供的方法进行cDNA 合成,反转录结束后将cDNA置于-20 ℃冰箱中保存。半定量PCR初步检测各基因的表达情况,程序为:95 ℃,5 min;95 ℃,30 s;50 ℃,30 s;72 ℃,30 s,重复循环2~4 步25~30次;72 ℃,5 min;4 ℃保存。通过1%琼脂糖凝胶电泳对PCR 产物进行检测,使用凝胶成像系统(Gel-Doc XR System,Bio-Rad)检测各基因表达量。梨PuActin 作内参基因。引物由生工生物工程(上海)股份有限公司合成,引物序列见表3。使用实时荧光定量(qRT-PCR)PCR 定量检测各基因相对表达量,程序为:95 ℃,10 min;95 ℃,30 s;60 ℃,30 s;72 ℃,30 s,重新返回程序第二步,共28 个循环;72 ℃,5 min;4 ℃保存。相对表达量使用△Ct 法计算:基因相对表达量=2-(目的基因Ct 值-内参基因Ct 值)。使用仪器为安捷伦实时荧光定量PCR 仪(Applied Biosystems 7500 Real-Time,USA)。
表3 试验所用引物
Table 3 Primers used in the study

基因名称Gene name PuPAL PuCHS PuCHI PuF3H PuDFR PuANS PuUFGT PuACS1 PuACO2 PuERF2 PuActin正向引物序列Forward primer sequence(5’-3’)CGGAAACCATCACCCAAAAT GGCATTTCGGACTGGAACTC ATGCAGAAGGCAAAGCCATT TGTGAGGGAGGGAGAGAAGC TCAGGATCTCGAGGCACGTA TGGCCTCAAACACCTGCTGA ATGGCACCGCCGCCGCCCACCAAAA ATGGCCTCATCTGCAAGTGAGAATCG GTTCTACAACCCAGGCAACG ATGGAAGAACAACCTCAGCACTACAC TGGTGAAGGCTGGATTTG反向引物序列Reverse primer sequence(3’-5’)CCACCGGCTTTCTGTACTCC CCCTCTCCGGTTGTTTTGAG TTGCTGGAGGAGAAACACCA ATTTCATCCGCTGGCTTGAT AGGCGGTGAGTCCTCCATTA CTCCAGCCTCCCTTCATCCA CTATGCTTTCTTGGATCCTGATATA TTAAGTCGTAGCTCGAAGGAGAGG TCTCAGAGCTCAGGCAGTTG TCAGCTAACCAATAGTTGCTCGCC CTGTGAGCAGAACTGGGTG
2 结果与分析
2.1 叶面喷施稀土微肥对南红梨果实外观品质的影响
叶面喷施稀土微肥后,在室温贮藏0 d 时,稀土1200 倍、稀土1000 倍、螯合稀土200 倍和螯合稀土100倍处理组相比于对照组没有显著差异,稀土800倍和螯合稀土300 倍处理组着色情况优于对照组;在室温贮藏5 d 时,对照组和处理组开始变黄;室温贮藏10 d 时,对照组和处理组的果实果皮的着色情况达到峰值,果实外观品质最好;室温贮藏15 d 时,处理组与对照组果实果皮彻底褪去绿色,变成黄色部分,果实开始出现腐烂现象(图1)。由图1可以看出,稀土微肥浓度在800倍时,果实着色情况最佳。
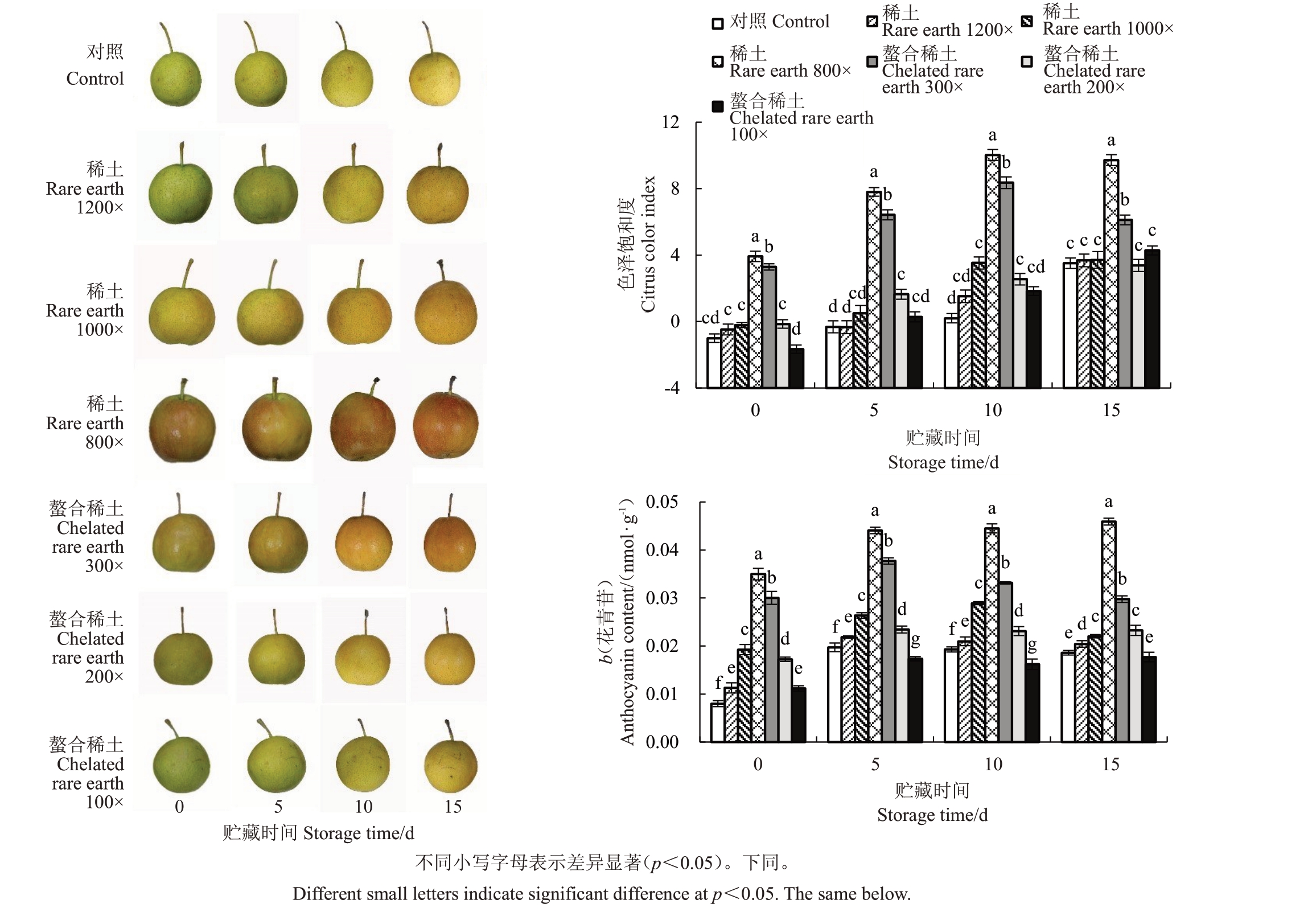
图1 稀土微肥处理对南红梨果实外在品质的影响
Fig.1 Effects of rare earth microfertilizer treatments on the exterior quality of the Nanhong fruit
随着贮藏时间增加,稀土800倍和螯合稀土300倍色差指数在贮藏10 d时达到最大,之后开始下降;而对照组和其他处理组色差指数呈现上升趋势;在各个贮藏时期,稀土800倍和螯合稀土300倍的色差指数均显著高于对照组,在0 d 时分别是对照组的2.2倍和1.8倍(图1)。
不同贮藏时间均以稀土800倍的处理组中花青苷含量最高;在贮藏0 d 时,处理组整体的花青苷含量显著高于对照组,稀土800 倍处理组花青苷含量是对照组的4.4倍;贮藏5 d时,不同处理花青苷含量均上升,螯合稀土100 倍处理组花青苷含量显著低于对照组12%,说明高浓度稀土元素会抑制花青苷合成;在贮藏10 d时,螯合稀土300倍、螯合稀土200倍、螯合稀土100 倍和稀土1200 倍处理组的花青苷含量下降,其他各处理组的花青苷含量上升;在贮藏15 d时,稀土800倍、螯合稀土200倍和螯合稀土100倍处理组的花青苷含量上升,其他各处理组花青苷含量下降(图1)。
2.2 叶面喷施稀土微肥对南红梨果实内在品质的影响
梨果实糖酸比及可滴定酸、可溶性固形物、石细胞、丙二醛和抗坏血酸含量变化是衡量果实内在品质是否优良的重要指标。在贮藏0 d 时,喷施稀土800倍处理组可溶性固形物含量是对照的1.3倍,且显著高于其他处理组,螯合稀土200 倍和螯合稀土100 倍处理组可溶性固形物含量显著低于对照,表明高浓度稀土微肥抑制可溶性固形物积累;在贮藏5 d 时,各处理组中可溶性固形物含量都有所上升,稀土800倍处理组的最高;在贮藏10 d时,各处理组中可溶性固形物含量到达峰值,表明南红梨贮藏10 d左右是最佳的食用时间;在贮藏15 d时,各处理组的可溶性固形物含量开始下降(图2)。
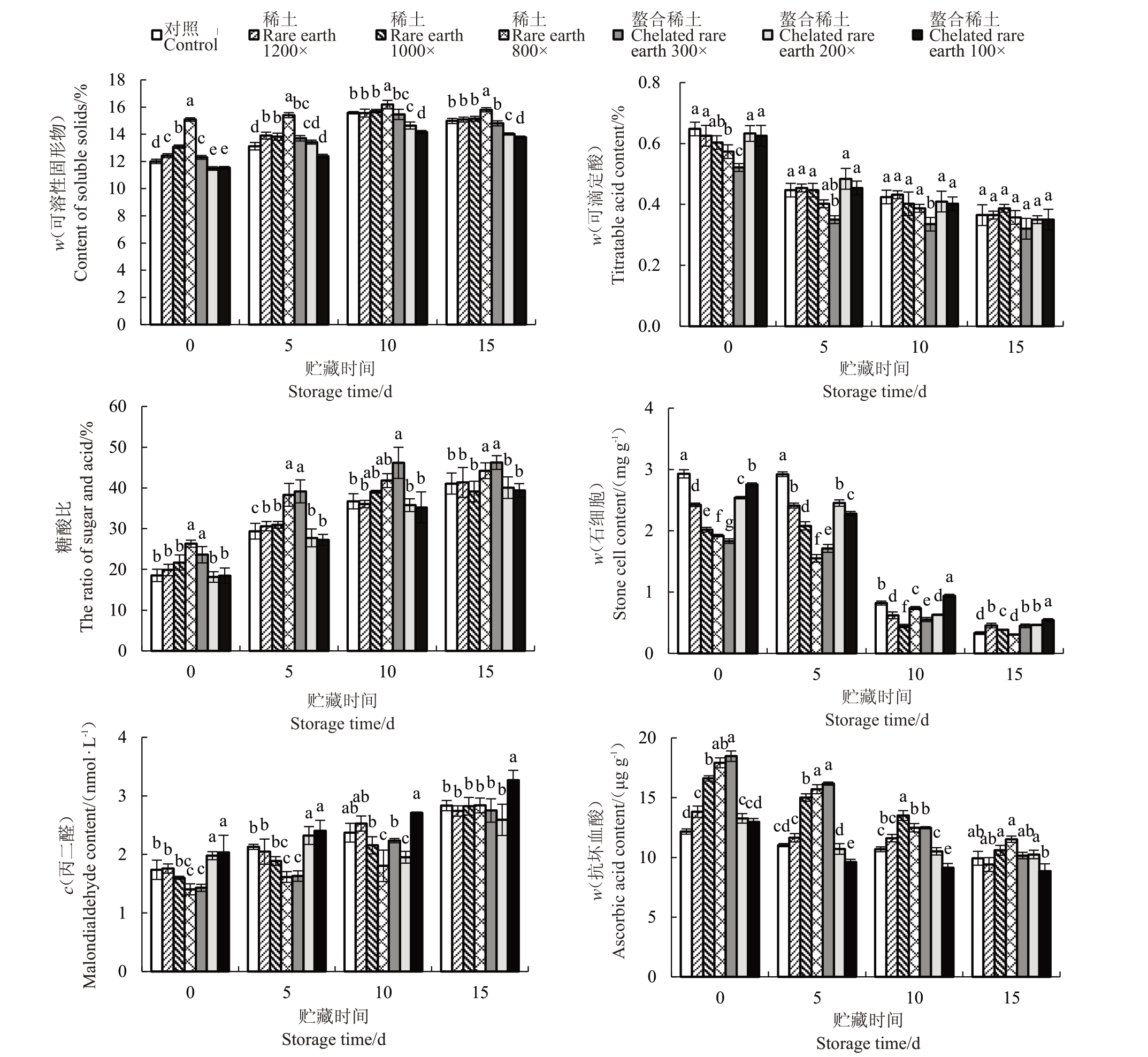
图2 稀土微肥处理对南红梨果实内在品质的影响
Fig.2 Effects of rare earth microfertilizer treatments on the internal quality of the Nanhong fruit
可滴定酸含量直接影响果实口感。贮藏0 d时,处理组可滴定酸含量低于对照,螯合稀土300倍处理组差异最为显著,下降20%;其次是稀土800倍处理组,下降11%,表明稀土微肥可降低可滴定酸含量,改善果实口感;在贮藏5 d时,各处理组中可滴定酸含量均已下降,螯合稀土300倍处理组含量最低;在贮藏10 d时,各处理组中可滴定酸含量下降程度减弱;在贮藏15 d时,各处理组中可滴定酸含量差异不显著(图2)。由图2可知,除贮藏10 d外,稀土800倍和螯合稀土300倍处理的果实糖酸比显著高于对照。
石细胞含量是评价梨果实的重要指标。贮藏0 d 时,稀土微肥处理组的石细胞含量显著下降,螯合稀土300 倍处理组下降最为显著,下降37%,其次是稀土800 倍处理组下降34%;在贮藏5 d 时,各处理组中石细胞含量呈现下降趋势;在贮藏10 d时,各处理组中石细胞含量下降幅度增加,表明贮藏10 d时石细胞降解速度加快;在贮藏15 d时,石细胞含量降至最低,表明石细胞已大部分降解(图2)。
丙二醛含量反映细胞抗氧化能力。贮藏0 d时,稀土800 倍处理组丙二醛含量显著低于对照组,下降19%,其次是螯合稀土300 倍,下降17%,螯合稀土200 倍和螯合稀土100 倍处理组丙二醛含量显著高于对照,说明喷施高浓度的稀土微肥提高果肉中丙二醛的含量;贮藏5 d 时,各组间变化趋势没有改变;贮藏10 d 和15 d 时,丙二醛含量呈现上升趋势,各组间的差异程度逐渐减小(图2)。
抗坏血酸具有抗氧化功能,是反映果实营养水平的重要指标。贮藏0 d 时,除螯合稀土100 倍处理外,各个稀土微肥处理组抗坏血酸含量显著高于对照,其中螯合稀土300 倍处理组差异最为显著,抗坏血酸含量提高52%,其次是稀土800 倍处理组,抗坏血酸含量提高47%;贮藏5 d 时,各处理组中抗坏血酸含量下降,且稀土1000 倍、稀土800 倍和螯合稀土300倍处理组抗坏血酸含量显著高于对照组;贮藏10 d时,各组中抗坏血酸含量之间差异减小,仍然是较低浓度的处理组显著高于对照;贮藏15 d时,处理组和对照之间没有显著差异(图2)。
梨属呼吸跃变型果实,呼吸跃变后果实的品质会明显下降。随着贮藏时间的增加,果实硬度整体呈现下降趋势;贮藏0 d 时,处理组硬度显著高于对照,稀土800倍和螯合稀土300倍处理组差异最为显著,提高7%;贮藏5 d 时,稀土800 倍、螯合稀土300倍和螯合稀土100倍处理组的果肉硬度显著高于对照,分别提高4.7%、7.0%和6.5%;贮藏10 d 时,稀土800 倍、螯合稀土300倍和螯合稀土200 倍处理组显著高于对照;贮藏15 d时,各处理组果肉硬度没有显著差异(图3)。
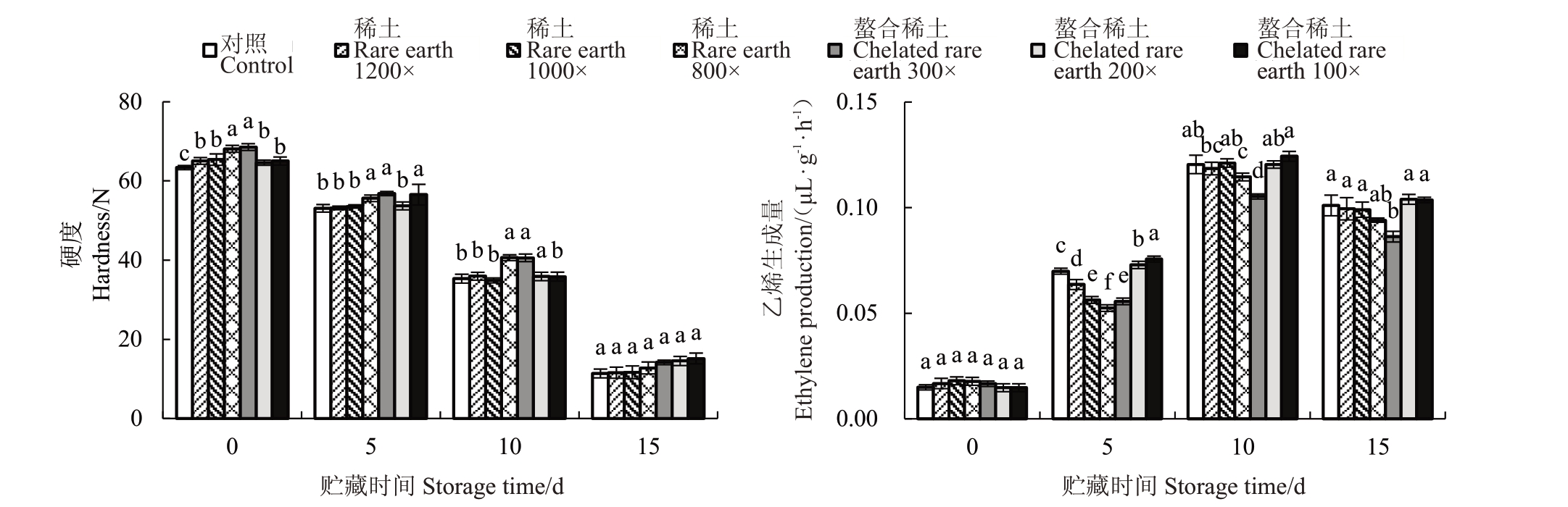
图3 稀土微肥处理对南红梨果实硬度和乙烯生成量的影响
Fig.3 Effect of rare earth microfertilizer treatment on fruit hardness and ethylene production of Nanhong
乙烯生成量是反映果实是否发生呼吸跃变的主要指标。在呼吸跃变型果实中,乙烯生成量呈现先升高后下降的变化趋势。贮藏0 d时,各处理组乙烯生成量没有显著差异;贮藏5 d 时,各处理组的乙烯生成量开始增加,稀土800 倍处理组乙烯生成量显著低于对照,降低25.0%,而螯合稀土200 倍和螯合稀土100 倍处理组乙烯生成量显著高于对照组,分别提高4.2%和8.2%;贮藏10 d 时,各组乙烯生成量均达到峰值,此时稀土微肥800倍和螯合稀土300倍处理组显著低于对照;贮藏15 d时,各组的乙烯生成量开始下降(图3)。
通过上述的试验结果,发现提高南红梨果实外观和内在品质的两个最适浓度为稀土微肥800倍和螯合稀土300 倍,但在采收时,发现喷施螯合稀土300倍处理组树体相比于对照出现果实大量脱落现象,考虑用于果树的实践生产,果实产量及果实品质会有所降低,没有实用性(图4)。因此,确定最适浓度为稀土800倍。

图4 螯合稀土300 倍处理对南红梨果实的影响
Fig.4 Effect of 300×chelated rare earth treatment on the fruit of Nanhong
2.3 稀土微肥叶面喷施对南红梨果实花青苷合成及响应相关基因表达的影响
稀土800倍处理组中南红梨果皮花青苷含量在贮藏的各个时期均显著高于对照,为阐明稀土微肥处理对果实着色的影响机制,因此选取着色最优的处理组稀土微肥800倍进行定量分析。通过分析花青苷合成途径中主要的结构基因,选取PuPAL、PuCHS、PuCHI、PuF3H、PuDFR、PuANS 和PuUFGT 进行定量分析。贮藏0 d时,处理组PuPAL、PuCHS、PuF3H、PuDFR、PuANS和PuUFGT表达量分别高于对照1.2倍、1.6倍、2.3倍、1.6倍、2.0倍和2.2倍,PuCHI基因表达量没有显著差异;贮藏5 d时,处理组PuCHI、PuDFR和PuANS相对表达量到达峰值,之后开始下降,PuPAL、PuCHS和PuUFGT表达量没有显著变化;在贮藏10 d时,PuF3H相对表达量达到峰值,之后开始下降;贮藏15 d时PuUFGT表达量达到最大(图5)。

图5 稀土微肥处理对花青苷合成相关基因表达量的影响
Fig.5 Effects of rare earth microfertilizer treatments on gene expression of anthocyanin synthesis and regulation
2.4 稀土微肥叶面喷施对南红梨果实乙烯相关基因表达的影响
果实乙烯生成量是影响果实贮藏性的关键指标,ACS 是乙烯合成的限速酶;ACO 是催化植物合成乙烯的关键酶;乙烯响应因子ERF家族在植物乙烯合成过程中发挥着重要作用。稀土微肥800倍处理后果实乙烯生成量下降,因此,对贮藏各时期果实中PuACS1、PuACO2 和PuEFR2 表 达 水 平 进 行 测定。由图6可知,稀土微肥处理后,果实中PuACS1、PuACO2和PuEFR2基因的表达水平在贮藏0 d没有显著差异;贮藏5 d 时各基因的表达量开始增加,处理组贮藏10 d 时,果肉中PuACS1、PuACO2 和Pu-EFR2 表达量达到最高;处理组在贮藏5、10 和15 d时乙烯合成相关基因表达量显著低于对照,导致果实乙烯生成量受到抑制。
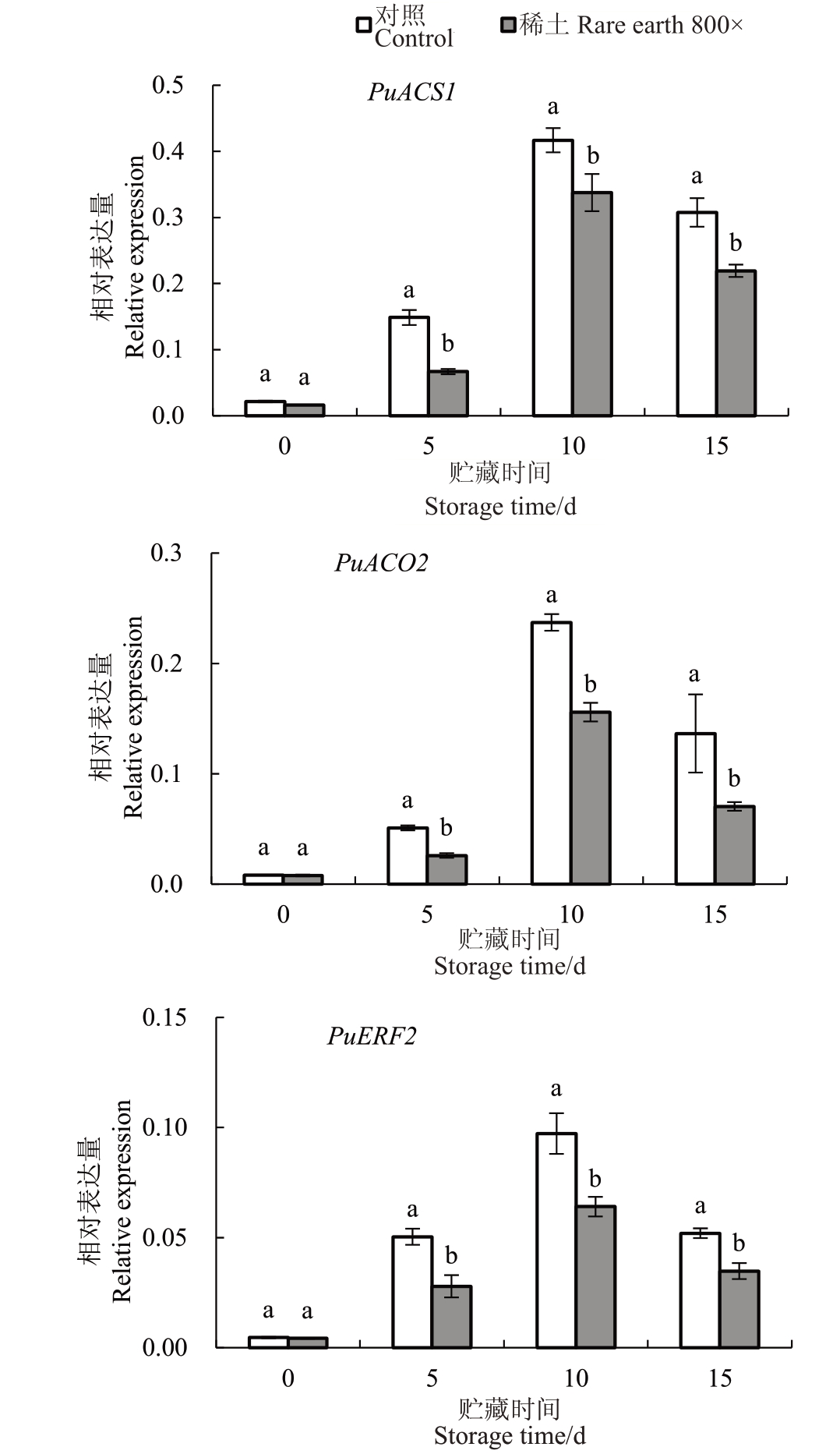
图6 稀土微肥处理对乙烯合成及响应相关基因表达量的影响
Fig.6 Effects of rare earth micro fertilizer treatments on gene expression associated with ethylene synthesis and response
3 讨 论
南红梨是南果梨的红色芽变品种,其果皮着色面积是南果梨的4 倍以上。经历20 多年的发展,虽然南红梨的产量正在稳步提升,但果实品质却参差不齐,受到陈旧的栽培制度和果园管理制度、树体老化、品种退化和气候异变等诸多因素的影响,加之果园的机械化水平较低,劳动力成本居高不下,更加剧南红梨果实品质下降[19]。
南红梨属于典型的红皮梨品种,果皮呈现鲜红色,外观品质明显优于南果梨。有研究表明,苹果上施用稀土微肥可明显提高单果质量和果实产量[20]。稀土元素能调节银杏细胞中的叶绿素荧光酶和抗氧化酶诱导类黄酮化合物的合成,进而影响银杏叶片的颜色[21]。在纽荷尔脐橙品质的研究中,发现纽荷尔脐橙果皮的亮度和着色度与土壤中稀土元素含量呈正相关[22]。在草莓生产中,喷施适当浓度的La3+能够明显提高草莓果实的色泽指数[23]。笔者通过本研究发现,在表型图中稀土微肥800倍处理组,对提高南红梨果实着色的作用最为明显,色泽指数是对照组的2.2倍。前人研究表明,稀土元素对作物的影响有着两面性,适当的浓度范围对植物有着正面效应,能够促进作物生长,提高抗逆性。当稀土元素的浓度超出植物的承受范围时,其对作物会呈现出负面影响,主要表现为诱导植物产生氧化胁迫和毒害现象[24]。笔者在本试验中,发现随着稀土微肥浓度的增大,果实着色程度呈现出先上升后下降的变化趋势,螯合稀土300倍处理组中,果树叶片出现烧叶和落果现象,与前人的研究相似。研究表明,在光照条件下,稀土元素处理后红叶石楠的色素含量明显提高,苯丙氨酸解氨酶(PAL)活性显著提高,进而促进多酚和原花青素合成[9]。之前的报道中提到,稀土元素调节植物次生代谢合成的相关机制是由于镧和铕元素与钙性质和结构相似,又被称作“超级钙”,可以优先结合细胞壁上的钙离子转运蛋白,进而提高细胞对营养成分的吸收,间接促进PAL 等的酶活性,促进花青素的积累[25]。在黄芩生长土壤的研究中,发现细胞内黄酮类化合物积累与根系土壤中稀土元素含量显著相关[26]。笔者在本试验中,测定稀土微肥800倍处理后花青素合成相关基因的表达情况,花青苷合成相关基因表达水平均显著高于对照,如PuCHS、PuDFR及PuANS。因此,推测稀土微肥处理后果皮中花青苷含量上升与稀土元素参与细胞中钙离子的转运过程有关,进而影响类黄酮物质合成,最终调节花青素合成。
梨果实内在品质体现梨果实的商业价值。有研究表明,稀土元素促进作物根系生长,提高根系对水及营养物质的吸收能力。在银杏幼苗研究中,发现在50 mg∙L-1稀土溶液处理银杏幼苗后,相比于对照其可溶性糖含量提高33%[21]。在草莓的生产中,施用适当浓度的镧元素可明显提高果实中可溶性固形物含量[23]。笔者在本试验中发现,南红梨果实中可溶性固形物含量在一定范围内随着稀土微肥浓度的增加而逐渐增加,浓度为800 倍时可溶性固形物含量达到峰值,然后随着浓度增大而下降,与前人研究中出现低促高抑的变化趋势相符。丙二醛(MDA)是细胞中膜脂过氧化的最终产物,是反映膜损伤程度和作物抗逆性的重要指标。有研究表明,在鸭梨栽培过程中施用稀土微肥能够显著减少病果量;稀土微肥应用于葡萄可以显著减少缺铁病的发生,减少白粉病和炭疽病发生[27]。利用适当浓度的稀土微肥浸泡薏苡种子,发芽后幼苗中超氧化物歧化酶活性提高,显著降低膜脂过氧化水平[28]。在本试验中,在贮藏0 d 时,稀土微肥800 倍处理组和螯合稀土300倍处理组中MDA含量显著低于对照,表明适当浓度稀土微肥可以提高果实的抗逆性,而高浓度螯合稀土微肥处理组MDA 含量显著高于对照组,一定程度反映出稀土元素对作物的毒害作用。可滴定酸含量是反映果实食用口感的重要指标。有研究表明,沙田柚施用适量的稀土可以起到增糖减酸的作用[29]。在本试验中,稀土微肥可以降低果实中可滴定酸的含量,改善果实口感。石细胞是梨中特有性状,含量过高会使得果实口感粗糙,严重影响果实食用性[30]。在前人的报道中,外源钙处理砀山酥梨愈伤组织后,显著降低果实中木质素合成相关基因表达量,抑制石细胞合成[31]。在本试验中,贮藏0~5 d时,稀土微肥处理组中石细胞含量显著下降,其中稀土微肥800 倍和螯合稀土300 倍处理组效果最为明显,与前人结果相似。果实中抗坏血酸含量是衡量果实营养水平的重要指标,在植物中作为一种重要的抗氧化剂在协助抵抗高温等逆境中有着重要作用。前人研究表明,大田栽培菠萝施用适当稀土元素后,果实中抗坏血酸含量明显提高[32]。在桃果实品质研究中,发现果实中抗氧化能力和糖与土壤中稀土元素含量呈正相关[33]。笔者在本试验中发现果实中抗坏血酸含量在螯合稀土微肥300倍处理组中达到峰值,与前人的研究相符。当稀土浓度高于此临界值时,开始出现抑制作用,果实中抗坏血酸含量降低。
果实后熟过程是果实采后贮藏阶段发生的一系列复杂反应。梨作为一种呼吸跃变型果实,采后会出现明显呼吸作用骤然升高的现象,并伴随着乙烯的大量生成,在这一过程中果实中的营养成分消耗增加。有研究表明,稀土配合1-MCP处理鲜切富士苹果后,能够明显抑制乙烯生成量和果实的呼吸速率,果实硬度下降速率减慢,果实保质期明显延长[34]。在杧果生产中,叶面喷施钙肥后,果实乙烯生成量减少,跃变峰推迟,杧果果实贮藏性明显提高[35]。对木瓜喷施适当浓度的氯化钙后,果实硬度显著提高,延缓果实硬度下降速率,果实乙烯生成量显著下降,果实耐贮性显著提高[36]。在网纹甜瓜生产中施用钙肥可显著提高果实硬度[37]。在本试验中,稀土微肥800 倍处理组南红梨果实硬度在贮藏0~10 d时显著高于对照,而乙烯生成量在贮藏5~10 d时显著低于对照,与前人研究相似。由于稀土元素中镧元素与钙的结构相似,推测稀土元素对果实贮藏性的影响机制类似钙的作用机制。
4 结 论
叶面喷施稀土微肥800倍显著提高南红梨采收时的果实硬度、可溶性固形物和抗坏血酸含量,显著上调花青苷合成相关基因PuPAL、PuCHS、PuF3H、PuDFR、PuANS 和PuUFGT 表达水平,提高果皮中花青苷含量;可滴定酸、石细胞、丙二醛含量和乙烯生成量显著下降,乙烯合成相关基因PuACS1、PuACO2 和PuEFR2 表达水平降低,推测稀土微肥中镧元素起主要作用。
[1] 李宏军,王家珍,李俊才,沙守峰,蔡忠民,姜晓艳,王杰.南红梨优质高效栽培关键技术[J].特种经济动植物,2022,25(5):66-68.LⅠHongjun,WANG Jiazhen,LⅠJuncai,SHA Shoufeng,CAⅠZhongmin,JⅠANG Xiaoyan,WANG Jie.Key techniques for high quality and efficient cultivation of Nanhong pear[J].Special Economic Animals and Plants,2022,25(5):66-68.
[2] 李文絮,曹晓云,汪晓谦.ALA 与氯化钙、蔗糖配施对南红梨果实品质及着色的影响[J].中国果树,2022(10):35-38.LⅠWenxu,CAO Xiaoyun,WANG Xiaoqian.Effects of ALA combined with calcium chloride and sucrose on fruit quality and color of Nanhong pear[J].China Fruits,2022(10):35-38.
[3] 高凌宇,邓月华,黄蓉,阳可臻,黄美松.稀土功能材料研究应用现状与发展趋势[J].稀有金属与硬质合金,2023,51(3):59-64.GAO Lingyu,DENG Yuehua,HUANG Rong,YANG Kezhen,HUANG Meisong.Research and application status and development trend of rare earth functional materials[J].Rare Metals and Cemented Carbides,2023,51(3):59-64.
[4] 李明,崔世茂,王怀栋,许涛,于翠玲.稀土处理对设施黄瓜幼苗生长的影响[J].湖北农业科学,2011,50(8):1546-1547.LⅠMing,CUⅠShimao,WANG Huaidong,XU Tao,YU Cuiling.Effect of rare earths treatment on cucumber seedling growth of greenhouse[J].Hubei Agricultural Sciences,2011,50(8):1546-1547.
[5] 郭伯生.稀土在生物领域中应用研究进展[J].稀土,1999,20(1):64-68.GUO Bosheng.Recent research advance of rare earth in the field of biology[J].Chinese Rare Earths,1999,20(1):64-68.
[6] 马倩怡,陈志强,陈志彪,张青青.南方红壤小流域水稻植株中稀土元素的内稳性特征[J].稀土,2018,39(2):57-65.MA Qianyi,CHEN Zhiqiang,CHEN Zhibiao,ZHANG Qingqing.Homeostasis of rare earth elements in paddies of southern red soil small watershed[J].Chinese Rare Earths,2018,39(2):57-65.
[7] 周上铃.柠檬园土壤养分、叶片营养与果实品质的相关性研究[D].重庆:西南大学,2021.ZHOU Shangling.Study on the correlation analysis of soil and leaf mineral nutrients with fruit quality of lemon[D].Chongqing:Southwest University,2021.
[8] 徐如松,柴瑞娟,王玉良.镧、铈对油菜种子萌发与幼苗生长的影响[J].热带作物学报,2012,33(9):1593-1597.XU Rusong,CHAⅠRuijuan,WANG Yuliang.Effect of La3+ and Ce3+ on the germination and growth of Brassica campestris[J].Chinese Journal of Tropical Crops,2012,33(9):1593-1597.
[9] 吴丽丽,高永生,黄伟峰,宋海水.稀土Eu3+对不同光强下红叶石楠色素含量及PAL 活性的影响[J].中国稀土学报,2011,29(2):217-223.WU Lili,GAO Yongsheng,HUANG Weifeng,SONG Haishui.Effects of Eu3+ on anthocyanin content and PAL activity in potted Photinia fraseri under different light intensity[J].Journal of the Chinese Society of Rare Earths,2011,29(2):217-223.
[10] 阮方毅,李运涛,邱硕,韩振斌,蒋子豪.稀土复合叶面肥对苹果叶片光合作用和果实品质的影响[J].北方园艺,2019(2):65-70.RUAN Fangyi,LⅠYuntao,QⅠU Shuo,HAN Zhenbin,JⅠANG Zihao.Effect of rare earth composite fertilizer on leaf photosynthesis and fruit quality of apple[J].Northern Horticulture,2019(2):65-70.
[11] CHEN S A,ZHAO B,WANG X D,YUAN X F,WANG Y C.Promotion of the growth of Crocus sativus cells and the production of crocin by rare earth elements[J].Biotechnology Letters,2004,26(1):27-30.
[12] CHEN D Y,ZOU Z X,REN D Y.Preliminary application of plant exploration in search for thallium mineral deposits[J].Bulletin of Mineralogy Petrology and Geochemistry,2000,19:397-400.
[13] 杨胜竹.稀土元素浓度及施用方式对烤烟生长和香气前体物质的影响[D].贵阳:贵州大学,2022.YANG Shengzhu.Effects of rare earth element concentrations and application methods on the growth and aroma precursors of flue-cured tobacco[D].Guiyang:Guizhou University,2022.
[14] 安建平.激素和环境信号调控苹果花青苷生物合成的机理研究[D].泰安:山东农业大学,2020.AN Jianping.Study on the mechanism of hormonal and environmental signals regulating anthocyanin biosynthesis in apple[D].Tai’an:Shandong Agricultural University,2020.
[15] 王海佳.紫外分光光度法研究维生素C 的稳定性及蔬果和果汁中含量的测定[D].太原:山西医科大学,2015.WANG Haijia.Study the stability of vitamin C by ultraviolet spectrophotometry and determination of the contents in several kinds of fruits,vegetables and juices[D].Taiyuan:Shanxi Medical University,2015.
[16] 李通.苹果乙烯应答因子ERF 调控果实成熟过程中乙烯合成的机理研究[D].沈阳:沈阳农业大学,2017.LⅠTong.Regulatory mechanism of apple ethylene response factor ERF in ethylene biosythesis during fruit ripening[D].Shenyang:Shenyang Agricultural University,2017.
[17] 梁爽.钙抑制剂对盐胁迫条件下植物丙二醛含量及营养结构的影响[D].长春:长春师范大学,2016.LⅠANG Shuang.Reduction of malondiadehyde (MDA) and the trophic structure in cheonopodiaceaes by calcium inhibitors under salts stressed[D].Changchun:Changchun Normal University,2016.
[18] 张伟,刘畅,杜国栋,汪晓谦.喷施钙肥对梨果实品质和石细胞代谢的影响[J].中国果树,2022(1):34-39.ZHANG Wei,LⅠU Chang,DU Guodong,WANG Xiaoqian.Effects of spraying calcium fertilizer on fruit quality and stone cell metabolism of pear[J].China Fruits,2022(1):34-39.
[19] 姜晓艳,王家珍,蔡忠民,李宏军,王杰,沙守峰.辽宁省梨产业优势与发展建议[J].北方果树,2023(2):47-48.JⅠANG Xiaoyan,WANG Jiazhen,CAⅠZhongmin,LⅠHongjun,WANG Jie,SHA Shoufeng.Advantages and development suggestions of pear industry in Liaoning province[J].Northern Fruits,2023(2):47-48.
[20] 张秀艳,李建强,张翼明,张宇生.稀土微肥对苹果中稀土含量的影响[J].稀土,2019,40(5):141-146.ZHANG Xiuyan,LⅠJianqiang,ZHANG Yiming,ZHANG Yusheng.Effects of REEs fertilizers on rare earth content in apple[J].Chinese Rare Earths,2019,40(5):141-146.
[21] CHEN Y,LUO Y Y,QⅠU N F,HU F,SHENG L L,WANG R Q,CAO F L.Ce3+ induces flavonoids accumulation by regulation of pigments,ions,chlorophyll fluorescence and antioxidant enzymes in suspension cells of Ginkgo biloba L.[J].Plant Cell,Tissue and Organ Culture,2015,123(2):283-296.
[22] 周上铃,王君秀,沈鑫健,朱礼乾,彭良志,凌丽俐,钱春,淳长品.纽荷尔脐橙果园稀土元素与果实品质的相关性研究[J].西南大学学报(自然科学版),2021,43(3):67-73.ZHOU Shangling,WANG Junxiu,SHEN Xinjian,ZHU Liqian,PENG Liangzhi,LⅠNG Lili,QⅠAN Chun,CHUN Changpin.The distribution of rare earth elements in newhall navel orange (Citrus sinensis Osbeck) orchards in southern Jiangxi province and their correlation with fruit quality[J].Journal of Southwest University(Natural Science Edition),2021,43(3):67-73.
[23] 晋莹莹,汤菊香,张妍妍,高尚,单长卷.硒、镧及其复合处理对草莓果实品质的影响[J].河南科技学院学报(自然科学版),2021,49(5):1-11.JⅠN Yingying,TANG Juxiang,ZHANG Yanyan,GAO Shang,SHAN Changjuan.Effects of selenium,lanthanum and their combined treatment on the quality of strawberry fruit[J].Journal of Henan Ⅰnstitute of Science and Technology (Natural Science Edition),2021,49(5):1-11.
[24] 李建秋.稀土元素镧和铈对小麦的毒性效应及分子机制研究[D].上海:上海交通大学,2020.LⅠJianqiu.Toxicity and underlying molecular mechanism of lanthanum and cerium on wheat[D].Shanghai:Shanghai Jiao Tong University,2020.
[25] 肖凤娟,常虹,刘德龙,白娟.稀土离子与钙调素相互作用的研究进展[J].稀土,2003,24(6):64-68.XⅠAO Fengjuan,CHANG Hong,LⅠU Delong,BAⅠJuan.Advance in study on interaction of rare earth ions with calmodium[J].Chinese Rare Earths,2003,24(6):64-68.
[26] XU Q M,CHEN H.Antioxidant responses of rice seedling to Ce4+ under hydroponic cultures[J].Ecotoxicology and Environmental Safety,2011,74(6):1693-1699.
[27] SUN Z J,SHEN W,FANG W X,ZHANG H Q,CHEN Z R,XⅠONG L H,AN T H.The quality of Scutellaria baicalensis Georgi is effectively affected by lithology and soil’s rare earth elements (REEs) concentration[J].Applied Sciences,2023,13(5):3086.
[28] LⅠU M C,PⅠRRELLO J,CHERVⅠN C,ROUSTAN J P,BOUZAYEN M.Ethylene control of fruit ripening:Revisiting the complex network of transcriptional regulation[J].Plant Physiology,2015,169(4):2380-2390.
[29] 王君秀.稀土元素对柑橘生长发育的影响研究[D].重庆:西南大学,2018.WANG Junxiu.Effects of rare earth elements on thegrowth and development of Citrus[D].Chongqing:Southwest University,2018.
[30] 汪润泽.梨石细胞性状的eQTL 和基因共表达网络研究[D].南京:南京农业大学,2020.WANG Runze.Study of eQTL and gene co-expression network on stone cell in pear[D].Nanjing:Nanjing Agricultural University,2020.
[31] 宋小飞,芮伟康,陶书田.不同浓度外源钙对梨果实石细胞的影响[J].江苏农业科学,2019,47(14):148-152.SONG Xiaofei,RUⅠWeikang,TAO Shutian.Ⅰmpacts of different concentrations of exogenous calcium on stone cells of pear fruit[J].Jiangsu Agricultural Sciences,2019,47(14):148-152.
[32] 姚艳丽,张秀梅,刘忠华,苏倚,窦美安,孙光明.硝酸镧和硝酸铈对菠萝产量品质和抗氧化酶系统的影响[J].热带作物学报,2010,31(8):1372-1376.YAO Yanli,ZHANG Xiumei,LⅠU Zhonghua,SU Yi,DOU Mei’an,SUN Guangming.Effects of lanthanum nitride and cerium nitrate on pineapple yield and quality and antioxidant enzyme system[J].Chinese Journal of Tropical Crops,2010,31(8):1372-1376.
[33] 卯新蕊,李昊聪,申志慧,陈小龙,王亚,余向阳.桃果实矿质元素与糖酸指标的相关性分析[J].江苏农业学报,2020,36(1):164-171.MAO Xinrui,LⅠHaocong,SHEN Zhihui,CHEN Xiaolong,WANG Ya,YU Xiangyang.Correlation analysis of mineral elements and sugar and acid contents in peach fruit[J].Jiangsu Journal of Agricultural Sciences,2020,36(1):164-171.
[34] BARRY C S,GⅠOVANNONⅠJ J.Ethylene and fruit ripening[J].Journal of Plant Growth Regulation,2007,26(2):143-159.
[35] ZHENG W W,CHUN ⅠJ,HONG S B,ZANG Y X.Quality characteristics of fresh-cut‘Fuji’apple slices from 1-methylcyclopropene- ,calcium chloride- ,and rare earth-treated intact fruits[J].Scientia Horticulturae,2014,173:100-105.
[36] 阎宁.氯化钙处理对番木瓜果实软化和乙烯合成的响应[D].海口:海南大学,2020.YAN Ning.Effects of calcium chloride treatment on softening and ethylene biosynthesis of harvested Papaya fruit[D].Haikou:Hainan University,2020.
[37] 宁祎琳,孙玉晨,董玉昕,郑植,陈晓峰.钙肥对日光温室网纹甜瓜生长发育的影响[J].中国瓜菜,2022,35(7):46-49.NⅠNG Yilin,SUN Yuchen,DONG Yuxin,ZHENG Zhi,CHEN Xiaofeng.Ca fertilizer affects muskmelon growth in solar greenhouse[J].China Cucurbits and Vegetables,2022,35(7):46-49.