随着全球气候变暖、夏季极端高温天气频发和重发,高温热害已经成为限制农业生产最主要的气象灾害之一。南丰蜜橘是江西省第二大特色柑橘品种,已有1300多年的历史,栽培面积约3.3万hm2,当前杨小-26是主栽品系,前期笔者研究团队已筛选其变异品系南丰-28,但两者的耐热性尚缺少数据支撑。近年来,高温热害已经成为南丰蜜橘健康生产最主要的限制因素,据南丰县地面国家气象站数据,2022年南丰县监测到38 ℃以上的高温天数是67 d,导致90%以上的果园植株叶片发生卷曲干枯,果实发生日灼,更有甚者部分果园绝收或毁园。因此,研究杨小-26、南丰-28 的高温响应机制并综合评价两者的耐热性,对未来耐热品系的筛选和推广、保证夏季植株生长和果实发育具有重要意义。
光合作用是植物细胞最主要的生理功能过程,对高温胁迫非常敏感,通常在其他细胞功能受损之前受到抑制。高温胁迫影响细胞功能的主要位点是光系统Ⅱ(PSⅡ)、核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco),而细胞色素b559(Cytb559)和质体醌(PQ)也受到影响,与PSⅡ相比,PSⅠ在高温下是相对稳定的[1-2]。在高温条件下,植物表现出短期的回避或驯化机制以响应高温热害,如改变叶向、蒸腾冷却或改变膜脂组成。同时,叶片气孔关闭和水分损失减少、气孔和毛状体密度增加以及木质部导管变大也是植物中常见的热诱导特征[2]。在高温胁迫下,植物体内会产生大量对细胞有害的活性氧(reactive oxygen species,ROS),例如超氧阴离子(O2-)、过氧化氢(H2O2)、羟自由基(·OH)等。研究证实,较低浓度的ROS 有助于植物耐受性的增强,但过量的ROS 会导致植物细胞氧化损伤[3],使叶绿体和线粒体发生膨胀,破坏蛋白和核酸等高分子,抑制新的D1蛋白合成,阻碍PSⅡ的修复循环,从而加剧光抑制[4]。植物体会产生氧化应激反应,激活体内抗氧化系统,维持细胞内ROS 产生和清除的平衡,以降低ROS对细胞的伤害程度[5]。常见的抗氧化酶主要包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)等。研究表明,高温下植物体内抗氧化酶的变化规律并不一致。通常情况下,适度的高温胁迫会增强植物叶片中抗氧化酶的活性,当温度超过一定阈值时,抗氧化酶的蛋白结构受损,活性大幅降低[6]。高温对抗氧化酶活性的影响在不同品种、器官、发育阶段、处理温度和持续时长条件下有所差异[7]。高温还会阻碍植物体内的电子传递。胡美君等[8]研究证实,高温使PSⅡ受体侧电子传递受到抑制,热耗散增加,电子传递能量减少,PSⅡ供体侧捕光复合物Ⅱ(light-harvasting complex Ⅱ,LHCⅡ)或者放氧复合体(oxygen-evolving complex,OEC)受损,捕获光能减少,电子传递受阻,最终导致光能利用率降低。叶绿素荧光作为光合作用研究的探针,不仅能反映光能吸收、激发能传递和光化学反应等光合作用的原初反应过程,而且与电子传递、质子梯度的建立及ATP 合成和CO2固定等过程有关[9]。几乎所有光合作用过程的变化均可通过叶绿素荧光反映出来,因此通过研究叶绿素荧光来间接研究光合作用的变化是一种简便、快捷、可靠的方法[10]。该技术也是笔者在本研究中使用的关键方法之一。
杨小-26是目前南丰蜜橘的主栽品种,笔者课题组前期已筛选出其变异优株南丰-28,准备在适种地区大范围推广。高温一直以来是限制南丰蜜橘植株健康生长发育的主要农业气象因素,因此,在大范围推广南丰-28 前,了解其对高温热害的生理响应,并综合评价其与杨小-26 的耐高温强弱尤其关键。笔者在本研究中以南丰蜜橘主栽品系杨小-26 及其变异品系南丰-28 的3 年生盆栽苗为试验材料,在42 ℃高温下处理24 h和48 h,观察叶片组织结构及气孔形态显微结构,测定光合荧光参数、抗氧化酶等生理生化参数,并基于以上指标构建耐热性评价模型,综合比较两个品系的耐热性,研究南丰蜜橘在高温胁迫下的生理响应机制,为耐热品种的选育和耐热机制的研究提供参考,为高温热害的综合防控提供理论支撑。
1 材料和方法
1.1 试验材料与处理
试验于2023年6月在江西省农业科学院园艺研究所综合实验大楼进行,以3年生南丰蜜橘(主栽品系杨小-26 及其变异品系南丰-28)盆栽苗为试验材料,盆的规格是高25 cm、直径50 cm,里面营养土与珍珠岩质量比为4∶1,土壤pH 约6.7,土壤湿度为70%~80%,按需浇水。
选取健康无病虫害、长势一致的杨小-26和南丰-28盆栽苗各18盆,将杨小-26和南丰-28植株移至25 ℃的人工气候室中适应3 d,此过程中人工气候室的湿度设定为65%~70%,光照度设定为800 μmol·m-2·s-1,光周期为16 h/8 h(白天/晚上),第3天将植株分别置于42 ℃人工气候室中连续处理24 h和48 h,高温处理过程中湿度、光照和光周期同上,以25 ℃培养的植株作为对照,每个处理3次重复,每个重复3株盆栽苗,试验过程中植株按需浇水,确保盆中土壤湿度维持在70%~80%。指标测定和取样时间分别是高温处理24 h和48 h后。
1.2 叶片细胞显微结构观测
每个处理3 个重复,每个重复选取1 枚叶片,剪取叶片中部主脉旁1.5 cm×1.5 cm 的方块放入2 mL的离心管中,用FAA 固定液(70%乙醇90 mL+冰乙酸5 mL+甲醛5 mL)固定,于4 ℃冰箱中保存,然后叶片经脱水、浸蜡、包埋、切片(切片厚度8 μm)、封片后制成永久装片。用体式显微镜(SMZ25,Nikon)观察并拍照,每个处理测定4 个视野。使用ⅠmageJ测量叶片上表皮、下表皮、栅栏组织和海绵组织等的结构参数[11]。
1.3 叶片下表皮气孔结构观测
每个处理3 个重复,每个重复选取1 枚叶片,剪取叶片中部主脉旁1.5 cm×1.5 cm 的方块放入2 mL的离心管中,用pH为7.0~7.5的电镜固定液(2.5%戊二醛+100 mmol·L-1磷酸盐)中固定,于4 ℃冰箱中保存。用扫描电镜(Regulus8100,日立)观测,每个处理观测10 个视野并拍照,用200 倍镜(200 μm)的照片统计气孔数目和闭合气孔的数目,计算气孔密度(公式1)和气孔闭合百分比(公式2);用3000倍镜(10 μm)照片测量气孔的长度、宽度和面积,使用ⅠmageJ软件测量[11]。
气孔密度/(个·mm-2)=气孔数目/视野面积;(1)
气孔闭合百分比/%=(每个视野闭合气孔数目/每个视野气孔数目)×100。 (2)
1.4 光合参数的测定
在活体情况下,每组处理选取盆栽植株健康的功能叶3~5 枚,使用便携式光 合仪LⅠ-6400(LⅠ-COR,美国)于09:00—11:00 测定叶片的净光合速率(Pn)、胞间二氧化碳浓度(Ci)和气孔导度(Gs)。测量期间叶室内流速500 μmol·s-1,相对湿度60%,CO2浓度390 μmol·mol-1,叶室温度25 ℃,光合有效辐射光强1000 μmol·m-2·s-1。气孔限制值(Ls)根据公式3求得,其中Ca为空气中二氧化碳值[12]。
1.5 叶绿素荧光参数的测定
在活体情况下,每组处理选取健康的功能叶3~5枚,用高速连续激发式荧光仪HandyPocket PEA(Hansatech,英国)测定快速叶绿素荧光诱导曲线,用于研究植物光合机构的光化学活性、光能的吸收和转化效率。测定前用仪器自带叶夹夹住叶片,暗适应25 min,然后仪器自动记录Fo、Fm、Fv、Fv/Fm、Sm、Area、PⅠABS、ABS/CSm、TRo/CSm、ETo/CSm、DⅠo/CSm等参数[13]。
1.6 过氧化氢和超氧阴离子含量测定
采集植株健康的功能叶0.2 g在液氮中研磨至粉末,置于2 mL离心管中,在离心管中加入2 mL提取液,于4000×g 4 ℃离心20 min,取上清液,作为待测液。使用过氧化氢和超氧阴离子活性检测试剂盒(南京建成生物工程研究所)进行加样和反应,用紫外分光光度计(UV-3600iPlus,Shimadzu)测定OD值,并以此计算H2O2和O2-含量,每个处理3次生物学重复[14]。
1.7 抗氧化酶活性和MDA含量的测定
采集植株健康的功能叶0.2 g 在液氮中研磨至粉末,置于2 mL离心管中,在离心管中加入2 mL提取液,于4000×g 4 ℃离心25 min,取上清液,作为待测液。使用超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和丙二醛(MDA)活性检测试剂盒(南京建成生物工程研究所)进行加样和反应,用紫外分光光度计(UV-3600iPlus,Shimadzu)测定OD 值,并以此计算酶活性和MDA含量,每个处理3次生物学重复[15]。
1.8 基于熵权TOPSIS的耐热性评价模型
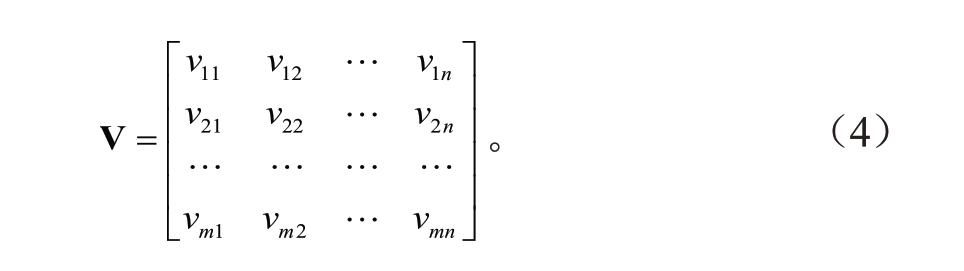
1.8.1 评价矩阵构建(1)原始耐热性评价矩阵为:
(2)标准化矩阵的构建。为了克服评价尺度的不统一,需要对原始数据V进行归一化处理,最终得到标准化矩阵R。具体见公式(5)~(7):

式中,V是原始评价矩阵;vij是第i个指标在第j个处理的初始值;R 是标准化后的矩阵;rij第i 个指标在第j 个处理的标准化值;i=1,2,3,…,m,m 是评价指标数量;j=1,2,3,…,n,n 是品系的数量。公式(6)和(7)分别为正向、负向指标算法。
1.8.2 评价指标权重的确定 利用熵权法计算各指标的权重,计算公式如(8)~(10):
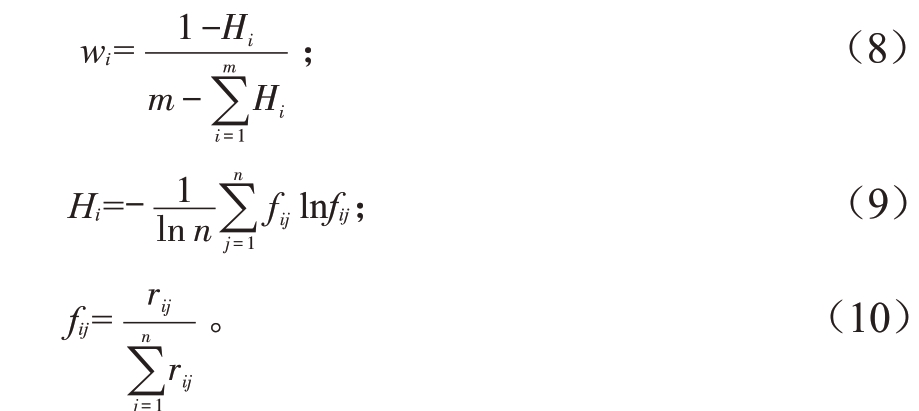
式中,wi为权重值;Hi为信息熵;fij为指标的特征比重;ln0=0。
1.8.3 综合评判结果 (1)基于熵权TOPSⅠS 的耐热性评价模型构建。使用熵权wi构建加权规范化耐热性评价矩阵,具体计算公式如(11):
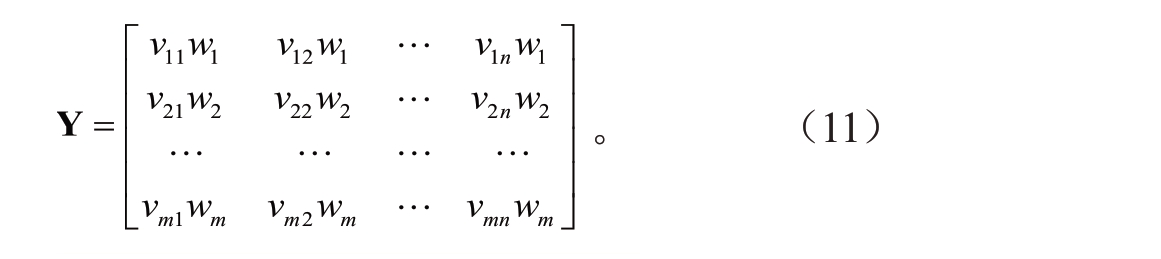
(2)耐热性评价。本文中以贴近度Tj表示耐热性的大小,范围在0~1之间,数值越贴近1,表明耐热性越强,计算公式如(12)~(16):
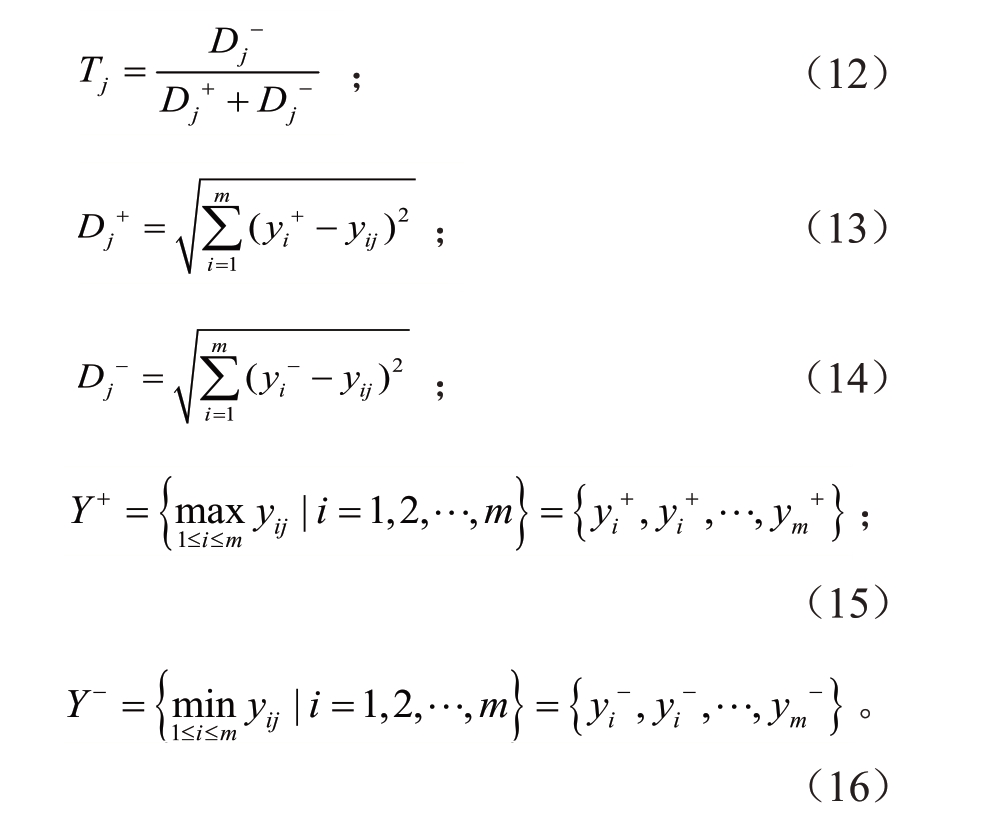
式中,Y+和Y-分别代表正负理想解;yi+和yi-分别为最优数据,其中yi+由每列中最大值构成,yi-由每列中最小值构成,yij代表第i 个指标在第j 个处理中的值。Dj+和Dj-分别代表第i 个指标与yi+和yi-的距离,其中Dj+为最优方案,Dj-为最劣方案。
1.9 数据分析
采用Excel 2013 软件对试验数据进行整理,利用Origin 2022 和Excel 软件绘图,采用Duncan 多重比较法分析多个样本之间的显著性水平,用t检验分析两个独立样本之间的显著性水平,显著水准选择p<0.05,极显著水平选择p<0.01。文中数据结果以“平均值±标准误差”表示。
2 结果和分析
2.1 高温热害对杨小-26 与南丰-28 叶片组织显微结构的影响
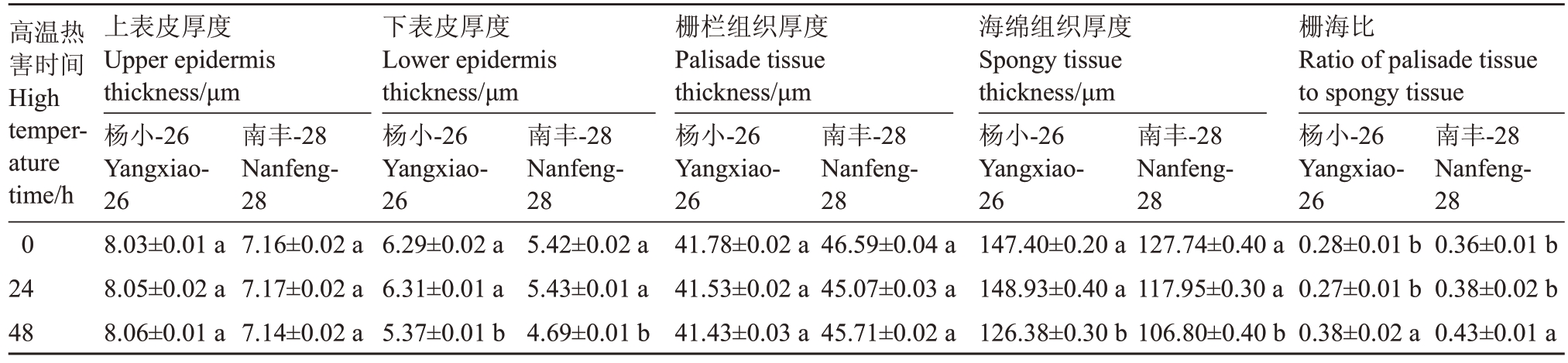
高温热害期间杨小-26与南丰-28叶片解剖结构清晰,可明显区分下表皮、海绵组织和栅栏组织,杨小-26 和南丰-28 均有双栅栏组织(图1)。由表1 可知,随着高温热害时间的延长,杨小-26和南丰-28叶片上表皮和栅栏组织的厚度变化不显著,但杨小-26叶片上表皮和栅栏组织的厚度均大于南丰-28。与对照相比,在高温处理48 h时,杨小-26和南丰28叶片下表皮和海绵组织厚度均显著降低,杨小-26分别降低了14.63%和14.29%,南丰-28 分别降低了13.47%和15.75%。在高温处理24 h时杨小-26和南丰-28的栅海比与未处理组相比差异不显著,而在高温处理48 h时差异显著。
表1 高温热害对杨小-26 与南丰-28 叶片下表皮气孔特征值的影响
Table 1 Effect of high temperature on leaf mesophyll structure parameters in leaves of Yangxiao-26 and Nanfeng-28
注:同列不同小写字母表示差异显著(p<0.05)。
Note:Different small letters in the same column indicate significant differences(p<0.05).
高温热害时间High temperature time/h 0 24 48上表皮厚度Upper epidermis thickness/μm杨小-26 Yangxiao-26 8.03±0.01 a 8.05±0.02 a 8.06±0.01 a南丰-28 Nanfeng-28 0.36±0.01 b 0.38±0.02 b 0.43±0.01 a南丰-28 Nanfeng-28 7.16±0.02 a 7.17±0.02 a 7.14±0.02 a下表皮厚度Lower epidermis thickness/μm杨小-26 Yangxiao-26 6.29±0.02 a 6.31±0.01 a 5.37±0.01 b南丰-28 Nanfeng-28 5.42±0.02 a 5.43±0.01 a 4.69±0.01 b栅栏组织厚度Palisade tissue thickness/μm杨小-26 Yangxiao-26 41.78±0.02 a 41.53±0.02 a 41.43±0.03 a南丰-28 Nanfeng-28 46.59±0.04 a 45.07±0.03 a 45.71±0.02 a海绵组织厚度Spongy tissue thickness/μm杨小-26 Yangxiao-26 147.40±0.20 a 148.93±0.40 a 126.38±0.30 b南丰-28 Nanfeng-28 127.74±0.40 a 117.95±0.30 a 106.80±0.40 b栅海比Ratio of palisade tissue to spongy tissue杨小-26 Yangxiao-26 0.28±0.01 b 0.27±0.01 b 0.38±0.02 a

图1 高温热害对杨小-26 与南丰-28 叶片解剖结构的影响
Fig.1 Effect of high temperature on leaf anatomy structure of Yangxiao-26 and Nanfeng-28
2.2 高温热害对杨小-26 与南丰-28 叶片下表皮气孔形态和特征值的影响
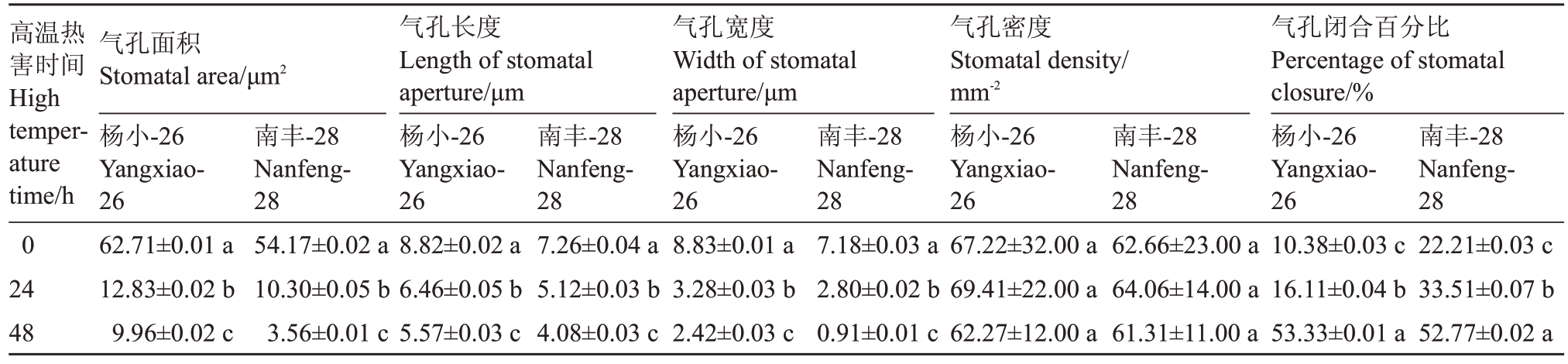
从图2 可看出,在3000 倍镜(10 μm)下可以清晰地看出,杨小-26 与南丰-28 叶片下表皮气孔形态均随着高温热害时间的延长而逐渐变小,且相同处理时长,杨小-26气孔开张大于南丰-28,尤其在高温处理48 h时更为明显。高温热害对杨小-26与南丰-28叶片下表皮气孔特征值的影响见表2。未进行高温处理时,杨小-26 与南丰-28 气孔面积分别为62.71 μm2和54.17 μm2,在高温处理48 h 后,二者气孔面积均显著降低,分别降低了84%和93%。高温对杨小-26 与南丰-28 气孔长度和宽度有显著影响,均随着高温处理时长的增加而显著减少。气孔密度不受高温处理的影响,杨小-26 与南丰-28 的气孔密度范围分别是62.27~69.41 个·mm-2 和61.31~64.06 个·mm-2。气孔闭合百分比显著受高温影响,杨小-26与南丰-28的气孔闭合百分比随着高温时间的延长而显著升高,与对照相比,在高温处理48 h后,二者气孔闭合百分比分别增加了4.14 倍和1.38倍。未进行高温处理前,杨小-26 的气孔长度、气孔宽度、气孔密度均大于南丰-28。
表2 高温热害对杨小-26 与南丰-28 叶片下表皮气孔特征值的影响
Table 2 Effect of high temperature on stomatal characteristics in leaves of Yangxiao-26 and Nanfeng-28
注:采用Duncan 多重比较法检测数据统计学意义,同列不同小写字母代表差异显著(p<0.05)。数据为3 个独立生物重复的平均值±标准误差。
Note: Different small letters indicate statistically significant by Duncan multiple- range test at p<0.05.Data were expressed as the mean ± standard error of three independent biological replicates.
高温热害时间High temperature time/h 0 24 48气孔面积Stomatal area/μm2杨小-26 Yangxiao-26 62.71±0.01 a 12.83±0.02 b 9.96±0.02 c气孔长度Length of stomatal aperture/μm杨小-26 Yangxiao-26 8.82±0.02 a 6.46±0.05 b 5.57±0.03 c气孔宽度Width of stomatal aperture/μm杨小-26 Yangxiao-26 8.83±0.01 a 3.28±0.03 b 2.42±0.03 c气孔密度Stomatal density/mm-2杨小-26 Yangxiao-26 67.22±32.00 a 69.41±22.00 a 62.27±12.00 a气孔闭合百分比Percentage of stomatal closure/%杨小-26 Yangxiao-26 10.38±0.03 c 16.11±0.04 b 53.33±0.01 a南丰-28 Nanfeng-28 22.21±0.03 c 33.51±0.07 b 52.77±0.02 a南丰-28 Nanfeng-28 54.17±0.02 a 10.30±0.05 b 3.56±0.01 c南丰-28 Nanfeng-28 7.26±0.04 a 5.12±0.03 b 4.08±0.03 c南丰-28 Nanfeng-28 7.18±0.03 a 2.80±0.02 b 0.91±0.01 c南丰-28 Nanfeng-28 62.66±23.00 a 64.06±14.00 a 61.31±11.00 a

图2 高温热害对杨小-26 与南丰-28 叶片下表皮气孔形态的影响
Fig.2 Effect of high temperature on stomatal morphology in leaves of Yangxiao-26 and Nanfeng-28
2.3 高温热害对杨小-26 与南丰-28 叶片光合参数的影响
高温热害下杨小-26与南丰-28叶片的Pn、Gs、Ci和Ls的变化规律如图3 所示。未进行高温处理时,杨小-26 与南丰-28 叶片的Pn无显著差异;随着高温时间的延长,两者Pn呈现下降趋势,高温处理48 h,两者的Pn较未进行高温处理时分别降低了57%和82%,且此时杨小-26 的Pn显著大于南丰-28。Gs与Pn的变化规律几乎一致,杨小-26 与南丰-28 的Gs均随着高温时间的延长而减少。高温下不同处理时长杨小-26 与南丰-28 的Ci和Ls变化规律相反,在高温处理24 h 时,杨小-26 与南丰-28 的Ci较未进行高温处理时下降,而Ls值较未进行高温处理时上升。高温处理48 h 时,杨小-26 与南丰-28 的Ci较未进行高温处理时上升,而Ls值较未进行高温处理时下降。但无论是24 h 还是48 h 下,杨小-26 与南丰-28 的Ci和Ls差异均不显著。
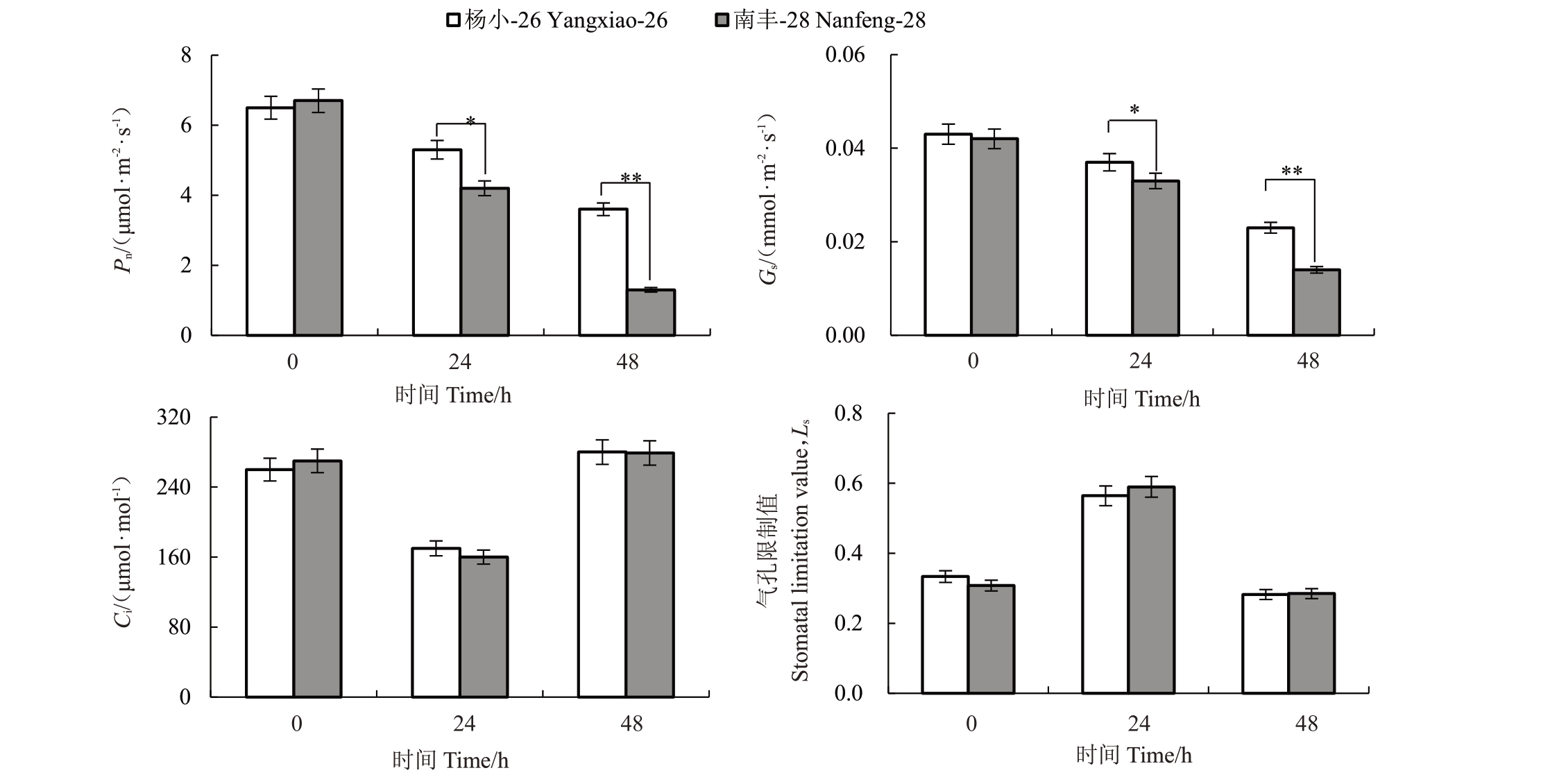
图3 高温对杨小-26 与南丰-28 叶片光合参数的影响
Fig.3 Effect of high temperature on photosynthetic parameters in leaves of Yangxiao-26 and Nanfeng-28
采用t 检测进行相同处理时间下两品系之间的差异分析,*表示在显著性水平0.05 下呈现差异,**表示在显著性水平0.01 下呈现差异。数据为3 个独立生物重复的平均值±标准误差。下同。
The t test was used to analyze the differences between the two lines under the same treatment time.*indicates the difference at a significance level of 0.05,and**indicates a difference at a significance level of 0.01.Data were expressed as the mean±standard error of three independent biological replicates.The same below.
2.4 高温热害对杨小-26 与南丰-28 叶片叶绿素荧光参数的影响
高温热害对杨小-26与南丰-28叶片荧光动力参数(Fo、Fm、Fv、Fv/Fm、Sm、Area 和PⅠABS)的影响如图4所示。随着高温热害处理时间的延长,杨小-26与南丰-28 的Fm、Fv、Fv/Fm、Sm、Area 和PⅠABS 呈现下降趋势,Fo则呈上升趋势。在高温处理48 h 时,杨小-26的Fm、Fv、Fv/Fm、Sm、Area 和PⅠABS值相对于未经过高温处理分别降低了46%、72%、53%、47%、78%和60%,南丰-28 分别降低了57%、81%、66%、53%、87%和65%,而杨小-26 和南丰-28 的Fo则分别上升31%和41%。
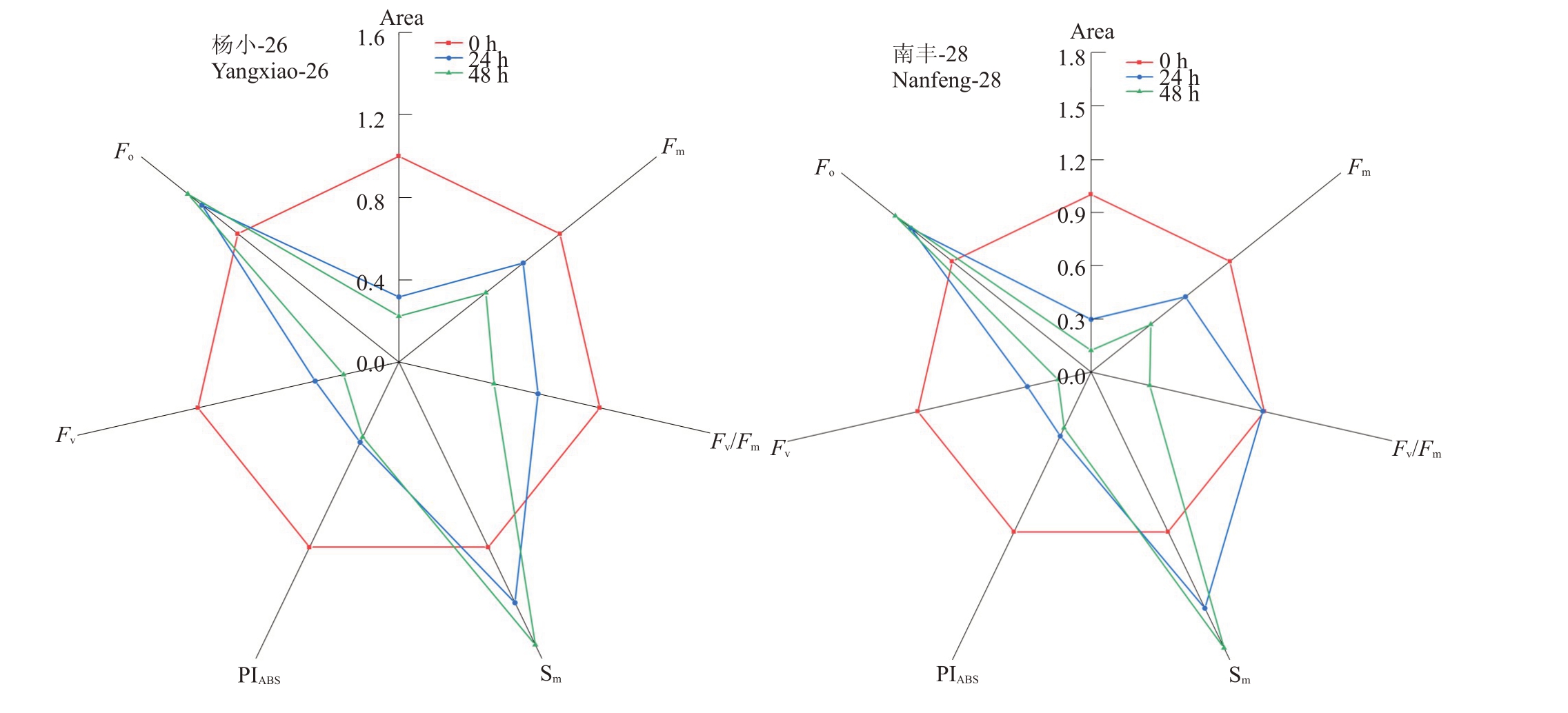
图4 高温对杨小-26 与南丰-28 叶片叶绿素荧光动力学参数的影响
Fig.4 Effect of high temperature on chlorophyll fluorescence kinetics parameters in leaves of
Yangxiao-26 and Nanfeng-28
图中数据量纲不一样,为了方便在同一图中展示,图中展示的值均是相对值,参照值是0 h 的数值(记作1)。
The data in above figures are relative values,referring to the value of 0 h.
2.5 高温热害对杨小-26 与南丰-28 叶片能量分配的影响
高温热害对杨小-26 与南丰-28 叶片能量分配[单位受光截面吸收的能量(ABS/CSm)、单位受光截面捕获用于电子传递的能量(ETo/CSm)、单位受光截面捕获用于还原QA的能量(TRo/CSm)、单位受光截面耗散的能量(DⅠo/CSm)]的影响如图5 所示。未进行高温处理时,杨小-26 与南丰-28 叶片的ABS/CSm、TRo/CSm、ETo/CSm、DⅠo/CSm无显著差异;随着高温时间的延长,两者ABS/CSm、TRo/CSm、ETo/CSm、DⅠo/CSm呈现下降趋势,无论是高温处理24 h或48 h,杨小-26 的ABS/CSm、TRo/CSm、ETo/CSm 和DⅠo/CSm值均始终高于南丰-28。
图5 高温对杨小-26 与南丰-28 叶片能量分配的影响
Fig.5 Effect of high temperature on energy distribution in leaves of Yangxiao-26 and Nanfeng-28
2.6 高温热害对杨小-26与南丰-28叶片H2O2和O2-含量的影响
高温热害对杨小-26 与南丰-28 叶片H2O2和O2-含量的影响如图6所示。随着高温热害处理时长的增加,杨小-26与南丰-28叶片上H2O2和O2-含量一直呈现增多趋势。在高温处理24 h后,南丰-28的H2O2和O2-含量均显著高于杨小-26。在高温处理48 h后,杨小-26 的H2O2和O2-含量较高温处理24 h 分别增加11%和15%,而南丰-28 的H2O2和O2-含量分别增加了11%和10%,且南丰-28 的H2O2和O2-含量均显著高于杨小-26。
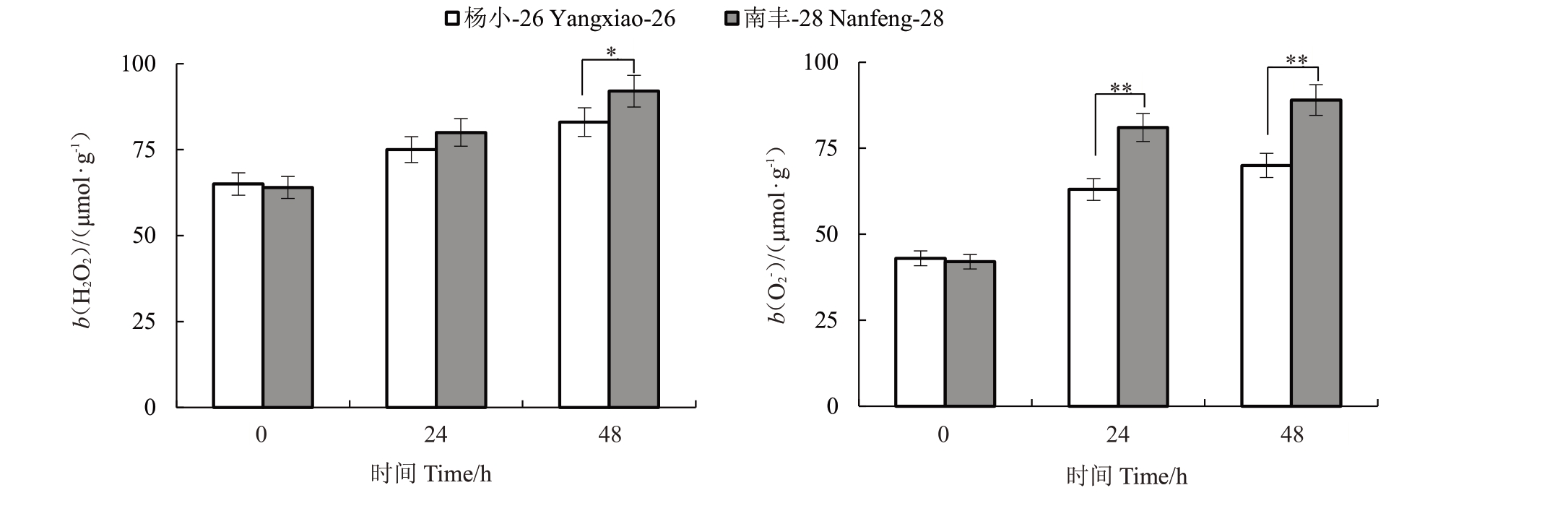
图6 高温对杨小-26 与南丰-28 叶片H2O2和O2-含量的影响
Fig.6 Effect of high temperature on H2O2 and O2-contents in leaves of Yangxiao-26 and Nanfeng-28
2.7 高温热害对杨小-26 与南丰-28 叶片抗氧化酶活性和MDA含量的影响
高温对杨小-26 与南丰-28 叶片MDA 含量及APX、SOD 和CAT 活性的影响如图7 所示。随着高温处理时间的延长,杨小-26和南丰-28叶片中MDA含量和APX活性显著上升,且高温处理后,南丰-28叶片中MDA 含量和APX 活性高于杨小-26。杨小-26 叶片中SOD 活性随着高温处理时间的延长而升高,南丰-28 叶片中SOD 活性随着高温处理时间的延长先升高后下降,在高温处理24 h 时,杨小-26 和南丰-28叶片中SOD活性差异不显著,但在处理48 h后杨小-26 叶片中SOD 活性显著低于南丰-28。杨小-26 叶片中CAT 活性的高低顺序为48 h>24 h>0 h,南丰-28叶片中CAT活性高低顺序为24 h>0 h>48 h,且高温处理24 h时杨小-26 CAT活性显著高于南丰-28,而高温处理48 h 时杨小-26 CAT 活性显著低于南丰-28。
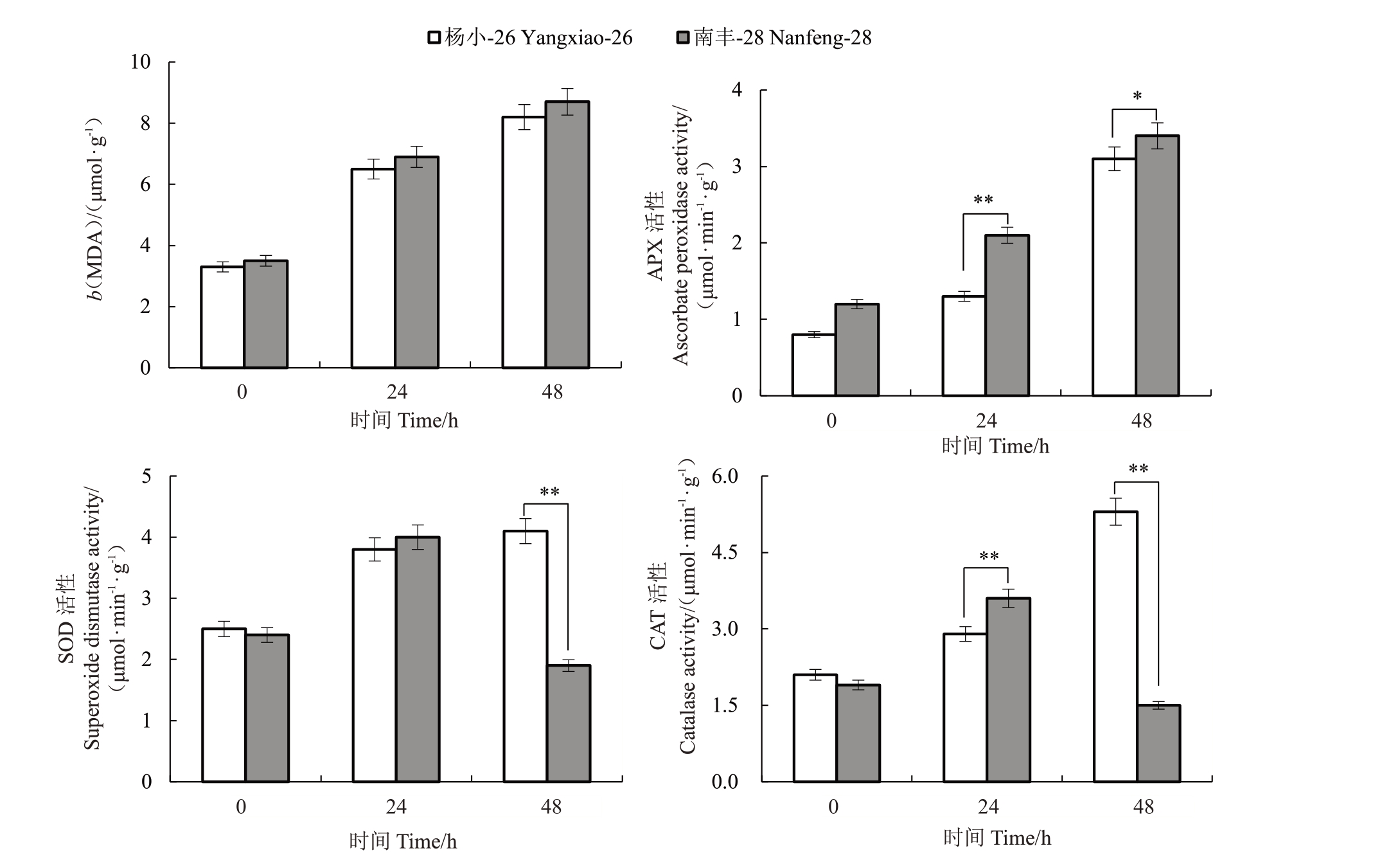
图7 高温对杨小-26 与南丰-28 叶片MDA 含量和抗氧化酶活性的影响
Fig.7 Effect of high temperature on MDA contents and antioxidant enzymes activities in leaves of
Yangxiao-26 and Nanfeng-28
2.8 基于熵权TOPSIS的杨小-26与南丰-28耐热性评价
通过相关性分析和主成分分析,兼顾数据易取性,筛选出气孔面积、净光合速率、MDA含量、Fv/Fm和SOD活性这5个参数来计算杨小-26与南丰-28的耐热性。
(1)加权规范化耐热性评价矩阵。通过计算不同处理下气孔面积(As)、净光合速率(Pn)、丙二醛(MDA)含量、最大光化学效率(Fv/Fm)和超氧化物歧化酶(SOD)活性等5 个指标的权重分别是0.16、0.21、0.25、0.23 和0.15,构建基于熵权TOPSⅠS 的耐热性评价模型Y,具体矩阵如下。

(2)耐热性评价。贴近度的范围是0到1,杨小-26的贴近度为0.678 4,南丰-28的贴近度为0.412 9,耐热性越强,贴近度越接近1,可以得出杨小-26 的耐热性强于南丰-28。
3 讨 论
叶片是植物对环境变化比较敏感且可塑性较强的器官,其形态解剖结构的变化能较好地反映植物的生长状况和对外界的适应性[16]。发达的栅栏组织不仅可以保护叶肉细胞免受灼伤,还可以利用衍射光进行光合作用。在本研究中,高温处理下杨小-26和南丰-28 叶片上表皮和栅栏组织的厚度变化不显著。与未处理相比,在高温48 h 时,杨小-26 和南丰28叶片下表皮和海绵组织厚度均显著降低,栅海比显著升高,表明长期高温破坏两者叶片内部结构。气孔是植物表皮上的特殊结构,是植物与外界环境进行CO2和H2O 等气体交换的重要通道和器官[17]。植物叶片通过改变气孔面积、密度、长(宽)度以及空间分布格局来迅速响应短期内环境变化,从而提高叶片的气孔交换速率[18]。目前,关于高温对气孔密度的影响还存在一定分歧,有研究表明,高温处理对植物叶片的气孔密度无显著影响[11];然而,另一些研究却发现高温能够减少或增加植物叶片表皮的气孔密度[19-20]。出现截然相反结果的原因可能与植物的种类、遗传特性、温度和处理方式等因素密切相关。本研究表明,高温处理24 h 和48 h 对杨小-26 和南丰-28 的气孔密度影响不显著。气孔密度是评价植物耐热性强弱的一个重要指标,通常耐热品种比不耐热品种气孔密度大,这有利于植物蒸腾作用的加强,显著降低叶片表面的温度,从而保护叶片组织免受高温热害[21]。在本研究中,杨小-26叶片下表皮的气孔密度大于南丰-28,这可能是杨小-26 耐热性强的原因之一。此外高温还会影响植物叶片的气孔开张度,气孔开张度是反映植物耐热性的另一个重要指标[22]。在高温逆境条件下,植物叶片通过气孔开闭对高温做出反馈,维持叶片细胞水分散失和光合效率间的平衡。笔者在本研究中发现,随着高温时间的延长,杨小-26 和南丰-28 叶片下表皮气孔的面积、长宽度和闭合比都有所下降,但是不管是24 h还是48 h,杨小-26 气孔的面积和长宽度均大于南丰-28,而气孔闭合比则小于南丰-28,这表明杨小-26的耐热性强于南丰-28。
光合作用是植物响应外界温度变化最为敏感的生理过程之一[23]。植物光合作用受到抑制有气孔因素和非气孔因素[24]。早期的研究把Gs与Pn之间的高度正相关当作光合作用受气孔限制的依据,把Ci的降低幅度远小于Pn降低的幅度和接近恒定的Ci当作Pn降低的非气孔原因的判断依据。而许大全[25]认为判断叶片光合速率降低的主要原因是气孔因素还是非气孔因素依据的是Ci和Ls的变化方向,即Ci降低和Ls升高表明主要原因是气孔因素,而Ci增高和Ls降低则表明主要原因是非气孔因素。笔者在本研究中发现杨小-26和南丰-28在高温处理24 h时二者Pn的下降伴随着Ci降低和Ls升高,这表明此时Pn的降低是气孔因素占主导原因。而在高温处理48 h时,杨小-26 和南丰-28 的Pn下降伴随着Ci增高和Ls降低,这表明此时非气孔因素是二者Pn降低的主要原因。在本研究中同时还可以间接证明将Gs与Pn之间的高度正相关当作光合作用受气孔限制的原因有一定的片面性。叶绿素荧光参数Fv/Fm是环境胁迫程度的指标和探针,反映的是植物潜在最大的光合能力,是评估光合作用效率的一种快捷有效的方法[9]。在非胁迫条件下其值变化很小,稳定在0.78~0.84 之间,表明能很好地吸收并利用光能[26]。本研究表明杨小-26 和南丰-28 的Fv/Fm值均随着高温时间的延长而降低,且相同的高温处理时长,杨小-26的Fv/Fm值均大于南丰-28,这表明高温抑制了两者对光能的吸收利用,且杨小-26的光合作用效率要大于南丰-28。Fo和Fm可以评估植物光合作用受到抑制的程度,当光合作用受到抑制时,Fm值会降低,而Fo值会升高。高温下Fo的升高,与光捕获复合体Ⅱ(LHCⅡ)解离和PSⅡ还原侧电子转移受阻有关[27],而Fm的降低可能与PSⅡ活性的效率较低有关,这是由于D1 蛋白的构象变化,导致PSⅡ电子受体的特性改变[28]。同时,Fo、Fm和Fv/Fm也是评估逆境伤害是否可逆的重要参数,本文仅仅涉及特定高温以及持续时间对杨小-26 和南丰-28 叶片的伤害,并未涉及灾后的恢复,这也是接下来实验需要完善的方面,为未来高温热害的防控措施制定提供理论支撑。
Sm可评估PSⅡ和PSⅠ之间质体醌库(PQ pool)的大小[29],该值变大表明PSⅡ和PSⅠ之间的电子传递较少。本研究表明,杨小-26 和南丰-28 随着高温时间的延长,Sm值逐渐变大,表明高温对两者的电子传递均有影响,相同处理时间,南丰-28的Sm大于杨小-26,表明高温对南丰-28的影响大于杨小-26。Area 是相对于PSⅠⅠ还原侧的电子受体QA 的池大小,该值的降低是由于从PSⅡ反应中心到醌池的电子转移被阻断[10]。因此,高温下杨小-26 和南丰-28 的Area降低可能是减少从RC到醌池的电子转移的结果。这一结果同样从光合性能指数PⅠABS值的变化得到验证。笔者在本研究中还发现,随高温时间的延长,杨小-26和南丰-28的ABS/CSm、ETo/CSm、TRo/CSm、DⅠo/CSm均显著下降,高温导致两者PSⅡ活性反应中心的密度下降,单位面积吸收的光能降低,捕获用于还原QA 的光能减少,捕获用于电子传递光能的能力减弱,从而导致PSⅡ的光化学活性受到抑制,进而影响植株光合作用,抑制植株的生长。上述参数值也证实,在相同高温且处理时间一致的情况下,对南丰-28 光合能量传递的影响要显著大于杨小-26。
在非生物胁迫条件下,过量ROS的产生会超过细胞的清除能力,破坏细胞膜的功能和结构,导致细胞死亡[4]。MDA 是植物细胞膜脂过氧化的最终产物,是衡量细胞膜破坏的关键指标[12]。为了克服氧化应激,植物体会诱导抗氧化防御机制,SOD、POD和CAT 是存在于植物体中抵御ROS 过量产生的抗氧化酶,SOD可以将超氧化物阴离子转化为H2O2和O2,而APX和CAT可以进一步将H2O2分解为H2O和O2[30],以降低ROS 的毒害作用。这3 种酶可在一定程度上清除体内过剩的ROS,维持ROS产生和清除之间的动态平衡,维持细胞膜结构和功能的完整,但是当胁迫超过植物的承受阈值时,SOD、APX 和CAT 活性则会下降甚至结构受到破坏,导致细胞内ROS过度积累,MDA含量增加,膜脂过氧化严重,导致细胞的代谢失衡,植物体的生长受到抑制。在本研究中,随着高温时间的延长,杨小-26和南丰-28叶片内的MDA、H2O2和O2-含量呈现逐渐上升趋势,表明高温破坏了两者细胞膜结构,并且随着高温热害时间的延长,对叶片细胞膜伤害越严重。同时,笔者在本研究中还发现杨小-26叶片内SOD和CAT活性最高值在高温处理48 h,而南丰-28 叶片内SOD 和CAT活性最高值在高温处理24 h,可能是由于南丰-28在高温处理24 h就达到细胞膜损伤的极限,在高温48 h 时,SOD 和CAT 酶结构和功能受到破坏,因此SOD和CAT活性变化趋势是先升高后降低。
4 结 论
通过观测高温(42 ℃)处理24 h和48 h杨小-26和南丰-28 的叶片组织解剖结构、气孔形态特征以及测定光合荧光参数、叶片能量分配、活性氧物质和抗氧化酶活性等生理生化指标,依据以上参数,构建基于熵权TOPSⅠS 的耐热性评价模型,计算出杨小-26 和南丰-28 的贴近度分别是0.678 4 和0.412 9,确定杨小-26 的耐热性强于南丰-28。高温处理下(24 h 或48 h),杨小-26 叶片电子传递效率均高于南丰-28,而PSⅡ活性中心的损伤程度则小于南丰-28。高温处理24 h时,杨小-26和南丰-28叶片Pn下降的原因是气孔因素,而高温处理48 h时,Pn下降的原因是非气孔因素。高温下杨小-26 叶肉组织紧实、气孔密度大以及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性的升高是其耐热性相对于南丰-28 较强的主要原因。
[1] RATH J R,PANDEY J,YADAV R M,ZAMAL M Y,RAMACHANDRAN P,MEKALA N R,ALLAKHVERDⅠEV S Ⅰ,SUBRAMANYAM R.Temperature-induced reversible changes in photosynthesis efficiency and organization of thylakoid membranes from pea (Pisum sativum)[J].Plant Physiology and Biochemistry,2022,185:144-154.
[2] MATHUR S,AGRAWAL D,JAJOO A.Photosynthesis:Response to high temperature stress[J].Journal of Photochemistry and Photobiology B:Biology,2014,137:116-126.
[3] APEL K,HⅠRT H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction[J].Annual Review of Plant Biology,2004,55:373-399.
[4] PⅠTZSCHKE A,FORZANⅠC,HⅠRT H.Reactive oxygen species signaling in plants[J].Antioxidants & Redox Signaling,2006,8(9/10):1757-1764.
[5] POSPÍŠⅠL P.Production of reactive oxygen species by photosystem Ⅱas a response to light and temperature stress[J].Frontiers in Plant Science,2016,7:1950.
[6] GARCÍA-CAPARRÓS P,FⅠLⅠPPⅠS L,GUL A,HASANUZZAMAN M,OZTURK M,ALTAY V,LAO M T.Oxidative stress and antioxidant metabolism under adverse environmental conditions:A review[J].The Botanical Review,2021,87(4):421-466.
[7] HASANUZZAMAN M,BHUYAN M H M B,ZULFⅠQAR F,RAZA A,MOHSⅠN S M,MAHMUD J A,FUJⅠTA M,FOTOPOULOS V.Reactive oxygen species and antioxidant defense in plants under abiotic stress:Revisiting the crucial role of a universal defense regulator[J].Antioxidants,2020,9(8):681.
[8] 胡美君,郭延平,沈允钢,张良诚.柑橘属光合作用的环境调节[J].应用生态学报,2006,17(3):3535-3540.HU Meijun,GUO Yanping,SHEN Yungang,ZHANG Liangcheng.Environmental regulation of Citrus photosynthesis[J].Chinese Journal of Applied Ecology,2006,17(3):3535-3540.
[9] MAXWELL K,JOHNSON G N.Chlorophyll fluorescence:A practical guide[J].Journal of Experimental Botany,2000,51(345):659-668.
[10] KALAJⅠH M,JAJOO A,OUKARROUM A,BRESTⅠC M,ZⅠVCAK M,SAMBORSKA ⅠA,CETNER M D,ŁUKASⅠK Ⅰ,GOLTSEV V,LADLE R J.Chlorophyll a fluorescence as a tool to monitor physiological status of plants under abiotic stress conditions[J].Acta Physiologiae Plantarum,2016,38(4):102.
[11] 刘敏,房玉林.高温胁迫对葡萄幼树生理指标和超显微结构的影响[J].中国农业科学,2020,53(7):1444-1458.LⅠU Min,FANG Yulin.Effects of heat stress on physiological indexes and ultrastructure of grapevines[J].Scientia Agricultura Sinica,2020,53(7):1444-1458.
[12] XU C,YANG Z Q,YANG S Q,WANG L,WANG M T.High humidity alleviates photosynthetic inhibition and oxidative damage of tomato seedlings under heat stress[J].Photosynthetica,2020,58(1):146-155.
[13] 耿庆伟,邢浩,翟衡,蒋恩顺,杜远鹏.臭氧胁迫下不同光强与温度处理对‘赤霞珠’葡萄叶片PSⅡ光化学活性的影响[J].中国农业科学,2019,52(7):1183-1191.GENG Qingwei,XⅠNG Hao,ZHAⅠHeng,JⅠANG Enshun,DU Yuanpeng.Effects of different light intensity and temperature on PS Ⅱphotochemical activity in‘Cabernet Sauvignon’grape leaves under ozone stress[J].Scientia Agricultura Sinica,2019,52(7):1183-1191.
[14] ⅠQBAL N,FATMA M,GAUTAM H,UMAR S,SOFO A,D'ⅠPPOLⅠTO Ⅰ,KHAN N A.The crosstalk of melatonin and hydrogen sulfide determines photosynthetic performance by regulation of carbohydrate metabolism in wheat under heat stress[J].Plants,2021,10(9):1778.
[15] XⅠAO F,YANG Z Q,LEE K W.Photosynthetic and physiological responses to high temperature in grapevine(Vitis vinifera L.)leaves during the seedling stage[J].The Journal of Horticultural Science and Biotechnology,2017,92(1):2-10.
[16] WANG Y,ZHANG L M,CHEN J,FENG L,LⅠF B,YU L F.Study on the relationship between functional characteristics and environmental factors in Karst plant communities[J].Ecology and Evolution,2022,12(9):e9335.
[17] HETHERⅠNGTON A M,WOODWARD F Ⅰ.The role of stomata in sensing and driving environmental change[J].Nature,2003,424(6951):901-908.
[18] 朱玉,黄磊,郑云普,郝立华,姜国斌,王贺新,李根柱,张自川,弓晓杰.高温对高丛越橘叶片气孔特征和气体交换参数的影响[J].果树学报,2016,33(4):444-456.ZHU Yu,HUANG Lei,ZHENG Yunpu,HAO Lihua,JⅠANG Guobin,WANG Hexin,LⅠGenzhu,ZHANG Zichuan,GONG Xiaojie.Effects of high temperatures on leaf stomatal traits and gas exchanges of highbush blueberries[J].Journal of Fruit Science,2016,33(4):444-456.
[19] 刘亮,张运鑫,郝立华,马保国,常志杰,殷嘉伟,刘媛媛,郑云普.大气CO2浓度倍增和高温对玉米气孔特征及气体交换参数的影响[J].农业工程学报,2022,38(22):73-80.LⅠU Liang,ZHANG Yunxin,HAO Lihua,MA Baoguo,CHANG Zhijie,YⅠN Jiawei,LⅠU Yuanyuan,ZHENG Yunpu.Effects of double atmospheric CO2 concentration and high temperature on the stomatal traits and leaf gas exchange of maize plants[J].Transactions of the Chinese Society of Agricultural Engineering,2022,38(22):73-80.
[20] JUMRANⅠK,BHATⅠA V S,PANDEY G P.Ⅰmpact of elevated temperatures on specific leaf weight,stomatal density,photosynthesis and chlorophyll fluorescence in soybean[J].Photosynthesis Research,2017,131(3):333-350.
[21] 申惠翡,赵冰,徐静静.15 个杜鹃花品种叶片解剖结构与植株耐热性的关系[J].应用生态学报,2016,27(12):3895-3904.SHEN Huifei,ZHAO Bing,XU Jingjing.Relationship between leaf anatomical structure and heat resistance of 15 Rhododendron cultivars[J].Chinese Journal of Applied Ecology,2016,27(12):3895-3904.
[22] DRⅠESEN E,VAN DEN ENDE W,DE PROFT M,SAEYS W.Ⅰnfluence of environmental factors light,CO2,temperature,and relative humidity on stomatal opening and development:a review[J].Agronomy,2020,10(12):1975.
[23] HUSSAⅠN S,ULHASSAN Z,BRESTⅠC M,ZⅠVCAK M,ZHOU W J,ALLAKHVERDⅠEV S Ⅰ,YANG X H,SAFDAR M E,YANG W Y,LⅠU W G.Photosynthesis research under climate change[J].Photosynthesis Research,2021,150(1/2/3):5-19.
[24] FARQUHAR G D,SHARKEY T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33:317-345.
[25] 许大全.光合作用气孔限制分析中的一些问题[J].植物生理学通讯,1997,33(4):241-244.XU Daquan.Some problems in stomatal limitation analysis of photosynthesis[J].Plant Physiology Communications,1997,33(4):241-244.
[26] EL-HENDAWY S,AL-SUHAⅠBANⅠN,ELSAYED S,ALOTAⅠBⅠM,HASSAN W,SCHMⅠDHALTER U.Performance of optimized hyperspectral reflectance indices and partial least squares regression for estimating the chlorophyll fluorescence and grain yield of wheat grown in simulated saline field conditions[J].Plant Physiology and Biochemistry,2019,144:300-311.
[27] GOLTSEV V N,KALAJⅠ H M,PAUNOV M,BĄBA W,HORACZEK T,MOJSKⅠJ,KOCⅠEL H,ALLAKHVERDⅠEV S Ⅰ.Variable chlorophyll fluorescence and its use for assessing physiological condition of plant photosynthetic apparatus[J].Russian Journal of Plant Physiology,2016,63(6):869-893.
[28] KALAJⅠH M,SCHANSKER G,LADLE R J,GOLTSEV V,BOSA K,ALLAKHVERDⅠEV S Ⅰ,BRESTⅠC M,BUSSOTTⅠF,CALATAYUD A,DĄBROWSKⅠP,ELSHEERY N Ⅰ,FERRONⅠL,GUⅠDⅠL,HOGEWONⅠNG S W,JAJOO A,MⅠSRA A N,NEBAUER S G,PANCALDⅠS,PENELLA C,POLⅠD,POLLASTRⅠNⅠ M,ROMANOWSKA- DUDA Z B,RUTKOWSKA B,SERÔDⅠO J,SURESH K,SZULC W,TAMBUSSⅠE,YANNⅠCCARⅠM,ZⅠVCAK M.Frequently asked questions about in vivo chlorophyll fluorescence:Practical issues[J].Photosynthesis Research,2014,122(2):121-158.
[29] STRASSER R J,TSⅠMⅠLLⅠ-MⅠCHAEL M,SRⅠVASTAVA A.Analysis of the chlorophyll a fluorescence transient[M]//PAPAGEORGⅠOU G C,GOVⅠNDJEE.Chlorophyll a Fluorescence.Dordrecht:Springer,2004:321-362.
[30] KUMARⅠA,SⅠNGH B M,SHARMA S,KUMAR C M,DEBNATH A,MAHARANA C,PARⅠHAR M,SHARMA B.ROS regulation mechanism for mitigation of abiotic stress in plants[M].London,UK:ⅠntechOpen,2022.