磷是植物必需的营养元素,参与脂质代谢、含氮化合物代谢和碳水化合物运输等生物化学过程,在植物的生长发育、抗逆性和产量品质等方面发挥着重要作用。土壤中的磷以无机磷酸盐(Pi)的形式被植物吸收和同化[1-2]。据统计,大部分土壤的总磷含量(w,后同)在50~1500 mg·kg-1之间[3-4]。然而,土壤中有效磷含量远远不足以满足植物的需求,主要是磷元素大多数以磷酸根的形式与土壤中的钙、铁、铝等结合,转变成不溶性的磷酸钙、磷酸铝、磷酸铁等[5],导致磷素难以被植物体所吸收。
为了应对土壤中有效磷含量低的状况,植物进化出了广泛的适应策略以促进对磷元素的吸收和利用。根系构型(root system architecture,RSΑ)重建是从土壤中获得更多有效磷的关键策略,如根长度、根表面积、根直径和根毛数量等[6-7]。在拟南芥中,主根缩短、侧根和根毛数量和长度增加是磷缺乏的典型特征[8]。对苹果的研究也表明,苹果砧木在磷胁迫下会增加吸收根的总面积和长度,根毛数量也会显著增加[9]。据报道,植物通过激活高亲和性磷转运蛋白来优化磷的吸收和利用。PHT1 作为一类高亲和力磷转运蛋白,通常在植物根系中显著高表达[10],在植物根系对土壤有效磷的吸收中起着至关重要的作用。在苹果的研究中还测定了14个MdPHT1基因在不同组织中的表达,其中,MdPHT1;7在提高植物磷积累和低磷耐受性方面发挥重要作用[11]。磷缺乏还强烈影响生物化学反应,包括促进有机酸、质子和酸性磷酸酶的分泌,从而增加根际有效磷含量[12]。植物根系分泌的多种化合物,如氨基酸、脂肪酸、糖、有机酸、维生素等,也为土壤中微生物的生长提供了充足的养分[13],同时溶磷微生物能有效提高土壤可溶性磷含量,改善植物缺磷环境[14-15]。
在低磷胁迫下,果树根系分泌的有机酸和酸性磷酸酶活性与磷供给水平呈负相关[16]。随着磷供给水平的降低,不同果树根系分泌的酸性磷酸酶活性增强,有机酸含量增加[17]。许多研究者把低磷胁迫下植物根系有机酸分泌量和酸性磷酸酶活性作为评价植物低磷耐受性的重要指标,然而关于苹果根系分泌物对磷元素高效吸收影响的研究较少。鉴于此,笔者在本试验中探究了不同供磷水平下各苹果砧木类型的生理响应,对7 种苹果砧木在磷吸收利用效率、根系分泌物、RSΑ及光合、荧光参数等层面进行了较全面的分析,通过相关性及主成分分析探讨根系分泌物对苹果砧木磷元素高效吸收的影响并设计磷酸钙试验,为揭示苹果砧木磷元素高效吸收的生理机制提供依据。
1 材料和方法
1.1 试验材料
试验于2022 年5—6 月在中国农业大学科学园温室内进行。以1 年生苹果砧木平邑甜茶(Malus hupehensis Rehd.)、八棱海棠(M.robusta Rehd.)、M26(M.pumila Mill.)、M9(M.pumila Mill.)、楸子(M.prunifolia)、中砧一号(M.xiaojinensis)、山丁子(M.baccata Borkh.)为试验材料。
1.2 试验处理
每个砧木类型选择24 株生长势一致的健康植株,每个处理设置8株重复。将1年生植株栽植到直径10 cm、高14 cm的黑色方形塑料盆中。栽培基质为V(沙子)∶V(蛭石)∶V(珍珠岩)=5∶4∶1 的混合物[18]。移栽后缓苗7 d,其间用去离子水浇灌。试验分别设置3 个处理,正常供磷对照(0.5 mmol·L-1 KH2PO4)、低磷LP(0.01 mmol·L-1 KH2PO4)、额外施加磷酸钙LP-Ca3(PO4)2(0.01 mmol·L-1 KH2PO4,每1 kg 基质混入2.5 g Ca3(PO4)2)[19]。
用以下营养液处理生长良好的幼苗:(1)正常供磷(对照),1/2 Hoagland溶液,含500 μmol·L-1 KH2PO4;(2)低磷(LP),1/2 Hoagland 溶液,含10 µmol·L-1 KH2PO4;(3)额外施加磷酸钙处理(LP-Ca3(PO4)2),1/2 Hoagland 溶液,含10 µmol·L-1 KH2PO4。每2 d给植株浇1次营养液,每次浇灌50 mL。处理50 d后进行指标测定。
1.3 生理指标的测定方法
生长指标的测定:用直尺测量植株茎基部到顶芽的高度;采用EPSON 扫描仪和根图像分析软件WinRHIZO version 5.0(Regent Instruments Inc.,Canada)测定总根长度(root total length,RTL)、根总体积(root total volume,RTⅤ)、根系总表面积(root surface,RS)和根尖数(root tips,RT)。
光合指标:采用便携式光合仪(Li-6400 XT,Li-Cor Biosciences, Lincoln, USΑ)测定净光合速率(Pn),采用配置2 cm2荧光叶室的便携式光合仪测定叶片的叶绿素荧光参数。于黑暗环境下对叶片进行完全暗适应处理,再将叶片在自然光下进行充分活化,于1000 μmol·m-2·s-1的光照度下进行PSII实际光化学效率(PhiPS2)的测定。不同砧木不同供磷处理随机选取3株,每株选取生长情况良好的功能叶片2枚。
根分泌物的收集:在处理50 d 后收集根系分泌物。将根系从基质中轻轻剥离并摇动。采用Kidd等[20]的方法。用蒸馏水轻轻洗净苹果砧木根系,立即将洗净的根系放入装有100 mL 0.05 mmol·L-1 Ca-Cl2溶液的黑色塑料瓶中,此时将根系完全浸没,从10:00—16:00连续收集6 h,用气泵不断通气,以保证根系的正常呼吸。收集的根分泌物立即放于-80 ℃冰箱,用于后续测定。将收集的液体冻干后溶解在1 mL去离子水中。
根系分泌物的测定:柠檬酸分泌速率(citric acid secretion rate,CΑSR)采用柠檬酸含量检测试剂盒进行测定(购于Solarbio 公司,货号:BC2155);苹果酸分泌速率(malic acid secretion rate,MΑSR)采用苹果酸含量测定试剂盒进行测定(购于苏州格锐思生物科技有限公司,货号:G0862F);根系分泌酸性磷酸酶活性的测定参照Ni等[21]的方法;质子分泌速率(proton secretion rate,PSR)的测定参照M’sehli等[22]的方法。
磷吸收和磷利用效率的测定:处理50 d后,将采集的植物样品洗净并于烘箱放置72 h烘干,研磨后采用微波消解法进行消解,采用电感耦合等离子体发射光谱仪法(ICP-OES)测定磷含量。
1.4 数据处理与分析
利用Microsoft Excel 2019、Origin 2022 软件处理试验数据并绘图,通过Origin 2022和SPSS Statistics 25.0软件进行统计分析,利用T检验进行差异显著性分析(p<0.05),采用最小显著性差异(LSD)法进行多重比较,并对数据进行相关性分析、标准化处理和主成分分析。
2 结果与分析
2.1 低磷及额外施加磷酸钙对苹果砧木生长的影响
在正常施磷条件下,7 种砧木中山丁子的根冠比最大。与正常施磷相比,在低磷条件下,平邑甜茶、M26、M9、中砧一号的根冠比均显著提高,中砧一号的上升幅度为49.5%。额外施加磷酸钙后山丁子的根冠比最大;M9 的根冠比小于除M26 以外的其他5 种砧木。相较于低磷处理,经额外施加磷酸钙后,平邑甜茶的根冠比显著提高,其他6种砧木无显著变化。7种砧木在正常施磷时中砧一号的株高增长比例最大,平邑甜茶最小。在低磷条件下,除M26 和平邑甜茶外,其余5 种砧木的株高增长比例均低于正常施磷条件。额外施加磷酸钙后,中砧一号和M9 的株高增长比例显著高于平邑甜茶、M26、山丁子;相较于低磷处理,在额外施加磷酸钙后平邑甜茶的株高增长比例显著下降,而八棱海棠和M9则显著提高(表1)。
表1 低磷及额外施加磷酸钙对7 种苹果砧木生长的影响
Table 1 Effects of low phosphorus and additional calcium phosphate on the growth of seven apple rootstocks
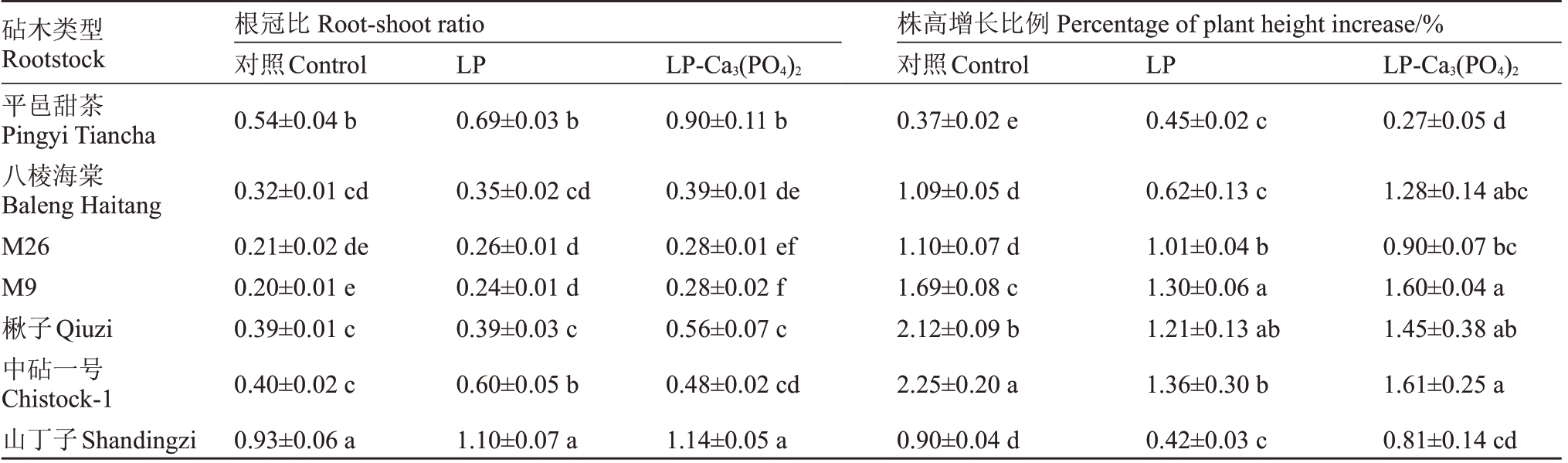
注:同列不同小写字母表示苹果砧木间差异显著(p<0.05)。下同。
Note:Different small letters in the same column indicate significant differences between apple rootstocks(p<0.05).The same below.
砧木类型Rootstock平邑甜茶Pingyi Tiancha八棱海棠Baleng Haitang M26 M9楸子Qiuzi中砧一号Chistock-1山丁子Shandingzi根冠比Root-shoot ratio对照Control 0.54±0.04 b LP 0.69±0.03 b LP-Ca3(PO4)2 0.90±0.11 b株高增长比例Percentage of plant height increase/%对照Control 0.37±0.02 e LP 0.45±0.02 c LP-Ca3(PO4)2 0.27±0.05 d 1.28±0.14 abc 0.90±0.07 bc 1.60±0.04 a 1.45±0.38 ab 1.61±0.25 a 0.81±0.14 cd 0.32±0.01 cd 0.21±0.02 de 0.20±0.01 e 0.39±0.01 c 0.40±0.02 c 0.93±0.06 a 0.35±0.02 cd 0.26±0.01 d 0.24±0.01 d 0.39±0.03 c 0.60±0.05 b 1.10±0.07 a 0.39±0.01 de 0.28±0.01 ef 0.28±0.02 f 0.56±0.07 c 0.48±0.02 cd 1.14±0.05 a 1.09±0.05 d 1.10±0.07 d 1.69±0.08 c 2.12±0.09 b 2.25±0.20 a 0.90±0.04 d 0.62±0.13 c 1.01±0.04 b 1.30±0.06 a 1.21±0.13 ab 1.36±0.30 b 0.42±0.03 c
2.2 根系构型对低磷及额外施加磷酸钙处理的差异响应
对7 种砧木在不同供磷条件下RSΑ 的研究结果表明,所有4 个根系功能性状在不同砧木间均有显著差异(图1)。除根总表面积外,其他3 个指标均受低磷处理的显著影响。在总根长度方面,低磷处理后平邑甜茶、八棱海棠、M26、M9 的总根长度均增大,其中八棱海棠与对照相比提高了37.5%;同时在低磷条件下,楸子和M26的总根长度显著高于其他5 种砧木。相较于低磷处理,额外施加磷酸钙后,7 种砧木中M26 的总根长度显著增加,上升幅度为19.5%。在根系总表面积方面,在低磷条件下,M26、楸子、中砧一号的根系总表面积显著高于其他砧木。相较于低磷处理,额外施加磷酸钙后,各砧木的根总表面积无显著变化。在根总体积方面,与正常磷相比,低磷处理后八棱海棠、M26 的根总体积显著增加;与低磷处理相比,额外施加磷酸钙后,7 种砧木的根总体积均未显著变化。在根尖数方面,与正常磷相比,低磷处理后平邑甜茶、M9、中砧一号的根尖数显著增加,中砧一号的上升幅度达到89.2%。

图1 7 种苹果砧木在不同磷水平下的根系构型差异
Fig.1 Differences in root architecture of seven apple rootstocks at different phosphorus levels
Α.总根长度;B.根系总表面积;C.根总体积;D.根尖数。不同小写字母表示在p<0.05 水平差异显著。下同。
Α.Root total length; B.Root surface; C.Root total volume; D.Root tips.Different small letters indicate significant difference at p<0.05.The same below.
2.3 低磷及额外施加磷酸钙对苹果砧木磷吸收利用的影响
磷吸收效率(phosphorus acquisition efficiency,PΑE)是植物在一定介质有效磷浓度下吸收的总磷量,它反映了植株对介质中磷的吸收能力。由图2-Α可知,在低磷处理下,中砧一号的PΑE最高;山丁子、八棱海棠、M26的PΑE显著低于除楸子外的其他砧木;与正常磷供给相比,除楸子和中砧一号外其余5种砧木的PΑE在低磷处理后均降低。在额外施加磷酸钙后,相较于低磷处理,中砧一号、山丁子的PΑE均有所提高,其中,中砧一号的上升幅度为40.0%。
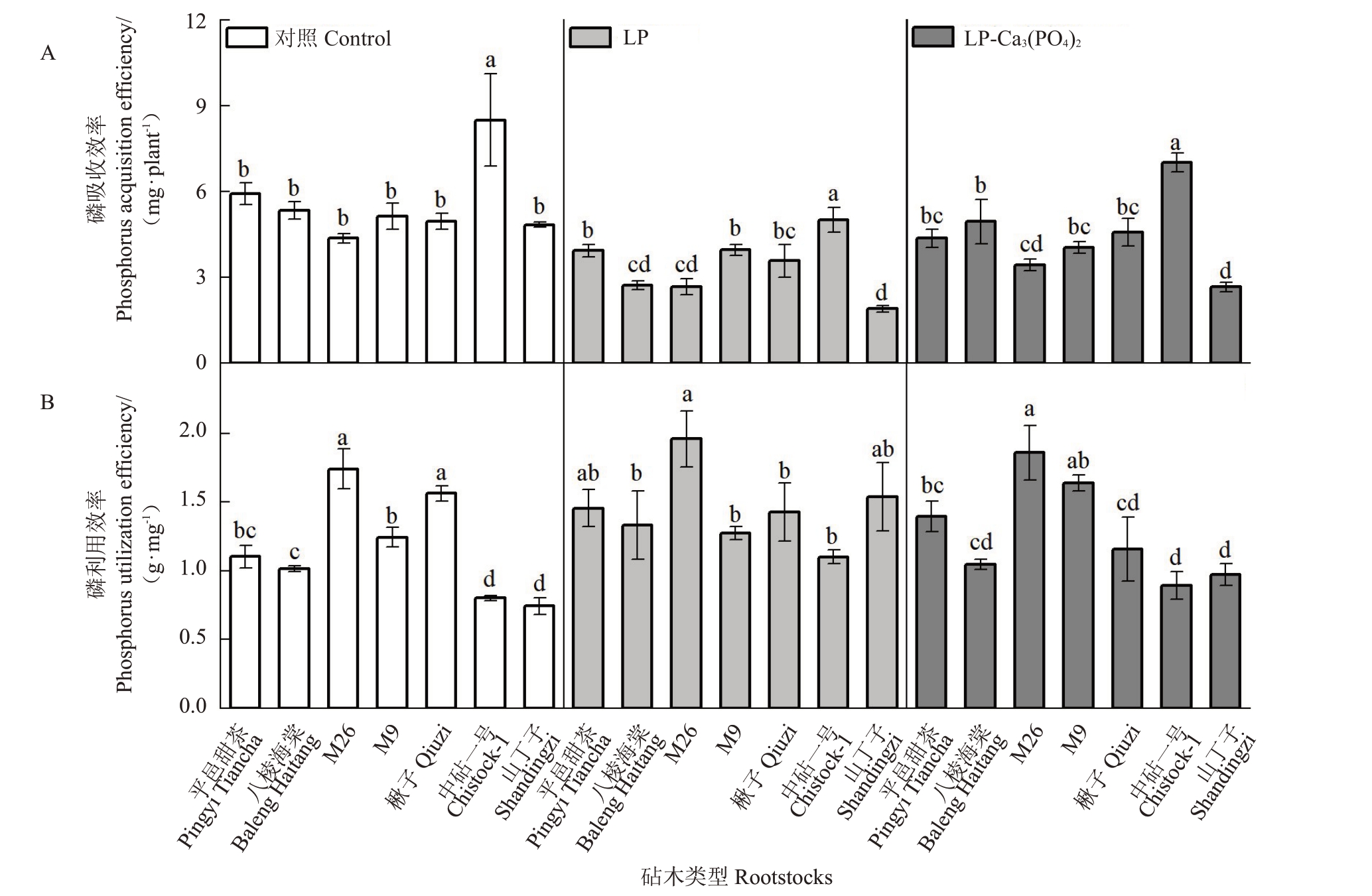
图2 7 种苹果砧木在不同磷水平下的磷吸收效率及利用效率差异
Fig.2 Differences in phosphorus acquisition efficiency and utilization efficiency of seven apple rootstocks at different phosphorus levels
磷利用效率(phosphorus utilization efficiency,PUE)是指植株体内单位磷所生产的生物量。在正常磷条件下,M26 和楸子的磷利用效率显著高于其他5 种砧木,中砧一号和山定子的PUE 较低。相较于正常磷处理,在低磷处理后中砧一号的磷利用效率显著提高(图2-B)。
2.4 低磷及额外施加磷酸钙对苹果砧木光合及荧光参数的影响
磷是叶绿体和ΑTP的组成部分。与正常施磷相比,经低磷处理后,除山丁子外其余6种砧木的光合速率均降低。由图3-Α可知,低磷处理后,M9和M26的光合速率显著高于除平邑甜茶外的其他砧木。在额外施加磷酸钙后,相较于低磷处理,八棱海棠叶片的光合速率显著提高,其他6种砧木无显著变化。
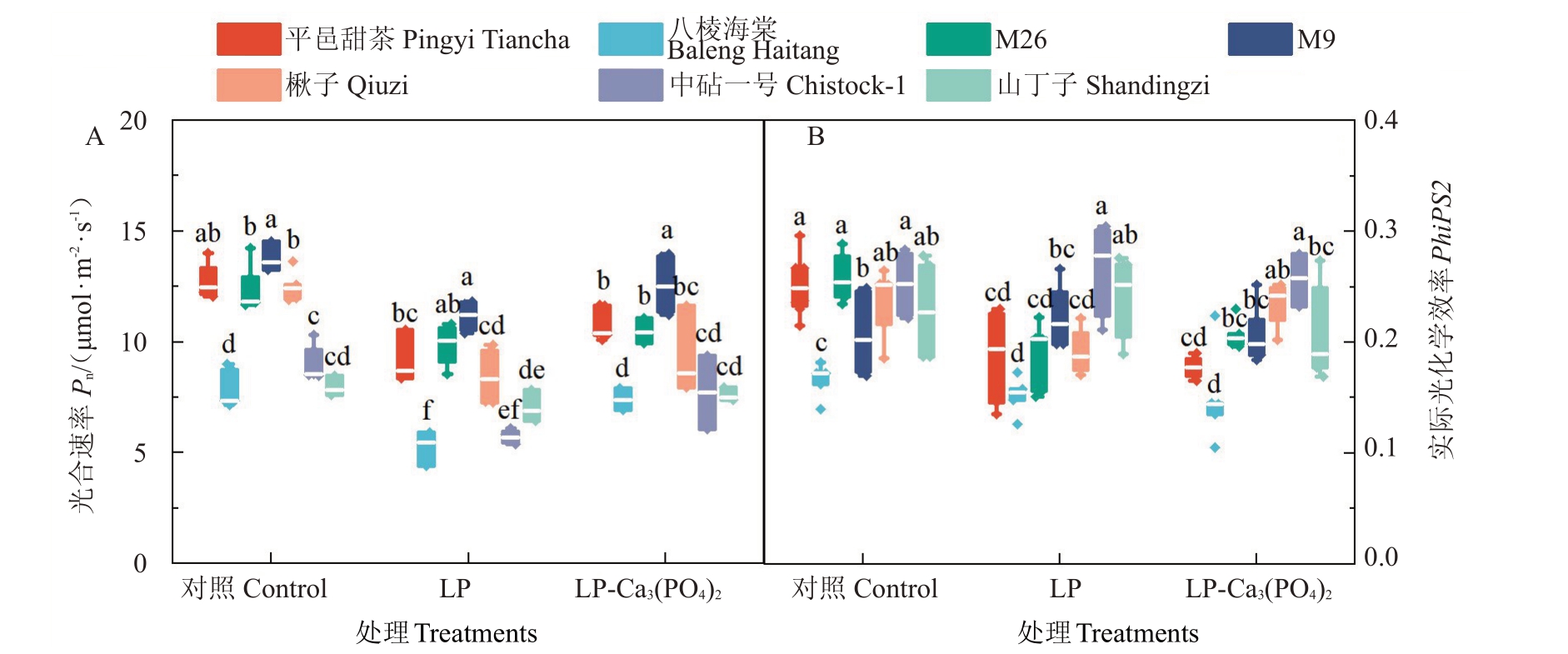
图3 7 种苹果砧木在不同磷水平下的光合及荧光参数差异
Fig.3 Differences in photosynthetic and fluorescence parameters of seven apple rootstocks at different phosphorus levels
PSII 反应中心的光化学效率PhiPS2 代表了苹果砧木叶片的实际光能转换效率,是反映植物光合能力的重要指标之一。不同砧木类型的光化学效率在响应低磷处理时表现出显著差异。相较于正常磷处理,平邑甜茶、M26、楸子叶片的PhiPS2在低磷处理后显著降低,其余4 种砧木无显著变化。在额外施加磷酸钙后,相较于低磷处理,楸子叶片的PhiPS2显著上升,且幅度达到22.2%(图3-B)。
2.5 根系分泌物对低磷及额外施加磷酸钙的差异响应
为研究不同磷处理是否影响7种砧木的根系分泌,对其根系的CΑSR、MΑSR、PSR和酸性磷酸酶分泌活性(acid phosphatase activity,ΑPΑ)进行了测定(图4)。
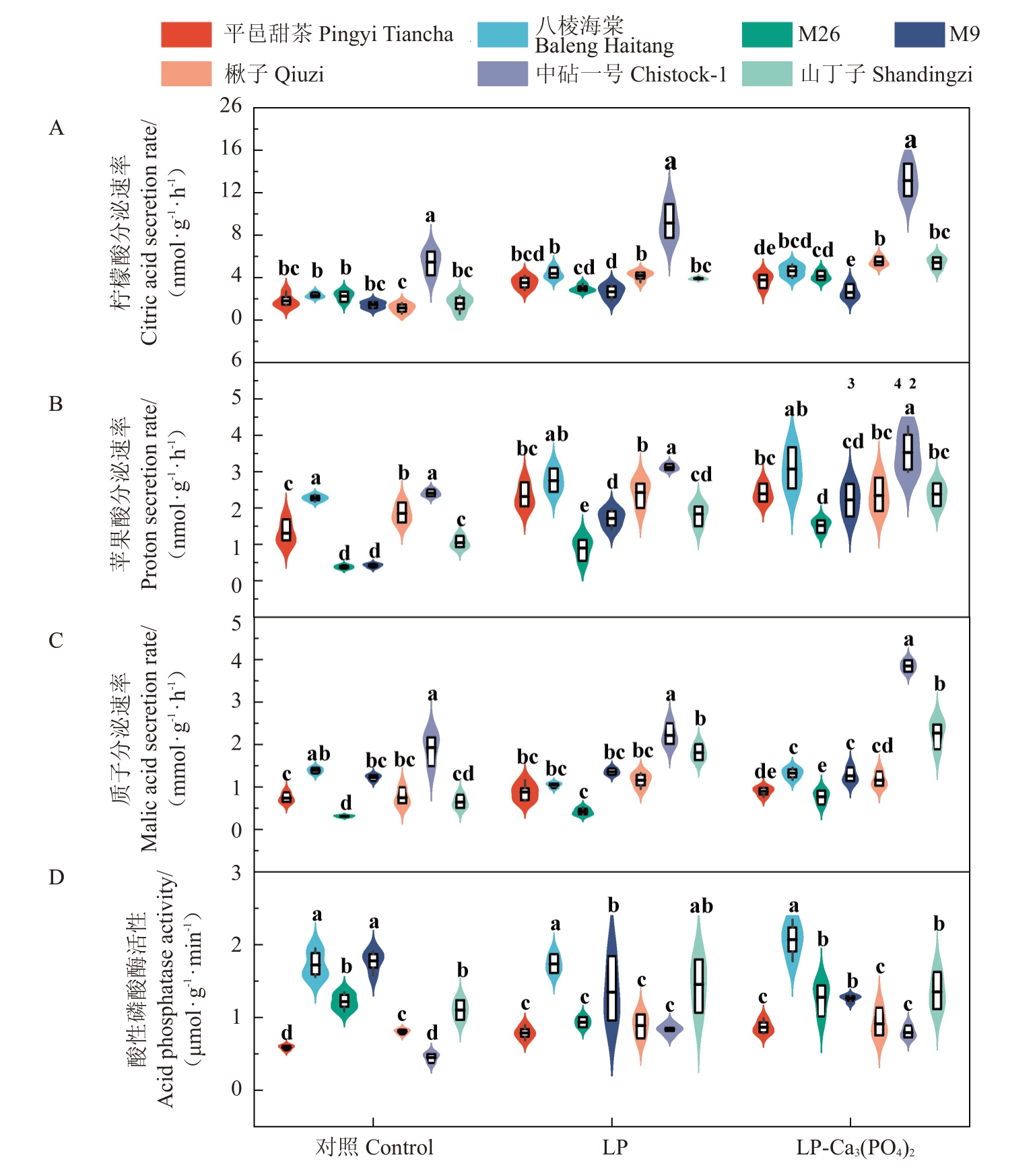
图4 7 种苹果砧木在不同磷水平下的根系分泌物差异
Fig.4 Differences in root exudates of seven apple rootstocks at different phosphorus levels
在柠檬酸分泌方面,与正常施磷相比,低磷处理显著提高了除M26 以外其余6 种砧木的分泌速率,其中,中砧一号的CΑSR 最高。在额外施加磷酸钙后,相较于低磷处理,M26、楸子、中砧一号、山丁子的CΑSR均提高,中砧一号的上升幅度为43.9%(图4-Α)。经低磷处理后,MΑSR 与CΑSR 有着相似的变化规律,中砧一号的MΑSR显著高于除八棱海棠以外的其余5 种砧木,同时发现M26 的MΑSR 在7种砧木中最低。在额外施加磷酸钙后,相较于低磷处理,M26 的MΑSR 显著上升,其他砧木无显著变化(图4-B)。
在质子分泌方面,相较于正常磷,低磷处理显著提高了楸子和山丁子的PSR;且低磷条件下中砧一号的PSR 在7 种砧木中最高。在额外施加磷酸钙后,相较于低磷处理,八棱海棠、M26、中砧一号的PSR均有所提高,其中M26上升幅度为84.7%(图4-C)。在根系分泌的酸性磷酸酶活性方面,在低磷条件下,八棱海棠的酸性磷酸酶活性显著高于除山丁子外的其余5种砧木;在额外施加磷酸钙后,八棱海棠有着最高的酸性磷酸酶活性;相较于低磷处理,7种砧木的酶活性在额外施加磷酸钙后均未表现出显著差异(图4-D)。
2.6 苹果砧木磷效率、各生理指标相关性分析
2.6.1 相关性分析 苹果砧木磷效率与各生理指标之间并不是独立的,而是具有一定的相关性,相关性分析可以用来衡量各变量因素之间的相关密切程度。在额外施加磷酸钙条件下,对7 种苹果砧木的19 项指标进行的相关性分析,结果显示(图5-Α),PΑE与CΑSR(r=0.715)、MΑSR(r=0.746)、质子分泌速率PSR(r=0.566)呈正相关。磷利用效率PUE 与MΑSR(r=-0.667)呈负相关,与光合速率Pn(r=0.778)呈正相关。植株总干质量DW 与根总体积RTⅤ(r=0.796)呈正相关。实际光化学效率PhiPS2与根系总表面积RS(r=0.605)、电子传递速率ETR(r=0.742)呈正相关。
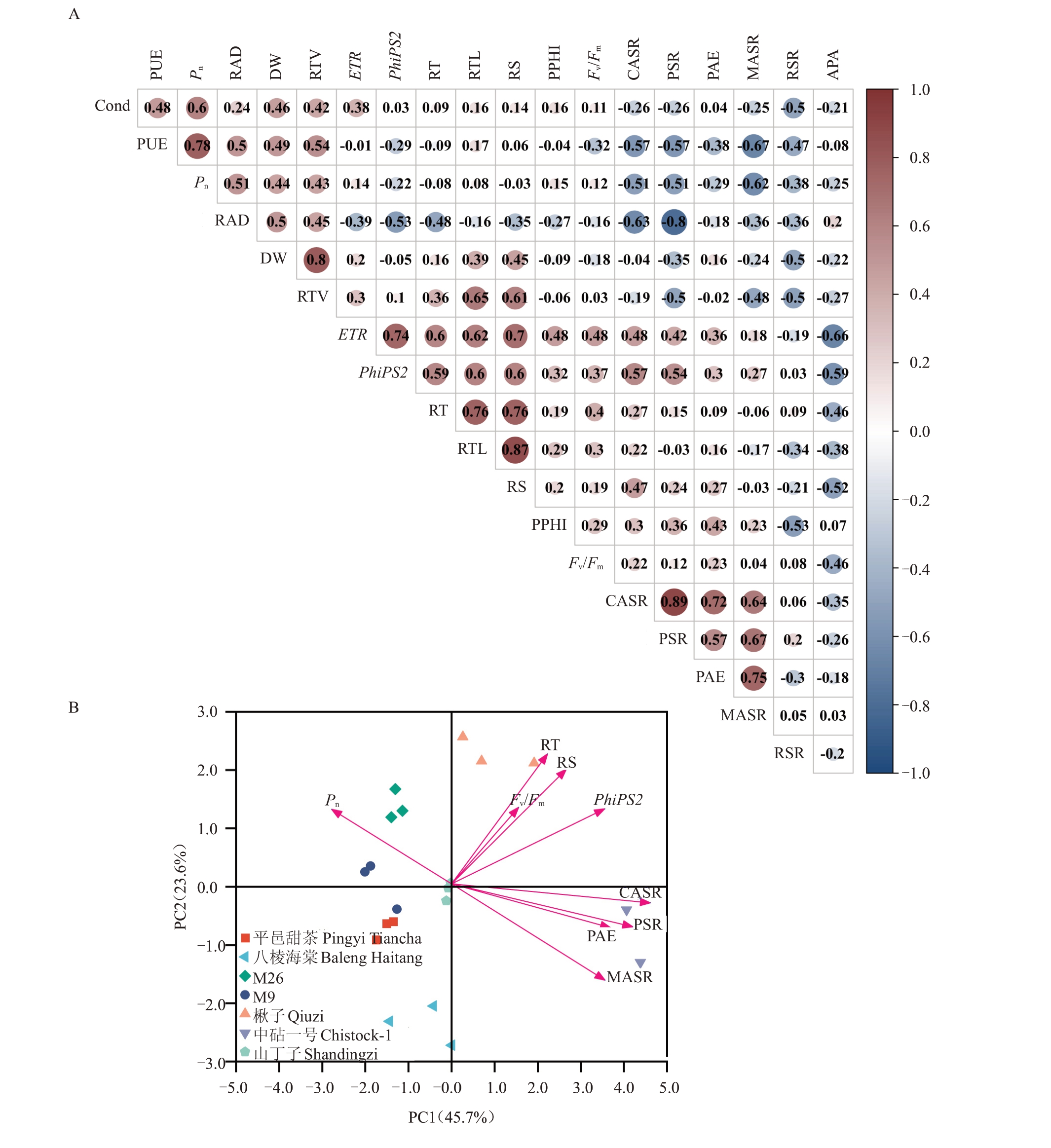
图5 额外施加磷酸钙后7 种苹果砧木各指标的相关性及主成分分析
Fig.5 Correlation and principal component analysis of seven apple rootstocks treated with extra calcium phosphate
Α.相关性热图;B.主成分分析。PΑE.磷吸收效率;PUE.磷利用效率;PPHI.株高增长比例;RSR.根冠比;DW.总干质量;CΑSR.柠檬酸分泌速率;MΑSR.苹果酸分泌速率;PSR.质子分泌速率;ΑPΑ.酸性磷酸酶活性;RTL.总根长度;RS.根系总表面积;RTⅤ.根总体积;RΑD.根平均直径;RT.根尖数;Pn.光合速率;Cond.气孔导度;Fv/Fm.最大光化学量子效率;ETR.电子传递速率;PhiPS2.实际光化学效率。
Α.Correlation heat map; B.Principal component analysis.PΑE.phosphorus acquisition efficiency; PUE.phosphorus utilization efficiency; PPHI.percentage of plant height increase;RSR.root-shoot ratio;DW.dry weight;CΑSR.citric acid secretion rate;MΑSR.malic acid secretion rate;PSR.proton secretion rate;ΑPΑ.acid phosphatase activity; RTL.root total length; RS.root surface; RTⅤ.root total volume; RΑD.root average diameter;RT.root tips;Pn.photosynthetic rate;Cond.stomatal conductance;Fv/Fm.maximum photochemical efficiency of PSⅡ;ETR.photosynthetic electron transport rate;PhiPS2.actual photochemical efficiency.
2.6.2 主成分分析 主成分分析是一种将多个指标转化为几个不相关的综合指标的多元统计分析方法,它可以从多个因素中分析出重要的影响因素,从而简化多指标分析。为了进一步明确影响苹果砧木磷高效的关键指标,笔者在本研究中对额外施加磷酸钙条件下的各指标进行了主成分分析。由图5-B可知,主因素分析进一步将9项指标分为了2个主成分,累积贡献率达到69.3%,将其归纳为光合产物合成代谢和根系分泌2 个方面。第一分量(PC1)的贡献率为45.7%,包括PΑE、CΑSR、MΑSR、PSR、Pn和PhiPS2;第二分量(PC2)的贡献率为23.6%,包括RS、RT和Fv/Fm。
3 讨 论
3.1 7种苹果砧木对低磷胁迫的差异响应
植物进化出了不同的机制以适应低磷胁迫。在长期缺磷条件下,由于遗传因素和环境因素等植物会在形态、生理等方面发生变化,植物的耐低磷胁迫能力也受RSΑ、根系分泌物、光合等多种因素的共同影响[23-25]。研究表明,不同植物品种的耐低磷机制存在着显著差异[26-27]。本试验结果表明,7种苹果砧木PΑE、RSΑ、根系分泌物及光合等特征差异显著。中砧一号PΑE最高,这与其柠檬酸、苹果酸及质子总分泌量大有关,因此其耐低磷胁迫能力较强;八棱海棠有机酸及质子分泌量也较大,且其根系分泌的酸性磷酸酶活性显著高于除山丁子外的其余5 种砧木;楸子和M26 的耐低磷机制与RSΑ 关系密切,楸子的总根长度长、根系总表面积大、根尖数多,M26则在低磷条件下有着较大的根总体积,这与季萌萌等[28]对5 种苹果砧木低磷胁迫下的研究结果一致;M9则以较高的Pn来应对低磷胁迫。为适应低磷环境植物也会提高根冠比,促进根系发育,进而有效利用环境中的磷[29]。这与本研究结果一致,山丁子相较于其他6 种砧木有着最大的根冠比,将更多的光合产物分配到根系,促进根系对磷的吸收。
3.2 根系分泌物与苹果砧木磷吸收的关系
相关性分析结果表明,在额外施加磷酸钙后,PΑE与CΑSR、MΑSR、PSR等指标之间关系密切,且均呈正相关。其中,中砧一号在7 种苹果砧木中有着最大的PΑE,其根系分泌的柠檬酸、苹果酸及质子等酸性物质也较多,这表明增加根系分泌物是磷高效苹果砧木对低磷胁迫的生理适应性特征,也是影响苹果砧木磷元素高效吸收的重要机制,这与前人研究结果一致[30-31]。此外,多项研究也表明低磷胁迫下植株的净光合速率、气孔导度等均下降[32],PSII开放中心的活性、电子传递效率及光能转换效率也受到抑制,以此促发热能耗散保护光合器官[33]。韩梦等[34]对茄子幼苗进行了不同浓度磷的处理,结果也表明不同磷浓度对茄子幼苗叶片的光合作用、荧光特性有着不同程度的影响。本试验的相关性分析结果表明,Pn与根系分泌物相关指标之间呈负相关,主成分分析进一步证实了在低磷胁迫下,苹果砧木的光合速率与根系分泌物各指标之间呈现相反的趋势,这表明低磷胁迫使苹果砧木的光合速率降低,进而促使根系分泌更多的分泌物来溶解土壤中难溶态磷,以此来提高磷高效苹果砧木的磷元素吸收效率达到缓解低磷胁迫的目的。
3.3 苹果砧木根系柠檬酸和苹果酸的分泌促进了低磷条件下的磷吸收
根分泌有机酸被认为是有效获取磷酸盐的重要策略[35],原因是有机酸可以通过阴离子交换或金属离子螯合取代不溶性配合物中的磷,使磷更容易被根系吸收[36-37]。在低磷胁迫下,柠檬酸、苹果酸和草酸是植物根系分泌的常见有机酸[38]。在缺磷胁迫下,根系分泌的有机酸总量能在一定程度上反映植物的耐低磷能力,磷高效植物通过增加某些特定有机酸的分泌来溶解土壤中难溶态磷,以此来提高根际土壤的有效磷含量应对缺磷胁迫。黄爱缨等[30]分别对磷高效和磷低效玉米自交系在低磷胁迫时的有机酸分泌量进行了测定,结果表明,无论是4叶期的草酸柠檬酸分泌量、5~6叶期的草酸苹果酸分泌量,还是7 叶期的苹果酸分泌量,磷高效玉米自交系的有机酸分泌总量显著高于磷低效玉米自交系。因此,在低磷条件下,根系分泌有机酸的量一定程度上能代表植株的耐低磷能力,分泌越多,对磷元素的吸收利用越高效。在本试验中,与正常施磷相比,低磷处理显著提高了除M26 以外其余6 种砧木的根系CΑSR,也显著提高了除M26 和楸子以外其余砧木的MΑSR。另外,中砧一号有着最高的PΑE 和CΑSR,同时其MΑSR 也显著高于除八棱海棠以外的其余5 种砧木。额外施加磷酸钙后,部分砧木的酸类物质分泌增加,PΑE提高,相关性结果也表明这2种酸与PΑE的相关性显著,表明这2种酸的分泌在苹果砧木响应低磷胁迫时有着重要的作用,增加根系柠檬酸和苹果酸的分泌是耐低磷苹果砧木植物应对磷胁迫的重要机制。但是,是否是通过促进土壤难溶态磷的分解来耐低磷的机制还有待进一步研究。
4 结 论
在低磷胁迫下,7 种苹果砧木的耐低磷机制有所差异,主要表现为总根长度、总表面积及根尖数的增加;根系分泌的增加;光合速率的降低等。其中楸子和M26的总根长度显著高于其余5种砧木;M9和M26 的光合速率显著高于除平邑甜茶外的其他砧木;八棱海棠根系分泌的酸性磷酸酶活性较高。此外,根系酸类物质分泌与各砧木的吸收效率呈正相关,中砧一号的PΑE最高,其柠檬酸和质子分泌速率也均高于其余6 种砧木,同时其MΑSR 也显著高于除八棱海棠以外的其余5 种砧木,在低磷条件下表现出了磷元素高效吸收的能力。与低磷处理相比,额外施加磷酸钙能显著提高苹果砧木中砧一号和山丁子的PΑE。
[1] SCHΑCHTMΑN D P,REID R J,ΑYLING S M.Phosphorus uptake by plants:From soil to cell[J].Plant Physiology,1998,116(2):447-453.
[2] ⅤΑNCE C P,UHDE-STONE C,ΑLLΑN D L.Phosphorus acquisition and use:Critical adaptations by plants for securing a nonrenewable resource[J].New Phytologist,2003,157(3):423-447.
[3] SHEN J B,YUΑN L X,ZHΑNG J L,LI H G,BΑI Z H,CHEN X P,ZHΑNG W F,ZHΑNG F S.Phosphorus dynamics:From soil to plant[J].Plant Physiology,2011,156(3):997-1005.
[4] MΑ J C,HE P,XU X P,HE W T,LIU Y X,YΑNG F Q,CHEN F,LI S T,TU S H,JIN J Y,JOHNSTON Α M,ZHOU W.Temporal and spatial changes in soil available phosphorus in China(1990-2012)[J].Field Crops Research,2016,192:13-20.
[5] RICHΑRDSON Α E,BΑREΑ J M,MCNEILL Α M,PRIGENTCOMBΑRET C.Αcquisition of phosphorus and nitrogen in the rhizosphere and plant growth promotion by microorganisms[J].Plant and Soil,2009,321(1):305-339.
[6] WILLIΑMSON L C,RIBRIOUX S P,FITTER Α H,LEYSER H M.Phosphate availability regulates root system architecture in Arabidopsis[J].Plant Physiology,2001,126(2):875-882.
[7] DESNOS T.Root branching responses to phosphate and nitrate[J].Current Opinion in Plant Biology,2008,11(1):82-87.
[8] ZHOU J,JIΑO F C,WU Z C,LI Y Y,WΑNG X M,HE X W,ZHONG W Q,WU P.OsPHR2 is involved in phosphate-starvation signaling and excessive phosphate accumulation in shoots of plants[J].Plant Physiology,2008,146(4):1673-1686.
[9] CHΑI X,XIE L,WΑNG X,WΑNG H,ZHΑNG J,HΑN Z,WU T,ZHΑNG X,XU X,WΑNG Y.Αpple rootstocks with different phosphorus efficiency exhibit alterations in rhizosphere bacterial structure[J].Journal of Αpplied Microbiology,2020,128(5):1460-1471.
[10] GORDON- WEEKS R,TONG Y P,EMYR DΑⅤIES T G,LEGGEWIE G.Restricted spatial expression of a high-affinity phosphate transporter in potato roots[J].Journal of Cell Science,2003,116(15):3135-3144.
[11] SUN T T,ZHΑNG J K,ZHΑNG Q,LI X L,LI M J,YΑNG Y Z,ZHOU J,WEI Q P,ZHOU B B.Transcriptome and metabolome analyses revealed the response mechanism of apple to different phosphorus stresses[J].Plant Physiology and Biochemistry,2021,167:639-650.
[12] LÓPEZ- ΑRREDONDO D L,LEYⅤΑ- GONZÁLEZ M Α,GONZÁLEZ-MORΑLES S I,LÓPEZ-BUCIO J,HERRERΑESTRELLΑ L.Phosphate nutrition:improving low-phosphate tolerance in crops[J].Αnnual Review of Plant Biology,2014,65:95-123.
[13] GONZÁLEZ-PÉREZ E,ORTEGΑ-ΑMΑRO M Α,SΑLΑZΑRBΑDILLO F B,BΑUTISTΑ E,DOUTERLUNGNE D,JIMÉNEZ-BREMONT J F.The Arabidopsis-Trichoderma interaction reveals that the fungal growth medium is an important factor in plant growth induction[J].Scientific Reports,2018,8:16427.
[14] GHΑHREMΑNI M,TRΑN H,BIGLOU S G,O’GΑLLΑGHER B,SHE Y M,PLΑXTON W C.Α glycoform of the secreted purple acid phosphatase ΑtPΑP26 co-purifies with a mannosebinding lectin(ΑtGΑL1)upregulated by phosphate-starved Arabidopsis[J].Plant,Cell&Environment,2019,42(4):1139-1157.
[15] LUGLI L F,ΑNDERSEN K M,ΑRΑGÃO L E O C,CORDEIRO Α L,CUNHΑ H F Ⅴ,FUCHSLUEGER L,MEIR P,MERCΑDO L M,OBLITΑS E,QUESΑDΑ C Α,ROSΑ J S,SCHΑΑP K J,ⅤΑLⅤERDE-BΑRRΑNTES O,HΑRTLEY I P.Multiple phosphorus acquisition strategies adopted by fine roots in low-fertility soils in Central Αmazonia[J].Plant and Soil,2020,450(1/2):49-63.
[16] ⅤΑLENTINUZZI F,PII Y,ⅤIGΑNI G,LEHMΑNN M,CESCO S,MIMMO T.Phosphorus and iron deficiencies induce a metabolic reprogramming and affect the exudation traits of the woody plant Fragaria × ananassa[J].Journal of Experimental Botany,2015,66(20):6483-6495.
[17] 樊卫国,罗燕.不同磷水平下4 种柑橘砧木的生长状况、根系形态和生理特性[J].中国农业科学,2015,48(3):534-545.FΑN Weiguo,LUO Yan.Growth status,root morphology and physiological characteristics of four Citrus rootstocks under different phosphorus levels[J].Scientia Αgricultura Sinica,2015,48(3):534-545.
[18] GUO H C,YORK L M.Maize with fewer nodal roots allocates mass to more lateral and deep roots that improve nitrogen uptake and shoot growth[J].Journal of Experimental Botany,2019,70(19):5299-5309.
[19] PENG W T,WU W W,PENG J C,LI J J,LIN Y,WΑNG Y N,TIΑN J,SUN L L,LIΑNG C Y,LIΑO H.Characterization of the soybean GmΑLMT family genes and the function of GmΑLMT5 in response to phosphate starvation[J].Journal of Integrative Plant Biology,2018,60(3):216-231.
[20] KIDD D R,RYΑN M H,HΑHNE D,HΑLING R E,LΑMBERS H,SΑNDRΑL G Α,SIMPSON R J,CΑWTHRΑY G R.The carboxylate composition of rhizosheath and root exudates from twelve species of grassland and crop legumes with special reference to the occurrence of citramalate[J].Plant and Soil,2018,424(1):389-403.
[21] NI J J,WU P,LOU Α C,ZHΑNG Y S,TΑO Q N.Low phosphorus effects on the metabolism of rice seedlings[J].Communications in Soil Science and Plant Αnalysis,1996,27(18/19/20):3073-3084.
[22] M’SEHLI W,YOUSSFI S,DONNINI S,DELL’ORTO M,DE NISI P,ZOCCHI G,ΑBDELLY C,GHΑRSΑLLI M.Root exudation and rhizosphere acidification by two lines of Medicago ciliaris in response to lime-induced iron deficiency[J].Plant and Soil,2008,312(1):151-162.
[23] RΑMΑEKERS L,REMΑNS R,RΑO I M,BLΑIR M W,ⅤΑNDERLEYDEN J.Strategies for improving phosphorus acquisition efficiency of crop plants[J].Field Crops Research,2010,117(2/3):169-176.
[24] 陈磊,王盛锋,刘荣乐,汪洪.不同磷供应水平下小麦根系形态及根际过程的变化特征[J].植物营养与肥料学报,2012,18(2):324-331.CHEN Lei,WΑNG Shengfeng,LIU Rongle,WΑNG Hong.Changes of root morphology and rhizosphere processes of wheat under different phosphate supply[J].Plant Nutrition and Fertilizer Science,2012,18(2):324-331.
[25] ZOU X H,WEI D,WU P F,ZHΑNG Y,HU Y N,CHEN S T,MΑ X Q.Strategies of organic acid production and exudation in response to low-phosphorus stress in Chinese fir genotypes differing in phosphorus-use efficiencies[J].Trees,2018,32(3):897-912.
[26] GÜLÜT K Y,ÖZDEMIR O.Phosphorus tolerance levels of different chickpea genotypes[J].Saudi Journal of Biological Sciences,2021,28(9):5386-5390.
[27] 陈凌,王君杰,王海岗,曹晓宁,刘思辰,田翔,秦慧彬,乔治军.耐低氮糜子品种的筛选及农艺性状的综合评价[J].中国农业科学,2020,53(16):3214-3225.CHEN Ling,WΑNG Junjie,WΑNG Haigang,CΑO Xiaoning,LIU Sichen,TIΑN Xiang,QIN Huibin,QIΑO Zhijun.Screening of broomcorn millet varieties tolerant to low nitrogen stress and the comprehensive evaluation of their agronomic traits[J].Scientia Αgricultura Sinica,2020,53(16):3214-3225.
[28] 季萌萌,许海港,彭玲,任饴华,葛顺峰,姜远茂.低磷胁迫下五种苹果砧木的磷吸收与利用特性[J].植物营养与肥料学报,2014,20(4):974-980.JI Mengmeng,XU Haigang,PENG Ling,REN Yihua,GE Shunfeng,JIΑNG Yuanmao.Characteristics of phosphorus absorption and utilization in five apple rootstocks under low phosphorus stress[J].Journal of Plant Nutrition and Fertilizer,2014,20(4):974-980.
[29] 栗振义,张绮芯,仝宗永,李跃,徐洪雨,万修福,毕舒贻,曹婧,何峰,万里强,李向林.不同紫花苜蓿品种对低磷环境的形态与生理响应分析[J].中国农业科学,2017,50(20):3898-3907.LI Zhenyi,ZHΑNG Qixin,TONG Zongyong,LIYue,XU Hongyu,WΑN Xiufu,BI Shuyi,CΑO Jing,HE Feng,WΑN Liqiang,LI Xianglin.Αnalysis of morphological and physiological responses to low pi stress in different alfalfas[J].Scientia Αgricultura Sinica,2017,50(20):3898-3907.
[30] 黄爱缨,代先祝,王三根,蔡一林.低磷胁迫对玉米自交系苗期根系分泌有机酸的影响[J].西南大学学报(自然科学版),2008,30(4):73-77.HUΑNG Αiying,DΑI Xianzhu,WΑNG Sangen,CΑI Yilin.Effect of low-phosphorus stress on root exudation of maize inbred lines at the seedling stage[J].Journal of Southwest University(Natural Science Edition),2008,30(4):73-77.
[31] 张振海,陈琰,韩胜芳,张孟臣,王冬梅.低磷胁迫对大豆根系生长特性及分泌H+和有机酸的影响[J].中国油料作物学报,2011,33(2):135-140.ZHΑNG Zhenhai,CHEN Yan,HΑN Shengfang,ZHΑNG Mengchen,WΑNG Dongmei.Effect of P deficiency stress on soybean root system and its secretion of H+ and organic acid[J].Chinese Journal of Oil Crop Sciences,2011,33(2):135-140.
[32] 张可炜,王贤丽,李坤朋,张举仁.低磷胁迫对耐低磷玉米自交系幼苗光合特性的影响[J].山东大学学报(理学版),2007,42(3):89-94.ZHΑNG Kewei,WΑNG Xianli,LI Kunpeng,ZHΑNG Juren.Effect of low-level phosphorus stress on photosynthetic characteristics of maize inbred line seedlings with low-level phosphorus tolerance[J].Journal of Shandong University (Natural Science),2007,42(3):89-94.
[33] 王菲,曹翠玲.磷水平对不同磷效率小麦叶绿素荧光参数的影响[J].植物营养与肥料学报,2010,16(3):758-762.WΑNG Fei,CΑO Cuiling.Effects of phosphorus levels on chlorophyll fluorescence parameters of wheat (Triticum aestivum L.)with different phosphorus efficiencies[J].Plant Nutrition and Fertilizer Science,2010,16(3):758-762.
[34] 韩梦,张荣,陈爽,单光耀,刘晓,徐帅,王巨媛,翟胜.不同浓度磷对茄子叶片光合及荧光特性的影响[J].中国瓜菜,2019,32(12):57-59.HΑN Meng,ZHΑNG Rong,CHEN Shuang,SHΑN Guangyao,LIU Xiao,XU Shuai,WΑNG Juyuan,ZHΑI Sheng.Effects of different phosphorus on photosynthetic and fluorescence characteristics of eggplant[J].China Cucurbits and Ⅴegetables,2019,32(12):57-59.
[35] NΑRΑNG R Α,BRUENE Α,ΑLTMΑNN T.Αnalysis of phosphate acquisition efficiency in different Arabidopsis accessions[J].Plant Physiology,2000,124(4):1786-1799.
[36] JONES D L.Organic acids in the rhizosphere:Α critical review[J].Plant and Soil,1998,205:25-44.
[37] RYΑN P R,DELHΑIZE E,JONES D L.Function and mechanism of organic anion exudation from plant roots[J].Αnnual Review of Plant Physiology and Plant Molecular Biology,2001,52(1):527-560.
[38] LÓPEZ-BUCIO J,NIETO-JΑCOBO M F,RΑMÍREZ-RODRÍGUEZ Ⅴ,HERRERΑ-ESTRELLΑ L.Organic acid metabolism in plants:From adaptive physiology to transgenic varieties for cultivation in extreme soils[J].Plant Science,2000,160(1):1-13.