梨火疫病是由解淀粉欧文氏菌Erwinia amylovora侵染梨、苹果等多种蔷薇科仁果类果树、造成毁灭性危害的重大国际检疫性细菌病害[1-2]。该病害于1780年首次报道于美国纽约,现分布于北美、欧洲、北非、中东和大洋洲等近60多个国家和地区[3]。近年来梨火疫病又传播至亚洲的日本、哈萨克斯坦、吉尔吉斯斯坦等国,2016—2017年相继在中国新疆伊犁、巴州等地首次被发现,危害梨、苹果、山楂、海棠、温桲等果树,尤其在库尔勒香梨(简称香梨)上传播极为迅速,造成大批梨树被砍伐、果园被毁的巨大损失,给香梨生产带来重创。该病害近期已传播至甘肃张掖等地区,目前在中国尚属局部发生,现已被中国列入《一类农作物病虫害名录》和《重点管理外来入侵物种名录》,对中国林果安全生产带来了巨大威胁和风险[4-5]。
国外针对梨火疫病的病原学、检测技术和预测预警、流行规律和防治技术等开展了大量研究,提出了包括化学防治、生物防治、抗病品种选育、转基因技术和果园苗圃的综合治理等多种防控措施。但目前果树抗病品种匮乏,专门的防治药剂有限,也没有能高效控制病害的单一措施,至今病害依然是威胁梨和苹果产业的突出问题[6]。已有研究表明,梨火疫病菌E.amylovora在寄主组织中快速转移的侵染特征是造成病害流行速度快、毁灭性危害和防治难度大的重要原因。梨火疫病菌通过伤口和自然孔口侵入寄主多个部位,造成花器、叶片、幼果变黑凋萎、新梢枯死。易感寄主在气候条件适宜时,病原菌从病梢快速扩展到枝条、树干,直至砧木和根部,严重时可在几周或1 至几个生长季导致全株枯死;病原菌在感病果树枝干的溃疡斑、枝条及病果,以及不表现症状的组织上越冬,还可在木质部导管中存活多年,难以根除。春季病原菌在病灶处大量繁殖作为当年的初侵染源,通过风雨、昆虫、鸟类及田间操作将病原菌传至寄主上造成初次侵染和再次侵染[7-8]。因此及时修剪发病果树的病枝,不仅可以大大降低病原菌的菌源量,还能阻止其在树体中的迁移扩展,是简便易行、经济有效的病害防控的重要措施。明确梨火疫病菌在不同寄主组织内生长及扩展特性,对深入了解梨火疫病菌的发生流行规律以及病害的科学防控具有重要的指导意义。
国外研究者对梨火疫病菌的侵入及在寄主体内的定殖和迁移扩展曾采用生物学、细胞学和组织学的方法开展过一些研究,但该病原菌寄主种类的多样性和研究手段及方法的局限性,仍然存在诸多问题,一直没有获得确定的结果[9]。绿色荧光蛋白(green fluorescent protein,GFP)具有荧光性质稳定、直观、操作方便和不需添加外源底物就可以在实时、原位条件下对活细胞直接检测等优点,已广泛应用于病原菌与寄主植物的互作过程和示踪观察的研究中[10-11]。1988 年,Bogs 等[12]首次利用GFP 作为报告基因标记梨火疫病菌,观察到其通过苹果枝条韧皮部进入木质部的侵染过程,并证明病原菌在破坏木质部导管后可以定殖到薄壁组织的细胞间隙。Heyens 等[13]利用GFP 标记技术发现梨火疫病菌在苹果叶片的侵染主要沿叶内主脉迁移,从主脉到叶肉和侧脉的迁移速率较慢。梨火疫病是近期在中国香梨生产区突发的流行病害,香梨作为梨火疫病的高感品种,梨火疫病菌在香梨枝条中的侵染定殖和扩展动态的研究未见报道。
本研究以分离获得梨火疫病强致病力菌株为材料,对其进行绿色荧光蛋白报告基因标记,通过人工接种示踪病原菌在香梨枝条组织中侵染定殖和迁移特征,为深入了解病原菌在寄主组织内的侵染扩展过程及机制,掌握病害发生流行规律,指导田间病枝修剪、抗病品种选育和制定综合防治措施提供参考依据。
1 材料和方法
1.1 供试病原菌和质粒
梨火疫病菌:Erwinia amylovora,E.a001 菌株,由新疆农业大学农业微生物与生物技术实验室从新疆库尔勒市香梨园梨火疫病树病枝中分离、鉴定和保存,致病力测定为强致病力菌株。
质粒:宿主菌为E.coli DH5α,携带gfp基因并具有卡那霉素(50 μg·mL-1)抗性筛选标记的phc60-gfp质粒载体,由南京农业大学植物保护学院胡白石教授惠赠。
1.2 供试培养基
梨火疫病菌和大肠杆菌培养采用LB(Luria-Bertani)培养基;感受态细胞复苏培养基为LB+0.5 mol·L-1山梨醇+0.38 mol·L-1甘露醇。
1.3 供试植株材料
以库尔勒市巴州农科所日光试验果温室中栽培的4年生香梨树的枝条和叶片作供试植株材料。
1.4 梨火疫病菌标记菌株的构建及验证
参考王颖[14]的方法并略作修改,将phc60-gfp质粒热击转化到E.a001 菌株的感受态细胞中。先将制备好的E. a001 感受态细胞置于冰上冻融,42 ℃水浴锅中热激90 s 后,迅速转移置于-40 ℃冰箱放置3 min,然后每管加37 ℃预热的LB 复苏培养基400 μL,32 ℃、180 r·min-1复苏培养30 min,将复苏后的培养物涂布于LB(加入Km 50 μg·mL-1)平板上,37 ℃恒温培养过夜,通过倒置荧光显微镜(NikonECLIPSE Ts2R-FL)检测菌落荧光。
挑取阳性转化子用GFP 特异性引物(gfp-F:5’-ATGAGTAAAGGAGAAGAACT- 3’;gfp- R:5’-TTATTTGTATAGTTCATCCATG-3’,Size:700 bp)分别对转化子与野生菌株进行菌落PCR 扩增和电泳检测,将扩增出目的基因的阳性转化子命名为E.a001-gfp。
1.5 E.a001-gfp标记菌株的生物学特性
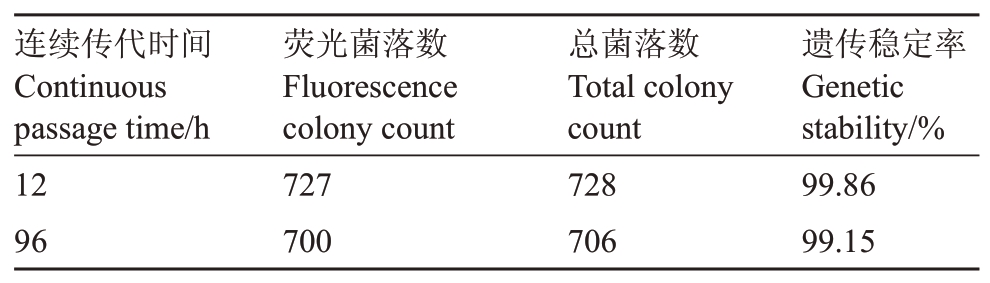
1.5.1 遗传稳定性测定 参照任嘉红等[15]的方法,挑取已长出的E.a001-gfp 单菌落接种至LB 液体培养基中,28 ℃、200 r·min-1培养过夜,以获取的菌悬液为种子液按1%的接种量接种至无抗生素LB培养液中,每次隔12 h接种到新鲜50 mL的LB液体培养基中培养。分别在培养12、24、36、48、60、72、84、96 h时取100 μL菌液涂布到不含抗生素的LB平板上培养过夜。用接种针随机挑取100 个单菌落,点接至LB(加入Km 50 μg·mL-1)培养基平板上,24 h 后计数平板生长菌落数,以荧光菌落数所占总菌落数百分比计算菌株的遗传稳定性。
1.5.2 生长曲线测定 将E. a001-gfp 和原始菌株E. a001 分别加入无抗生素的LB 培养液中,28 ℃、200 r·min-1培养OD600=1.0 左右。按照1%的比例分别接至LB培养液中,28 ℃、200 r·min-1振荡培养,每隔2 h测量一次OD600值,绘制生长曲线。
1.5.3 标记菌株的致病性测定 取健康香梨离体叶片,用0.5%次氯酸钠浸泡10 min 进行表面消毒,用无菌水浸泡漂洗3 次。用无菌牙签在叶片的叶柄基部扎孔,用移液枪分别滴加5 μL的E.a001-gfp和E. a001 菌悬液(浓度为108 cfu·mL-1),每个处理20枚叶片,以接种无菌水为对照。接种后将叶片置于培养皿中,28 ℃下保湿培养,观察发病时间并用游标卡尺测量病原菌沿叶脉扩展的病斑长度。
1.6 接种E.a001-gfp 标记菌株在香梨枝条组织中的侵染和迁移扩展动态
1.6.1 不同浓度的E. a001-gfp 菌悬液的制备将E.a001-gfp 菌株在LB 培养基上活化,挑取单菌落接入LB(加入Km 50 μg·mL-1)培养液中,在28 ℃、160 r·min-1震荡培养OD600=1.2 左右。用无菌水将培养液稀释至106、107、108和109 cfu·mL-1不同浓度的菌悬液。
1.6.2 香梨枝条上接种E.a001-gfp及其在枝条中的迁移扩展测定 在试验温室供试香梨植株上选取长势一致的1 年生、2 年生枝条,分别采用针刺法和喷雾法接种E.a001-gfp 菌悬液。(1)针刺法接种:在香梨幼嫩枝条距顶梢5 cm 左右处用无菌牙签刺伤约0.5 cm的伤口,用移液枪吸取10 μL不同浓度的菌悬液滴入伤口,在接种点上方1 cm处包裹一圈无菌水浸润的无菌棉条,再用保鲜膜将接种部位同脱脂棉条一起包裹好保湿24 h后去除接种位点上方塑料薄膜和脱脂棉;(2)喷雾法接种:将不同浓度的菌悬液装入手持式压力喷壶中,将菌液均匀喷施在香梨枝条顶梢约10 cm 处至叶片与枝条完全湿润,套袋保湿24 h。每个菌悬液浓度处理接种20个枝条,以接种无菌水作为对照。接种后每天定时观察枝条发病情况,测定并记录发病香梨植株枝条上病斑扩展的距离、时间,计算迁移速度。
1.7 接种E.a001-gfp 标记菌株在香梨枝条组织中的定殖
1.7.1 E.a001-gfp在香梨枝条组织中的定殖量 在试验温室种植的4年生香梨植株的当年生幼嫩枝条上,采用1.6.2 针刺法接种E.a001-gfp 菌悬液(浓度为109 cfu·mL-1)。接种后9、19、40 d 分别从发病枝条顶梢处、病健交接处和未显症部位取样,用75%的酒精浸泡1 min,1%次氯酸钠浸泡2~3 min,再用无菌水冲洗3~4次。取最后一次无菌水冲洗液100 μL涂布于LB培养基,置于28 ℃恒温箱中培养2 d。取表面灭菌彻底的样品放入灭菌的研钵中,加入PBS缓冲液将组织充分研磨,将上清液加入试管无菌水中充分混匀制成不同稀释度的稀释液。每个梯度稀释液吸取100 μL加在LB(含50 μg·mL-1的Km)平板培养基上,用无菌涂布器均匀涂布后放入28 ℃培养箱,培养2 d。在倒置荧光显微镜下观察、统计平板上长出的具有绿色荧光的菌落,计算出病原菌在枝条不同部位的定殖量(cfu·g-1)。
1.7.2 E.a001-gfp在香梨枝条组织中定殖位点的显微观察 采用1.6.2的方法对香梨1年生枝条针刺接种E.a001-gfp。于接种10 d后取发病枝条的不同部位(接种点,距接种点不同距离,显症和未显症部位)1 cm的片段在冷冻切片机(赛默飞CryoStar NX50)上横切、纵切制作组织切片,置于激光共聚焦扫描显微镜下(TCS SP8 STED 3X),在GFP 的激发波长(488 nm),荧光检测波长(495~515 nm)下观察在香梨枝条表皮、皮层、韧皮部、维管束、木质部和导管组织中标记菌株的分布,拍照并分析。
1.7.3 E.a001-gfp在离体香梨枝条中的存活能力检测 将1.7.1 接种E.a001-gfp发病的香梨枝条剪下,装入牛皮纸袋放置在实验室室温下保存,每个月抽取6 个病枝,采用1.7.1 的组织分离法进行病原菌的分离,检测病枝条中存活的病原菌数量。
2 结果与分析
2.1 梨火疫病菌E.a001-gfp转化子的获得和鉴定
采用热激转化法将携带gfp 基因的质粒phc60-gfp 导入梨火疫病菌E. a001 感受态细胞中。挑取在LB 选择性抗生素平板上长出的菌落,在荧光显微镜下观察可见菌落和菌体均发出强烈的绿色荧光(图1-B,C);抗性菌落呈乳白色、半球形隆起状,表面湿润,光滑,半透明(图1-A),菌体为短杆状,与野生菌株无差异,而野生菌株不发荧光。用gfp基因特异性引物对阳性转化子、野生菌株E.a001进行PCR检测,结果显示在阳性转化子基因组、含gfp 基因的质粒DNA中均能扩增出大小约700 bp的目标条带,而野生菌株中扩增不到目的片段(图2),表明gfp基因已成功转入到E.a001 的基因组中并在细胞中成功表达,将标记菌株命名为E.a001-gfp。

图1 野生菌株和GFP 标记菌株的形态特征
Fig.1 Morphological characteristics of wild type and GFP-marked E.a001 strain
A.E.a001 菌落形态;B,C.荧光显微镜观察E.a001-gfp 菌落和菌体(UV 光,放大倍数分别为10×,1000×)。
A.Colony morphology of E.a001 strain ;B,C.Colony and bacteria morphology of E.a001-gfpstrain under the fluorescent microscope(UV-light,magnifications were 10×and 1000×,respectively).
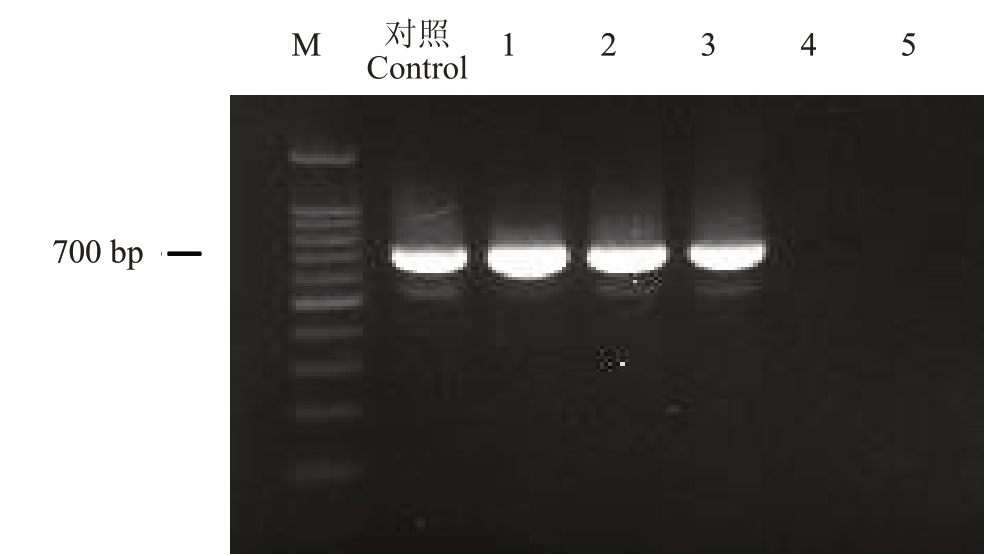
图2 阳性转化子中GFP 基因的PCR 检测
Fig.2 PCR detection of GFP gene in positive trans formants
M.Marker;对照.GFP 质粒;1-3.E.a001-gfp 阳性转化子;4-5.野生菌株E.a001。
M. Marker; Control. GFP plasmid; 1-3. E. a001-gfp positive trans formants;4-5.wild typeo of E.a001.
2.2 E.a001-gfp标记菌株的生物学特性
2.2.1 E.a001-gfp遗传稳定性检测 遗传稳定性检测结果显示(表1),E.a001-gfp标记菌株在不含抗生素的LB培养基中每隔12 h连续继代培养8次后,菌落保持强烈的绿色荧光,质粒保持率为99%以上。结果表明,gfp质粒可在E.a001中稳定遗传且表达良好。
表1 标记菌株E.a001-gfp 菌株的遗传稳定性测定结果
Table 1 Determination of genetic stability of marked E.a001-gfp strain
?
2.2.2 标记菌株与野生菌株的生长曲线比较 测定比较标记菌株与野生菌株的生长曲线(图3)。在相同培养条件下,标记菌E.a001-gfp与野生菌株E.a001均在生长6 h后进入指数期,约24 h后,进入稳定期,生长曲线的变化趋势基本相同(图3)。结果显示,外源基因gfp的转化和表达未影响标记菌株E.a001-gfp的生长,其生长速率与野生菌株基本一致。

图3 E.a001 与E.a001-gfp 的生长曲线
Fig.3 Growth curve of E.a001 and E.a001-gfp
2.2.3 标记菌株与野生菌株的致病性比较 在香梨叶片上针刺接种标记菌株E. a001-gfp 和野生菌株E.a001,比较其致病性(图4)。E.a001-gfp和E.a001在香梨叶片上产生病斑的显症时间无差异,均在接种后3 d可见病原菌开始沿主叶脉扩展,扩展距离略有差异,分别为4.1 cm和3.9 cm,但差异不显著(p>0.05)。结果表明,E.a001-gfp标记菌株的侵染能力和致病性与野生菌株相似,可以将其用于接种测定病原菌在寄主组织中的侵染过程的功能菌株。

图4 标记菌株E.a001-gfp(左)和野生菌株E.a001(右)的致病力比较
Fig.4 Comparison of pathogenicity between E.a001-gfp(left)and E.a001(right)
2.3 E. a001-gfp 标记菌株在香梨枝条中的迁移扩展特征
2.3.1 针刺法接种标记菌株在香梨枝条中的侵染扩展距离、迁移时间和速率 采用针刺法在香梨树1年生、2年生枝条上接种E.a001-gfp菌液,观察测定病原菌的侵染和在枝条组织中的迁移扩展情况。试验结果表明(图5,表2),接种不同浓度E.a001-gfp 菌液,从针刺伤口侵染产生的坏死病斑在枝条中的扩展距离、迁移时间及速率均有明显差异。在香梨1年生幼嫩枝条上接种,当病原菌浓度为105 cfu·mL-1时仅局限在伤口处变黑,病斑不扩展;病原菌浓度为106 cfu·mL-1时,接种3 d 后枝条上开始出现黑色坏死病斑,5 d后病斑才逐渐开始扩展,之后扩展迅速;浓度为107、108和109 cfu·mL-1病原菌接种后2 d枝条上即出现黑色坏死病斑并扩展,扩展速率随病原菌浓度的增加而提高,108 cfu·mL-1病原菌在枝条中的扩展最快,速率可达3.95 cm·d-1,显著高于其他浓度。浓度≥106 cfu·mL-1病原菌接种后侵染香梨枝条组织产生坏死病斑并上下迁移的时间为10~15 d(平均13.5 d),病斑扩展距离为38.06~45.31 cm(平均42.55 cm),其中106、107 cfu·mL-1接种处理的枝条病斑迁移持续时间最长(15 d),109cfu·mL-1接种处理的枝条病斑的迁移时间持续最短(10 d);108cfu·mL-1浓度的病原菌接种处理的病斑扩展最长(45.31 cm)。在2 年生枝条上针刺接种,病原菌浓度为105 cfu·mL-1 时仅局部变色,病斑不扩展;浓度≥106 cfu·mL-1病原菌接种后8~12 d 才开始出现病斑症状并缓慢扩展,扩展距离为3.05~3.86 cm(平均3.46 cm),15 d后病斑不再扩展。
表2 针刺接种不同浓度的E.a001-gfp 菌液在香梨枝条中病斑的迁移速率比较
Table 2 Comparison of migration rate of necrotic lesions by stab inoculation with different concentrations of E.a001-gfp suspension in pear shoots

注:同列不同小写字母表示各处理间间差异显著(p<0.05)。下同。
Note:Different lowercase letters in the same column indicate significant difference at p<0.05.The same below.
?
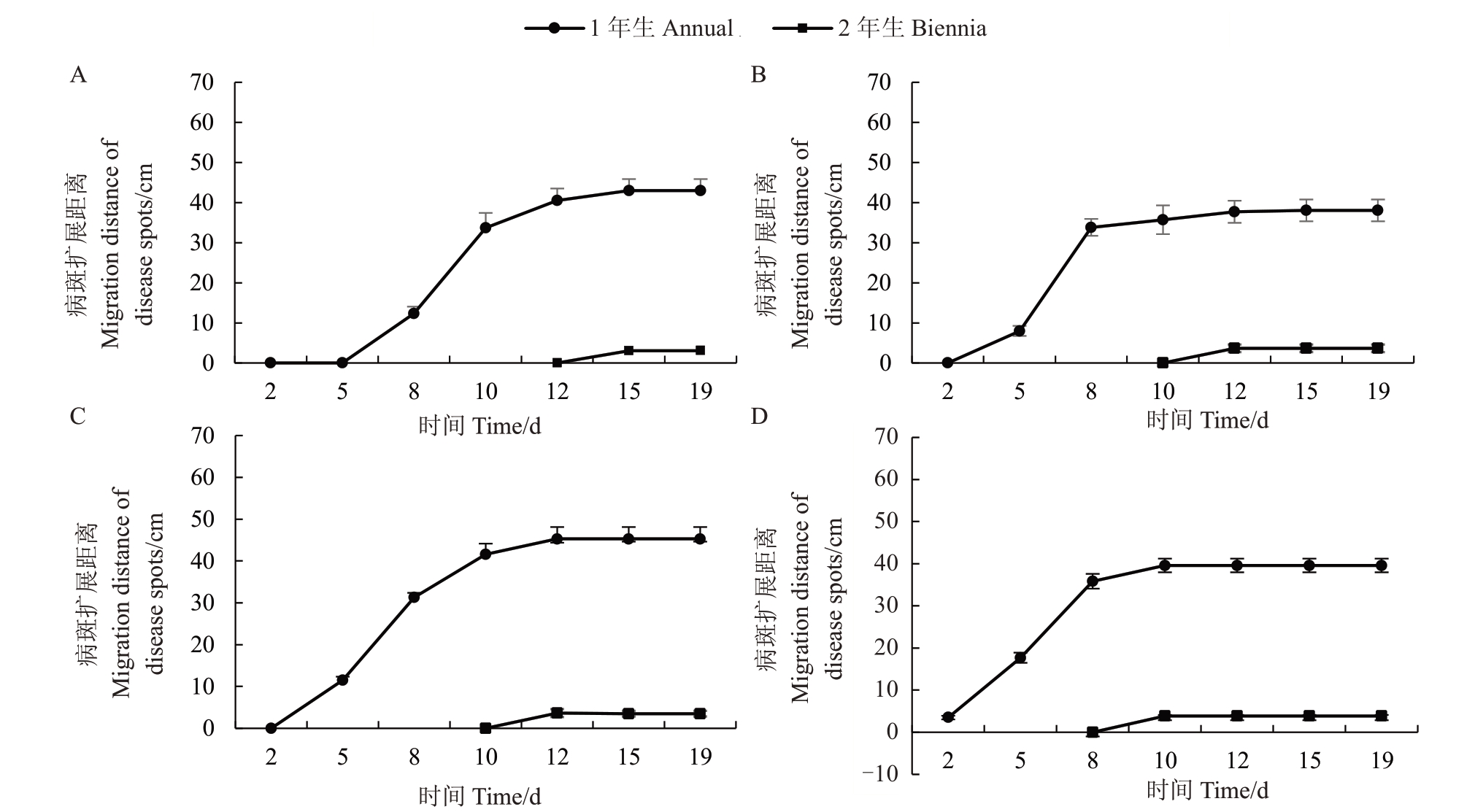
图5 针刺接种E.a001-gfp 在香梨枝条中病斑的扩展距离和迁移时间
Fig.5 Migration distance and time of necrotic lesions in pear shoots bystab inoculation with E.a001-gfp
A~D.接种浓度分别为106cfu·mL-1,107cfu·mL-1,108cfu·mL-1,109cfu·mL-1。
A-D.Inoculation concentration 106cfu·mL-1,107cfu·mL-1,108cfu·mL-1,109cfu·mL-1.
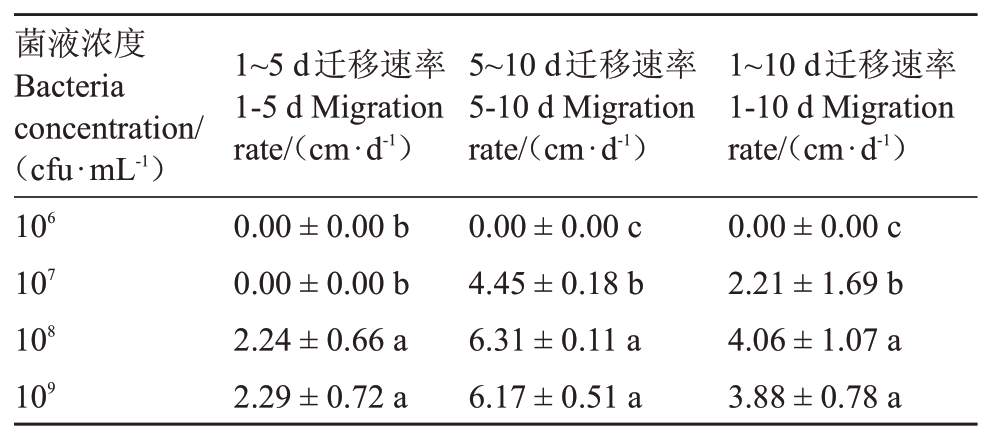
2.3.2 喷雾接种标记菌株在香梨枝条中的扩展距离、迁移时间和速率 在香梨树1 年生、2 年生枝条上采用喷雾法接种不同浓度的E.a001-gfp菌液。试验结果表明(图6,表3),在1年生枝幼嫩枝条上,浓度为≤106 cfu·mL-1病原菌接种后枝条不显症;浓度为107 cfu·mL-1病原菌接种后5~6 d在顶梢处开始出现黑色坏死病斑并沿枝条逐渐向下扩展;浓度为108 cfu·mL-1和109 cfu·mL-1病原菌接种后2 d即开始显症并沿枝条扩展,108 cfu·mL-1接种处理的病斑扩展最快,扩展速率可达4.06 cm·d-1。浓度≥107 cfu·mL-1的接种处理,枝条病斑的迁移时间为15 d,之后病斑长度不再增加;病斑扩展距离为38.89~47.27 cm(平均43.08 cm),108 cfu·mL-1接种处理的病斑扩展最长(47.27 cm)。
表3 喷雾接种不同浓度的E.a001-gfp 菌液在香梨枝条中病斑的迁移速率比较
Table 3 Comparison of migration rate of necrotic lesions by spray inoculation with different concentrations of E.a 001-gfp suspension in pear shoots
?

图6 喷雾接种E.a001-gfp 在香梨枝条中病斑的扩展距离和迁移时间
Fig.6 Migration distance and time of necrotic lesions in pear shoots by spray inoculation with E.a001-gfp
A~C.接种浓度分别为107 cfu·mL-1,108cfu·mL-1,109cfu·mL-1。
A-C.Inoculation concentration 107 cfu·mL-1,108cfu·mL-1,109cfu·mL-1.
在2年生枝条上喷雾接种病原菌浓度≤107 cfu·mL-1均不出现症状,浓度≥108的接种处理后10 d 开始出现病斑并扩展,扩展距离为2.05~3.9 cm(平均2.96 cm),15 d后病斑不再扩展。
2.4 E.a001-gfp 标记菌株在香梨枝条组织中的定殖
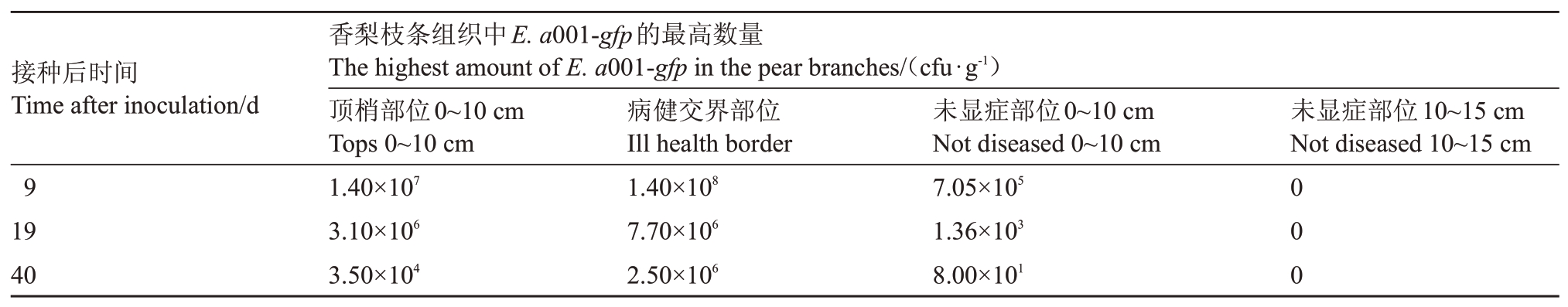
2.4.1 标记菌株在香梨枝条中的定殖量 在4年生香梨植株的当年生幼嫩枝条上距顶梢5 cm 处针刺接种E.a001-gfp菌悬液。在接种后分别从发病枝条顶梢、病健交界和未显症部位取样,通过选择性抗性平板进行组织分离,结合菌落荧光观察,测定标记菌株在枝条不同部位中的活菌定殖量。结果显示(表4),在接种后9~40 d,从感病枝条的顶梢、病斑和健康组织的交接处及未显症的0~10 cm枝条部位均能检测到活病原菌的定殖。在感病枝条的病健交界组织中的病原菌最为集中,活菌定殖量最大。接种后第9天定殖量可达到1.40×108 cfu·g-1,之后随着侵染时间延长有所下降并维持稳定,至40 d时可保持在2.50×106 cfu·g-1。其次,活菌定殖量较多的部位是在感病枝条的顶梢部位。接种后第9天定殖量可达到1.40×107 cfu·g-1,40 d 后下降至3.50×104 cfu·g-1。在感病枝条的未显症部位0~10 cm 有病原菌定殖,定殖量为8.00×101~7.05×105 cfu·g-1,40 d 后在该部位仍能分离出活菌。但在感病和枝条未显症部位10~15 cm组织中未分离出病原菌。
表4 香梨枝条不同部位病原菌定殖量
Table 4 Colonization count of the viable bacteria in different parts of pear shoots
?
2.4.2 标记菌株在香梨枝条内定殖的显微观察 在激光共聚焦扫描显微镜下观察接种E.a001-gfp感病的香梨枝条。由图7可见,接种10 d后,在感病枝条组织中E. a001-gfp 标记菌株主要定殖于维管系统中,大量分布于皮层薄壁细胞和韧皮部薄壁细胞的细胞间隙,有少量存在于木质部导管中。

图7 病原细菌在香梨茎组织中的分布
Fig.7 Distribution of E.a001-gfp in stem tissue of pear
A.香梨病枝横切面;B.健康香梨枝条横切面;C.香梨病枝纵切面;D.韧皮组织。
A.Crosssection of diseased pear shoots;B.Crosssection of healthy pear shoots;C.Longitudinal section of diseased pear shoots;D.Phloem tissue.
2.5 标记菌株在香梨离体枝条中的存活能力
E. a001-gfp 标记菌株在离体香梨枝条中存活力的测定结果如图8所示。感病枝条在室温下存放1 个月后检出病原菌活菌量为108 cfu·g-1,之后逐渐下降,3个月时活菌数下降至106 cfu·g-1,4个月后仍能在病枝中分离到105 cfu·g-1的活菌量。
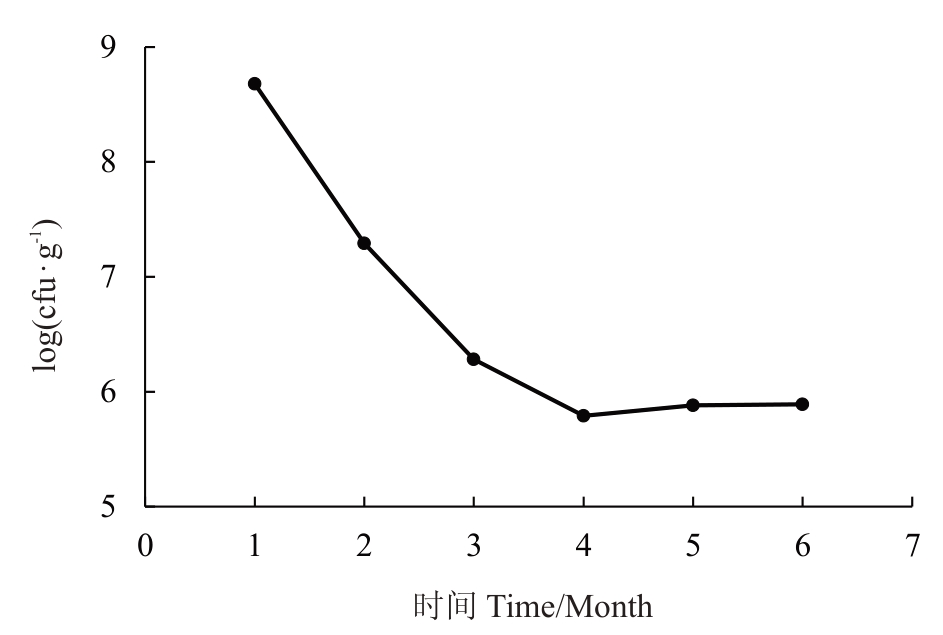
图8 E.a001-gfp 标记菌株在离体病枝中的存活量检测结果
Fig.8 Survival viable count of E.a001-gfp in vitrodiseased shoots
3 讨 论
GFP 作为报告基因,在定性和定量监测功能微生物菌株在环境中的动态、微生物与宿主的相互作用,示踪病原菌对宿主组织侵染过程、空间定位和基因表达调控等研究中得到了广泛应用。有研究发现,GFP 在微生物细胞内的高效表达会造成一些标记菌株的代谢负担,影响其遗传稳定性、生理代谢活动和生物学功能的发挥[16]。因此标记菌株的生长,生理生化特性、致病力及遗传稳定性等,与原始菌株相比是否有较大的变化都会直接影响到该菌株的研究和应用价值。冯永君等[17]比较成团泛菌YS19 的GFP 标记菌株及其野生菌株的生长情况,发现标记菌株最大比生长速率和最大生物量减少12.4%和6%,代时延长14.0%。张昕等[18]报道的在无选择压力标记菌株ZJY-116G 连续传10 代,GFP 质粒保存率是69.3%。笔者在本研究中成功将携带GFP基因的质粒导入梨火疫病菌E. a001 菌株中,标记菌株E.a001-gfp与野生菌株E.a001的菌落形态无差异,生长曲线基本一致,致病力相当,无显著差异;同时在无抗生素的选择压力条件下多次继代培养后质粒的保持率仍能达到99%以上,并且保持强烈的绿色荧光,表明GFP 重组质粒在E.a001-gfp 菌株中能稳定遗传和基因表达,可用于示踪研究病原菌在寄主组织中的侵染过程的功能菌株。
梨火疫病菌从香梨枝条嫩梢侵入是病原菌的另一个重要侵入途径,梨树新梢生长期也是病害发生的另一个高峰期。为掌握病原菌对枝条嫩梢侵入、扩展迁移的规律,本研究在香梨树枝条上采用不同浓度的E.a001-gfp 标记菌株菌液通过针刺和喷雾2种方法接种,比较病原菌侵入枝条组织发病显症的时间及病斑扩展距离、速率和迁移时间等。试验结果表明,针刺接种引起枝条发病的最低病原菌浓度为106 cfu·mL-1,低于喷雾接种(107 cfu·mL-1)。相同浓度的病原菌接种,喷雾接种较针刺接种后发病,显症时间延迟2~3 d。这可能是因为喷雾接种病原菌主要通过枝条表皮上的皮孔、气孔等的自然孔口入侵,进入组织内的病原菌量有限,而针刺接种病原菌更容易通过伤口穿透表皮进入皮层组织中,更利于病原菌的快速生长和扩展,在较短时间、较低的病原菌浓度下即可致病。研究结果为梨火疫病菌在香梨枝条上接种试验提供了接种浓度和接种方法的参考。Sedlák等[19]通过伤口法接种(105 cfu·mL-1)在苹果嫩梢上接种时发现显症时间(5 d)较喷雾法提前了2 d,与本研究结果相似。但枝条发病的最低病原菌浓度对比本试验结果(106 cfu·mL-1)略低,可能由选用寄主植物的抗性、接种方法差异所致。笔者在本研究中发现,接种病原菌浓度显著影响其在香梨枝条组织中的扩展速率,病原菌侵染枝条产生的坏死病斑的扩展速率随病原菌浓度的增加而提高,108 cfu·mL-1的病原菌浓度接种处理的病斑扩展速度最快,迁移速率可达3.95 cm·d-1(针刺接种)和4.06 cm·d-1(喷雾接种)。结果可见,外界的菌源量是影响病害侵染和发生程度的重要因素。
研究表明,在2年生枝条上,针刺法与喷雾法接种下的梨火疫病菌的扩展速度慢,在1年生的枝条上扩展速度快,二者有显著差异。分析认为,1年生枝条生长旺盛,组织柔软,有利于病原菌侵染;病原菌进入皮层薄壁组织,此部位细胞分布疏散、细胞间隙大,其中幼嫩多汁、富含淀粉,有利于病原菌的繁殖并随运输有机物的筛管迁移;而2年生枝条组织的次生木质化程度较高,对病原菌扩展起到了一定的阻隔作用,减缓和缩小了病原菌扩展迁移的速度和距离。
梨火疫病菌从寄主幼嫩枝条入侵,如控制不当不仅会造成病原菌迅速扩展进入大枝、主枝甚至主干,引起整株死亡,而且还是重要的侵染源,对病害的发生、传播和流行至关重要[20]。对发病果树在生长期和冬季休眠期及时修剪病枝,不仅能阻止其在树体中的迁移扩展,还能从源头上大大降低病原菌的菌源量,减少其传播和扩散,对病害防治能达到事半功倍的效果。在生产中对病枝修剪,既要做到将带有病原菌的枝条组织彻底清除,又要尽可能地保留健康组织,明确病枝条修剪的位置、长度、范围及时间等是一个关键的技术问题。笔者在本研究中采用梨火疫病菌GFP标记菌株,通过选择培养基分离培养结合荧光菌落鉴别,以及采用激光共聚焦扫描显微镜观察,明确病原菌在枝条中的定殖部位、定殖量及存活时间。结果表明,梨火疫病菌入侵后主要存在于维管系统中,大量分布于皮层薄壁细胞和韧皮部薄壁细胞间隙,少量存在于木质部导管中,与国外已报道病原菌的分布一致[21]。韧皮部在植物中起到运输养料的作用,可双向上下运输,其中含有蔗糖等营养物质,适于病原菌生长和繁殖,是入侵病原菌在寄主组织中繁殖和定殖的主要部位,也是病原菌迅速扩展的重要原因。有研究认为,进入到木质部导管中的病原菌可在树体内多年存活,一定条件下从木质部导管中扩散再次侵入皮层薄壁组织或侵入砧木,造成病害的再次暴发流行。这也是梨火疫病菌一旦入侵寄主树体,在其中定殖造成病害难以控制和根除的重要原因之一。测定入侵病原菌在香梨发病枝条中的定殖指标,结果显示,病健交接部位的活菌数量最高,可达到108 cfu·g-1;枝条未显症部位0~10 cm 处病原菌最高可达到105 cfu·g-1,在40 d 时坏死病斑部位仍能分离出活菌,但在香梨枝条病斑外未显症部位10~15 cm 处均未分离出病原菌。Wilson 等[22]研究认为,在可见病变下方15~45 cm处修剪能有效控制病害,Clarke 等[23]建议在超过可见症状的20~25 cm处修剪,但未提出明确的依据。本研究结果证实了他们的结论,建议在梨火疫病感病的香梨枝条可见病斑20~30 cm处修剪病枝,能有效清除病源,是安全有效的修剪长度。对在室温下保存的发病香梨离体枝条中的病原菌活菌数的检测结果显示,存放6 个月的病枝中检出的梨火疫病菌活菌数为105 cfu·g-1数量级的病原菌。结果可见,病原菌可在发病枝条等组织中长时期存活,保持其侵染活性。如不及时修剪果园中的发病枝条或不及时清理出果园,则病残体就成为重要的侵染源,通过风、雨、气溶胶等传播,造成病害的再次发生流行。因此及时修剪病枝和清园销毁病枝等病残体是病害防治的重要环节。
4 结 论
梨火疫病菌侵染枝条产生的坏死病斑的扩展速率随病原菌浓度的增加而提高;病原菌入侵枝条后主要存在于皮层薄壁细胞和韧皮部薄壁细胞间隙,少量存在于木质部导管中;病斑外未显症部位10~15 cm处均未分离出病原菌,建议在可见病斑外20~30 cm处修剪病枝,能有效清除病源。
[1] 胡白石,许志刚,周国梁,易建平,焦国尧.梨火疫病的进境风险分析[J].植物保护学报,2001,28(4):303-308.HU Baishi,XU Zhigang,ZHOU Guoliang,YI Jianping,JIAO Guoyao. Primary risk analyses of import of erwinia amywvora to China[J].Journal of Plant Protection,2001,28(4):303-308.
[2] ZHAO Y Q,TIAN Y L,WANG L M,GENG G M,ZHAO W J,HU B S,ZHAO Y F. Fire blight disease,a fast-approaching threat to apple and pear production in China[J]. Journal of Integrative Agriculture,2019,18(4):815-820.
[3] 李洪涛,张静文,盛强,唐章虎,张祥林,张春竹,罗明.我国20个梨品种(种质)对国外梨火疫病菌的抗病性评价[J].果树学报,2019,36(5):629-637.LI Hongtao,ZHANG Jingwen,SHENG Qiang,TANG Zhanghu,ZHANG Xianglin,ZHANG Chunzhu,LUO Ming. Resistance evaluation of 20 pear varieties (germplasms) in China to foreign strains of Erwinia amylovora[J].Journal of Fruit Science,2019,36(5):629-637.
[4] 中华人民共和国农业农村部.农办农(2021)12 号:全国农业植物检疫性有害生物分布行政区名录[EB/OL].(2021-04-22)[2022-05-15].https://www.moa.gov.cn/nybgb/2021/202105/202-110/t20211021_6380164.htm.Ministry of Agriculture and Rural Affairs of the People’s Republic of China. Agricultural Office of Agriculture (2021)No. 12:National agricultural plant quarantine pests distribution of the administrative list[EB/OL]. (2021-04-22)[2022-05-15]. https://www.moa.gov.cn/nybgb/2021/202105/202110/t20211021_6380-164.htm.
[5] MALNOY M,MARTENS S,NORELLI J L,BARNY M A,SUNDIN G W,SMITS T H M,DUFFY B. Fire blight:Applied genomic insights of the pathogen and host[J].Annual Review of Phytopathology,2012,50:475-494.
[6] DOOLOTKELDIEVA T,BOBUSHEVA S. Fire blight disease caused by Erwinia amylovora on Rosaceae plants in Kyrgyzstan and biological agents to control this disease[J].Advances in Microbiology,2016,6(11):831-851.
[7] MARINOVA-TODOROVA M,RANTA J,HANNUNEN S. The suitability of Finnish climate for fire blight(Erwinia amylovora)epidemics on apple[J].Agricultural and Food Science,2015,24(1):59-66.
[8] AZEGAMI K,TSUKAMOTO T,MATSUURA T,OHARA T,INOUE Y,MIZUNO A,YOSHIDA K,BESSHO H,KIMURA S,GOTO M. Invasion and colonization of mature apple fruit by Erwinia amylovora tagged with bioluminescence genes[J]. Journal of General Plant Pathology,2004,70(6):336-341.
[9] SANTANDER R D,CATALÀ-SENENT J F,FIGÀS-SEGURA À,BIOSCA E G.From the roots to the stem:Unveiling pear root colonization and infection pathways by Erwinia amylovora[J].FEMS Microbiology Ecology,2020,96(12):fiaa210.
[10] 贾娜娜,翟立峰,白晴,陈晓忍,王彩霞,洪霓,王国平.腐烂病菌的GFP 标记及其在梨叶片组织中的侵染和扩展观察[J].果树学报,2015,32(6):1195-1200.JIA Nana,ZHAI Lifeng,BAI Qing,CHEN Xiaoren,WANG Caixia,HONG Ni,WANG Guoping.Marking of Valsa pyri with GFP and observing the infection and extension of marked strains in pear leaf tissues[J]. Journal of Fruit Science,2015,32(6):1195-1200.
[11] 陈卓,肖熙鸥,陈曙,李可,邹华芬,金辉. 利用GFP 标记的Ralstonia solanacearum 鉴定马铃薯青枯病抗性[J].中国瓜菜,2021,34(1):35-41.CHEN Zhuo,XIAO Xiou,CHEN Shu,LI Ke,ZOU Huafen,JIN Hui.Identification of potato bacterial wilt resistance using GFPlabeled Ralstonia solanacearum[J].China Cucurbits and Vegetables,2021,34(1):35-41.
[12] BOGS J,BRUCHMÜLLER I,ERBAR C,GEIDER K.Colonization of host plants by the fire blight pathogen Erwinia amylovora marked with genes for bioluminescence and fluorescence[J].Phytopathology®,1998,88(5):416-421.
[13] HEYENS K,VALCKE R.Fluorescence imaging of the infection pattern of apple leaves with Erwinia amylovora[J]. Acta Horticulturae,2006(704):69-74.
[14] 王颖.生防芽孢杆菌ZA1 的GFP 基因标记及其定殖动态研究[D].兰州:甘肃农业大学,2015.WANG Ying. Study on labeling biocontrol bacteria Bacillus ZA1 with GFP and its colonization[D].Lanzhou:Gansu Agricultural University,2015.
[15] 任嘉红,刘辉,姜楠,魏玉宏,张冰,王莹.GFP 标记溶磷草木樨中华根瘤菌CHW10B 及其定殖[J].林业科学,2015,51(1):74-79.REN Jiahong,LIU Hui,JIANG Nan,WEI Yuhong,ZHANG Bing,WANG Ying. Sinorhizobium meliloti CHW10B strain GFP-labelling and its colonization associated with Taxus chinensis var.mairei[J].Scientia Silvae Sinicae,2015,51(1):74-79.
[16] 董爱菊,邱慧珍,董莉,周洋子,陈兰兰,王友玲,王川.类芽孢杆菌QHZ11-gfp 在马铃薯植株上的定殖特征及促生效果[J].微生物学通报,2021,48(11):4075-4086.DONG Aiju,QIU Huizhen,DONG Li,ZHOU Yangzi,CHEN Lanlan,WANG Youling,WANG Chuan. The colonization characteristics of Paenibacillus jamilae QHZ11-gfp in potato plants and its growth-promoting effect[J]. Microbiology China,2021,48(11):4075-4086.
[17] 冯永君,宋未.水稻内生优势成团泛菌GFP 标记菌株的性质与标记丢失动力学[J].中国生物化学与分子生物学报,2002,18(1):85-91.FENG Yongjun,SONG Wei. Characteristics and label loss dynamics of Pantoea agglomerans,predominant endophytic bacteria isolated from rice plant[J]. Chinese Journal of Biochemistry and Molecular Biology,2002,18(1):85-91.
[18] 张昕,张炳欣,喻景权,张震,沈卫峰,陈振宇,石江.生防菌ZJY-1 及ZJY-116 的GFP 标记及其在黄瓜根围的生态适应性[J].应用生态学报,2005,16(11):2144-2148.ZHANG Xin,ZHANG Bingxin,YU Jingquan,ZHANG Zhen,SHEN Weifeng,CHEN Zhenyu,SHI Jiang. Labeling of biocontrol agents ZJY-1 and ZJY-116 gfp gene and its ecological adaptability in cucumber rhizosphere[J]. Chinese Journal of Applied Ecology,2005,16(11):2144-2148.
[19] SEDLÁK J,PAPRŠTEIN F,KORBA J,ŠILLEROVÁ J. Development of a system for testing apple resistance to Erwinia amylovora using in vitro culture techniques[J]. Plant Protection Science,2015,51(1):1-5.
[20] PARK D H,YU J G,OH E J,HAN K S,YEA M C,LEE S J,MYUNG I S,SHIM H S,OH C S.First report of fire blight disease on Asian pear caused by Erwinia amylovora in Korea[J].Plant Disease,2016,100(9):1946.
[21] KUNIEDA T,KUBO T.In vivo gene transfer into the adult honeybee brain by using electroporation[J]. Biochemical and Biophysical Research Communications,2004,318(1):25-31.
[22] WILSON R A. Six years of testing streptomycin oxytetracycline for control of fire blight of bartlett pear[J].Plant Disease Reporter,1962,46(6):397-400.
[23] CLARKE G G,HICKEY K D,TRAVIS J W.Recovery of Erwinia amylovora from excised infected apple shoots and subsequent development of symptoms on pruning stubs in the orchard as influenced by pruning methods[J]. Phytopathology,1991,62(1):81-121.