我国是世界柑橘重要起源中心、世界第一大柑橘生产国[1-2],栽培面积近306.67 万hm2,总产量约6000 万t。2004 年在陕西城固温州蜜柑(Citrus unshiu Marcov.)及金橘[Fortunella margarita(Lour.)Swingle]上首次发现柑橘轮斑病(citrus target spot)[3-5],其病菌被鉴定为Cryptosporiopsis citricarpa Zhu,Hyde & Li,后被重新鉴定为Pseudofabraea citricarpar[6]。该病在冬末春初发病最重,患病的柑橘叶片每年冬春季提前脱落,枝干大量枯死,树势衰弱,严重时整株枯死,甚至毁园[7-10],高温季节一般不发病。在万州柠檬上,该病也侵染果实,造成果实出现直径0.2~2.2 cm、黑褐色凹陷斑点,最终烂果落果。
近年来,柑橘轮斑病在我国发生愈加频繁,呈现由北向南加速传播的趋势。据2021年报道,经科赫氏法则验证湖北宜昌温州蜜柑、湖南吉首椪柑(C.reticulata Blanco‘Ponkan’)及重庆万州的尤力克柠檬[C. limon (L.) Burm. F.‘Eureka’]、北京柠檬(C.meyerii Y.Tan.‘Meyer’)、碰柑和纽荷尔脐橙(C.sinensis‘Newhall’)均发生了柑橘轮斑病[10-11],此外还在重庆塔罗科血橙[C. sinensis (L.) Osbeck‘Tarocco’]和纽荷尔脐橙发现了类似轮斑病症状[10]。当前研究表明,柑橘轮斑病在我国处于高度风险等级,对长江上中游及鄂西-湘西两大柑橘产区存在较大威胁[12],给全国柑橘乃至水果产业带来严峻的防控压力。
目前围绕柑橘轮斑病菌的研究主要集中于病原学[4-5,10-11]、分子检测[13-14]、适生区预测[12]、抗性鉴定[15]等方面,未见该病的发病过程、不同柑橘类植物病害症状的报道,这严重影响各地植保工作者对田间病害的诊断与控制。不同来源的病原菌在同一品种寄主上的潜育期、病情指数、抗感反应有差异[16-18],不同品种对同一株病原菌的抗感性也存在较大的差异[19]。轮斑病对陕西城固县不同品种柑橘类果树的危害程度不同[7],离体接种叶片表明重庆27 个品种柑橘类果树对重庆轮斑病菌Pc-WZBY1 的抗性存在显著差异[15]。因此,研究田间症状、发病规律及不同柑橘品种对不同菌株的抗病性,对重庆柑橘轮斑病的田间诊断、防控及品种布局均具有重要的现实意义。为此,笔者在本研究中将跟踪调查重庆万州轮斑病田间症状和发病规律,采用陕西、湖北、重庆不同来源的轮斑病菌接种重庆不同的柑橘引种品种,以期为柑橘生产的合理布局与防控提供理论依据。
1 材料和方法
1.1 田间症状调查
根据重庆气候特点,于尤力克柠檬轮斑病症状典型时,进行不同受害部位田间症状描述并拍照记录。
1.2 田间发病规律调查
选取重庆市万州区白羊镇双石社区尤力克柠檬果园(海拔750 m)开展定时定点调查。从发病开始,每周拍照记录一次,并于每月26 日调查发病率和病情指数。每次调查,新掉落的叶片记为9级,本次调查已经记为9 级并落叶的,下次调查不再统计。
病害调查的分级标准—0级:无病斑;1级:病斑面积占整个叶片面积5%以下;3 级:病斑面积占整个叶片面积5%~10%;5级:病斑面积占整个叶片面积11%~25%;7 级:病斑面积占整个叶片面积的26%~50%;9 级:病斑面积占整个叶片面积50%以上或叶片受害掉落。
发病率(%)=发病株数/调查总株数×100,病情指数=[Σ(各级发病数×该病级数)/调查总数×最高级数]×100。
1.3 不同果园发病情况调查
选取重庆市万州区不同海拔、树龄、栽植密度、树势和品种的果园调查开始发病的时间,并采取“五点法”,统一于3月15日调查发病率和病情指数。轮斑病危害造成落叶记为9级。
1.4 调查期间气象因子记录
在天气网(https://tianqi.2345.com/wea_history/70965.htm)查阅万州2021 年11 月至2022 年4 月期间气象因子数据,并结合果园安装的智慧农业微型气象站的数据,进行统计分析。
1.5 材料
供试菌株详细信息见表1。分离菌株经过形态学和分子生物学鉴定为柑橘轮斑病菌(P. citricarpa),在20 ℃于马铃薯葡萄糖琼脂(PDA)培养基避光培养,直至菌丝体覆盖约四分之三的平板,4 ℃保存、备用。
表1 试验所用菌株信息
Table 1 Information on strains of tested strains

?
47 份供试柑橘种质来自于重庆三峡农业科学院柑橘种质资源圃,详见表2。
表2 试验所用柑橘品种
Table 2 Citrus cultivars used in this study

?
1.6 试验设计
选取分别分离自陕西、重庆、湖北的CGDS2、WZSS1、YLSDP80等3个菌株为供试菌株。室内离体接种表2 中的47 个柑橘品种,每个品种每个菌株接种15 枚叶片,每片叶片接种2 个菌饼,以无菌PDA块接种叶片为对照,3次重复。
1.7 接种方法
选取大小、长势基本一致的健康、成熟叶片,用75%乙醇表面消毒晾干后放入铺有灭菌纱布的无菌托盘,加蒸馏水浸湿纱布。叶片背面针刺创伤,把直径5 mm的菌饼接种针刺处,菌丝面紧贴叶片,放入托盘内的纱布上,用保鲜膜覆盖保湿,10 ℃培养21 d后,统计发病率和病斑平均直径。
1.8 抗性评价方法
采用病斑平均直径法(简称AD法)[20],并对分级标准进行略微调整。抗性分级标准稍作调整:免疫(I)为AD=0 mm;高抗(HR)为0 mm<AD≤3 mm;抗病(R)为3 mm<AD≤6mm;中抗(MR)为6 mm<AD≤9 mm;感病(S)为9 mm<AD≤12mm;高感(HS)为AD>12 mm。
病斑平均直径计算公式为:AD=∑发病叶片病斑直径/调查叶片数。
1.9 数据分析
试验数据采用SPSS22.0软件进行统计分析,处理间的差异性分析采用多重比较应用中最小显著差法(LSD)。
2 结果与分析
2.1 柑橘轮斑病的病害症状
2.1.1 轮斑病侵染柑橘不同部位症状 通过田间调查发现,柠檬感染轮斑病后,叶片(图1-A,C,E~F)、枝条(图1-O~P)、果实(图1-B,D,H,J)、嫩梢(图1-N)、叶(果)柄(图1-K~L)、花萼(图1-M)等均可表现症状。

图1 轮斑病菌侵染柑橘田间症状
Fig.1 The field symptoms of citrus target spot
A、B.尤力克柠檬叶片和果实;C、D.北京柠檬叶片和果实;E、F.温州蜜柑叶片;G、H.砂糖橘叶片和果实;I、J.奉节脐橙叶片和果实;K.尤力克柠檬叶柄;L. 尤力克柠檬果柄;M.尤力克柠檬花萼;N.尤力克柠檬嫩梢;O.尤力克柠檬未木质化枝条;P.尤力克柠檬木质化枝条;Q、R.尤力克柠檬树体枯萎、落叶。
A,B.Leaves and fruits of Eureka lemon;C,D.Leaves and fruits of Meyer lemon;E,F.Leaves of Satsuma orange;G,H.Leaves and fruits of Sugar orange;I,J.Leaves and fruits of Fengjie Navel Orange;K.Petiole of Eureka lemon leaf;L.Stem of Eureka lemon fruit;M.Calyx of Eureka lemon flower; N. New shoots of Eureka lemon; O. Non, lignified softwood twigs of Eureka lemon; P. Lignified branch; Q, R. The trees of Eureka lemon withered and leaves fell.
侵染叶片后,病斑初期红褐色针尖状小点,后逐渐扩大为圆形、椭圆形、梭形或不规则形,略微凹陷(图2-B),中央灰白色,边缘棕褐色(图2-D),外缘深褐色或红褐色油渍状(图2-E),大小为0.2~2.2 cm,中央产生“轮纹状”排列的黑色子实体(图2-A,D,F),也有不产生子实体的(图2-C),后期可穿孔,子实体随之掉落,作为来年主要侵染源。发病较晚或部分多年生叶片上的病斑较小,可一直保持在叶片表面不穿孔也不扩大,直至条件适宜感染其他叶片(图2-E)。柑橘轮斑病发病严重可导致落叶、落果,最后枯死(图1-Q~R)。侵染不同品种柑橘,如尤力克柠檬、北京柠檬、砂糖橘、温州蜜柑、奉节脐橙等成熟叶片症状相似,但侵染温州蜜柑后,叶片病斑大多圆形或椭圆形,少有拖尾(图1-E~F)。
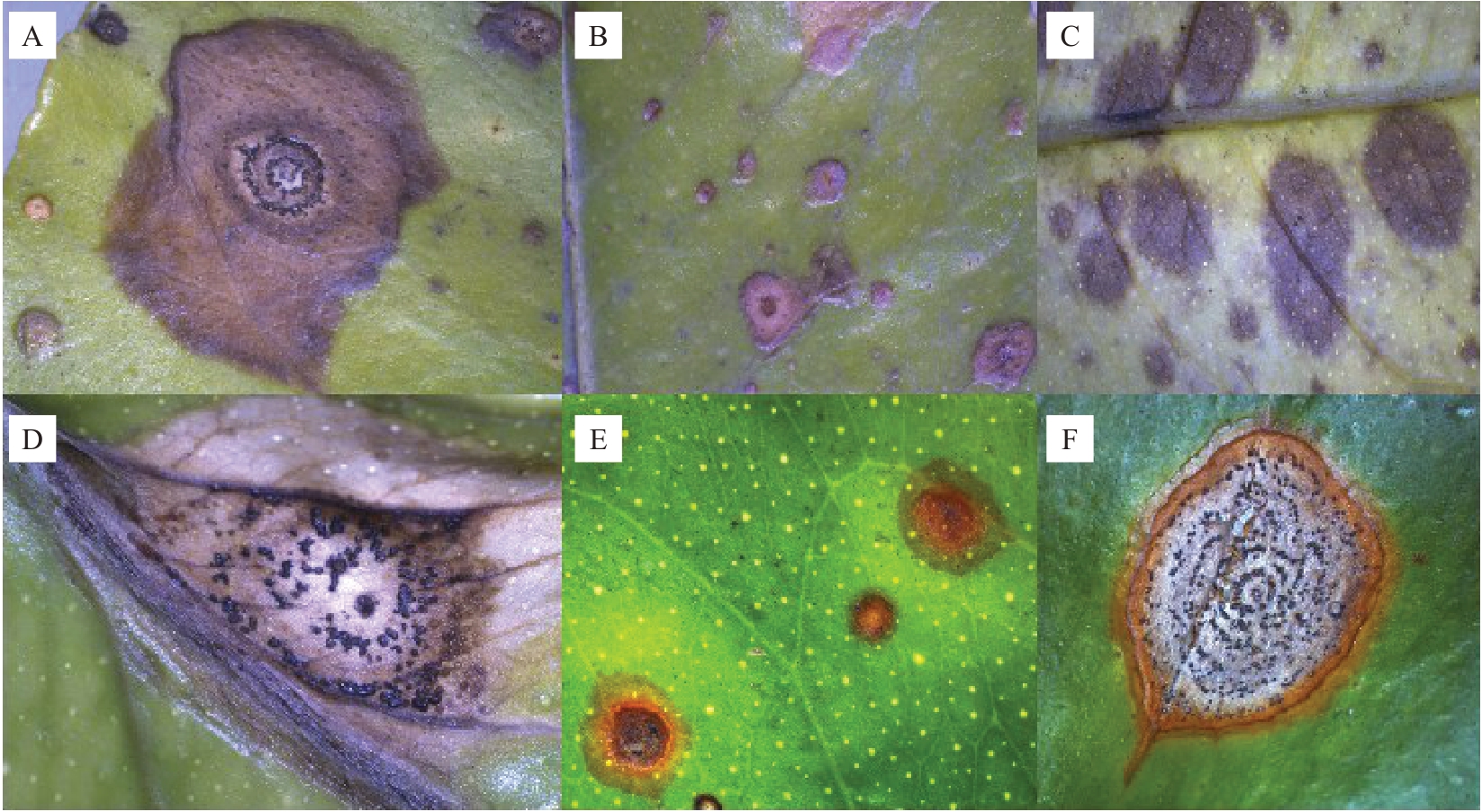
图2 柑橘轮斑病不同病斑
Fig.2 Various lesions of citrus target spot
A.不规则病斑;B.下陷病斑;C.不下陷病斑;D.幼嫩叶病斑;E.边缘油渍状病斑;F.拖尾病斑。
A.Irregular lesions;B.Sagged spots;C.Lesions that didn’t sag;D.Disease spots on young leaves;E.The edge of the lesion is oily;F.Trailing lesion.
侵染嫩梢后,病斑初期红褐色小点,后逐渐扩大为圆形、椭圆形或梭形,凹陷明显,中央灰白色,形成“轮纹状”排列的黑色子实体,边缘深褐色病斑,后期造成嫩梢萎蔫(图1-N)。侵染枝条症状与侵染嫩梢相似,病斑颜色由内而外由灰褐色变深褐色,侵染未木质化枝条后病斑凹陷明显(图1-O),而侵染木质化枝条后病斑无明显凹陷(图1-P)。不同柑橘品种枝条感病症状类似。
侵染果实后,初期病斑为深褐色小点,后逐渐扩大为深褐色圆形,凹陷明显的病斑(图1-B,D,H,J)。后期,果实病斑由内而外为灰白色、棕色和深褐色,中央可形成“轮纹状”排列的黑色子实体。病斑直径为0.2~2.2 cm,多个病斑大多愈合成1 个大斑(图1-B,J),同时引发炭疽病,造成果实腐烂。不同柑橘品种果实感病症状相似,但砂糖橘和奉节脐橙病斑呈现更深的黑褐色(图1-H,J)。
侵染果柄、叶柄和花萼后,病斑初期为黑色针尖状小点,后扩大为圆形、椭圆形或不规则形病斑,病斑由内而外为灰白色,棕色和深褐色,可形成黑色子实体(图1-K~M)。
2.1.2 不同生育期叶片轮斑病特点 不同生育期尤力克柠檬叶片的症状也有显著差异。当年生健壮成熟叶片感病后,病斑直径大,数量为1~20个不等(图3-A~C);当年生营养缺乏、黄化的秋梢叶片感病后,病斑散生,病斑中央棕褐色,外缘深褐色油渍状,凹陷明显,最后病斑直径大多为0.2~0.5 cm,病斑密集,单个叶片病斑可达50个以上,发展迅猛,1月初即可造成全树落叶(图3-D);当年生未完全老熟的晚秋梢感病后,病斑中心灰白色,向外为黑褐色,病斑外缘为灰白色水渍状萎蔫,病斑的一边或多边可沿叶脉产生拖尾。多个病斑可愈合成1个大斑,引起整片叶片萎蔫腐烂(图3-E);发病较晚或部分多年生叶片上的病斑较小,可一直保持在叶片表面不穿孔也不扩大,直至条件适宜感染其他叶片(图3-F)。部分两年生以上的叶片,病情扩展较当年生叶片缓慢,病斑颜色深褐色、红褐色,边缘油渍状更明显,病斑直径大多在1 cm 以内,如果树势较旺,则落叶相对较轻(图3-G)。

图3 尤力克柠檬不同生育期叶片病斑特点
Fig.3 Characteristics of various leaves of Eureka lemon infected by P.citricarpar
A.当年春梢;B.当年夏梢;C.当年老熟秋梢;D. 营养缺乏、黄化叶片;E.当年未老熟晚秋梢;F.多年生中下部叶片;G.2 年生及以上叶片。
A. Spring-shoot in that year; B. Summer-shoot in that year; C.Ageing and mature autumn-shoot; D. Nutritionally deficient, yellowing leaves; E.Late autumn and immature tops;F.Perennial and the middle and lower leaves of the tree;G.Two-years old and perennial leaves.
2.2 柑橘轮斑病的发生规律
2.2.1 柑橘轮斑病在重庆柠檬上的发病规律 在重庆万州白羊镇双石村张邦全尤力克柠檬园(海拔750 m,30°51'23.51"N,108°36'39.67"E,树龄15 年)进行定时调查。结果显示:尤力克柠檬叶片在11月底表现正常(图4-A),在12 月初开始表现轮斑病症状(图4-B)。一旦发病,随着低温来临,病情发展十分迅速,主要表现为病斑快速扩大,颜色变深,病斑数量迅速增加(图4-C~F);12月底发病率达60.55%,病情指数为15.87(图5)。到1 月中下旬,病斑扩展到当年生枝条、果实和叶(果)柄,叶片开始大量脱落(图4-G~J),发病率达到100%,病情指数达到最高峰59.96(图5);2—3 月部分树体叶片基本落光(图4-K~L)。病情指数表现为11月至翌年1月先增加、2月降低、3—4月又增加的趋势(图5)。

图4 不同时期尤力克柠檬轮斑病发病情况
Fig.4 Change of symptoms in different times of citrus target spot on Eureka lemon
A.11 月26 日;B.12 月3 日;C.12 月10 日;D.12 月17 日;E.12 月24 日;F.12 月31 日;G.1 月7 日;H.1 月14 日;I.1 月21 日;J.1 月26 日;K.2 月11 日;L.3 月18 日。
A.Nov.26;B.Dec.3;C.Dec.10;D.Dec.17;E.Dec.24;F.Dec.31;G.Jan.7;H.Jan.14;I.Jan.21;J.Jan.26;K.Feb.11;L.Mar.18.
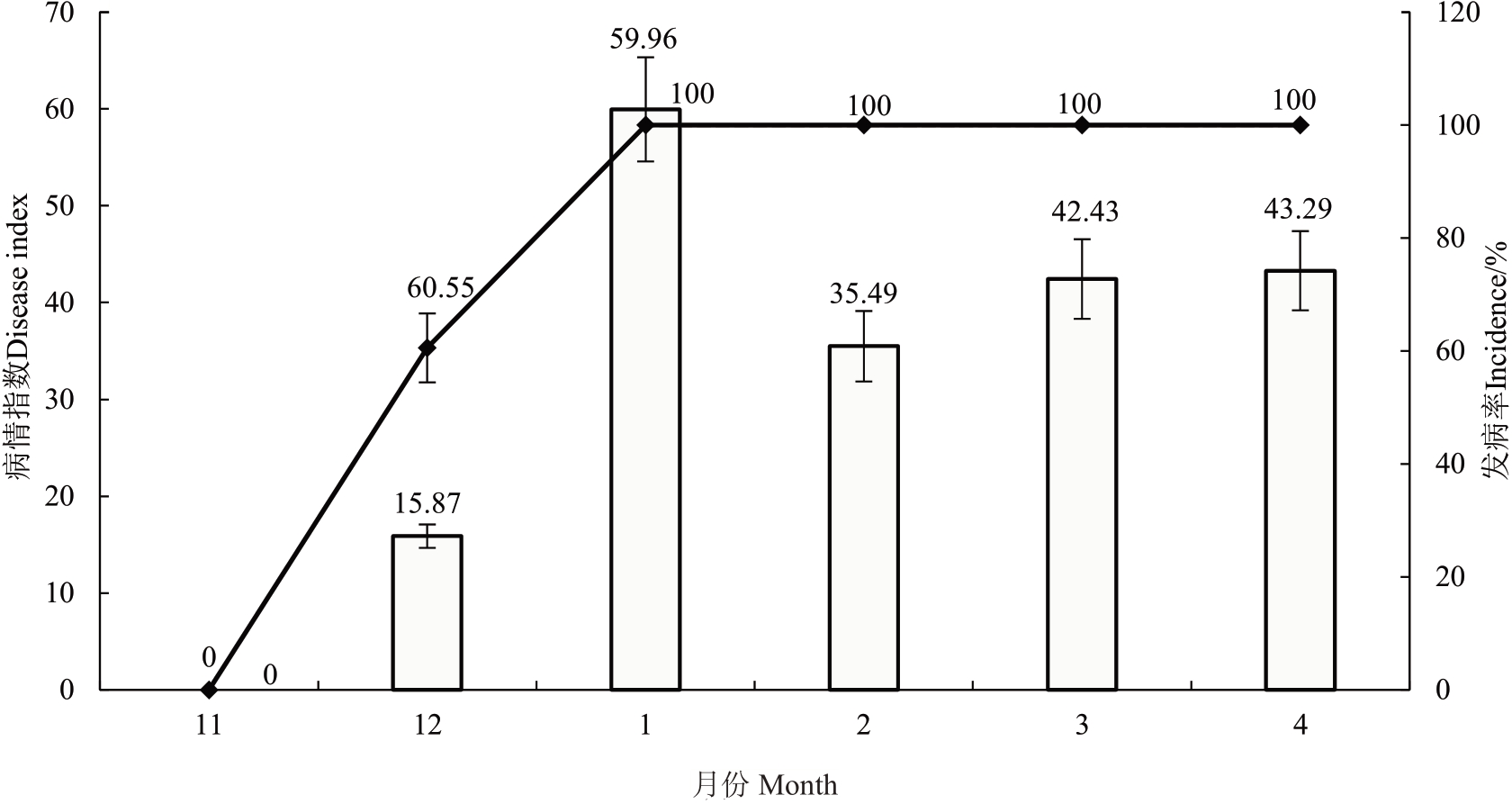
图5 轮斑病发病率和病情指数变化
Fig.5 Incidence and disease index of citrus target spot on Eureka lemon in Wanzhou,Chongqing
柱形图为2021 年11 月至2022 年4 月的尤力克柠檬轮斑病病情指数,折线为2021 年11 月至2022 年4 月的尤力克柠檬轮斑病发病率。
The column chart shows the disease index of ring spot on Eureka lemon from November 2021 to April 2022, and the dotted line is the incidence rate of ring spot on Eureka lemon from November 2021 to April 2022.
2.2.2 不同海拔果园发病特点 通过对重庆市万州区白羊镇对不同海拔的尤力克柠檬园轮斑病发生特点系统调查,结果显示:不同海拔区域该病发生流行时间差异较大。海拔750 m左右双石社区杨必秀果园12月初叶片表现症状,海拔410 m白燕村宇恒农业果园则在12月下旬发病,两个果园初始发病时间相差21 d。3月15日调查时不同海拔地区果园发病率均为100%,双石社区杨必秀果园病情指数为55.1,是白燕村宇恒农业果园的2.25倍(表3)。
表3 不同海拔果园柑橘轮斑病发病特点
Table 3 The incidence of citrus target spot at different altitudes

注:不同小写字母表示差异显著(p<0.05)。下同。
Note:Different lowercase letters indicated significant difference(p<0.05).The same below.
?
2.2.3 不同树龄果园发病特点 调查了重庆万州白羊镇和太龙镇病区,在相似海拔下,均由农民自主管理、树龄不同的果园发病情况。结果显示:在相似海拔区域和管理水平的果园,柑橘轮斑病开始发病时间均为12 月3 日,发病率均为100%,病情指数也无明显差异(表4)。
表4 不同树龄果园柑橘轮斑病发病率情况
Table 4 The incidence of citrus target spot at different ages

?
2.2.4 不同种植密度果园发病特点 调查重庆市万州区白羊镇长石村的果园发现:在相同海拔、相同树龄、均由农民自主管理的果园,因种植密度不同,果园开始发病时间也不同。在调查的3 个不同种植密度的果园中,株行距(2.0~2.5 m)×(2.5~3.5 m),果园郁闭,通风透光差,12 月16 日发病,比株行距(2.5~3.0 m)×(4.5~5.0 m)早7 d,两种种植密度的果园发病率和病情指数差异显著(p<0.05)(表5)。整体表现为种植密度越高,发病时间越早、发病率越高的趋势。
表5 不同种植密度果园柑橘轮斑病发病特点
Table 5 The incidence of citrus target spot with different planting densities

?
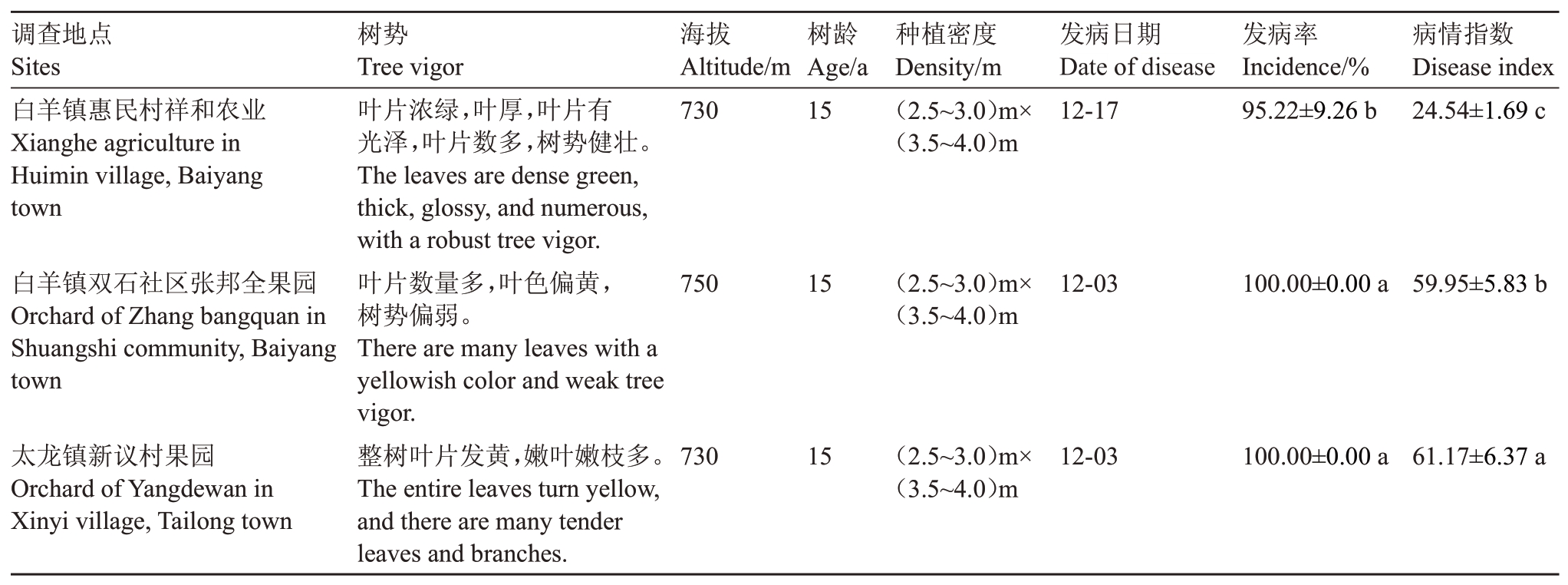
2.2.5 不同树势柑橘树发病特点 调查了重庆万州3 个海拔相近、树龄相同、种植密度相同,但是树势不同的果园轮斑病发病情况。结果表明,惠民村祥和农业基地坚持标准化管理,树势旺盛,叶色浓绿,营养充足,病虫害危害少,果实产量和品质较高,其发病时间为12 月17 日。而邻近的双石社区张邦全果园以及距离15 km 的新议村果园,比惠民村祥和农业基地发病早14 d,病情指数也达到惠民村祥和农业基地的2.4倍以上(表6)。
表6 不同树势下柑橘轮斑病发病特点
Table 6 The incidence of citrus target spot in different tree vigor
?
2.2.6 不同柑橘品种发病特点 选择重庆万州白羊镇惠民村农民果园(海拔为730 m、树龄15 a、株行距约为(2.5~3.0 m)×(3.5~4.0 m)的4个柑橘品种,分别为尤力克柠檬、北京柠檬、奉节脐橙(C. sinensis‘Fengjie’)和砂糖橘的发病情况。结果显示:尤力克柠檬和砂糖橘发病最早,其次是北京柠檬,奉节脐橙发病最晚、发病率最低为21%,而其余3个品种均达100%。各品种的病情指数由高到低为砂糖橘>尤力克柠檬>北京柠檬>奉节脐橙,且差异显著(p<0.05)(表7)。
表7 不同柑橘品种轮斑病发病率
Table 7 The incidence of citrus target spot of different varieties
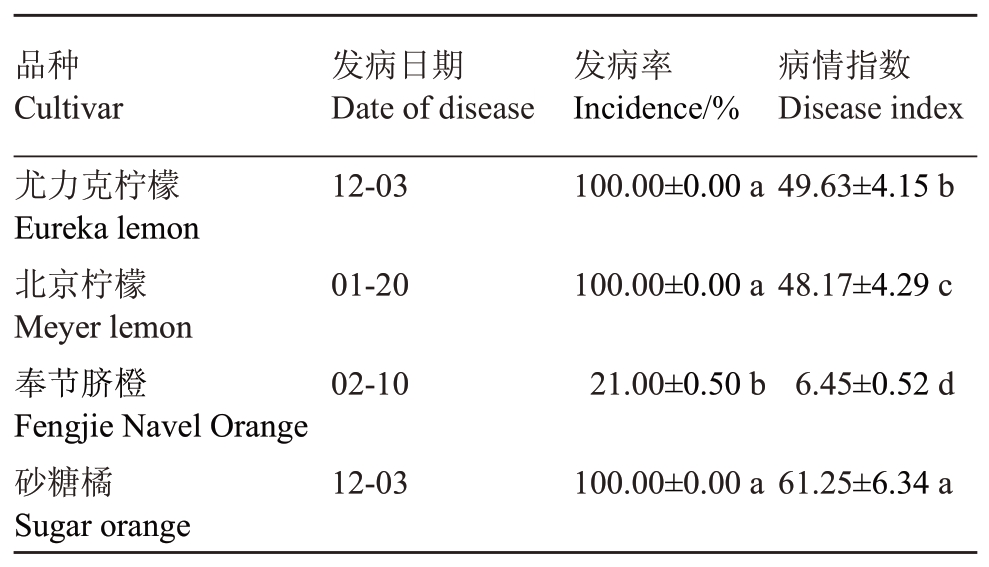
?
2.2.7 调查期间的气象因子及对发病的影响 调查统计了重庆市万州区白羊镇双石社区(海拔750 m)和白燕村(海拔400 m)2021年11月至2022年4月的天气情况。结果显示:双石社区调查期间温度范围为2.8~23.0 ℃,其中12 月至翌年2 月平均低温均小于5 ℃,且极端低温达0 ℃以下,而2月平均高温和平均低温均为调查的5 个月份中最低;调查期间雨日累积72 d,占总天数的39.78%,其中1月和2月雨日占其总天数的1/2 以上,且2 月的雨日在调查的5个月份中最多;平均空气湿度和平均降雨量由高到低均呈现4 月>3 月>11 月>1 月>2 月>12 月趋势;而白燕村平均高温、平均低温和极端低温均高于双石社区1~2 ℃,雨日数、空气湿度、降雨量3 个指标的值均与双石社区相似。
将双石社区气象因子数据与图5轮斑病发病调查数据一并作图6。通过分析发现:11月至翌年1月,温度持续降低,而病情指数快速升高,2—4 月,温度先降低后升高,病情指数也表现同样趋势;而12月至翌年4月,雨日、空气湿度和降雨量表现为先升高后降低再升高趋势,病情指数也表现同样趋势。
2.3 不同品种的抗性测定
通过菌丝离体接种法,将来自陕西城固、重庆万州和湖北宜昌的轮斑病菌株接种到47 个柑橘主栽品种的叶片上,测定其抗性。接种21 d后,接种部位表现明显的黑褐色病斑,边缘油渍状明显,不同的菌株对不同柑橘品种毒力表现不同。
2.3.1 橙类品种对柑橘轮斑病的抗性 结果表明(表8),陕西城固菌株CGDS2、重庆万州菌株WZSS1、湖北夷陵菌株YLSDP80 等3 株病菌接种13个橙类品种后的发病率存在差异。除了奉晚、津香橙、纽荷尔、伦晚和福本之外,CGDS2、YLSDP80对其余9 个品种的发病率均高于WZSS1 导致的发病率,并且13个品种的发病率均高于60%。CGDS2导致的血橙9 号、奉晚和98-1 长叶橙3 个品种发病率达到100%;YLSDP80 导致的津香橙发病率最低为68.75%,丽朵血橙、塔罗科血橙、渝北梨橙、94-1长叶橙、伦晚和纽荷尔共6个品种发病率达到100%;WZSS1导致血橙9号、丽朵血橙、奉晚、94-1长叶橙、津香橙、伦晚、福本、血橙8 号、纽荷尔、98-1 长叶橙等10个品种的发病率在50%及以上,纽荷尔发病率最高为100%;塔罗科血橙发病率最低为33.33%。
表8 接种21 d 后13 个橙类品种的发病情况及其抗性
Table 8 The incidence and resistance of C.sinensis varieties at 21 days after inoculation with different strains of P.citricarpar
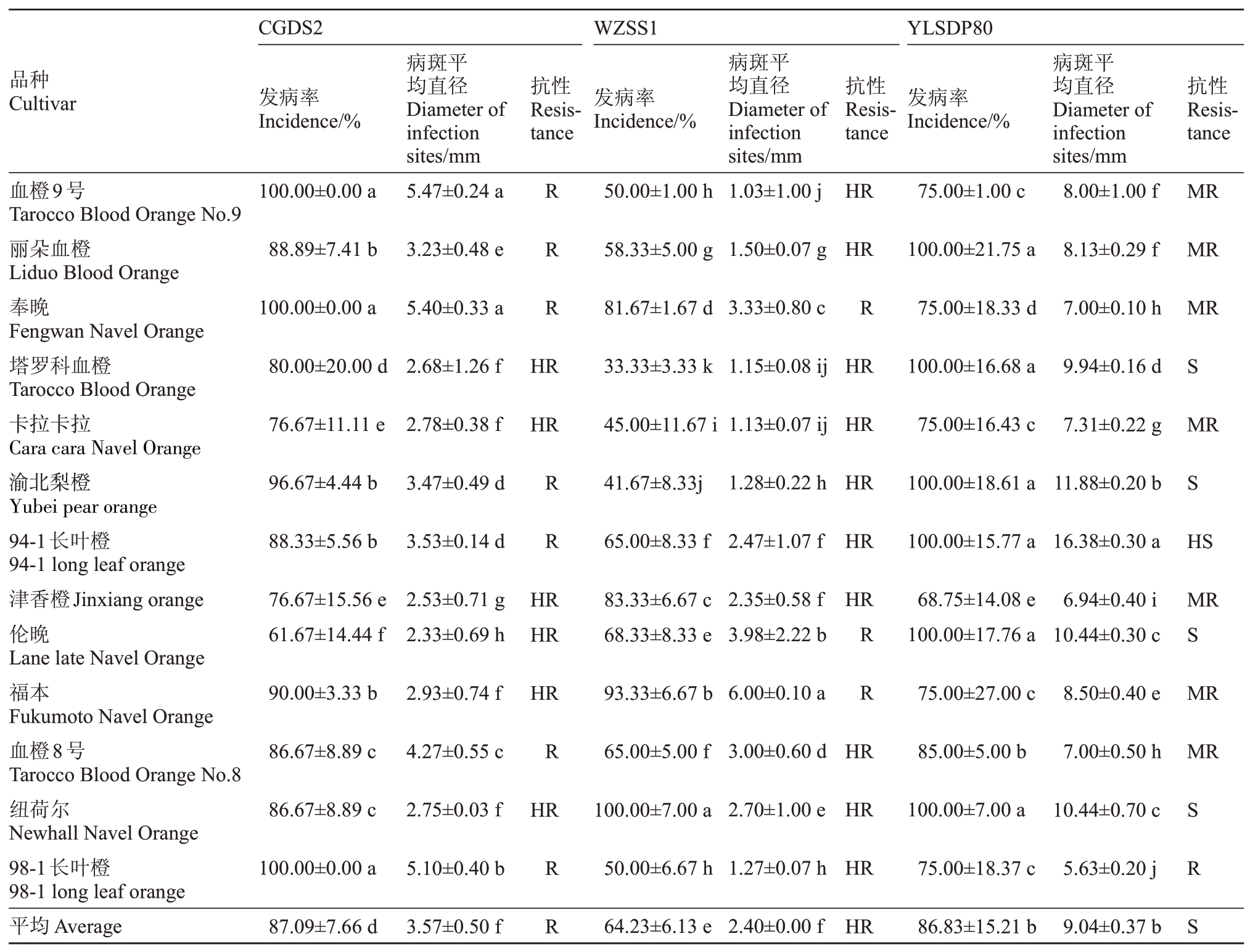
注:R.抗病;MR.中抗;HR.高抗;S.感病;HS.高感。下同。
Note:R.Resistant;MR.Moderately resistant;HR.High resistance;S.Susceptible;HS.High susceptible.The same below.
?
陕西城固菌株CGDS2、重庆万州菌株WZSS1、湖北夷陵菌株YLSDP80 等3 株病菌接种13 个橙类品种后的毒力也不同。除了98-1长叶橙、伦晚和福本之外,CGDS2、YLSDP80 对其余11 个品种的毒力均高于WZSS1 的毒力,CGDS2 接种13 个橙类品种造成的病斑平均直径均小于6.0 mm,发病率100%的血橙9 号、奉晚和98-1 长叶橙3 个品种的病斑大于5.1 mm,但仍低于6.0 mm,上述3个品种属于抗病品种,即该菌株毒力较弱;WZSS1接种13个橙类品种造成的病斑平均直径除福本为6.0 mm以外,其余均小于6.0 mm,毒力较弱。奉晚、伦晚、福本等3个品种表现抗病,其余10个品种对WZSS1表现高抗,发病率达100%的纽荷尔病斑平均直径仅为2.7 mm;YLSDP80接种13个橙类品种,对98-1长叶橙的毒力较弱,病斑平均直径小于6.0 mm,对塔罗科血橙、渝北梨橙、94-1长叶橙、伦晚、纽荷尔等5个品种的毒力较强,病斑平均直径均大于9.0 mm(表8)。
总体来看,陕西、重庆、湖北等三地来源的菌株侵染橙类产生的病斑平均直径不同,CGDS2和YLSDP80对橙类的传染性较强,平均发病率均达到85%以上;YLSDP80对橙类品种的毒力强,病斑平均直径达到9.04 mm,分别是接种CGDS2 和WZSS1 后的2.53倍和3.77倍。根据其病斑平均直径分析橙类品种抗性表现,发现在供试的13 个橙类品种中,对CGDS2、WZSS1 和YLSDP80 菌株高抗的品种分别占比46.15%、76.92%和0.00%,高感及感病品种分别占比0.00%、0.00%和38.46%,没有免疫品种(表8)。
2.3.2 柚类品种对柑橘轮斑病的抗性 结果表明(表9),陕西城固菌株CGDS2、重庆万州菌株WZSS1、湖北夷陵菌株YLSDP80等3株病菌接种14个柚类品种后的发病率也存在差异。WZSS1、YLSDP80接种葡萄柚、梁平柚、琯溪蜜柚和龙都早香柚4个品种导致的发病率均高于CGDS2 导致的发病率。CGDS2导致的泰国红柚、强德勒红心柚发病率均高于接种其他2 个菌株的发病率,琯溪蜜柚发病率为13.33%,在14个品种中最低,而三红柚、垫江白柚、泰国白柚、垫江老红柚、红肉优系5 个品种发病率达到100%;YLSDP80导致的黄金柚和红肉优系2个品种发病率为0,垫江晚柚、泰国白柚、垫江老红柚、沙田柚和龙都早香柚共5 个品种发病率均达到100%;WZSS1导致三红柚、黄金柚、垫江白柚、泰国白柚、垫江老红柚和红肉优系6 个品种发病率达到100%,沙田柚发病率最低为5.0%,除龙都早香柚、强德勒红心柚外,其余品种发病率均达到60.0%以上。
表9 接种21 d 后14 个柚类品种的发病情况及其抗性
Table 9 The incidence and resistance of 14 C.grandis varieties at 21 days after inoculation with different strains of P.citricarpar
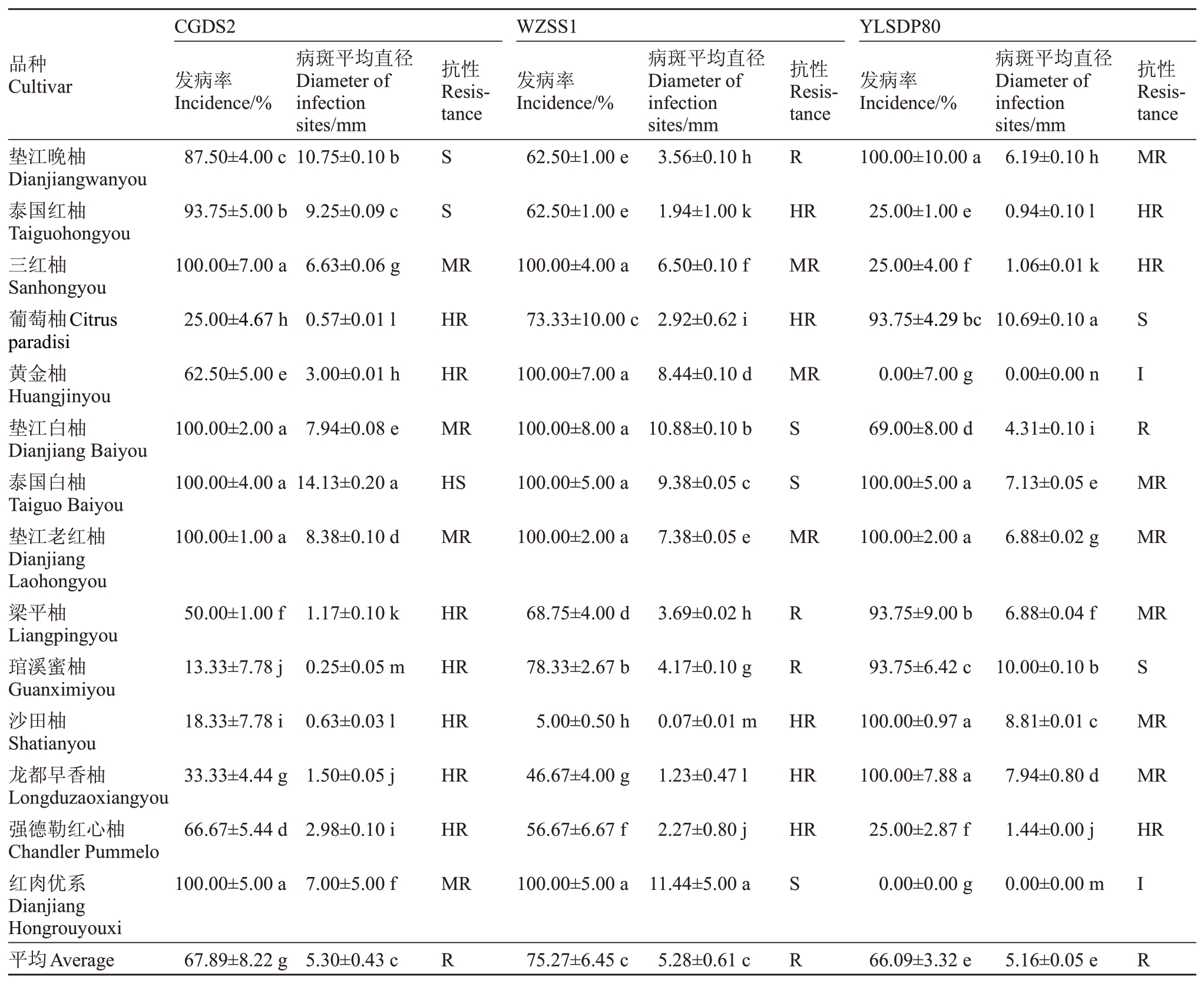
注:I.免疫。Note:I.Immunity.
?
陕西城固菌株CGDS2、重庆万州菌株WZSS1、湖北夷陵菌株YLSDP80 等3 株病菌接种14 个柚类品种后的毒力表现也不尽一致。接种3 株病菌后,CGDS2、WZSS1 导致泰国红柚、三红柚、黄金柚、垫江白柚、泰国白柚、垫江老红柚、强德勒红心柚和红肉优系共8 个品种毒力均高于YLSDP80 的毒力。CGDS2 接种14 个柚类品种造成的病斑平均直径为0.25~14.13 mm,其中发病率100%的三红柚、垫江白柚、泰国白柚、垫江老红柚、红肉优系5 个品种的病斑平均直径均在6.0~9.0 mm,属于中抗品种,泰国白柚、泰国红柚发病率也为100%,病斑平均直径最大,为14.13 mm,属于高感品种,垫江晚柚和泰国红柚属于感病品种,即该菌株毒力强;WZSS1 接种垫江白柚、泰国白柚、红肉优系发病率均达到100%,病斑平均直径均大于9.0 mm,毒力较强,上述3个品种属于感病品种,WZSS1 接种泰国红柚、葡萄柚、沙田柚、龙都早香柚、强德勒红心柚等5个品种造成病斑均在3.0 mm 以下,上述5 个品种属于高抗品种;YLSDP80 接种14 个柚类品种,其中,黄金柚和红肉优系2个品种发病率和病斑平均直径均为0,菌株毒力弱,表现免疫,葡萄柚和琯溪蜜柚病斑平均直径均达10.0 mm及以上,菌株毒力强,属于感病品种。而泰国红柚、三红柚、强德勒红心柚共3个品种病斑平均直径在3.0 mm 以下,菌株毒力弱,属于高抗品种(表9)。
总体来说,不同地区菌株接种至14个柚类品种后,WZSS1 导致的平均发病率(75.27%)和CGDS2导致的病斑平均直径(5.30 mm)为最高,部分品种病斑平均直径最高达14.13 mm。通过抗病性分析,结果显示供试的14 个柚类品种中,对CGDS2、WZSS1 和YLSDP80 高抗的品种分别占比达50.00%、35.71%和21.43%,而感病及高感品种仅分别占比21.43%、21.43%和14.29%,黄金柚、红肉优系2 个品种对YLSDP80 表现免疫。综合以上情况,3株病原菌接种后,三红柚、黄金柚、垫江老红柚、梁平柚、沙田柚、龙都早香柚、强德勒红心柚共7 个品种属于中抗及以上品种(表9)。
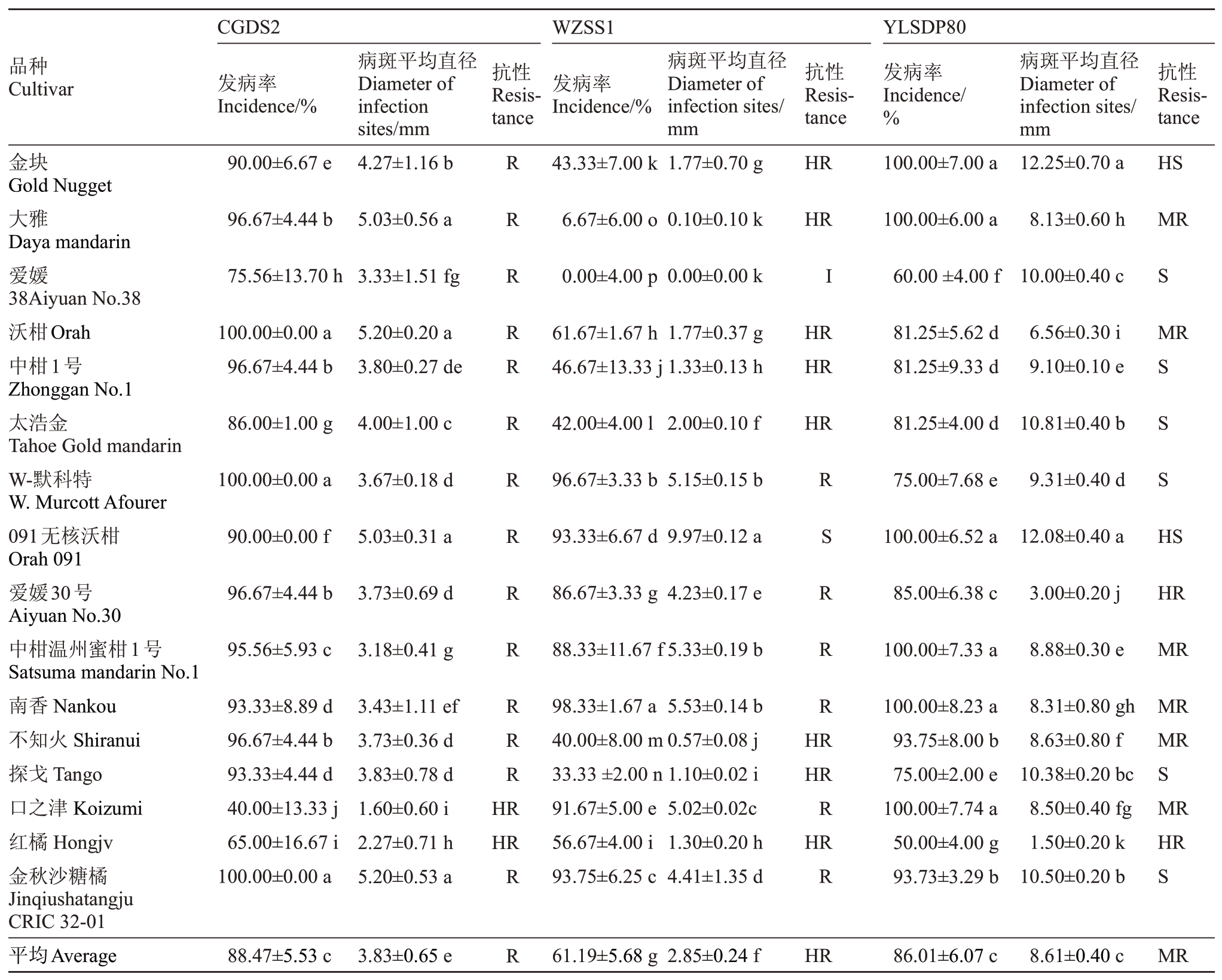
2.3.3 柑类品种对柑橘轮斑病的抗性 结果表明(表10),陕西城固菌株CGDS2、重庆万州菌株WZSS1、湖北夷陵菌株YLSDP80 等3 株病菌接种16 个柑类品种后的发病率存在差异。W-默科特、爱媛30号、红橘和金秋砂糖橘4个品种发病率均表现为CGDS2>WZSS1>YLSDP80。南香、口之津和091 无核沃柑发病率表现为YLSDP80>CGDS2>WZSS1,其余9个品种表现为CGDS2、YLSDP80导致的发病率均高于WZSS1导致的发病率。CGDS2导致的16个品种的发病率除口之津、红橘小于或等于65.0%外,其余14个品种发病率均高于75.0%,沃柑、W-默科特和金秋砂糖橘发病率达到100%;YLSDP80导致的金块、大雅、091 无核沃柑、中柑温州蜜柑1 号、南香、口之津共6个品种的发病率均为100%,红橘发病率最低也达到50.0%;WZSS1 导致爱媛发病率最低为0%,其次是大雅为6.67%,南香发病率最高为98.33%。
表10 接种21 d 后16 个柑类品种的发病情况及其抗性
Table 10 The incidence and resistance of 16 C.reticulata varieties at 21 days after inoculation with different strains of P.citricarpar
?
陕西城固CGDS2、重庆万州菌株WZSS1、湖北夷陵菌株YLSDP80 等3 株病菌接种16 个柑类品种后的毒力也存在差异。除了W-默科特、091 无核沃柑、爱媛30 号、中柑温州蜜柑1 号、南香和口之津6个品种外,CGDS2、YLSDP80对其余10个品种的毒力均高于WZSS1的毒力。CGDS2接种16个柑类品种造成的病斑平均直径均小于6.0 mm,口之津最低为1.6 mm,沃柑和金秋砂糖橘最高均为5.2 mm,上述16个品种属于抗病及以上品种,即该菌株毒力较弱;WZSS1 接种16 个柑类品种造成的病斑平均直径除091 无核沃柑为9.97 mm 以外,其余均小于等于6.0 mm,爱媛的发病率和病斑平均直径均为0,即该菌株毒力弱。除091 无核沃柑外,其余15 个品种属于抗病及以上品种,其中爱媛38 为免疫品种;YLSDP80接种16个柑类品种,对爱媛30号的毒力较弱,病斑小于6.0 mm,而对金块、爱媛38、中柑1号、太浩金、W-默科特、091无核沃柑、探戈和金秋砂糖橘等8 个品种的毒力较强,病斑平均直径均在9.0 mm及以上,上述8个品种除金块和091无核沃柑属于高感品种外,其余6个品种属于感病品种(表10)。
总体来看,柑橘轮斑病菌株侵染柑类产生的病斑平均直径差异显著(p<0.05),CGDS2 和YLSDP80 对柑类的传染性较强,平均发病率均达到86.0%以上。YLSDP80 对柑类品种的毒力最强,病斑平均直径达到8.61 mm,分别是接种CGDS2 和WZSS1 后的2.25 倍和3.02 倍。根据其病斑平均直径分析柑类品种的抗性表现,发现供试的16个柑类品种中,对CGDS2、WZSS1和YLSDP80菌株高抗的品种分别占比12.50%、50.0%和12.50%,感及高感品种分别占比0.00%、6.25%和50.00%(表10)。
2.3.4 金钱橘、柠檬和枳壳对柑橘轮斑病的抗性 结果表明(表11),陕西城固CGDS2、重庆万州菌株WZSS1、湖北夷陵菌株YLSDP80等3株病菌接种金钱橘、尤力克柠檬、北京柠檬和枳壳后的发病率不同。表现为CGDS2、WZSS1均导致尤力克发病率达到100%,且对尤力克柠檬、北京柠檬和枳壳的发病率均高于YLSDP80导致的发病率。CGDS2导致的4个品种发病率均高于75.0%;YLSDP80导致金钱橘发病率最高为93.75%,枳壳发病率最低为40.0%,4个品种间发病率和病斑平均直径差异显著(p<0.05)。CGDS2和WZSS1对尤力克柠檬毒力强,即尤力克柠檬属高感品种。YLSDP80导致金钱橘病斑平均直径最大为10.69 mm,该菌株毒力强,金钱橘为感病品种。
表11 接种21 d 后金钱橘、柠檬和枳壳的发病情况及其抗性
Table 11 The incidence and resistance of Clementines,Limon and Trifoliate at 21 days after inoculation with different strains of Ps.citricarpar
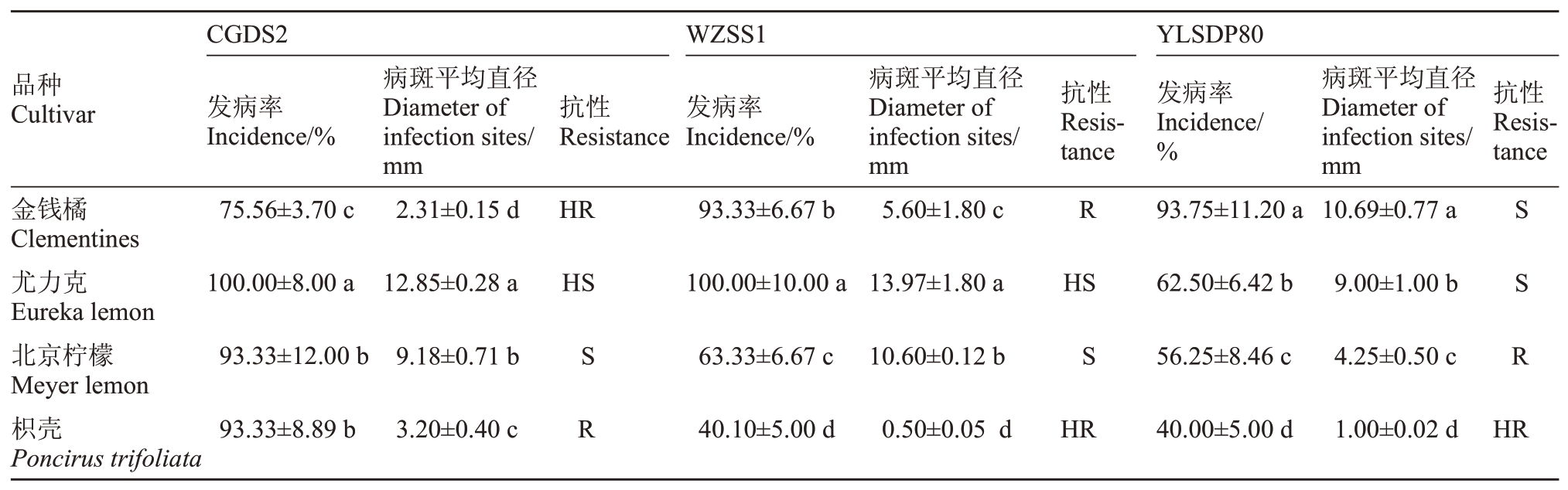
?
综上,供试柑橘种类中,平均发病率由高到低表现为:金钱橘>尤力克柠檬>橙类>柑类>北京柠檬>柚类>枳壳,病斑平均直径由高到低表现为:尤力克柠檬>北京柠檬>金钱橘>柚类>柑类>橙类>枳壳。血橙9号、丽朵血橙、奉晚、卡拉卡拉、津香橙、福本、血橙8号、98-1长叶橙、三红柚、黄金柚、垫江老红柚、梁平柚、沙田柚、龙都早香柚、强德勒红心柚、大雅、沃柑、爱媛30号、中柑温州蜜柑1号、南香、不知火、口之津、红橘以及枳壳共24 个品种总体表现为抗病(表8~表11),尤力克对3 个省份菌株同时表现感病,其余22个品种对三个省份的菌株抗性表现不一,差异较大,甚至同一个品种对不同菌株表现高抗和高感,如94-1 长叶橙和金块。因此,同一柑橘品种对不同地区菌株的抗性差异明显,同一菌株对不同柑橘品种毒力也有差异。
3 讨 论
3.1 柑橘轮斑病的田间症状
田间调查发现,柑橘轮斑病病斑外缘油渍状,向内为棕褐色、深褐色,中央灰白色,可产生“轮纹状”排列的黑色子实体,后期可穿孔,病斑可沿叶脉产生拖尾,不同生育期叶片症状有差异。枝条病斑大多椭圆或梭形,产生或不产生黑色子实体。果实上病斑大多为圆形,凹陷明显,果实发病后期会引发炭疽病危害造成果实腐烂。而朱丽[5]报道柑橘轮斑病不侵染果实,侵染叶片、枝条时,病斑的形状和颜色与笔者在本研究中的调查结果也有差异,这可能与柑橘品种不同及柠檬果实冬季挂树越冬导致果实发病等有关。
柑橘轮斑病与黑斑病、炭疽病和溃疡病症状类似,然而在田间诊断中,黑斑病主要侵染果实,病斑凹陷,病斑上黑色子实体少,病斑直径普遍在0.2~0.3 cm,没有明显的“轮纹状”,发病高峰期在4—5月,并且会导致流胶[21-22];炭疽病主要在春梢期和采果前危害叶片、枝条与果实,侵染叶片时多在叶尖或叶缘部位,病斑半圆形、近圆形或“V”字形,病部会散生或轮纹状排列黑色小粒点,没有油渍状外缘,潮湿时子实体橘黄色[23-24];侵染果实时多表现果腰干疤病斑,病斑少。而轮斑病则在果实任何部位均可发生,且病斑数量多,多个病斑可愈合成一个大病斑。侵染枝梢时多表现春梢嫩梢枯死,呈深褐色或黑色,潮湿时表面橘红色黏质物[25]。枝梢感染轮斑病在2—3月显症,其余时间症状不明显。溃疡病发病高峰期为春秋季,被感染的柑橘叶片、枝条和果实木栓化并开裂呈火山口状[26],潮湿时病部会产生黄色菌脓。而轮斑病是真菌性病害,病斑没有火山口开裂,且没有菌脓。
3.2 柑橘轮斑病发病规律
柑橘轮斑病最早可在12月3日发病,发病高峰期在1—2月,不同情况果园发病时间和严重程度有差异。调查数据显示,不同海拔、种植密度、树势、柑橘品种、气象因子等均会影响发病,树龄与发病没有明显的关系。海拔750 m处,尤力克柠檬12月初叶片发病,海拔410 m处12月下旬发病。因此,海拔750 m处11月中旬、410 m处11月下旬喷施广谱性保护剂预防病害发生,能够产生更好的防控效果;果园郁闭、通风透光差、叶片发黄、嫩叶嫩枝多、树势衰弱的柑橘树,易受病菌侵染;在调查的4个柑橘品种中,奉节脐橙发病相对最晚,其次北京柠檬,尤力克柠檬和砂糖橘最早发病,发病率和病情指数均最高。说明奉节脐橙抗性更强,北京柠檬虽然发病较晚,但仍然会在低温来临后严重发病,但落叶较少;尽管本研究及前期研究未采用奉节脐橙、砂糖橘评估对轮斑病菌的抗性,但根据田间调查结果,重庆应避免发病率、病情指数高的砂糖橘连片种植,奉节脐橙可以与对轮斑病抗性弱的柑橘品种进行间作延缓轮斑病的传染速度。
通过分析双石社区调查点与气候因子的关系,发现11 月至翌年1 月,平均高温、平均低温和极端低温持续降低,而病情指数快速升高,2—4月,以上3 个气象因子先降低后升高,病情指数也表现同样趋势。以上结果说明在发病前至发病盛期,平均高温、平均低温和极端低温影响尤力克柠檬轮斑病病情指数,温度越低,发病越严重;而进入发病中后期,温度越高,发病加重。12 月至翌年4 月,雨日、空气湿度和降雨量表现为先升高后降低再升高趋势,病情指数也表现同样趋势,说明以上3 个湿度相关气象因子影响轮斑病病情指数,湿度越高,发病越重。但是,6个气象因子之间是否有交互作用,及对轮斑病影响的主效因子为何还有待进一步研究。
综上,应该在冬季低温来临前,及时平衡施肥,秋季补充钾肥提高抗病性[27],并在冬季降温前喷施果实促控剂提高柑橘类抗寒性,合理种植密度和修剪,保证果园通风透光,选择抗性较强品种,避免感病品种集中种植,从而降低病害发生率。
3.3 柑橘轮斑病抗性测定
陈泉等[15]选用2019 年分离自重庆万州白羊镇的轮斑病菌Pc-WZBY1,探索了柑橘对轮斑病菌抗性评价的接种方法、适宜温度、接种部位,继而以27个柑橘品种测试了抗性评价方法的适用性,并初步评估了27 个品种对轮斑病菌Pc-WZBY1 的抗性。结果显示,柚类抗病力最强,杂柑类相对最感病,而橙类、柑类与橘类抗性处于柚类与杂柑类中间。笔者在本研究中不仅增加了陕西、湖北的轮斑病菌菌株,还增加了20 个柑橘品种,采用2022 年分离自陕西城固CGDS2、重庆万州WZSS1 和湖北夷陵YLSDP80共3省份的菌株进行离体接种。研究发现,柑橘轮斑病菌不同菌株毒力不一致,即便是同样分离自重庆万州白羊镇尤力克柠檬的Pc-WZBY1 与WZSS1,对津香橙、中柑温州蜜柑1号、091无核沃柑的毒力也存在显著差异[15],即不仅不同地理、不同品种寄主来源的菌株对相同品种柑橘的毒力存在差异,而且相同地理、相同寄主品种来源的不同菌株对同一品种毒力也存在差异,前者可能与柑橘品种的抗性有关,后者可能与菌株遗传分化有关。因此,研究柑橘轮斑病菌的毒力差异,不仅要采用不同省份、不同寄主品种来源的菌株,而且地理来源要细化到不同的乡镇甚至村庄;评价不同柑橘品种的抗病性,也要采用不同地理来源、不同寄主品种来源的多个菌株,采用单一省份单一寄主来源的菌株评价不同品种抗病性的结果或许不能真实地反映柑橘品种的抗病性。尤力克柠檬对3 个菌株表现感病甚至高感,而田间调查也表明重庆万州近0.67 万hm2尤力克柠檬发病,局部造成毁灭性灾害,因此,尤力克柠檬不能集中连片种植,应逐步考虑选择高抗或免疫的品种,如黄金柚、沙田柚、龙都早香柚、强德勒红心柚等柚类品种和血橙9 号、丽朵血橙、奉晚、卡拉卡拉、津香橙、福本、血橙8 号、98-1 长叶橙等橙类品种,大雅、沃柑、中柑1号、爱媛30号、中柑温州蜜柑1号、不知火、口之津等柑类及红橘,进行间作,切断病菌的传播途径。对重庆菌株表现感病、高感的091无核沃柑、红肉优系、泰国白柚、垫江白柚、尤力克柠檬、北京柠檬等品种也不能集中连片种植;对陕西城固或湖北夷陵菌株表现感病、高感的塔罗科血橙、渝北梨橙、94-1长叶橙、伦晚、纽荷尔、垫江晚柚、泰国红柚、泰国白柚、琯溪蜜柚、金块、爱媛、中柑1号、太浩金、W-默科特、091无核沃柑、探戈、金钱橘、金秋砂糖橘、尤力克柠檬、北京柠檬在从陕西或湖北引进穗条或苗木时需要加强检疫,避免柑橘轮斑病菌流入重庆。此外,枳壳作为柑橘的主要砧木,在试验中也表现出接种CGDS2后较高的发病率,在砧木选择时应加强检疫,避免采用病苗作砧木嫁接。
陕西城固温州蜜柑与金橘、湖北宜昌温州蜜柑、湖南吉首椪柑及重庆万州的尤力克柠檬、北京柠檬、椪柑和纽荷尔脐橙等4省市7个柑橘品种[4,10-11]已被报道发生轮斑病。鉴于津香橙、091 无核沃柑对重庆万州白羊镇尤力克柠檬菌株的抗性差异显著[15],笔者在本研究中采用湖北宜昌与陕西城固温州蜜柑、重庆万州北京柠檬等3省市2种柑橘的分离菌株进行47个品种的抗性评价,或许不能全面评价品种的抗性,将来应进一步分离不同地区、不同品种柑橘的轮斑病分离菌株评价重庆柑橘的轮斑病抗性,并采用宏基因组学分析轮斑病菌的致病基因及其不同来源菌株致病力分化的机制。
4 结 论
柑橘轮斑病病斑由内向外为灰白色、棕褐色和深褐色,产生“轮纹状”排列的黑色子实体,外缘油渍状,不同生育期叶片病斑有差异;1—2 月为发病高峰,高海拔区、果园郁闭、树势弱、感病品种连片种植等发病早,发病严重;11月至翌年1月,平均高温、平均低温和极端低温越低,发病越重,而2—4月,以上3个气候因子值越高,发病加重;12月至翌年4月,雨日天数、空气湿度和降雨量值越大,发病越重;24个品种对3个菌株表现抗病,尤力克柠檬表现感病,其余22个品种抗性表现不一。
[1] WU G A,TEROL J,IBANEZ V,LÓPEZ-GARCÍA A,PÉREZROMÁN E,BORREDÁ C,DOMINGO C,TADEO F R,CARBONELL-CABALLERO J,ALONSO R,CURK F,DU D L,OLLITRAULT P,ROOSE M L,DOPAZO J,GMITTER F G,ROKHSAR D S,TALON M.Genomics of the origin and evolution of Citrus[J].Nature,2018,554(7692):311-316.
[2] 李蔚青.近年世界柑橘贸易结构及中国柑橘出口形势展望[J].农业展望,2011,7(6):51-54.LI Weiqing. The structure of world citrus trade in recent years and the prospect of Chinese citrus export situation[J].Agricultural Outlook,2011,7(6):51-54.
[3] 朱丽,丁德宽,李红叶.陕西城固柑桔叶片圆斑病病原研究[C]//中国菌物学会2011 年学术年会论文摘要集. 广州:中山大学,2011:66-67.ZHU Li,DING Dekuan,LI Hongye.A leaf spot disease of citrus caused by a new species in Cryptosporiopsis[C]//2022 Annual Meeting of Mycological Society of China. Guangzhou:Zhongshan University,2011:66-67.
[4] ZHU L,WANG X H,HUANG F,ZHANG J Z,LI H Y,DING D K,HYDE K D.A destructive new disease of Citrus in China caused by Cryptosporiopsis citricarpa sp.nov.[J].Plant Disease,2012,96(6):804-812.
[5] 朱丽.五种柑橘真菌性病害病原鉴定[D].杭州:浙江大学,2012.ZHU Li. Identification of five fungal pathogens causing Citrus diseases in China[D].Hangzhou:Zhejiang University,2012.
[6] CHEN C,VERKLEY G J M,SUN G Y,GROENEWALD J Z,CROUS P W. Redefining common endophytes and plant pathogens in Neofabraea,Pezicula,and related Genera[J]. Fungal Biology,2016,120(11):1291-1322.
[7] 刘亚红,田伟,魏高艳.柑橘轮斑病的发生特点与防治措施[J].果农之友,2015(5):36.LIU Yahong,TIAN Wei,WEI Gaoyan. Occurrence characteristics and control measures of citrus ring spot disease[J]. Fruit Growers’Friend,2015(5):36.
[8] 罗磊,张波,章彦宏,黄永玲.危害陕南柑桔的新病害:柑桔轮斑病[J].中国果业信息,2015,32(7):55-56.LUO Lei,ZHANG Bo,ZHANG Yanhong,HUANG Yongling.A new disease of Citrus in southern Shaanxi-Citrus ring spot[J].China Fruit News,2015,32(7):55-56.
[9] 敖义俊,丁德宽,邓家锐,余小丽,罗磊.柑桔轮斑病发生规律及防控对策[J].中国果业信息,2021,38(7):64-66.AO Yijun,DING Dekuan,DENG Jiarui,YU Xiaoli,LUO Lei.Occurrence regularity and control countermeasures of citrus ring spot disease[J].China Fruit News,2021,38(7):64-66.
[10] XIAO X E,ZENG Y T,WANG W,CHENG L,QIAO X H,HOU X,LI H Y. First report and new hosts of Pseudofabraea citricarpa causing Citrus target spot in China[J]. Plant Health Progress,2021,22(1):26-30.
[11] 占爽,吴望,胡军华,吴玉珠,乔兴华,陈力,程兰,周彦.重庆万州疑似柑桔轮斑病的病原鉴定及防治药剂筛选[J].中国南方果树,2021,50(1):1-7.ZHAN Shuang,WU Wang,HU Junhua,WU Yuzhu,QIAO Xinghua,CHEN Li,CHENG Lan,ZHOU Yan.Identification and fungicides screening for Pseudofabraea citricarpa like pathogen caused Citrus target spot disease in Wanzhou,Chongqing[J].South China Fruits,2021,50(1):1-7.
[12] 徐永红,陈力,唐松,丁德宽,杨宇衡.柑橘轮斑病的适生区预测及风险分析[J].中国农业科学,2020,53(21):4430-4439.XU Yonghong,CHEN Li,TANG Song,DING Dekuan,YANG Yuheng. Prediction of suitable area and risk analysis for Citrus target spot[J]. Scientia Agricultura Sinica,2020,53(21):4430-4439.
[13] YANG Y H,HU J H,CHEN F J,DING D K,ZHOU C Y.Development of a SCAR marker-based diagnostic method for the detection of the Citrus target spot pathogen Pseudofabraea citricarpa[J].BioMed Research International,2018,2018:7128903.
[14] YANG Y H,FANG A F,YU Y,BI C W,ZHOU C Y. Integrated transcriptomic and secretomic approaches reveal critical pathogenicity factors in Pseudofabraea citricarpa inciting citrus target spot[J].Microbial Biotechnology,2019,12(6):1260-1273.
[15] 陈泉,徐永红,何锦辉,杨宇衡.柑橘轮斑病抗性鉴定方法的建立[J].果树学报,2022,39(2):295-301.CHEN Quan,XU Yonghong,HE Jinhui,YANG Yuheng. Establishment of an identification method of citrus resistance to target spot[J].Journal of Fruit Science,2022,39(2):295-301.
[16] 于东洋,晏立英,宋万朵,康彦平,雷永,陈玉宁,淮东欣,王欣,王志慧,罗怀勇,周小静,黄莉,刘念,陈伟刚,姜慧芳,廖伯寿.花生白绢病病原菌致病力分化的研究进展[J].中国油料作物学报,2022,44(5):930-936.YU Dongyang,YAN Liying,SONG Wanduo,KANG Yanping,LEI Yong,CHEN Yuning,HUAI Dongxin,WANG Xin,WANG Zhihui,LUO Huaiyong,ZHOU Xiaojing,HUANG Li,LIU Nian,CHEN Weigang,JIANG Huifang,LIAO Boshou. Progress on pathogenicity differentiation in Sclerotium rolfsii isolates from peanut[J]. Chinese Journal of Oil Crop Sciences,2022,44(5):930-936.
[17] 陆英,贺春萍,吴伟怀,梁艳琼,郑金龙,黄兴,习金根,谭施北,易克贤. 我国咖啡炭疽病菌致病力分化[J]. 西南农业学报,2021,34(5):1008-1014.LU Ying,HE Chunping,WU Weihuai,LIANG Yanqiong,ZHENG Jinlong,HUANG Xing,XI Jingen,TAN Shibei,YI Kexian. Pathogenicity differentiation of coffee anthracnose in China[J]. Southwest China Journal of Agricultural Sciences,2021,34(5):1008-1014.
[18] 杜蕙,王春明,吕和平,郭建国,漆永红,蒋晶晶.不同来源葡萄霜霉菌致病力差异研究[J].中国果树,2019(1):42-46.DU Hui,WANG Chunming,LÜ Heping,GUO Jianguo,QI Yonghong,JIANG Jingjing. Study on difference of pathogenicity of Plasmopara viticola from different sources[J]. China Fruits,2019(1):42-46.
[19] 任春梅,杨柳,缪倩,陆芳,顾雪,程兆榜.江苏省玉米小斑病菌的分离鉴定及致病力分析[J]. 南方农业学报,2020,51(10):2454-2460.REN Chunmei,YANG Liu,MIAO Qian,LU Fang,GU Xue,CHENG Zhaobang. Isolation identification and pathogenicity analysis of Bipolaris maydis in Jiangsu[J]. Journal of Southern Agriculture,2020,51(10):2454-2460.
[20] 李文杨,郑春耀,李超萍,蔡志英,林春花,黄贵修.中国橡胶树主栽品系和部分种质对尖孢炭疽病的室内抗性评价[J].热带农业工程,2009,33(5):31-36.LI Wenyang,ZHENG Chunyao,LI Chaoping,CAI Zhiying,LIN Chunhua,HUANG Guixiu. Resistance identification of main rubber cultivars and some rubber germplasm in China to Colletotrichum acutatum in laboratory[J]. Tropical Agricultural Engineering,2009,33(5):31-36.
[21] 罗金水,林晓兰,赖跃先,曾保忠,李红叶.琯溪蜜柚黑斑病侵染循环及防治适期研究[J].植物保护,2020,46(1):219-222.LUO Jinshui,LIN Xiaolan,LAI Yuexian,ZENG Baozhong,LI Hongye. Infection cycle of pomelo black spot and suitable period for its control[J].Plant Protection,2020,46(1):219-222.
[22] 张晓彬,王宏毅,卢友民,黄智辉,严进,张绍升.蜜柚黑斑病症状及病原鉴定[J].福建农林大学学报(自然科学版),2014,43(3):245-250.ZHANG Xiaobin,WANG Hongyi,LU Youmin,HUANG Zhihui,YAN Jin,ZHANG Shaosheng. Pathogen identification and symptoms of honey pomelo black spot[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition),2014,43(3):245-250.
[23] 陈泉,黄仁军,冯小华,羊练,何锦辉.塔罗科血橙新系炭疽病发生情况调查及防治药剂筛选[J].南方农业,2021,15(13):34-38.CHEN Quan,HUANG Renjun,FENG Xiaohua,YANG Lian,HE Jinhui. Investigation on the occurrence of anthracnose in Taroko new blood orange line and screening of control agents[J]. South China Agriculture,2021,15(13):34-38.
[24] 刘欢欢.四川省柑橘炭疽病病原鉴定和遗传多样性分析[D].雅安:四川农业大学,2020.LIU Huanhuan. Colletotrichum species and genetic diversity of cultivated Citrus in Sichuan Province[D].Yaan:Sichuan Agricultural University,2020.
[25] 陈国庆.中国柑橘炭疽病病原种类及种群遗传多样性研究[D].杭州:浙江大学,2010.CHEN Guoqing. Species of Citrus anthracnose pathogens and the population genetic diversity of dominant species Colletotrichum gloeosporioides in China[D]. Hangzhou:Zhejiang University,2010.
[26] 彭耀武.中国柑橘溃疡病病原菌多态性研究[D].重庆:西南大学,2014.PENG Yaowu.Genetic polymorphism differentiation from‘Xanthomonas axonopodis pv. citri’in China[D]. Chongqing:Southwest University,2014.
[27] PENG H X,WEI X Y,XIAO Y X,SUN Y,BIGGS A R,GLEASON M L,SHANG S P,ZHU M Q,GUO Y Z,SUN G Y.Management of Valsa canker on apple with adjustments to potassium nutrition[J].Plant Disease,2016,100(5):884-889.