枇杷[Eriobotrya japonica (Thunb.) Lindl.]是我国南方主要果树之一,原产于中国,有着两千多年的栽培历史[1]。枇杷在我国有着广泛的栽培,北起陕西中部,南至海南岛,东至台湾,西至西藏东部都有枇杷栽培,其中,四川、福建、浙江等省份的栽培规模较大[2]。与苹果、香蕉、柑橘等主要水果相比,虽然枇杷目前的市场规模较小,但栽培的经济价值很高。截至2018年,我国枇杷生产规模占世界枇杷的80%以上[3]。
枇杷属植物的花序为顶生圆锥状混合花序,花序性状如花序长度、花序宽度、花瓣颜色等是重要的表型性状,也是区分枇杷种质资源的主要性状[4]。在枇杷栽培生产中,花序的大小以及疏密程度是生产人员非常关注的农艺性状,花序过大或者过小、过疏散或者过紧密都不利于疏花疏果以及套袋工作的开展。选育出花序大小以及紧密程度适中的枇杷品种有利于降低果园管理成本,提高管理效率。根据《枇杷种质资源描述规范和数据标准》[5]所定义的“花序支轴紧密度”可以用来描述花序支轴的紧密程度,将枇杷花序分为疏散型、中等型和紧密型三种,但类型判定需依赖目测确定。由于从目测上判断,疏散、中等和紧密之间没有明确的界限,加上不同调查人员对三种花序类型的直观理解有偏差,导致测量误差较大而且不能忽略。
前人的研究表明,花序支轴紧密度与花序宽度显著相关[6]。为了进一步分析与花序支轴紧密度相关的其他花序性状,寻找关键量化指标,笔者在本研究中增加了花序长度、花序支轴数、花序节间平均长度、第一分枝长度、第二分枝长度、第一分枝角度、第二分枝角度作为可能会影响花序支轴紧密度的相关数量性状,挖掘其中可以较为准确评价花序支轴紧密度的性状指标。由于上述性状只聚焦花序的局部结构,笔者在本研究中增加花序疏密程度这一新型性状,与上述性状进行比较分析,判断该性状的可靠性,为枇杷花序支轴紧密度的评价提供新型方法。
1 材料和方法
1.1 试验材料
以来自日本、美国、意大利等国家及我国的广东、江苏、浙江、福建、四川、陕西等省的41份枇杷资源为试验材料(表1),供试材料均种植保存于华南农业大学枇杷种质资源圃。于2021 年10 月份枇杷初花期选择生长状态良好的可以稳定开花结果的成年果树1~3 株,测量其花序相关性状。种质资料信息来源于相关文献[2,7-14]。
表1 本试验使用的枇杷种质信息
Table 1 Information of loquat germplasm used in this study

编号Code 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41种质名称Cultivar光荣本Guangrongben白梨Baili白肉Bairou白肉小Bairouxiao解放钟Jiefangzhong解放钟白Jiefangzhongbai梅花霞Meihuaxia乌躬白Wugongbai早钟6号Zaozhong 6长红3号Changhong 3莫家2代Mojia F2粤晖Yuehui早佳5号Zaojia 5早佳8号Zaojia 8早佳90 Zaojia 90早茂15号Zaomao 15早西白Zaoxibai白玉Baiyu荸荠种Biqizhong冰糖种Bintangzhong常绿4号Changlv 4常绿5号Changlv 5串脑Chuannao高粱姜Gaoliangjiang鸡蛋白Jidanbai铜皮Tongpi麦后黄Maihouhuang大五星Dawuxing新黄肉Xinhuangrou大红袍Dahongpao华宝2号Huabao 2宁海白Ninghaibai黄金块Golden Nugget白茂木Moriowase茂木Mogi长崎早生Nagasaki-wase Italiano MCB佳伶Javierin马可Marc BRT来源地Sample source安徽Anhui福建Fujian福建Fujian福建Fujian福建Fujian福建Fujian福建Fujian福建Fujian福建Fujian福建Fujian广东Guangdong广东Guangdong广东Guangdong广东Guangdong广东Guangdong广东Guangdong广东Guangdong江苏Jiangsu江苏Jiangsu江苏Jiangsu江苏Jiangsu江苏Jiangsu江苏Jiangsu江苏Jiangsu江苏Jiangsu江苏Jiangsu陕西Shanxi四川Sichuan四川Sichuan浙江Zhejiang浙江Zhejiang浙江Zhejiang美国U.S.A.日本Japan日本Japan日本Japan西班牙Spain西班牙Spain西班牙Spain西班牙Spain意大利Italy
1.2 方法
1.2.1 花序直测性状调查 将可以直接从田间获取到数据的性状归类为直测性状。花序长度(length of flower cluster,CL)、花序宽度(width of flower cluster,CW)、花序支轴数(flower cluster:number of secondary peduncles,CPN)和花序支轴紧密度(Flower cluster:density of secondary peduncles,CPD)这4个花序直测性状按照《枇杷种质资源描述规范和数据标准》进行调查[5]。
具体方法如下:花序长度、花序宽度、花序支轴数的测量,均于枇杷初花期选取树上不同部位的中心枝上花序10 个,分别测量花序基部至先端的长度、花序最大处宽度、计算每一个花序的一级支轴数,再取平均值。花序长度和花序宽度的单位为cm,精确到0.1 cm。花序支轴数单位为个,精确到0.1个。花序支轴紧密度的测量采用目测法观察上述10 个花序的支轴间紧密程度,如为疏散型(Sparse)赋值为1,如为中等型(Medium)赋值为2,如为紧密型(Dense)赋值为3,以此确定种质的花序支轴紧密度。
此外,平均节间长度(flower cluster:mean internode length,CIL)、第一分枝长度(flower cluster:first branch length,FBL)、第一分枝角度(flower cluster:first branch angle,FBA)、第二分枝长度(flower cluster:second branch length,SBL)以及第二分枝角度(flower cluster:second branch angle,SBA)这5 个花序直测性状在《枇杷种质资源描述规范和数据标准》中没有描述,笔者根据本研究需要规范其测量方法如图1。
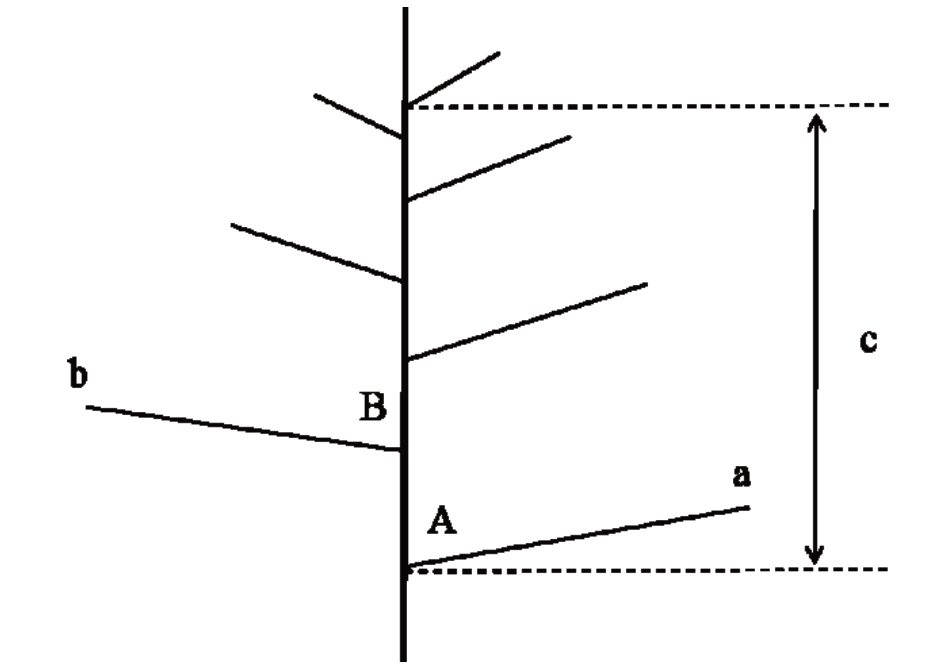
图1 枇杷花序简图
Fig.1 Schematic of loquat inflorescence
A.花序第一分枝角度;B.花序第二分枝角度;a.花序第一分枝长度;b.花序第二分枝长度;c.花序节间总长。
A. The first branch length of flower cluster; B. The second branch length of flower cluster; a. The first branch angle of flower cluster;b. The second branch angle of flower cluster; c. The total internode length of flower cluster.
以上述选定的10个花序作为测量对象。如图1所示,将从花序基部第一分枝的分枝起点处向上至最高处分枝的分枝起点处的主轴长度作为节间总长,平均节间长度=节间总长/(分枝数-1),由此计算得到平均节间长度。第一分枝长度为花序最下方的一级分枝(即第一分枝)的长度。第一分枝角度为第一分枝与花序轴自下而上方向相交处的夹角。第二分枝长度为距离第一分枝的分枝起点最近的一级分枝(即第二分枝)的长度。第二分枝角度为第二分枝与花序轴自下而上方向相交处的夹角。平均节间长度、第一分枝长度和第二分枝长度的单位为cm,精确到0.1 cm;第一分枝角度和第二分枝角度的单位为(°),精确到0.1°。
1.2.2 花序疏密程度调查 花序疏密程度概念的提出,是为了更准确和直观地描述花序在空间上的疏密程度。笔者在本研究中通过分析花序不同侧方位的投影,计算花序部分占所在花序框的比例来判断花序疏密程度。在进行调查时,选择中心枝上不同方位结构完整的10个花序,调查其平均花序疏密程度作为种质的花序疏密程度,单位为百分数,精确到0.01%。具体方法如下。
首先在每份种质树上选择具有代表性的不同方位中心枝条的完整10个花序,采摘后立即将花序基部浸水保湿,并在8 h 内进行拍摄;拍摄场景如图2所示,先将枇杷花序基部固定于底座上,底座与打光屏的距离保持固定,并且相机镜头正对花序侧面;由计算机控制底座每旋转10°拍摄一张花序照片,每个花序拍摄36张照片。图3为紧密型、中等型和疏散型3种花序的彩色图例和花序疏密程度拍摄场景图例。
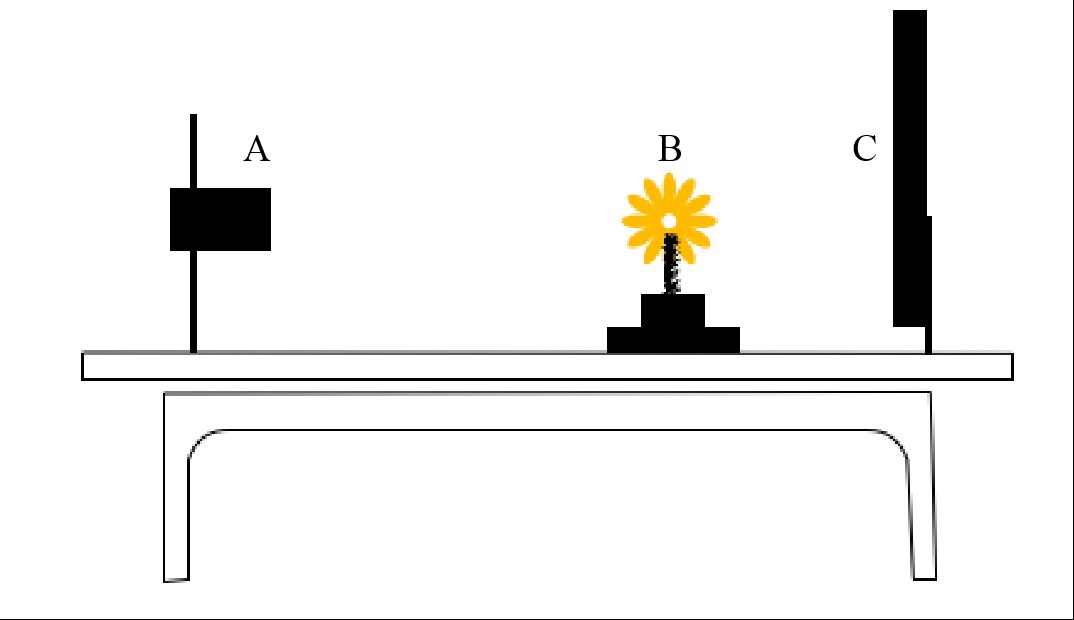
图2 拍摄场景
Fig.2 Shooting scene
A.摄像机;B.枇杷花序;C.打光屏幕。
A. Camera; B. One flower cluster of loquat; C.The screen for lighting.

图3 三种花序支轴紧密度种质图例
Fig.3 Germplasms of three kinds of CPD
A.光荣本花序图例,目测为紧密型;B.串脑花序图例,目测为中等型;C.乌躬白花序图例,目测为疏散型;D~F.光荣本、串脑和乌躬白在计算花序疏密程度拍摄场景中的花序图例;标尺为5 cm。
A.The inflorescence legend of Guangrongben,dense type visually;B.The inflorescence legend of Chuannao,medium type visually;C.The inflorescence legend of Wugongbai, sparse type visually; D-F. The inflorescence legend of Guangrongben, Chuannao and Wugongbai in the shooting scene of calculating the density of inflorescences,respectively.The bar is 5 cm.
笔者在本研究中开发出一款用于计算种质花序疏密程度的工具。该工具的开发环境是Python 3.8 64-bit,使用PyCharm Community Edition 工具开发,所使用计算机系统为Windows 7 64 位,计算机内存为8 GB。该工具通过识别特定路径下的花序照片集,将图像进行灰度处理并对花序部位进行切割,再对花序部位的像素进行运算,可批量处理获得花序疏密程度。
单个花序的花序疏密程度的计算模型如图4所示,以花序F 的第i 张花序侧面照为例,该程序可以识别花序框的边界AiBiCiDi ,在花序框内通过计算图形像素数获得花序部分Yi 与花序框部分Xi 的像素数比值InDi ,即花序F 第i 张花序侧面照的花序疏密程度。以同样的方法计算出该花序其余35 张照片的InD ,并求出所有InD 的平均值![]() ,即为单个花序的疏密程度,由此可以计算出所选10 个花序的均值,即为该种质的花序疏密程度值。程序数据流如图5 所示,输入参数有图片所在文件夹路径、强制下截参数、种质名称、花序支轴紧密度目测值,经计算机处理得到种质的花序疏密程度信息。
,即为单个花序的疏密程度,由此可以计算出所选10 个花序的均值,即为该种质的花序疏密程度值。程序数据流如图5 所示,输入参数有图片所在文件夹路径、强制下截参数、种质名称、花序支轴紧密度目测值,经计算机处理得到种质的花序疏密程度信息。
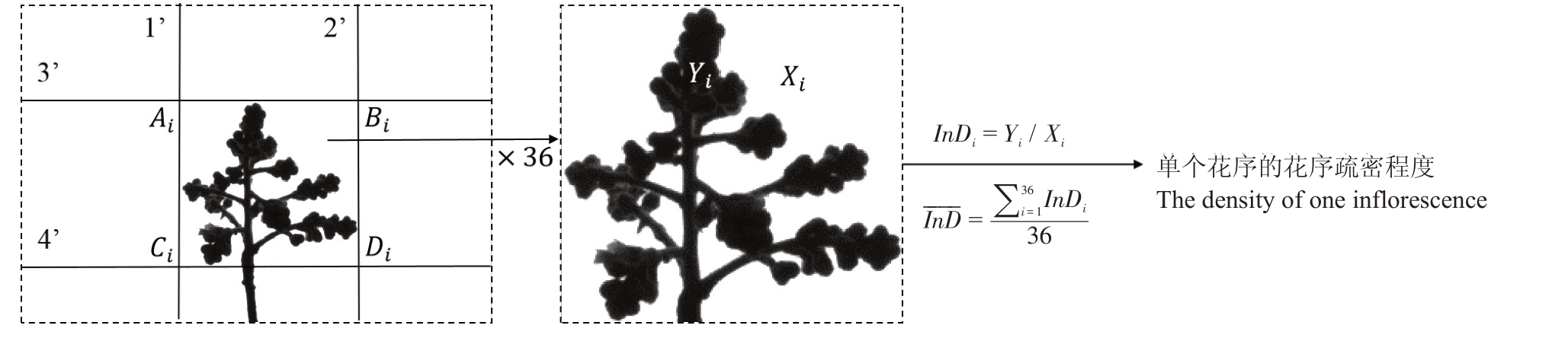
图4 花序F 第i 张花序侧面照及花序疏密程度计算方法
Fig.4 Lateral view of inflorescence F i and calculation method of inflorescence density
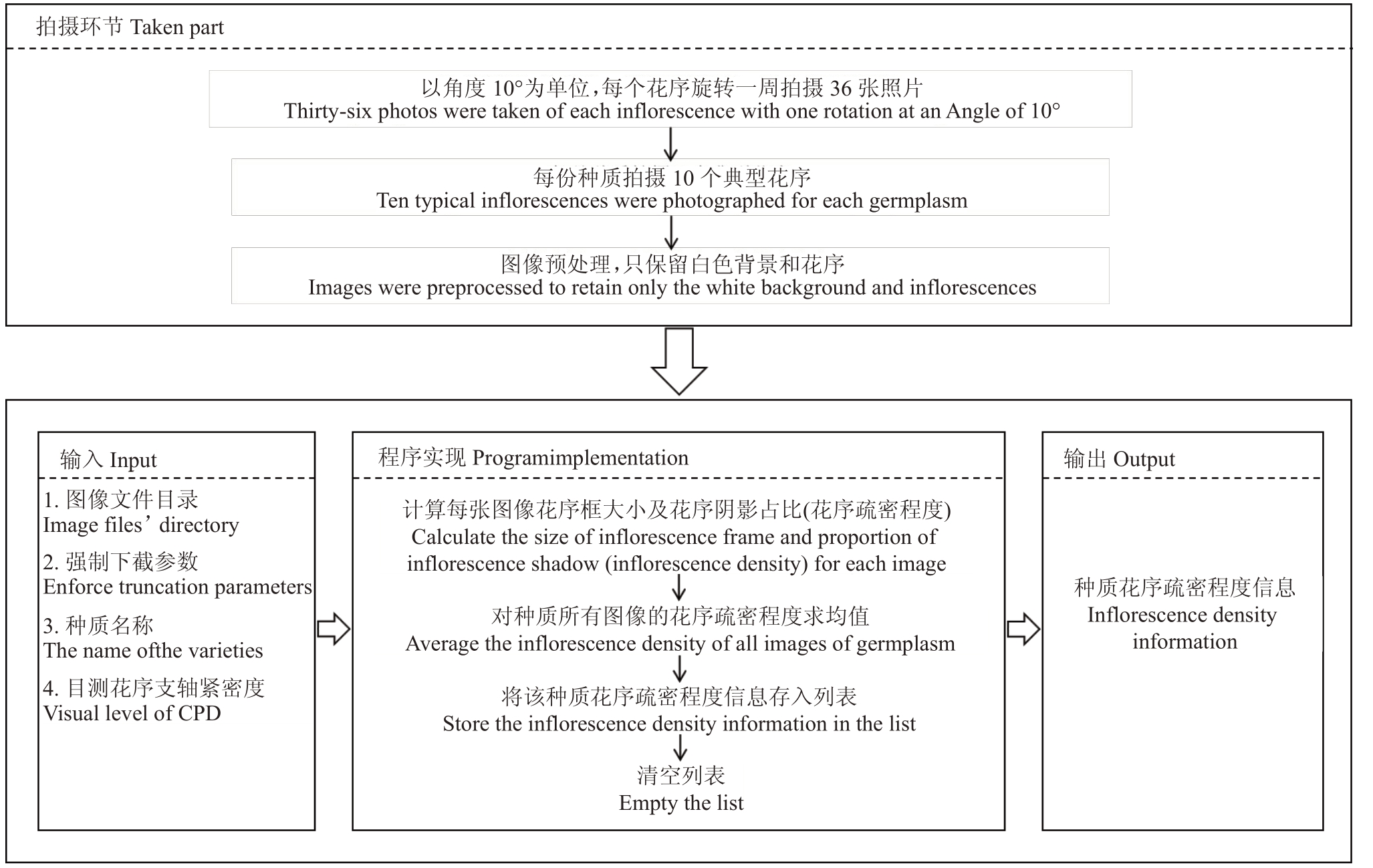
图5 花序疏密程度实现流程
Fig.5 Model for calculating inflorescence density
1.3 数据分析
1.3.1 多样性分析 参考李颖等[15]和陈秀萍等[4]方法。Shannon 多样性指数(H’)的计算公式为:H’=-∑(Pi×ln Pi)。Pi为某一性状第i 个等级中的样本数占总样本数的比值。如将数量性状花序长度、花序宽度等按照X±2δ 范围分为10 个等级(δ为标准差),以小于X-2δ 作为第一等级为起点等间距依次划分,直到大于X+2δ 作为第十等级为止。1.3.2 相关性分析 首先对各性状数据集进行正态性检验,符合正态分布的数据集之间进行皮尔逊(Person)相关分析,非正态分布数据集之间或非正态分布与正态分布数据集之间进行斯皮尔曼(Spearman)相关分析[16]。齐方差的条件下使用LSD方法进行多重比较,方差不齐的条件下使用Brown-Forssythe 或Welth 修正值判断显著性,并使用Dunnett’s方法进行多重比较[17-18]。
1.3.3 花序支轴紧密度综合评价方法 花序支轴紧密度的综合评价主要采用主成分分析法(PCA)进行赋权重评价并筛选核心指标[19-20]。首先对数据进行KMO 检验以确定PCA 的可行性,该检验表明用于主成分分析的每个变量的抽样充分性,Kaise[21]建议高于0.5 的值是可以接受的。本试验的抽样充分性在0.6 以上,适用于PCA 分析。为避免量纲和数量集对试验的影响,需要将花序性状数据进行标准化。数据经过主成分分析后,保留特征值≥1的主成分用于指标选择和评价[20,22-23]。按照公式(1)计算出其综合得分[22,24]。
S 代表最终得分,Qn代表第n 个因子的得分,Tn代表第n个因子的方差贡献率,T代表n个因子的累计方差贡献率。
另参考黄彪[25]和刘龙昌[26]采用层次聚类的方法对花序直测性状进行聚类分析,以完善对花序支轴紧密度的综合评价。
1.4 数据处理
试验数据采用Excel 2016 进行均值(Xˉ)、标准差(δ)、Shannon’s 多样性指数(H’)和变异系数(CV)计算分析,采用SPSS 25进行相关性、差异显著性、聚类分析以及主成分分析,同时采用Excel 2016、SPSS 25作图。
2 结果与分析
2.1 花序直测性状的多样性分析
按照《枇杷属种质资源描述规范和数据标准》[5]对41份枇杷种质的花序支轴紧密度进目测判断,统计并分析疏散、中等和紧密3 种花序支轴紧密度在不同地区的分布情况(表2)。总体上,41 份种质中花序疏散型种质占34.1%,花序中等型种质占41.5%,花序紧密型种质占24.4%。以广东、福建、江苏作为代表地区分析,发现41 份种质中,广东和福建地区的枇杷种质以疏散型花序占多数,占比分别为66.7%和55.5%,江苏地区的枇杷种质以中等型花序占多数,占比为44.4%。
表2 不同地区枇杷种质花序支轴紧密度分布
Table 2 Distribution of loquat’s CPD in different regions

来源地Sample source广东Guangdong评价Evaluate花序支轴紧密度CPD疏散Sparse 6中等Medium 3紧密Dense福建Fujian 66.7 5 33.3 3 0 0 1江苏Jiangsu 55.5 2 33.3 4 11.1 3所有地区Total种质数Number of species比率Rate/%种质数Number of species比率Rate/%种质数Number of species比率Rate/%种质数Number of species比率Rate/%22.2 14 44.4 17 33.3 10 34.1 41.5 24.4
表3列出了41份种质中8个花序直测性状的均值、标准差以及种质间的差异显著性。可以看出,第一分枝角度和第二分枝角度的种质间区分度不明显。不同种质间,花序长度、花序宽度、花序支轴数均有较大的差异性。从中可以看出一些性状较为极端的种质,例如莫家2 代的花序长度、花序宽度、平均节间长度、第一分枝长度和第二分枝长度都显著高于其他种质;乌躬白的花序宽度、花序支轴数、第一分枝长度和第二分枝长度也都显著高于其他种质;白梨的花序宽度和第二分枝长度显著高于大部分种质;早佳8 号的花序长度和平均节间长度显著高于大部分种质;而黄金块的花序长度、花序宽度、花序支轴数、平均节间长度、第一分枝长度和第二分枝长度都显著低于其他种质;大五星的花序长度和平均节间长度显著低于其他种质;白肉小的花序宽度和第一分枝长度显著低于大部分种质;常绿5 号的花序长度和第二分枝长度显著低于大部分种质。
表3 41份种质中花序直测性状的比较分析
Table 3 Comparative analysis of the traits of inflorescence direct measurement in 41 germplasm

紧支CPD 轴序度花密31131211221111122233132221132232223232213度角第SBA/(°)枝分二77.00±11.48 abAB 72.30±11.34 abAB 84.10±8.90 aA 87.50±5.20 aA 86.30±14.96 aA 69.33±10.96 abAB 74.20±10.51 abAB 82.35±6.70 Aab 80.80±12.00 aAB 79.00±6.57 abAB 83.05±6.91 Aa 74.80±8.10 abAB 74.10±5.94 abAB 80.27±4.88 aAB 77.80±9.88 abAB 73.70±10.42 abAB 77.40±7.10 abAB 78.50±6.01 abAB 67.60±8.05 abAB 83.70±8.79 aA 80.30±9.46 aAB 76.30±7.62 abAB 90.85±12.09 aA 80.80±6.54 aAB 79.10±12.72 abAB 84.40±8.38 aA 80.50±8.43 aAB 71.10±7.15 abAB 77.20±9.67 abAB 75.50±12.54 abAB 65.00±7.75 Bb 74.30±12.50 abAB 83.00±21.88 aAB 76.40±10.20 abAB 77.80±7.83 abAB 78.70±14.08 abAB 91.00±5.60 aA 81.50±10.50 aAB 77.30±10.33 abAB 88.90±7.87 aA 80.50±7.89 Aab度长枝第SBL/cm 分二4.43±0.72 bcAB 8.23±2.20 aA 6.17±1.94 abA 3.51±0.45 cB 6.05±2.02 abA 5.94±1.38 abA 8.16±1.61 aA 8.43±2.04 aA 5.18±1.03 bcAB 6.16±1.17 abA 9.48±3.12 aA 7.56±1.92 abA 6.47±2.73 abA 7.56±0.70 aA 7.09±1.67 abA 7.57±2.37 aA 4.75±2.10 bcAB 5.03±1.17 bcAB 5.15±0.82 bcAB 4.41±1.25 bcAB 7.58±3.73 aA 3.46±0.92 cB 5.29±1.44 bAB 6.39±1.63 abA 5.12±2.03 bcAB 6.57±2.22 abA 6.53±1.43 abA 4.26±1.21 bcAB 6.57±1.82 abA 5.62±0.96 bAB 4.29±1.46 bcAB 4.52±1.27 bcAB 3.13±0.83 cB 5.06±1.69 bcAB 4.12±1.28 bcAB 4.36±1.11 bcAB 4.52±1.41 bcAB 4.48±1.27 bcAB 6.16±1.77 abA 6.88±1.89 abA 4.72±1.57 bcAB度角枝分一第FBA/(°)69.85±6.37 abAB 73.00±8.85 abAB 78.80±7.21 abAB 83.30±5.75 aA 78.80±12.50 abAB 61.14±10.04 bB 70.40±8.35 abAB 73.05±14.14 abAB 75.50±10.86 abAB 75.00±7.72 abAB 75.43±12.18 abAB 76.40±10.81 abAB 68.80±7.36 abAB 77.82±7.74 abAB 78.70±8.31 abAB 74.00±13.87 abAB 69.50±12.52 abAB 75.75±6.90 abAB 59.30±9.48 bB 77.60±11.01 abAB 78.60±7.45 abAB 64.40±9.17 abAB 84.35±5.07 aA 79.30±8.53 aAB 78.10±14.00 abAB 82.50±11.47 aAB 77.00±10.88 abAB 71.50±8.08 abAB 76.50±13.38 abAB 76.50±11.19 abAB 66.50±11.84 abAB 71.30±8.67 abAB 95.20±21.48 aA 79.20±4.21 aAB 72.14±11.02 abAB 80.00±7.07 aAB 85.80±9.85 aA 81.90±11.94 aAB 73.20±12.36 abAB 77.90±12.48 abAB 80.67±10.31 aAB长枝分度FBL/cm一第5.10±1.15 bcAB 8.60±2.12 abA 7.08±1.48 abA 4.08±0.74 cB 7.08±2.32 abA 6.61±1.50 abA 8.80±3.36 abA 9.91±3.07 aA 7.04±1.87 abA 7.55±1.65 abA 9.72±2.93 abA 8.24±2.26 abA 9.33±2.91 abA 8.04±1.83 abA 8.32±2.72 abA 7.40±2.88 abA 6.29±1.00 bAB 6.18±1.90 bcAB 6.47±1.72 abAB 4.90±1.93 bcAB 6.51±2.32 abAB 4.41±1.28 bcAB 6.97±1.86 abA 8.85±3.19 abA 5.92±2.43 bcAB 6.82±2.22 abA 7.81±1.58 abA 4.84±1.23 bcAB 7.24±2.12 abA 7.18±1.84 abA 4.87±1.83 bcAB 6.41±2.40 abAB 3.87±0.97 cB 6.18±1.24 bcAB 4.24±1.00 cB 4.71±0.48 bcAB 4.81±1.12 bcAB 4.99±1.36 bcAB 6.24±1.40 bcAB 8.06±2.34 abA 4.23±1.39 cB长间节均度CIL/cm平0.38±0.09 bcBC 0.60±0.07 abAB 0.61±0.11 aAB 0.42±0.07 bcBC 0.61±0.11 aAB 0.47±0.10 bBC 0.48±0.08 abBC 0.57±0.13 abAB 0.49±0.07 abBC 0.41±0.08 bcBC 0.75±0.15 aA 0.61±0.08 aAB 0.58±0.07 abAB 0.76±0.11 aA 0.55±0.08 abAB 0.50±0.08 abB 0.57±0.19 abAB 0.42±0.08 bcBC 0.45±0.11 bcBC 0.38±0.04 bcBC 0.62±0.16 aAB 0.51±0.34 abB 0.56±0.10 abAB 0.53±0.16 abAB 0.45±0.11 bcBC 0.58±0.09 abAB 0.47±0.08 abBC 0.33±0.04 cC 0.49±0.06 abB 0.54±0.11 abAB 0.40±0.05 bcBC 0.47±0.07 abBC 0.35±0.09 bcBC 0.47±0.08 abBC 0.42±0.08 bcBC 0.41±0.09 bcBC 0.53±0.06 abB 0.45±0.07 bcBC 0.58±0.06 abAB 0.76±0.15 aA 0.61±0.06 aAB数CPN轴支序花12.65±1.77 bcB 11.10±1.92 cdBC 9.10±2.17 deD 8.70±2.05 deDE 8.70±2.15 deDE 12.71±3.49 bcB 16.80±3.25 aA 15.40±2.82 abA 10.20±2.04 dD 13.20±2.44 bcAB 14.90±2.88 bAB 11.50±2.97 cdBC 12.60±1.28 bcB 13.82±1.95 bcAB 13.60±2.58 bcAB 13.10±2.21 bcAB 9.50±2.69 deD 12.20±1.63 cB 12.00±2.41 cdB 10.10±2.43 deD 11.30±2.83 cdBC 8.40±2.63 deDE 11.30±2.51 cdBC 12.00±1.95 cdB 8.70±2.83 deDE 10.60±2.65 cdD 10.60±2.24 cdD 11.70±2.05 cdBC 14.30±2.10 bAB 7.30±1.68 efDE 12.10±1.92 cB 9.30±2.10 deD 5.90±2.17 fE 10.50±2.16 cdD 10.19±2.63 dD 7.30±1.62 efDE 11.80±1.98 cdBC 7.00±1.84 efDE 10.40±1.36 dD 11.10±2.12 cdBC 8.20±2.79 eDE度CW/cm 宽序花8.96±1.69 bcBC 16.27±2.40 aAB 13.52±2.77 abAB 7.60±1.21 cC 11.77±2.68 abBC 11.55±2.53 abBC 14.10±4.25 abAB 17.44±3.70 aA 11.59±2.15 abBC 12.83±2.53 abAB 18.40±5.52 aA 15.55±2.39 abAB 15.55±3.48 abAB 14.66±2.24 abAB 16.83±4.45 aAB 14.60±2.81 abAB 11.26±2.36 bcBC 11.41±2.40 bBC 10.51±1.61 bcBC 9.78±2.18 bcBC 14.57±5.46 abAB 7.86±1.01 cC 11.84±2.46 abB 14.27±4.02 abAB 10.68±3.49 bcBC 13.16±3.09 abAB 12.65±1.20 abAB 9.21±2.08 bcBC 14.09±2.70 abAB 11.10±2.74 bcBC 7.61±1.45 cC 11.16±2.48 bcBC 7.48±1.63 cC 11.32±2.27 bcBC 8.19±1.56 cC 8.70±1.65 bcBC 9.16±1.98 bcBC 8.99±1.16 bcBC 12.71±1.73 abAB 14.25±3.66 abAB 9.62±2.22 bcBC度CL/cm 长序花7.97±1.50 cdCD 11.40±1.42 bcBC 11.47±1.61 bcBC 7.88±0.62 dCD 10.55±1.42 bcBC 10.10±2.21 bcBC 13.57±3.03 abAB 13.01±2.80 abAB 10.17±1.42 bcBC 11.12±3.13 bcBC 16.04±3.04 aA 12.70±1.36 abAB 12.30±1.57 abAB 15.44±1.35 aA 13.00±1.64 abAB 11.92±2.10 bcBC 9.40±1.32 bcBC 8.90±1.67 cdCD 9.00±1.72 cdCD 8.64±1.84 cdCD 12.61±2.82 abAB 7.52±1.45 dCD 12.11±1.65 bB 12.05±2.54 bcBC 9.63±2.18 bcBC 11.28±2.09 bcBC 10.20±1.35 bcBC 6.66±1.08 dD 11.05±2.15 bcBC 10.76±2.06 bcBC 8.34±1.59 cdCD 9.39±0.67 cC 7.37±1.52 dCD 10.38±1.98 bcBC 8.32±1.28 cdCD 7.58±0.80 dCD 10.12±1.55 bcBC 8.27±1.22 cdCD 9.99±1.15 bcBC 13.32±2.04 abAB 10.76±1.79 bcBC号Code编1234567891011121314151617181920212223242526272829303132333435363738394041著(p<0.01)。极(p<0.05),and different uppercase letters in the same column indi-显著(p<0.05),同(p<0.01).异差状性一某间质种示表母字写大同不列一显异差状性一某间质种示表母字写小同不列一;同密;3.紧;2.中:1.疏注Note:1.Sparse;2.Medium;3.Dense;Different lowercase letters in the same column indicate significant differences in a trait between germplasm等散cate extremely significant differences in a trait between germplasm
从频率分布和多样性指数(表4)来看,供试群体的8 个直测性状呈均衡分布,其中平均节间长度的多样性指数较低为1.85,花序支轴数和第二分枝长度的多样性指数较高均为2.04。从变异系数(表4)来看,除了第一分枝角度和第二分枝角度的变异系数分别为8.71%和7.32%,其他性状的变异系数均在20.20%至26.01%之间。其中,第二分枝长度的变异系数最高,为26.01%;平均节间长度变异系数较低,为20.20%。变异系数越高,该性状在群体中的表现越不稳定[27];多样性指数越高,该性状在物种中具有较高的丰富度[28-29]。因此优先选择多样性指数较高变异系数在合理范围内的花序长度、花序宽度、花序支轴数、平均节间长度、第一分枝长度和第二分枝长度作为评价指标。
表4 8 个花序直测性状各级分布频率、变异系数及多样性指数
Table 4 Frequency,CV and H’of the 8 traits of inflorescence direct measurement at all levels
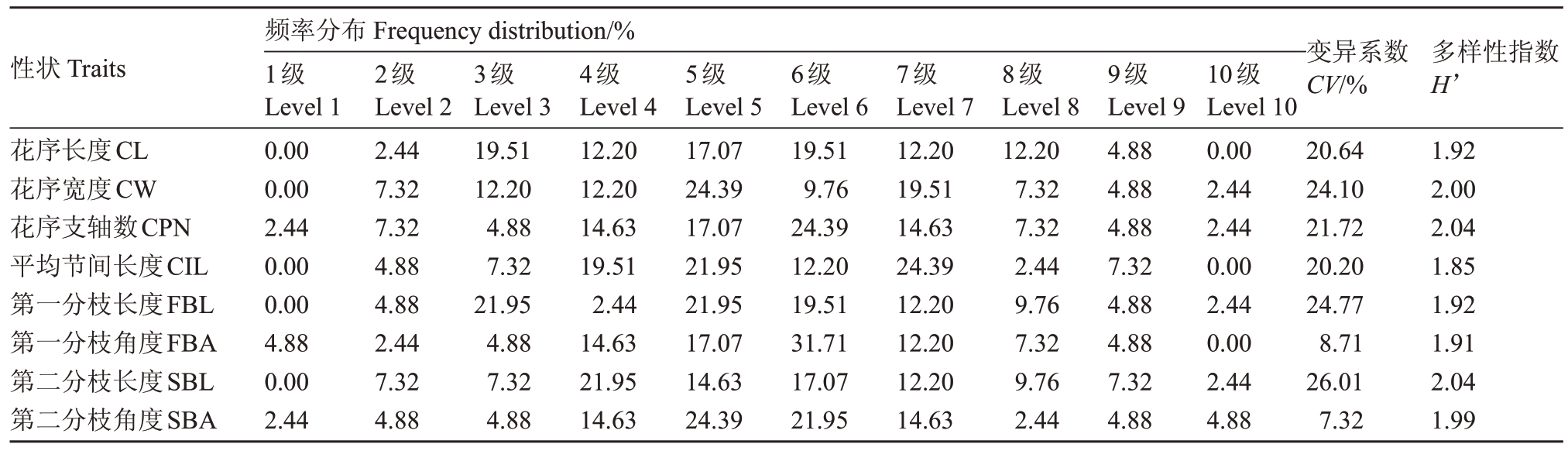
性状Traits 变异系数CV/%多样性指数H’花序长度CL花序宽度CW花序支轴数CPN平均节间长度CIL第一分枝长度FBL第一分枝角度FBA第二分枝长度SBL第二分枝角度SBA频率分布Frequency distribution/%1级Level 1 0.00 0.00 2.44 0.00 0.00 4.88 0.00 2.44 2级Level 2 2.44 7.32 7.32 4.88 4.88 2.44 7.32 4.88 3级Level 3 19.51 12.20 4.88 7.32 21.95 4.88 7.32 4.88 4级Level 4 12.20 12.20 14.63 19.51 2.44 14.63 21.95 14.63 5级Level 5 17.07 24.39 17.07 21.95 21.95 17.07 14.63 24.39 6级Level 6 19.51 9.76 24.39 12.20 19.51 31.71 17.07 21.95 7级Level 7 12.20 19.51 14.63 24.39 12.20 12.20 12.20 14.63 8级Level 8 12.20 7.32 7.32 2.44 9.76 7.32 9.76 2.44 9级Level 9 4.88 4.88 4.88 7.32 4.88 4.88 7.32 4.88 10级Level 10 0.00 2.44 2.44 0.00 2.44 0.00 2.44 4.88 20.64 24.10 21.72 20.20 24.77 8.71 26.01 7.32 1.92 2.00 2.04 1.85 1.92 1.91 2.04 1.99
2.2 花序直测性状的差异分析和相关性分析
以3种花序支轴紧密度类型为分类因子,对8个性状的测量值进行差异显著性分析,结果如图6 所示。其中第一分枝长度、第二分枝长度在3种花序类型之间达到极显著差异水平;而第一分枝角度和第二分枝角度在3种花序类型之间均没有显著差异;平均节间长度和花序支轴数在中等和紧密型花序之间没有显著差异。花序长度、花序宽度、第一分枝长度以及第二分枝长度可以较好地区分3种花序类型。
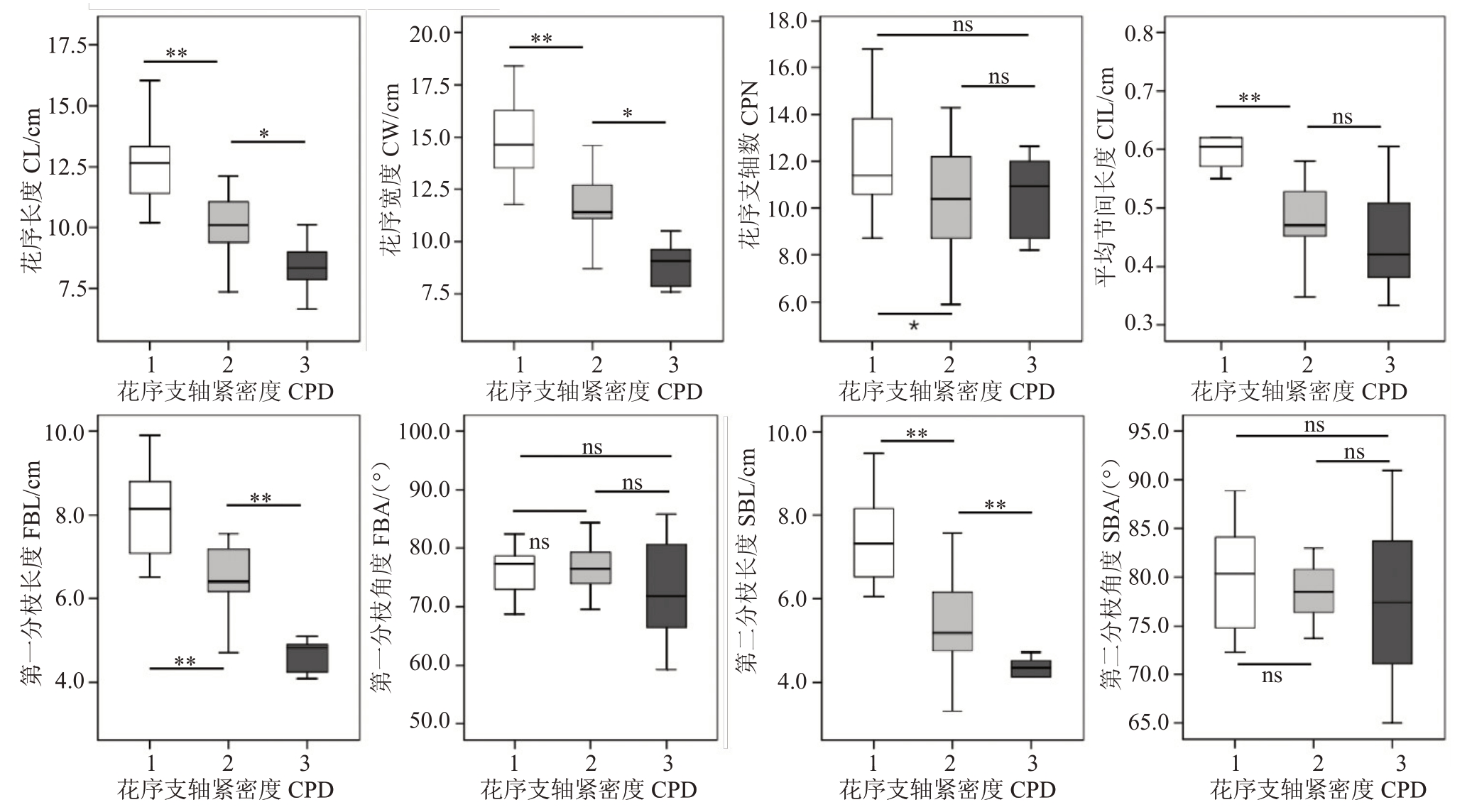
图6 8 个花序直测性状在不同花序支轴紧密度下的比较分析
Fig.6 Comparative analysis of the 8 traits of inflorescence direct measurement under different CPD
*表示差异显著(p<0.05);**表示差异极显著(p<0.01);ns 表示无显著差异。下同。
*means significant difference(p<0.05);**means extremely significant difference(p<0.01);ns means no significant difference.The same below.
8个直测性状与花序支轴紧密度(目测)的相关性分析表明(表5),花序长度、花序宽度、平均节间长度、第一分枝长度、第二分枝长度与花序支轴紧密度均呈极显著负相关,其中花序宽度、第二分枝长度与花序支轴紧密度之间的相关系数达到-0.818和-0.825;而花序支轴数、第一分枝角度、第二分枝角度与花序支轴紧密度之间的相关系数只有-0.27、-0.128和-0.172。这一结果说明,花序长度、花序宽度、第一分枝长度和第二分枝长度与花序支轴紧密度这一性状密切相关,同时将平均节间长度也列为参考对象。此外,花序长度、花序宽度、平均节间长度、第一分枝长度、第二分枝长度和花序支轴紧密度彼此之间呈极显著相关,说明可以对高度相关的指标进行筛选,简化评价体系。
表5 8 个花序直测性状的相关性分析
Table 5 Correlation analysis of 8 inflorescences directly measured characters
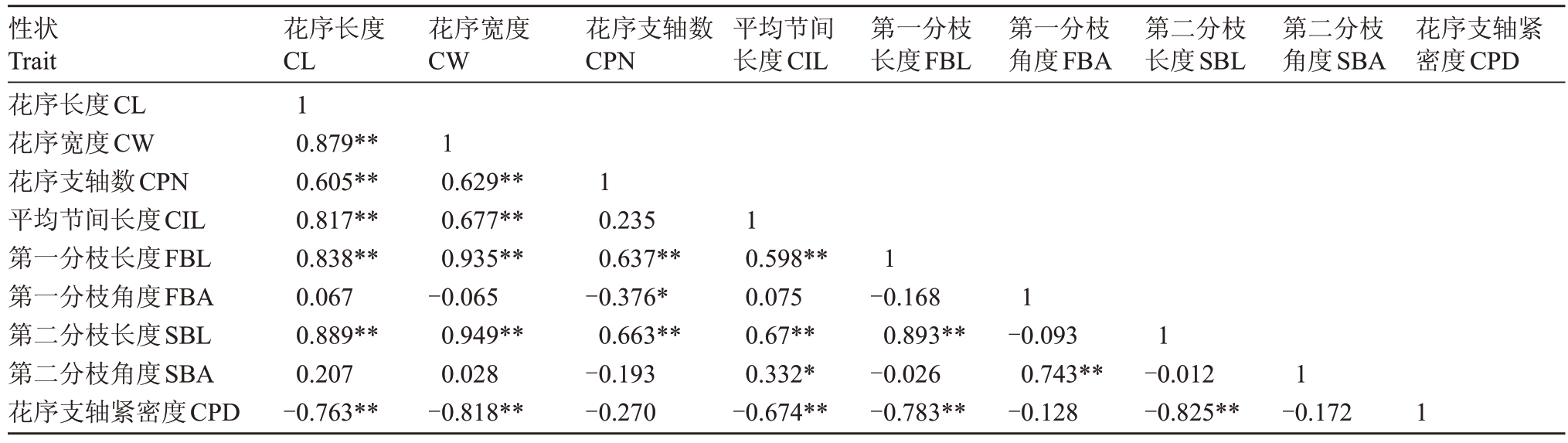
注:*表示相关性在0.05 水平上显著(双尾),**表示相关性在0.01 水平上显著(双尾)。下同。
Note:*means the correlation is significant at the 0.05 level(double-tailed),**means the correlation is significant at the 0.01 level(double-tailed).The same below.
性状Trait花序长度CL花序宽度CW花序支轴数CPN平均节间长度CIL第一分枝长度FBL第一分枝角度FBA第二分枝长度SBL第二分枝角度SBA花序支轴紧密度CPD花序长度CL 1 0.879**0.605**0.817**0.838**0.067 0.889**0.207-0.763**花序宽度CW花序支轴数CPN平均节间长度CIL第一分枝长度FBL第一分枝角度FBA第二分枝长度SBL第二分枝角度SBA花序支轴紧密度CPD 1 0.629**0.677**0.935**-0.065 0.949**0.028-0.818**1 0.235 0.637**-0.376*0.663**-0.193-0.270 1 0.598**0.075 0.67**0.332*-0.674**1-0.168 0.893**-0.026-0.783**1-0.093 0.743**-0.128 1-0.012-0.825**1-0.172 1
2.3 花序支轴紧密度综合评价及聚类分析
为评价所选择性状对花序支轴紧密度这一目标性状的综合影响,分别以5个显著相关性状和8个直测性状进行主成分分析。从载荷矩阵和方差贡献率(表6)看出,第一类主成分分析找出2个特征根大于1 的特征向量,累计方差贡献率达84.007%;第二类主成分分析找出一个特征根大于1 的特征向量,方差贡献率达85.649%。从各因子权重来看,花序宽度、第二分枝长度、花序长度和第一分枝长度的权重都在0.9 以上,其中花序宽度权重最高,为0.966;平均节间长度和花序支轴数的权重较低,分别为0.756和0.705。由于花序宽度、第二分枝长度、花序长度和第一分枝长度彼此呈极显著相关,相关系数均在0.8 以上(表5),因此选择花序宽度作为核心指标之一。在与花序支轴紧密度显著相关的性状中,平均节间长度与花序宽度的相关系数为-0.674(表5),而从载荷矩阵b 看出,平均节间长度的权重为0.807,选择平均节间长度作为另一核心指标。
表6 8 个花序直测性状主成分分析的载荷矩阵及方差贡献率
Table 6 Load matrix and variance contribution rate of PCA of 8 inflorescence traits

注:主成分a1、主成分a2 为包含非显著相关性状的载荷矩阵;主成分b1 为去除非显著相关性状的载荷矩阵。
Note:Principal components a1 and a2 are the load matrix containing non-significant correlation characters; Principal component b1 is the load matrix without significant correlation traits.
组分Component花序宽度CW第二分枝长度SBL花序长度CL第一分枝长度FBL平均节间长度CIL花序支轴数CPN第二分枝角度SBA第一分枝角度FBA特征根Eigenvalue方差贡献率Variance contribution rate/%累计方差贡献率Cumulative contribution rate/%载荷矩阵a Load matrix a主成分a1 Factor a1 0.966 0.963 0.951 0.936 0.756 0.705 0.052-0.114 4.725 59.066主成分a2 Factor a2 0.007-0.031 0.191-0.086 0.355-0.413 0.917 0.901 1.995 24.941载荷矩阵b Load matrix b主成分b1 Factor b1 0.966 0.958 0.958 0.929 0.807 0 0 0 4.282 85.649 59.066 84.007 85.649
以花序宽度和平均节间长度作为核心指标对花序进行综合评价,按照1.3.3 的方法计算综合得分,其与花序支轴紧密度目测结果间的斯皮尔曼相关系数为-0.817。按照三种花序类型对每种类型的种质综合得分进行差异分析,结果如图7 所示。主成分分析结果基本可以区分疏散、中等、紧密这3种花序类型,但仍然存在部分重叠区域,尤其是中等型与紧密型花序之间的区分不明显。比如在调查中发现,黄金块、大红袍这类目测为中等型花序的种质,其花序大小与紧密型种质区别不大,但是其花序支轴间较为稀疏而将其归类为中等型。另外,像MCB和冰糖种两者的综合得分十分相近,但是目测判断MCB为中等型,而冰糖种为紧密型。

图7 三种花序类型种质综合得分差异分析
Fig.7 Variance analysis in composite scores among the three inflorescence types
为了进一步分析所选性状能否综合评价花序支轴紧密度,使用层次聚类的方法对5 个显著相关性状进行聚类分析,结果如图8 所示。其中有部分种质的聚类结果与目测结果不一致,例如,早茂15 号与高粱姜在聚类分析中归为S 类(疏散型),在目测结果中为中等型;黄金块、长崎早生和MCB 在聚类分析中归为D类(紧密型),在目测结果中为中等型;麦后黄、白肉、解放钟和荸荠种在聚类分析中为M类(中等型),在目测结果中为疏散型。

图8 5 个显著相关性状聚类分析
Fig.8 Cluster analysis of 5 significantly correlated traits
M 类为中等型花序种质集合;D 类为紧密型花序种质集合;S 类为疏散型花序种质集合。
Class M is a medium inflorescence germplasm collection;Class D is a dense inflorescence germplasm collection and class;Class S is a sparse inflorescence germplasm collection.
2.4 花序疏密程度调查及指标评价
上述分析结果表明,对所选8 个直测性状进行聚类分析与主成分分析均不能准确地对花序支轴紧密度进行分类,通过调查发现花序的疏密程度也许与花序支轴紧密度紧密相关。因此,笔者在本研究中从41份枇杷种质中选出表型较明显的8份种质进行了试验。这8 份种质分别为:莫家2 代(编号2)、乌躬白(编号9)、早佳8号(编号41)3份花序疏散型种质;解放钟白(编号11)、串脑(编号24)2份花序中等型种质;Italiano(编号20)、光荣本(编号4)、茂木(编号14)3份花序紧密型种质。
根据1.2.2花序疏密程度的调查方法对所选8份种质进行了调查,花序疏密程度由高到低分别为:光荣本(47.36%)、茂木(46.34%)、Italiano(46.34%)、解放钟白(41.58%)、串脑(40.31%)、早佳8 号(36.45%)、乌躬白(35.45%)和莫家2 代(28.27%)。与8个直测性状进行相关性分析,结果如表7所示,发现花序疏密程度与花序支轴紧密度、花序长度、花序宽度、第一分枝长度和第二分枝长度的相关系数绝对值均在0.9以上;其中与花序支轴紧密度的相关性最显著,系数为0.945。同时,花序疏密程度与花序长度、花序宽度、花序支轴数、平均节间长度、第一分枝长度和第二分枝长度均呈极显著相关。花序疏密程度在3种花序类型间的差异分析也表明(图9),不同花序类型的种质在花序疏密程度这一性状上存在极显著差异。
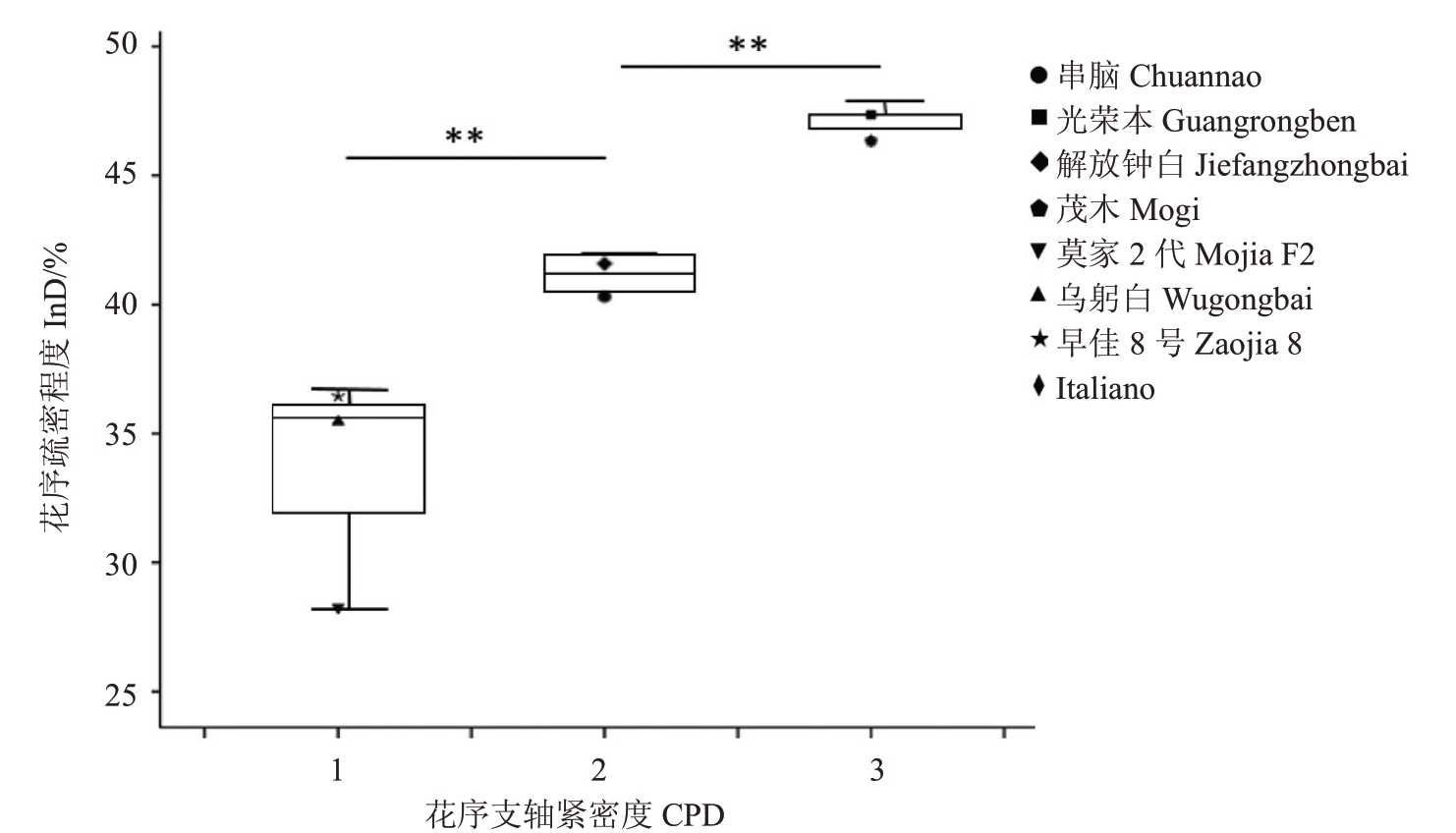
图9 花序疏密程度与花序支轴紧密度的差异分析
Fig.9 Variance analysis of inflorescence density and CPD
表7 8 份种质的花序主要性状相关性分析
Table 7 Correlation analysis of main traits of 8 germplasm’inflorescence
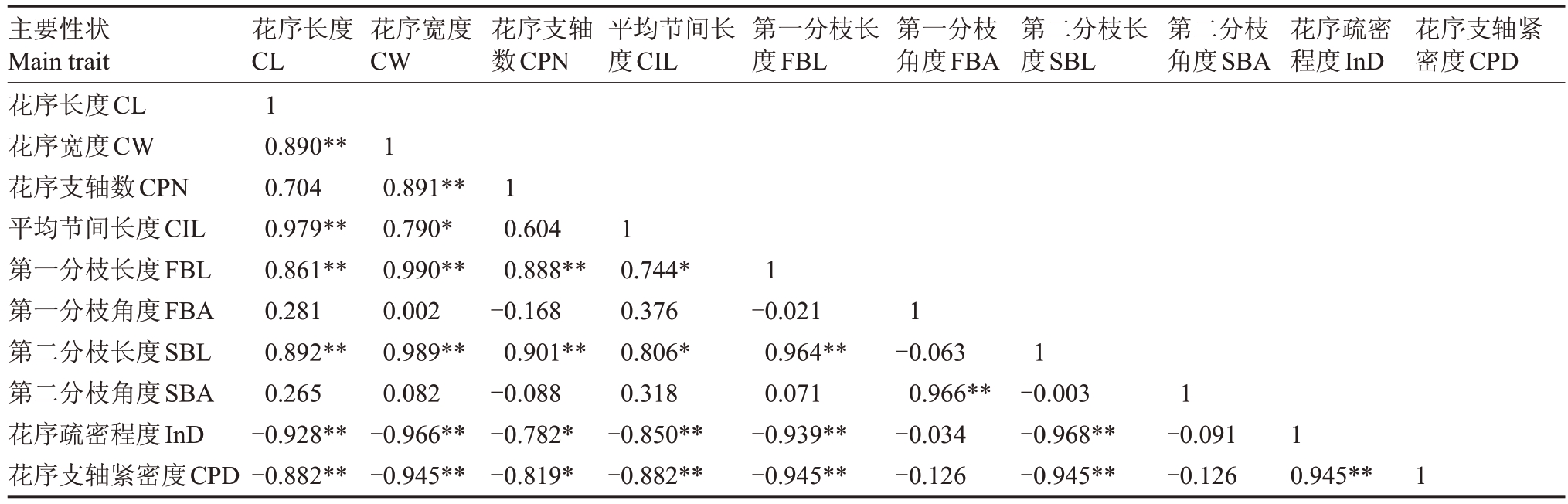
花序长度CL 1 0.890**0.704 0.979**0.861**0.281 0.892**0.265-0.928**-0.882**主要性状Main trait花序长度CL花序宽度CW花序支轴数CPN平均节间长度CIL第一分枝长度FBL第一分枝角度FBA第二分枝长度SBL第二分枝角度SBA花序疏密程度InD花序支轴紧密度CPD花序宽度CW花序支轴数CPN平均节间长度CIL第一分枝长度FBL第一分枝角度FBA第二分枝长度SBL第二分枝角度SBA花序疏密程度InD花序支轴紧密度CPD 1 0.891**0.790*0.990**0.002 0.989**0.082-0.966**-0.945**1 0.604 0.888**-0.168 0.901**-0.088-0.782*-0.819*1 0.744*0.376 0.806*0.318-0.850**-0.882**1-0.021 0.964**0.071-0.939**-0.945**1-0.063 0.966**-0.034-0.126 1-0.003-0.968**-0.945**1-0.091-0.126 1 0.945**1
对8份种质进行主成分分析,以花序疏密程度、花序长度、花序宽度、平均节间长度、第二分枝长度作为参考指标。结果如表8所示,特征根大于1的主成分只有1 个,其方差贡献率达到92%。从载荷矩阵中看出,花序疏密程度的权重最高,为-0.983,且优于花序宽度。对花序疏密程度从高到低进行排序(表9),其结果可以与目测的3 种花序类型相对应。在实际观察中,光荣本是3 种紧密型种质中花序最紧密种质,茂木和Italiano 的花序紧密度相似;在中等和疏散型种质中,花序疏密程度大小与花序支轴紧密度的表型更为接近。由此可见,花序疏密程度相较花序宽度更加符合花序的疏密形态。以上数据说明,花序疏密程度可以区分典型的疏散、中等和紧密3 种花序类型,其测量值越大,花序表现越紧密,测量值越小,花序表现越疏散。
表8 8 份种质显著相关性状载荷矩阵及方差贡献率
Table 8 Loading matrix and variance contribution rate of significantly correlated traits in 8 germplasm
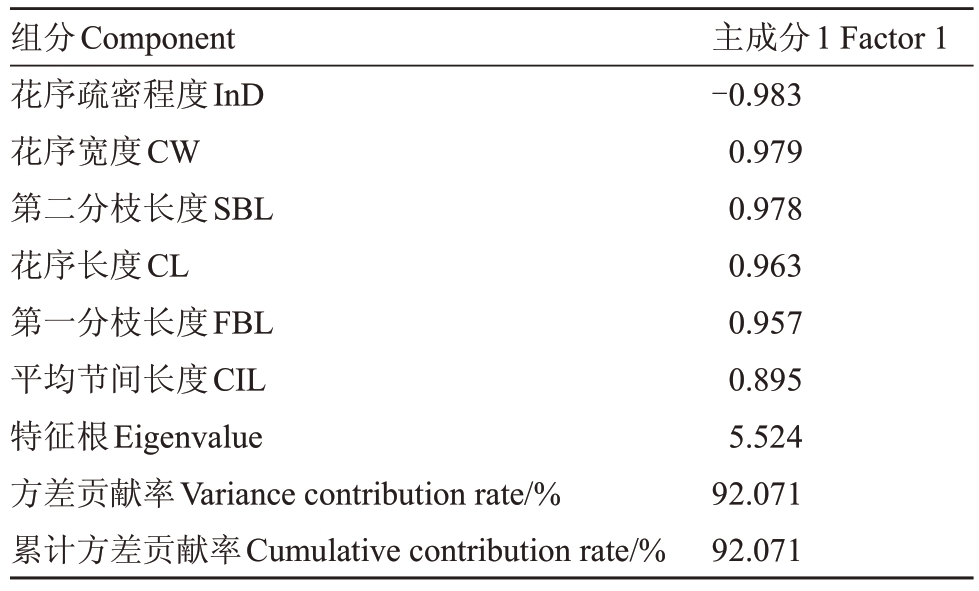
组分Component花序疏密程度InD花序宽度CW第二分枝长度SBL花序长度CL第一分枝长度FBL平均节间长度CIL特征根Eigenvalue方差贡献率Variance contribution rate/%累计方差贡献率Cumulative contribution rate/%主成分1 Factor 1-0.983 0.979 0.978 0.963 0.957 0.895 5.524 92.071 92.071
表9 8 份种质的花序疏密程度、花序宽度与目测结果比较
Table 9 Inflorescence density and visual inspection results of 8 germplasm
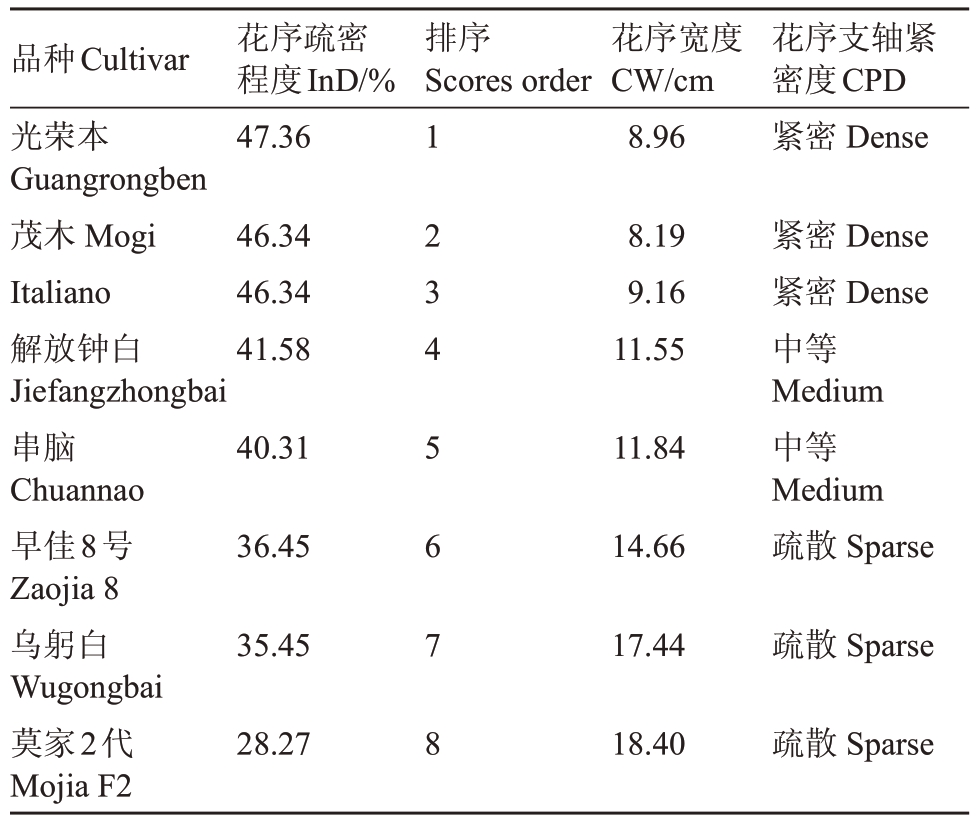
品种Cultivar光荣本Guangrongben茂木Mogi Italiano解放钟白Jiefangzhongbai串脑Chuannao早佳8号Zaojia 8乌躬白Wugongbai莫家2代Mojia F2花序疏密程度InD/%47.36排序Scores order花序宽度CW/cm 8.96花序支轴紧密度CPD紧密Dense 46.34 46.34 41.58 8.19 9.16 11.55 40.31 11.84 36.45 14.66紧密Dense紧密Dense中等Medium中等Medium疏散Sparse 35.45 17.44疏散Sparse 28.27 1 2 3 4 5 6 7 8 18.40疏散Sparse
为了更直观地区分疏散、中等和紧密3种花序类型,笔者在本研究中试图对花序疏密程度进行分界。疏散型与中等型在花序疏密程度上的分界可能在36.45%~40.31%之间,中等型与紧密型在花序疏密程度上的分界可能在41.58%~46.34%之间。后续还需要扩大样本范围进一步验证该方法的可靠性,以求既能大幅减少目测误差又可以准确判断花序支轴紧密度。
3 讨 论
枇杷的花序支轴紧密度是生产管理人员非常关注的农艺性状,寻找可以量化该性状的指标有着较高的研究价值。目前关于枇杷花序支轴紧密度的研究报道较少,郭乙含[6]对130株枇杷杂交群体进行调查,发现花序支轴紧密度和花序宽度显著相关;陈秀萍等[4]对210份枇杷种质资源进行了调查,发现花序为疏散型、中等型和紧密型种质的占比分别为31.43%、41.43%和27.14%。
笔者在本研究中对41 份栽培枇杷种质的花序支轴紧密度进行了调查,疏散、中等和紧密3种花序支轴紧密度的分布以中等型居多,其次是疏散型,分布结果与陈秀萍等[4]的结果一致。说明笔者在本研究中所使用枇杷群体的花序支轴紧密度分布接近总体分布,可进行可靠的花序性状的统计分析。来源地为广州和福建地区的枇杷花序以疏散型占多数,来源地为江苏地区的枇杷花序以中等型占多数,在陈秀萍等[4]对210份枇杷资源的多样性分析中,福建地区的枇杷花序大于广东和江苏地区,广东和江苏地区的枇杷花序大小差别不大;由于疏散型花序大小要显著大于中等和紧密型,可见福建地区枇杷花序更大更疏散,由于本研究来自江苏和广东的种质数量较多,结果有较高的可信度。
8个花序直测性状中,花序长度、花序宽度、花序支轴数、平均节间长度、第一分枝长度和第二分枝长度拥有较高的变异系数和多样性指数,这些性状适合用于对花序支轴紧密度的描述,陈秀萍等[4]也发现枇杷花序长度、花序宽度和花序支轴数有着较高的多样性指数,与枇杷花序类似的龙眼花序的长、宽和支轴数也具有较高的变异系数[30]。从8 个花序直测性状的相关性分析看出,花序长度、花序宽度、平均节间长度、第一分枝长度、第二分枝长度与花序支轴紧密度呈显著相关。其中花序长度与花序宽度极显著相关,与黄彪[25]研究结果相一致;花序宽度与花序支轴紧密度呈极显著相关,与郭乙含[6]研究结果相一致。
主成分分析(PCA)通常用来综合评价某一个指标,将某一指标用与其相关联的若干性状来评价[31-32]。类似的应用如枇杷种质的丰产性综合评价[24]、荔枝的矮化综合评价[33]、圆黄梨果实品质综合评价[19]等。该方法也用于关键评价指标的筛选[31-32],类似的应用如土壤属性关键指标筛选和评价[22],桑葚果实品质关键指标筛选[20]。笔者在本研究中通过主成分分析从8个直测性状中筛选出花序宽度和平均节间长度作为花序支轴紧密度核心评价指标。对种质的综合得分进行排序,发现3 种花序类型在综合得分上的分界不是十分清晰;同时也对显著相关性状进行了聚类分析,发现有两份目测为中等型的种质被归于疏散型,3 份目测为中等型的种质被归于紧密型,4 份目测为疏散型的种质被归于中等型。根据以上结果推测可能存在与花序支轴紧密度更为相关的性状。
笔者在本研究中创建花序疏密程度作为可能相关的新型性状,并选择花序支轴紧密度表型较明显的8份枇杷种质进行试验。笔者在本研究中采用旋转拍摄的方式采集枇杷花序多个侧方位图像,结合计算机程序批量处理花序图像,计算出种质花序疏密程度信息,实践证明该方法高效可靠。对这8 份种质的花序疏密程度、花序长度、花序宽度、花序支轴数、平均节间长度、第一分枝长度、第一分枝角度、第二分枝长度、第二分枝角度和花序支轴紧密度进行相关性分析,发现花序疏密程度与花序支轴紧密度的斯皮尔曼相关系数最高。对花序疏密程度以及5 个显著相关的直测性状进行主成分析,发现花序疏密程度在载荷矩阵中的权重最高,高于花序宽度,说明以花序疏密程度作为核心指标比花序宽度和平均节间长度更优。花序疏密程度和花序疏密形态相一致,在8份典型种质中可以准确区分疏散、中等和紧密3 种花序类型。笔者在本研究中初步估计,疏散型与中等型在花序疏密程度上的分界可能在36.45%~40.31%之间,中等型与紧密型在花序疏密程度上的分界可能在41.58%~46.34%之间。然而花序疏密程度是否在更多的种质中有比较稳定的表现,这方面的研究还需要进一步深入。
4 结 论
枇杷的花序支轴紧密度与花序疏密程度、花序宽度、花序长度、平均节间长度、第一分枝长度和第二分枝长度呈极显著相关,其中花序疏密程度的相关性最高;初步研究发现,花序疏密程度可以作为花序支轴紧密度的新型量化指标,区分典型的疏散、中等和紧密3种花序类型种质;此外,采用旋转拍摄和计算机程序处理的方式可以高效准确获取花序疏密程度信息。
[1] 刘国强,林志清,林文忠,赖钟雄.我国枇杷种质资源及选育种研究进展[J].亚热带植物通讯,2000,29(2):65-70.LIU Guoqiang,LIN Zhiqing,LIN Wenzhong,LAI Zhongxiong.A review of progress in study of Chinese loquat germplasm resource,selection and breeding[J]. Subtropical Plant Science,2000,29(2):65-70.
[2] 蔡礼鸿.枇杷学[M].北京:中国农业出版社,2012:14-27.CAI Lihong. Loquat science[M]. Beijing:China Agriculture Press,2012:14-27.
[3] 蒋际谋,陈秀萍,邓朝军,许奇志,郑少泉.我国枇杷产业优劣势分析与发展对策[J].中国园艺文摘,2018,34(4):46-48.JIANG Jimou,CHEN Xiuping,DENG Chaojun,XU Qizhi,ZHENG Shaoquan.Analysis and development strategy of the advantages and disadvantages of loquat industry in China[J]. Chinese Horticulture Abstracts,2018,34(4):46-48.
[4] 陈秀萍,黄爱萍,蒋际谋,林旗华,魏秀清,张小艳,许奇志,郑少泉.枇杷属植物4 个种的花序性状多样性研究[J].植物遗传资源学报,2010,11(6):709-714.CHEN Xiuping,HUANG Aiping,JIANG Jimou,LIN Qihua,WEI Xiuqing,ZHANG Xiaoyan,XU Qizhi,ZHENG Shaoquan.Diversity analysis on the flower cluster characters of four Eriobotrya plants[J]. Journal of Plant Genetic Resources,2010,11(6):709-714.
[5] 郑少泉.枇杷种质资源描述规范和数据标准[M].北京:中国农业出版社,2006:36-45.ZHENG Shaoquan.Descriptors and data standard for loquat(Eriobotrya spp.)[M]. Beijing:China Agriculture Press,2006:36-45.
[6] 郭乙含.‘宁海白’与‘大房’杂交后代性状遗传分析及果重等性状特异分子标记开发[D].广州:华南农业大学,2022.GUO Yihan.Genetic analysis of major traits for the progenies of‘Ninghaibai’and‘Dafang’and development of specific molecular markers for fruit weight[D]. Guangzhou:South China Agricultural University,2022.
[7] 邱武陵,章恢志.中国果树志·龙眼枇杷卷[M].北京:中国林业出版社,1996:137-233.QIU Wuling,ZHANG Huizhi. China fruit records:Longan·Loquat Volume[M]. Beijing:China Forestry Publishing House,1996:137-233.
[8] 王云生,林顺权.枇杷野生型与栽培型的cpDNATrnS-TrnG及cpDNATrnQ-rps16序列多态性的比较[J].园艺学报,2012,39(10):1913-1918.WANG Yunsheng,LIN Shunquan. A comparative study on the polymorphism of loci cpDNATrnS-TrnG and cpDNATrnQ-rps16 in cultivated and wild loquats[J].Acta Horticulturae Sinica,2012,39(10):1913-1918.
[9] 王永清,付燕,杨芩,罗楠,邓群仙,严娟,曾建国,阮光伦.枇杷属植物遗传多样性的ISSR 分析[J].林业科学,2010,46(4):49-57.WANG Yongqing,FU Yan,YANG Qin,LUO Nan,DENG Qunxian,YAN Juan,ZENG Jianguo,RUAN Guanglun.Genetic diversity of Eriobotrya analyzed by ISSR markers[J]. Scientia Silvae Sinicae,2010,46(4):49-57.
[10] 尹述德,王亚君,韩启成.枇杷新品种麦后黄及省工高效栽培技术[J].陕西农业科学,2012,58(1):260-261.YIN Shude,WANG Yajun,HAN Qicheng.A new loquat variety Maihou Huang and its efficient cultivation techniques[J].Shaanxi Journal of Agricultural Sciences,2012,58(1):260-261.
[11] 郄红丽,王镇,黄颖宏.苏州洞庭山枇杷品种果实主要性状的多样性分析[J].江苏农业科学,2015,43(4):182-185.QIE Hongli,WANG Zhen,HUANG Yinghong.Diversity analysis of main fruit characters of loquat varieties in Dongting Mountain,Suzhou[J].JiangsuAgricultural Sciences,2015,43(4):182-185.
[12] 白昀鹭.枇杷属植物种间杂交后代的鉴定、筛选和初步利用[D].广州:华南农业大学,2020.BAI Yunlu. Identification and screening of interspecific hybrid progenies in genus Eriobotrya plants and their preliminary utilization[D]. Guangzhou:South China Agricultural University,2020.
[13] 王琼.枇杷属植物种间杂交后代的性状分析[D].广州:华南农业大学,2018.WANG Qiong. Character analysis of hybrid progeny in genus Eriobotrya plants[D]. Guangzhou:South China Agricultural University,2018.
[14] 戴亚.枇杷属植物DUS 测试指南的研制及其种质数据库的建立[D].广州:华南农业大学,2017.DAI Ya. The developmentof Eriobotrya plants DUS test guideline and establishment of the germplasm resources database[D].Guangzhou:South China Agricultural University,2017.
[15] 李颖,张树航,郭燕,张馨方,王广鹏.211 份板栗种质资源花序表型多样性和聚类分析[J]. 中国农业科学,2020,53(22):4667-4682.LI Ying,ZHANG Shuhang,GUO Yan,ZHANG Xinfang,WANG Guangpeng. Catkin phenotypic diversity and cluster analysis of 211 Chinese chestnut germplasms[J]. Scientia Agricultura Sinica,2020,53(22):4667-4682.
[16] 张伟锋.斯皮尔曼简捷相关系数与基尼伽玛相关系数的统计特性分析[D].广州:广东工业大学,2020.ZHANG Weifeng. Statistical analysis of Spearman’s footrule and gini’s gamma[D]. Guangzhou:Guangdong University of Technology,2020.
[17] 魏泽辉,郑惠玲,贾存灵.动物试验中多重比较方法的选择[J].中国家禽,2018,40(24):1-6.WEI Zehui,ZHENG Huiling,JIA Cunling. How to choose the methods of multiple comparison for data of animal experiment[J]. China Poultry,2018,40(24):1-6.
[18] 胡纯严,胡良平.如何正确运用方差分析:多个均值之间的多重比较[J].四川精神卫生,2022,35(1):21-25.HU Chunyan,HU Liangping.How to use analysis of variance correctly:The multiple comparisons among the multiple means[J].Sichuan Mental Health,2022,35(1):21-25.
[19] 严鑫,吴巨友,贡鑫,焦玉茹,袁凯莉,鲁彬,王苗苗,陶书田,王然,张绍铃. 不同产地圆黄梨果实品质差异分析[J]. 果树学报,2021,38(12):2082-2090.YAN Xin,WU Juyou,GONG Xin,JIAO Yuru,YUAN Kaili,LU Bin,WANG Miaomiao,TAO Shutian,WANG Ran,ZHANG Shaoling. Analysis of fruit quality of Wonhwang pear from different regions[J].Journal of Fruit Science,2021,38(12):2082-2090.
[20] 李勋兰,魏召新,彭芳芳,罗友进,韩国辉.35 份果桑资源果实品质分析与综合评价[J].果树学报,2022,39(3):332-342.LI Xunlan,WEI Zhaoxin,PENG Fangfang,LUO Youjin,HAN Guohui. Fruit quality analysis and comprehensive evaluation of 35 mulberry accessions[J]. Journal of Fruit Science,2022,39(3):332-342.
[21] KAISER H F.A second generation little jiffy[J].Psychometrika,1970,35(4):401-415.
[22] KUMAR U,MISHRA V N,KUMAR N,SRIVASTAVA L K,TEDIA K,BAJPAI R K,SINGH M,MOHANTY M.Assessing soil quality and their indicators for long-term rice-based cropping systems in hot sub-humid eco-region of India[J]. Soil Research,2022,60(6):610-623.
[23] KAISER H F. The application of electronic computers to factor analysis[J]. Educational and Psychological Measurement,1960,20(1):141-151.
[24] 陈秀萍.普通枇杷[Eriobotrya japonica(Thunb.)Lindl.]植物若干性状鉴定与分类研究[D].北京:中国农业科学院,2010.CHEN Xiuping. Identification and classification of some traits of loquat[Eriobotrya japonica(Thunb.)Lindl.][D].Beijing:Chinese Academy of Agricultural Sciences,2010.
[25] 黄彪. 枇杷品种DUS 测试指南的研制及其相关研究[D]. 广州:华南农业大学,2011.HUANG Biao.Development of DUS test guide for loquat varieties and its related research[D].Guangzhou:South China Agricultural University,2011.
[26] 刘龙昌.桂花品种分子标记和综合分类研究[D].南京:南京林业大学,2003.LIU Longchang. Study on molecular markers and comprehensive classification of Osmanthus fragrans varieties[D].Nanjing:Nanjing Forestry University,2003.
[27] 盖钧镒.试验统计方法·第4 版[M].北京:中国农业出版社,2016:44.GAI Junyi. Statistics for experiments 4th edition[M]. Beijing:China Agriculture Press,2016:44.
[28] 朱锦迪,韦新良,汤孟平,杨晶晶,张继艳.林分树种组成多样性指数的构建[J].浙江农林大学学报,2022,39(2):262-271.ZHU Jindi,WEI Xinliang,TANG Mengping,YANG Jingjing,ZHANG Jiyan. Construction of diversity index of tree species composition[J]. Journal of Zhejiang A& F University,2022,39(2):262-271.
[29] 钱迎倩,马克平.生物多样性研究的原理与方法[M].北京:中国科学技术出版社,1994:141-166.QIAN Yingqian,MA Keping. Principles and methods of biodiversity research[M]. Beijing:China Science and Technology Press,1994:141-166.
[30] 黄爱萍,陈秀萍,郑少泉,邓朝军,胡文舜,章希娟,骆键夫,陈秀妹,许奇志.龙眼种质资源花序性状多样性研究[J].福建农业学报,2010,25(2):201-206.HUANG Aiping,CHEN Xiuping,ZHENG Shaoquan,DENG Chaojun,HU Wenshun,ZHANG Xijuan,LUO Jianfu,CHEN Xiumei,XU Qizhi. Inflorescence trait diversity of longan germplasm[J]. Fujian Journal of Agricultural Sciences,2010,25(2):201-206.
[31] GUILLÉN- CASLA V,ROSALES- CONRADO N,LEÓNGONZÁLEZ M E,PÉREZ-ARRIBAS L V,POLO-DÍEZ L M.Principal component analysis (PCA) and multiple linear regression(MLR)statistical tools to evaluate the effect of E-beam irradiation on ready-to-eat food[J]. Journal of Food Composition and Analysis,2011,24(3):456-464.
[32] VAINIONPÄÄ J,SMOLANDER M,ALAKOMI H L,RITVANEN T,RAJAMÄKI T,ROKKA M,AHVENAINEN R.Comparison of different analytical methods in the monitoring of the quality of modified atmosphere packaged broiler chicken cuts using principal component analysis[J]. Journal of Food Engineering,2004,65(2):273-280.
[33] 胡福初.荔枝矮化性状的鉴定评价与遗传研究[D].广州:华南农业大学,2019.HU Fuchu. Identification,evaluation and genetic study on dwarf traits in Litchi chinensis Sonn.[D].Guangzhou:South China Agricultural University,2019.