砂糖橘(Citrus reticulata Blanco‘Shatangju’)是我国南方地区的主栽柑橘品种,仅广东、广西种植面积就达到16.67 万hm2,年产量约250 万t,是华南地区山区农民增收的重要树种,在乡村产业振兴方面具有重要的经济社会价值[1]。砂糖橘主要种植于南方山地、丘陵等干旱缺水地带,干旱胁迫是影响砂糖橘生长发育、果实品质、高产稳产的重要因素,如何降低干旱对柑橘的胁迫作用是生产中亟待解决的问题[2]。柑橘抗旱品种选育及推广是防止干旱胁迫最经济有效的措施,因此揭示柑橘干旱胁迫生理机制并克隆相关抗性基因,对砂糖橘抗旱品种选育具有重要意义[3]。
多胺(polyamines,PAs)是一类具有生物活性的低分子脂肪族含氮碱,参与柑橘植物胚胎发生、根系形态建成、芽形成及植株生长、成花及开花调控、果实形成及发育、气孔闭合及气体交换、光合作用及叶绿素荧光现象等诸多生长发育和生理过程[4]。植物PAs 主要以二胺的腐胺(putrescine,Put)、三胺的亚精胺(spermidine,Spd)以及四胺的精胺(spermine,Spm)形式存在。在PAs 合成过程中,首先通过3 种精氨酸代谢途径来合成Put,第一种途径植物会通过精氨酸脱羧酶(arginine decarboxylase,ADC)催化的精氨酸脱羧产生胍基丁胺,然后在胍基丁胺脱氨酶和N-氨基甲酰腐胺酰胺水解酶连续催化下形成Put;第二种途径是精氨酸能在ADC 催化下直接合成Put,或者胍基丁胺在胍基丁胺脲水解酶作用下合成Put;第三种途径主要存在于动物和真菌中,精氨酸被线粒体中的精氨酸酶催化为鸟氨酸,然后在鸟氨酸脱羧酶作用下转变成Put。Spd、Spm 合成则需要借助甲硫氨酸代谢途径,L-甲硫氨酸在S-腺苷甲硫氨酸合成酶以及脱羧酶的催化下生成脱羧S-腺苷甲硫氨酸(decarboxylated S-adenosylmethionime,dc-SAM),然后在亚精胺合成酶(spermidine synthase,SPDS)催化作用下,Put 接受dcSAM 提供的一个氨丙基生成Spd;最后在精胺合成酶(spermine synthase,SPMS)催化下,Spd接受一个氨丙基后转变为四胺的Spm[4]。前人研究表明多胺与植物抗旱性状密切相关,Yang等[5]发现水稻能通过增强叶片的PAs生物合成来维持细胞渗透压,从而适应干旱胁迫。Shi 等[6]研究报道了PAs 能通过调控叶片的气孔闭合,抑制叶片水分和电解质流失,从而缓解干旱胁迫。Yao 等[7-8]研究发现外喷PAs 能增加黎檬(C.li-monia)的根长、根系表面积、根体积和根尖数,促进根系吸水,缓解干旱胁迫。在植物PAs合成过程中,Spd、Spm 是以Put 为底物进一步合成,而ADC 是植物通过精氨酸代谢途径合成Put 的第一关键限速酶,因此克隆植物ADC 基因对研究PAs 合成调控及干旱胁迫生理机制具有重要意义。
目前在葡萄[9]、枳[10]、甜橙[11]、桃树[12]、杜梨[13]等果树中已分离并克隆了ADC基因,上述果树ADC基因不含内含子结构,其开放阅读框(ORF)介于2178~2262 bp之间,编码720~753个氨基酸。但关于砂糖橘CrADC 的基因克隆以及表达与功能分析等研究尚未见报道。笔者在本研究中以砂糖橘为材料,成功克隆得到CrADC基因并进行生物信息学分析,通过实时荧光定量PCR 检测不同组织中和干旱胁迫处理下该基因的表达量,并通过稳定遗传转化烟草对该基因进行功能验证,以期为CrADC 基因参与PAs 生理调控的分子机制提供基础,并为砂糖橘抗旱分子育种提供候选基因。
1 材料和方法
1.1 试验材料
供试材料为广东地区种植的砂糖橘品种,由肇庆市四会果园提供。选择6 年生砂糖橘植株并参照唐文武等[14]的方法获取春梢期嫩叶、越冬期老叶、花芽期花苞、30 d 幼果果肉以及30 d 幼果果皮,置于-80 ℃冰箱保存后提取总RNA,用于不同组织的基因表达分析。选用6 年生砂糖橘的新发秋梢,于10%PEG-6000溶液中模拟干旱胁迫处理,处理时间分别为0、3、6、9、12、24 和36 h,3 次重复,每个处理所采叶片置于液氮速冻后提取总RNA,用于干旱胁迫下的CrADC基因表达特征分析。
1.2 主要试剂
柱式植物RNAout 2.0 试剂盒购自北京天恩泽基因科技有限公司,M-MLV 反转录试剂盒购自美国Life technology 公司,TaKaRa LA Taq®酶、各种限制性内切酶、T4 DNA 连接酶、凝胶回收试剂盒Gel DNA Extraction Kit Ver.4.0 以及载体构建的In-Fusion®HD Cloning Kit 等试剂盒均购自TaKaRa 公司(日本),SYBRTM Green Ⅰ核酸荧光染料购自ThermoFisher 公司,大肠杆菌DH5α 感受态细胞、农杆菌GV3101 感受态细胞、克隆载体pMD19-T 和植物表达载体pBI121 均由笔者课题实验室保存提供。主要设备仪器:ABI 7500荧光定量PCR仪(美国ThermoFisher 公司)、T100 PCR 仪(美国Bio-Rad 公司)、GelDoc XR+凝胶成像系统(美国Bio-Rad公司)。
1.3 砂糖橘CrADC基因克隆
1.3.1 叶片总RNA 提取及cDNA 第一链的合成取6 年生砂糖橘果树的嫩叶,按照柱式植物RNAout试剂盒说明提取叶片总RNA,按照M-MLV 反转录试剂盒操作步骤合成cDNA第一链。
1.3.2 引物序列设计及PCR扩增 根据柑橘泛基因组育种数据库(http://citrus.hzau.edu.cn)公布的甜橙(C.sinesisi)v3.0版ADC基因序列(Gene ID:Cs_ont_8g020080),设计并筛选到1 对PCR 引物(CrADC-F/CrADC-R),其引物序列见表1。以反转录合成的cDNA 为模板扩增砂糖橘CrADC 基因的cDNA 序列,PCR 反应体系50.0 μL,包括0.5 μL LA Taq,5.0 μL 10×PCR buffer,2 μL dNTP(2.5 mmol·L-1),CrADCF 和CrADC-R(10 μmol·L-1)各1.0 μL,2.0 μL cDNA(100 ng),加ddH2O 补充至50 μL。PCR 反应程序:94 ℃预变性4 min;设置30 个循环,94 ℃30 s,55 ℃45 s,72 ℃60 s;最后72 ℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳后,用DNA 凝胶回收试剂盒回收纯化目的片段。
表1 所用引物序列及用途
Table 1 The primers sequence and application

引物名称Primer name CrADC-F CrADC-R QCrADC-F QCr ADC-R ACTB-F ACTB-R TranADC-F TranADC-R TranPCR-F TranPCR-R Q-actin-F Q-actin-R引物序列(5’→3’)Primer sequence(5’→3’)CTCACTCTCCTCTCATTTCCCTC GGCCCTACACGGGATCTAAAT CCGTAGCGCCTCCTGCCTACGCCA GTAGGGCGCACCCCAGGAGTCGAT CCAATTCTCTCTTGAACCTGTCCTT TGACTGATGAGAACTGCCAGAAG CGGGATCCATGCCGGCCCTTGGGTGTTGCG CGGAGCTCAGCATAGCAGTATGACCACTGC TTGAAGATGCCTCTGCCGACAGT GCCGGACGATAAGAGGGAGCTGC CTGGCATTGCAGATCGTATGA GCGCCACCACCTTGATCTT引物用途Application基因克隆Gene cloning qRT-PCR柑橘内参引物Reference primer of Citrus表达载体构建Construction of expression vector转基因检测Transgenic test烟草内参引物Reference primer of tobacco
1.3.3 CrADC基因测序 以pMD19-T为克隆载体,将目的基因CrADC与克隆载体连接后,转化到感受态细胞DH5α 中,经涂板、培养、质粒DNA 提取及PCR鉴定后,送上海生工公司进行测序。
1.4 序列分析及系统进化分析
利用Prot Param进行目标基因编码的蛋白质基本理化性质预测,利用Prot Scale 进行亲疏水性分析,利用SOPMA、Predict Protein 预测其二级结构,利用SMART对其功能结构域进行分析,利用DNAMAN 和MEGA7 软件进行蛋白序列多重比较和系统进化树分析。
1.5 CrADC基因表达分析
利用qPCR检测CrADC基因在不同组织及干旱胁迫下的转录表达量,嫩叶、老叶、花、果皮、果肉等样品总RNA 提取及cDNA 合成参照试剂盒的方法。根据CrADC基因序列,设计并筛选了1对特异性引物(QCrADC-F/QCrADC-R,表1),以柑橘ACTB 基因作为内参基因[15]。扩增反应采用SYBR Green Ⅰ染料法在ABI 7500 实时定量PCR 仪上进行,设置3 次生物学重复,数据分析采用2-△△CT法计算[16]。
1.6 植物表达载体构建与烟草遗传转化
设计含有BamHⅠ和SacⅠ酶切位点的引物TranADC-F/TranADC-R(表1),然 后PCR 扩 增CrADC基因。利用BamHⅠ和Sac Ⅰ双酶切pBI121空 载 体,采 用In-Fusion® HD Cloning Kit 法,将CrADC 基因连接到pBI121 载体,转化后经PCR 及测序鉴定,获得重组pBI121-CrADC 植物表达载体。制备根癌农杆菌GV3101感受态细胞并经冻融法转化重组载体,然后采用农杆菌介导的叶盘法转化烟草[17],经浸染、共培养、抗性芽筛选、生根培养及分子鉴定获得转CrADC 基因烟草植株。以烟草βactin 为内参基因[18],利用实时荧光qPCR 检测CrADC基因在转基因植株中的表达情况。
1.7 转基因烟草抗旱性鉴定
选取转基因烟草后代中CrADC 基因表达量高的T3纯合株系,以及对照普通烟草种子。上述种子播种出苗后,移至植物培养箱在24 ℃、70%湿度、16 h光照下正常浇水种植30 d 后,停止浇水20 d 进行干旱胁迫处理。取转基因和对照烟草的叶片,参照李合生[19]方法测定干旱胁迫后的叶片电导率、丙二醛(MDA)含量,以及过氧化氢酶(CAT)和超氧化物歧化酶(SOD)等抗氧化酶活性。参照Wu 等[20]方法取正常生长30 d的烟草叶片称质量,然后置于25 ℃恒温培养箱中自然脱水,分别于15、30、60、90、120 min 后称质量,测定自然脱水后的叶片失水率。上述试验均3 次重复,利用SPSS 软件进行LSD检验。
2 结果与分析
2.1 CrADC基因克隆及序列测定
以砂糖橘嫩叶总RNA 反转录得到的cDNA 为模板,利用CrADC-F/QCrADC-R引物扩增后得到一条约3.0 kb 特异条带(图1)。该扩增条带经回收纯化后进行基因测序,结果显示,砂糖橘CrADC 基因cDNA序列全长为3076 bp,含有1个2262 bp的开放阅读框(ORF),编码753个氨基酸(图2)。
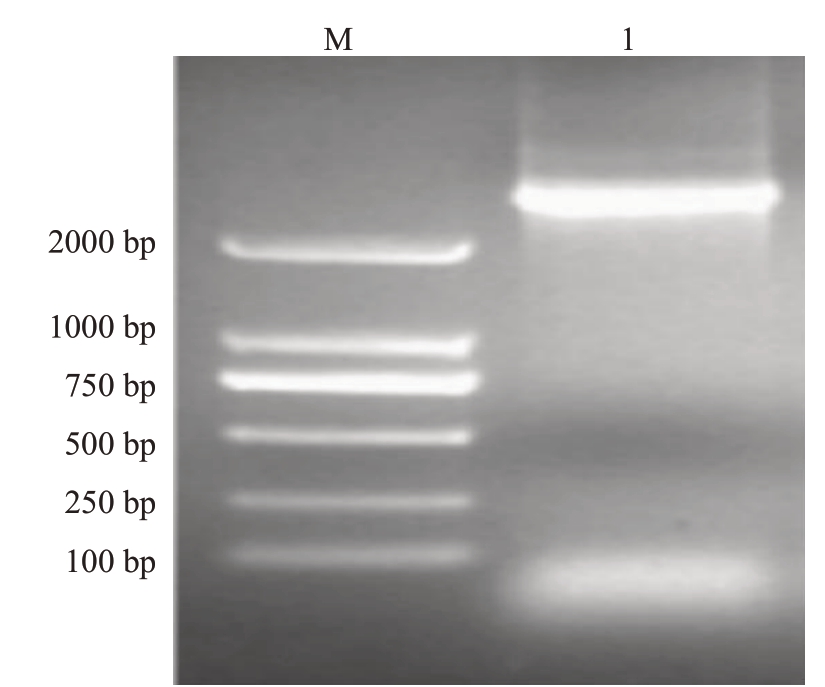
图1 砂糖橘CrADC 基因的PCR 扩增结果
Fig.1 PCR amplification of CrADC from Shatangju
M.DL2000 DNA Marker;1.CrADC.

图2 砂糖橘CrADC 基因序列及其氨基酸序列
Fig.2 Sequence of cDNA and Protein of CrADC of Shatangju
2.2 CrADC蛋白序列比对
利用Prot Param 分析的结果表明,CrADC 蛋白相对分子质量为80.84 ku,理论等电点为5.13,不稳定系数为40.98。Prot Scale 的疏水性分析表明,该蛋白第203位氨基酸疏水性最高,为2.567,第743位疏水性最低,为-2.689,平均亲水性系数为-0.009,属于不稳定亲水性蛋白。SOPMA 二级结构预测显示(图3-A),该蛋白二级结构以α-螺旋和无规则卷曲为主,分别占41.30%和37.45%,β-转角仅6.61%,扩展束占14.61%。TMHMM 跨膜区分析表明该蛋白不含跨膜结构域(图3-B),属于非跨膜蛋白。SMART 预测显示该蛋白的139~414 区域为吡哆醛结合域Orn_Arg_deC_N(图3-C),与精氨酸脱羧酶功能密切相关[21]。
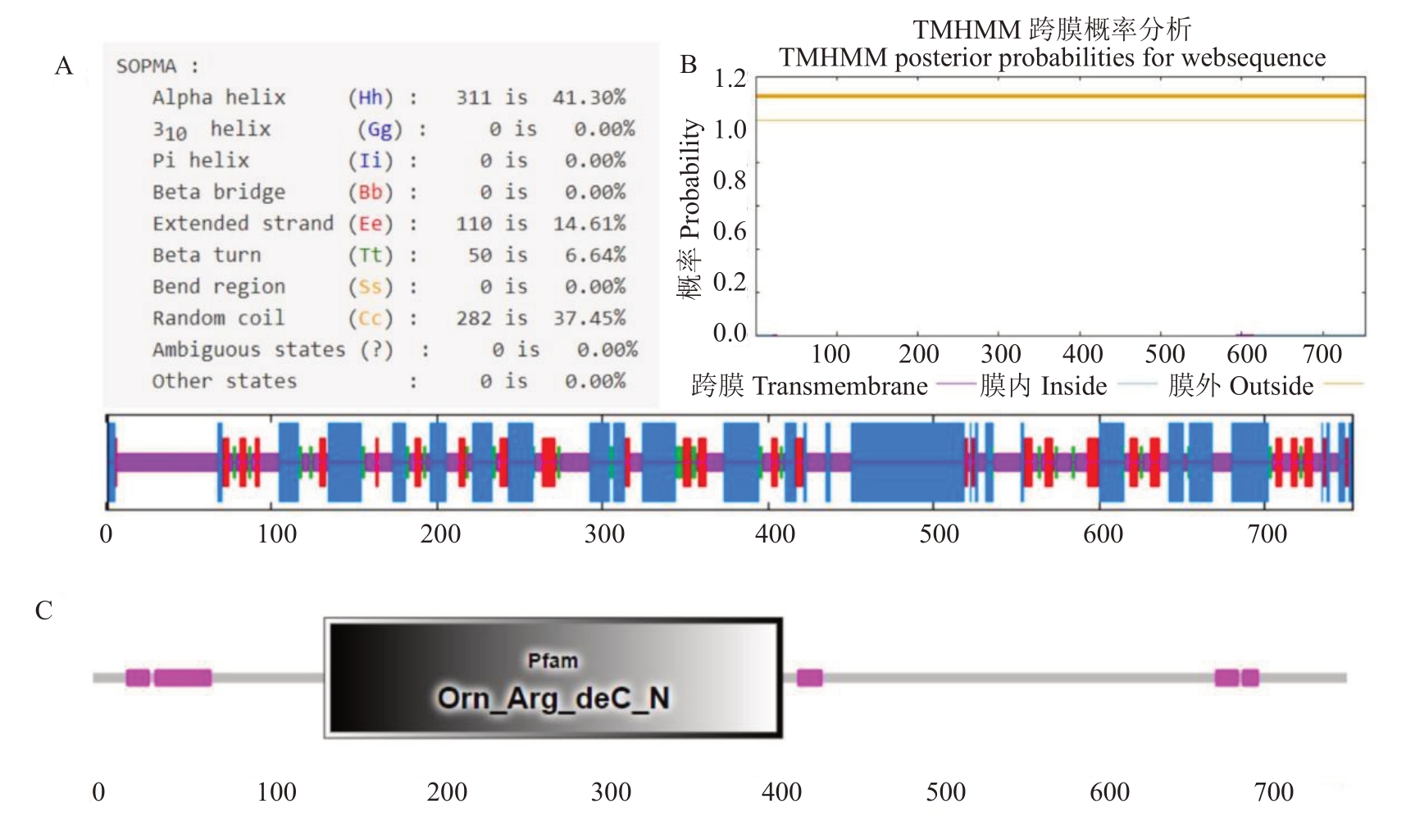
图3 砂糖橘CrADC 蛋白的生物信息学分析
Fig.3 Bioinformatics analysis of CrADC protein in Shatangju
A.蛋白二级结构;B.蛋白跨膜结构域;C.蛋白结构域。
A.The secondary structure of the protein;B.Ransmembrane domain of the protein;C.Analysis result of the protein domain.
为分析果树ADC基因间进化关系,从NCBI数据库中选取15种果树ADC蛋白与CrADC进行序列比对分析。双序列比对表明砂糖橘CrADC与甜橙(C.sinensis,XP_006487299.2)、克里曼丁橘(C.clementina,XP 006423501.1)、枳(C. trifoliata,AEE99192.1)的ADC蛋白序列高度相似,序列一致性超过96.5%,与香蕉(Musa acuminata,XP_009393201.1)ADC 蛋白序列一致性最低(62.0%)。多序列比对(图4)显示,16 种果树的ADC 蛋白序列相似性较高,均包含一个完整的吡哆醛结合域Orn_Arg_deC_N,该结构域的氨基酸序列高度保守,表明果树进化过程中ADC蛋白作为关键酶促蛋白,氨基酸序列较保守。

图4 砂糖橘CrADC 与其他果树ADC 蛋白多序列比对结果
Fig.4 Multiple alignment of Shatangju CrADC and other fruit tree ADC proteins
下划线部分为吡哆醛结合域Orn_Arg_deC_N。
The underlined part was the pyridoxal binding domain Orn_Arg_deC_N.
2.3 CrADC蛋白进化分析
系统进化分析(图5)显示,16种果树的ADC蛋白聚为三类。其中芸香科柑橘属的甜橙、克里曼丁橘、枳、砂糖橘,以及杧果(Mangifera indica,XP_044488993.1)、番木瓜(Carica papaya,XP_021889268.1)6 种果树ADC蛋白聚为一类,是主要起源于亚热带或热带地区的果树,处于同一进化分支。蔷薇科的甜樱桃(Prunus avium,XP_021806331.1)、桃(Prunus persica,XP_007200307.1)、李(Prunus dulcis,XP_034226752.1)、苹果(Malus domestica,XP_008358425.2),以及葡萄科的葡萄(Vitis riparia,XP_034681234.1)、鼠李科的枣(Ziziphus jujuba,XP_015892431.2)等果树ADC蛋白聚为一类,是主要起源于温带地区的落叶型果树,处于同一进化分支。芭蕉科的香蕉(Musa acuminata,XP_009393201.1)与杜鹃花科的蓝莓(Vaccinium darrowii,KAH7835244.1)与其他ADC 蛋白差异较大,被聚为一类。
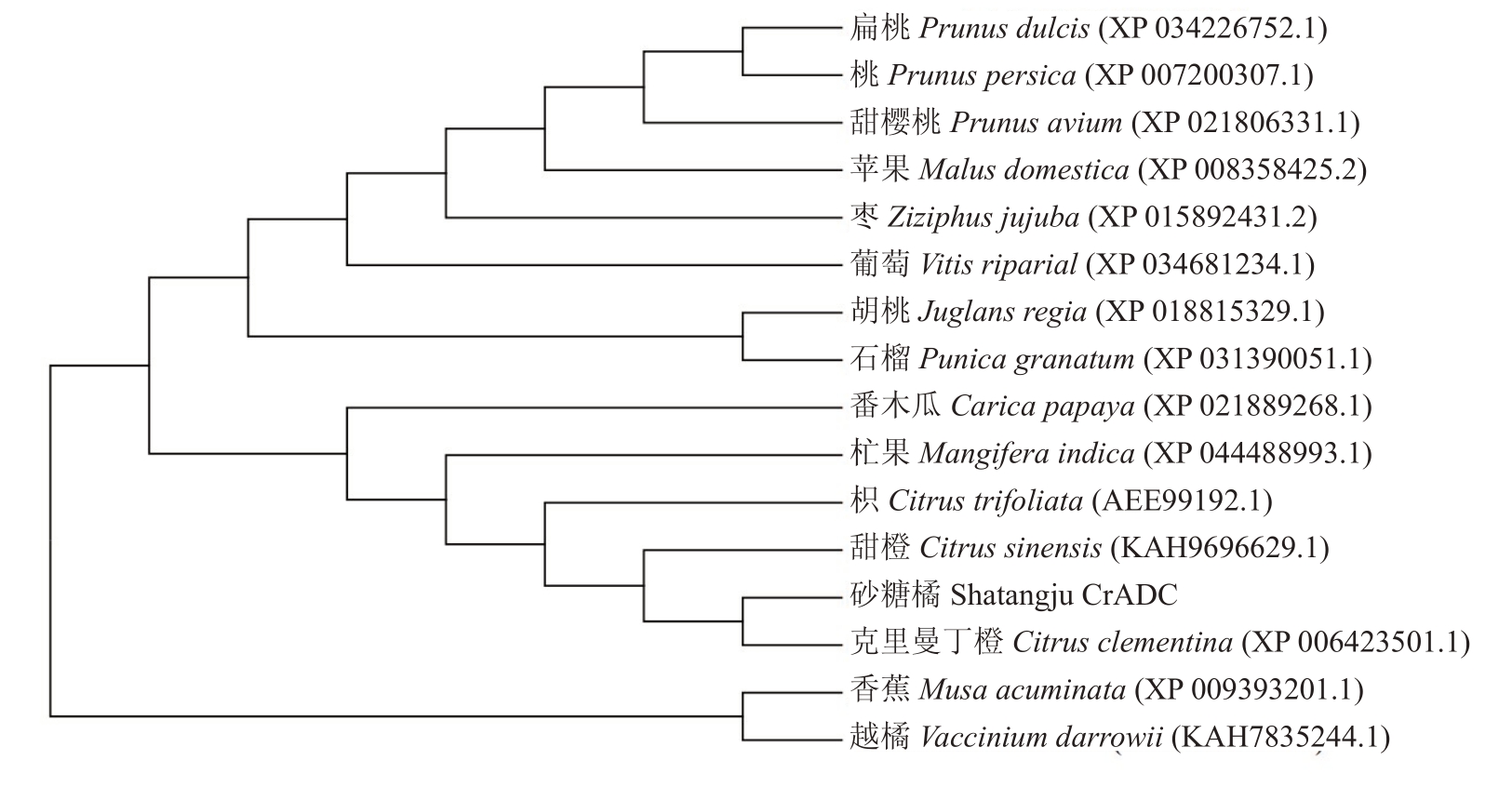
图5 16 种果树ADC 蛋白的系统进化树
Fig.5 Phylogenetic tree of ADC proteins from 16 fruit trees species
2.4 砂糖橘CrADC基因表达分析
对砂糖橘不同组织CrADC 基因的qPCR 结果(图6)显示,CrADC基因在砂糖橘春梢期嫩叶、越冬期老叶、花、30 d幼果果皮和30 d幼果果肉等组织中均有表达,且除嫩叶与花外,其他组织间基因表达差异均达到显著水平。以30 d 幼果果皮的表达量最高,其次是嫩叶和花,老叶中基因表达量最低。进一步比较发现,30 d幼果果皮表达量是果肉的3.18倍,春梢期嫩叶表达量是越冬期老叶的3.41 倍,表明CrADC基因在叶片生长的不同时期,以及果实不同部位的基因表达量具有显著差异,表现出基因表达的时空特异性,这可能与CrADC基因参与的生理调控功能或多胺区域化分布差异有关。

图6 CrADC 基因在砂糖橘不同组织中的表达水平
Fig.6 Expression level of CrADC in different tissues of Shatangju
不同字母表示不同组织间的差异显著(p<0.05)。
Different lowercase letters indicate significant differences between tissues(p<0.05).
为研究CrADC基因在干旱胁迫时的表达特征,利用10%的PEG-6000 溶液来模拟干旱胁迫环境。剪取6 年生新发秋梢进行干旱胁迫处理,并于3、6、9、12、24、36 h提取叶片总RNA进行相对定量qPCR分析,以0 h 为对照。试验结果(图7)显示,随着干旱胁迫时间的延长,CrADC 基因表达量也相应上升,并在处理24 h 时达到最高,其表达量是0 h 对照的3.82 倍。当干旱胁迫继续延长后,其基因表达量开始下降,处理36 h 时表达量仅为最高24 h 时的59.5%。该结果表明,砂糖橘在干旱胁迫24 h内,可显著提高CrADC基因的表达量,推测该基因的高表达将促进腐胺等PAs 的合成来适应干旱胁迫,上述推测还有待于进一步试验验证。
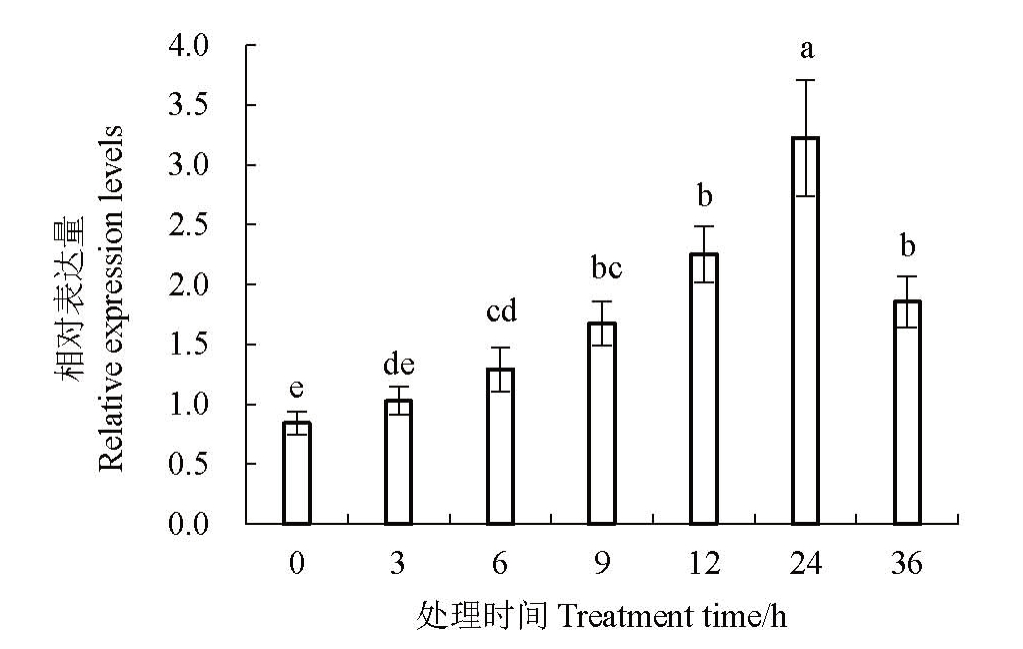
图7 干旱胁迫处理的砂糖橘CrADC 基因表达水平
Fig.7 Expression level of CrADC of Shatangju under drought stress
不同字母表示不同处理间的差异显著(p<0.05)。
Different lowercase letters indicate significant differences between treatments(p<0.05).
2.5 CrADC基因转化烟草研究
将含有pBI121-CrADC 重组质粒的农杆菌GV3101,通过叶盘法转化烟草,经Kan 抗性筛选后获得25 个转基因抗性植株。利用扩增片段包括载体与目的基因序列的特异性引物TranPCR-F/Tran-PCR-R进行PCR检测,结果发现18株转基因抗性植株中检测到特异性条带(图8),表明CrADC 基因已整合到烟草基因组中。
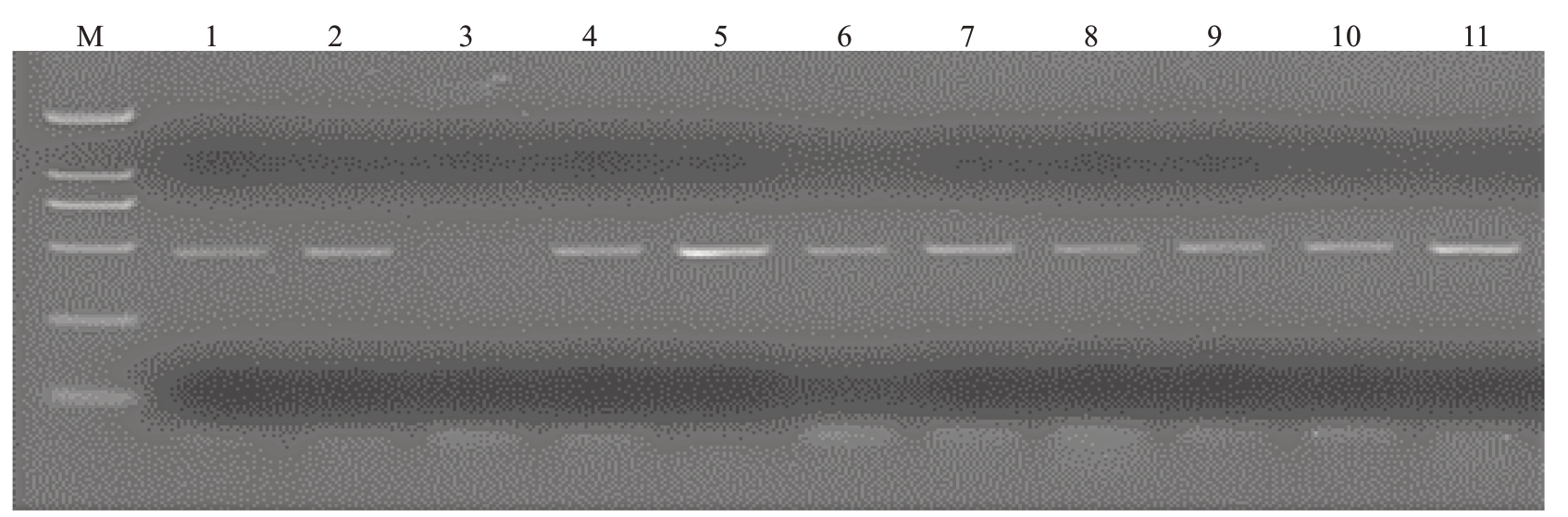
图8 部分转CrADC 基因烟草植株的PCR 结果
Fig.8 PCR results of transgenic tobacco plants with CrADC gene
M.Marker DL2000;1.阳性对照(含pBI121-CrADC 质粒的GV3101 农杆菌);3.阴性对照(非转基因烟草);2,4~10.转CrADC 基因抗性植株。
M. Marker DL2000; 1. Positive control (Agrobacterium GV3101 with pBI121-CrADC plasmid); 3. Negative control (Non-transgenic tobacco plant);2,4-10.Transgenic tobacco plants with CrADC.
为了检测CrADC 基因在转基因烟草中的表达情况,分别提取转基因烟草和对照非转基因烟草的根、茎、叶组织总RNA,经反转录cDNA 后进行qPCR 实验,以烟草actin 为内参基因。结果显示(图9),CrADC基因在转基因烟草的根、茎、叶组织中均能表达,以烟草嫩叶中表达量最高,其次为根系,茎组织表达量最低,而非转基因对照的组织中未检测到该基因表达水平。
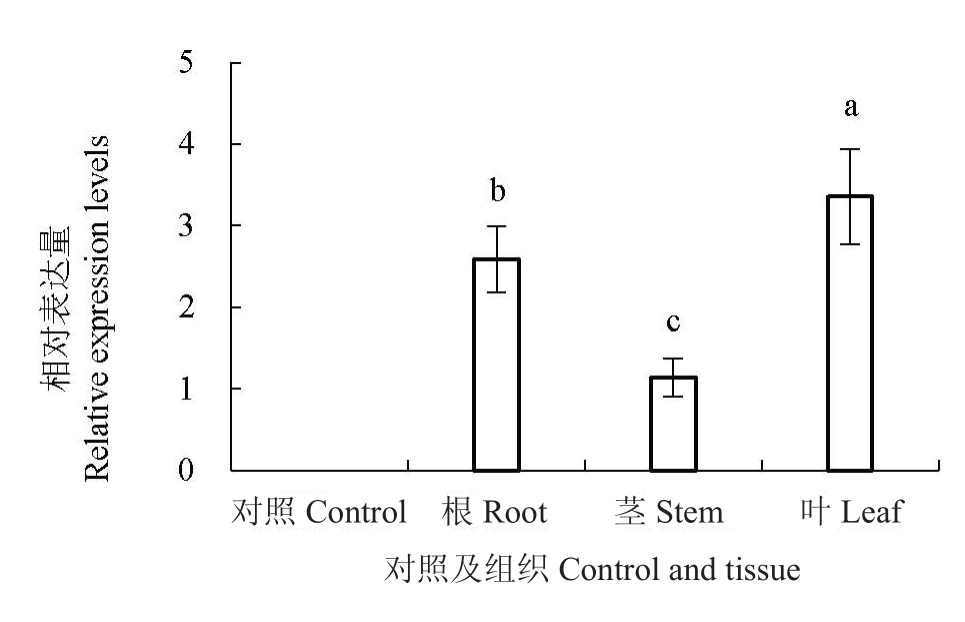
图9 CrADC 基因在转基因烟草植株中的表达水平
Fig.9 Expression level of CrADC gene in transgenic plants
对照为非转基因烟草,其他为转基因烟草的根、茎、叶组织,不同字母表示不同组织间的差异显著(p<0.05)。
Control was non-transgenic tobacco; plant, root, stem and leaf were transgenic tobacco, different lowercase letters indicate significant differences between tissues(p<0.05).
2.6 转基因烟草抗旱性分析
对上述转基因T0代植株,进行续代、筛选鉴定后获得一批T3代纯合株系。对T3代纯合株系进行表达分析,筛选出1个CrADC基因表达量最高的株系11-2a开展抗旱性分析。选取该转基因株系和对照烟草正常生长30 d后,剪取叶片进行自然脱水处理后,并于不同时间段取样测定失水率,结果见图10。由图10可知,在120 min内转基因系的失水率在不同时间段都低于对照普通烟草。该结果表明CrADC基因在烟草中超表达后,表现出明显的抗脱水性。
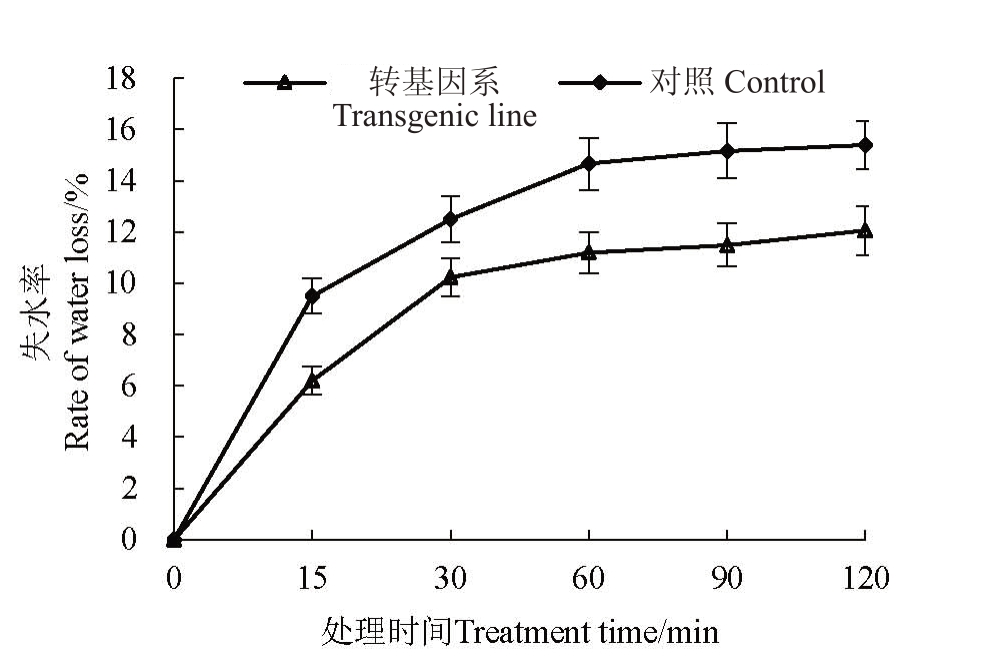
图10 转基因系及对照烟草的失水率
Fig.10 Rates of water loss in transgenic tobacco lines and control
对照为普通烟草,转基因系为超表达的转CrADC 株系11-2a。
Control was non-transgenic tobacco, transgenic line was over expressed transgenic lines 11-2a.
进一步对转基因系和对照烟草进行20 d的干旱胁迫处理,并分别测定衡量细胞膜通透性的电导率、丙二醛含量指标,以及清除过氧化氢、活性氧的抗氧化酶活性,相关结果见图11。由图11-A~B可知,转基因系的电导率和丙二醛含量均低于对照普通烟草,两者间差异分别达到显著和极显著水平,表明超表达CrADC的转基因系能降低叶片细胞膜通透性,从而表现出较高的抗旱性。由图11-C~D可知,转基因系的CAT酶和SOD酶活性均高于对照烟草,两者间差异均达到极显著水平,表明在干旱胁迫后,转基因系提高了叶片的抗氧化酶活性,更能有效清除体内活性氧,避免转基因植株的生理损伤,从而表现较强的抗旱性。
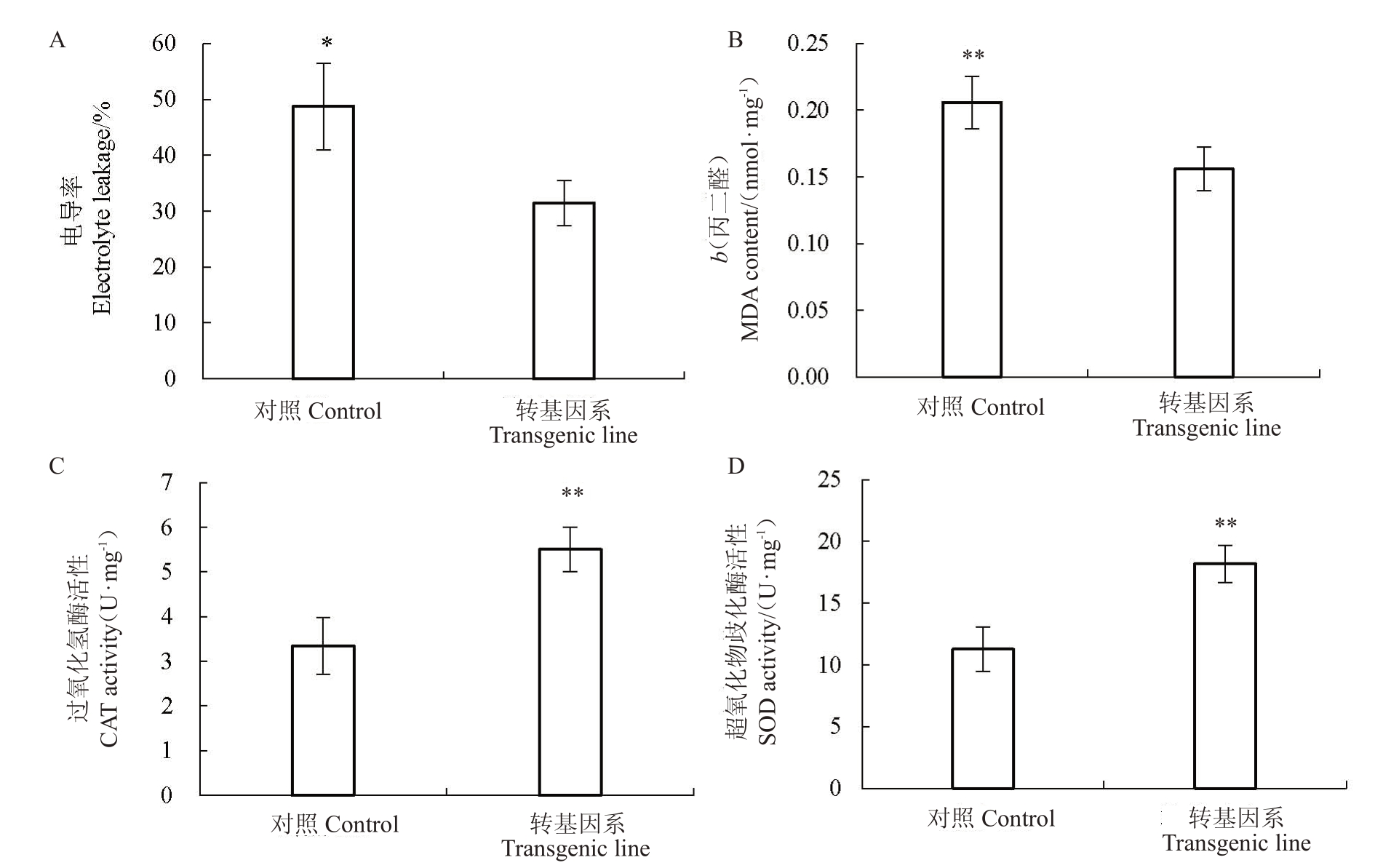
图11 干旱胁迫下转基因系及对照烟草的抗旱生理指标
Fig.11 Drought resistance traits in transgenic tobacco lines and control under drought stress
对照为普通烟草,转基因系为超表达的转CrADC 株系11-2a。**和*分别表示两者间差异达到极显著(p<0.01)和显著水平(p<0.05)。
The control was non-transgenic tobacco,transgenic line was over-expressed transgenic lines 11-2a.The asterisks on the bars indicate a value that is significant differences(**,p<0.01;*,p<0.05).
3 讨 论
PAs 是生物体普遍存在的一类低分子脂肪族含氮碱,在柑橘属植物的细胞分化、根系建成、成花过程、果实发育、气孔调节和气体交换等生理代谢活动中发挥重要作用[4]。ADC 作为PAs 生物合成途径中的第一个关键限速酶,能通过调控PAs合成速率来调节植物代谢活动,降低逆境胁迫对植物生长的不利影响[22]。目前在柑橘属PAs 合成途径的相关基因中,仅报道了甜橙(C.sinensis)Cs-SAMDC[23]、砂糖橘CsSAMDC[14],以及枳(C.trifo-liata)PtADC[10]的基因克隆相关研究,柑橘属广泛栽培的其他柑、橘、橙、柚等物种的ADC基因克隆及相关功能研究尚未报道。本研究克隆了砂糖橘CrADC 基因,与Wang 等[10]报道的枳PtADC(AEE99192.1)的氨基酸序列一致性为96.5%,均含有一个序列高度保守的吡哆醛结合域Orn_Arg_deC_N(PF02784),与精氨酸脱羧酶功能密切相关[21]。对16种果树ADC蛋白进化分析显示,起源于温带的苹果、李、枣、葡萄等8种落叶果树为一个进化分支,起源于热带或亚热带的柑橘、杧果、番木瓜等6种果树属于另一分支。表明在果树进化过程中ADC 蛋白作为关键酶促蛋白,氨基酸序列较为保守。
前人研究发现,果树ADC 基因在植物根、茎、叶、果实等多个组织中均能表达,在杜梨的叶片中表达量最高,而在枳的果皮中表达量最高,在一定脱水时间内果树ADC基因相对表达量会上升[10,13]。本研究CrADC 基因在砂糖橘的叶、花、果等组织中均有表达,以30 d幼果果皮的表达量最高。在干旱胁迫的24 h内,CrADC基因表达量随时间延长也相应稳步上升,与枳[10]、桃树[12]、杜梨[13]等果树在脱水环境下的ADC基因表达特征基本相似。Miller等[24]报道干旱胁迫会诱导植株体内活性氧积累,从而造成细胞膜损伤。PAs作为渗透调节剂具有保护酶活性和降低丙二醛含量,清除体内活性氧自由基,增强植物的抗干旱胁迫能力的功能[25]。Shi 等[6]和Zhang 等[26]研究发现干旱或脱水会导致植物叶片气孔保卫细胞中的PAs浓度上升,而天然PAs会强烈抑制气孔开放、诱导气孔关闭,植物气孔关闭能减少水分蒸发及电解质流失,从而保持植株在干旱环境下正常生长。在根系建成中,PAs 能充当细胞增殖分化等激素的第二信使,通过控制生长素/细胞分裂素的比率,从而诱导根系发育[27]。Yao 等[7-8]发现外施PAs 能增加黎檬(C.limonia)的根长、根系表面积、根体积和根尖数,增强根系吸水能力,缓解干旱胁迫。本研究中,筛选出的转CrADC 基因烟草在自然脱水处理后,其叶片相较于对照烟草表现出明显的抗脱水性。在20 d干旱胁迫后,转基因系的电导率、丙二醛含量均低于对照,表现出更低的细胞膜通透性;其CAT 酶、SOD 酶活性均高于对照,表现强抗氧化酶活性从而避免细胞膜损伤,表现出更好的植株抗旱性。通过基因表达水平和转基因烟草功能分析,笔者推测柑橘在干旱胁迫的诱导下,CrADC基因高表达后促进腐胺等PAs 合成,PAs 可调节细胞内渗透物质含量,增强吸水性,同时PAs具有保护抗氧化酶活性,清除活性氧而减轻膜脂过氧化程度。高浓度PAs 能导致叶片保卫细胞控制气孔关闭,同时PAs作为第二信使促进根系发育而增强吸水能力,从而缓解干旱胁迫对植物生长的不利影响。上述假设还有待于SPMS、SPDS 等PAs 合成途径基因的克隆及表达特征分析,并继续开展干旱胁迫下砂糖橘内源PAs 浓度和气孔闭合、根系生长发育等表型的关联性分析,从而为探究CrADC等基因通过调控PAs合成代谢,抵御干旱等非生物胁迫的生理机制提供分子生物学证据。
4 结 论
克隆了砂糖橘CrADC 基因,其全长2262 bp,编码753 个氨基酸,属起源于亚热带或热带果树的进化分支。CrADC 基因在砂糖橘叶、花、果等组织中均能表达,但不同时期叶片和果实不同部位的表达量均有显著差异,在干旱胁迫24 h 内基因表达量随时间延长而逐步上升,转基因系比对照烟草有更好的抗旱生理特性。
[1] 区善汉,莫健生,张社南.广西沙糖橘产业发展存在的问题与对策[J].南方园艺,2014,25(5):28-30.OU Shanhan,MO Jiansheng,ZHANG Shenan. Problems and countermeasures in the development of Guangxi sugar orange industry[J].Southern Horticulture,2014,25(5):28-30.
[2] 李果果,陈香玲,秦荣耀,刘要鑫,赵小龙,孙宁静,欧智涛,唐志鹏,张广珍.大果沙糖橘的遗传鉴定及引种栽培表现[J].南方农业学报,2018,49(6):1171-1176.LI Guoguo,CHEN Xiangling,QIN Rongyao,LIU Yaoxin,ZHAO Xiaolong,SUN Ningjing,OU Zhitao,TANG Zhipeng,ZHANG Guangzhen. Genetic identification and cultivation performance of introduced Daguo shatangju[J]. Journal of Southern Agriculture,2018,49(6):1171-1176.
[3] 龚成宇,王毅,宋海岩,杨科,陶海青,刘俊宏,龚荣高.干旱胁迫对黄果柑果实品质及糖酸代谢酶活性的影响[J].西南农业学报,2021,34(2):272-278.GONG Chengyu,WANG Yi,SONG Haiyan,YANG Ke,TAO Haiqing,LIU Junhong,GONG Ronggao. Effects of drought stress on fruit quality and enzyme activity of glycolic acid metabolism in Huangguogan fruit[J]. Southwest China Journal of Agricultural Sciences,2021,34(2):272-278.
[4] KILLINY N,NEHELA Y. Citruspolyamines:structure,biosynthesis,and physiological functions[J].Plants,2020,9(4):426.
[5] YANG J C,ZHANG J H,LIU K,WANG Z Q,LIU L J.Involvement of polyamines in the drought resistance of rice[J]. Journal of Experimental Botany,2007,58(6):1545-1555.
[6] SHI J,FU X Z,PENG T,HUANG X S,FAN Q J,LIU J H.Spermine pretreatment confers dehydration tolerance of citrus in vitro plants via modulation of antioxidative capacity and stomatal response[J].Tree Physiology,2010,30(7):914-922.
[7] YAO Q,WANG L R,CHEN J Z,ZHU H H.The effects of polyamines on root morphology and arbuscular mycorrhiza of citrus seedlings[J].Acta Horticulturae,2008,774:151-158.
[8] YAO Q,WANG L R,XING Q X,CHEN J Z,ZHU H H.Exogenous polyamines influence root morphogenesis and arbuscular mycorrhizal development of Citrus limonia seedlings[J]. Plant Growth Regulation,2010,60(1):27-33.
[9] PRIMIKIRIOS N I,ROUBELAKIS-ANGELAKIS K A. Cloning and expression of an arginine decarboxylase cDNA from Vitis vinifera L. cell-suspension cultures[J]. Planta,1999,208(4):574-582.
[10] WANG J,SUN P P,CHEN C L,WANG Y,FU X Z,LIU J H.An arginine decarboxylase gene PtADC from Poncirus trifoliata confers abiotic stress tolerance and promotes primary root growth in Arabidopsis[J]. Journal of Experimental Botany,2011,62(8):2899-2914.
[11] 吴昊.柑橘转录因子CsCBF1 和PtrNAC72 在调控精氨酸脱羧酶基因表达及抗逆中的功能鉴定[D].武汉:华中农业大学,2017.WU Hao. Functional characterization of Citrus sinensis CBF1 and Poncirus trifoliata NAC72 in regulation ofarginine decarboxylase gene expression and stress tolerance[D]. Wuhan:Huazhong Agricultural University,2017.
[12] 王保全,张晓娜,刘继红,李国怀.桃树PpADC 基因克隆及逆境胁迫表达分析[J].西南师范大学学报(自然科学版),2020,45(7):34-41.WANG Baoquan,ZHANGXiaona,LIU Jihong,LI Guohuai.Cloning and abiotic stress-induced expression of the arginine decarboxylase gene from Prunus persica[J]. Journal of Southwest China Normal University (Natural Science Edition),2020,45(7):34-41.
[13] 靳丛,郭巧会,陈国栋,孙小川,孙敏,周瑾,王纪忠,黄小三.杜梨精氨酸脱羧酶基因PbADC 的克隆与表达分析[J].核农学报,2021,35(2):306-313.JIN Cong,GUO Qiaohui,CHEN Guodong,SUN Xiaochuan,SUN Min,ZHOU Jin,WANG Jizhong,HUANG Xiaosan.Cloning and expression analysis of PbADC in Pyrus betulifolia[J].Journal of Nuclear Agricultural Sciences,2021,35(2):306-313.
[14] 唐文武,吴秀兰.沙糖橘S-腺苷甲硫氨酸脱羧酶基因克隆及表达分析[J].南方农业学报,2020,51(6):1369-1376.TANG Wenwu,WU Xiulan. Cloning and expression analysis of S-adenosylmethionine decarboxylase gene(CrSAMDC)in Shatangju[J]. Journal of Southern Agriculture,2020,51(6):1369-1376.
[15] WU X, QIN Y H, HU G B.Cloning and expression analysis of self-incompatibility S1 family protein gene in Citrus reticulata Blanco cv. Wuzishatangju[J]. Research Journal of Biotechnology,2015,10(7):19-25.
[16] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2- ΔΔCT method[J].Methods,2001,25(4):402-408.
[17] HORSCH R B,FRY J E,HOFFMANN N L,EICHHOLTZ D,ROGERS S G,FRALEY R T.A simple and general method for transferring genes into plants[J]. Science,1985,227(4691):1229-1231.
[18] FAIZE M,FAIZE L,BURGOS L. Using quantitative real-time PCR to detect chimeras in transgenic tobacco and apricot and to monitor their dissociation[J].BMC Biotechnology,2010,10:53.
[19] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.LI Hesheng.Principles and techniques of plant physiological biochemical experiment[M].Beijing:Higher Education Press,2000.
[20] WU H,FU B,SUN P P,XIAO C,LIU J H.A NAC transcription factor represses putrescine biosynthesis and affects drought tolerance[J].Plant Physiology,2016,172(3):1532-1547.
[21] MEHTA P K,CHRISTEN P. The molecular evolution of pyridoxal-5’-phosphate-dependent enzymes[J]. Advances in Enzymology and Related Areas of Molecular Biology,2000,74:129-184.
[22] WI S J,KIM S J,KIM W T,PARK K Y.Constitutive S-adenosylmethionine decarboxylase gene expression increases drought tolerance through inhibition of reactive oxygen species accumulation in Arabidopsis[J].Planta,2014,239(5):979-988.
[23] WANG J,LIU J H,KUROSAWA T,NADA K,BAN Y,MORIGUCHI T. Cloning,biochemical identification,and expression analysis of a gene encoding S-adenosylmethionine decarboxylase in navel orange (Citrus sinensis Osbeck)[J]. The Journal of Horticultural Science and Biotechnology,2010,85(3):219-226.
[24] MILLER G,SUZUKI N,CIFTCI-YILMAZ S,MITTLER R.Reactive oxygen species homeostasis and signalling during drought and salinity stresses[J]. Plant,Cell & Environment,2010,33(4):453-467.
[25] 李霞,程运河,马晓东,韩蕾,孙振元.多胺在植物抗逆中的生理机制[J].世界林业研究,2018,31(4):23-28.LI Xia,CHENG Yunhe,MA Xiaodong,HAN Lei,SUN Zhenyuan.Physiological mechanism of polyamines in plant resistance[J].World Forestry Research,2018,31(4):23-28.
[26] ZHANG Q H,WANG M,HU J B,WANG W,FU X Z,LIU J H.PtrABF of Poncirus trifoliata functions in dehydration tolerance by reducing stomatal density and maintaining reactive oxygen species homeostasis[J]. Journal of Experimental Botany,2015,66(19):5911-5927.
[27] CUI X,GE C M,WANG R X,WANG H Z,CHEN W Q,FU Z M,JIANG X N,LI J Y,WANG Y H. The BUD2 mutation affects plant architecture through altering cytokinin and auxin responses in Arabidopsis[J].Cell Research,2010,20(5):576-586.