查尔酮合成酶(chalcone synthase,CHS)属于植物聚酮合酶超家族成员(polyketide synthase,PKS),PKS 可催化聚酮类化合物形成芪类化合物、黄酮类化合物、抗生素及真菌毒素等多种物质[1]。根据蛋白的结构可将PKS 分为Ⅰ、Ⅱ和Ⅲ型,PKS-Ⅰ、PKS-Ⅱ型仅存在于微生物界,而PKS-Ⅲ型(CHS 超家族)则是由40~45 ku 的二聚体多肽形成,主要分布在植物界。Cys164、His303 和Asn336 是PKSs 家族高度保守的残基,可催化生成一系列结构各异、生理活性不同的植物次生代谢产物[2]。Thr132、Ser133、Thr194、Thr197、Gly256、Phe265 和Ser338 是在CHS 中高度保守的残基,但在其他Ⅲ型PKSs 中被相应的氨基酸替代,从而形成不同的产物[3]。
CHS是植物类黄酮合成途径的第一个限速酶,可以催化底物4-香豆酰辅酶A(coenzyme A,CoA)与丙酚CoA 生成4,5,7-三羟基黄烷酮,产生各种黄酮类化合物,也可以在查尔酮异构酶(chalcone isomerase,CHI)的催化下,进一步衍生转化成各类黄酮化合物[4]。花青苷合成途径是类黄酮合成的一部分,花青苷物质在植物的花、叶、果皮等组织的着色过程中起着重要作用,而CHS基因参与花青苷合成的第一步缩合反应。同时,CHS基因也参与植物对非生物胁迫的响应,对植物花色形成、生长发育、逆境胁迫、激素调节和运输都会产生影响[5]。此外,CHS 基因的表达受多种外源激素和非生物胁迫的诱导,例如茉莉酸甲酯(methyl jasmonate,MeJA)、脱落酸(abscisic acid,ABA)、水杨酸(salicylic acid,SA)、干旱聚乙二醇(polyethylene glycol,PEG)和低温(4 ℃)等[6-8]。研究发现,EaCHS1基因超表达提高了紫茎泽兰(Eupatorium adenophorum)对高盐的耐受性[9],桑葚(Fructus mori)CHS 基因能够调控其耐盐及耐旱性[10],钝鳞紫背苔(Plagiochasma Appendiculatum)PaCHS 基因显著受SA 诱导[11]。CHS 超基因家族不同成员之间结构的微小差异,导致其表达模式略有不同。
到目前为止,CHS 基因在拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa)、番茄(Solanum lycopersicum)、苹果(Malus domestica)等物种中得到鉴定[12-15],在甜橙(Citrus sinensis)等部分物种中进行了克隆和转化研究[16]。CHS基因cDNA全长在1000 bp左右,编码区高度保守,一般由2个外显子和1个内含子构成;但是也有例外,如苔藓(Physcomitrella patens)PpCHS基因家族部分成员不含或含有2个内含子[17],虎杖(Polygonum cuspidatum)CHS 基因含有3个内含子[18]。
目前,葡萄CHS 基因家族虽有报道,但其在葡萄中响应外源激素和非生物胁迫的机制研究甚少。因此,笔者在本研究中利用葡萄和拟南芥等植物基因组数据库,利用生物信息学的方法筛选和鉴定葡萄CHS基因家族成员,并对葡萄CHS基因家族各成员的理化性质、亚细胞定位、基因结构和系统进化等进行分析,初步揭示了在不同外源激素和非生物胁迫下该家族基因在葡萄不同组织中的表达模式,同时进行了VvCHS3 基因的亚细胞定位实验,为进一步揭示葡萄CHS 基因家族的功能与提高葡萄的抗逆性奠定理论基础。
1 材料和方法
1.1 试验材料及处理
本试验于2020—2021 年在甘肃农业大学园艺学院进行。以黑比诺葡萄(Vitis vinifera L.‘Pinot Noir’)试管苗为试验材料,将带叶的单芽茎段转接于装有50 mL GS液体培养基的三角瓶中,以搭建纸桥的方法对材料进行固定培养,每瓶接种3株,置于RDN型人工气候箱(宁波东南仪器有限公司,中国)中培养,培养条件为25 ℃,220 μmol·m-2·s-1光照16 h,22 ℃暗培养8 h,湿度为60%。继代培养30 d 后,挑选生长健壮、无污染的试管苗,将其转移至分别含有0.2 mmol·L-1 ABA、50 mg·L-1 赤霉素(gibberellin,GA3)、0.05 mg·mL-1 萘乙酸(1-naphthlcetic acid,NAA)、5 mmol·L-1 SA、0.1 mmol·L-1 MeJA、400 mmol·L-1 NaCl、10% PEG 的GS 液体培养基中。4 ℃处理在低温植物培养箱(PERCIVAL LT-36公司,美国)中进行,处理时长均为24 h,以正常生长的试管苗作为对照(CK),每个处理5瓶,3次重复。
1.2 葡萄CHS基因家族的序列获得和比对
从拟南芥基因组网站TAIR(https://www.Arabidopsis.org/)下载CHS 基因的编码序列(coding sequence,CDS),导入葡萄基因组数据库(https://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/entry_ggb.html)进行BLAST 搜索,下载葡萄CHS 基因全长、CDS 和蛋白序列。在植物基因组网站JGI(https://phytozome.jgi.doe.gov/pz/portal.html)分别下载番茄和柑橘的CHS 基因成员序列。同时使用DNAMAN软件对葡萄CHS基因成员的氨基酸序列进行多重比对,利用HMMER 在线软件(https://www.ebi.ac.uk/Tools/hmmer/)对葡萄CHS 基因成员进行结构域筛选,剔除不含特定结构域的基因。
1.3 葡萄CHS基因家族理化性质分析
利用ExPASy 在线软件(https://web.expasy.org/protparam/)分析VvCHS 基因的理化性质。运用在线软件WoLF PSORT(https://wolfpsort.hgc.jp/)和Prabi 工具(http://gsds.cbi.pku.edu.cn/)分别预测VvCHS基因家族成员的亚细胞定位和α-螺旋、β-转角和不规则卷曲等二级结构所占比例。
1.4 葡萄与其他物种CHS 蛋白系统进化和共线性分析
将葡萄、拟南芥、柑橘和番茄4 个物种的CHS蛋白的氨基酸序列用ClustalX 2.1 比对,利用MEGA7 软件构建系统进化树,Bootstrap 值为1000。利用在线软件GSDS(http://gsds.cbi.pku.edu.cn/)绘制CHS 基因家族成员的基因结构图。根据CHS 基因fasta 格式的总CDS 序列,利用DNAsp 软件计算葡萄、柑橘、番茄和拟南芥CHS 基因的非同义突变率(Ka)和同义突变率(Ks),分析基因对之间的选择压。利用BAT(http://www.infspire.org/)工具绘制葡萄、柑橘、番茄和拟南芥四者间的共线性关系。
1.5 葡萄CHS基因家族顺式作用元件预测
下载VvCHS 基因成员起始密码子上游2 kb 的序列作为启动子区域,使用PlantCARE 软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对启动子元件进行分析,并用TBtools统计作图。
1.6 葡萄CHS基因家族的实时荧光定量分析
VvCHS 基因引物序列由生工生物工程(上海)股份有限公司在线设计(表1)并合成。TaKaRa MiniBEST Plant RNA Extraction Kit 和Primer-ScriptTM Ⅱ1 st Strand cDNA Synthesis Kit[TaKaRa,宝生物工程(大连)有限公司]试剂盒分别用于葡萄试管苗根、茎、叶RNA的提取和反转录。使用TaKa-Ra TB Green Premix Ex TaqⅡ(TaKaRa Biotechnology)试剂盒和LightCycle®96(Roche,瑞士)PCR仪进行实时荧光定量PCR(quantitative real-time PCR,qRT-PCR),反应体系总体积为20 μL,包括10 μL 的2 × SYBR,1 μL cDNA,2 μL 上、下游引物,7 μL 的ddH2O。以VvGAPDH 基因(登录号:CB973647)作为葡萄定量表达内部参照基因[19],试验3 次重复。采用2-ΔΔCT[20]法对葡萄CHS基因家族的相对表达量进行分析。
表1 葡萄CHS 基因家族实时荧光定量引物设计序列
Table 1 Design sequence of real-time fluorescent quantitative primers of CHS gene family in grape

注:表中引物序列根据CDS 区设计。
Note:The primer sequence in the table is designed according to the CDS region.
基因名称Gene name VvCHS1 VvCHS2 VvCHS3 VvCHS4 VvCHS5 VvCHS6 VvCHS7 VvGAPDH上游引物Forward primer 5’-AGTCTAATCCTCGGTGGCTGCTC-3’5’-CCGTCAAGACATGGTGGTGGTTG-3’5’-GAACCGTCCTTCGAACCGCTAAG-3’5’-GCTATGCAGGTGGAACTGTCCTTC-3’5’-GGCACAGCTACACCGGACAAC-3’5’-GAGGAGGTTGCGGTGCTAACG-3’5’-CCTGCACCAGATGGATAACTCAGC-3’5’-TTCTCGTTGAGGGCTATTCCA-3’下游引物Reword primer 5’-GCAATGGTGTGCGTCTATTCGTTC-3’5’-GAGGTGGTGCAGAAGACAAGGTG-3’5’-AACAACGGTGATCTCAGAGCACAC-3’5’-CTCAGAGCACACCACAAGAACTCG-3’5’-CGGTCATGTGCTCGCTCTTAGTG-3’5’-CCGAACACTCTCCTGCCTAACATC-3’5’-GATGAAGCCGAGGCGCAAGG-3’5’-CCACAGACTTCATCGGTGACA-3’
1.7 VvCHS3基因克隆与烟草瞬时转化
1.7.1 VvCHS3 基因克隆 通过基因家族定量数据分析,筛选表达差异显著的VvCHS3(GSVIVG01010590001),使用SnapGene 软件设计带有BamH Ⅰ酶切位点的特异性引物,VvCHS3-F:5’-GAGCTCGGTACCCGGGGATCCATGGCTTCAATTGAGGAAATTAGAA-3’,VvCHS3-R:5’-GGTGTCGACTCTAGAGGATCCATTAGAAACCATAGGAATGCTATGCA-3’。以黑比诺葡萄cDNA为模板进行PCR 扩增,将回收产物与pCAMBIA1300-GFP 质粒进行连接,随后将连接产物转入DH5α 大肠感受态细胞,经菌液PCR 检测后送上海生工测序,测序合适后,提取VvCHS3质粒转化农杆菌,并鉴定阳性农杆菌重组子用于后续的植物转化试验。
1.7.2 烟草瞬时转化 将含有目的基因已培养好的农杆菌菌液5000×g离心10 min,收集菌体。使用缓冲液(50 mL 灭菌蒸馏水+500 μL MES+200 μL MgCl2+75 μL As)将菌体重悬至OD600为0.7~0.8。使用2 mL一次性注射器将重悬的菌液从生长25 d左右的本氏烟草叶背打入,以空载体作为对照,并于25 ℃黑暗培养48 h后转入正常光照下培养1 d。在注射有菌液的叶片上用手术刀切取0.2 mm×0.2 mm 镜检样本,置于AX10 荧光倒置显微镜(ZEISS 公司,德国)下观察拍照。
1.8 数据处理与统计分析
采用Excel 软件统计试验数据,处理间用单因素ANOVA检验下的邓肯法(Duncun)进行显著性差异分析,p<0.05代表显著差异,并用Origin 9.0软件作图。
2 结果与分析
2.1 葡萄CHS基因家族成员理化性质分析
从葡萄基因组中共鉴定出7个CHS基因家族基因,根据其在染色体上的先后位置分别将其命名为VvCHS1~VvCHS7。通过氨基酸序列比对分析(图1)发现,VvCHS 蛋白序列相似性为29.77%,7 个VvCHS 均含CHS 基因家族特征氨基酸序列WGVLFGFGPGL和4个保守活性位点氨基酸残基。由表2可知,葡萄CHS基因家族成员分布在12、14、16、17和18 号染色体上,其中16 号染色体上分布最多。VvCHS1是编码序列最长、氨基酸残基数目最多、分子质量最大、等电点最小的成员,而VvCHS2是全长序列和编码序列最短、氨基酸残基数目和分子质量最小的成员。葡萄CHS 基因家族成员理论等电点为5.61(VvCHS1)~8.86(VvCHS7),7个成员中有4个编码酸性氨基酸。不稳定指数介于36.64(VvCHS7)~43.50(VvCHS2)之间,其中有5 个成员为稳定性蛋白。总平均亲水性指数分布在-0.36(VvCHS1)~0.05(VvCHS2)之间,其中有6个成员为亲水性蛋白。

图1 葡萄VvCHS 基因多重序列比对分析
Fig.1 Multiple sequence alignment of the predicted VvCHS from grape
横线表示活性位点所在序列;箭头表示活性结合位点;黑色框内是CHS 基因家族序列标签。
Underline.Conserved sequence of activesite;Arrows.Active center;Chalcone synthase family sequence label are in are in black frame.
表2 葡萄CHS 基因家族理化性质
Table 2 Physical and chemical properties of CHS gene family in grape
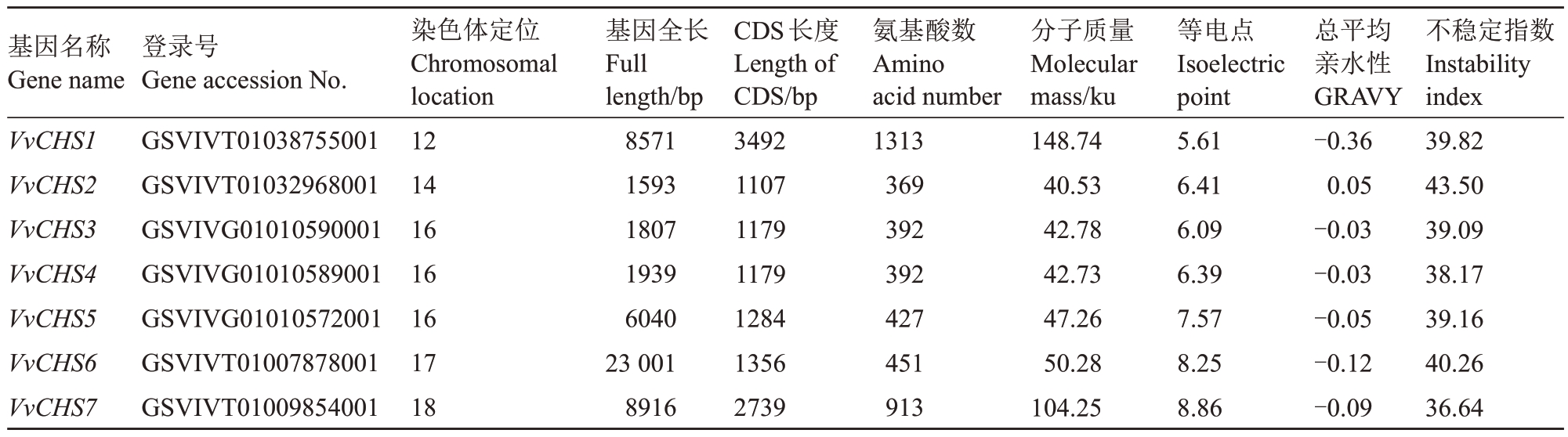
基因名称Gene name VvCHS1 VvCHS2 VvCHS3 VvCHS4 VvCHS5 VvCHS6 VvCHS7登录号Gene accession No.GSVIVT01038755001 GSVIVT01032968001 GSVIVG01010590001 GSVIVG01010589001 GSVIVG01010572001 GSVIVT01007878001 GSVIVT01009854001染色体定位Chromosomal location 12 14 16 16 16 17 18基因全长Full length/bp 8571 1593 1807 1939 6040 23 001 8916 CDS长度Length of CDS/bp 3492 1107 1179 1179 1284 1356 2739氨基酸数Amino acid number 1313 369 392 392 427 451 913分子质量Molecular mass/ku 148.74 40.53 42.78 42.73 47.26 50.28 104.25等电点Isoelectric point 5.61 6.41 6.09 6.39 7.57 8.25 8.86总平均亲水性GRAVY-0.36 0.05-0.03-0.03-0.05-0.12-0.09不稳定指数Instability index 39.82 43.50 39.09 38.17 39.16 40.26 36.64
2.2 葡萄CHS蛋白系统进化关系与基因结构分析
利用葡萄与拟南芥、柑橘和番茄CHS蛋白构建系统发育树,发现4 个物种26 个蛋白可聚类为3 个亚族。GroupⅠ由7 个CitCHS 蛋白、4 个SlCHS 蛋白、4 个VvCHS 蛋白和1 个AtCHS 蛋白聚为1 个亚族。Group Ⅱ有2 个VvCHS 蛋白和2 个AtCHS 蛋白。Group Ⅲ由VvCHS1蛋白和5个AtCHS蛋白组成,表明VvCHS1、VvCHS6 和VvCHS7 蛋白与拟南芥AtCHS 蛋白有较高的同源性(图2)。26 个CHS基因家族成员中,除AtCHS2 和AtCHS5 基因只有1个外显子、AtCHS8基因有13个外显子外,其余CHS基因外显子数在2~6个之间,其中有12个基因包含2个外显子和1个内含子。结果表明,同一亚族不同基因之间基因结构相似,亲缘关系较近。
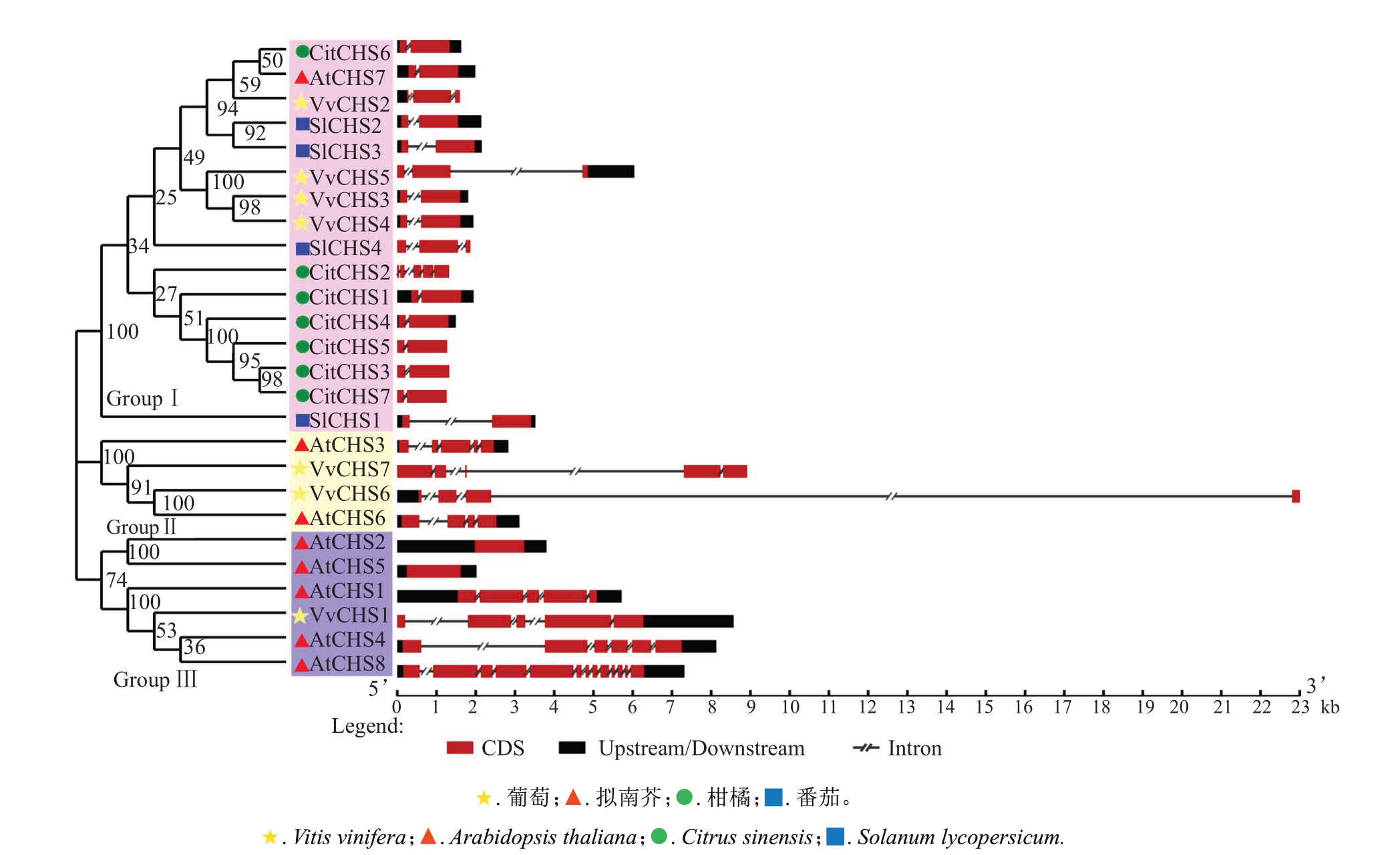
图2 葡萄与其他物种CHS 蛋白系统进化和基因结构分析
Fig.2 Phylogenetic evolution and gene structure analysis of CHS protein in grape and other species
进化选择压主要通过非同义突变率和同义突变率的比值(Ka/Ks)进行分析。本研究结果显示,VvCHS1、VvCHS3、VvCHS4、VvCHS5与AtCHS3基因之间,VvCHS3、VvCHS4、VvCHS5 与AtCHS6 基因之间,VvCHS6 与AtCHS8、CitCHS7 基因之间,VvCHS1与SlCHS1、SlCHS2、SlCHS4 基因之间的Ka/Ks 值大于1,进行正向选择,其余基因对之间均为纯化选择关系,所有成员之间均不存在中性进化关系(表3)。
表3 葡萄CHS 基因家族选择压分析
Table 3 Selection pressure analysis of CHS gene family in grape

基因对Gene pairs VvCHS1 VvCHS1 VvCHS2 VvCHS2 VvCHS3 VvCHS3 VvCHS4 VvCHS4 VvCHS4 VvCHS5 VvCHS5 VvCHS5 VvCHS6 VvCHS6 VvCHS6 VvCHS7 VvCHS2 VvCHS3 VvCHS4 VvCHS5 AtCHS3 AtCHS8 AtCHS3 AtCHS6 AtCHS3 AtCHS6 AtCHS3 AtCHS6 AtCHS8 AtCHS3 AtCHS6 AtCHS8 AtCHS8 AtCHS6 AtCHS3 AtCHS3 CitCHS2 CitCHS2 CitCHS2 CitCHS2同义突变频率Ks 1.61 1.84 2.15 1.58 1.62 1.28 1.66 1.48 2.89 1.96 1.33 3.13 2.69 0.70 4.00 1.89 0.67 0.67 0.67 0.66非同义突变频率Ka 2.49 1.04 2.00 1.38 2.28 1.53 2.33 1.58 2.12 2.28 1.50 2.04 3.46 0.35 1.60 1.52 0.43 0.39 0.40 0.41非同义突变率/同义突变率Ka/Ks 1.55 0.57 0.93 0.87 1.41 1.19 1.40 1.07 0.73 1.16 1.12 0.65 1.29 0.50 0.40 0.80 0.64 0.59 0.60 0.62基因对Gene pairs VvCHS6 VvCHS1 VvCHS1 VvCHS1 VvCHS2 VvCHS2 VvCHS2 VvCHS2 VvCHS3 VvCHS3 VvCHS3 VvCHS3 VvCHS4 VvCHS4 VvCHS4 VvCHS4 VvCHS5 VvCHS5 VvCHS5 VvCHS5 CitCHS7 SlCHS1 SlCHS4 SlCHS2 SlCHS1 SlCHS2 SlCHS3 SlCHS4 SlCHS4 SlCHS2 SlCHS1 SlCHS3 SlCHS4 SlCHS2 SlCHS1 SlCHS3 SlCHS4 SlCHS1 SlCHS2 SlCHS3同义突变频率Ks 1.53 2.86 1.96 1.93 0.89 0.62 0.63 0.62 0.65 0.57 0.84 0.73 0.66 0.53 0.80 0.64 0.72 0.82 0.62 0.66非同义突变频率Ka 1.62 3.32 2.03 1.99 0.50 0.28 0.29 0.42 0.45 0.36 0.46 0.33 0.45 0.36 0.47 0.33 0.43 0.48 0.36 0.34非同义突变率/同义突变率Ka/Ks 1.06 1.16 1.04 1.03 0.57 0.44 0.46 0.68 0.70 0.63 0.55 0.46 0.68 0.68 0.58 0.52 0.59 0.58 0.58 0.52
2.3 葡萄CHS 蛋白亚细胞定位预测及蛋白质二级结构分析
亚细胞定位预测结果显示,有5个VvCHS蛋白在细胞质、细胞膜和细胞核中表达,在线粒体和叶绿体中只有4 个蛋白表达(表4)。在过氧化物酶体中表达的有VvCHS3、VvCHS4 和VvCHS5 蛋白。在液泡中表达的只有VvCHS2 和VvCHS3 蛋白。VvCHS6蛋白只在叶绿体和线粒体中表达,VvCHS7蛋白只在细胞膜中表达。
表4 葡萄CHS 蛋白亚细胞定位预测和蛋白质二级结构分析
Table 4 The secondary structure and subcellular location prediction of CHS protein in grape
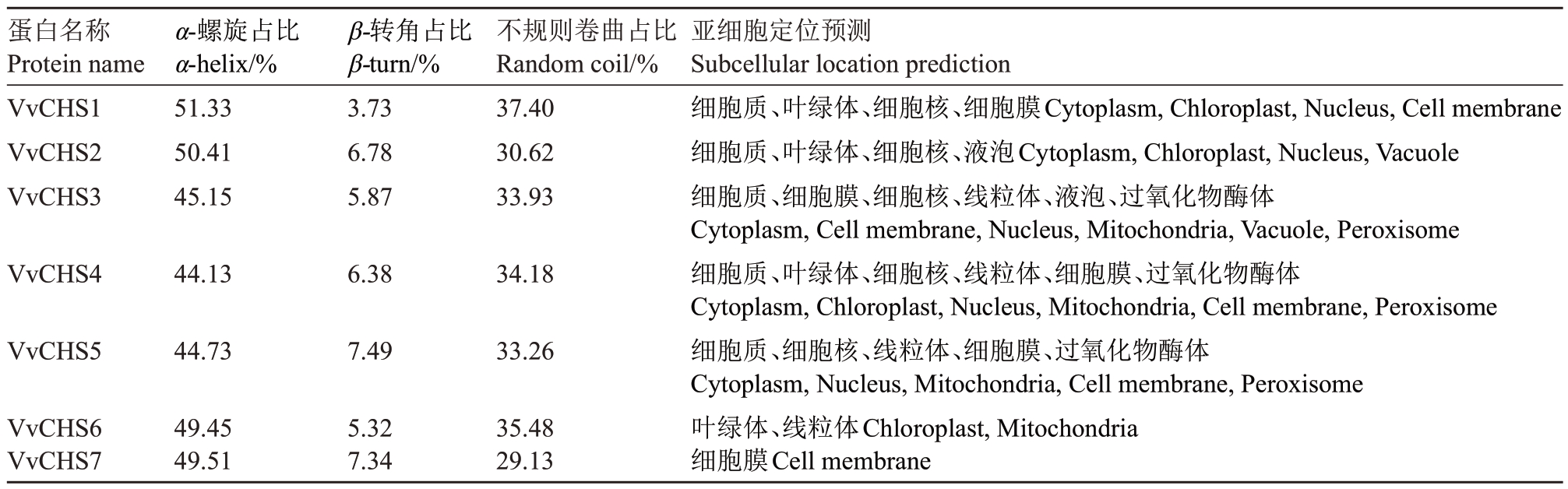
蛋白名称Protein name VvCHS1 VvCHS2 VvCHS3 VvCHS4 VvCHS5 VvCHS6 VvCHS7 α-螺旋占比α-helix/%51.33 50.41 45.15 44.13 44.73 49.45 49.51 β-转角占比β-turn/%3.73 6.78 5.87 6.38 7.49 5.32 7.34不规则卷曲占比Random coil/%37.40 30.62 33.93 34.18 33.26 35.48 29.13亚细胞定位预测Subcellular location prediction细胞质、叶绿体、细胞核、细胞膜Cytoplasm,Chloroplast,Nucleus,Cell membrane细胞质、叶绿体、细胞核、液泡Cytoplasm,Chloroplast,Nucleus,Vacuole细胞质、细胞膜、细胞核、线粒体、液泡、过氧化物酶体Cytoplasm,Cell membrane,Nucleus,Mitochondria,Vacuole,Peroxisome细胞质、叶绿体、细胞核、线粒体、细胞膜、过氧化物酶体Cytoplasm,Chloroplast,Nucleus,Mitochondria,Cell membrane,Peroxisome细胞质、细胞核、线粒体、细胞膜、过氧化物酶体Cytoplasm,Nucleus,Mitochondria,Cell membrane,Peroxisome叶绿体、线粒体Chloroplast,Mitochondria细胞膜Cell membrane
蛋白质二级结构预测分析结果表明,葡萄CHS基因家族编码的蛋白质二级结构以α-螺旋结构(占比44.13%~51.33%)和不规则卷曲结构(占比30.62%~37.40%)为主,β-转角结构占比(3.73~7.49%)较小(表4)。
2.4 葡萄CHS 基因启动子上游2 kb顺式作用元件分析
为进一步了解葡萄CHS 基因家族的生物学功能,对其进行顺式作用元件预测,发现该基因家族主要包含与激素调节和逆境胁迫相关的顺式作用调控元件,包括MeJA 响应元件(TGACG-motif)、脱落酸响应元件(ABRE)、SA 响应元件(TCA-element)、干旱响应元件(MBS)和低温响应元件(LTR)等多种调控元件。这表明葡萄CHS 基因家族大部分成员可能同时响应多种逆境胁迫和激素调控(图3)。另外,葡萄CHS 基因家族部分基因还包含生长素、GA3、光反应和厌氧诱导相关调控元件,可能与其相应的调控相关。
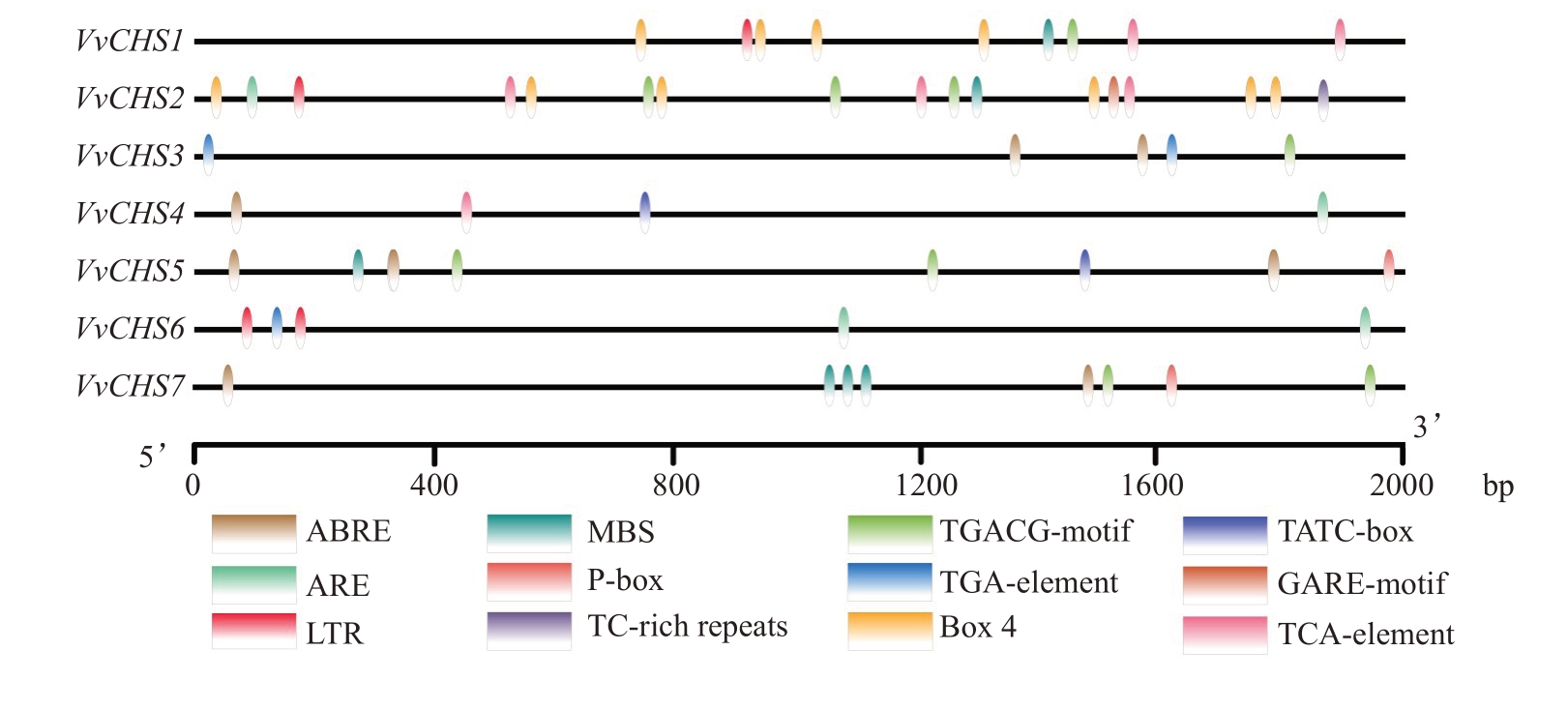
图3 葡萄CHS 基因家族启动子顺式作用元件分析
Fig.3 Analysis of cis-acting elements in the promoters of grape CHS gene family
2.5 葡萄与柑橘、番茄、拟南芥共线性基因分析
共线性关系分析结果显示,葡萄与柑橘、番茄和拟南芥CHS 基因家族基因之间都不存在共线性关系(图4)。葡萄7 个CHS 成员中只有3 对基因之间(VvCHS3 与VvCHS4、VvCHS3 与VvCHS5、VvCHS4与VvCHS5)存在共线性关系,柑橘8 个CHS 成员中只有4 对基因(CitCHS3 与CitCHS7、CitCHS3 与CitCHS5、CitCHS4与CitCHS5、CitCHS5与CitCHS7)之间存在共线性关系。经推测,这7个基因VvCHS3、VvCHS4、VvCHS5以及CitCHS3、CitCHS4、CitCHS5、CitCHS7 可能是由基因复制产生的,且CHS 基因家族的基因复制事件只发生在物种基因组内部,在不同的物种之间未发生。

图4 葡萄与柑橘、番茄、拟南芥CHS 基因家族基因的共线性关系
Fig.4 Collinearity of CHS family genes between grape,citrus,tomato and Arabidopsis thaliana
Vv.葡萄;At.拟南芥;Cit.柑橘;Sl.番茄。
Vv.Vitis vinifera;At.Arabidopsis thaliana;Cit.Citrus sinensis;Sl.Solanum lycopersicum.
2.6 葡萄CHS基因家族的qRT-PCR分析
2.6.1 葡萄不同组织中VvCHS 基因的表达分析qRT-PCR 分析结果显示,VvCHS1 基因在叶中表达水平最高,相对表达量是根的1.2倍。VvCHS6在根中表达水平最高,在叶中表达水平最低。其余5 个VvCHS 基因在根中相对表达量最高,叶中次之,茎中相对表达量最低,具有明显的组织特异性(图5)。
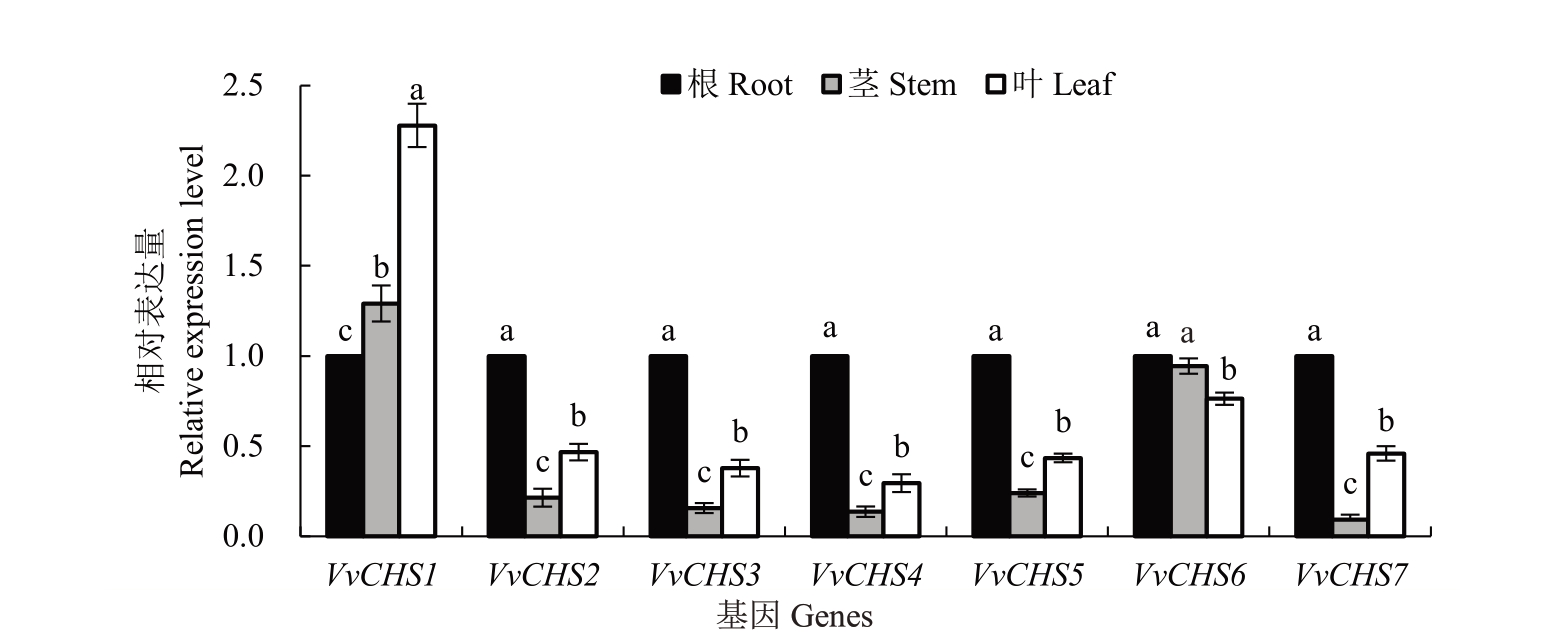
图5 VvCHS 基因在葡萄不同组织(根、茎、叶)中的特异性表达
Fig.5 Specific expression of VvCHS genes in grape different tissues(roots,stems,leaves)
不同小写字母表示差异显著(p<0.05)。下同。
Different small letters indicate significant difference(p<0.05).The same below.
2.6.2 激素诱导下葡萄CHS 基因家族在葡萄根、茎、叶中的表达 在不同激素处理下,对葡萄CHS基因家族进行qRT-PCR分析,发现葡萄根、茎、叶经MeJA 和SA 诱导后,VvCHS 基因上调表达,其中以VvCHS3上调表达最为显著,在根、茎和叶中相对表达量分别为对照的16.4、31.2、36.1 倍和40.3、44.3、25倍(图6)。
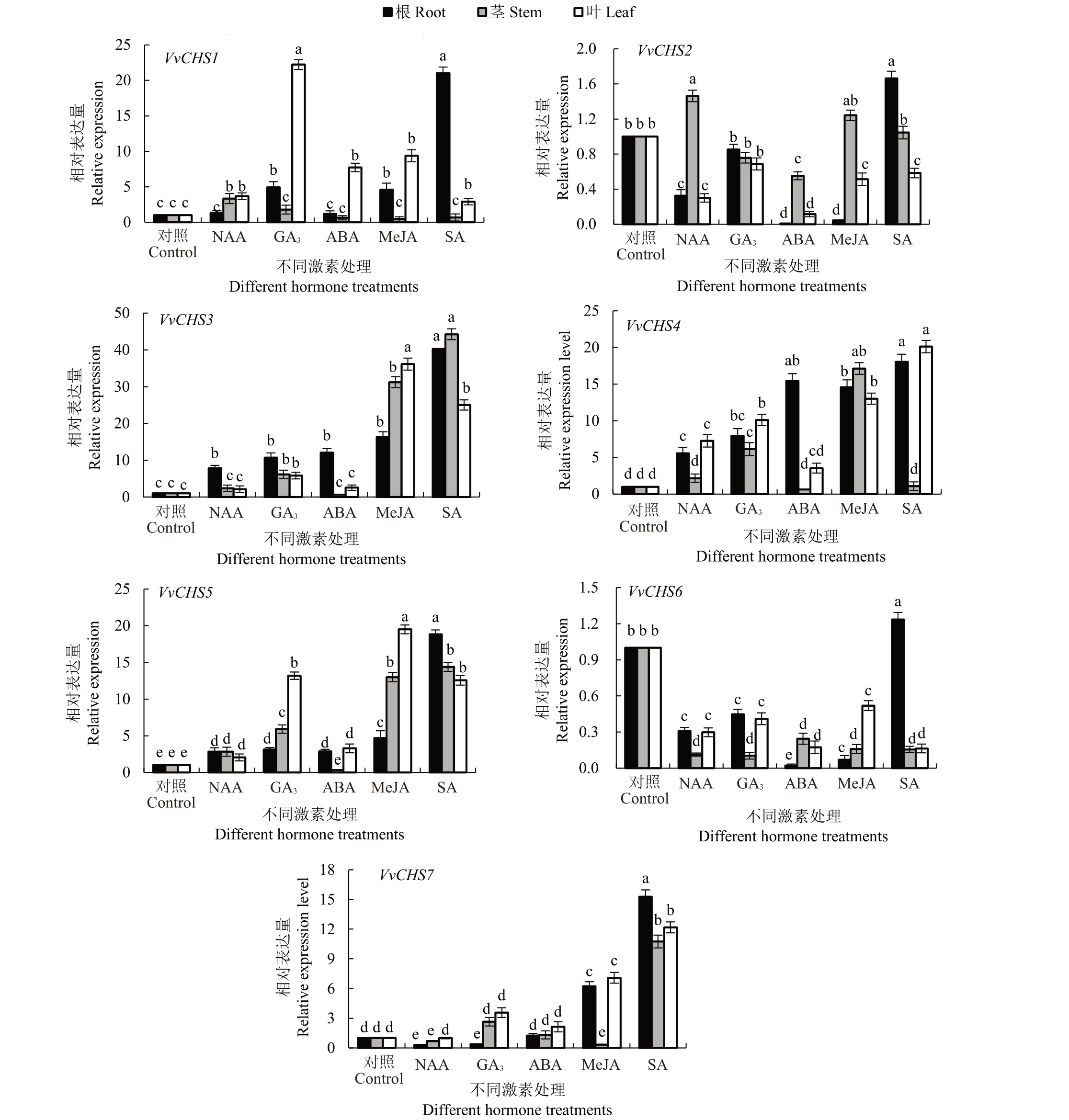
图6 激素诱导下VvCHS 基因在葡萄根、茎、叶中的相对表达量
Fig.6 Relative expression of VvCHS genes in grape roots,stems and leaves under hormone treatments
在MeJA 处理下,VvCHS2 和VvCHS4 基因在根中的表达水平高于茎和叶,其余基因在葡萄叶中的表达水平高于根和茎。在SA诱导后,VvCHS3基因在茎中的表达水平高于根和叶,VvCHS4 基因在根和叶中的表达水平较高,在茎中表达水平较低,其余基因在根中的表达水平最高。NAA 诱导后,VvCHS2 基因在根和叶中的表达水平较低,在茎中表达水平较高。GA3诱导后,VvCHS1 和VvCHS3 基因在叶片中的表达水平显著高于根和茎。VvCHS6基因只在葡萄根组织经SA 诱导后上调表达,为对照的1.23倍。这表明在不同激素诱导下,VvCHS基因在葡萄不同组织中的表达水平不同,VvCHS基因可能参与MeJA和SA的信号传导途径,响应激素调控。
2.6.3 非生物胁迫下葡萄CHS基因家族在葡萄根、茎、叶中的表达 在非生物胁迫处理下,对VvCHS基因在葡萄不同组织中的表达模式进行分析,发现在4 ℃处理下,VvCHS1、VvCHS3、VvCHS4 和VvCHS7 基因在根中的表达水平最高,在茎中的表达水平最低。以VvCHS4基因在葡萄根中上调表达最为显著,相对表达量为对照的53.4 倍。VvCHS6基因在葡萄叶片中的相对表达量高于根,VvCHS3和VvCHS5基因在叶片中的表达水平低于茎(图7)。
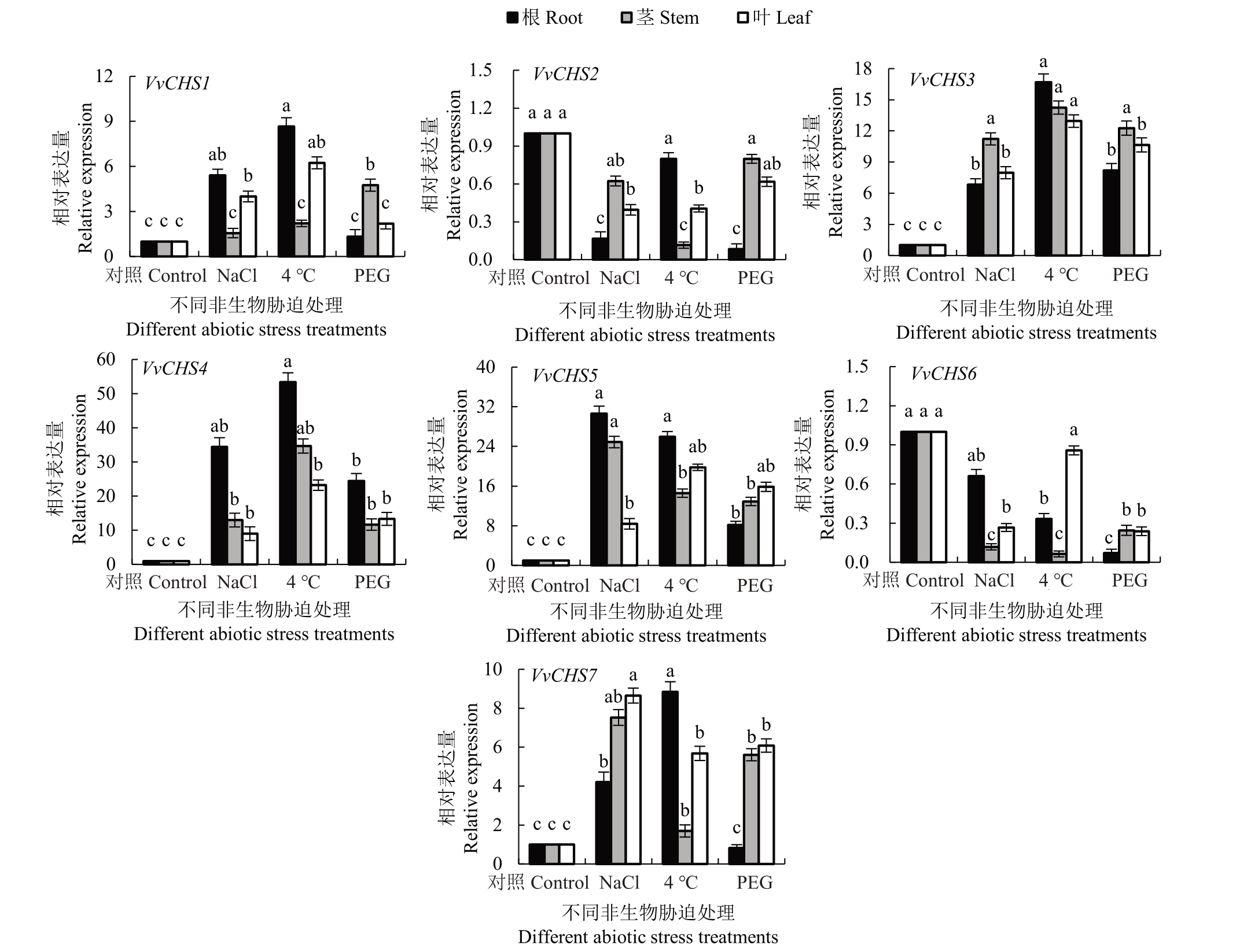
图7 非生物胁迫下VvCHS 基因在葡萄根、茎、叶中的相对表达量
Fig.7 Relative expression of VvCHS genes in grape roots,stems and leaves under abiotic stresses
在NaCl 处理下,VvCHS1、VvCHS4、VvCHS5 和VvCHS6 基因在根中的表达水平最高,其中VvCHS1和VvCHS6基因在茎中的表达水平最低,VvCHS4和VvCHS5 基因在叶片中的表达水平最低。VvCHS5基因在根中上调表达最为显著,相对表达量为对照的30.6 倍。在PEG 处理下,VvCHS4 基因在根、茎、叶中的相对表达量最高,分别为对照的24.4、11.7和13.3 倍。VvCHS1、VvCHS2 和VvCHS3 基因在茎中的表达水平高于根和叶。
葡萄根、茎、叶在NaCl、4 ℃和PEG 处理下,除VvCHS2 和VvCHS6 基因的相对表达量显著下调表达外,其余基因均上调表达,说明在不同非生物胁迫下,不同组织器官中VvCHS 基因的表达水平有差异,VvCHS基因响应葡萄高盐、低温和干旱胁迫。
2.7 VvCHS3烟草瞬时转化
通过农杆菌介导法将35S::VvCHS3::GFP导入本氏烟草叶片下表皮细胞内,进行瞬时表达分析,结果显示注射空载35S::GFP的整个细胞发绿色荧光,而注射35S::VvCHS3::GFP 的本氏烟草叶片在细胞核和细胞膜上有绿色荧光。试验证明VvCHS3基因定位在细胞核和细胞膜中(图8),该结果与亚细胞定位预测结果一致。
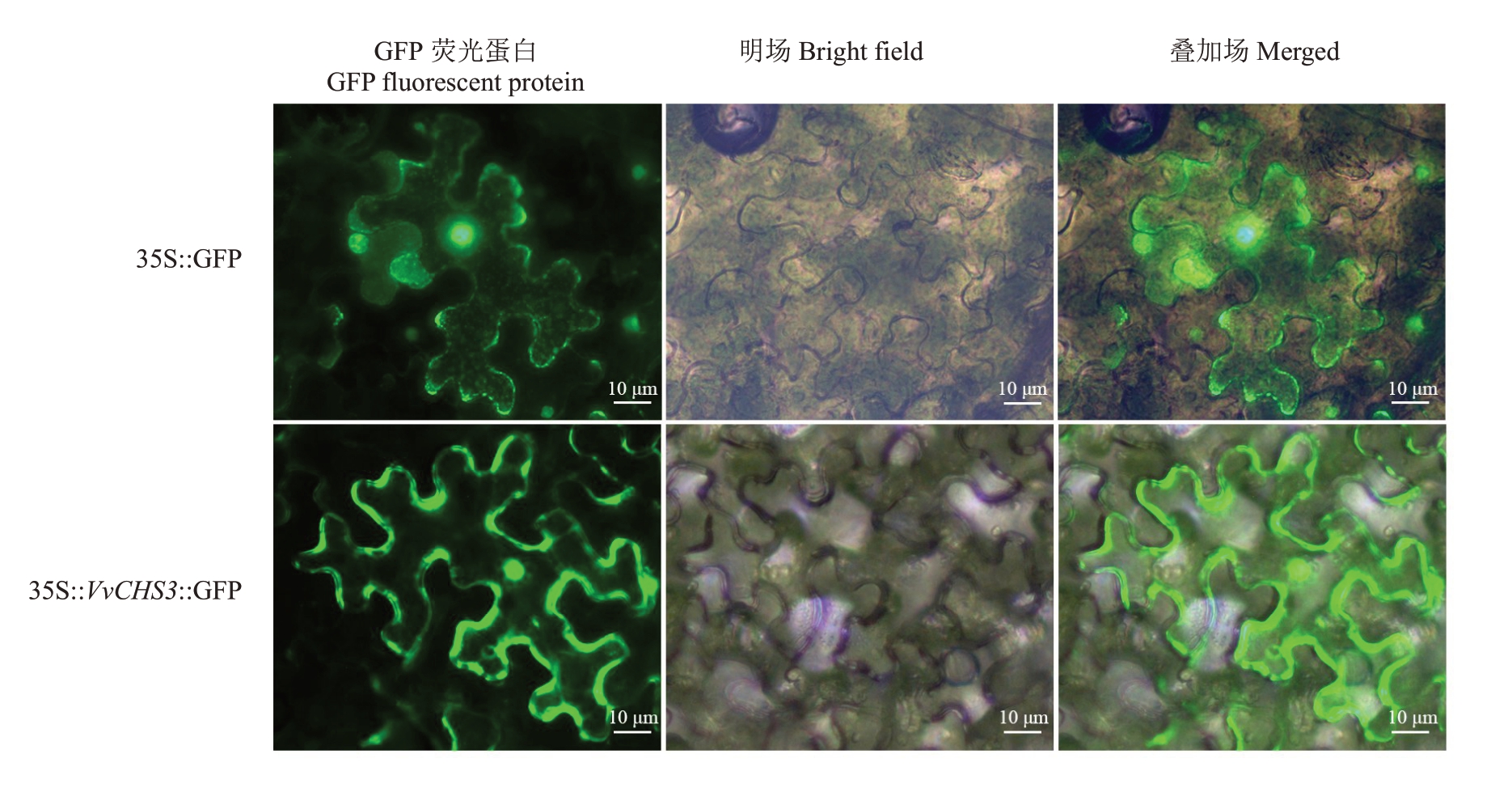
图8 VvCHS3 基因在本氏烟草下表皮细胞中的亚细胞定位
Fig.8 Subcellular localization of VvCHS3 in the lower epidermal cells of Nicotiana benthamiana
3 讨 论
CHS是植物体类黄酮合成路径中的关键酶,也是与苯丙酮代谢有关的基因。笔者在本研究中从葡萄基因组中鉴定出7个CHS基因,与拟南芥、柑橘和番茄CHS基因进行系统进化和选择压力分析,运用qRT-PCR分析不同激素诱导和非生物胁迫下该基因家族成员的组织表达特异性和不同处理下的表达情况,明确该家族基因在响应激素和非生物胁迫时的分子机制。到目前为止,已从矮牵牛(Petunia hybrida Vilm.)、白木香(Aquilaria sinensis)等物种中分离鉴定出了CHS基因[21-22]。双子叶植物中CHS基因家族数目较多,其中番茄中有8个CHS基因[14],辣椒(Capsicum annuum)中有7 个CHS 基因[23]。大多数单子叶植物含有2个或3个CHS基因。而在葡萄中鉴定到7 个VvCHS 基因。由此可见,不同物种中的CHS基因在数量上存在差异,这可能与基因组大小和物种的进化有关。VvCHS基因不均匀分布于5条不同的染色体上,其中有3个基因均分布于第16条染色体上。VvCHS基因家族等电点值表明,该基因家族只有1种中性蛋白质(VvCHS5),有2种碱性蛋白质(VvCHS6 和VvCHS7)。根据遗传距离笔者将CHS 蛋白划分为3 大亚族,其中Group Ⅱ和GroupⅢ均由葡萄VvCHS 蛋白和拟南芥AtCHS 蛋白聚类为一族,说明葡萄与拟南芥CHS 之间同源关系较近。葡萄CHS 基因与其他3 个物种CHS 基因之间主要进行纯化选择,葡萄中仅VvCHS3 与VvCHS4、VvCHS3与VvCHS5、VvCHS4与VvCHS5之间具有共线性关系,柑橘中仅CitCHS3 与CitCHS7、CitCHS3与 CitCHS5、CitCHS4 与 CitCHS5、CitCHS5 与CitCHS7之间具有共线性关系。通过共线性分析结合基因的结构、进化分析发现,VvCHS3、VvCHS4、VvCHS5、CitCHS3、CitCHS4、CitCHS5、CitCHS7 的基因结构高度相似,这7 个基因分布在同一个亚家族,基因之间亲缘关系相近,说明这些基因是在同一物种内由于基因复制而分离的同源基因。因此推测这几个基因可能是由基因复制产生的。
赵伟等[24]发现红仁核桃(Juglans regia L.)JrCHS蛋白主要分布于细胞质。章妮等[25]研究表明毛竹(Phyllostachys edulis)CHS 蛋白主要定位于内质网,少数定位于细胞质。何梦媛等[26]通过亚细胞定位预测发现甘草(Glycyrrhiza uralensis)GuCHS蛋白主要在细胞质中发挥作用。本研究亚细胞定位预测显示,葡萄CHS 蛋白主要定位于细胞质、细胞膜和细胞核中,烟草瞬时转化显示VvCHS3 基因定位于细胞核和细胞膜上,与预测结果相符,表明CHS基因可能大多在细胞质中起作用,但是不同物种CHS 基因家族成员在细胞器中的分布也存在一定差异。对葡萄CHS 基因家族进行蛋白质二级结构预测发现,VvCHS蛋白二级结构以α-螺旋和无规卷曲为主,β-转角则相对较少,这一结果与赵伟等[24]分析红仁核桃CHS蛋白的研究结果一致。
CHS 基因的表达与器官形态建成、功能分化有着密切关系,由于表达模式的差异,使其表达具有组织特异性。张变玲等[7]研究结果表明人参(Panax ginseng C.)CHS 基因主要在叶片中表达。梅志栋等[27]研究表明杧果(Mangifera indica)CHS1基因的相对表达量在叶和花中较高。而本研究表明,葡萄CHS 基因主要在根中表达,也有个别基因在叶片中表达水平最高,如VvCHS1 基因在叶片中的相对表达量是根的1.2 倍。除VvCHS6 基因在茎中的相对表达量高于叶片外,该基因家族其余成员在茎中的表达水平最低。这与前人的研究结果有相似之处,但是也存在一定的差异,表明不同物种CHS基因家族成员在不同组织中的表达水平不尽相同。顺式作用元件预测发现,葡萄CHS基因家族成员的启动子序列中含有与激素、非生物胁迫相关的调控元件,这与赵伟等[24]的研究结果一致。
研究发现,泡核桃(Juglans sigillata)JsCHS1 基因在低温处理6 h 后上调表达,说明JsCHS1 基因可响应低温胁迫[28]。秋茄(Kandelia candel)KcCHS 基因的相对表达量随着盐胁迫的增强呈极显著上升趋势,这与秋茄抵抗盐胁迫的能力有关[29]。马立功等[8]研究向日葵(Helianthus annuus)HaCHS 基因的逆境应答,发现经SA 和ABA 诱导后,HaCHS 基因的相对表达量变化不显著。王海波等[30]通过半定量RTPCR 分析说明JcCHS 基因在小桐子(Jatropha curcas)中响应低温。本研究通过qRT-PCR 分析表明,在不同外源激素诱导和非生物胁迫条件下,VvCHS基因家族成员在葡萄根、茎、叶中均有表达。在5 mmol·L-1 SA 诱导下,VvCHS1 和VvCHS7 基因在葡萄根中显著上调表达,其相对表达量分别为对照的21 倍和15.3 倍;VvCHS3 在葡萄茎中的相对表达量最高,为对照的44.3 倍。这与张变玲等[7]的研究结果一致,与马立功等[8]的研究结果不符,说明CHS基因在不同植物中可能具有不同的表达模式,存在不同的调控机制。在0.2 mmol·L- 1 ABA 诱导下,VvCHS基因的相对表达量与对照并无显著差异,且该处理下VvCHS基因的表达水平最低,说明VvCHS基因对ABA 诱导不敏感,可能没有参与ABA 信号传导途径的调控。在0.1 mmol·L-1 MeJA 诱导下,VvCHS 基因家族成员除VvCHS6 呈下调表达外,其余基因均上调表达,在葡萄叶片中,VvCHS3的相对表达量最高,为对照的36.1 倍,说明VvCHS 基因受MeJA诱导而上调表达,这与前人的研究结果一致。葡萄在400 mmol·L-1 NaCl、4 ℃和10%PEG胁迫下,VvCHS1、VvCHS3、VvCHS4、VvCHS5 和VvCHS7 基因均上调表达,其中以VvCHS4 基因上调表达最为显著,说明VvCHS 基因参与盐胁迫、低温诱导和干旱胁迫,这与前人研究结果一致。以上结果表明VvCHS 基因家族的大多数成员受MeJA、SA、ABA和各种非生物胁迫调节的影响,说明VvCHS基因家族在葡萄逆境胁迫应答中起作用。
4 结 论
本研究基于葡萄基因组数据库共鉴定出7 个VvCHS 基因家族成员,分布于5 条不同染色体上。分析发现VvCHS基因家族有4个成员为酸性蛋白,5个成员为稳定性蛋白,6 个成员为亲水性蛋白。蛋白质二级结构均以α-螺旋和无规卷曲为主。该基因家族启动子区域包括低温、干旱及激素响应元件。烟草瞬时表达证明VvCHS3基因定位在细胞核和细胞膜。qRT-PCR 结果表明,该基因家族参与水杨酸和茉莉酸甲酯等外源激素的调控,同时响应低温、干旱和高盐胁迫。
[1]PANDITH S A,RAMAZAN S,KHAN M I,RESHI Z A,SHAH M A. Chalcone synthases (CHSs):The symbolic type III polyketide synthases[J].Planta,2020,251(1):15.
[2]李星,陈默,柴团耀,王红.基于定点突变的植物Ⅲ型聚酮合酶结构与功能研究进展[J].生物工程学报,2018,34(4):473-488.LI Xing,CHEN Mo,CHAI Tuanyao,WANG Hong.Advances in structure-function relation of plant type Ⅲpolyketide synthases by site-directed mutagenesis[J]. Chinese Journal of Biotechnology,2018,34(4):473-488.
[3]JEZ J M,AUSTIN M B,FERRER J L,BOWMAN M E,SCHRÖDER J,NOEL J P. Structural control of polyketide formation in plant-specific polyketide synthases[J]. Chemistry &Biology,2000,7(12):919-930.
[4]WANG Z B,YU Q B,SHEN W X,EL MOHTAR C A,ZHAO X C,GMITTER F G. Functional study of CHS gene family members in citrus revealed a novel CHS gene affecting the production of flavonoids[J].BMC Plant Biology,2018,18(1):189.
[5]DAO T T H,LINTHORST H J M,VERPOORTE R. Chalcone synthase and its functions in plant resistance[J].Phytochemistry Reviews,2011,10(3):397-412.
[6]何春艳,甘露,闫蒙举,张兰,苏浩天,尹淑霞.草地早熟禾查尔酮合成酶基因PpCHS1 克隆、功能与表达分析[J].中国草地学报,2018,40(4):8-15.HE Chunyan,GAN Lu,YAN Mengju,ZHANG Lan,SU Haotian,YIN Shuxia. Cloning,functional and expression analysis of chalcone synthase gene PpCHS1 in Kentucky bluegrass[J].Chinese Journal of Grassland,2018,40(4):8-15.
[7]张变玲,黄雪梅,刘心怡,谢彪,黄合庆,张儒.人参查尔酮合成酶基因PgCHS1 的克隆与表达分析[J].中国细胞生物学学报,2018,40(12):2010-2017.ZHANG Bianling,HUANG Xuemei,LIU Xinyi,XIE Biao,HUANG Heqing,ZHANG Ru.Cloning and expression analysis of chalcone synthase gene PgCHS1 in Panax ginseng[J]. Chinese Journal of Cell Biology,2018,40(12):2010-2017.
[8]马立功,张匀华,孟庆林,石凤梅,刘佳,李易初,王志英.向日葵查尔酮合酶HaCHS 基因的克隆与逆境应答[J].中国油料作物学报,2016,38(1):19-26.MA Ligong,ZHANG Yunhua,MENG Qinglin,SHI Fengmei,LIU Jia,LI Yichu,WANG Zhiying.Cloning and stress response of chalcone synthase gene in sunflower (Helianthus annuus)[J].Chinese Journal of Oil Crop Sciences,2016,38(1):19-26.
[9]CHEN L J,GUO H M,LIN Y,CHENG H M. Chalcone synthase EaCHS1 from Eupatorium adenophorum functions in salt stress tolerance in tobacco[J]. Plant Cell Reports,2015,34(5):885-894.
[10] WANG C H,ZHI S,LIU C Y,XU F X,ZHAO A C,WANG X L,TANG X,LI Z G,HUANG P,YU M D.Isolation and characterization of a novel chalcone synthase gene family from mulberry[J].Plant Physiology and Biochemistry,2017,115:107-118.
[11] YU H N,WANG L,SUN B,GAO S,CHENG A X,LOU H X.Functional characterization of a chalcone synthase from the liverwort Plagiochasma appendiculatum[J]. Plant Cell Reports,2015,34(2):233-245.
[12] WANG W K,SCHAAL B A,CHIOU Y M,MURAKAMI N,GE X J,HUANG C C,CHIANG T Y. Diverse selective modes among orthologs/paralogs of the chalcone synthase (Chs) gene family of Arabidopsis thaliana and its relative A. halleri ssp.gemmifera[J].Molecular Phylogenetics and Evolution,2007,44(2):503-520.
[13] HAN Y H,CAO Y P,JIANG H Y,DING T.Genome-wide dissection of the chalcone synthase gene family in Oryza sativa[J].Molecular Breeding,2017,37(10):119.
[14] SCHIJLEN E G W M,RIC DE VOS C H,MARTENS S,JONKER H H,ROSIN F M,MOLTHOFF J W,TIKUNOV Y M,ANGENENT G C,VAN TUNEN A J,BOVY A G.RNA interference silencing of chalcone synthase,the first step in the flavonoid biosynthesis pathway,leads to parthenocarpic tomato fruits[J].Plant Physiology,2007,144(3):1520-1530.
[15] YAHYAA M,ALI S,DAVIDOVICH-RIKANATI R,IBDAH M,IBDAH M,SHACHTIER A,EYAL Y,LEWINSOHN E,IBDAH M. Characterization of three chalcone synthase- like genes from apple(Malus×domestica Borkh.)[J].Phytochemistry,2017,140:125-133.
[16] LU X,ZHOU W,GAO F. Cloning,characterization and localization of CHS gene from blood orange,Citrus sinensis(L.)Osbeck cv. Ruby[J]. Molecular Biology Reports,2009,36(7):1983-1990.
[17] JIANG C G,SCHOMMER C K,KIM S Y,SUH D Y. Cloning and characterization of chalcone synthase from the moss,Physcomitrella patens[J]. Phytochemistry,2006,67(23):2531-2540.
[18] MA L Q,PANG X B,SHEN H Y,PU G B,WANG H H,LEI C Y,WANG H,LI G Y,LIU B Y,YE H C. A novel type III polyketide synthase encoded by a three-intron gene from Polygonum cuspidatum[J].Planta,2009,229(3):457-469.
[19] 马宗桓,毛娟,李文芳,杨世茂,吴金红,陈佰鸿.葡萄SnRK2家族基因的鉴定与表达分析[J]. 园艺学报,2016,43(10):1891-1902.MA Zonghuan,MAO Juan,LI Wenfang,YANG Shimao,WU Jinhong,CHEN Baihong. Identification and expression profile of the SnRK2 family genes in grapevine[J].Acta Horticulturae Sinica,2016,43(10):1891-1902.
[20] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2- ΔΔCT method[J].Methods,2001,25(4):402-408.
[21] 汪结明,王凤玲,李瑞雪,魏万亮.矮牵牛的查尔酮合酶(CHS)基因的生物信息学分析[J].农学学报,2011,1(4):34-39.WANG Jieming,WANG Fengling,LI Ruixue,WEI Wanliang.Analysis on bioinformatics of chalcone synthetase gene in Petunia hybrida Vilm.[J].Journal of Agriculture,2011,1(4):34-39.
[22] 汪孟曦,李文兰,张争,魏建和,杨云,徐艳红,梁良.白木香查尔酮合酶(AsCHS1)基因的克隆和生物信息学分析[J].中国中药杂志,2013,38(2):149-153.WANG Mengxi,LI Wenlan,ZHANG Zheng,WEI Jianhe,YANG Yun,XU Yanhong,LIANG Liang.Cloning and bioinformatics analysis of chalcone synthase(AsCHS1)gene in Aquilaria sinensis[J].China Journal of Chinese Materia Medica,2013,38(2):149-153.
[23] 徐婉莉,裴徐梨,荆赞革,熊自立.辣椒查尔酮合成酶基因家族全基因组鉴定及表达特征分析[J]. 基因组学与应用生物学,2015,34(8):1747-1752.XU Wanli,PEI Xuli,JING Zange,XIONG Zili. Genome-wide identification and expression analysis of chalcone synthase gene in pepper[J].Genomics and Applied Biology,2015,34(8):1747-1752.
[24] 赵伟,李琳,刘永辉,章露露,杨莹,孟海军,王磊,吴国良.红仁核桃自然杂交后代不同表型叶片差异表达CHS 基因的鉴定及生物信息学分析[J].果树学报,2021,38(2):179-191.ZHAO Wei,LI Lin,LIU Yonghui,ZHANG Lulu,YANG Ying,MENG Haijun,WANG Lei,WU Guoliang. Identification and bioinformatics analysis of CHS genes in different phenotypic leaves of natural hybrid progenies of red-kernel walnut[J].Journal of Fruit Science,2021,38(2):179-191.
[25] 章妮,暴涵,崔博亮,陈克龙.毛竹查尔酮合成酶基因家族全基因组分析[J].分子植物育种,2022,20(3):817-825.ZHANG Ni,BAO Han,CUI Boliang,CHEN Kelong. Genomic analysis of chalcone synthase gene family of Phyllostachys edulis[J].Molecular Plant Breeding,2022,20(3):817-825.
[26] 何梦媛,姚华,李国治,杨茂,沈海涛.甘草CHS 基因家族鉴定、表达特性分析及其与甘草查尔酮A 积累的关系研究[J].植物生理学报,2022,58(1):141-154.HE Mengyuan,YAO Hua,LI Guozhi,YANG Mao,SHEN Haitao.Identification of CHS gene family and analysis of its expression characteristics in relation to the accumulation of licochalcone A in Chinese licorice (Glycyrrhiza uralensis)[J]. Plant Physiology Journal,2022,58(1):141-154.
[27] 梅志栋,张贺,刘晓妹,黄建峰,蒲金基.杧果查尔酮合成酶基因(CHS1)的克隆与表达分析[J]. 果树学报,2015,32(6):1077-1084.MEI Zhidong,ZHANG He,LIU Xiaomei,HUANG Jianfeng,PU Jinji. Cloning and expression analysis of chalcone synthase gene(CHS1)from mango[J].Journal of Fruit Science,2015,32(6):1077-1084.
[28] 王毅,肖良俊,马婷,宁德鲁.低温诱导泡核桃中查尔酮合成酶基因克隆及功能分析[J].分子植物育种,2018,16(2):386-391.WANG Yi,XIAO Liangjun,MA Ting,NING Delu. Cloning and functional analysis of chalcone synthase gene in cold-induced Juglans sigillata[J]. Molecular Plant Breeding,2018,16(2):386-391.
[29] 潘德灼,林伟彬,谭芳林,陈伟.红树植物秋茄查尔酮合酶基因克隆及其在盐胁迫下的表达分析[J]. 福建农林大学学报(自然科学版),2017,46(2):180-186.PAN Dezhuo,LIN Weibin,TAN Fanglin,CHEN Wei. Cloning and expression analysis of chalcone synthase gene from mangrove tree Kandelia candel under salt stress[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition),2017,46(2):180-186.
[30] 王海波,邹竹荣,龚明.小桐子低温诱导查耳酮合酶基因的克隆及其表达分析[J].热带亚热带植物学报,2015,23(4):370-378.WANG Haibo,ZOU Zhurong,GONG Ming. Cloning and expression analysis of chilling-induced chalcone synthase gene from Jatropha curcas[J]. Journal of Tropical and Subtropical Botany,2015,23(4):370-378.