番木瓜(Carica papaya L.)是广泛分布于全球热带亚热带区域的重要果树,具有丰富的营养价值和药用价值[1],被世界卫生组织列为最有营养价值的十大水果之首[2]。随着消费者对番木瓜认识的提高、消费者保健意识的增强以及番木瓜储存运输技术的发展进步,番木瓜逐渐受到广大消费者的青睐,成为在中国农业品种结构调整和乡村振兴中发挥重要作用的经济作物[3-4]。然而,番木瓜环斑花叶病毒病(Papaya ringspot virus,PRSV)严重限制了番木瓜产业的发展,其抗病品种的培育成为产业发展的关键[5]。可食用番木瓜抗病资源匮乏,栽培种遗传基础狭窄,通过传统的杂交育种难以培育出抗病品种[5-6];而分子育种技术则可有效地改良品种的抗病性,对PRSV 具有高抗性的华农1 号已成功培育并在我国释放种植[7]。
建立高效植株再生技术体系是番木瓜分子育种技术研发的基础。前人曾较多地报道直接利用番木瓜胚性愈伤组织诱导体细胞胚发生并获得植株再生[8-13],但该途径存在基因型依赖、体细胞胚发育不同步、胚根端愈伤化导致生根质量差、体细胞胚发生率和植株再生率低等问题[14],这些限制了转基因技术的广泛应用。基于此,笔者在本研究中旨在建立一种基于胚性细胞悬浮培养的高效植株再生技术体系,提高体细胞胚发生和发育的同步性及其植株再生率,以期为番木瓜大量离体快繁、细胞工程育种和分子育种提供技术支撑。
1 材料和方法
1.1 材料
以广东省农业科学院果树研究所番木瓜种质资源圃中紫晖品种为试验材料,该品种具有丰产、优质且适应性强等特性[15]。定植时采用组织培养两性株种苗,采用常规管理办法,植株生长正常。
1.2 外植体的选择与处理
选择生长势旺盛的健康植株,挂牌标记两性花开花日期。取开花坐果后110~120 d 的果实,参照魏岳荣等[4]的方法对果实进行表面消毒,纵向切开后收集种子,分离未成熟合子胚作为外植体。
1.3 愈伤组织诱导
将外植体接种于装有30 mL愈伤组织诱导培养基(MCI)的100 mL 锥形瓶中,在(27±1)℃下暗培养。MCI基本组成为:1/2 MS培养基+400 mg·L-1谷氨酰胺+60 g·L-1蔗糖+7 g·L-1琼脂粉,pH值5.8。为观察2,4-二氯苯氧乙酸(2,4-Dichlorophenoxyacetic acid,2,4-D)质量浓度对愈伤组织诱导的影响,本试验共设1、2、3、4和5 mg·L-1共5个2,4-D质量浓度处理,以不添加2,4-D 为对照。每个处理接种5 瓶,每瓶接种外植体7 个,3 次重复。培养60 d 后,统计愈伤组织和胚性愈伤组织诱导率。
1.4 胚性愈伤组织的增殖培养
挑选松散易碎的浅黄色胚性愈伤组织团进行继代培养,继代培养基为MCI 基本培养基,并根据1.3胚性愈伤组织诱导率统计结果添加适宜质量浓度的2,4-D,培养条件与1.3相同。继代时剔除褐化、致密组织和非胚性愈伤组织,继代周期为28~30 d。
1.5 胚性愈伤组织的液体培养、筛选和均质胚性细胞悬浮系的建立
取优质胚性愈伤组织约2 g,加入到装有30 mL液体培养基(ML)的100 mL 锥形瓶中,在黑暗条件下,(27±1)℃、110 r·min-1振荡培养。ML 组成为胚性愈伤组织继代增殖培养基成分去除琼脂粉,pH值5.8。初次悬浮培养7 d 后,参照魏岳荣等[16]的方法对培养物进行筛选和继代培养,滤除大颗粒愈伤组织、细胞团和体细胞胚,直至获得细胞分散且稳定增殖的均质胚性细胞悬浮系(embryogenic cell system,ECS)。后期ECS 继代过程中,每次取5 mL ECS 加入25 mL新鲜培养基中,继代周期为21 d。
1.6 体细胞胚的诱导和成熟培养
取继代培养后第10 天的ECS 5 mL,静置后去除培养液,加入体细胞胚诱导培养基(MSI)30 mL,MSI 组成为1/2 MS 盐+MS 维生素+50 mg·L-1肌醇+400 mg·L-1谷氨酰胺+30 g·L-1蔗糖,pH 值5.8,110 r·min-1振荡培养21 d。将诱导的体细胞胚转移至装有20 mL体细胞胚成熟培养基(MSM)、表面铺有一层滤纸的培养皿(直径9.0 cm)内,在(27±1)℃、黑暗条件下培养30~45 d,期间每15 d 更新一次培养基。MSM组成为MSI+5 g·L-1活性炭(activated carbon,AC)+4.0 g·L-1凝胶,pH值5.8。
1.7 体细胞胚的萌发和生根培养
挑选发育正常的子叶期体细胞胚,在加有萌发培养基(MG)的培养皿(直径9.0 cm)中萌发培养。MG 基本组成为MS+30 g·L-1蔗糖+7 g·L-1琼脂粉,pH 值5.8。为观察6-苄基氨基嘌呤(6-Benzylaminopurine,6-BA)、萘乙酸(1-naphthlcetic acid,NAA)和AC 组合对体细胞胚萌发和生根的影响,试验共设MG1(0.4 mg·L-1 6-BA+0.02 mg·L-1 NAA)、MG2(0.1 mg·L-1 6-BA+0.1 mg·L-1 NAA+5 g·L-1 AC)、MG3(0.4 mg·L-1 6-BA+0.02 mg·L-1 NAA+5 g·L-1 AC)、MG4(0.4 mg·L-1 6-BA+0.2 mg·L-1 NAA+5 g·L-1 AC)、MG5(0.1 mg·L-1 NAA+5 g·L-1 AC)和MSM 共6 个处理,在(27±1)℃、12 h/12 h 光周期条件下培养,光照度54 μmol·m-2·s-1。培养21 d 后统计体细胞胚萌发率、生根率、同步萌发和生根率及愈伤化比率。
1.8 植株再生和驯化培养
挑选正常萌发和生根的体细胞胚,转移到植株再生培养基(MR)促进地上部和根系发育。MR 组成为1/2 MS+0.1 mg·L-1 6-BA+2 mg·L-1吲哚丁酸(3-Indolebutyric acid,IBA)+10 g·L-1活性炭+30 mg·L-1蔗糖+7 g·L-1琼脂粉,pH 值5.8,培养条件与1.7 相同。30 d 后统计植株再生率。轻轻拔出再生小植株,移栽到含有2/3泥炭土+1/3蛭石(体积分数)的基质营养杯中,在温室大棚中进行驯化培养45~60 d,当植株生长发育至15 cm后即可移植到田间生长。
1.9 统计分析
各试验处理均设置3次重复,使用SPSS 15.0软件进行数据分析。采用Duncan’s 多重比较法进行差异显著性测验。
2 结果与分析
2.1 外植体未成熟合子胚的分离获取
本试验以紫晖坐果后110~120 d果实种子(图1-A)的合子胚为外植体进行愈伤组织诱导。观察发现,110~120 d 龄果实种子为未成熟种子,外层为白色肉质外种皮,内层中种皮仍为白色,尚未硬化。将种子置于超静工作台面的无菌滤纸中央,剥离外种皮后,以手术刀背面按压种子中部,使内层种皮轻微破裂,然后轻轻按压种子基部至中部,即可挤压分离出完整的未成熟合子胚(图1-B)。

图1 紫晖番木瓜未成熟合子胚愈伤组织诱导和增殖培养
Fig.1 Callus induction and proliferation from immature zygotic embryos of Zihui cultivar
2.2 愈伤组织诱导
接种至愈伤组织诱导培养基3 d后,未成熟合子胚开始膨大。15 d后,含有2,4-D的所有处理中未成熟合子胚开始愈伤组织分化,不含2,4-D的对照处理则未见愈伤组织形成。在愈伤组织诱导过程中,可观察到浅褐色海绵状愈伤组织(图1-C a)、白色粉状愈伤组织(图1-C b)、浅黄色透明状愈伤组织(图1-D)和浅黄色松散易碎的胚性愈伤组织(图1-E)。随着培养时间的延长,部分胚性愈伤组织表面可观察到丛状体细胞胚(图1-E a)的发生。
诱导培养60 d 后,统计愈伤组织和胚性愈伤组织诱导率。结果表明,1 mg·L-1 2,4-D 处理愈伤组织诱导率为41.90%,2~5 mg·L-1 2,4-D 处理均能诱导50%以上未成熟合子胚形成愈伤组织,其中4 mg·L-1 2,4-D 处理可获得92.38%的最高愈伤组织诱导率。就胚性愈伤组织诱导率而言,4 mg·L-1 2,4-D 处理效果最好,可达62.86%;其次为3 mg·L-1 2,4-D 处理,两者无显著差异。当2,4-D 质量浓度增加至5 mg·L-1时,胚性愈伤组织诱导率下降至38.10%(表1)。
表1 不同质量浓度2,4-D 对紫晖番木瓜未成熟合子胚愈伤组织诱导的影响
Table 1 Effects of different concentrations of 2,4-D on callus induction from immature zygotic embryos of Zihui cultivar
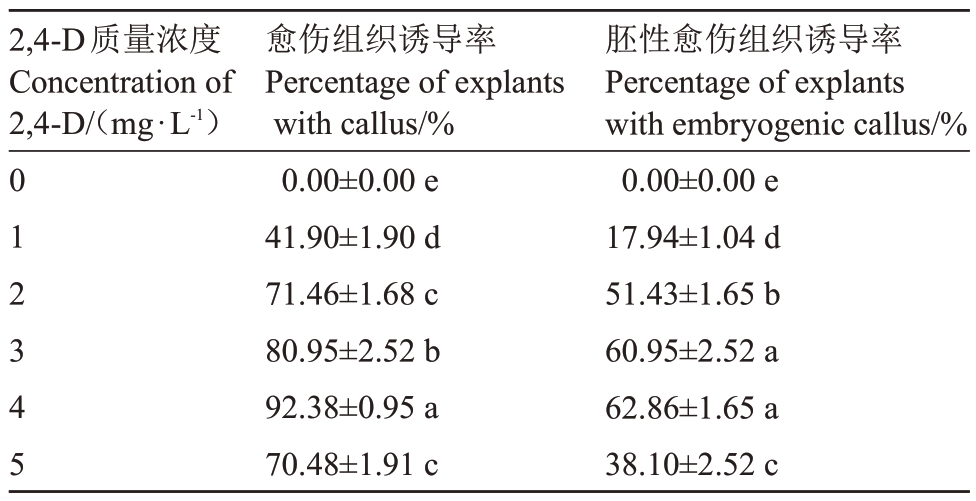
注:表中数据代表平均值±标准误,不同字母表示不同试验处理条件下的显著性差异(p<0.05)。
Note:Mean ± SE followed by the different letter are significantly different at p<0.05 according to Duncan’s multiple range tests.
2,4-D质量浓度Concentration of 2,4-D/(mg·L-1)胚性愈伤组织诱导率Percentage of explants with embryogenic callus/%0.00±0.00 e 17.94±1.04 d 51.43±1.65 b 60.95±2.52 a 62.86±1.65 a 38.10±2.52 c 012345愈伤组织诱导率Percentage of explants with callus/%0.00±0.00 e 41.90±1.90 d 71.46±1.68 c 80.95±2.52 b 92.38±0.95 a 70.48±1.91 c
2.3 胚性愈伤组织的增殖培养
为提高胚性愈伤组织质量,增加胚性愈伤组织数量,挑取胚性愈伤组织团,剔除褐化组织及非胚性愈伤组织,转移至含4 mg·L-1 2,4-D的MCI培养基中进行增殖培养。3个继代周期后可获得大量松散易碎的优质胚性愈伤组织(图1-F)。
2.4 胚性愈伤组织的液体培养、筛选和均质胚性细胞悬浮系的建立
优质胚性愈伤组织被转移至液体培养基后,在摇床的振荡作用下,愈伤组织团较易散开,无褐化现象。继代过程中,使用不同孔径的筛网滤除体积较大的愈伤组织团块、大细胞团和已形成的体细胞胚等培养物。5 个继代周期后,可获得由大量单细胞和小细胞团组成的均质的胚性细胞悬浮系(图2-A~B)。

图2 紫晖番木瓜均质胚性细胞悬浮系及其体细胞胚的诱导与成熟培养
Fig.2 Somatic embryos induction and maturation of Zihui cultivar from homogeneous embryogenic cell suspension
2.5 体细胞胚的诱导和成熟培养
均质胚性细胞在液体体细胞胚诱导培养基中经1 个继代周期(21 d)的培养后,可形成大量球形胚(图2-C)。将球形胚转移到含有5 g·L-1 AC 的半固体体细胞胚成熟培养基培养30~45 d(图2-D),可逐步发育为成熟的子叶期体细胞胚(图2-E),该过程中体细胞胚发生和发育的同步性较好。
2.6 体细胞胚的萌发和生根培养
挑选成熟的子叶期体细胞胚接种于含0.4 mg·L-1 6-BA+0.02 mg·L-1 NAA 体细胞胚萌发培养基MG1中培养(图3-A),3 d 后可见体细胞胚开始萌发,7 d后可见到萌发的绿色子叶(图3-B),同时体细胞胚根端开始出现愈伤化。培养21 d 后,萌发的体细胞胚已具备完整的下胚轴、子叶和芽(图3-C),萌发率97.58%,但胚根端愈伤化严重,愈伤化比率为95.48%,有少量生根,同步生根率为18.18%(表2),根系数量少且质量差。该途径萌发的芽可用于增殖,但均表现出基部愈伤化(图3-D),生根难度大。
表2 不同质量浓度激素和活性炭对紫晖番木瓜体细胞胚萌发和生根的影响
Table 2 Effects of different concentrations of phytohormones and activated carbon on germination and rooting of somatic embryos of Zihui cultivar

注:表中数据代表(平均值±标准误),不同字母表示不同试验处理条件下的显著性差异(p<0.05)。
Note:(Mean±SE)followed by the different letter are significantly different at p<0.05 according to Duncan’s multiple range tests.
培养基Medium ρ(活性炭)Content of activated carbon/(g·L-1)MG1 MG2萌发率Germination rate/%97.58±0.63 a 96.19±0.86 ab生根率Rooting rate/%18.18±1.04 e 83.33±2.07 c同步萌发和生根率Synchronous germination and rooting rate/%18.18±1.04 e 80.47±1.86 c愈伤化比率Callus formation rate/%95.48±0.63 a 55.95±0.63 d MG393.81±0.63 bc 95.95±1.19 a 92.62±1.45 a 33.10±1.86 e MG492.62±1.45 c 88.1±0.24 b 84.05±3.20 bc 74.76±1.26 b MG5 MSM激素组成Phytohormone composition and content 0.4 mg·L-1 6-BA+0.02 mg·L-1 NAA 0.1 mg·L-1 6-BA+0.1 mg·L-1 NAA 0.4 mg·L-1 6-BA+0.02 mg·L-1 NAA 0.4 mg·L-1 6-BA+0.2 mg·L-1 NAA 0.1 mg·L-1 NAA 005555566.43±1.09 c 11.67±0.63 f 95.71±1.65 abc 97.86±0.71 a 69.05±1.67 d 88.33±0.63 b 66.19±1.56 d 88.33±0.63 ab
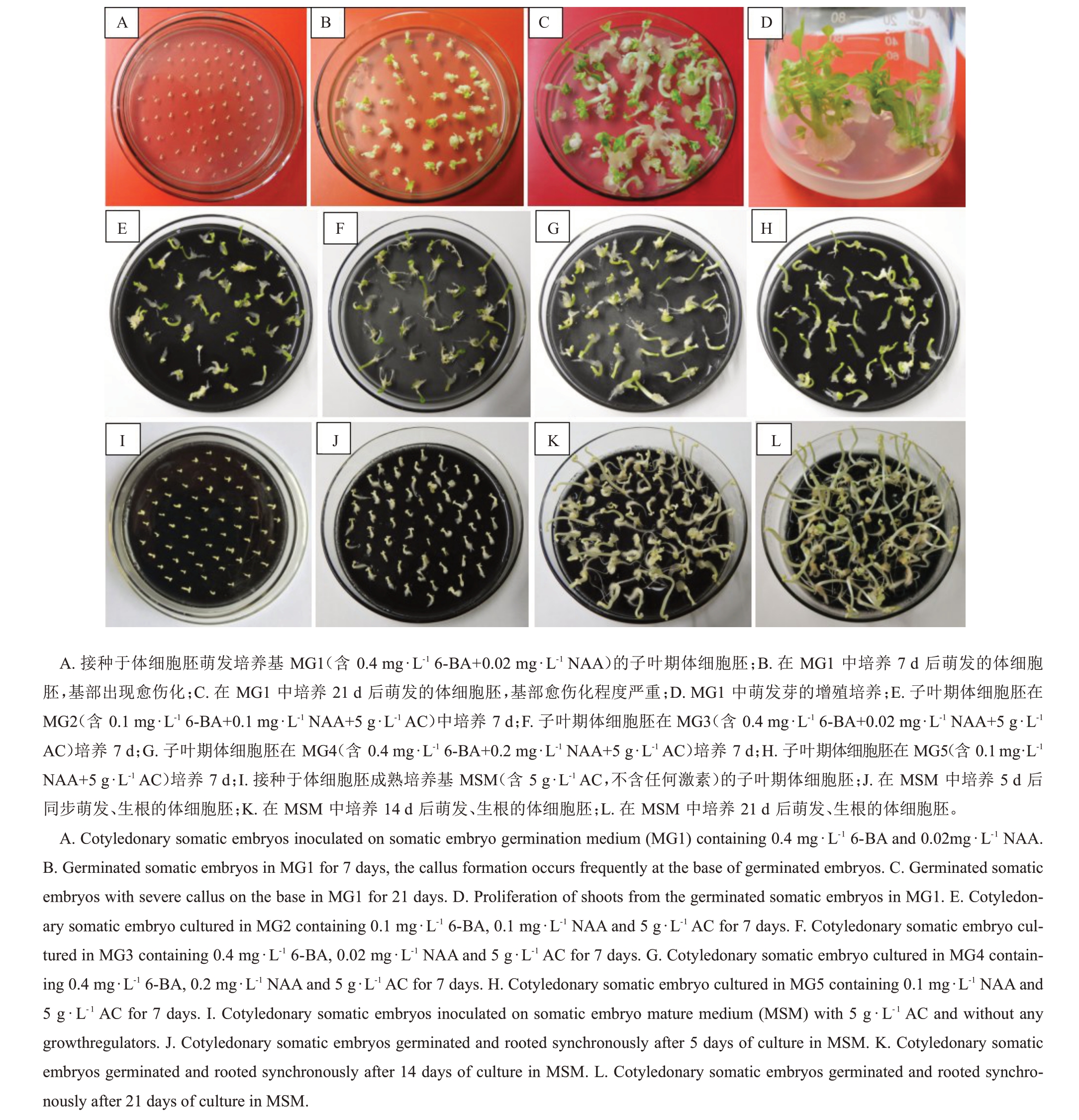
图3 紫晖番木瓜体细胞胚的萌发和生根
Fig.3 Germination and rooting of somatic embryos of Zihui cultivar
基于此,为改善番木瓜体细胞胚的萌发和生根质量,笔者在本试验中比较了不同质量浓度6-BA和NAA 组合及AC 的作用效果(表2)。结果表明,与MG1 培养基比较而言,5 g·L-1活性炭的添加,可有效促进成熟的子叶期体细胞胚萌发和生根同步进行,同时显著降低愈伤化程度。MG2(图3-E)、MG3(图3-F)、MG4(图3-G)和MG5(图3-H)培养基中体细胞胚的同步萌发和生根率分别为80.47%、92.62%、84.05%和66.19%,愈伤化比率分别为55.95%、33.10%、74.76%和66.43%(表2),其中含0.4 mg·L-1 6-BA+0.02 mg·L-1 NAA+5 g·L-1 AC的MG3 培养基促体细胞胚萌发和生根效果最佳。综合以上结果分析,不同质量浓度的6-BA 和NAA的添加会导致萌发体细胞胚根端及根系的愈伤化,而AC的添加可显著降低愈伤化程度。
将成熟的子叶期体细胞胚接种于含5 g·L-1活性炭的不含任何激素的MSM 培养基中培养(图3-I),3 d 后即可见到体细胞胚下胚轴膨大伸长和基部生根,5 d后根部出现大量根毛(图3-J),14 d后体细胞胚萌发率为97.86%(图3-K),同步生根率为88.33%,其中已萌发但未能生根的体细胞胚基部表现为轻度愈伤化,愈伤化比率为11.67%(表2)。培养21 d后,萌发生根的体细胞胚表现为下胚轴伸长、根系伸长且数量增加,未见愈伤化比率升高情况出现(图3-L)。
2.7 植株再生和驯化
将萌发和生根的体细胞胚移植到含0.1 mg·L-1 6-BA+2 mg·L-1 IBA+10 g·L-1AC的植株再生培养基培养30 d后,可获得具有6~8枚锥形小叶、根系发育良好的健康植株(图4-A~B),植株再生率为81.36%。将上述植株轻轻拔出并清洗干净根系附带琼脂,移植到透气基质中,在前期加强保湿的情况下,经45~60 d 驯化培养,可获得具8~10 枚真叶的种苗(图4-C),并移植到田间进行性状观察。

图4 来源于紫晖番木瓜胚性细胞悬浮系的体细胞胚再生植株和驯化培养
Fig.4 Plant regeneration from somatic embryos from embryogenic cell suspensions of Zihui cultivar and acclimatization
3 讨论
3.1 番木瓜未成熟合子胚的有效分离获取及其胚性发生效果
番木瓜未成熟合子胚体积较小,长约3 mm,常规分离方法是在体视显微镜的辅助下进行剥离,操作难度较大,速度慢,效率低,且合子胚完整性差。笔者在本试验中采用肉眼分离法,通过挤压方式可有效分离获取未成熟合子胚。该方法无需体视显微镜的辅助,简单易操作,速度快,且分离的合子胚完整性好,可大大提高工作效率。
由体细胞启动间接器官发生的过程包括胚性诱导和形态建成2 个阶段,其中体细胞脱分化形成胚性愈伤组织的诱导阶段非常关键,直接决定了后期形态建成和植株再生的成败与效率,而胚性愈伤组织的诱导跟外植体材料密切相关。自1980 年Litz等[17]开展番木瓜体细胞胚性诱导研究以来,使用的外植体类型包括子叶[9,11,18-19]、下胚轴[12-13,19-21]、叶片[18-19,22]、叶柄[22]、茎尖[11,18]、茎段[18,23]、幼根[18,23-24]、胚珠[25-26]、合子胚等[4,8-10,12,14,19,27-29]。综合文献结果及项目组前期研究数据(未公开发表)分析,以子叶、叶片、叶柄、茎和根为外植体时,愈伤组织诱导率可达50%~95%,但胚性愈伤组织诱导率低,体细胞胚发生能力较弱,且不同基因型材料之间差异显著;而下胚轴、胚珠、合子胚则具有较高的胚性发生潜力,胚性愈伤组织诱导率可达到30%~77.5%,体细胞胚形成效果好,植株再生率高。被利用的合子胚可分为90~120 d 果实未成熟合子胚和成熟合子胚2 种,综合比较而言,本试验采用的110~120 d 的未成熟合子胚胚性诱导效果更佳,是番木瓜间接器官发生和高效植株再生的理想外植体材料。
3.2 不同质量浓度2,4-D对番木瓜未成熟合子胚胚性诱导的影响
体细胞脱分化受多种物理和化学因素的影响,其中生长素在体细胞向胚性状态的转变过程中起着重要作用,通过染色质修饰和激活特定转录因子来诱导相关基因表达[30-32]。就番木瓜胚性诱导而言,前人曾报道2,4-D是最佳化合物[8],并在后续相关研究中被广泛应用[9-13,27]。基于各种试验材料的基因型、外植体类型、外源植物生长调节剂组合效果等差异,2,4-D处理质量浓度介于1~10 mg·L-1之间,胚性愈伤组织诱导效果差异显著。其中以10 mg·L-1 2,4-D +250 mg·L-1 Carbenicillin 处理马来西亚番木瓜品种Eksotika 90~100 d 龄果实合子胚,胚性愈伤组织诱导率最高可达到77.5%[27]。本试验中,以自主选育番木瓜新品种紫晖为试验材料,利用110~120 d龄果实的未成熟合子胚为外植体,在不添加其他植物生长调节剂的情况下,1~5 mg·L-1 2,4-D处理均能诱导形成胚性愈伤组织,其中4 mg·L-1 2,4-D 处理效果最佳,能诱导62.33%的外植体获得质量良好的浅黄色、松散易碎型胚性愈伤组织。鉴于胚性诱导阶段2,4-D 的添加可能会导致体细胞胚异常和无性系变异的发生[17,30],在实际应用中,不同品种和试验体系中2,4-D 处理质量浓度与无性系变异发生之间的关系仍需验证,应根据具体试验目的进行综合考虑和选择。
3.3 番木瓜均质胚性细胞悬浮系建立的作用与重要性
诱导获得的浅黄色、松散易碎型胚性愈伤组织可在固体培养基中得到有效增殖,生长速度适中。随着继代时间的延长,在胚性愈伤组织表面可形成丛生状体细胞胚。在笔者及前人的研究中,通常直接利用胚性愈伤组织进行体细胞胚的诱导和成熟培养,从而获得植株再生,但该途径均表现出体细胞胚发育不同步、植株再生率低的特点[4,11-12]。ECS 具有增殖率高、培养物同步的优势[33],本试验经5次继代筛选培养后,可建立由生理状态较一致的单细胞和小细胞团富集组成的均质ECS,体细胞胚诱导和成熟同步性好,可同时获得大量发育成熟的子叶形体细胞胚,为后续体细胞胚的同步萌发和生根奠定了基础。因此,均质ECS的建立成为番木瓜高效植株再生技术的关键。
3.4 番木瓜体细胞胚萌发和生根的同步化培养
目前番木瓜间接器官发生过程通常是先诱导成熟体细胞胚萌发,然后再诱导生根。在体细胞胚萌发过程中,往往添加6-BA、NAA等一些生长调节剂来促进萌发[8,25]。然而,目前的技术体系中最大的瓶颈在于萌发的体细胞胚胚根端极易出现愈伤化,并抑制有效根系的形成[10]。这是因为番木瓜组织培养过程中对生长素类物质极为敏感[34],体细胞胚具有结合生长素的能力,这些生长素在随后的分化过程中排入培养基,从而产生愈伤组织[35]。本试验体系进一步验证了该问题的存在,0.4 mg·L-1 6-BA+0.02 mg·L-1 NAA组合在促进97.73%体细胞胚萌发的同时,导致95.45%的体细胞胚根端出现愈伤化,有效根系少,大大降低了植株再生率和存活率。补充添加5 g·L-1AC则可有效促进93.33%体细胞胚萌发和生根同步进行,同时显著降低愈伤化比率至33.37%。同时,笔者在本研究中发现,成熟的子叶期体细胞胚在含有5 g·L-1 AC、不添加任何植物生长调节剂的体细胞胚成熟培养基中可实现同步萌发和生根,同步萌发和生根率可达88.53%,且愈伤化程度轻,愈伤化比率仅11.47%。由此可见,就番木瓜发育成熟的子叶期体细胞胚的萌发和生根而言,6-BA 和NAA 并非必需因素。AC对番木瓜体细胞胚萌发和生根的积极效果与在栎树、卫矛上的报道相似[36-37],这可能与AC具有吸附发育组织释放的生长素类物质和次级代谢产物的作用密切相关[38-40]。
4 结论
以紫晖110~120 d 未成熟合子胚为外植体,最佳的胚性愈伤组织诱导培养基为1/2 MS 培养基+4 mg·L-1 2,4-D+400 mg·L-1谷氨酰胺+ 60 g·L-1蔗糖。经5 次继代筛选培养后,可建立由生理状态较一致的单细胞和小细胞团富集组成的均质ECS。最优体细胞胚发生方案为ECS 经液体培养方式诱导球形胚形成,在含1/2 MS 盐+MS 维生素+50 mg·L-1肌醇+400 mg·L-1谷氨酰胺+30 g·L-1蔗糖+5 g·L-1 AC的培养基中促进体细胞胚的成熟及后续的同步萌发和生根,可有效缓解胚根端愈伤化现象。
[1] DOTTO J M,ABIHUDI S A. Nutraceutical value of Carica papaya:A review[J].Scientific African,2021,13:e00933.
[2] 周鹏,王树昌,沈文涛,言普,黎小瑛.我国番木瓜抗环斑病毒种质资源创新研究及应用[J].热带农业科学,2013,33(5):51-55.ZHOU Peng,WANG Shuchang,SHEN Wentao,YAN Pu,LI Xiaoying. Innovation research and application of anti-PRSV Carica papaya germplasm resources in China[J]. Chinese Journal of Tropical Agriculture,2013,33(5):51-55.
[3] 林冠雄,周常清,游恺哲,李卫红.我国番木瓜育种研究进展与展望[J].广东农业科学,2005,32(4):22-24.LIN Guangxiong,ZHOU Changqing,YOU Kaizhe,LI Weihong.Current research progress and prospect of papaya in China[J].Guangdong Agricultural Science,2005,32(4):22-24.
[4] 魏岳荣,陈彩霞,杨敏,黄炳雄,杨护.番木瓜成熟种子的体细胞胚简易诱导和植株再生[J]. 分子植物育种,2018,16(12):4010-4015.WEI Yuerong,CHEN Caixia,YANG Min,HUANG Bingxiong,YANG Hu.A simple protocol of plant regeneration of Carica papaya L. through somatic embryogenesis from mature seeds[J].Molecular Plant Breeding,2018,16(12):4010-4015.
[5] 黄建昌,肖艳,赵春香.番木瓜遗传改良研究进展[J].果树学报,2005,22(1):60-65.HUANG Jianchang,XIAO Yan,ZHAO Chunxiang. Advances and prospects on genetic improvement in Carica papaya[J].Journal of Fruit Science,2005,22(1):60-65.
[6] DHEKNEY S A,KANDEL R,BERGEY D R,SITTHER V,SOORIANATHASUNDARAM K,LITZ R E.Advances in Papaya biotechnology[J]. Biocatalysis and Agricultural Biotechnology,2016,5:133-142.
[7] MO C P,WU Z L,XIE H P,ZHANG S G,LI H P. Genetic diversity analysis of Papaya leaf-distortion mosaic virus isolates infecting transgenic Papaya Huanong No. 1 in South China[J].Ecology and Evolution,2020,10(20):11671-11683.
[8] FITCH M M M,MANSHARDT R M. Somatic embryogenesis and plant regeneration from immature zygotic embryos of Papaya (Carica papaya L.)[J]. Plant Cell Reports,1990,9(6):320-324.
[9] 曾继吾,易干军,张秋明.番木瓜体胚发生及植株再生研究[J].果树学报,2003,20(6):471-474.ZENG Jiwu,YI Ganjun,ZHANG Qiuming.Somatic embryogenesis and plant regeneration of papaya[J]. Journal of Fruit Science,2003,20(6):471-474.
[10] POSADA-PÉREZ L,MONTESINOS Y P,GUERRA D G,DANIELS D,ÓMEZ-KOSKY R. Complete germination of Papaya (Carica papaya L. cv.‘Maradol Roja’) somatic embryos using temporary immersion system type RITA® and phloroglucinol in semi-solid culture medium[J].In Vitro Cellular&Developmental Biology-Plant,2017,53(5):505-513.
[11] CIPRIANO J L D,CRUZ A C F,MANCINI K C,SCHMILDT E R,LOPES J C,OTONI W C,ALEXANDRE R S. Somatic embryogenesis in Carica papaya as affected by auxins and explants,and morphoanatomical-related aspects[J].Anais Da Academia Brasileira De Ciências,2018,90(1):385-400.
[12] SOLÓRZANO- CASCANTE P,SÁNCHEZ- CHIANG N,JIMÉNEZ V M. Explant type,culture system,6-benzyladenine,meta-topolin and encapsulation affect indirect somatic embryogenesis and regeneration in Carica papaya L.[J]. Frontiers in Plant Science,2018,9:1769.
[13] ZHAO X B,SONG J J,ZENG Q X,MA Y Y,FANG H M,YANG L Y,DENG B,LIU J,FANG J P,ZUO L P,YUE J J.Auxin and cytokinin mediated regulation involved in vitro organogenesis of Papaya[J]. Journal of Plant Physiology,2021,260:153405.
[14] AL-SHARA B,TAHA R M,MOHAMAD J,ELIAS H,KHAN A.Somatic embryogenesis and plantlet regeneration in the Carica papaya L.cv.Eksotika[J].Plants,2020,9(3):360.
[15] 魏岳荣,杨护,周陈平,邝瑞彬,黄炳雄,杨敏.优质丰产番木瓜新品种紫晖的选育[J].果树学报,2022,39(6):1129-1132.WEI Yuerong,YANG Hu,ZHOU Chenping,KUANG Ruibin,HUANG Bingxiong,YANG Min.Breeding of a new papaya cultivar Zihui with good quality and high yield[J]. Journal of Fruit Science,2022,39(6):1129-1132.
[16] 魏岳荣,黄学林,李佳,黄霞,李哲,李筱菊.贡蕉胚性细胞悬浮系的建立和植株再生[J].生物工程学报,2005,21(1):58-65.WEI Yuerong,HUANG Xuelin,LI Jia,HUANG Xia,LI Zhe,LI Xiaoju. Establishment of embryogenic cell suspension culture and plant regeneration of edible banana Musa acuminata cv.Mas (AA)[J]. Chinese Journal of Biotechnology,2005,21(1):58-65.
[17] LITZ R E,CONOVER R A. Somatic embryogenesis in cell cultures of Carica stipulata1[J].HortScience,1980,15(6):733-734.
[18] CHEN M H,WANG P J,MAEDA E. Somatic embryogenesis and plant regeneration in Carica papaya L. tissue culture derived from root explants[J]. Plant Cell Reports,1987,6(5):348-351.
[19] 蔡雪玲,陈晓静,申艳红,何玮毅.番木瓜胚性愈伤组织的诱导及体胚发生[J].福建农林大学学报(自然科学版),2011,40(2):122-127.CAI Xueling,CHEN Xiaojing,SHEN Yanhong,HE Weiyi. Embryogenic callus induction and somatic embryogenesis of Papaya[J]. Journal of Fujian Agriculture and Forestry University(Natural Science Edition),2011,40(2):122-127.
[20] FITCH M M M. High frequency somatic embryogenesis and plant regeneration from Papaya hypocotyl callus[J]. Plant Cell,Tissue and Organ Culture,1993,32(2):205-212.
[21] 郭德章,鄢铮.番木瓜体细胞胚胎发育与植株再生[J].亚热带植物通讯,2000,29(1):38-40.GUO Dezhang,YAN Zheng. Development of somatic embryogenesis and plantlet regeneration of Carica papaya[J].Subtropical Plant Science,2000,29(1):38-40.
[22] 何玮毅,陈晓静,申艳红,卢秉国,潘东明.番木瓜叶片、叶柄胚性愈伤组织的诱导及其体胚植株的发生[J].热带作物学报,2008,29(6):690-697.HE Weiyi,CHEN Xiaojing,SHEN Yanhong,LU Bingguo,PAN Dongming. Induction of embryogenic calli from leaves and petioles of papaya and plant regeneration via somatic embryogenesis[J]. Chinese Journal of Tropical Crops,2008,29(6):690-697.
[23] YE K N,MA L,LI B J.Somatic embryogenesis and plant regeneration from Papaya suspension cultures[J]. Journal of Integrative Plant Biology,1991,33(7):565-568.
[24] 黄俊潮,叶克难,陈谷,李宝健.番木瓜体细胞胚发生及发育的影响因素[J].中山大学学报(自然科学版),1996,35(4):90-94.HUANGJunchao,YEKenan,CHENGu,LIBaojian.Studiesoffactors influencing the somatic embryogenesis of Carica papaya[J].Acta Scientiarum Naturalium Universitatis Sunyatseni,1996,35(4):90-94.
[25] LITZ R E,CONOVER R A.In vitro somatic embryogenesis and plant regeneration from Carica papaya L.ovular callus[J].Plant Science Letters,1982,26(2/3):153-158.
[26] 邹韵霞,郭惠珊.番木瓜胚珠高频率体胚发生和植株再生[J].中山大学学报(自然科学版),1992,31(3):60-65.ZOU Yunxia,GUO Huishan.High-frequency of somatic embryogenesis and transference to plantlets from Carica papaya L.[J].Acta Scifntiarum Naturalium Universitatis Sunyaatseni,1992,31(3):60-65.
[27] KHALID N. Improved protocol for high frequency plant regeneration through somatic embryogenesis in Carica papaya[J].Research in Biotechnology,2013,4(5):9-19.
[28] ABREU I S,CARVALHO C R,CLARINDO W R.Massal induction of Carica papaya L. ‘Golden’ somatic embryos and somaclone screening by flow cytometry and cytogenetic analysis[J].Cytologia,2014,79(4):475-484.
[29] 饶雪琴,李华平.番木瓜体胚间接发生方式的研究[J].园艺学报,2007,34(6):1539-1542.RAO Xueqin,LI Huaping. Studies of indirect somatic embryogenesis of papaya[J]. Acta Horticulturae Sinica,2007,34(6):1539-1542.
[30] GARCIA C,FURTADO DE ALMEIDA A A,COSTA M,BRITTO D,VALLE R,ROYAERTS,MARELLI J P.Abnormalities in somatic embryogenesis caused by 2,4-D:an overview[J]. Plant Cell,Tissue and Organ Culture (PCTOC),2019,137(2):193-212.
[31] WÓJCIK A M,WÓJCIKOWSKA B,GAJ M D.Current perspectives on the auxin-mediated genetic network that controls the induction of somatic embryogenesis in plants[J]. International Journal of Molecular Sciences,2020,21(4):1333.
[32] SALAÜN C,LEPINIEC L,DUBREUCQ B.Genetic and molecular control of somatic embryogenesis[J]. Plants,2021,10(7):1467.
[33] VON ARNOLD S,SABALA I,BOZHKOV P. Developmental pathways of somatic embryogenesis[J]. Plant Cell,Tissue and Organ Culture,2002,69(3):233-249.
[34] ZHOU C P,YANG M,LUO X Y,KUANG R B,YANG H,YAO J J,HUANG B X,WEI Y R. Transcriptomic analysis of Papaya (Carica papaya L.) shoot explants obtained by leaf- and stem-inoculation methods for adventitious roots induction[J].Scientia Horticulturae,2021,276:109762.
[35] MICHALCZUK L,COOKE T J,COHEN J D. Auxin levels at different stages of carrot somatic embryogenesis[J]. Phytochemistry,1992,31(4):1097-1103.
[36] PINTOS B,MANZANERA J A,BUENO M A.Oak somatic and gametic embryos maturation is affected by charcoal and specific aminoacids mixture[J]. Annals of Forest Science,2010,67(2):205.
[37] WOO H A,KU S S,JIE E. Efficient plant regeneration from embryogenic cell suspension cultures of Euonymus alatus[J].Scientific Reports,2021,11(1):15120.
[38] RAO P,PATTABIRAMAN T N. Further studies on the mechanism of phenol-sulfuric acid reaction with furaldehyde derivatives[J].Analytical Biochemistry,1990,189(2):178-181.
[39] MERKLE S A,PARROTT W A,FLINN B S. Morphogenic aspects of somatic embryogenesis[M]//THORPE T A. In vitro embryogenesis in plants. Dordrecht:Springer Netherlands,1995:155-203.
[40] EBERT A,TAYLOR H F.Assessment of the changes of 2,4-dichlorophenoxyacetic acid concentrations in plant tissue culture media in the presence of activated charcoal[J].Plant Cell,Tissue and Organ Culture,1990,20(3):165-172.