西番莲(Passiflora edulis)又名百香果、鸡蛋果等,是西番莲科(Passifloraceae)西番莲属(Passiflora L.)藤本植物,也是中国南方重要的特色果树,可用作鲜食、加工或观赏绿化。西番莲栽培食用品种主要有紫色果和黄色果2 种类型,紫色果的自交亲和性普遍优于黄色果,由于西番莲自交不亲和性的存在,有些黄色果品种自然授粉无法坐果或坐果率低,需要匹配异交亲和性高的授粉树,辅助人工授粉,提高生产成本。此外,自交和异交不亲和性阻碍了杂交育种获得纯合和杂合后代。授粉与坐果、结实密切相关,植物的授粉受精需要经历花粉与柱头的识别、花粉管与花柱的识别、雌雄配子之间的识别阶段,其中任何过程受到阻碍,都会导致授粉受精不良[1]。因此,探明西番莲自交和异交授粉过程对提高西番莲坐果率和杂交育种效率均具有重要意义。
在亲和互作中,花粉管通过柱头向子房生长。花粉附着在柱头上后进行水合和萌发,长出花粉管,花粉管穿透柱头,并通过花柱引导组织生长,而后花粉管进入子房腔并沿子房内壁生长,进行珠孔受精,花粉管由珠孔进入胚囊[2-3]。每条花粉管都有两个精子细胞,其中一个与卵细胞融合,形成受精卵,发育成胚;另一个与中央细胞的两个极核融合,形成受精极核,发育成三倍体胚乳[4-5]。由于自交不亲和性的存在,西番莲高度依赖异花授粉结实,这种异花杂交的机制促进了物种内的遗传变异[6-7]。植物常见的自交不亲和主要有几种表现:花粉在柱头上不能萌发;花粉可以萌发但无法穿透柱头;花粉管能穿透柱头,但在花柱内生长受到抑制;花粉管能进入子房,但不能进入胚珠形成受精卵。前两者属于孢子体不亲和,后两者属于配子体不亲和[8]。目前,关于国内西番莲栽培品种授粉受精过程的研究鲜见报道,多集中在花粉萌发条件的研究上[9-10]。鉴于目前国内西番莲栽培品种多而杂,但公知公用和种植面积较大的品种较少,目前获得新品种保护的品种数量稀少,其中尚未有广泛推广的主栽品种,故笔者在本研究中选取了自交亲和性差异较大的5个西番莲品种(系)作为试验材料,包含了紫色果主栽品种台农1号和紫色果及黄色果(中果型和大果型)品系。试验结合西番莲雌蕊解剖结构及花粉管的荧光显微观察,对供试材料组成的4个自交授粉组合和6个异交授粉组合的花粉萌发时间、花粉管数量及花粉管生长速度进行观察,并结合田间坐果率,以明确各个组合授粉亲和性的强弱、亲和及不亲和组合花粉萌发和花粉管生长差异、不亲和发生部位及特征,为西番莲授粉及杂交育种提供参考。
1 材料和方法
1.1 试验点及供试品种
试验于2021 年11 月中旬在广西南宁市西乡塘区石埠街道办美丽南方示范园区(108°09′E,22°46′N)进行。授粉当天和次日最高温度分别为34.9 ℃、29.1 ℃,平均温度分别为19.2 ℃、19.9 ℃,授粉当天夜间最低温度17.0 ℃,天气晴朗。供试品种共5个,包括台农1 号(简称TN,中果型,紫色果皮)和自主选育西番莲品系4 个,均为在黄色果和紫色果杂交后代中选育的品系,分别为H6(大果型,黄色果皮)、MB(中果型,黄色果皮)、H2(中果型,黄色果皮)、ZS(中果型,紫色果皮);供试品种的花和果实性状参见图1,对试验地植株统一进行常规水肥管理。

图1 供试西番莲品种(系)花和果实表型性状
Fig.1 Phenotypic characters of flower and fruit of tested passion fruit varieties(lines)
1.2 试验设计
试验共设计4 个自交授粉组合和6 个异交授粉组合,观察其授粉后花粉萌发和花粉管生长的情况,详见表1。
表1 西番莲自交和异交授粉组合
Table 1 Self and cross-pollination combinations of passion fruit
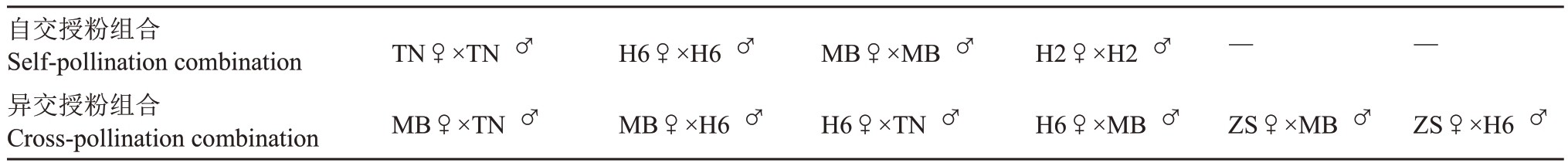
自交授粉组合Self-pollination combination异交授粉组合Cross-pollination combination TN♀×TN♂H6♀×H6♂MB♀×MB♂H2♀×H2♂——MB♀×TN♂MB♀×H6♂H6♀×TN♂H6♀×MB♂ZS♀×MB♂ZS♀×H6♂
1.3 测定项目与方法
1.3.1 授粉(1)自交:挑选当天会开放的成熟花蕾,在上午还未开花前进行套袋,待开花后揭开袋子,用干净的毛刷蘸上同一朵花的花粉进行点授,在硫酸纸袋上标记自交品种和具体的授粉时间,然后立即套袋。(2)异交:挑选当天会开放的成熟花蕾,在上午还未散粉前对母本去雄,剪除雄蕊(花药),然后套袋。父本花粉收集:挑选当天会开放的成熟花蕾,在上午还未开花前进行套袋,待散粉后收集用于异交的父本植株花粉。对母本进行授粉,在硫酸纸袋上标记父母本和具体的授粉时间,然后立即套袋。
1.3.2 荧光显微观察 分别采集授粉后0.5、1、2、4、6、8、18、24 h的花朵,每个授粉组合的每个时段各采集4朵花。将花瓣、副花冠花丝、萼片、苞片去掉,留下雌蕊,放入装有FAA固定液的50 mL离心管中固定24 h,置于4 ℃冰箱保存备用。每个授粉组合在每个时段分别选取3 组雌蕊制作压片,其中每组雌蕊保留1个柱头和1个子房用于观测。先用蒸馏水洗去残余固定液,加入3 mol·L-1 NaOH于60 ℃水浴锅中软化约1.5 h,用蒸馏水洗去残余的NaOH。将苯胺蓝溶于0.1 mol·L-1 K3PO4溶液中配制成0.1%苯胺蓝染液,置于黑暗处染色3 h。将花柱对半纵切,分别将柱头外露面和花柱切面置于载玻片上,滴加甘油,加盖玻片,施力将花柱压平,以便观察到柱头表面花粉粒萌发情况和柱头及花柱引导组织中花粉管的伸长情况;将子房从中部纵切,再切取薄片置于载玻片上压片;用奥特光学BK-FL荧光显微镜观察花粉行为并拍照,统计柱头上萌发的花粉管数量、进入柱头引导组织的花粉管数量、到达花柱中部的花粉管数量、进入子房的花粉管数量,每个授粉组合的各取样时段分别观察3 组数据;用Adobe Photoshop CC 软件对图片进行处理和排版。
1.3.3 石蜡切片制作及观察 取1.3.2 中固定好的MB 自交授粉后18 h 和24 h 的雌蕊样品经脱水浸蜡、包埋、切片(厚度4 μm)、脱蜡、番红-固绿染色、透明封片制作石蜡切片,将切片分别放于奥特光学BK-FL 显微镜和奥林巴斯SZ61 解剖镜下观察雌蕊的解剖形态,拍照。
1.3.4 坐果率调查 于2020 年9—10 月调查H6×MB、H6×TN、MB×H6、MB×TN共4个异交组合的坐果情况。授粉步骤同1.3.1,套袋后20 d 调查坐果数、坐果失败数和落果数,计算坐果率和落果率。授粉数=坐果数+坐果失败数+落果数,坐果率/%=(坐果数/授粉数)×100,落果率(%)=(落果数/授粉数)×100。
1.4 数据统计
授粉亲和性指数参照李瑞芬等[11]的计算公式,并对变量进行调整,授粉亲和性指数的计算公式为:P=(Ma+3Mb+9Mc+27Md)/100,变量为Mi(i=a, b, c,d)。其中Ma、Mb、Mc、Md分别代表柱头上萌发的花粉管数量、进入柱头引导组织的花粉管数量、到达花柱中部的花粉管数量、进入子房的花粉管数量。观察到的上述4种类别花粉管数量为<10、10~50、>50~100、>100~200、>200 时 分 别 标 记 为“0、-、±、+、++”,并分别赋予0、1、2、4、8的分值,根据每个样本的观察值计算各个时期的授粉亲和性指数,并计算授粉后8、18、24 h的授粉亲和性指数的平均值。
2 结果与分析
2.1 西番莲雌蕊的解剖结构
西番莲雌蕊由柱头、花柱和子房构成。由图1可知,西番莲的花柱有3个分支,其顶端各连接一个柱头,花柱底端连接子房。对授粉后18~24 h的西番莲雌蕊进行显微观察,由图2可以看出,柱头上密布乳突结构,柱头乳突长度为90~130 μm,呈多细胞紧密排列(图2-A);从柱头乳突的横截面可观察到中部空腔,为花粉管穿过乳突中央细胞间隙后花粉管所在的位置(图2-B)。与柱头乳突连接的是柱头引导组织,再往下是实心花柱,引导组织从柱头延伸至花柱(图2-C)。柱头横截面可观察到乳突与引导组织的连接(图2-F),柱头纵切面可见引导组织呈漏斗状(图2-G)。引导组织一直延伸至花柱基部(图2-C~E),并连接子房。子房内可见上百枚倒生胚珠(图2-H~I),胚珠呈梨形,珠孔在珠柄基部一侧,胚囊呈长椭圆形,胚囊外覆盖珠被(图2-I)。
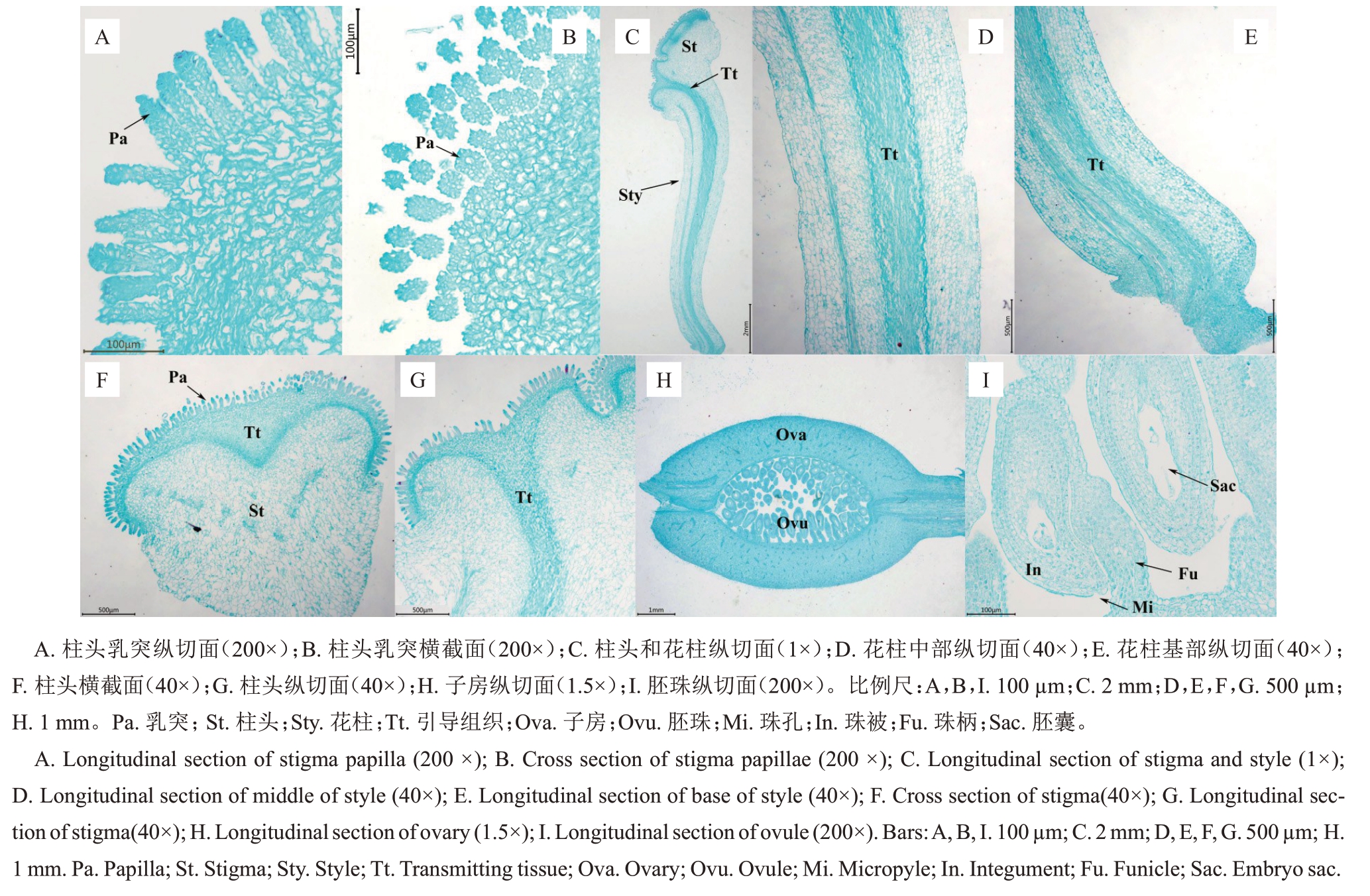
图2 西番莲品系MB 雌蕊的解剖结构
Fig.2 Anatomical structure of the pistil of passion fruit line MB
2.2 4个西番莲自交授粉组合的花粉管荧光显微观察及自交亲和性比较
苯胺蓝染液可与花粉管生长过程中的胼胝质结合,在紫外光的激发下花粉管壁和胼胝质发出特定的黄绿色荧光。通过对4个不同自交授粉组合的观察,发现其自交亲和性有较大差异。其中,MB自交授粉后0.5 h未见花粉粒附着或萌发,可见少量柱头乳突胼胝质堆积;授粉后1 h少量花粉萌发出花粉管(图3-A1);授粉后2 h 花粉管伸长,穿过柱头乳突,但未进入引导组织;授粉后4 h少量花粉管进入引导组织(图3-B1);授粉后6 h 大量花粉管穿过引导组织,集中进入花柱上端(图3-C1);授粉后8 h花粉管到达花柱2/5 处;授粉后18 h 花粉管到达花柱3/5处(图3-D1),但未见花粉管进入子房;授粉后24 h 花粉管到达花柱基部,可见大量花粉管进入子房(图3-E1),观察到花粉管进入胚珠(图3-F1)。

图3 MB 自交(A1~F1)和H6 自交(A2~F2)花粉管生长情况
Fig.3 Pollen tube growth of MB self-pollination combination(A1-F1)and H6 self-pollination combination(A2-F2)
H6 自交授粉后0.5 h 柱头可见零星花粉粒附着,几粒花粉开始萌发;授粉后1 h 可见零星几粒花粉附着柱头,刚开始萌发,可见柱头乳突点状胼胝质堆积;授粉2 h后可见少数花粉附着并萌发出花粉管(图3-A2);授粉后4 h可见花粉萌发数量增多,但花粉管仍然较短,可见花粉管进入柱头乳突(图3-B2);授粉后6 h 可见部分花粉粒附着在柱头上,花粉管未继续伸长,花粉管底部出现膨大畸形(图3-C2);授粉后8 h 可见大量花粉附着柱头萌发,但花粉管较短,未继续伸长,花粉管底部变粗,无法继续穿透柱头乳突(图3-D2);授粉后18 h可见大量柱头乳突胼胝质堆积,仅见零星花粉粒附着柱头;授粉后24 h少量花粉粒附着柱头,花粉管较短且未伸长,可见柱头乳突胼胝质堆积(图3-E2),同时引导组织未见花粉管进入(图3-F2)。
此外,TN 授粉后0.5 h 柱头已有少数花粉萌发出花粉管,并进入柱头乳突;授粉后1 h柱头可见大量花粉萌发,花粉管已伸入引导组织;授粉后8 h大量花粉管通过花柱基部,少量花粉管到达子房,但未观察到进入胚珠;授粉后18 h大量花粉管进入子房,少数花粉管进入胚珠;授粉后24 h可见大量花粉管进入胚珠。H2 自交授粉后1 h 大量花粉萌发,花粉管进入柱头乳突;授粉后8 h 花粉管到达花柱1/2处;授粉后18 h大量花粉管到达花柱基部,少量或零星花粉管到达子房;授粉后24 h部分花粉管到达子房,可见花粉管进入胚珠。
结合表2和表3分析可知,4个自交授粉组合花粉与雌蕊的相互作用表现出较大差异,其中,TN、H2、MB自交授粉后,其花粉均能萌发并穿过柱头到达子房,进入胚珠;而H6自交授粉后花粉可以萌发,但花粉管不能正常伸长,而是出现末端膨大畸形,最终停留在柱头乳突中。对4 个自交组合授粉后8、18、24 h 的授粉亲和性指数平均值进行统计,由表3可以看出TN 自交亲和性指数为1.25,而H6 自交亲和性指数仅为0.03,4个西番莲品种(系)的自交亲和性排序为:TN>H2>MB>H6。
表2 授粉后不同时段花粉管到达位置和花粉管数量
Table 2 Pollen tube arrival position and pollen tube number at different stages after pollination
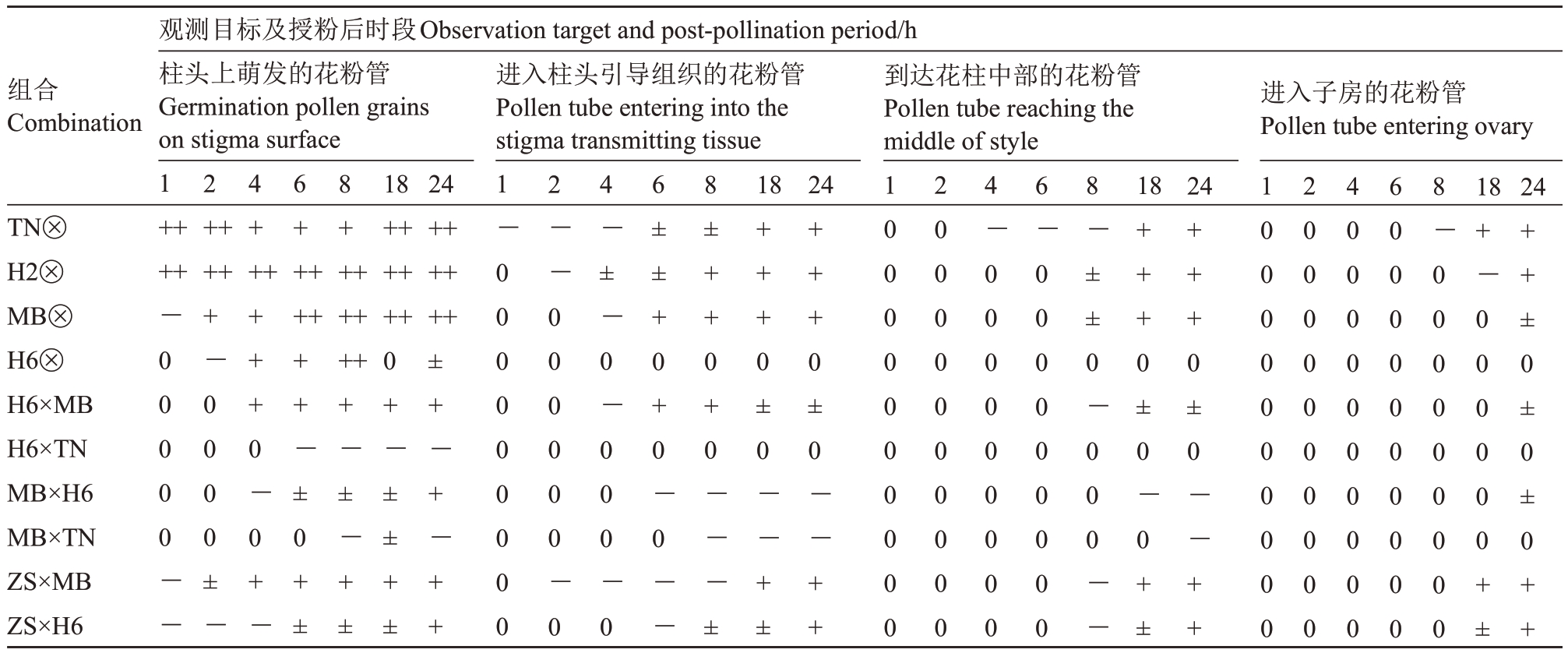
注:“0、-、±、+、++”分别代表花粉管数量<10、10~50、>50~100、>100~200、>200。
Note:“0,-,±,+,++”mean the number of pollen tubes<10,10~50,>50~100,>100~200,>200,respectively.
组合Combination进入柱头引导组织的花粉管Pollen tube entering into the stigma transmitting tissue到达花柱中部的花粉管Pollen tube reaching the middle of style进入子房的花粉管Pollen tube entering ovary观测目标及授粉后时段Observation target and post-pollination period/h柱头上萌发的花粉管Germination pollen grains on stigma surface 1++++2 4++6+++8+++18++++++24++++++1-0 0 0 0 0 0 0 0 0 2--0 0 0 0 0 0-0 4-±-0-0 0 0-0 6±±+0+0-0--8±++0+0---±182418241824 TN⊗H2⊗MB⊗H6⊗H6×MB H6×TN MB×H6 MB×TN ZS×MB ZS×H6++++-0 0 0 0 0--+-0 0 0 0±-++++0-0+-++++-±0+±+++++-±-+±0+-±±+±±+-+-+++++0±0--+±+++0±0--++10 0 0 0 0 0 0 0 0 0 20 0 0 0 0 0 0 0 0 0 4-0 0 0 0 0 0 0 0 0 6-0 0 0 0 0 0 0 0 0 8-±±0-0 0 0--+++0±0-0+±+++0±0--++10 0 0 0 0 0 0 0 0 0 20 0 0 0 0 0 0 0 0 0 40 0 0 0 0 0 0 0 0 0 60 0 0 0 0 0 0 0 0 0 8-0 0 0 0 0 0 0 0 0+-0 0 0 0 0 0+±++±0±0±0++
表3 授粉后8、18、24 h 花粉管到达位置及授粉亲和性指数
Table 3 Pollen tube arrival position and pollination compatibility index at 8,18 and 24 h after pollination
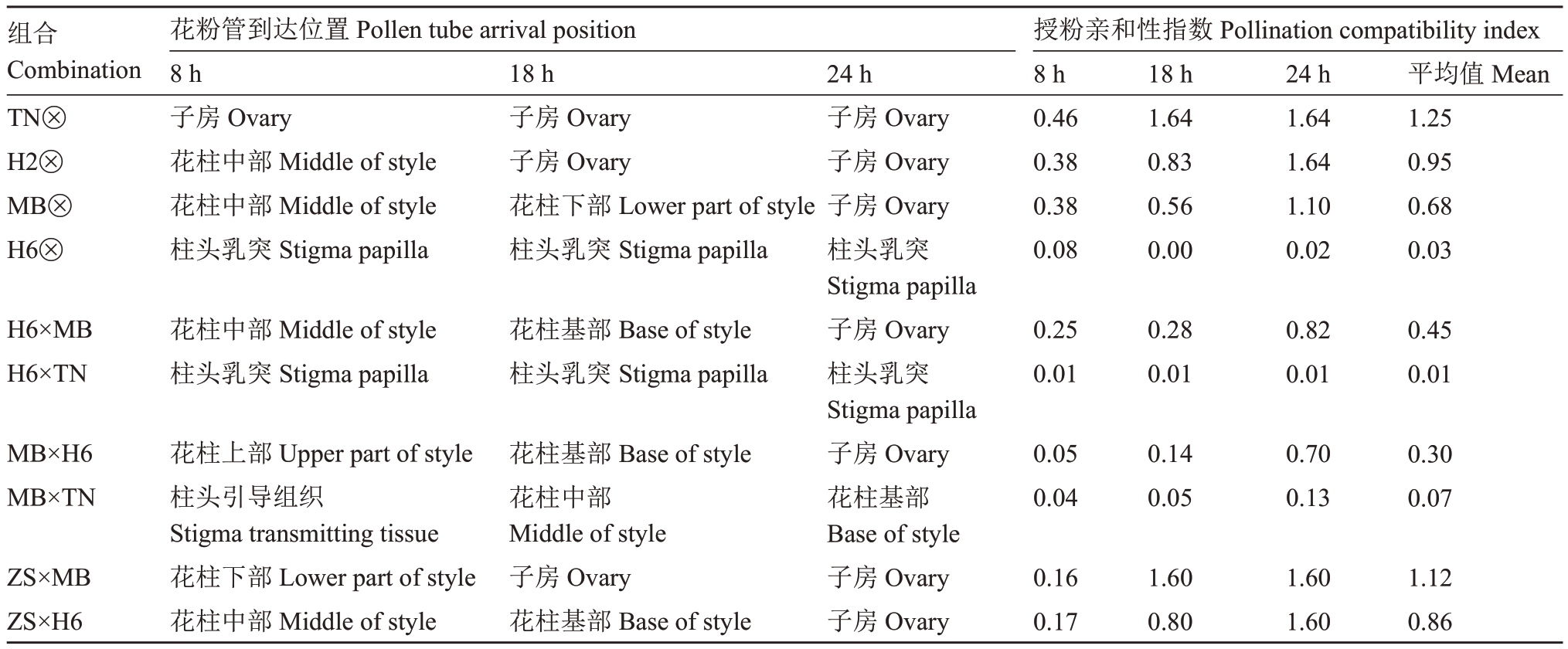
组合Combination TN⊗H2⊗MB⊗H6⊗花粉管到达位置Pollen tube arrival position 8 h子房Ovary花柱中部Middle of style花柱中部Middle of style柱头乳突Stigma papilla 18 h子房Ovary子房Ovary花柱下部Lower part of style柱头乳突Stigma papilla授粉亲和性指数Pollination compatibility index 8 h 0.46 0.38 0.38 0.08 18 h 1.64 0.83 0.56 0.00 24 h 1.64 1.64 1.10 0.02平均值Mean 1.25 0.95 0.68 0.03 H6×MB H6×TN花柱中部Middle of style柱头乳突Stigma papilla花柱基部Base of style柱头乳突Stigma papilla 0.25 0.01 0.28 0.01 0.82 0.01 0.45 0.01 MB×H6 MB×TN 0.05 0.04 0.14 0.05 0.70 0.13 0.30 0.07 ZS×MB ZS×H6花柱上部Upper part of style柱头引导组织Stigma transmitting tissue花柱下部Lower part of style花柱中部Middle of style花柱基部Base of style花柱中部Middle of style子房Ovary花柱基部Base of style 24 h子房Ovary子房Ovary子房Ovary柱头乳突Stigma papilla子房Ovary柱头乳突Stigma papilla子房Ovary花柱基部Base of style子房Ovary子房Ovary 0.16 0.17 1.60 0.80 1.60 1.60 1.12 0.86
2.3 西番莲6个异交授粉组合的花粉管荧光显微观察及异交亲和性比较
通过以H6、MB、ZS为母本,分别设置2个父本,比较不同异交授粉组合的亲和性,荧光显微观察结果如下:
2.3.1 H6为母本的异交组合 H6×MB异交组合授粉后4 h 花粉已萌发但花粉管较短(图4-A3);授粉后6 h柱头引导组织可见花粉管,花粉管进入花柱上端(图4-B3);授粉后8 h 少量花粉管到达花柱中部位置;授粉后18 h 大量花粉管到达花柱基部(图4-D3);授粉后24 h大量花粉管进入子房(图4-E3),可见花粉管进入胚珠(图4-F3),同时柱头乳突有大量胼胝质堆积。H6×TN异交组合授粉后2 h未见花粉萌发(图4-A4);授粉后6 h 可见少数或几粒花粉附着柱头,有少量柱头乳突胼胝质堆积(图4-B4);授粉后8 h柱头可见少量花粉萌发,但花粉管较短(图4-C4);授粉后18 h有少数花粉粒附着在柱头上,但未能伸长,同时可见大量柱头乳突胼胝质堆积(图4-D4);授粉后24 h柱头可见少量花粉附着在柱头上,花粉管仍然无法伸长(图4-F4),且柱头乳突出现大面积胼胝质堆积(图4-E4)。

图4 H6×MB(A3~F3)和H6×TN(A4~F4)异交授粉组合的花粉管生长情况
Fig.4 Pollen tube growth of H6×MB(A3-F3)and H6×TN(A4-F4)cross-pollination combinations
结合自交授粉亲和性的结论和表2 可知,西番莲异交授粉的过程中,花粉和雌蕊的相互作用与自交授粉类似,具有异交亲和性的组合花粉管萌发后最终能进入子房和胚珠,而不具有异交亲和性的组合花粉能萌发但随后花粉管不能正常伸长,相比于正常的花粉管(图5-A5),其出现末端膨大变粗的畸形形态,最终只能停留在柱头乳突中,不能穿透柱头(图5-B5)。此外,由表3可知,H6×MB和H6×TN的授粉亲和性指数分别为0.45和0.01,故以H6为母本的异交组合的亲和性,MB作为父本优于TN。

图5 花粉管形态比较(A5,B5)和胼胝质观察(C5,D5)
Fig.5 Comparison of pollen tube morphology(A5,B5)and callose observation(C5,D5)
2.3.2 MB 为母本的异交组合 以MB 为母本的异交组合中,MB×H6 在授粉后4 h 柱头可见少量花粉粒附着并萌发,柱头乳突胼胝质荧光面积加大;授粉后18 h部分花粉管到达花柱中部,少数花粉管到达花柱基部;授粉后24 h大量花粉管到达花柱基部,进入胚珠。而MB×TN 异交组合授粉后4 h 柱头仍未见花粉粒萌发,可见少部分柱头乳突胼胝质堆积;授粉后6 h柱头可见零星花粉粒附着并萌发,柱头乳突胼胝质堆积增多;授粉后18 h花粉萌发数量增多,花粉管集中到达花柱1/3 处,少数花粉管到达花柱中部;授粉后24 h部分花粉管到达花柱基部,但还未进入子房。故MB×H6 的花粉萌发数量和速度、花粉管生长速度均优于MB×TN,且授粉亲和性指数为MB×H6(0.30)>MB×TN(0.07),故MB×H6 异交亲和性优于MB×TN。
2.3.3 ZS为母本的异交组合 ZS×MB组合授粉后4 h可见大量花粉萌发,花粉管穿过柱头乳突进入引导组织;授粉后8 h 花粉管到达花柱2/3 处;授粉后1~8 h均可见部分柱头乳突胼胝质堆积;授粉后18 h大量花粉管已到达花柱基部并进入子房,部分花粉管进入胚珠;同时授粉后18~24 h可见大量柱头乳突胼胝质堆积。ZS×H6组合授粉后6 h可见部分花粉萌发,花粉管伸长进入花柱上部;授粉后8 h 可见花粉管到达花柱中部位置;授粉后1~8 h未见明显的柱头乳突胼胝质堆积;授粉后18 h 大量花粉管到达子房,花粉管进入胚珠,可见大量柱头乳突胼胝质堆积;授粉后24 h大部分胚珠已受精,同时柱头乳突胼胝质荧光覆盖90%以上。此外,由表3 可知授粉亲和性指数ZS×MB(1.12)>ZS×H6(0.86),故前者异交亲和性优于后者,同时,ZS×MB 和ZS×H6 也是6个异交组合中授粉亲和性指数最高的两个组合。
2.4 不同授粉亲和性组合的柱头乳突和花粉管胼胝质积累特性
笔者在自交和异交多个组合中发现柱头乳突出现不同程度的胼胝质堆积现象(图5-C5),其中,H6自交和H6×TN 异交不亲和组合在授粉后24 h 柱头乳突均可见大量胼胝质堆积,而TN自交、H2自交2个自交亲和性最强的组合均未观察到明显的柱头乳突胼胝质堆积,此外,H6×MB、ZS×MB、ZS×H6异交授粉组合虽然也有花粉管到达子房进入胚珠,但进入子房的花粉管数量和授粉亲和性均低于TN自交和H2自交,且其柱头上能观察到大量乳突细胞胼胝质堆积。故推测乳突细胞的胼胝质堆积可能与授粉亲和性有一定关系,表现出乳突细胞胼胝质堆积量随着亲和性的减弱而增加。除了柱头乳突的胼胝质堆积,笔者也发现花粉管的伸长伴随着胼胝质的积累,在具有亲和性组合的花粉管中形成近等距离的胼胝质塞(图5-D5)。
2.5 西番莲4个异交授粉组合的坐果率
前期对H6 和MB 为母本的4 个西番莲异交授粉组合的坐果率调查结果(表4)显示,异交授粉后部分子房可正常膨大并收获果实,而部分子房虽然也出现膨大,但在授粉后2~3 周提前出现落果现象,未能成功坐果。H6 为母本的异交组合中,H6×MB 异交坐果率远高于H6×TN,其中H6×TN 坐果率为0,与花粉管荧光显微观察的结果一致,证实该组合为异交不亲和。MB 为母本的异交组合中,MB×H6 的坐果率高于MB×TN,但同时分别有18.90%和28.57%的落果率。MB×TN 异交组合的荧光显微观察显示其花粉管萌发数量较少、花粉管生长速度较慢,授粉后24 h花粉管到达花柱基部但未进入子房,授粉亲和性指数较低,这与坐果率的结果不一致,可能是由于坐果率调查时间为10 月中旬而花粉管荧光显微观察时间为11 月中旬,温度和光照条件相差较大,对TN 花粉管的萌发和生长有影响。此外,对比H6 和MB 正交和反交的坐果率可知,H6×MB 坐果率(60.0%)较MB×H6(37.5%)高出60%,MB×H6 落果率较高;同时荧光显微观察的授粉亲和性指数H6×MB(0.45)较MB×H6(0.30)高出50%,故二者均可证实H6×MB 异交亲和性高于MB×H6。
表4 西番莲4 个异交授粉组合的坐果率
Table 4 Fruit setting rate of four passion fruit cross-pollination combinations
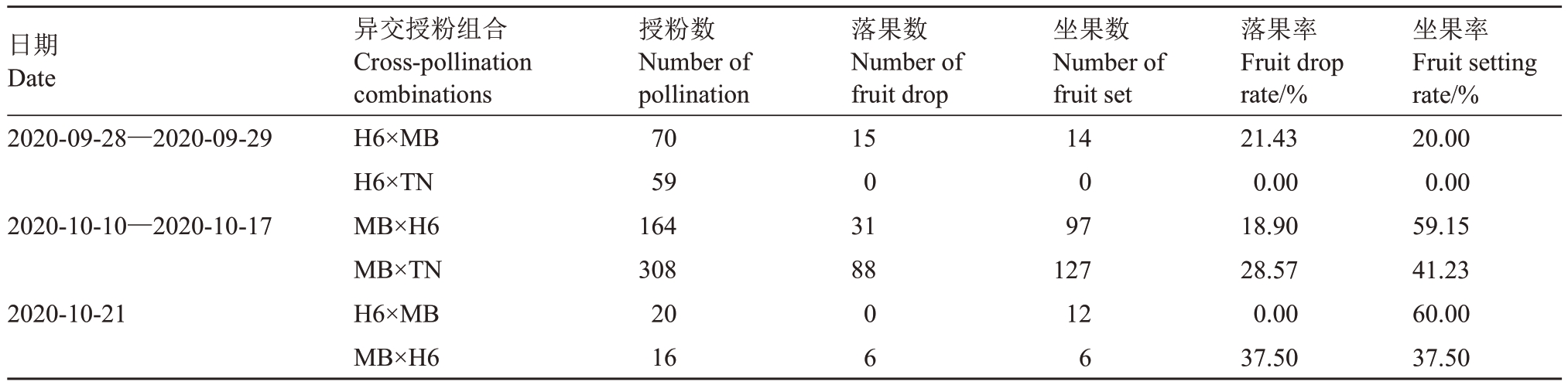
日期Date 2020-09-28—2020-09-29 2020-10-10—2020-10-17落果数Number of fruit drop 15 0 31 88 2020-10-21异交授粉组合Cross-pollination combinations H6×MB H6×TN MB×H6 MB×TN H6×MB MB×H6授粉数Number of pollination 70 59 164 308 20 16 0 6坐果数Number of fruit set 14 0 97 127 12 6落果率Fruit drop rate/%21.43 0.00 18.90 28.57 0.00 37.50坐果率Fruit setting rate/%20.00 0.00 59.15 41.23 60.00 37.50
3 讨 论
授粉受精需要经历3 个层次的识别:花粉与柱头、花粉管与花柱、雌雄配子之间[1]。石蜡切片及荧光显微观察均显示,在具有亲和性的西番莲自交和异交组合中,花粉粒附着在柱头后,萌发出花粉管,花粉管是从柱头乳突细胞间隙穿过进入柱头的,而非从柱头乳突之间穿过[12],乳突横截面可观察到花粉管通过乳突中央留下的空腔,与Madureira等[13]的观察结果一致。之后花粉管穿过柱头乳突进入柱头和花柱引导组织,进入子房和胚珠,完成受精。但在相同的环境条件下,不同授粉组合的花粉萌发数量、开始萌发时间、花粉管生长速度存在差异。快者在授粉后0.5 h花粉已萌发出花粉管,如TN自交和H2自交组合;慢者则在授粉后4 h才观察到花粉萌发,且花粉数量较少,如MB×H6 异交组合。而花粉管的生长速度快者如TN 自交组合在授粉后8 h 已有少量花粉管到达子房,而慢者如MB 自交、MB×H6等异交组合在授粉后24 h 才观察到花粉管进入子房。大部分授粉组合花粉管在授粉后18 h或24 h进入子房和胚珠,这与Ishihata[14]和Ho 等[15]的报道一致,但也有7 h[3]和12 h[16]的报道。因此,可以依据不同组合的花粉萌发和花粉管生长速度鉴定其亲和性强弱,笔者在本研究中依据上述指标计算了授粉亲和性指数从而量化授粉亲和性,但前提是在相同环境下比较,因为环境因素如温度、光周期和空气相对湿度会影响花粉萌发和花粉管的生长[17]。
自交不亲和性(Self-incompatibility,SI)是被子植物阻止自交的一种遗传机制,SI在自然界中非常常见[13]。自交不亲和的过程使雌性生殖细胞能够区分遗传相关(不亲和)和遗传无关(亲和)的花粉,并明确拒绝不亲和花粉[18]。自交不亲和过程是由具复等位基因的单基因位点——S 位点(S-locus)控制的[19]。SI根据花粉粒表达的S等位基因的数量分为孢子体自交不亲和(sporophytic self-incompatibility,SSI)和配子体自交不亲和(gametophytic self-incompatibility,GSI)两种类型。SSI 的抑制发生在柱头上[20],而GSI 的抑制发生在花柱中[21]。笔者在本研究中发现,H6自交不亲和的表现为花粉粒可以附着在柱头上并萌发出花粉管,但花粉管出现末端膨大变粗的畸形形态,仅停留在柱头乳突中,不能穿透柱头;这种不亲和的特征表现为孢子体不亲和类型。Suassuna等[22]对西番莲属植物SI的研究也支持了孢子体同态不亲和假说。有研究认为在西番莲的SI 系统中,不亲和花粉粒的排斥以花粉和花粉管的剧烈结构变化为特征,如不亲和的花粉粒外壁纹饰改变和花粉管的膜系统受损[13]。此外,有研究表明,成熟柱头发出的信号是西番莲自交不亲和反应的原因,认为花前24 h 的柱头不能区分亲和和不亲和花粉粒[2],还需进一步研究。
胼胝质是一种β-1,3-葡聚糖,普遍存在于高等植物中,多见于细胞壁,在植物生长发育中起着重要的调节作用[23]。笔者在本研究中发现,西番莲自交和异交多个组合中柱头乳突均出现不同程度的胼胝质堆积,且乳突细胞胼胝质堆积量随着亲和性的减弱而增加;可能与乳突细胞的胼胝质堆积会阻碍花粉萌发和花粉管向下伸长有关[24]。此外,笔者在本研究中发现具亲和性组合的花粉管伴随近等距离的胼胝质塞积累。前人研究认为亲和的花粉管伴有规则的胼胝质堆积,而不亲和的花粉管被不规则的胼胝质堆积所封闭,无法正常生长[25],故笔者在本研究中观察到的花粉管伴有胼胝质堆积为正常现象。
坐果率是反映亲和性强弱的重要指标,笔者前期对4 个西番莲品种(系)坐果率的调查结果显示,H6×TN 坐果率为0,与花粉管荧光显微观察的结果一致,即H6×TN为异交不亲和组合;而对H6田间的观察也表明其不能自然坐果,为自交不亲和品系。此外,MB×TN 异交组合虽然荧光显微观察下其在11月中旬花粉管生长速度较慢,但该组合10月中旬坐果率可达41.23%,故亲和性组合的授粉亲和性强弱可能受季节和环境条件变化以及花粉活力和柱头可授性的影响,而不亲和组合在环境改变时仍不具亲和性。笔者在试验中还发现部分异交组合授粉后,其中一部分子房在授粉后2~3 周出现生长停滞和大量落果现象。在其他果树如榆叶梅[26]、甜樱桃[27]、枣[8,28]中均发现有类似现象,并推测子房生长停滞和落果可能是由胚胎发育不良、受阻导致胚胎败育引起的。此外,供试西番莲品系正交和反交的亲和性和落果率存在差异,如H6 作为母本,MB 作为父本时异交组合的亲和性较高且落果率低,反之则亲和性降低、落果率升高;说明亲本的选择与异交组合的授粉亲和性和坐果有关。这种现象在远缘杂交中较为普遍,如李和桃作为亲本时正反交亲和性差异较大,可能与单侧种间不亲和性有关[29]。
在实际应用中,供试材料中黄色果皮的品系中H2 的自交亲和性较好,MB 其次,必要时也可补充人工授粉;黄色果皮大果型的H6 为自交不亲和品系,需要配置异交亲和性较高的授粉树,MB可作为其授粉树的选择之一;台农1 号虽然自交亲和性较强,但其不宜作为部分黄色果皮品种(系)的授粉树。由于西番莲属于孢子体不亲和类型,在杂交育种中,需要克服材料自身的SI和材料间的异交不亲和性,如本研究中的H6自交和H6×TN异交组合,以获得纯合和杂合后代,由于不亲和反应部位在柱头,可尝试切柱[30]等方法,并进一步研究花粉与柱头的交互作用及授粉后的胚胎发育。
4 结 论
具亲和性的西番莲自交和异交组合于授粉后18~24 h花粉管进入胚珠,而不亲和组合的花粉管出现末端膨大变粗畸形形态,无法穿过柱头乳突,属于孢子体不亲和类型,且亲和性降低伴随柱头乳突细胞胼胝质堆积量的增多。可依据花粉萌发数量、开始萌发时间、花粉管生长速度、柱头乳突胼胝质堆积量鉴定亲和性强弱。
[1]胡适宜. 被子植物生殖生物学[M]. 北京:高等教育出版社,2005:148-152.HU Shiyi. Reproductive biology of angiosperms[M]. Beijing:Higher Education Press,2005:148-152.
[2]MADUREIRA H C,PEREIRA T N S,DA CUNHA M,KLEIN D E. Histological analysis of pollen-pistil interactions in sour passion fruit plants(Passiflora edulis Sims)[J].Biocell,2012,36(2):83-90.
[3]曾华金,秦云霞,刘志昕,彭存智.西番莲双受精过程的细胞学观察[J].植物研究,2003,23(4):407-409.ZENG Huajin,QIN Yunxia,LIU Zhixin,PENG Cunzhi. Observation on double fertilization of Passionflora edulis f. flavicarpa Deg.[J]. Bulletin of Botanical Research,2003,23(4):407-409.
[4]HISCOCK S J,ALLEN A M. Diverse cell signalling pathways regulate pollen-stigma interactions:The search for consensus[J].New Phytologist,2008,179(2):286-317.
[5]GOTELLI M M,GALATI B G,MEDAN D. Structure of the stigma and style in sunflower (Helianthus annuus L.)[J]. Biocell,2010,34(3):133-138.
[6]BRUCKNER C H,CASALI V W D,DE MORAES C F,REGAZZI A J,DA SILVA E A M. Self-incompatibility in passion fruit (Passiflora edulis Sims)[J].Acta Horticulturae,1995,370:45-58.
[7]HIGASHIYAMA T. Peptide signaling in pollen-pistil interactions[J].The Plant Cell Physiology,2010,51(2):177-189.
[8]侯思皓,张钟,李一荷,张春梅,杨阳,李新岗.枣自交与异交花粉管生长行为及早期胚胎发育研究[J]. 果树学报,2019,36(11):1515-1523.HOU Sihao,ZHANG Zhong,LI Yihe,ZHANG Chunmei,YANG Yang,LI Xingang. Observation of pollen tubes behavior and early embryogenesis following self and cross-pollination in Chinese jujube[J]. Journal of Fruit Science,2019,36(11):1515-1523.
[9]刘洁云,吴艳艳,牟海飞,温放,田青兰,韦毅刚,张英俊,符龙飞,彭嘉宇,黄伟华.黄百香果花粉离体培养基筛选及贮藏试验[J].西南农业学报,2021,34(8):1699-1704.LIU Jieyun,WU Yanyan,MOU Haifei,WEN Fang,TIAN Qinglan,WEI Yigang,ZHANG Yingjun,FU Longfei,PENG Jiayu,HUANG Weihua. Medium screening for in vitro germination and storage conditions of yellow passion fruit pollen[J]. Southwest China journal of Agricultural Sciences,2021,34(8):1699-1704.
[10]蔡昭艳,苏伟强,董龙,邱文武,施平丽,刘业强,黄辉晔,黄章保,任惠,王小媚.钙、镁、钾浓度及光照、温度对西番莲花粉离体萌发的影响[J].果树学报,2022,39(1):86-94.CAI Zhaoyan,SU Weiqiang,DONG Long,QIU Wenwu,SHI Pingli,LIU Yeqiang,HUANG Huiye,HUANG Zhangbao,REN Hui,WANG Xiaomei. Effects of calcium,magnesium,potassium,light and temperature on pollen germination and pollen tube elongation of passion fruit in vitro[J]. Journal of Fruit Science,2022,39(1):86-94.
[11]李瑞芬,李聪,苏加楷.沙打旺与鹰咀紫云英种间杂交不亲和性研究[J].草地学报,2001,9(1):8-15.LI Ruifen,LI Cong,SU Jiakai.Interspecific cross-incompatibility between Astragalus adsurgens Pall. and A. cicer L.[J]. Acta Agrestia Sinica,2001,9(1):8-15.
[12]HISCOCK S J,HOEDEMAEKERS K,FRIEDMAN W E,DICKINSON H G. The stigma surface and pollen-stigma interactions in Senecio squalidus L. (Asteraceae) following cross(compatible) and self (incompatible) pollinations[J]. International Journal of Plant Sciences,2002,163(1):1-16.
[13]MADUREIRA H C,PEREIRA T N S,DA CUNHA M,KLEIN D E,DE OLIVEIRA M V V,DE MATTOS L,DE SOUZA F G A.Self-incompatibility in passion fruit:Cellular responses in incompatible pollinations[J].Biologia,2014,69(5):574-584.
[14]ISHIHATA K. Studies on pollen germination and tube growth from normal and upright-style flowers in purple passion fruit,Passiflora edulis Sims using various artificial media[J]. Japanese Journal of Tropical Agriculture,1991,35(2):98-103.
[15]HO W F,SHII C T.Incompatibility system in passion fruit(Passiflora edulis Sims)[J].Acta Horticulturae,1986,194:31-38.
[16]RÊGO M M,RÊGO E R,BRUCKNER C H,SILVA DA E A M,FINGER F L,PEREIRA K J C. Pollen tube behavior in yellow passion fruit following compatible and incompatible crosses[J].Theoretical and Applied Genetics,2000,101(5/6):685-689.
[17]HESLOP-HARRISON J. Incompatibility and the pollen-stigma interaction[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1975,26:403-425.
[18]REA A C,NASRALLAH J B.Self-incompatibility systems:barriers to self-fertilization in flowering plants[J].The International Journal of Developmental Biology,2008,52(5/6):627-636.
[19]SILVA N F,GORING D R. Mechanisms of self-incompatibility in flowering plants[J]. Cellular and Molecular Life Sciences,2001,58(14):1988-2007.
[20]WATANABE M,SUWABE K,SUZUKI G.Molecular genetics,physiology and biology of self-incompatibility in Brassicaceae[J].Proceedings of the Japan Academy,2012,88(10):519-535.
[21]WHEELER M J,DE GRAAF B H J,HADJIOSIF N,PERRY R M,POULTER N S,OSMAN K,VATOVEC S,HARPER A,FRANKLIN F C H,FRANKLIN-TONG V E. Identification of the pollen self-incompatibility determinant in Papaver rhoeas[J].Nature,2009,459(7249):992-995.
[22]SUASSUNA T D F,BRUCKNER C H,DE CARVALHO C R,BORÊM A.Self-incompatibility in passionfruit:Evidence of gametophytic-sporophytic control[J]. Theoretical & Applied Genetics,2003,106(2):298-302.
[23]崔海芳,张凡,尹俊龙,郭瑛琪,岳艳玲.胼胝质沉积与花粉发育[J].云南农业大学学报(自然科学),2017,32(3):551-557.CUI Haifang,ZHANG Fan,YIN Junlong,GUO Yingqi,YUE Yanling. Callose deposition and pollen development[J]. Journal of Yunnan Agricultural University (Natural Science),2017,32(3):551-557.
[24]王冲,雷家军,姜闯,邢桂梅.君子兰种间杂交及自交亲和性[J].中国农业科学,2011,44(18):3822-3829.WANG Chong,LEI Jiajun,JIANG Chuang,XING Guimei.Study on cross-compatibility of interspecific hybridization and selfing in Clivia Lindl.[J]. Scientia Agricultura Sinica,2011,44(18):3822-3829.
[25]SOARES T L,JESUS O N D,SOUZA E H D,DE OLIVEIRA E J.Reproductive biology and pollen-pistil interactions in Passiflora species with ornamental potential[J]. Scientia Horticulturae,2015,197:339-349.
[26]李娜,邓童,罗乐,李进宇.榆叶梅的远缘杂交亲和性和花粉管行为[J].分子植物育种,2022,20(17):5754-5762.LI Na,DENG Tong,LUO Le,LI Jinyu. Distant hybridization compatibility and pollen tube behavior of Prunus triloba[J].Molecular Plant Breeding,2022,20(17):5754-5762.
[27]吴延军,武凯翔,袁玥,董梦梦.甜樱桃新种质种内及与中国樱桃种间杂交效率分析[J].果树学报,2019,36(9):1112-1120.WU Yanjun,WU Kaixiang,YUAN Yue,DONG Mengmeng.Analysis the efficiency of inter and intra-specific hybridization of new cultivars of sweet cherry and Chinese cherry[J]. Journal of Fruit Science,2019,36(9):1112-1120.
[28]任海燕,李登科,王永康,赵爱玲,薛晓芳,苏万龙,石美娟,刘丽,李毅.迎秋红枣的柱头形态变化及早期胚胎发育研究[J].果树学报,2022,39(4):602-609.REN Haiyan,LI Dengke,WANG Yongkang,ZHAO Ailing,XUE Xiaofang,SU Wanlong,SHI Meijuan,LIU Li,LI Yi. Stigma shape development and early embryogenesis development of yingqiuhong Chinese jujube (Ziziphus Jujuba Mill.)[J]. Journal of Fruit Science,2022,39(4):602-609.
[29]曹后男,朴日子,宗成文,赵成日,朱波.桃、李种间杂交花粉萌发及花粉管行为的观察[J].果树学报,2004,21(4):302-307.CAO Hounan,PU Rizi,ZONG Chengwen,ZHAO Chengri,ZHU Bo. Observation on the pollen germination and the pollen tube behavior under interspecies crossing conditions between peach and plum[J]. Journal of Fruit Science,2004,21(4):302-307.
[30]DE LIRA JÚNIOR J S,BRUXCKNER C H,CARNEIRO P C S.Methods for overcome the passion fruit self-incompatibility[J].Revista Brasileira de Fruticultura,2016,38(4):477.