石榴(Punica granatum L.)属于石榴科(Punicaceae)石榴属(Punica L.),花大而鲜艳,有“天下之奇树,九州之名果”的美称[1-2]。石榴原产中亚地区,种质资源较为丰富,截止到目前,全球已有1100多个栽培品种[3-4]。近年来,随着无公害、绿色食品标准化技术的推广,高品质高效益的软籽石榴逐步被消费者认可[5]。
新疆是我国传统石榴种植区,多年来,在生产上多采用粗放的水氮管理模式,造成了水分与氮素的大量流失,水氮利用效率大幅下降,因此,寻找石榴生长发育最佳的水氮耦合模式,进一步提高水氮利用效率已成为当前研究的重点。关于水氮耦合对植物光合特性、叶绿素荧光的影响,大多集中在小麦[6]、水稻[7]、玉米[8]、棉花[9]、番茄[10]等作物上,其对软籽石榴光合及叶绿素荧光参数的影响少有报道。对于水氮耦合对植株氮素代谢酶活性及其渗透调节物质含量的影响,国内外学者也作了相关研究。陈修斌等[11]研究发现,适宜的水氮耦合模式对提高硝酸还原酶(NR)、谷氨酰胺合成酶(GS)、谷氨酸草酰乙酸转氨酶(GOT)和谷氨酸丙酮酸转氨酶(GPT)活性有明显的促进作用,进而植株氮代谢能力增强;张智猛等[12]研究结果表明,适度增加氮素用量不仅会提高花生叶片的可溶性蛋白质和游离氨基酸含量,也会提高叶片中NR等氮代谢酶的活性,但施氮量过高虽能提高NR活性以及可溶性蛋白质和游离氨基酸的含量,但会使GS活性下降,因此研究适宜水氮耦合效应有利于各作物的水氮精准管理,提高其水氮利用效率[13]。
软籽石榴是一种耐旱怕涝不抗冻的果树,不合理的施氮和水分管理严重影响幼树树体和枝条发育,造成越冬耐寒性降低,甚至无法越冬,对软籽石榴生产造成很大损失。目前,水氮耦合对石榴幼苗的研究鲜见报道。因此,笔者在本文中通过分析不同水氮处理对软籽石榴幼苗光合指标与叶绿素荧光参数、渗透调节物质含量、氮代谢关键酶活性的影响,以期揭示氮素高效利用的光合、生理机制,为软籽石榴幼苗的优培和合理水氮运筹提供理论依据和技术支持。
1 材料和方法
1.1 试验地概况
试验在石河子大学农学院试验站进行(44°18'N,88°3'E),试验站年均日照时间2865 h,≥10 ℃积温3 563.5 ℃,≥15 ℃积温2960 ℃,无霜期170 d,多年平均降水量207 mm,平均蒸发量1660 mm,昼夜温差较大。以上一年春季扦插的突尼斯软籽石榴幼苗为试验材料(引自河南荥阳),次年7 月移栽于高25 cm、内径30 cm 的美植袋中(美植袋外套塑料袋,防止水分流出),每个美植袋土与蛭石(体积比1∶1)混合,总质量22 kg,待缓苗结束后进行不同水氮处理。试验站供试土壤(0~20 cm)理化性质见表1。
表1 供试土壤基本理化性质
Table1 Basic physical and chemical properties of the tested soil
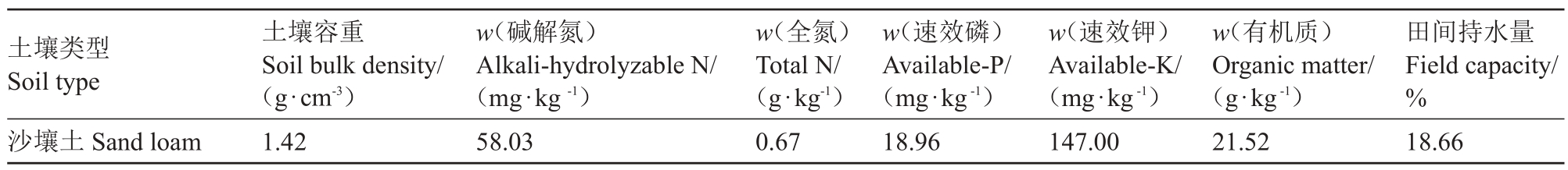
土壤类型Soil type沙壤土Sand loam土壤容重Soil bulk density/(g·cm-3)1.42 w(碱解氮)Alkali-hydrolyzable N/(mg·kg-1)58.03 w(全氮)Total N/(g·kg-1)0.67 w(速效磷)Available-P/(mg·kg-1)18.96 w(速效钾)Available-K/(mg·kg-1)147.00 w(有机质)Organic matter/(g·kg-1)21.52田间持水量Field capacity/%18.66
1.2 试验设计
设灌水和施氮2 个因素。3 个灌溉水平,即(1)低水:W1(灌水上下限为田间持水量的35%~45%,换算成土壤含水量为0.065%~0.084%)、(2)中水:W2(灌水上下限为田间持水量的55%~65%,换算成土壤含水量为0.103%~0.121%)、(3)高水:W3(灌水上下限为田间持水量的75%~85%,换算成土壤含水量为0.140%~0.159%);4 个氮肥水平:即(1)不施氮(N0,0 g·kg-1),每株施0 g 普通尿素;(2)低氮(N1,0.1 g·kg-1),每株施4.78 g 普通尿素;(3)中氮(N2,0.2 g·kg-1),每株施9.57g 普通尿素;(4)高氮(N3,0.3 g·kg-1),每株施14.35 g 普通尿素。不同水氮处理下的软籽石榴幼苗生长状态见图1。氮肥用尿素(分析纯),装土前与土均匀拌入。试验采用随机区组试验设计,共设12个处理,每个处理3次重复。试验前利用烘干法与TDR水分仪测定校准,灌水处理前各处理土壤含水率控制在田间持水量的75%~85%,待缓苗结束后开始灌水处理,为减少环境差异带来的系统误差,每5 d调换盆栽位置1次。

图1 不同水氮处理下的软籽石榴幼苗生长状态
Fig.1 Growth status of pomegranate seedlings under different water and nitrogen treatments
利用TDR水分测定仪测定土壤水分,测定深度20 cm。
灌水量计算公式:M=r×p×h×θf×(q1-q2)/η[14]。
其中:M—灌水量(g·cm-2);r—土壤体积质量(0~20 cm),1.40 g·cm-3 ;p—土壤湿润比,取100%;h与θf代表灌水计划湿润层和最大田间持水率,取值为0.2 m 和18.66%;q1 与q2 分别表示土壤水分上限和实际含水率;η—水分利用系数,取0.8(井灌水分利用系数不低于0.8),每天9:00 进行土壤水分测量,不同处理在达到田间持水率的下限时进行灌溉。
1.3 测定项目与方法
1.3.1 叶绿素含量、光合特性及叶绿素荧光参数的测定 于水氮处理至第40天,参照严衍禄等[15]的方法测定叶绿素a、叶绿素b、叶绿素(a+b)。10:00—12:00 进行光合气体交换参数的测定;使用美国LICOR 公司便携式光合仪LI-6400 测定石榴叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr),测定光照度为400 mol·m-2·s-1,CO2 浓度为400 μmol·mol-1,流速为500 μmol·s-1。叶绿素荧光参数利用脉冲调制式叶绿素荧光成像系统MAX-Imaging-PAM 测定;测定时选取生长一致且受光方向相同的功能叶(从枝条顶部倒数第5~8个完全叶),暗适应30 min 后测定石榴幼苗功能叶的参数包括PSⅡ最大光化学效率(Fv/Fm)、光化学淬灭系数(qP)、非光化学淬灭系数(NPQ)、光合电子传递速率(ETR)和光化学能量转化的有效量子产量Y(Ⅱ)。
1.3.2 渗透调节物质含量测定 试验于处理10、20、30、40 d 后取每株幼苗功能叶(从枝条顶部倒数第5~8个完全叶)进行指标的测定,每个处理3次重复。利用考马斯亮蓝法测定可溶性蛋白质含量,脯氨酸含量的测定采用磺基水杨酸比色法[16]。可溶性糖含量采用蒽酮比色法测定[16]。
1.3.3 氮代谢酶活性的测定 试验于处理10、20、30、40 d后采样,将采集的功能叶进行氮代谢酶活性的测定,每个处理3次重复。NR活性采用离体法[17]进行测定,GS活性采用王月福等[18]和李佳帅等[19]的方法进行测定,GOT和GPT活性采用吴良欢[20]的方法测定。
1.4 数据分析
利用Microsoft Excel 2003进行数据整理,采用R 4.0.3进行数据分析(p<0.05),利用Origin 2022绘图。
2 结果与分析
2.1 石榴叶片叶绿素含量对不同水氮调控的响应
由表2 可知,同一氮素处理,叶绿素a、b 含量及叶绿素总量W2 处理显著大于W1、W3;在W1 灌水条件下,叶绿素a、b 含量及叶绿素总量随施氮量的增加而降低;在W2 灌水条件下,随施氮量的增加,叶绿素含量呈现先升高后下降的趋势,且以N2处理最高;在W3 灌水条件下,在一定范围内,叶绿素含量随施氮量的增加而增加。
表2 水氮耦合对石榴叶片的叶绿素a、叶绿素b 及叶绿素总量的影响
Table 2 Effects of water-nitrogen coupling on chlorophyll a,chlorophyll b,and total chlorophyll content in pomegranate

注:同列不同小写字母表示处理间差异显著(p<0.05)。下同。
Note:Different lowercase letters in the same column indicate significant differences between treatments(p<0.05).The same below.
灌水水平Water levels W1 W2 W3 w(总叶绿素)Total chlorophyll content/(mg·g-1)0.579±0.016 h 0.741±0.015 fg 0.740±0.016 fg 0.763±0.020 f 0.698±0.016 g 1.135±0.015 c 1.425±0.033 a 1.290±0.008 b 0.634±0.021 h 0.916±0.017 e 0.938±0.015 e 1.063±0.007 d施氮水平Nitrogen levels N0 N1 N2 N3 N0 N1 N2 N3 N0 N1 N2 N3 w(叶绿素a)Chlorophyll a content/(mg·g-1)0.449±0.005 i 0.609±0.008 f 0.607±0.008 f 0.561±0.010 g 0.528±0.006 g 0.842±0.010 c 1.060±0.022 a 0.959±0.006 b 0.491±0.005 h 0.687±0.009 e 0.703±0.004 e 0.790±0.008 d w(叶绿素b)Chlorophyll b content/(mg·g-1)0.130±0.011 f 0.132±0.009 f 0.133±0.008 f 0.202±0.010 cd 0.170±0.010 de 0.294±0.005 b 0.364±0.011 a 0.331±0.002 a 0.143±0.018 ef 0.229±0.009 c 0.234±0.012 c 0.274±0.003 b
2.2 石榴光合特性对不同水氮调控的响应
由表3 可看出,在施氮量相同的情况下,W1 灌水处理显著降低光合效率。氮对石榴光合特性的影响表现为:W1 灌水条件下,随施氮量的增加,Pn、Tr和Gs反而下降,Ci的变化与Pn、Tr和Gs的变化趋势相反;W2 灌水条件下,Pn、Tr、Gs和Ci随施氮量的增加呈现先升高后下降的趋势,以N2施氮处理最高;W3灌水条件下,Pn、Tr、Gs和Ci的值随施氮量的增加而增加;且在各灌水处理下,施氮处理下的Pn、Tr和Gs均较不施氮处理的大。
表3 水氮耦合下石榴光合特性参数的变化
Table 3 Changes in photosynthetic properties of pomegranate under water-nitrogen coupling

灌水水平Water levels W1 W2 W3施氮水平Nitrogen levels N0 N1 N2 N3 N0 N1 N2 N3 N0 N1 N2 N3净光合速率Pn/(μmol·m-2·s-1)1.968±0.239 g 7.068±0.014 d 4.333±0.043 e 3.297±0.288 f 3.311±0.222 f 9.256±0.012 c 14.553±0.391 a 12.957±0.322 b 3.299±0.283 f 9.173±0.504 c 10.112±0.368 c 12.436±0.027 b蒸腾速率Tr/(mmol·m-2·s-1)1.331±0.249 h 4.331±0.434 d 3.965±0.338 de 3.216±0.070 ef 2.753±0.282 fg 4.724±0.226 cd 7.057±0.248 a 6.206±0.240 ab 2.169±0.050 gh 3.331±0.275 ef 5.626±0.174 bc 6.057±0.240 b气孔导度Gs/(mmol·m-2·s-1)0.095±0.026 g 0.336±0.08 cdef 0.289±0.037 def 0.213±0.014 efg 0.283±0.012 ef 0.408±0.015 bcd 0.556±0.112 a 0.456±0.030 ab 0.195±0.006 fg 0.306±0.009 cdef 0.368±0.046 cde 0.451±0.030 abc胞间CO2浓度Ci/(μmol·mol-1)396.967±4.902 a 213.351±4.759 g 287.663±6.782 de 323.505±6.577 c 137.162±4.400 i 246.426±3.630 f 275.586±3.880 e 246.082±7.208 f 190.247±7.021 h 270.098±2.502 e 299.413±4.221 d 358.297±7.208 b
2.3 不同水氮处理对石榴叶片叶绿素荧光参数的影响
2.3.1 石榴叶片Fv/Fm对不同水氮调控的响应 如图2-A,各水分处理间比较显示,当施氮量相同时,W2 灌水处理下的Fv/Fm显著高于W1、W3,表现为W2>W3>W1。在W1 灌水水平下,以N1 处理的Fv/Fm最大,且与N0、N3 达到显著差异水平;在W2灌水处理下,以N2施氮处理下的Fv/Fm最大,分别高出N0、N1、N3处理21.57%、5.26%、2.15%。W3灌水水平下,各施氮水平间达显著差异,N3 较N0、N1、N2分别高出了30.65%、19.44%、16.98%。
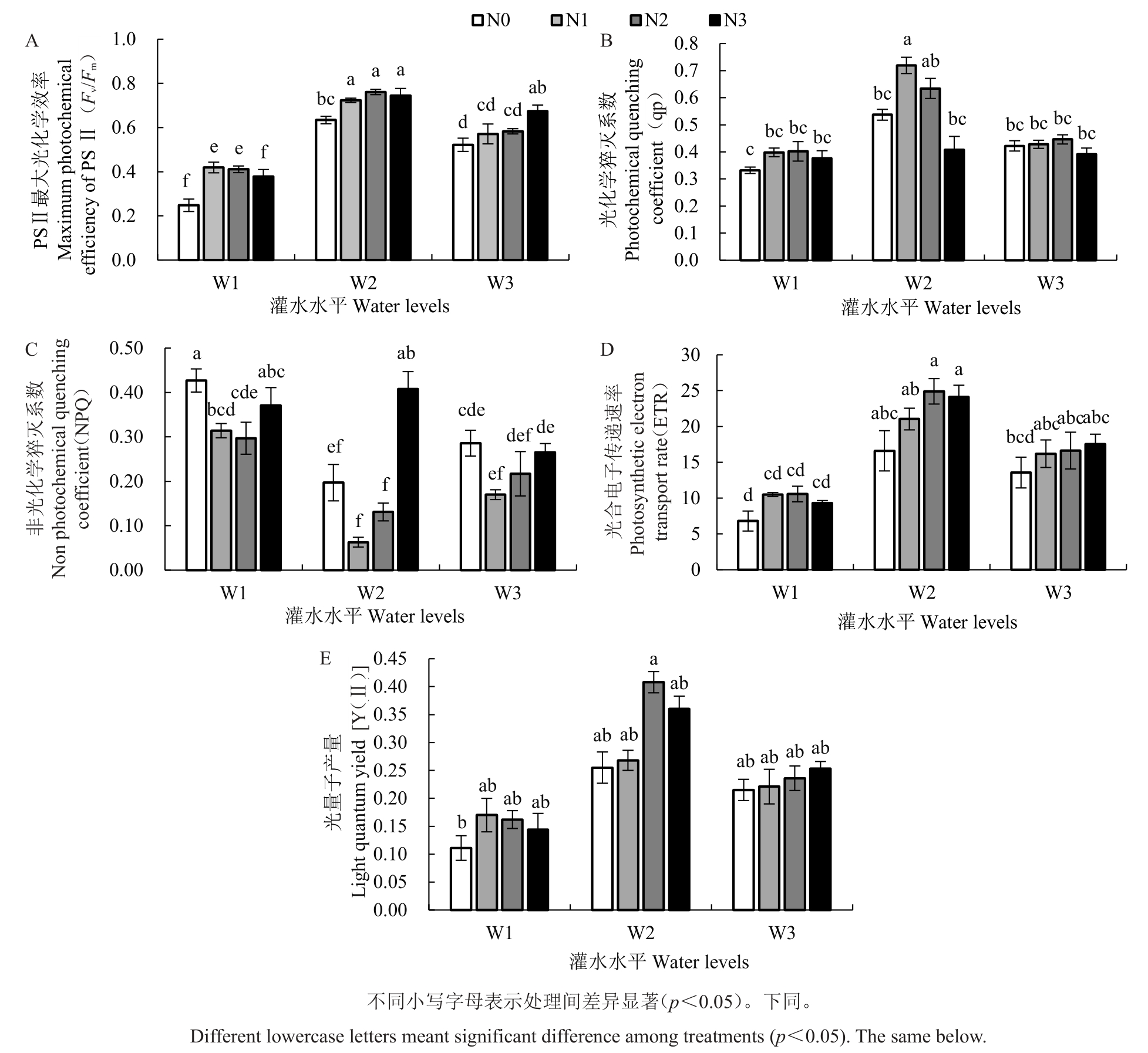
图2 水氮耦合对石榴幼苗叶绿素荧光特性的影响
Fig.2 Effects of water and nitrogen coupling on chlorophyll fluorescence characteristics of pomegranate seedlings
2.3.2 石榴叶片qP 和NPQ 对不同水氮调控的响应 不同水氮处理对石榴叶片qP 和NPQ 的影响见图2-B~C,在相同施氮量条件下,W2 灌水处理的qP高于W1与W3处理,但W2灌水处理下的N1、N3处理与W1、W3 处理下的N1、N3 处理间差异不显著。低水水平下,以N1、N2 施氮处理的qP 相对较高,与N0相比,分别高出19.88%、21.08%;中水水平下,以N1 处理的qP 最高,除与N2 处理间的差异不显著外,与N0、N3 处理间的差异均显著,N1 较N0、N2、N3分别高出76.66%、13.41%、76.23%;高水水平下,各施氮处理间差异不显著,且以N2 处理的qP 相对较高,较N0 高出5.69%。从整体变化情况看,NPQ值的变化幅度大qP,且NPQ 值与qP 大致呈现相反趋势。
2.3.3 石榴叶片ETR 对不同水氮调控的响应 由图2-D可知,施氮量相同时,灌水对石榴叶片ETR的影响表现为W2>W3>W1,且W2 与W1 处理间差异显著。W1 灌水处理下,以N1、N2 处理的石榴叶片ETR值较大,分别较N0增加54.41%、55.40%;W2灌水处理下,以N2 处理的ETR 值最大,高出N0 施氮处理50%;W3灌水处理下,施氮对石榴叶片ETR的影响表现为N3>N2>N1>N0,N3 较N0 施氮处理提高了29.23%。
2.3.4 石榴叶片Y(Ⅱ)对不同水氮调控的响应 如图2-E 所示,水分处理分析结果显示,W2 灌水处理下的Y(Ⅱ)值最大,表现为W2>W3>W1。W1 灌水水平下,各施氮处理结果差异不显著,以N1 处理下的Y(Ⅱ)值最大,与N0、N2、N3 相比,分别高出53.15%、4.94%、18.06%;W2 灌水水平下,各施氮处理间差异不显著,N2施氮处理分别高出N0、N1、N3处理60%、52.24%、13.33%。W3 灌水处理下,各施氮处理间差异亦不显著,以N3处理的Y(Ⅱ)值较大,分别高出N0、N1、N2处理17.67%、14.48%、7.20%。
2.3.5 不同水氮处理对石榴叶片可溶性蛋白含量的影响 由图3 可知,相同氮素水平下,W3 条件下的可溶性蛋白质含量显著高于W1、W2。W1 条件下,随处理时间的增加,石榴叶片可溶性蛋白含量呈先增加后降低的趋势,且增加氮素施用量,可溶性蛋白含量反而下降,即N1>N2>N3>N0,N1较N0增加了3.08%~97.16%。W2 条件下,可溶性蛋白含量随施氮量的增加而呈现先增加后下降的趋势,20 d 达最大值,且以N2 处理其含量最高,N2 较N0 增加了16.02%~39.31%。W3条件下,在一定范围内增加施氮量,可促进石榴叶片可溶性蛋白质含量的积累,即N3>N2>N1>N0;且在N2、N3 处理下,随处理时间的延长,可溶性蛋白含量不断增加,而N0、N1 处理至40 d,其含量略有降低;在处理的40 d内,N3较N0增加了14.27%~26.21%。

图3 水氮运筹对石榴叶片可溶性蛋白质含量的影响
Fig.3 Effects of irrigation and nitrogen application regimes on pomegranate soluble protein content
2.3.6 不同水氮处理对叶片可溶性糖含量的影响从图4 可看出,石榴叶片可溶性糖含量对水分响应较为明显,整体表现为W1>W2>W3,低水条件下,其叶片可溶性糖含量相对较高,表现出一定的渗透调节能力,水氮处理至30 d时,可溶性糖含量达到峰值,继续进行干旱处理,其含量略有回落趋势,且增加施氮量可降低其可溶性糖含量,水氮处理的40 d内,N1较N0条件下,可溶性糖含量增加了15.80%~21.17%。在中水处理下,随处理时间的延长,可溶性糖含量先快速增加后趋于平稳,增加施氮量,叶片可溶性糖含量增加,N3 较N0 增加了16.93%~23.42%;充分灌水条件下的可溶性糖含量变化趋势与中水处理一致;该灌水条件下高氮处理相对于无氮处理可溶性糖含量增加了7.11%~16.35%。
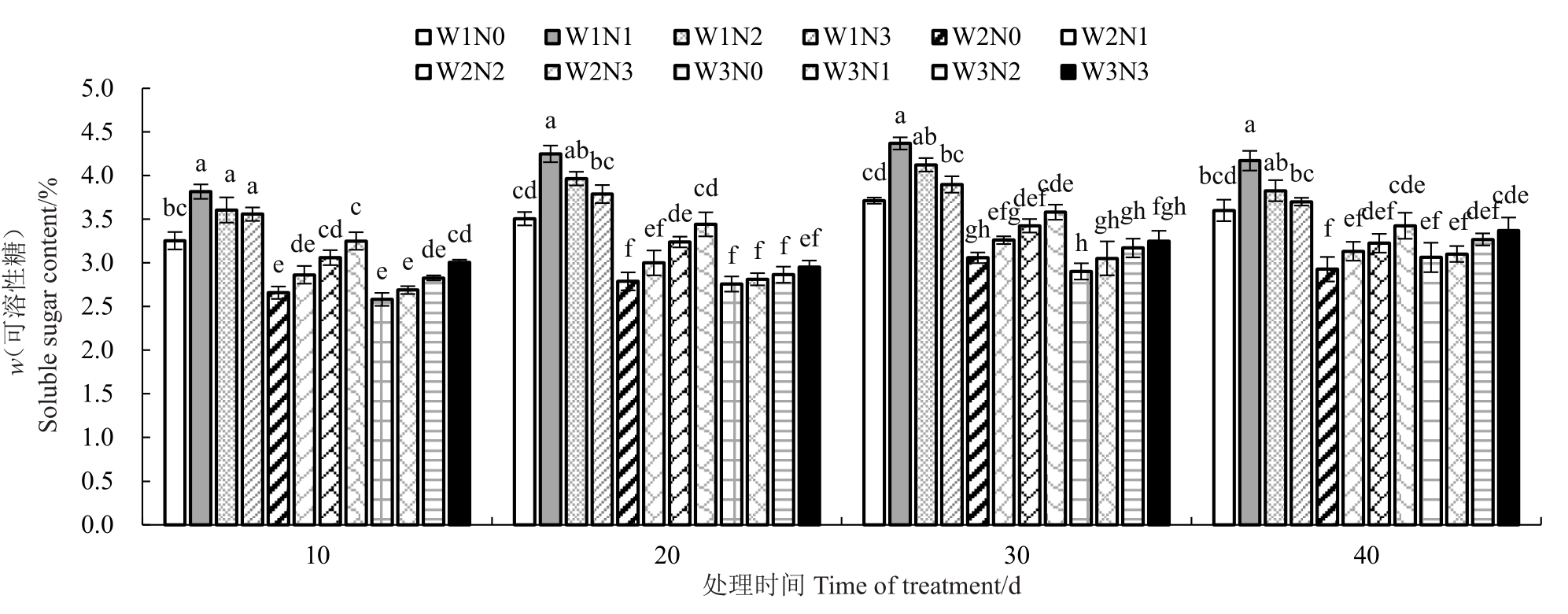
图4 水氮运筹对石榴叶片可溶性糖含量的影响
Fig.4 Effects of irrigation and nitrogen application regimes on pomegranate soluble sugar content
2.3.7 不同水氮处理对石榴叶片脯氨酸含量的影响 从图5可看出,水氮处理过程中,石榴叶片脯氨酸含量均呈现先增加后减少的趋势,30 d 达到最高。随着土壤水分含量的下降,叶片脯氨酸含量呈现上升趋势,且在各灌水水平下,增加氮肥施用量使石榴叶片脯氨酸含量增加。低水(W1)条件下,高氮处理相对于不施氮处理的40 d 内,脯氨酸含量升高38.61%~87.84%,中水(W2)条件下,高氮处理较无氮处理脯氨酸含量增幅为29.22%~56.29%,高水(W3)条件下,高氮处理的脯氨酸含量较无氮处理增加15.86%~26.98%。
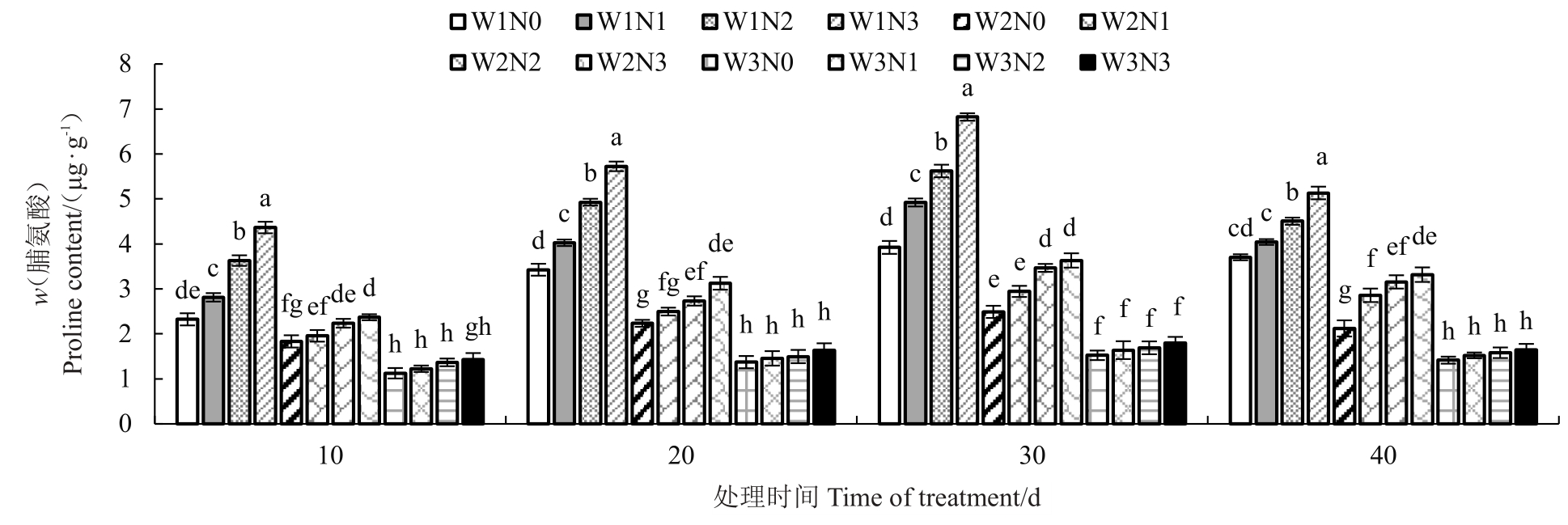
图5 水氮运筹对石榴叶片脯氨酸含量的影响
Fig.5 Effects of irrigation and nitrogen application regimes on pomegranate proline content
2.3.8 不同水氮处理对石榴叶片氮代谢酶活性的影响(1)水氮耦合对石榴叶片NR 活性的影响。由图6可知,在各灌水水平下,从第20天开始,随施氮量增加,NR 活性表现出差异;原因可能是:第10 天时,由于温度等环境因素的影响,氮肥未能被完全吸收利用,随处理天数的增加,氮素被完全吸收,从而表现出差异。低水(W1)条件下,随时间推移,NR活性先升高后下降,在灌水施氮处理至30 d时,表现出较高的活性,且在该灌水条件下,NR 活性表现为N1>N2>N3>N0;中水(W2)条件下,NR活性以水氮处理至30 d、中氮处理(N2)最高,分别高出N0、N1、N3 处理60.09%、40.89%、27.28%。充分灌水(W3)的条件下,随处理天数的增加,除N0外,NR活性总体表现升高趋势,且在该灌水条件下,NR 活性表现为N3>N2>N1>N0。
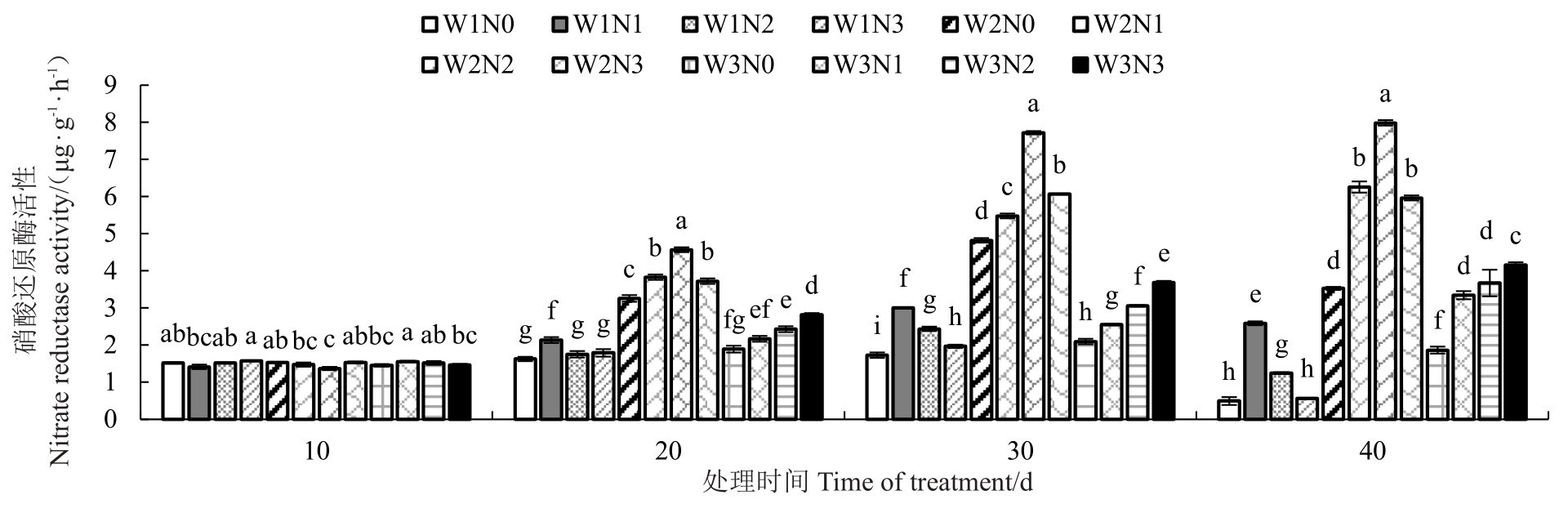
图6 水氮运筹对石榴叶片硝酸还原酶活性的影响
Fig.6 Effects of irrigation and nitrogen application regimes on pomegranate nitric acid reductase activity
(2)水氮耦合对石榴叶片GS活性的影响。如图7所示,与NR活性表现一致,不同氮素水平下,灌水过多或过少,均会显著降低GS活性,进而影响植株生长。低水(W1)条件下,GS活性先升高后下降,且其活性最高的为N1,是0.96 A540 nm·mg-1·h-1;W2灌水处理下,随处理时间的延长,GS活性不断升高,且以N2 处理最高,为6.90 A540 nm·mg-1·h-1;W3 灌水条件下,除N0 处理至40 d 出现下降趋势外,其余氮处理均随时间的推移呈升高趋势,同样以N2 处理最高,为2.50 A540 nm·mg-1·h-1。

图7 水氮运筹对石榴叶片谷氨酰胺合成酶活性的影响
Fig.7 Effects of irrigation and nitrogen application regimes on pomegranate glutamine synthase activity
(3)水氮耦合对石榴叶片GOT与GPT活性的影响。不同水氮处理对GOT 活性的影响见图8,其中W1灌水处理以N1处理下的GOT活性最高,增加施氮量,石榴叶片GOT活性反而降低;说明低灌水量下,低氮更利于GOT 活性的提高。W2 水分条件下,N2、N3处理,GOT活性均随处理天数的增加,呈升高趋势,而N0、N1 呈先升高后降低趋势,在处理30 d时达峰值,分别为0.87 μmol·g-1·min-1、1.62 μmol·g-1·min-1。W3 灌水条件下,石榴叶片GOT 活性随施氮量的增加而增加,且均以水氮处理至30 d表现出最高活性。

图8 水氮运筹对石榴叶片谷氨酸草酰乙酸转氨酶活性的影响
Fig.8 Effects of irrigation and nitrogen application regimes on pomegranate glutamate oxalyl acetase activity
如图9所示,不同水氮处理下,GPT活性在处理至20 d 才表现出差异。W1 条件下,GPT 活性以N1处理最高,且各氮素处理下的GPT活性均随处理时间的延长而先升高后降低,与NR、GS、GOT 活性表现一致,在该灌水条件下随施氮量增加,GPT 活性反而下降,说明在不同灌水条件下,一定范围内增加施氮量可促进叶片GPT活性提高,而施氮过量会造成氮素营养过剩,使GPT 活性降低。W2 灌水条件下,以处理至40 d 的N2 下的GPT 活性最高,且N0、N1 处理的GPT 活性随处理时间的推移呈现先增加后降低的趋势,N2、N3处理的GPT活性随处理时间的延长而增加。在W3 灌水条件下,除N0 外,其余氮素处理的GPT活性均随处理时间的增加而增加。
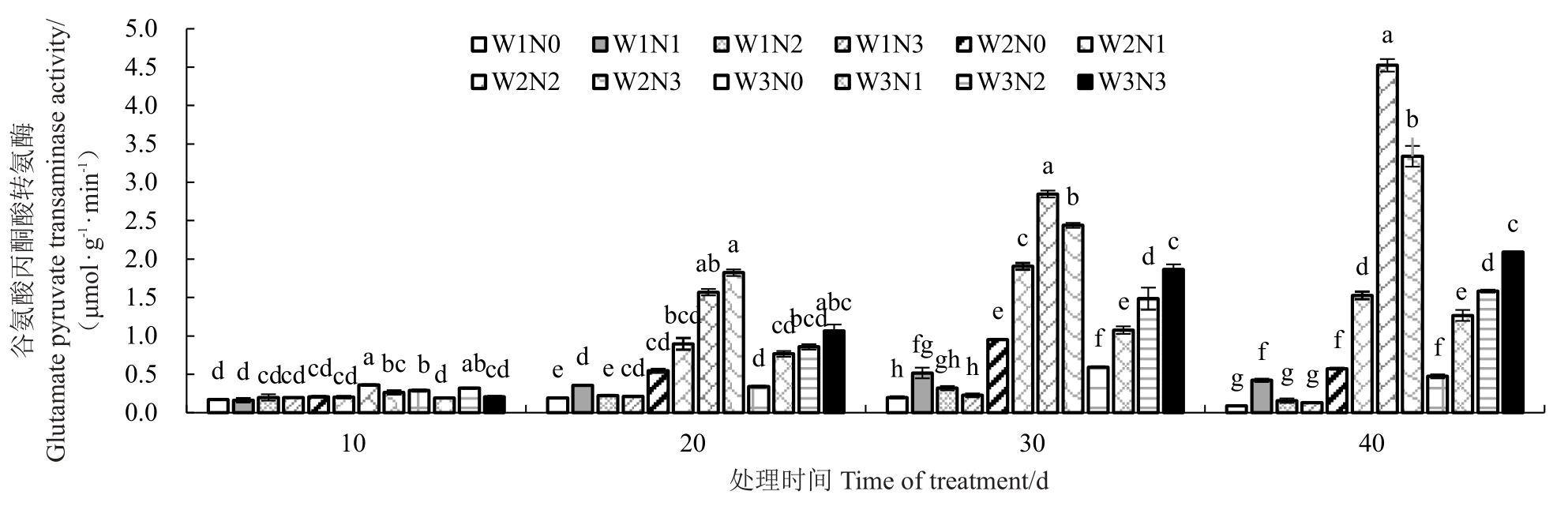
图9 水氮运筹对石榴叶片谷氨酸丙酮酸转氨酶活性的影响
Fig.9 Effects of irrigation and nitrogen application regimes on pomegranate acetone glutamate transaminase activity
3 讨 论
光合色素在光合作用的吸收、传递和转换等过程中发挥重要作用,其含量的高低与光合强度密切相关[21]。本试验关于光合色素的结果与张仁和等[9]对玉米的盆栽试验有类似趋势,中等灌水量更有利于叶绿素含量的提高,这可能是适度的水分亏缺更利于初生根系的生长发育,使软籽石榴尽可能地吸收土壤中的水分和养分[22]。且在本研究中,不同灌水条件下,适量施氮对提高叶片叶绿素含量有促进作用,这可能是由于适宜的施氮量会促进水分胁迫条件下叶绿素的生物合成或抑制叶绿素酶活性的提高[23-24]。
水氮施用直接影响作物的光合作用,而光合作用又是作物生长发育的基础[25]。土壤水分过多[26]或过少[25]均会降低植物的净光合速率。本研究表明:W2 处理下,Pn、Tr、Gs均表现最高,且3 种水分处理下,Pn、Tr、Gs随施氮量的增加表现出不同程度的变化趋势,其中不施氮处理会显著抑制软籽石榴的净光合速率,说明在不同灌水条件下,适宜施氮均能减轻水分对石榴的胁迫程度;W1处理下,增加施氮量对石榴叶片光合速率的提高有更显著的抑制作用,而在W2、W3处理下,Pn、Tr、Gs的变化与施氮量呈正相关。在低水水平下,Ci变化与Pn、Tr、Gs的变化呈相反趋势;在中水和高水水平下,Pn、Tr、Gs和Ci变化趋势相同。表明石榴叶片Pn的变化是由气孔与非气孔因素互作的结果[25],在W2、W3 条件下,气孔限制因子对光合作用影响较大;而在W1条件下,则非气孔因素占主导地位。
在荧光动力学参数的测定中,经暗适应的叶片,可变荧光(Fv)与最大荧光(Fm)的比值(Fv/Fm)可代表PSⅡ光化学的最大效率,是植物受到抑制程度的理想指标[27]。本研究结果表明:施氮量相同的情况下,灌水过多或过少均会抑制Fv/Fm值的提高;各灌水条件下,在一定范围内不同程度地增加施氮量会缓解水分胁迫对石榴叶片Fv/Fm的抑制作用。表明水分胁迫和营养亏缺或过剩的情况均会显著抑制软籽石榴幼苗对光能的利用效率。
植物叶片的荧光光化学猝灭系数(qP)反映了PSⅡ反应中心的开放程度,而荧光非光化学猝灭系数(NPQ)是指PSⅡ天线色素吸收的光能不能用于光合电子传递而以热能的形式耗散掉的光能部分[7]。本研究结果显示,在相同施氮量条件下,W2灌水处理的qP 高于W1 与W3 处理,且各水分条件下均以N1、N2 处理下的qP 值相对较高。这表明在不同的水分条件下,适宜的施氮量有提高软籽石榴叶片qP 并降低NPQ的作用,使其叶片减少热耗散,有利于把所捕获的光能尽可能地用于光合作用[28]。
ETR 表示实际光照度下的光合电子传递速率,可反映出光化学反应过程中固定碳的电子传递情况[29]。Y(Ⅱ)是PSⅡ中光化学能量转化的有效量子产量[30]。灌水过多或过少均会抑制ETR和Y(Ⅱ)的增加;W1灌水处理下,以N1、N2处理的叶片ETR和Y(Ⅱ)值较高,W2灌水处理下,以N2处理的ETR和Y(Ⅱ)值最大,W3 灌水处理下,ETR 和Y(Ⅱ)值随施氮量的增加而增大。这表明不同灌水条件下一定范围内增加施氮量可在一定程度上缓解干旱对石榴叶片光合系统的损害程度,降低干旱对其PSⅡ的绝对电子传递速率的抑制作用,从而改善软籽石榴叶片光合性能。
植物可溶性蛋白含量可作为反映植株体内代谢强度的一个重要指标[19]。周萍[31]认为干旱胁迫会导致小麦旗叶可溶性蛋白含量下降,进而加速其叶片衰老进程,本试验进一步证实了周萍等人的观点,土壤含水量对石榴叶片可溶性蛋白含量影响显著,在一定范围内可溶性蛋白的积累与土壤含水量呈正相关。在充分灌水的情况下,增加施氮量,可显著促进石榴的生长及叶片光合作用,为蛋白质合成提供物质基础;但在干旱胁迫下,施氮反而会降低其叶片可溶性蛋白含量,胁迫严重甚至会影响其正常生理功能。为保证植物的正常生长,当植株受到水分胁迫时,它会积累大量渗透调节物质来防止细胞和组织脱水[32]。刘小刚等[33]在水氮耦合下小粒咖啡幼树的生理机制的研究中指出,增加灌水能不同程度地降低小粒咖啡幼树叶片内脯氨酸和可溶性糖含量,本试验设计的水氮处理结果亦是如此,低水条件下,石榴叶片内会积累大量的脯氨酸和可溶性糖。本研究表明,在中水和高水条件下,增加施氮量,可显著提高石榴植株体内的渗透调节能力,而在低水条件下,水氮处理的40 d 内,以N1 处理的可溶性糖含量最高。这说明在各灌水水平下,适宜的施氮量可促进石榴叶片脯氨酸和可溶性糖的积累,而过量施氮抑制了可溶性糖含量的提高。这可能是因为参与植株体内的渗透调节物质大多是碳氮代谢产物,而适宜施氮量提高了植株体内的氮代谢水平和碳同化效率[34]。当施氮过多时,植株体内积累大量氮素,因此需提供更多的碳骨架和能量给氮素同化过程,而使其他代谢过程受到影响,由此推测,可溶性糖含量下降可能与植株光合能力下降有关。
植物的氮素吸收形态主要为NH4+和NO3-,两者在植物体内通过相应代谢酶的催化由无机态向有机态转化后被植物利用[35]。植物在生长发育过程中,植物体内的硝酸盐在NR和亚硝酸还原酶(NiRs)的作用下,通过代谢途径转化为亚硝酸盐,再转化为铵,随后在ATP供能下,GS将谷氨酸和NH4+转换成谷氨酰胺,最终参与到氨基酸的合成。GOT和GPT是将无机氮转化为有机氮的过程中不可或缺的2个酶[36-38]。本研究结果表明,随干旱胁迫加重,各氮代谢酶活性逐渐降低;这可能是由于干旱使植株ATP合成减少,降低了植物吸收氮素的能力,进而使氮代谢酶合成受阻[31]。此外,Gonzalez-moro 等[39]的研究也表明植物受到严重干旱胁迫时,会影响其对无机氮的利用,进而影响植物体内的氮代谢强度。在水分充足的条件下,低氮不利于石榴叶片氮代谢酶活性的提高,在一定范围内增加施氮量,可显著提高其叶片氮代谢水平,这可能是因为水分充足时,氮肥用量越大,给植株提供的氮素越多,植物体内积累的硝酸盐就越多,从而使氮代谢酶活性增强。但当石榴受到干旱胁迫时,增加施氮量,反而会抑制其氮代谢酶活性,因此,在该情况下,低氮更利于植株生长发育。综上,可推测出,在水分适宜的情况下增加氮素用量,可在一定程度上增加后期土壤氮素含量,使植株继续吸收土壤中的氮素,提高其氮素同化与转运能力来延缓叶片衰老。
4 结 论
盆栽试验结果表明,中度干旱胁迫会抑制软籽石榴幼苗光合及荧光特性,降低石榴叶片硝酸还原酶、谷氨酰胺合成酶、谷氨酸草酰乙酸转氨酶与谷氨酸丙酮酸转氨酶活性,适当增加施氮量可在一定程度上缓解该光合荧光抑制效应,提高软籽石榴叶片氮代谢关键酶活性;且在该试验条件下,W2N2处理(土壤含水量为田间持水量的55%~65%,施氮量为0.2 g·kg-1)为该试验最佳水氮运筹模式。
[1]JALIKOP S H,VENUGOPALAN R,KUMAR R. Association of fruit traits and aril browning in pomegranate (Punica granatum L.)[J].Euphytica,2010,174(1):137-141.
[2]ZHAO X Q,YUAN Z H,FENG L J,FANG Y M. Cloning and expression of anthocyanin biosynthetic genes in red and white pomegranate[J]. Journal of Plant Research,2015,128(4):687-696.
[3]季亚萍.不同光质LED 组合光源对石榴幼树生长和果实品质的影响[D].郑州:河南农业大学,2017.JI Yaping.Effect of different light quality LED light source combinations on the growth and fruit quality of young pomegranate trees[D].Zhengzhou:Henan Agricultural University,2017.
[4]KATZ S R,NEWMAN R A,LANSKY E P. Punica granatum:Heuristic treatment for diabetes mellitus[J]. Journal of Medicinal Food,2007,10(2):213-217.
[5]史江莉,胡青霞,季亚萍,赵乾,陈延惠.不同红/蓝LED 组合光源对石榴幼树光合特性和生理指标的影响[C].第二届中国石榴博览会暨第七届全国石榴生产与科研研讨会论文集,2017:105-112.SHI Jiangli,HU Qingxia,JI Yaping,ZHAO Qian,CHEN Yanhui.Effects of different red/blue LED light sources on photosynthetic characteristics and physiological indicators of young pomegranate trees[C]. The 2nd China Pomegranate Expo and the 7th National Symposium on Pomegranate Production and Scientific Research,2017:105-112
[6]董伟欣,张月辰.水氮互作对不同小麦品种生理参数及产量形成的影响[J].作物杂志,2022(3):125-133.DONG Weixin,ZHANG Yuechen. Effects of water and nitrogen interaction on physiological parameters and yield formation of Wheat varieties[J].Crops,2022(3):125-133.
[7]张忠学,郑恩楠,王长明,贠宁晗.不同水氮处理对水稻荧光参数和光合特性的影响[J].农业机械学报,2017,48(6):176-183.ZHANG Zhongxue,ZHENG Ennan,WANG Changming,YUN Ninghan. Effects of different water nitrogen treatments on fluorescence parameters and photosynthetic characteristics of rice[J].Transactions of the Chinese Society for Agricultural Machinery,2017,48(6):176-183.
[8]李广浩,赵斌,董树亭,刘鹏,张吉旺,何在菊.控释尿素水氮耦合对夏玉米产量和光合特性的影响[J]. 作物学报,2015,41(9):1406-1415.LI Guanghao,ZHAO Bin,DONG Shuting,LIU Peng,ZHANG Jiwang,HE Zaiju. Effect of water and nitrogen coupling of controlled-release urea on yield and photosynthetic characteristics of summer maize[J]. Acta Agronomica Sinica,2015,41(9):1406-1415.
[9]罗宏海,张宏芝,陶先萍,张亚黎,张旺锋.膜下滴灌条件下水氮供应对棉花根系及叶片衰老特性的调节[J].中国农业科学,2013,46(10):2142-2150.LUO Honghai,ZHANG Hongzhi,TAO Xianping,ZHANG Yali,ZHANG Wangfeng. Regulation of water and nitrogen supply on root and leaf senescence characteristics of cotton under submembrane drip irrigation[J]. Scientia Agricultura Sinica,2013,46(10):2142-2150.
[10]罗慧,李伏生.滴灌施氮对番茄氮代谢及水氮利用的影响[J].节水灌溉,2021(9):90-94.LUO Hui,LI Fusheng.Effects of drip irrigation on nitrogen metabolism and water and nitrogen utilization in tomato[J]. Water Saving Irrigation,2021(9):90-94.
[11]陈修斌,蒋梦婷,尹鑫,关博文,杨彬.水氮配施对绿洲温室黄瓜氮素代谢及产量品质的影响[J].土壤与作物,2021,10(1):79-90.CHEN Xiubin,JIANG Mengting,YIN Xin,GUAN Bowen,YANG Bin. Effect of water and nitrogen application on nitrogen metabolism and yield quality of cucumber in oasis greenhouse[J].Soils and Crops,2021,10(1):79-90.
[12]张智猛,万书波,宁堂原,戴良香.氮素水平对花生氮素代谢及相关酶活性的影响[J]. 植物生态学报,2008,32(6):1407-1416.ZHANG Zhimeng,WAN Shubo,NING Tangyuan,DAI Liangxiang. Effects of nitrogen levels on nitrogen metabolism and related enzyme activities in peanut[J]. Chinese Journal of Plant Ecology,2008,32(6):1407-1416.
[13]刘小刚,张富仓,杨启良,田育丰,李志军.石羊河流域武威绿洲春玉米水氮耦合效应[J].应用生态学报,2013,24(8):2222-2228.LIU Xiaogang,ZHANG Fucang,YANG Qiliang,TIAN Yufeng,LI Zhijun. Water and nitrogen coupling effects of spring maize in Wuwei Oasis,Shiyang River Basin[J].Chinese Journal of Applied Ecology,2013,24(8):2222-2228.
[14]陈修斌,李翊华,许耀照.温室番茄对水肥耦合的光合特性及叶绿素荧光参数响应[J].土壤通报,2015,46(3):687-693.CHEN Xiubin,LI Yihua,XU Yaozhao.Photosynthetic characteristics and chlorophyll fluorescence parameters response of greenhouse tomato to water and fertilizer coupling[J]. Chinese Journal of Soil Science,2015,46(3):687-693.
[15]严衍禄,刘心生.叶绿素测定方法的研究[J].中国农业大学学报,1982,13(2):53-69.YAN Yanlu,LIU Xinsheng. Study on the method of chlorophyll determination[J]. Journal of China Agricultural University,1982,13(2):53-69.
[16]高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.GAO Junfeng. Experimental guidance of plant physiology[M].Beijing:Higher Education Press,2006.
[17]叶利庭,吕华军,宋文静,图尔迪,沈其荣,张亚丽.不同氮效率水稻生育后期氮代谢酶活性的变化特征[J]. 土壤学报,2011,48(1):132-140.YE Liting,LÜ Huajun,SONG Wenjing,TU Erdi,SHEN Qirong,ZHANG Yali. Characteristics of nitrogen metabolizing enzyme activities in rice with different nitrogen efficiency at late reproductive stages[J].Acta Pedologica Sinica,2011,48(1):132-140.
[18]王月福,于振文,李尚霞,余松烈.氮素营养水平对冬小麦氮代谢关键酶活性变化和籽粒蛋白质含量的影响[J].作物学报,2002,28(6):746-748.WANG Yuefu,YU Zhenwen,LI Shangxia,YU Songlie. Effect of nitrogen nutrition level on changes in key enzyme activities and grain protein content of winter wheat[J]. Acta Agronomica Sinica,2002,28(6):746-748.
[19]李佳帅,杨再强,王明田,韦婷婷,赵和丽,江梦圆,孙擎,黄琴琴.水氮耦合对苗期葡萄叶片氮素代谢酶活性的影响[J].中国农业气象,2019,40(6):368-379.LI Jiashuai,YANG Zaiqiang,WANG Mingtian,WEI Tingting,ZHAO Heli,JIANG Mengyuan,SUN Qing,HUANG Qinqin.Effect of water and nitrogen coupling on nitrogen metabolizing enzyme activities in seedling grapevine leaves[J]. Chinese Journal of Agrometeorology,2019,40(6):368-379.
[20]吴良欢.植物转氨酶(GOT 和GPT)活度比色测定方法及其应用[J].土壤通报,1998,29(3):136-138.WU Lianghuan. Colorimetric determination of plant transaminase (GOT and GPT) activity and its application[J]. Chinese Journal of Soil Science,1998,29(3):136-138.
[21]吕金印,山仑,高俊凤.非充分灌溉及其生理基础[J].西北植物学报,2002,22(6):232-237.LÜ Jinyin,SHAN Lun,GAO Junfeng. Non-sufficient irrigation and its physiological basis[J].Acta Botanica Boreali-Occidentalia Sinica,2002,22(6):232-237.
[22]郭卫东,桑丹,郑建树,廖海兵,陈文荣.缺氮对佛手气体交换、叶绿素荧光及叶绿体超微结构的影响[J].浙江大学学报(农业与生命科学版),2009,35(3):307-314.GUO Weidong,SANG Dan,ZHENG Jianshu,LIAO Haibing,CHEN Wenrong. Effects of nitrogen deficiency on the gas exchange,chlorophyll fluorescence and chloroplast ultrastructure in fingered citron[J]. Journal of Zhejiang University(Agriculture and Life Sciences),2009,35(3):307-314.
[23]董博,张绪成,张东伟,郭天文,于显枫.水氮互作对春小麦叶片叶绿素含量及光合速率的影响[J]. 干旱地区农业研究,2012,30(6):88-93.DONG Bo,ZHANG Xucheng,ZHANG Dongwei,GUO Tianwen,YU Xianfeng.Effects of water and nitrogen interactions on chlorophyll content and photosynthetic rate of spring wheat leaves[J].Agricultural Research in the Arid Areas,2012,30(6):88-93.
[24]项洪涛,郑殿峰,何宁,李琬,王曼力,王诗雅.植物对低温胁迫的生理响应及外源脱落酸缓解胁迫效应的研究进展[J].草业学报,2021,30(1):208-219.XIANG Hongtao,ZHENG Dianfeng,HE Ning,LI Wan,WANG Manli,WANG Shiya. Physiological response of plants to low temperature stress and the mitigation effect of exogenous abscisic acid[J].Acta Prataculturae Sinica,2021,30(1):208-219.
[25]吴海华,陈波浪,盛建东,郝丽娜.不同水氮水平对全立架露地栽培伽师瓜光合特性与水分利用效率的影响[J].中国瓜菜,2013,26(2):6-10.WU Haihua,CHEN Bolang,SHENG Jiandong,HAO Lina. Effects of different water and nitrogen levels on photosynthetic characteristics and water use efficiency of melon under openfield cultivation[J]. China Cucurbits and Vegetables,2013,26(2):6-10.
[26]张健,刘美艳.一氧化氮提高黄瓜幼苗耐涝性的探究[J].中国瓜菜,2017,30(1):18-21.ZHANG Jian,LIU Meiyan. Effects of nitric oxide on waterlogging tolerance of cucumber seedlings[J]. China Cucurbits and Vegetables,2017,30(1):18-21.
[27]YIN C Y,PANG X Y,KE C.The effects of water,nutrient availability and their interaction on the growth,morphology and physiology of two poplar species[J]. Environmental and Experimental Botany,2009,67(1):196-203.
[28]焦娟玉,尹春英,陈珂.土壤水氮供应对麻疯树幼苗光合特性的影响[J].植物生态学报,2011,35(1):91-99.JIAO Juanyu,YIN Chunying,CHEN Ke. Effects of soil water and nitrogen supply on photosynthetic characteristics of Jatropha curcas seedlings[J]. Chinese Journal of Plant Ecology,2011,35(1):91-99.
[29]梁芳,郑成淑,孙宪芝,王文莉.低温弱光胁迫及恢复对切花菊光合作用和叶绿素荧光参数的影响[J]. 应用生态学报,2010,21(1):29-35.LIANG Fang,ZHEN Chengshu,SUN Xianzhi,WANG Wenli.Effects of low temperature and low light stress and recovery on photosynthesis and chlorophyll fluorescence parameters of cut flower chrysanthemum[J]. Chinese Journal of Applied Ecology,2010,21(1):29-35.
[30]BILGER W,BJöRKMAN O. Role of the xanthophyll cycle in photoprotection elucidated by measurements of light-induced absorbance changes,fluorescence and photosynthesis in leaves of Hedera canariensis[J]. Photosynthesis Research,1990,25(3):173-185.
[31]周萍.不同水分和氮素营养水平对滴灌小麦旗叶活性氧代谢及产量的影响[D].石河子:石河子大学,2013.ZHOU Ping. Effect of different water and nitrogen nutrient levels on reactive oxygen metabolism and yield of drip irrigated wheat flag leaf[D].Shihezi:Shihezi University,2013.
[32]田甜,王海江,王金刚,朱永琪,史晓艳,李维弟,李文瑞玉.盐胁迫下施加氮素对饲用油菜有机渗透调节物质积累的影响[J].草业学报,2021,30(10):125-136.TIAN Tian,WANG Haijiang,WANG Jingang,ZHU Yongqi,SHI Xiaoyan,LI Weidi,LI Wenruiyu. Effects of nitrogen application on osmotic substances accumulation in Brassica napus L.under salt stress[J].Acta Prataculturae Sinica,2021,30(10):125-136.
[33]刘小刚,张岩,程金焕,钟原,杨启良.水氮耦合下小粒咖啡幼树生理特性与水氮利用效率[J].农业机械学报,2014,45(8):160-166.LIU Xiaogang,ZHANG Yan,CHENG Jinhuan,ZHONG Yuan,YANG Qiliang. Physiological characteristics and water and nitrogen utilization efficiency of small-grain coffee young trees under water and nitrogen coupling[J]. Transactions of the Chinese Society for Agricultural Machinery,2014,45(8):160-166.
[34]王贺正,张均,吴金芝,徐国伟,陈明灿,付国占,李友军.不同氮素水平对小麦旗叶生理特性和产量的影响[J].草业学报,2013,22(4):69-75.WANG Hezheng,ZHANG Jun,WU Jinzhi,XU Guowei,CHEN Mingcan,FU Guozhan,LI Youjun. Effects of different nitrogen levels on physiological characteristics and yield of wheat flag leaf[J].Acta Prataculturae Sinica,2013,22(4):69-75.
[35]朱红,孔令刚,张志浩,毕思圣,凌春辉,韦业,颜攀,王华田,马风云,刘秀梅,唐金,陈淑英,丛桂芝.磁化处理促进施氮条件下葡萄氮素的代谢和分布[J].中国生态农业学报(中英文),2020,28(4):535-544.ZHU Hong,KONG Linggang,ZHANG Zhihao,BI Sisheng,LING Chunhui,WEI Ye,YAN Pan,WANG Huatian,MA Fengyun,LIU Xiumei,TANG Jin,CHEN Shuying,CONG Guizhi. Magnetization enhances nitrogen metabolism and distribution in grape under nitrogen application[J]. Chinese Journal of Eco-Agriculture,2020,28(4):535-544.
[36]刘焕.不同施氮水平对冬小麦根系形态参数、光合特性、碳氮代谢酶活性及产量的影响[D].郑州:河南农业大学,2019.LIU Huan. Effects of different nitrogen application levels on root morphological parameters,photosynthetic characteristics,carbon and nitrogen metabolism enzyme activities and yield of winter wheat[D].Zhengzhou:Henan Agricultural University,2019.
[37]李金娜,姜丽娜,岳影,张雅雯,朱娅林,李春喜.灌溉方式和施氮量对冬小麦籽粒氮代谢酶和蛋白质产量的影响[J].麦类作物学报,2018,38(7):817-824.LI Jinna,JIANG Lina,QIU Ying,ZHANG Yawen,ZHU Yalin,LI Chunxi.Effects of irrigation and nitrogen application rates on grain nitrogen metabolism enzymes and protein production in winter wheat[J]. Journal of Triticeae Crops,2018,38(7):817-824.
[38]刘敏,李絮花,刘文博,杨柳,李金鑫.腐植酸对番茄苗期氮素代谢的影响[J].水土保持学报,2019,33(3):327-331.LIU Min,LI Xuhua,LIU Wenbo,YANG Liu,LI Jinxin. Effects of humic acid on nitrogen metabolism in tomato seedlings[J].Journal of Soil and Water Conservation,2019,33(3):327-331.
[39]GONZÁLEZ-MORO B,MENA-PETITE A,LACUESTA M,GONZÁLEZ-MURUA C,MUÑOZ-RUEDA A. Glutamine synthetase from mesophyll and bundle sheath maize cells:isoenzyme complements and different sensitivities to phosphinothricin[J].Plant Cell Reports,2000,19(11):1127-1134.