柑橘(Citrus reticulate Blanco)是世界水果业中最重要的大宗商品[1]。据FAO(2020)统计,全球共计138 个国家和地区进行柑橘商业栽培,面积约为667 万hm2,总产量1 亿多吨,约占世界水果总产的22%。中国作为柑橘的重要原产地之一,资源丰富,优良品种繁多,有4000 多年的栽培历史[2]。柑橘性喜温,营养生长期较长,对高温适应性较强,对低温反应极为敏感,最适的生长温度为26 ℃左右,在23~34 ℃范围间均适宜生长,温度降至12.8 ℃则停止生长[3-4]。因此,强冷空气过程中急剧的降温会对柑橘产生致命的危害,严重影响柑橘植株的生长发育、果实产量和品质。
光合作用是植物最基本的生理过程,光合特性是判断植物生长状况及品种间抗寒性强弱的重要指标[5]。Allen 等[6]研究表明,低温下植株叶绿体含量下降、类囊体电子传递受阻、光合器官(PSⅡ和PSⅠ)受损,进而导致光合作用受阻。叶绿素荧光是检测植物体光合器官受损的有效探针[7]。Fv/Fm是最重要的叶绿素荧光参数,反映植物光合色素把捕获的光能转化为化学能的速度和效率,Fv/Fm的变化可反映低温下PSⅡ受伤害的程度,植物PSⅡ受损越严重,Fv/Fm下降越明显[8]。吉春容等[9]研究表明,低温会导致枣树叶片PSⅡ光能转化效率(Fv/Fm)呈明显下降趋势。同时,低温还会导致植物细胞内的活性氧物质的积累过多,膜脂过氧化程度加大,这一结果已经在葡萄[10]、猕猴桃[11]和苹果[12]等果树上得到证实。植物为了抵御低温胁迫,会产生应激反应,通过体内抗氧化酶(CAT、POD和SOD)活性和渗透物质含量的变化等方面维持细胞结构及生理功能,抵抗恶劣气候条件[13]。但低温过程中,不同抗寒性品种之间的抗氧化酶活性的变化差异很大。杨再强等[14]研究发现,茶树叶片内POD活性在寒潮及恢复期间持续增强。刘兴禄等[15]对苹果枝条进行低温胁迫后,发现SOD和POD酶的活性呈现先上升后降低的趋势,抗氧化酶活性变化与品种间的抗寒性存在明显的相关性。
目前,关于低温对柑橘植株光合特性和抗氧化酶活性影响的研究多集中在人工气候箱的模拟试验,尚未见自然降温过程对柑橘植株生理影响的报道,更鲜有通过生理指标综合评价柑橘品种间的抗寒性。笔者在本研究中通过测定江西3 个地方主栽柑橘品种在一次冷空气过程中植株叶绿素含量、光合参数、荧光参数、抗氧化酶活性和活性氧物质含量的变化,采用主成分分析法对其进行抗寒性综合评价,以期为柑橘品种的适宜种植区域划分提供科学依据。
1 材料和方法
1.1 强冷空气的划分依据
强冷空气的划分依据采用《冷空气等级》国家标准(GB/T 20484—2017),依据此标准,采用受冷空气影响的某地一定时段内日最低气温下降幅度和日最低气温值两个指标,将冷空气划分为弱冷空气、较强冷空气、强冷空气和寒潮4 个等级。其中,强冷空气划分标准是日最低气温48 h 内降温幅度大于或等于8 ℃,且使该地日最低气温下降到8 ℃或以下。日最低气温是指观测的前一日14:00 后至当日14:00 之间的气温最低值;48 h 内降温幅度是指某日14:00 以后48 h 内最低气温与该日日最低气温之差。
1.2 试验设计
本试验于2021 年12 月23 日—2021 年12 月30日在江西省农业科学院横岗基地进行,以5 年生柑橘品种南丰蜜橘(C.reticulata‘Nanfengmiju’)、金沙柚(C.grandis‘Jinshayou’)和纽荷尔脐橙(C.sinensis‘Newhall Navel Orange’)为试验材料。果树行距为4 m,株距为3 m,主干明显,果树间彼此孤立,无相互遮挡,行间光照条件良好。果园内土壤为壤土,土壤pH 值6.2,土壤有效氮、有效磷和速效钾含量(w,后同)分别为84、37 和123 mg·kg-1。选取长势整齐一致、生长健壮、无病虫害的果树,采样时选取东、南、西、北4个方位当年春梢上从上向下第5~8枚叶,每个品种选3个样株,同一品种采取的测定叶片混合,做混样测定。测定时间间隔是2 d,测定指标参数分别是叶绿素含量、光合特性、荧光动力参数、活性氧物质和抗氧化酶活性,各指标测定均3个重复。表1是各品种树体的基本参数。
表1 3 个柑橘品种树体的基本参数
Table 1 Basic parameters of three citrus species

注:每个值代表3 次重复的(平均值±标准差)。通过邓肯检验,不同小写字母表示差异显著(p <0.05)。下同。
Note:Each value represents (the mean ± standard error) of three replicates. Different small letters represent significant differences at p <0.05 by Duncan’s test.The same below.
品种Varieties南丰蜜橘C.reticulata‘Nanfengmiju’金沙柚C.grandis‘Jinshayou’纽荷尔脐橙C.sinensis‘Newhall Navel Orange’叶面积指数Leaf area index 2.78±0.12 b 2.65±0.08 b 3.16±0.09 a平均冠幅Average crown width/cm 275.64±8.33 a 277.35±5.78 a 269.71±6.49 a平均主干高度Average trunk height/cm 73.33±2.11 a 70.47±3.27 b 75.62±2.10 a平均主干直径Average trunk diameter/cm 21.21±2.22 a 19.83±1.37 a 22.12±2.43 a
1.3 生理参数的测定
1.3.1 气象数据的采集 果园的气象数据由便携式自动气象站(CR3000,Campbell Scientific)采集,选取2021年12月23日—2021年12月30日,采集的参数分别是空气温度(℃)、光照度(μmol·m-2·s-1)、相对湿度(%)和风速(m·s-1)。采集频率1次·10 s-1,存储每30 min的平均值。
1.3.2 叶绿素、类胡萝卜素含量的测定 称取新鲜叶片,去除粗大叶脉并剪碎,称取0.1 g 放入预冷的研钵中,研钵中加入5 mL 80%的预冷丙酮,少许石英砂和碳酸钙,研磨至匀浆,随即将匀浆转入离心管,并用适量丙酮洗涤研钵,一并转入离心管,用丙酮定容至10 mL,用锡箔纸封口并置于温室黑暗中浸提。采用紫外分光光度计(UV-1800,日本岛津)分别测定663、645 和652 nm 波长下提取液的吸光值,并计算叶绿素a(Chla)、叶绿素b(Chlb)和类胡萝卜素(Car)的含量[16]。
1.3.3 光合参数的测定 使用便携式光合作用测定系统(LI-6400XT,LI-COR)在9:00—11:00测定3种柑橘光响应曲线,测量时叶室的温度设置为25 ℃,CO2浓度维持在(390±10)μmol·mol-1,光照度为1200、1000、800、400、200、150、80、50、30和0 μmol·m-2·s-1等10个梯度[17],根据叶子飘模型模拟得到光响应曲线特征参数,即最大光合速率(Pmax)、表观量子效率(AQY)、光饱和点(LSP)和光补偿点(LCP)。
1.3.4 叶绿素荧光参数的测定 使用便携式调制叶绿素荧光仪(PAM-2500,WALZ,Germany)在9:00—11:00 测定3 种柑橘叶片叶绿素荧光参数。所用的叶片和测定光响应曲线的叶片一致,测量前柑橘叶片暗适应20 min(用仪器自带叶夹),然后测定叶绿素荧光参数,仪器自动记录PSⅡ的最大光化学效率(Fv/Fm)和非光化学淬灭系数(NPQ)等参数。
1.3.5 丙二醛(MDA)和过氧化氢(H2O2)含量的测定 MDA 含量根据Hodges等[18]的方法测定。将叶组织(0.1 g)在1 mL的0.1%(φ)三氯乙酸中匀浆,该三氯乙酸含有1%(ρ)聚乙烯吡咯烷酮(PVP)和0.5%(φ)丁基化羟基甲苯。上清液与20%硫代巴比妥酸反应,然后使用紫外分光光度计在440、532和600 nm处读取上清液的吸光度值。
H2O2含量使用Ansari等[19]的方法测定。叶组织(0.2 g)在5 mL 50 mmol·L-1磷酸钠缓冲液(pH=6.5)中匀浆。上清液(3 mL)与1 mL 0.1%(ρ)硫酸钛或20%(φ)H2SO4混合,并以4000×g离心25 min。用紫外分光光度计(Cary50ConcUV-VIS,Varian,Victoria,Australia)在410 nm处记录上清液的吸光度值。
1.3.6 抗氧化酶活性的测定 酶溶液的提取使用Xu 等[16]的方法并稍作修改。将2 g 叶样品在冰浴中与10 mL 磷酸盐缓冲液(pH=7.8)研磨,并在4 ℃下以4000×g 离心25 min。用磷酸盐缓冲液(pH=7.8)将上清液稀释至终体积35 mL,用于测定抗氧化酶的活性。其中过氧化物酶(POD;EC1.11.1.7)活性采用愈创木酚显色法测定,超氧化物歧化酶(SOD;EC1.15.1.1)活性采用硝基四唑(NBT)方法测定。
1.4 数据的分析
使用SPSS 17.0(SPSS,Chicago.IL,USA)进行数据分析,利用Duncan检验法进行多重比较和差异显著性检验(α=0.05)。文中所有图形均使用Excel(Microsoft Office Software,2010,USA)绘制。数据以[平均值±标准差(SD)]来表示,每个重复3个样本。
2 结果与分析
2.1 强冷空气过程中温度的变化情况
强冷空气过程中日平均、最低和最高气温的变化情况如图1所示。12月24日与12月26日的日最低气温分别是7.2 ℃和-1.5 ℃,日最低气温48 h 内降温幅度≥8 ℃,且使该地日最低气温下降到8 ℃或以下,因此判断此为一次强冷空气过程。随后至12 月30 日,气温明显升高,12 月27 日以后,认为是此次强冷空气过程的恢复期。日最高气温在12 月24—26 日期间持续下降,26 日均达到最小值,为1.6 ℃,而后逐渐升高。日最低气温的变化趋势与日最高气温的变化趋势基本一致。
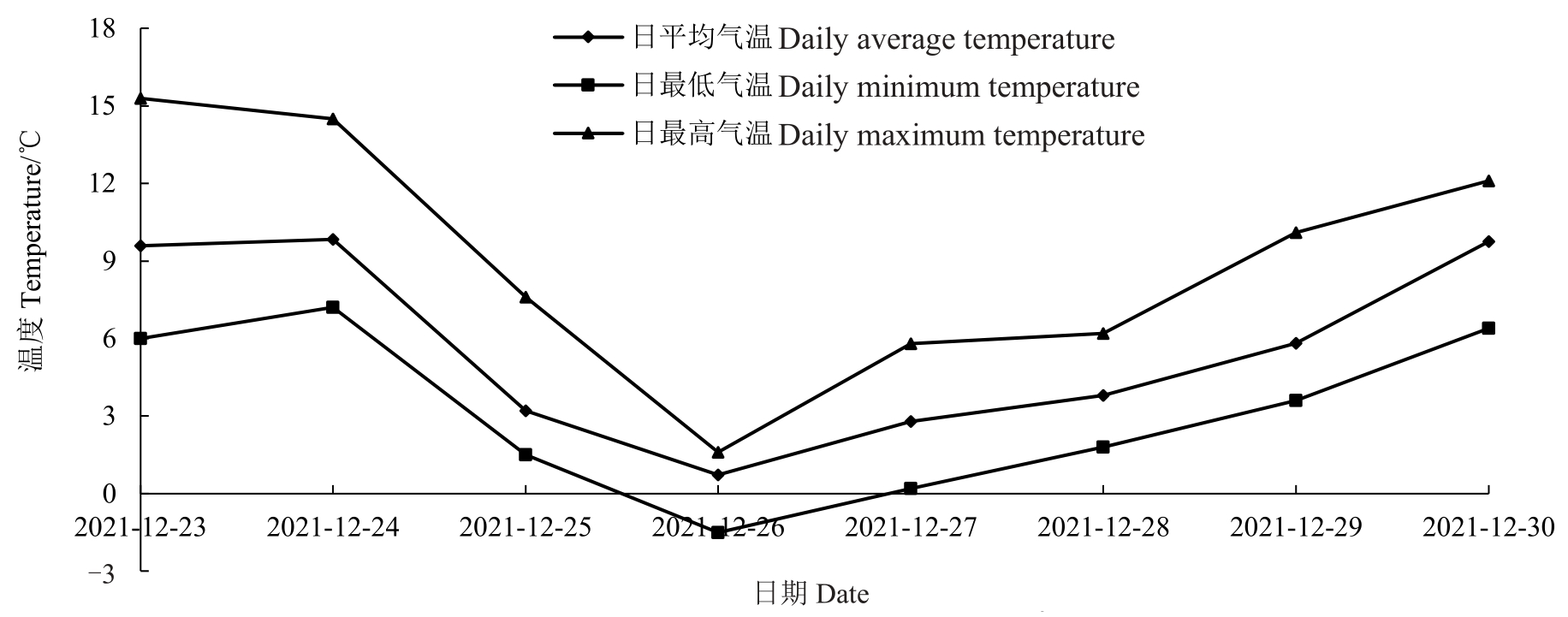
图1 强冷空气期间日平均、最低和最高气温的变化情况
Fig.1 Variation of daily average,minimum and maximum air temperatures during the occurrence of strong cold air flow
2.2 强冷空气对柑橘叶片叶绿素含量的影响
强冷空气期间,柑橘树叶片中Chla、Chlb 和Car 含量的变化如表2 所示。本次强冷气过程中,3 种柑橘叶片中叶绿素含量变化较大,但变化趋势相对一致,12 月24—26 日,Chla 和Chlb 含量逐渐降低,12 月26 日以后Chla 和Chlb 含量缓慢上升。12 月30 日试验结束时,3 种柑橘Chla 含量较初始时略低,差异不显著,但Chlb 含量下降幅度稍大,差异较显著,Chlb 含量分别下降了11.76%(南丰蜜橘)、11.29%(金沙柚)、12.06%(纽荷尔脐橙),显然,本次强冷空气过程对Chlb 含量影响较大。Car含量的变化因柑橘品种而异,具体表现是随着强冷气过程的推进,3 种柑橘品种Car 含量均有所增加,在12 月30 日3 种柑橘叶片中Car 含量均显著高于初始值。
表2 强冷空气对柑橘叶片叶绿素含量的影响
Table 2 Effect of strong cold air flow on chlorophyll content in citrus leaves
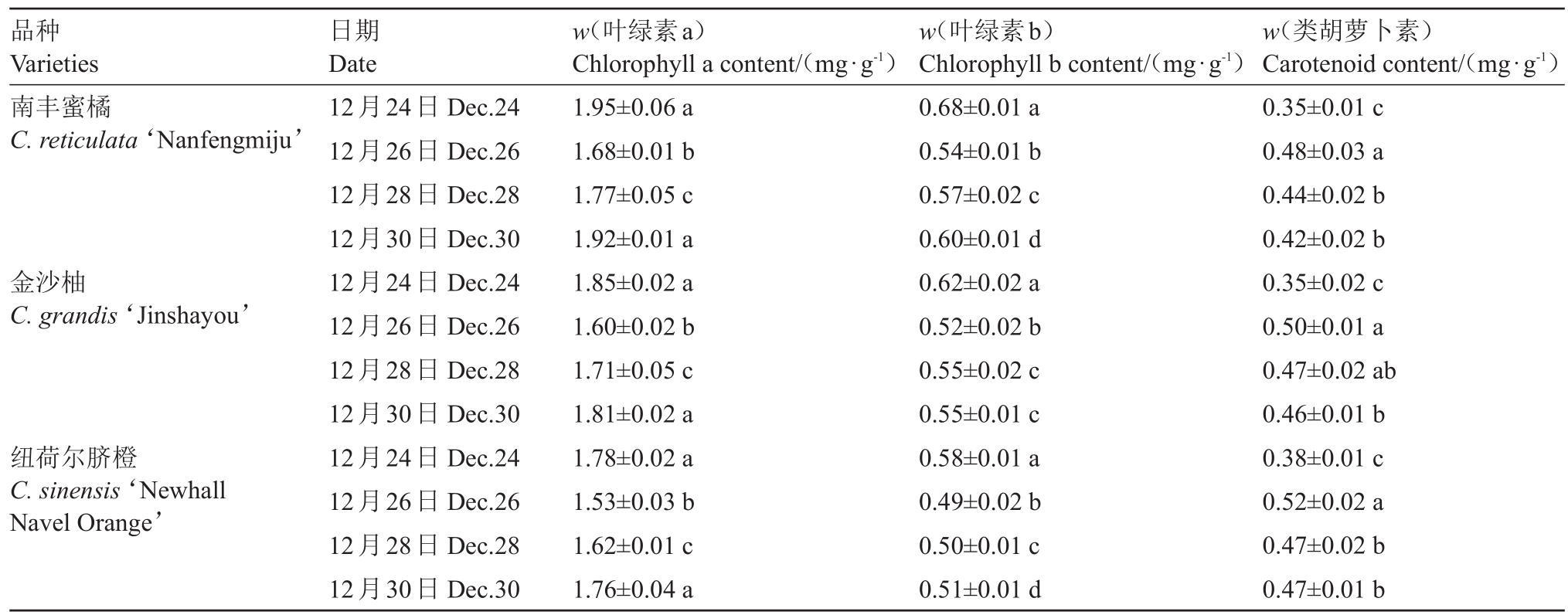
注:不同小写字母表示同一品种不同时间差异显著(邓肯检验,p <0.05)。下同。
Note:Different small letters indicate significant difference among different time of the same variety by Duncan’s test(p <0.05).The same below.
品种Varieties南丰蜜橘C.reticulata‘Nanfengmiju’金沙柚C.grandis‘Jinshayou’纽荷尔脐橙C.sinensis‘Newhall Navel Orange’w(类胡萝卜素)Carotenoid content/(mg·g-1)0.35±0.01 c 0.48±0.03 a 0.44±0.02 b 0.42±0.02 b 0.35±0.02 c 0.50±0.01 a 0.47±0.02 ab 0.46±0.01 b 0.38±0.01 c 0.52±0.02 a 0.47±0.02 b 0.47±0.01 b日期Date 12月24日Dec.24 12月26日Dec.26 12月28日Dec.28 12月30日Dec.30 12月24日Dec.24 12月26日Dec.26 12月28日Dec.28 12月30日Dec.30 12月24日Dec.24 12月26日Dec.26 12月28日Dec.28 12月30日Dec.30 w(叶绿素a)Chlorophyll a content/(mg·g-1)1.95±0.06 a 1.68±0.01 b 1.77±0.05 c 1.92±0.01 a 1.85±0.02 a 1.60±0.02 b 1.71±0.05 c 1.81±0.02 a 1.78±0.02 a 1.53±0.03 b 1.62±0.01 c 1.76±0.04 a w(叶绿素b)Chlorophyll b content/(mg·g-1)0.68±0.01 a 0.54±0.01 b 0.57±0.02 c 0.60±0.01 d 0.62±0.02 a 0.52±0.02 b 0.55±0.02 c 0.55±0.01 c 0.58±0.01 a 0.49±0.02 b 0.50±0.01 c 0.51±0.01 d
2.3 强冷空气对柑橘叶片光合参数的影响
强冷空气期间,3 个柑橘品种叶片最大光合速率(Pmax)、表光量子效率(AQE)、光饱和点(LSP)和光补偿点(LCP)的变化如表3 所示。Pmax是光达到饱和时的光合速率,反映了植物叶片的光合潜能。随着强冷空气过程的持续,3 种柑橘叶片的Pmax均呈下降趋势,在12 月26 日降到最小值,随后3 种柑橘的Pmax开始缓慢上升;AQY代表的是光能转化效率,强冷空气过程中,3 个柑橘品种AQE 的变化规律类似,从12 月24 日至12 月30 日,AQE 为先降低后上升的变化趋势,12 月26 日降到最低,此日南丰蜜橘、金沙柚和纽荷尔脐橙的AQE 较12 月24 日分别下降了14.63%、21.05%和19.44%;3 个柑橘品种的LCP 点随着冷空气过程的延续先升高后降低,在12 月26 日均达到最高,而LSP 的变化趋势则与LCP 相反。
表3 强冷空气对柑橘叶片光合参数的影响
Table 3 Effect of strong cold air flow on photosynthetic parameters in citrus leaves
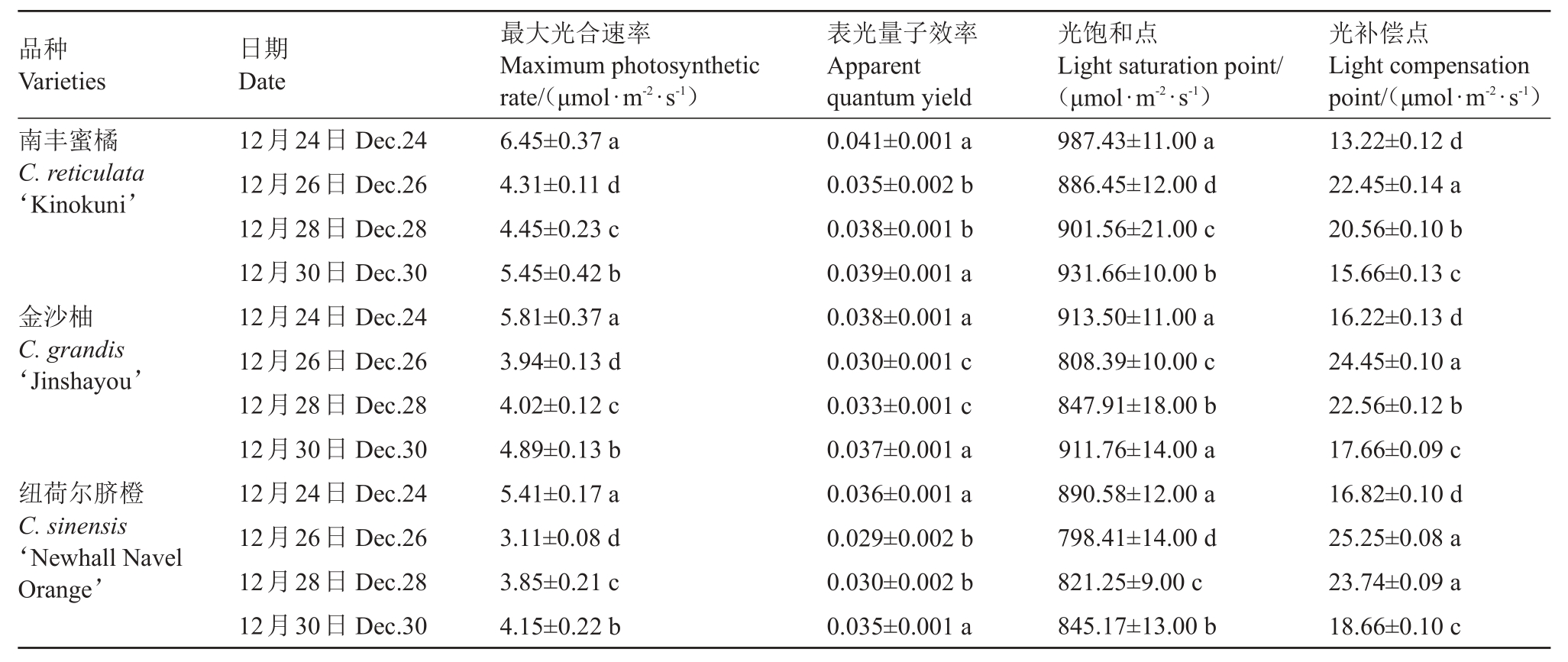
品种Varieties日期Date最大光合速率Maximum photosynthetic rate/(μmol·m-2·s-1)表光量子效率Apparent quantum yield光饱和点Light saturation point/(μmol·m-2·s-1)光补偿点Light compensation point/(μmol·m-2·s-1)南丰蜜橘C.reticulata‘Kinokuni’金沙柚C.grandis‘Jinshayou’纽荷尔脐橙C.sinensis‘Newhall Navel Orange’12月24日Dec.24 12月26日Dec.26 12月28日Dec.28 12月30日Dec.30 12月24日Dec.24 12月26日Dec.26 12月28日Dec.28 12月30日Dec.30 12月24日Dec.24 12月26日Dec.26 12月28日Dec.28 12月30日Dec.30 6.45±0.37 a 4.31±0.11 d 4.45±0.23 c 5.45±0.42 b 5.81±0.37 a 3.94±0.13 d 4.02±0.12 c 4.89±0.13 b 5.41±0.17 a 3.11±0.08 d 3.85±0.21 c 4.15±0.22 b 0.041±0.001 a 0.035±0.002 b 0.038±0.001 b 0.039±0.001 a 0.038±0.001 a 0.030±0.001 c 0.033±0.001 c 0.037±0.001 a 0.036±0.001 a 0.029±0.002 b 0.030±0.002 b 0.035±0.001 a 987.43±11.00 a 886.45±12.00 d 901.56±21.00 c 931.66±10.00 b 913.50±11.00 a 808.39±10.00 c 847.91±18.00 b 911.76±14.00 a 890.58±12.00 a 798.41±14.00 d 821.25±9.00 c 845.17±13.00 b 13.22±0.12 d 22.45±0.14 a 20.56±0.10 b 15.66±0.13 c 16.22±0.13 d 24.45±0.10 a 22.56±0.12 b 17.66±0.09 c 16.82±0.10 d 25.25±0.08 a 23.74±0.09 a 18.66±0.10 c
2.4 强冷空气对柑橘叶片叶绿素荧光参数的影响
强冷空气过程中,3 种柑橘品种叶片叶绿素荧光参数的变化如图2所示。3种柑橘品种的Fv/Fm在12 月24 日至12 月30 日呈现先下降后上升的趋势,在12 月26 日最低,与12 月24 日相比分别下降了6.09%(南丰蜜橘)、11.11%(金沙柚)和14.81%(纽荷尔脐橙),12月24日以后呈现上升趋势,但是试验结束日Fv/Fm值仍低于初始日。3 种柑橘叶片的NPQ呈现与Fv/Fm相反的变化趋势,11 月24 日至26 日,NPQ 的值逐渐升高,11 月26 日较24 日分别升高了8%(南丰蜜橘)、11%(金沙柚)和14%(纽荷尔脐橙),随后逐渐减低,但是NPQ 的值在12 月30 日仍略高于24日。

图2 强冷空气对柑橘叶片叶绿素荧光参数的影响
Fig.2 Effect of strong cold air flow on chlorophyll fluorescence parameters in citrus leaves
2.5 强冷空气对柑橘叶片丙二醛和过氧化氢含量的影响
强冷空气期间,3 种柑橘叶片的丙二醛和过氧化氢含量的变化如图3 所示。MDA 是细胞膜脂过氧化程度的最终产物,其含量值越大表明植株叶片受损越严重。由图3 可知,3 种柑橘的MDA 含量的变化趋势基本一致,都是呈现先上升后下降的趋势,在12 月26 日最高,与12 月24 日相比分别上升了60.22%(南丰蜜橘)、75.11%(金沙柚)和74.24%(纽荷尔脐橙),12月26日以后呈现下降趋势,但是试验结束日MDA 值仍高于初始日。整个强冷空气过程中,纽荷尔脐橙的MDA 含量都是最高,金沙柚次之,南丰蜜橘最低。H2O2含量的变化趋势与MDA含量的变化趋势一致。11 月24 日至26 日,H2O2含量逐渐升高,11 月26 日较24 日分别升高了9.37%(南丰蜜橘)、11.59%(金沙柚)和11.11%(纽荷尔脐橙),随后逐渐减低,但是H2O2含量在12 月30 日仍略高于24日。
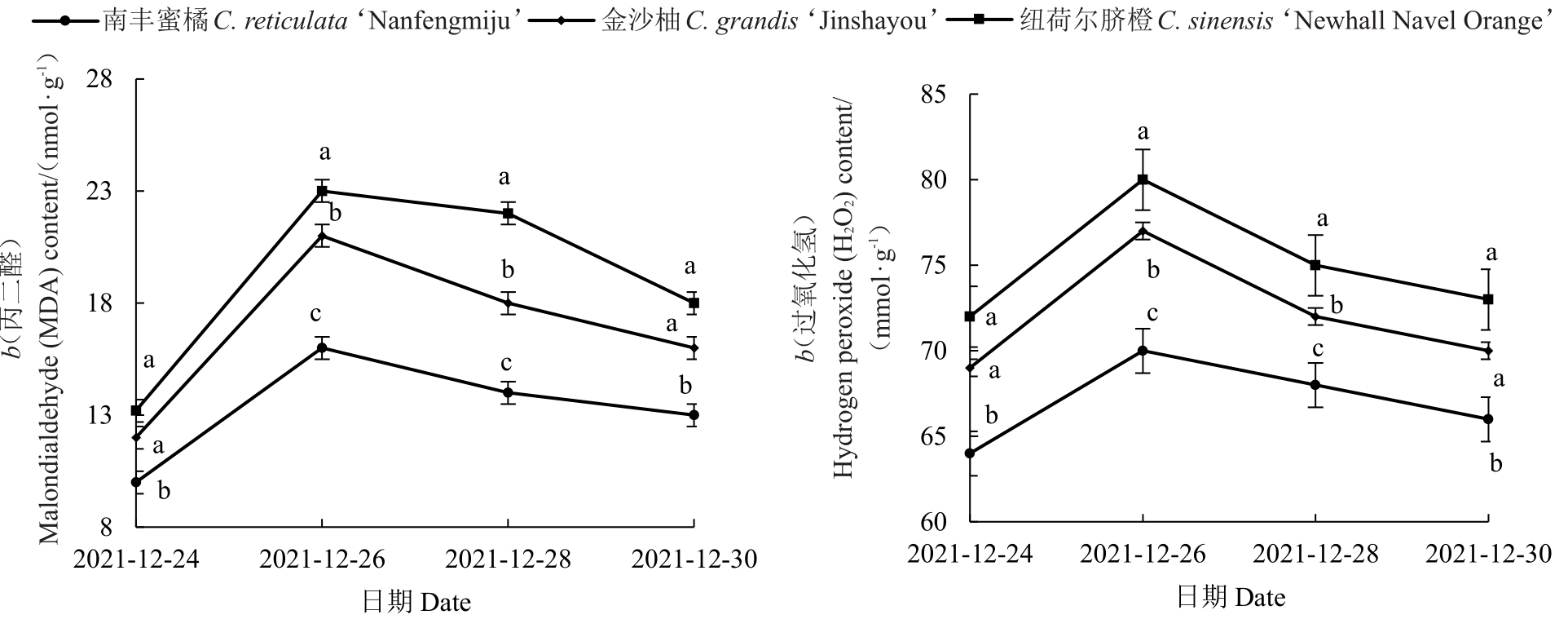
图3 强冷空气对柑橘叶片过氧化氢和丙二醛含量的影响
Fig.3 Effect of strong cold air flow on H2O2 and MDA content in citrus leaves
2.6 强冷空气对柑橘叶片抗氧化酶活性的影响
强冷空气期间,3种柑橘叶片POD和SOD活性的变化如图4所示。抗氧化酶是植物体内广泛存在的保护性酶,在逆境条件下,它们与活体氧物质(ROS)发生反应,维持体内ROS清除和产生的动态平衡,保护细胞膜。POD可清除低温下产生的过多H2O2,减轻H2O2对细胞的损害。由图4 可知,3 种柑橘品种的POD活性变化的趋势基本一致,都是呈现先上升后下降的趋势,在12月26日最高,与12月24日相比分别上升了34.29%(南丰蜜橘)、30.77%(金沙柚)和39.02%(纽荷尔脐橙),12月26日以后呈现下降趋势,但是试验结束日POD 活性仍高于初始日。SOD 活性变化趋势与POD 活性一致。11 月24日至26日,SOD活性逐渐升高,11月26日较24日分别升高了33.33%(南丰蜜橘)、30.30%(金沙柚)和40.63%(纽荷尔脐橙),随后逐渐降低,但是SOD 活性在12 月30 日仍略高于24 日。在整个强冷空气过程中,纽荷尔脐橙的POD 和SOD 活性都是最高,金沙柚次之,南丰蜜橘最低。
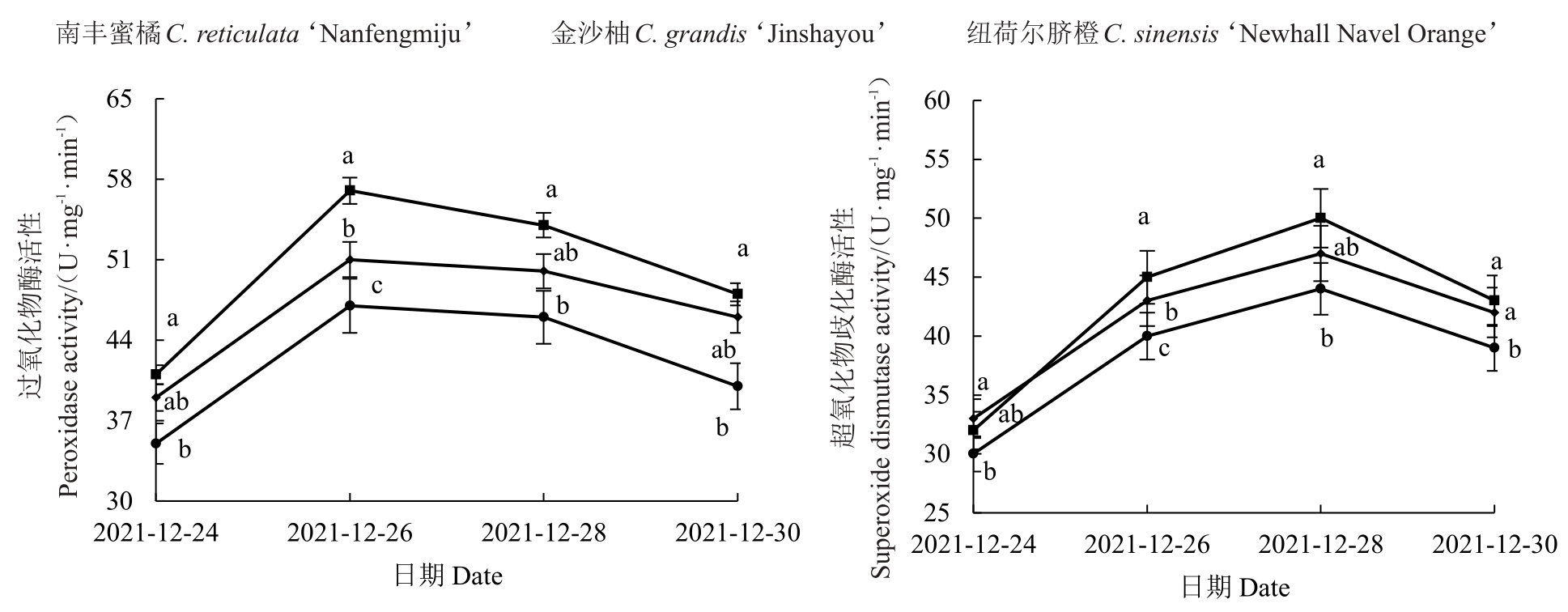
图4 强冷空气对柑橘叶片保护酶活性的影响
Fig.4 Effect of strong cold air flow on protective enzyme activity in citrus leaves
2.7 柑橘品种间抗寒性的综合评价
对3 个柑橘品种叶片的生理生化指标进行主成分分析,得到主成分特征值(表4)和主成分初始因子载荷矩阵(表5)。由表4可知,前2个主成分的累计贡献率达到90.731%,即反映了所测的13个指标的绝大部分信息,因此提取前2个主成分来综合分析比较3个柑橘品种的抗寒性强弱。由表5可知,主成分1主要包含Pmax、AQE、LSP、LCP、Fv/Fm、NPQ、H2O2含量及POD、SOD 活性9 个变量的信息。主成分2 主要包含Chla、Chlb和Car含量3个变量的信息。
表4 主成分特征值
Table 4 Component eigenvalue
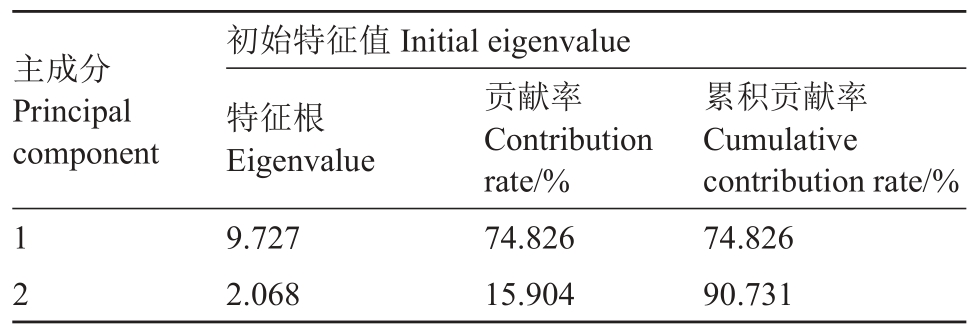
主成分Principal component 1 2初始特征值Initial eigenvalue特征根Eigenvalue 9.727 2.068贡献率Contribution rate/%74.826 15.904累积贡献率Cumulative contribution rate/%74.826 90.731
表5 主成分初始因子荷载矩阵
Table 5 Primary factor load matrix of principal component
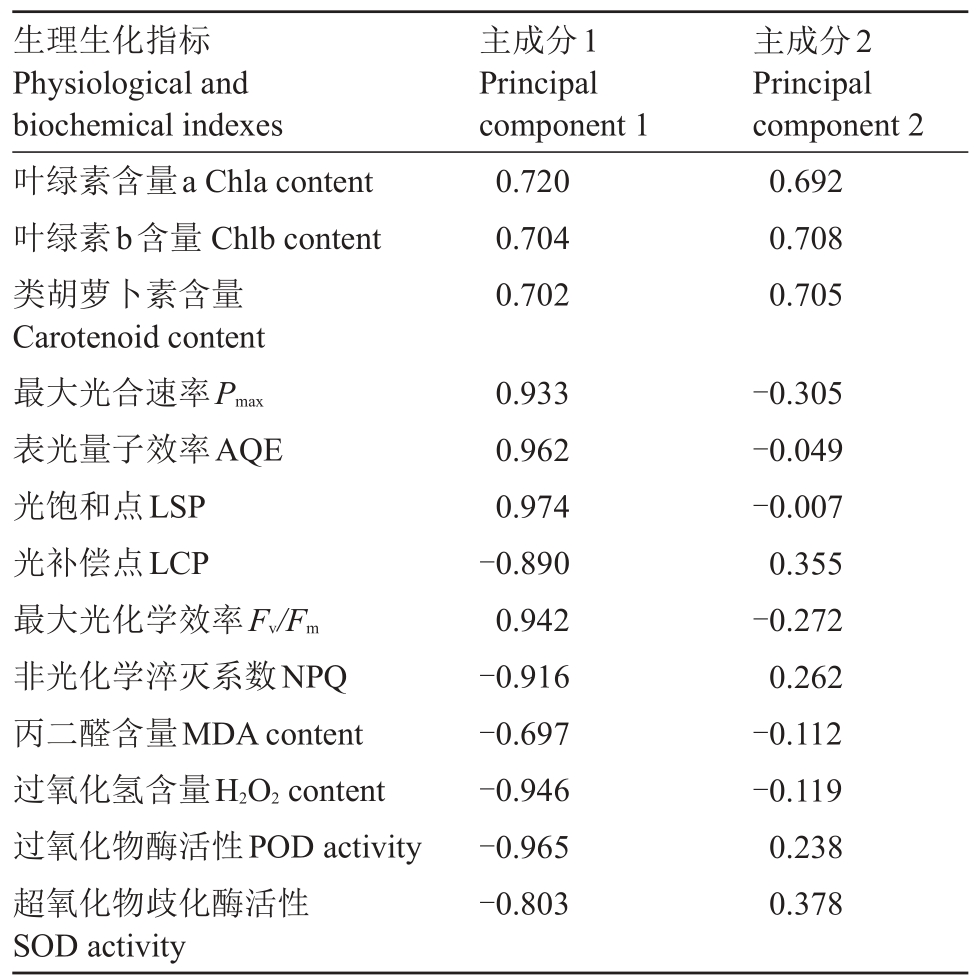
生理生化指标Physiological and biochemical indexes叶绿素含量a Chla content叶绿素b含量Chlb content类胡萝卜素含量Carotenoid content最大光合速率Pmax表光量子效率AQE光饱和点LSP光补偿点LCP最大光化学效率Fv/Fm非光化学淬灭系数NPQ丙二醛含量MDA content过氧化氢含量H2O2 content过氧化物酶活性POD activity超氧化物歧化酶活性SOD activity 0.720 0.704 0.702 0.692 0.708 0.705 0.933 0.962 0.974-0.890 0.942-0.916-0.697-0.946-0.965-0.803-0.305-0.049-0.007 0.355-0.272 0.262-0.112-0.119 0.238 0.378主成分1 Principal component 1主成分2 Principal component 2
根据特征值与初始因子载荷矩阵计算特征向量,由主成分的特征向量乘以相应的主成分得分计算出每个柑橘品种的综合得分,得分越高即表示抗寒力越强。因此,3 个柑橘品种品种抗寒性的强弱顺序为南丰蜜橘>金沙柚>纽荷尔脐橙(表6)。
表6 3 种柑橘的抗寒性得分
Table 6 The cold resistance scores of three citrus species
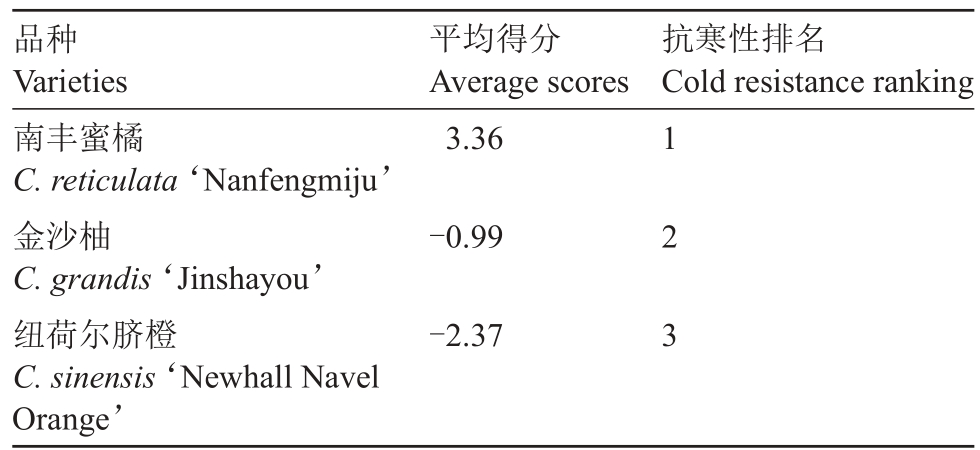
品种Varieties南丰蜜橘C.reticulata‘Nanfengmiju’金沙柚C.grandis‘Jinshayou’纽荷尔脐橙C.sinensis‘Newhall Navel Orange’平均得分Average scores 3.36抗寒性排名Cold resistance ranking-0.99-2.37 1 2 3
3 讨 论
叶绿素是植物体内重要的光合色素[20]。研究表明3个柑橘品种的叶绿素含量随着温度的降低而降低,随着温度的回升而增加。先前的研究认为低温破坏叶绿体结构和功能,抑制合成叶绿素关键酶的活性,这种伤害在恢复正常生长后可以得到补偿,但也有人认为低温加速了叶绿素的分解,同时阻碍叶绿素合成原料的产生,从而使叶绿素含量降低,这种伤害在后期得不到补偿[21-22]。在整个冷空气过程中Car 与叶绿素(Chl)含量的变化趋势相反,Chl 含量与Pmax的变化一致,这与前人[14]结果一致。此次强冷空气过程中,3 个柑橘品种的Pmax和AQY 随着气温的降低而下降,随着气温的回升而上升,表明低温造成了光合器官的损伤,使得光合作用强度下降,同时影响光合电子链能量的传递以及光合酶的活性[8]。笔者前期的研究也表明,低温导致Chlb 含量降低,而Chlb含量又与植物光能捕获能力有关,进而导致CO2的固定速率降低,从而造成AQY值的下降[16,23]。
叶绿素荧光是研究环境胁迫对植物体光系统结构和功能影响的有效探针[24]。Fv/Fm是PSⅡ最大光化学量子产量,反映PSⅡ反应中心的光能转换效率,非胁迫条件下该参数的值相对稳定,胁迫条件下该参数明显下降[25]。本研究表明,在整个强冷空气过程中,3 个柑橘品种的Fv/Fm值随着气温的降低持续降低,该结果与张旭等[26]、范宗民等[27]的研究结果一致。同时研究还发现3种柑橘叶片的NPQ值随温度的降低而升高,表明此时柑橘PSⅡ反应中心天线色素吸收的光能不能用于光合电子传递,而以热的形式耗散掉多余的那部分光能,对植物光合机构免受破坏起到保护作用[28]。笔者在本研究中发现南丰蜜橘在该次强冷气过程中NPQ 的变化幅度远低于纽荷尔脐橙和金沙柚,表明其耗散掉多余的光能来维持自身的光合机构不受破坏,保护光合器官功能的正常运行。
活性氧(ROS)是植物体内氧气正常代谢的副产物,在细胞信号传导和体内平衡中具有重要作用[29]。正常情况下,植物中ROS 的产生和清除之间存在良好的平衡。但当植物体经受低温胁迫时,植物自身细胞氧化应激反应,产生过量ROS,反过来引起细胞膜脂过氧化、色素变色、蛋白质失活、DNA损伤,最终导致细胞死亡[30]。本研究表明3 种柑橘的H2O2的含量在温度降低过程中呈现上升趋势,这表明低温致使柑橘植株产生了氧化应激反应,产生过多的活性氧物质。抗氧化酶是植物体广泛存在的物质,具有将体内形成过氧化物转换为毒害较低或无害的物质的功能[31]。在本研究中笔者发现3种柑橘在整个冷空气过程中,POD和SOD活性呈现先上升后下降的趋势,说明柑橘在降温期间产生过多的抗氧化酶来清除体内过多的ROS,当温度回升、植物体内ROS 含量降低时,POD 和SOD 活性降低以保持体内ROS 含量产生和清除的动态平衡。MDA是植物体细胞膜脂过氧化的最终产物之一,直接反映细胞膜受损害的程度[31]。在本研究中笔者发现3种柑橘体内的MDA 含量随着温度的降低而升高,这是因为低温导致植物体内过多的自由基与细胞膜脂质发生过氧化反应,导致MDA的过度积累,进而引起细胞膜上蛋白质、核酸、脂类和糖类等有机物高分子的交联聚合,阻碍细胞膜物质的运输,使细胞膜的正常功能受阻[32]。同时,笔者发现在整个冷空气过程中,南金沙柚和纽荷尔脐橙体内MDA 含量远高于南丰蜜橘,这说明此次冷空气过程对南丰蜜橘的细胞损害较轻。在温度恢复过程中,3 种柑橘MDA 含量有所下降,表明此时细胞受伤害程度有所缓解,说明此次强冷空气过程对3 种柑橘并未产生不可逆的损害。
4 结 论
3种柑橘植株叶片生理变化的主要原因是这次强冷气过程,通过对叶绿素含量、光合荧光特性、活性氧物质含量和抗氧化酶活性进行主成分分析,得到3 种柑橘的抗寒性排序依次为南丰蜜橘>金沙柚>纽荷尔脐橙。
[1]侯茹平,蒋景龙,阳妮,李丽,邓家锐,丁德宽,孙旺,董艳鑫.低温胁迫下8 种柑橘的生理响应与抗寒性评价[J].分子植物育种,2021,19(6):2013-2022.HOU Ruping,JIANG Jinglong,YANG Ni,LI Li,DENG Jiarui,DING Dekuan,SUN Wang,DONG Yanxin. Physiological response and cold resistance evaluation of eight species of Citrus under low temperature stress[J]. Molecular Plant Breeding,2021,19(6):2013-2022.
[2]彭抒昂,邓秀新.柑橘学[M].北京:中国农业出版社,2013.PENG Shu’ang,DENG Xiuxin.Citrus[M].Beijing:China Agricultural Press,2013.
[3]潘学军,李绍权.柑橘栽培技术[M].长沙:湖南科学技术出版社,2008.PAN Xuejun,LI Shaoquan. Citrus cultivation techniques[M].Changsha:Hunan Science and Technology Press,2008.
[4]黄寿波,温福光,陈尚谟.果树气象学[M].北京:气象出版社,1988.HUANG Shoubo,WEN Fuguang,CHEN Shangmo. Meteorology of fruit trees[M].Beijing:China Meteorological Press,1988.
[5]ASHRAF M,HARRIS P J. Photosynthesis under stressful environments:An overview[J]. Photosynthetica,2013,51(2):163-190.
[6]ALLEN D J,ORT D R.Impacts of chilling temperatures on photosynthesis in warm-climate plants[J]. Trends in Plant Science,2001,6(1):36-42.
[7]STRASSER R J,TSIMILLI-MICHAEL M,SRIVASTAVA A.Analysis of the chlorophyll a fluorescence transient[M].Switzerland:Springer,2004:321-362.
[8]ZAREEI E,KARAMI F,GHOLAMI M,ERSHADI A,AVESTAN S,ARYAL R,GOHARI R,FAROOQ M. Physiological and biochemical responses of strawberry crown and leaf tissues to freezing stress[J].BMC Plant Biology,2021,21(1):1-17.
[9]吉春容,刘海蓉,罗继,杨明凤,范金霞,邹陈.低温冻害过程中枣树枝条相关生理指标的变化[J]. 中国农业气象,2016,37(5):545-554.JI Chunrong,LIU Hairong,LUO Ji,YANG Mingfeng,FAN Jinxia,ZOU Chen. Changes of physiological indices of jujube branches under process of low temperature and freeze injury[J].Chinese Journal of Agrometeorology,2016,37(5):545-554.
[10]GU B,ZHANG B,DING L,LI P Y,SHEN L,ZHANG J X.Physiological change and transcriptome analysis of Chinese wild Vitis amurensis and Vitis vinifera in response to cold stress[J]. Plant Molecular Biology Reporter,2020,38(3):478-490.
[11]李化龙,王景红,张维敏,柏秦凤,潘宇鹰,张焘,权文婷,郭建平.模拟低温下主产品种猕猴桃结果母枝冻害指标[J].应用气象学报,2021,32(5):618-628.LI Hualong,WANG Jinghong,ZHANG Weimin,BAI Qinfeng,PAN Yuying,ZHANG Tao,QUAN Wenting,GUO Jianping.Freezing injury index of kiwifruit branches for main varieties under simulated low temperature[J]. Journal of Applied Meteorological Science,2021,32(5):618-628.
[12]WANG Y X,YA H U,CHEN B H,ZHU Y F,DAWUDA M M,SVETLA S. Physiological mechanisms of resistance to cold stress associated with 10 elite apple rootstocks[J]. Journal of Integrative Agriculture,2018,17(4):857-866.
[13]TARTOURA K A,YOUSSEF S A.Stimulation of ROS-scavenging systems in squash(Cucurbita pepo L.)plants by compost supplementation under normal and low temperature conditions[J].Scientia Horticulturae,2011,130(4):862-868.
[14]杨再强,韩冬,王学林,金志凤.寒潮过程中4 个茶树品种光合特性和保护酶活性变化及品种间差异[J].生态学报,2016,36(3):629-641.YANG Zaiqiang,HAN Dong,WANG Xuelin,JIN Zhifeng.Changes in photosynthetic parameters and antioxidant enzymatic activity of four tea varieties during a cold wave[J].Acta Ecologica Sinica,2016,36(3):629-641.
[15]刘兴禄,王红平,孙文泰,董铁,牛军强,马明.5 个砧木苹果枝条的抗寒性评价[J].果树学报,2021,38(8):1264-1274.LIU Xinglu,WANG Hongping,SUN Wentai,DONG Tie,NIU Junqiang,MA Ming. Cold resistance evaluation of the shoots of 5 apple rootstocks[J]. Journal of Fruit Science,2021,38(8):1264-1274.
[16]XU C,WANG M T,YANG Z Q,ZHENG Q T.Low temperature and low irradiation induced irreversible damage of strawberry seedlings[J].Photosynthetica,2020,58(1):156-164.
[17]史晓敏,刘竞择,张艳霞,陈祖民,郭帅奇,王振平.水分胁迫对‘赤霞珠’不同叶龄叶片光合特性的影响[J]. 果树学报,2021,38(1):50-63.SHI Xiaomin,LIU Jingze,ZHANG Yanxia,CHEN Zumin,GUO Shuaiqi,WANG Zhenping.Effects of water stress on photosynthetic characteristics of‘Cabernet Sauvignon’at different leaf ages[J].Journal of Fruit Science,2021,38(1):50-63.
[18]HODGES D M,DELONG J M,FORNEY C F,PRANGE R K.Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J]. Planta,1999,207(4):604-611.
[19]ANSARI W A,ATRI N,SINGH B,KUMAR P,PANDEY S.Morpho-physiological and biochemical responses of muskmelon genotypes to different degree of water deficit[J]. Photosynthetica,2018,56(4):1019-1030.
[20]MATILE P,HORTENSTEINER S,THOMAS H. Chlorophyll degradation[J]. Annual Review of Plant Biology,1999,50(1):67-95.
[21]KUAI B,CHEN J,HORTENSTEINER S.The biochemistry and molecular biology of chlorophyll breakdown[J]. Journal of Experimental Botany,2018,69(4):751-767.
[22]张立业,邱佳奇,王晓香,王鑫月,常飞杨,袁旭,张家安,刘洋,李寒,张雪梅.外源褪黑素对低温胁迫下红树莓叶片生理特性的影响[J].果树学报,2022,39(3):416-425.ZHANG Liye,QIU Jiaqi,WANG Xiaoxiang,WANG Xinyue,CHANG Feiyang,YUAN Xu,ZHANG Jia’an,LIU Yang,LI Han,ZHANG Xuemei.Effects of exogenous melatonin on physiological characteristics of leaves under low-temperature stress in red raspberry[J].Journal of Fruit Science,2022,39(3):416-425.
[23]XU C,YANG Z Q,ZHANG X R,ZHENG Q T,LI J J,HUANG H J,WANG L,WANG M T,ZOU Y J. Effects of low temperature on photosynthesis and antioxidant enzyme activities of Panax notoginseng during seeding stage[J]. International Journal of Agriculture and Biology,2019,21(6):1279-1286.
[24]许永安.低温胁迫对甜瓜幼苗光合能力及叶绿素荧光参数的影响[J].中国瓜菜,2020,33(2):22-26.XU Yong’an.Effects of low-temperature stress on photosynthetic capacity and chlorophyll fluorescence parameters in melon[J].China Cucurbits and Vegetables,2020,33(2):22-26.
[25]罗鑫辉,刘明月,黄科,刘玉兵,彭淼,王军伟.不同品种番茄幼苗低温适应性评价及光合特性分析[J]. 中国瓜菜,2021,34(8):49-55.LUO Xinhui,LIU Mingyue,HUANG Ke,LIU Yubing,PENG Miao,WANG Junwei.Evaluation of low temperature adaptability and analysis of photosynthetic characteristics in different tomato varieties[J]. China Cucurbits and Vegetables,2021,34(8):49-55.
[26]张旭,朱珍珍,孙鲁龙,李凤龙,韦德闯,朱佳顺,樊良栋,赵政阳.陇东地区不同矮化中间砧对‘长富2 号’苹果抗寒性的影响[J].果树学报,2020,37(7):985-996.ZHANG Xu,ZHU Zhenzhen,SUN Lulong,LI Fenglong,WEI Dechuang,ZHU Jiashun,FAN Liangdong,ZHAO Zhengyang.Effects of different dwarfing interstocks on cold resistance of‘Changfu 2’apple in Longdong area[J]. Journal of Fruit Science,2020,37(7):985-996.
[27]范宗民,孙军利,赵宝龙,刘怀锋,于坤,章智钧,刘晶晶.不同砧木‘赤霞珠’葡萄枝条抗寒性比较[J]. 果树学报,2020,37(2):215-225.FAN Zongmin ,SUN Junli,ZHAO Baolong,LIU Huaifeng,YU Kun,ZHANG Zhijun,LIU Jingjing. Evaluation of cold resistance of one-year shoots from‘Cabernet Sauvignon’grape vine grafted on different rootstocks[J]. Journal of Fruit Science,2020,37(2):215-225.
[28]MISHRA K B,MISHRA A,KUBASEK J,URBAN O,HEYER A G.Low temperature induced modulation of photosynthetic induction in non- acclimated and cold- acclimated Arabidopsis thaliana:Chlorophyll a fluorescence and gas-exchange measurements[J].Photosynthesis Research,2019,139(1):123-143.
[29]MITTLER R. ROS are good[J]. Trends in Plant Science,2017,22(1):11-19.
[30]TAVANTI T R,DE M A A R,MOREIRA L D K,SANCHEZ D E J,SANTOS S R D,SILVA R M,REIS A R.Micronutrient fertilization enhances ROS scavenging system for alleviation of abiotic stresses in plants[J].Plant Physiology and Biochemistry,2021,160:386-396.
[31]李冰,张敬敬,高秀瑞,史宇凡,潘秀清,武彦荣.低温胁迫下不同基因型西瓜抗寒性综合评价[J].中国瓜菜,2019,32(4):16-19.LI Bing,ZHANG Jingjing,GAO Xiurui,SHI Yufan,PAN Xiuqing,WU Yanrong. Comprehensive evaluation of cold resistance of different watermelon under low temperature stress[J].China Cucurbits and Vegetables,2019,32(4):16-19.
[32]刘育梅,金亮,宋志瑜,黄霏.5 种山榄科果树的耐寒性研究[J].果树学报,2019,36(2):195-202.LIU Yumei,JIN Liang,SONG Zhiyu,HUANG Fei.A study on cold resistance in five Sapotaceae fruit trees[J]. Journal of Fruit Science,2019,36(2):195-202.