菠萝[Ananas comosus(L.)Merr.]为凤梨科凤梨属多年生草本植物,是我国重要的热带果树,在中国福建、广东、广西、云南、海南、台湾等地均有大面积栽培[1]。据联合国粮农组织发布的统计数据,2020年我国菠萝种植面积9.96万hm2,总产量263.93万t,位居世界第三(FAO,2022)。广东是我国最大的菠萝种植区域[1],2020 年种植面积3.90 万hm2,总产量121.02万t。
氮是植物生长发育的必需元素,也是作物产量的限制因子。为保证作物产量,全球每年使用的氮肥超过1.1 亿t[2];然而,作物对氮肥的吸收利用率较低,仅为施用量的30%~50%,剩余氮肥流失到大气、深层土壤或水体中[3-4],造成能源浪费和环境污染[5]。菠萝也是需氮较多的作物,每形成1 kg 的菠萝果实需要吸收7.22 kg 的氮[6],但氮肥施用过多也会降低菠萝产量和果实品质[7-9]。
硝酸盐是大多数作物的主要氮源[10],其利用过程包括吸收、转运、同化和再转运,硝酸盐转运载体在其中起着重要作用[11]。植物中的硝酸盐转运载体包括3个基因家族,分别为NRT1/PTR(Nitrate transporters 1/Peptide transporters)基因家族、NRT2(Nitrate transporters 2)基因家族和NRT3/NAR2(Nitrate transporters 3/Nitrate Assimilation Related protein 2)基因家族[12]。菠萝全基因组测序结果表明,菠萝中有44个NRT1/PTR基因家族成员,3个NRT2基因家族成员和1个NRT3/NAR1基因家族成员[13],但它们在菠萝生长发育中的作用尚不清楚,这些基因家族成员对菠萝施氮后的响应变化及其在菠萝氮稳态维持中的作用还鲜有报道。对基因家族成员进行鉴定和表达分析,有助于明确在相应生理过程中发挥关键作用的基因成员[14]。笔者在本研究中结合氮肥施用和基因的荧光定量表达,对这些基因在菠萝氮肥吸收与利用中的作用进行了深入分析,以期为菠萝栽培氮精准施用和氮高效育种提供参考。
1 材料和方法
1.1 植物材料
试验材料为移栽至育苗基质中生长3个月后的菠萝组培苗,品种为金菠萝,每盆1株种植于25 cm×25 cm的塑料花盆中。
1.2 试验设计
试验设5 个处理和1 个清水(蒸馏水)对照。处理前1个月停止施肥。5个处理分别为30 mmol·L-1的NH4NO3(Nn),60 mmol·L-1的NH4NO3(Nhn),含60 mmol·L-1 NH4NO3的MS营养液(Nhm),不含氮源的MS 营养液(Nd),MS 营养液(Nm)。选择生长基本一致的盆栽菠萝苗,每株施用50 mL 处理溶液或清水(Nw)。每个处理5 株,3 次重复。处理后的0、3、6、9 和26 d 的10:00 采集菠萝植株的D 叶用于RNA 提取及硝态氮含量测定;60 d 后取全株,分别测定根、茎和叶的鲜质量及干质量。
为揭示硝酸盐吸收和相关基因表达的日变化模式,试验还设计了30 mmol·L-1的NH4NO3处理。选晴朗天气,10:00 开始处理,选择生长基本一致的盆栽菠萝苗,每株施用50 mL 处理溶液或清水(蒸馏水),每个处理5株,3次重复。处理后的0、2、4、6和8 h 分别采集菠萝植株的叶、茎及根系用于RNA 提取及硝态氮含量测定。
1.3 方法
1.3.1 干质量和鲜质量的测定 使用万分之一天平测定植株各组织的鲜质量;将各组织烘干至恒重后,用万分之一天平测定其干质量。
1.3.2 硝态氮含量的测定 硝态氮含量的测定采用水杨酸比色法[15]。精确称取2 g左右鲜样,加10 mL去离子水研磨后,沸水浴30 min。冷却后,过滤,取上清液定容后,使用5%水杨酸-浓硫酸试剂进行比色测定。
1.3.3 总RNA 提取及基因表达分析 RNA 的提取按照试剂盒(RNAiso plus,大连宝生物)的操作手册进行。采用PrimeScript(大连宝生物)试剂盒进行反转录反应,TB Green(大连宝生物)试剂盒进行基因表达水平的荧光法检测,反应程序为:95 ℃30 s;95 ℃5 s,40 cycles;60 ℃34 s;95 ℃15 s。基因表达引物参考Li等[13]的方法设计,各引物的扩增产物经回收、测序验证后再使用。
1.4 数据处理
基因的相对表达水平按照2-ΔΔCT法计算,参考Jin 等[16]的方法选用Alpha-tubulin 和Ubiquitin 为内参基因。使用Microsoft excel 2010计算平均值和标准误,使用SPSS statistics 24软件进行差异显著性分析,使用R软件绘制热图。
2 结果与分析
2.1 施氮对菠萝植株硝酸盐吸收与积累日变化的影响
施用30 mmol·L-1 NH4NO3后,菠萝植株硝酸盐积累的日变化见图1。从图1中可看出,菠萝植株的茎中含量较高的硝酸盐,可能是菠萝植株硝酸盐的储存库。未施氮时,菠萝植株的叶片、根和茎呈现类似的日变化模式,均在10:00 和16:00 有个峰值。施入硝态氮后,叶片硝酸盐含量在施氮后的6 h(16:00)低于对照,施氮后8 h(18:00)高于对照;根系硝酸盐含量在施氮后2 h(12:00)较对照有显著增加(p<0.01),施氮后6 h(16:00)根系硝酸盐含量较对照有显著减少(p=0.019 4);茎中硝酸盐含量在施氮后4 h(14:00)和8 h(18:00)显著低于对照(p<0.01)。

图1 30 mmol·L-1 NH4NO3处理与清水对照植株各组织硝酸盐含量的日变化
Fig.1 Diurnal changes of nitrate content in various tissues of plants treated with 30 mmol·L-1 NH4NO3 and water
leaf_tr、root_tr 和stem_tr 分别表示处理植株的叶、根和茎;leaf_ck、root_ck 和stem_ck 分别表示未处理植株的叶、根和茎。不同大写和小写字母分别表示在p<0.01 和p<0.05 水平上差异显著(LSD 法)。下同。
leaf_tr, root_tr and stem_tr indicated respectively leaf, root and stem of treated plantlet; leaf_ck, root_ck and stem_ck indicated respectively leaf,root and stem of untreated plantlet.Differemt uppercase and lowercase letters indicated respectively significant levels at p<0.01 and p<0.05 (LSD test).The same below.
2.2 不同施氮处理对菠萝植株各组织质量的影响
从表1 中可看出,菠萝植株各组织鲜质量与干质量的变化模式相似。清水处理的叶片质量、根质量和茎质量均最低,MS处理的叶片质量、根质量和茎质量最高。叶片鲜质量,MS 处理最高,其次为60 mmol·L-1氮和含60 mmol·L-1氮的MS处理,均与清水处理差异达到极显著水平;30 mmol·L-1氮和含0 mmol·L-1氮的MS 处理与清水差异未达到极显著水平。各处理间的根鲜质量和根干质量差异未达到显著水平。MS处理的茎鲜质量极显著高于其他处理,MS、60 mmol·L-1氮、含60 mmol·L-1氮的MS 和30 mmol·L-1氮处理的茎干质量均与清水处理的差异达到极显著水平,含0 mmol·L-1氮的MS处理与清水处理间无显著差异。
表1 6 种施氮处理对菠萝植株各组织质量的影响
Table 1 Effects of six nitrogen treatments on the weight of various tissues of pineapple plantlet
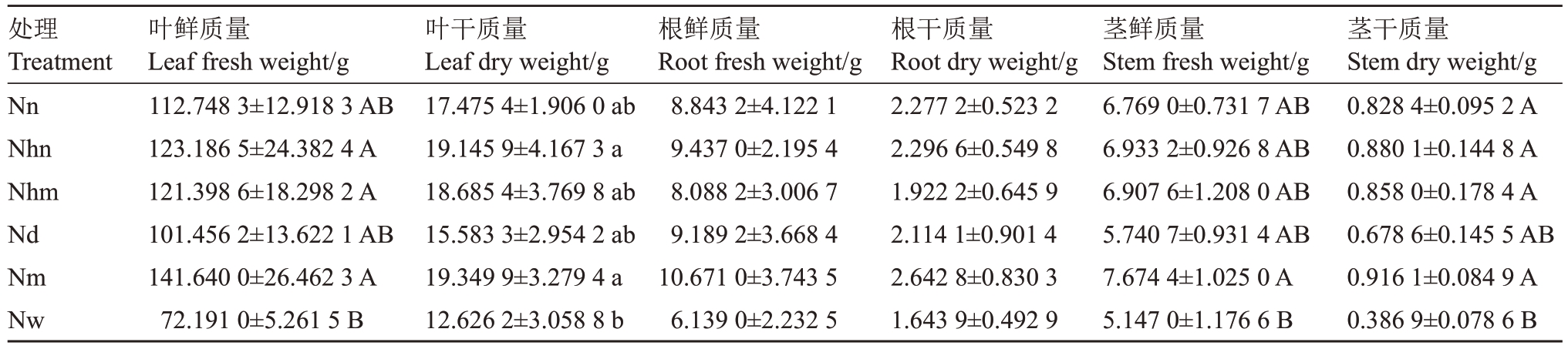
处理Treatment Nn Nhn Nhm Nd Nm Nw叶鲜质量Leaf fresh weight/g 112.748 3±12.918 3 AB 123.186 5±24.382 4 A 121.398 6±18.298 2 A 101.456 2±13.622 1 AB 141.640 0±26.462 3 A 72.191 0±5.261 5 B叶干质量Leaf dry weight/g 17.475 4±1.906 0 ab 19.145 9±4.167 3 a 18.685 4±3.769 8 ab 15.583 3±2.954 2 ab 19.349 9±3.279 4 a 12.626 2±3.058 8 b根鲜质量Root fresh weight/g 8.843 2±4.122 1 9.437 0±2.195 4 8.088 2±3.006 7 9.189 2±3.668 4 10.671 0±3.743 5 6.139 0±2.232 5根干质量Root dry weight/g 2.277 2±0.523 2 2.296 6±0.549 8 1.922 2±0.645 9 2.114 1±0.901 4 2.642 8±0.830 3 1.643 9±0.492 9茎鲜质量Stem fresh weight/g 6.769 0±0.731 7 AB 6.933 2±0.926 8 AB 6.907 6±1.208 0 AB 5.740 7±0.931 4 AB 7.674 4±1.025 0 A 5.147 0±1.176 6 B茎干质量Stem dry weight/g 0.828 4±0.095 2 A 0.880 1±0.144 8 A 0.858 0±0.178 4 A 0.678 6±0.145 5 AB 0.916 1±0.084 9 A 0.386 9±0.078 6 B
2.3 不同施氮处理对菠萝植株硝酸盐吸收与积累的长期影响
不同施氮处理下菠萝植株叶片硝酸盐含量的长期动态变化见图2。从图2 中可看出,施氮处理后第3 天,除清水处理的叶片硝酸盐含量下降外,其余各处理的叶片硝酸盐含量均较对照有大幅度增加,30 mmol·L-1氮、60 mmol·L-1氮处理的叶片硝酸盐含量最高,其次为含60 mmol·L-1氮的MS、MS和含0 mmol·L-1氮的MS。单纯氮处理可能促进了叶片硝态氮的积累,含氮MS 处理中的氮可能被吸收转化,无氮MS 处理中的氮可能来自氮库(如茎)的转运。
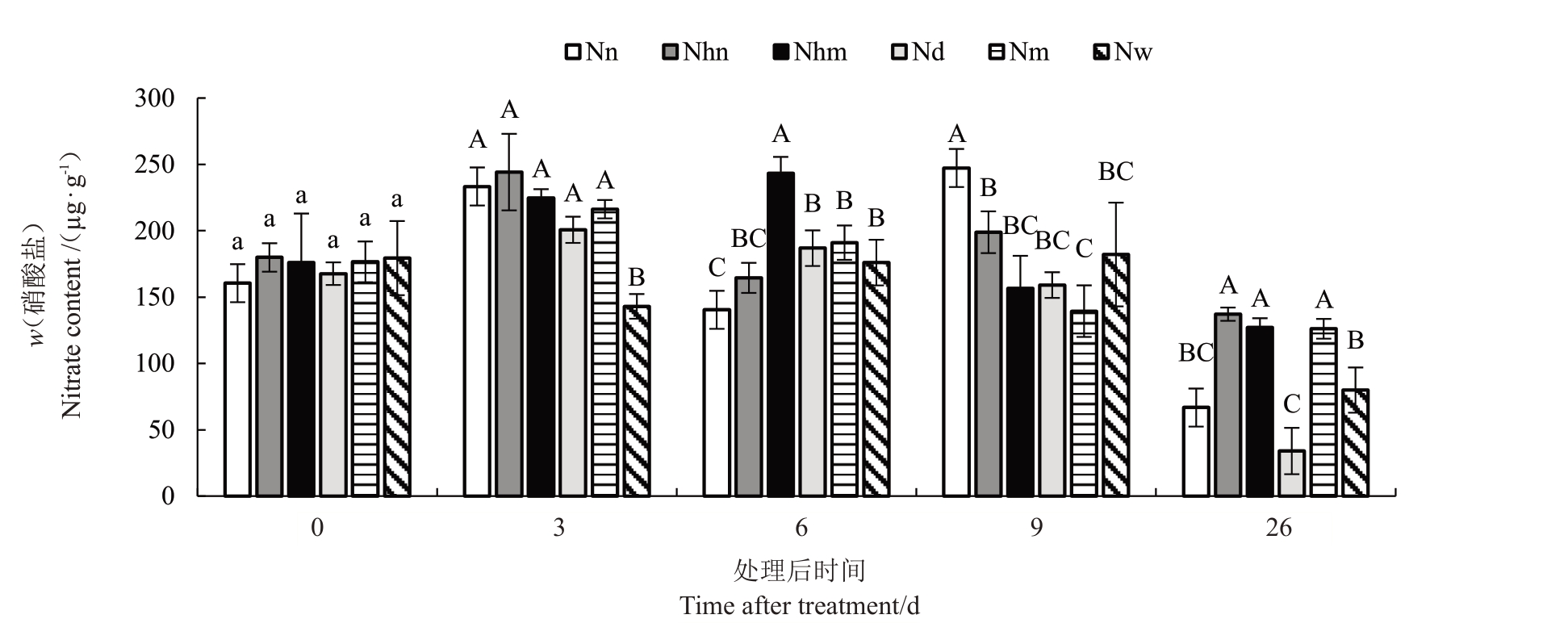
图2 6 种施氮处理下菠萝植株叶片硝酸盐含量的动态变化
Fig.2 Dynamic changes in leaf nitrate content of pineapple plantlet under six nitrogen treatments
施氮处理6 d后,除含60 mmol·L-1氮的MS处理外,其余处理的叶片硝酸盐含量均较3 d 时下降。30 mmol·L-1氮、60 mmol·L-1氮处理的叶片硝酸盐含量低于清水处理,其中30 mmol·L-1氮处理的叶片硝酸盐含量与清水处理的差异达到显著水平(p<0.05);含60 mmol·L-1氮的MS处理的叶片硝酸盐含量显著高于清水处理(p<0.05)。此时的硝酸盐含量下降表明,施氮促进了叶片硝态氮的同化。
施氮处理9 d后,30 mmol·L-1氮、60 mmol·L-1氮处理的叶片硝态氮含量上升,高于清水处理;其余处理的叶片硝酸盐含量下降,低于清水处理。结合施氮处理对菠萝各组织质量影响的结果来看,单纯氮处理促进植株生长的作用不及MS营养液基础上的施氮,因此硝态氮在叶片中开始积累;MS营养液基础上施用的氮则继续被同化以供植株生长。
施氮处理26 d 后,所有处理的叶片硝酸盐含量均大幅下降,30 mmol·L-1氮和清水处理的下降幅度最大,其次为含0 mmol·L-1氮的MS处理,60 mmol·L-1氮处理、含60 mmol·L-1氮的MS 和MS 处理的叶片硝酸盐含量下降幅度近似,表明此时大多数处理的植株处于缺氮状态。结合施氮处理对菠萝各组织质量影响的结果来看,低氮处理和清水的缺氮应当源自较低的施氮量,含0 mmol·L-1氮的MS处理的低氮可能源自营养元素不均衡导致的生理性缺氮。
2.4 施氮处理对菠萝各组织硝酸盐转运相关基因表达日变化的影响
40 个菠萝氮转运相关基因在处理与对照的菠萝根、茎和叶中的日变化见图3。从图3 中可看出,不同基因在根、茎和叶中的表达量不同,具有组织特异性。各基因在对照根、茎和叶组织中具有日变化的表达模式。
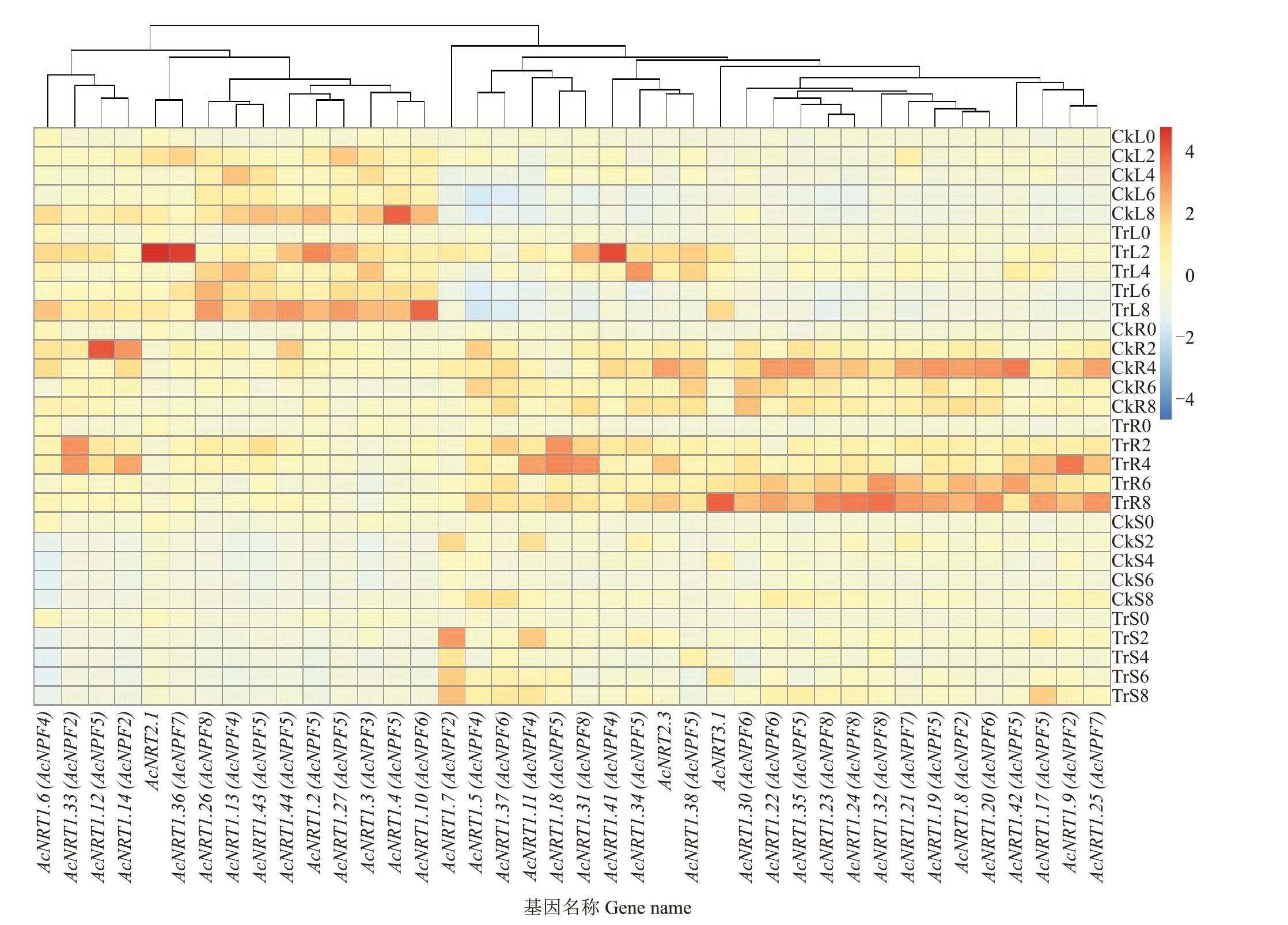
图3 硝态氮转运蛋白基因在处理与对照菠萝植株的根、茎和叶中的日表达变化
Fig.3 Heat map of the expression changes of nitrate nitrogen transporter gene in the roots,stems,and leaves of treated and control pineapple plantlet
CkL.对照叶;TrL.处理叶;CkR.对照根;TrR.处理根;CkS.对照茎;TrS.处理茎;处理名称后的数字表示处理(或对照)后0 h、2 h、4 h、6 h、8 h。颜色深度表示归一化后各基因的相对表达量。下同。
CkL.control leaf;TrL.treated leaf;CkR.control root;TrR.treated root;CkS.control stem;TrS.treated stem;numbers after the treatment name indicates the relative gene expression after 0 h, 2 h, 4 h, 6 h, 8 h of treatment or control.The color depth indicates the normalized relative expression levels of each gene.The same below.
菠萝叶片中,各基因的日表达模式大致可分为3 类,12:00 和14:00 具有表达峰值(如AcNRT1.38),12:00 和18:00 具有表达峰值(如AcNRT2.1),12:00至18:00 均具有较高表达量(如AcNRT1.26)。与对照相比,施氮植株中,12:00 上调表达的基因有Ac-NRT1.31、AcNRT1.41、AcNRT1.2、AcNRT2.1 和Ac-NRT1.36,14:00上调表达的基因有AcNRT1.34,18:00上调表达的基因有AcNRT1.27 和AcNRT1.10,12:00和18:00 上 调 表 达 的 基 因 有AcNRT1.44,12:00 和14:00 上调表达的基因有AcNRT1.38;AcNRT1.26 基因的表达在14:00、16:00 和18:00 均增强;与其他基因表达量上调不同,AcNRT1.4基因的表达量在处理后下调。
菠萝根中受施氮影响的基因较多。大多数基因在14:00 出现峰值,施氮后,该峰值延后到18:00,这些基因有AcNRT1.25、AcNRT1.17、AcNRT1.20、Ac-NRT1.8、AcNRT1.19、AcNRT1.21、AcNRT1.32、Ac-NRT1.24、AcNRT1.23、AcNRT1.35、AcNRT1.22、Ac-NRT3.1;AcNRT1.42基因在14:00的表达高峰延后到16:00;AcNRT1.14基因在12:00的表达高峰被迟后到14:00。除峰值延后外,AcNRT1.31 基因的表达高峰从18:00提前至14:00。有些基因的表达峰值因施氮而加强,如AcNRT1.9、AcNRT1.17、AcNRT1.18、Ac-NRT1.11 和AcNRT1.33 基因;相反,部分基因在施氮后,峰值减弱,如AcNRT2.3、AcNRT1.35、AcNRT1.38和AcNRT1.12基因。
菠萝茎中受施氮影响的硝酸盐转运载体基因较少。其中,AcNRT1.7基因在茎中的表达量较高,12:00为其峰值;施氮后峰值被强化,并持续到18:00。Ac-NRT1.17 基因的峰值在施氮后得到增强;AcNRT1.5和AcNRT1.37基因的峰值在施氮后被弱化。
2.5 不同施氮处理对菠萝叶片硝酸盐转运相关基因长期表达变化的影响
菠萝硝酸盐转运相关基因在6种施氮处理后菠萝叶片中的表达变化见图4。从图4中可看出,处理后第3 天,AcNRT 1.18 基因在所有处理中均有较高表达量,清水处理的表达水平最高;在不含氮源MS处理中上调表达的基因有AcNRT 1.2、AcNRT 1.43和AcNRT 1.3,而在清水处理中上调表达的基因为Ac-NRT 1.18、AcNRT1.5 和AcNRT 1.37,两者无共有上调表达的基因。在所有含氮处理中,也未找到特异的共有上调表达基因。这一结果表明,与木质部硝酸盐卸载有关的基因此时未受到调控。

图4 菠萝硝态氮转运蛋白基因在6 种施氮处理后菠萝叶片中的表达变化
Fig.4 Heat map of expression levels of NRT genes in leaves of pineapple plantlet treated with 6 nitrogen recipes
处理名称后的数字表示处理后3 d、6 d、9 d、26 d。
The numbers after the name of treatments indicates 3 d,6 d,9 d,26 d after application.
处理后第6 天,多数处理的叶片硝酸盐含量开始下降,此时被上调表达的基因也最多,且多在清水处理和不含氮处理(不含氮的MS营养液处理)中具有最大表达量。所研究的40个基因,21个基因在清水处理中具有表达峰值,如AcNRT1.17、AcNRT1.42、AcNRT1.20、AcNRT1.34、AcNRT1.41、AcNRT1.44、Ac-NRT1.13、AcNRT1.30、AcNRT1.38、AcNRT 2.1、Ac-NRT1.43、AcNRT3.1、AcNRT1.24、AcNRT2.3、AcNRT 1.25、AcNRT1.23、AcNRT1.31、AcNRT 1.37、AcNRT 1.8、AcNRT1.9、AcNRT1.12等。在不含氮源MS处理中上调表达的基因有AcNRT 1.7、AcNRT 2.1、AcNRT 1.33、AcNRT1.36、AcNRT 1.12、AcNRT 1.2。其中,Ac-NRT 1.13、AcNRT 2.1和AcNRT 1.12在这两个无氮处理中共同表达,可能与植株的缺氮信号有关。
处理后第9 天,单氮处理的叶片硝酸盐含量上升,其他处理的叶片硝酸盐含量下降。从基因表达水平上看,AcNRT 1.11、AcNRT 1.19、AcNRT 1.24、Ac-NRT2.3、AcNRT 1.25、AcNRT 1.37、AcNRT 1.8、Ac-NRT 1.32在30 mmol·L-1氮处理中具有表达峰值,但这些基因未在60 mmol·L-1氮处理中上调表达。这些基因中,除AcNRT 1.11、AcNRT 1.19和AcNRT 1.32外,其他基因也是清水处理6 d后上调表达的基因。
处理后第26 天出现表达高峰的基因较少。在30 mmol·L-1氮处理中具有表达峰值的基因有Ac-NRT 1.5、AcNRT 1.11、AcNRT 1.19 和AcNRT 1.35。无氮MS 处理中具有表达峰值的基因有AcNRT 1.14、AcNRT 1.21 和AcNRT 1.22。在清水处理中具有表达峰值的基因有AcNRT 1.6和AcNRT 1.10。
3 讨 论
3.1 菠萝植株硝态氮积累及基因表达的日变化
土壤中可供作物利用的氮源包括硝态氮和铵态氮等无机氮以及氨基酸等有机氮,其中硝态氮是富氧土壤中植物吸收的主要无机氮[17]。植物对硝态氮的吸收除受到土壤中硝态氮浓度的影响外,还受到植株的光合作用、营养状态、蒸腾作用、环境条件等多种因素的影响[18]。在很多作物中,植株对硝态氮的吸收和同化具有日变化周期[19]。在本研究中,未施氮植株的叶片、茎和根系的硝态氮含量呈现出特定的日变化模式,在10:00 和16:00 具有最高峰,其他时间段含量较低,可能与光合作用促进的硝态氮同化有关[20]。施氮处理后,改变了该变化模式,降低了根系和叶中的16:00的峰值,提高了根系12:00的硝态氮含量,降低了茎中14:00和18:00的硝态氮含量,说明施氮后,根系增强了对硝态氮的吸收,促进了植株各部位对硝态氮的同化。
与此相应,菠萝植株各组织中硝态氮吸收和转运相关基因的表达变化也呈现出日变化模式。拟南芥中也有多个硝酸盐转运相关基因具有日变化模式[21-23]。在本研究中,40 个菠萝硝态氮转运与吸收基因在菠萝茎、根和叶3 个组织中的表达模式并不完全相同,说明各基因可能具有各自特异的生理功能。
根系中受施氮处理影响的硝态氮吸收与转运相关基因最多。施氮后,14个基因的表达峰值后延,1个基因的表达峰值提前,5个基因的表达峰值增强,4个基因的表达峰值减弱。根系中的硝态氮吸收与转运相关基因除直接参与根系自土壤中吸收和转运硝态氮外,还可作为信号分子感知和传递环境中的硝态氮[24]。拟南芥中就有多个硝态氮转运相关基因参与根系中的硝态氮积累与分配,除了直接负责根系硝态氮吸收外,根系中表达的AtNRT1.8 可自木质部中卸载硝态氮[25],AtNRT1.5 参与根系木质部硝态氮的负载[26],AtNRT1.9 则参与根系韧皮部硝态氮的运输[22]。菠萝根系中的硝态氮含量分别在10:00和16:00 有峰值,施氮后2 h,即12:00 出现峰值,而16:00 的峰值消失;根系中受施氮影响的大多数基因的表达峰值则从14:00延后到18:00;因此,这些基因在14:00的表达可能与随后16:00硝态氮含量增加有关,施氮2 h后,根系硝态氮含量迅速增加,可能导致这些基因表达减弱,峰值延后。施氮2 h后,AcNRT 1.33 和AcNRT 1.18 基因即上调表达,AcNRT1.12 和AcNRT1.14 基因下调表达,这些基因可能与根系16:00 硝态氮的峰值消失有关,可能促进了根系硝态氮向地上部的转运。
叶片中也有不少基因受施氮处理的影响。施氮处理对叶片硝态氮的主要影响是增加了叶片18:00的硝态氮含量;主要在叶片中基因的表达峰值也是出现在18:00,如AcNRT1.4 等。施氮处理对这些基因的影响主要是进一步上调了其在12:00(Ac-NRT1.6、AcNRT1.44、AcNRT1.2)、14:00(AcNRT1.26、AcNRT1.13、AcNRT1.3)和16:00(AcNRT1.26、Ac-NRT1.27)的表达,但AcNRT1.4 基因在18:00 的表达高峰被减弱。叶片中的硝态氮转运载体可能参与叶片中硝态氮的卸载和重新分配[11,24-25]。这些基因在菠萝叶片中的提前表达可能与随后叶片中的硝态氮含量下降有关。
本研究结果表明菠萝茎中含有较多的硝态氮,可能为菠萝硝态氮的贮藏库。茎中受施氮影响的基因非常少,施氮对茎硝态氮含量变化模式的影响也较小。施氮降低了茎中12:00 和18:00 的硝态氮含量。AcNRT1.7基因是少数在茎中具有高表达水平的基因,该基因在12:00 有表达峰值,施氮后其较高的表达量可持续至18:00。该基因可能与茎中的硝态氮积累有关。在拟南芥中,有多个NRT基因家族的基因在茎中表达,主要参与硝酸盐的转运[27]。
3.2 不同施氮处理对菠萝植株硝态氮积累及基因表达的影响
为揭示硝态氮转运蛋白基因与菠萝叶片营养状态的关系,本研究通过5个施氮处理,创造了分别处于高氮、氮均衡和缺氮等不同氮营养状态的菠萝植株。从结果来看,处理后3 d,除清水处理外,各处理的菠萝叶片都有显著的硝态氮积累。处理后6 d,除含60 mmol·L-1氮的MS 处理外,其他处理的叶片硝态氮含量开始下降,说明此时硝态氮的同化得到激活,同化的速度超过吸收的速度。处理后9 d,除2个纯氮处理外,其他处理的叶片硝态氮含量均呈下降趋势,说明含有MS 的全营养液最有利于植物硝态氮同化。对植株生长情况的分析进一步验证了该结果。不含氮的MS和清水处理的植株质量无明显增加,植株几乎没有生长,前者可能是由于营养元素供应不均衡,后者则可能是由于无营养元素供应;不含氮的MS处理的根系鲜质量高于60 mmol·L-1氮+MS处理和清水处理,也说明不含氮的MS处理促进了根系生长以利于营养元素的吸收。MS处理植株的鲜质量增加幅度最大,营养元素供应均衡,最有利于植株的生长。
从叶片中硝态氮转运相关基因的表达变化来看,处理3 d后,未找到施氮与未施氮处理特异的共有上调表达基因;清水处理叶片中硝态氮的增加可能与AcNRT 1.18基因的高表达有关,不施氮情况下叶片硝态氮的增加可能源自氮库的重新分配。处理6 d 后,含氮处理的叶片硝态氮含量因被同化而降低,不含氮处理的植株叶片处于氮饥饿状态,大量基因被上调表达,其中包括高亲和力的硝态氮转运载体基因AcNRT 2.1、AcNRT 2.3 和AcNRT 3.1;不含氮MS处理和清水处理间上调表达的基因并不完全相同,表明有些NRTs 基因响应了其他矿质元素缺乏的信号,比如钾元素的运载[28]。
施氮处理9 d后,受元素供应不均衡的影响,纯氮处理植株的叶片氮同化减弱、开始积累氮。此时,有8个清水处理6 d后上调表达的基因在30 mmol·L-1氮处理中具有表达峰值,进一步表明这些基因可能参与了其他矿质元素的调运或信号传递。这些基因在60 mmol·L-1氮处理中并未上调表达,一种可能就是这些基因的表达峰值在9 d前出现,此时已经检测不到。
施氮处理26 d 后,大多数处理的叶片硝态氮含量均有较大幅度下降,以无氮MS 处理的下降幅度最大。此时叶片中硝态氮含量的下降可能是由于硝态氮向新叶或其他库的转移;因此,有生长量但无氮供应的无氮MS 处理的下降幅度最大,无氮供应但也无生长量的清水处理下降幅度较小,MS 营养液处理的生长量虽大,但元素供应均衡,硝态氮含量下降幅度也不大。从基因表达上看,清水处理和无氮MS 处理无共有高表达基因;AcNRT 1.14、AcNRT 1.21和AcNRT 1.22基因在无氮MS处理中具有表达峰值,这些基因可能与叶片硝态氮的重新分配有关[29]。拟南芥中,这一功能主要由AtNRT1.7 基因完成[12],可将硝态氮自老叶转运至幼叶。促进硝态氮自老叶向新叶的转运可提高氮的利用效率,进而促进烟草和水稻的生长或提高其产量[30]。这些基因在菠萝育种中能否实现类似应用值得尝试。
4 结 论
菠萝根、茎、叶硝酸盐含量和硝酸盐转运蛋白基因表达均呈现日动态变化,施氮后其变化模式发生改变;硝酸盐转运蛋白基因表达受植株氮营养状态调控,AcNRT 1.13、AcNRT 2.1 和AcNRT 1.12 基因可能与叶片氮吸收有关,AcNRT 1.14、AcNRT 1.21 和AcNRT 1.22基因可能与叶片氮再分配有关。
[1] 刘传和,贺涵,邵雪花,赖多,匡石滋,肖维强,何秀古.菠萝品种选育与栽培技术研究进展[J].农学学报,2021,11(8):53-59.LIU Chuanhe,HE Han,SHAO Xuehua,LAI Duo,KUANG Shizi,XIAO Weiqiang,HE Xiugu.Research progress of breeding and cultivation practices of pineapple[J].Journal of Agriculture,2021,11(8):53-59.
[2] GOOD A G,SHRAWAT A K,MUENCH D G.Can less yield more? Is reducing nutrient input into the environment compatible with maintaining crop production?[J].Trends in Plant Science,2004,9(12):597-605.
[3] GOOD A G,BEATTY P H.Biotechnological approaches to improving nitrogen use efficiency in plants:Alanine aminotransferase as a case study[M]//MALCOM J H,PETER B.The molecular and physiological basis of nutrient use efficiency in crops.West Sussex:Wiley-Blackwell,2011:165-191.
[4] 潘飞飞,宋俊杰,李庆飞.不同种植年限设施菜田土壤硝态氮的累积与空间分布特性[J].中国瓜菜,2022,35(1):70-75.PAN Feifei,SONG Junjie,LI Qingfei.Accumulation and spatial distribution characteristics of nitrate nitrogen in vegetable fields with different planting years[J].China Cucurbits and Vegetables,2022,35(1):70-75.
[5] 陈淼,李玮,陈歆,李宁,杨桂生,彭黎旭.菜地土壤氮素迁移转化研究进展[J].中国瓜菜,2017,30(8):1-6.CHEN Miao,LI Wei,CHEN Xin,LI Ning,YANG Guisheng,PENG Lixu.Research progress on transfer and transformation of soil nitrogen in vegetable field[J].China Cucurbits and Vegetables,2017,30(8):1-6.
[6] 周柳强,张肇元,黄美福,龙淑珍,徐青臣.菠萝的营养特性及平衡施肥研究[J].土壤,1994,26(1):43-47.ZHOU Liuqiang,ZHANG Zhaoyuan,HUANG Meifu,LONG Shuzhen,XU Qingchen.Study on nutritional characteristics and balanced fertilization of pineapple[J].Soils,1994,26(1):43-47.
[7] 韦巧云,徐健,王小媚,赵静,周婧,韦优,黄丽君.不同施氮水平对‘台农16 号’菠萝生长、果实品质和产量的影响[J].中国果树,2019(3):71-73.WEI Qiaoyun,XU Jian,WANG Xiaomei,ZHAO Jing,ZHOU Jing,WEI You,HUANG Lijun.Effects of different nitrogen application levels on the growth,fruit quality and yield of‘Tainong 16’pineapple[J].China Fruits,2019(3):71-73.
[8] 张江周,严程明,刘亚男,马海洋,石伟琦.不同施肥量对菠萝产量和品质的影响[J].热带作物学报,2014,35(5):837-841.ZHANG Jiangzhou,YAN Chengming,LIU Yanan,MA Haiyang,SHI Weiqi.Effects of different fertilizer application rates on yield and quality of pineapple[J].Chinese Journal of Tropical Crops,2014,35(5):837-841.
[9] 石伟琦,孙光明,陆新华,陈菁,左雪冬,孙伟生.分次施氮对菠萝产量和品质的影响[J].植物营养与肥料学报,2012,18(6):1524-1529.SHI Weiqi,SUN Guangming,LU Xinhua,CHEN Jing,ZUO Xuedong,SUN Weisheng.Effects of split application of nitrogen on yield and quality of pineapple[J].Plant Nutrition and Fertilizer Science,2012,18(6):1524-1529.
[10] CRAWFORD N M.Nitrate:Nutrient and signal for plant growth[J].The Plant Cell,1995,7(7):859-868.
[11] HE Y N,PENG J S,CAI Y,LIU D F,GUAN Y,YI H Y,GONG J M.Tonoplast-localized nitrate uptake transporters involved in vacuolar nitrate efflux and reallocation in Arabidopsis[J].Scientific Reports,2017,7(1):6417.
[12] WANG Y Y,HSU P K,TSAY Y F.Uptake,allocation and signaling of nitrate[J].Trends in Plant Science,2012,17(8):458-467.
[13] LI W M,YAN M K,HU B Y,PRIYADARSHANI S V G N,HOU Z M,OJOLO S P,XIONG J J,ZHAO H M,QIN Y.Characterization and the expression analysis of nitrate transporter(NRT) gene family in pineapple[J].Tropical Plant Biology,2018,11(3):177-191.
[14] 阮城城,胡福初,罗志文,王祥和,郭利军,李玉静,范鸿雁,韩冰,陈哲,张治礼.菠萝TCP 基因家族的鉴定及成花诱导阶段的表达谱分析[J].果树学报,2020,37(11):1623-1635.RUAN Chengcheng,HU Fuchu,LUO Zhiwen,WANG Xianghe,GUO Lijun,LI Yujing,FAN Hongyan,HAN Bing,CHEN Zhe,ZHANG Zhili.Genome-wide identification of pineapple TCP gene family and analysis of expression profile in flower induction stage[J].Journal of Fruit Science,2020,37(11):1623-1635.
[15] 任同辉.萝卜硝酸盐含量分析的初步研究[D].南京:南京农业大学,2005.REN Tonghui.Primary studies on nitrate content in radish(Raphanus sativus L.)[D].Nanjing:Nanjing Agricultural University,2005.
[16] JIN X Y,HOU Z M,ZHAO L H,LIU L P,PRIYADARSHANI S V G N,WANG L L,HUANG Y M,CHEN F Q,QIN Y.Genome-wide identification and evaluation of new reference genes in pineapple (Ananas comosus L.) during stamen and ovule development[J].Tropical Plant Biology,2020,13(4):371-381.
[17] MASCLAUX- DAUBRESSE C,DANIEL- VEDELE F,DECHORGNAT J,CHARDON F,GAUFICHON L,SUZUKI A.Nitrogen uptake,assimilation and remobilization in plants:challenges for sustainable and productive agriculture[J].Annals of Botany,2010,105(7):1141-1157.
[18] SMIRNOFF N,STEWART G R.Nitrate assimilation and translocation by higher plants:Comparative physiology and ecological consequences[J].Physiologia Plantarum,1985,64(2):133-140.
[19] LILLO C,MEYER C,RUOFF P.The nitrate reductase circadian system.The central clock dogma contra multiple oscillatory feedback loops[J].Plant Physiology,2001,125(4):1554-1557.
[20] ASLAM M,TRAVIS R L,RAINS D W.Diurnal fluctuations of nitrate uptake and in vivo nitrate reductase activity in pima and acala cotton[J].Crop Science,2001,41(2):372-378.
[21] LI H,YU M,DU X Q,WANG Z F,WU W H,QUINTERO F J,JIN X H,LI H D,WANG Y.NRT1.5/NPF7.3 functions as a proton-coupled H+/K+antiporter for K+loading into the xylem in Arabidopsis[J].The Plant Cell,2017,29(8):2016-2026.
[22] WANG Y Y,TSAY Y F.Arabidopsis nitrate transporter NRT1.9 is important in phloem nitrate transport[J].The Plant Cell,2011,23(5):1945-1957.
[23] FAN S C,LIN C S,HSU P K,LIN S H,TSAY Y F.The Arabidopsis nitrate transporter NRT1.7,expressed in phloem,is responsible for source-to-sink remobilization of nitrate[J].The Plant Cell,2009,21(9):2750-2761.
[24] OKAMOTO M,VIDMAR J J,GLASS A D M.Regulation of NRT1 and NRT2 gene families of Arabidopsis thaliana:Responses to nitrate provision[J].Plant and Cell Physiology,2003,44(3):304-317.
[25] LI J Y,FU Y L,PIKE S M,BAO J,TIAN W,ZHANG Y,CHEN C Z,ZHANG Y,LI H M,HUANG J,LI L G,SCHROEDER J I,GASSMANN W,GONG J M.The Arabidopsis nitrate transporter NRT1.8 functions in nitrate removal from the xylem sap and mediates cadmium tolerance[J].The Plant Cell,2010,22(5):1633-1646.
[26] LIN S H,KUO H F,CANIVENC G,LIN C S,LEPETIT M,HSU P K,TILLARD P,LIN H L,WANG Y Y,TSAI C B,GOJON A,TSAY Y F.Mutation of the Arabidopsis NRT1.5 nitrate transporter causes defective root-to-shoot nitrate transport[J].The Plant Cell,2008,20(9):2514-2528.
[27] TAOCHY C,GAILLARD I,IPOTESI E,OOMEN R,LEONHARDT N,ZIMMERMANN S,PELTIER J B,SZPONARSKI W,SIMONNEAU T,SENTENAC H,GIBRAT R,BOYER J C.The Arabidopsis root stele transporter NPF2.3 contributes to nitrate translocation to shoots under salt stress[J].The Plant Journal,2015,83(3):466-479.
[28] DE LOS RÍOS L M,CORRATGÉ-FAILLIE C,RADDATZ N,MENDOZA I,LINDAHL M,DE ANGELI A,LACOMBE B,QUINTERO F J,PARDO J M.The Arabidopsis protein NPF6.2/NRT1.4 is a plasma membrane nitrate transporter and a target of protein kinase CIPK23[J].Plant Physiology and Biochemistry,2021,168:239-251.
[29] DIAZ C,LEMAÎTRE T,CHRIST A,AZZOPARDI M,KATO Y,SATO F,MOROT-GAUDRY J F,LE DILY F,MASCLAUXDAUBRESSE C.Nitrogen recycling and remobilization are differentially controlled by leaf senescence and development stage in Arabidopsis under low nitrogen nutrition[J].Plant Physiology,2008,147(3):1437-1449.
[30] CHEN K E,CHEN H Y,TSENG C S,TSAY Y F.Improving nitrogen use efficiency by manipulating nitrate remobilization in plants[J].Nature Plants,2020,6(9):1126-1135.