我国是山楂属植物的起源中心之一,山楂属植物在我国分布有18 个种、1 个变种,伏山楂(Crataegus bretschneideri)、云南山楂(C. scabrifolia)、湖北山楂(C.hupehensis)以及羽裂山楂中的大果山楂变种(C. pinnatifida Bge.var. major)是我国现存的4个栽培种[1]。
山楂具有抗寒、耐旱、病虫害少、适应性强等优点[2],可用于困难立地种植,是服务“乡村振兴”的战略树种。山楂果实具有很高的营养价值,富含维生素、矿质营养元素、有机酸和果胶,同时还含有多种生物活性成分,可以消积健胃、消痰止咳、降血压、降血脂和防治冠心病等,被誉为“营养保健果品”,在鲜食、加工和入药上广泛应用[3-4]。
作为中国原产和特有的栽培果树,国家十分重视山楂种质资源的研究。20世纪七八十年代,全国进行了大规模的山楂种质资源的考察,基本查清了中国山楂属植物种质资源情况。进入90年代,由于全国山楂产业发展过热,加上山楂深加工没有跟上,致使山楂价格一落千丈,全国大面积的山楂树被砍伐,山楂种质资源的研究也一度受到影响。近年来,随着人们保健意识的增强,不仅要求果品色香味俱全,而且要求具有营养,山楂产业也因此开始逐步恢复,重新走到了市场的前台[5-6],在此形势下,加强中国山楂种质资源的创新和利用显得尤为重要。
种质资源合理利用的前提是对资源进行鉴定和评价。山楂种质资源遗传多样性研究经历了从形态学多样性到DNA 多样性的过程,涉及形态学、孢粉学、生物化学和分子生物学[7-10],为山楂资源的收集、保护、评价和创新利用提供了有力的科学依据。近年来,多种分子标记被应用于山楂种质资源的鉴定和评价[11],但是表型性状仍然是种质资源研究的最基本的方法和途径[12-15]。表型性状的考量最为直观、快速和经济,是明显受生态环境条件影响的特征指标。表型多样性研究能够阐明种群变异结构、来源和规律,能够为植物种质资源收集、保护和遗传改良提供科学参考[16-19]。在此基础上,通过对基因资源的深入挖掘,为复杂性状的形成机制研究提供重要依据[17]。目前基于形态学和农艺学表型性状对山楂种质资源表型性状多样性鉴评的研究虽有部分报道[20-23],但局限于有限资源和少数性状,特别是对农艺性状的研究较少,且缺乏深入、系统、全面的评价,难以为山楂种质资源的创新和利用提供有效的科学参考。
本研究中,在对北京市农林科学院林业果树研究所山楂种质资源圃收集保存的山楂种质资源初步鉴定和筛选的基础上,对初步筛选出的62份山楂种质的48个表型性状进行多样性鉴定评价,利用统计软件进行聚类、相关性、主成分等分析,旨在揭示其变异特点和多样性,划分不同育种目标的种质类群,简化资源鉴定评价指标,为山楂种质资源的保护、评价及新品种选育等提供理论依据。
1 材料和方法
1.1 试材及取样
试验于2019—2021 连续3 a(年)在北京市农林科学院林业果树研究所山楂资源圃进行。试验材料为收集保存在圃内的62 份山楂种质资源(表1),均为10 年生植株,树体生长、立地条件和栽培管理水平基本一致。
表1 本研究中的62 份山楂资源
Table 1 62 accessions of hawthorn germplasms used in this study

编号Code 12345678 9种名Specific name C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major倍性Ploidy 2x=34 2x=34 3x=51 3x=51 3x=51 3x=51 2x=34 3x=51编号Code 32 33 34 35 36 37 38 39种名Specific name C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major倍性Ploidy 2x=34 3x=51 2x=34 2x=34 2x=34 3x=51 2x=34 2x=34 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27名称Name叶赫Yehe土谷子1号Tuguzi 1大旺Dawang大糖球Datangqiu大货Dahuo子母红Zimuhong大棉球Damianqiu山东大金星Shandong Dajinxing燕瓤红Yanranghong临汾大金星Linfen Dajinxing二乙子Eryizi京短1号Jingduan 1京短2号Jingduan 2蟹子石4号-1 Xiezishi 4-1蟹子石4号-2 Xiezishi 4-2铁球Tieqiu兴隆2号Xinglong 2劈破石2号Piposhi 2灯笼红Denglonghong北早实生Beizaoshisheng卧龙岗2号Wolonggang 2双红Shuanghong掛甲峪1号Guajiayu 1敞口Changkou早红Zaohong涧沟2号Jiangou 2燕瓢青Yanrangqing C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major 2x=34 3x=51 2x=34 3x=51 3x=51 2x=34 2x=34 2x=34 2x=34 2x=34 2x=34 2x=34 2x=34 2x=34 2x=34 3x=51 2x=34 2x=34 2x=34 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.C.bretschneideri Schneid C.bretschneideri Schneid C.bretschneideri Schneid 2x=34 2x=34 2x=34 2x=34 2x=34 2x=34 2x=34 2x=34 2 x=34 2x=34 2x=34 2x=34 2x=34 2x=34 2x=34 2x=34 3x=51 3x=51 3x=51 28 29 30 31白瓤绵Bairangmian磨盘Mopan磨盘-223 Mopan-223秋金星Qiujinxing C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major C.pinnatifida Bge.var.major 3x=51 3x=51 3x=51 2x=34 59 60 61 62名称Name紫肉山楂Zirou Shanzha红瓤绵Hongrangmian聂家峪1号Niejiayu 1聂家峪2号Niejiayu 2艳果红Yanguohong西坟5号Xifen 5西丰红Xifenghong西坟实生Xifen Shisheng蟹子石1号Xiezishi 1豫北红Yubeihong辽宁10号Liaoning 10辽宁11号Liaoning 11辽红Liaohong银冶岭2号Yinyeling 2银冶岭7号Yinyeling 7 204-A 786202 792204 792402 792403 792605 795507 795509开原软籽Kaiyuanruanzi左伏1号Zuofu 1伏里红Fulihong红肉伏里红Hongrou Fulihong湖北1号Hubei 1湖北2号Hubei 2湖北3号Hubei 3湖北5号Hubei 5 C.hupehensis Sarg.C.hupehensis Sarg.C.hupehensis Sarg.C.hupehensis Sarg.4x=68 4x=68 4x=68 4x=68
1.2 性状调查与测定
每个品种选取3株生长基本一致的结果树作为试验对象。每株从树冠外围东、南、西、北4 个方向随机选取健康、无病虫害的1 年生枝条和果实各10份,在枝条中部选取生长均匀、成熟的叶片10份,所有材料于采收当天送回实验室进行样品处理及各项指标的测定。依照《中国果树志:山楂卷》第8章《山楂种质资源描述评价系统》[1]和《山楂种质资源描述规范》[24]选取22个描述型性状(表2)、26个数值型性状(表4)进行统计记录。其中,可食率:随机取样100 个果实称质量,然后除去果梗、果萼和果核,再称可食部分质量,通过可食部分质量与果实质量的比值,计算百分率;萌芽率:随机取样树冠外围30个2 年生延长枝,用总萌芽数除以总芽数,计算百分率;成枝力:萌芽中15 cm 以上枝数除以总萌芽数,计算百分率;果枝指数:随机取样30 个以上结果母枝,统计其上的结果枝平均数;中母枝系数:全树范围内长度5.1~15.0 cm的中母枝被母枝总数除得的商数;母枝负荷量:30个母枝平均坐果数乘单果质量(g)。
表2 62 份山楂种质资源22 个描述型性状及分级标准
Table 2 Twenty-two descriptive phenotypic traits and recorded standard of 62 hawthorn germplasm resources

可溶性糖含量采用蒽酮比色法[25]测定。可滴定酸含量采用氢氧化钠滴定法[25]测定。果胶的提取及含量测定参照张英楠等[26]的方法。淀粉含量采用酶水解法[27]测定。维生素C含量采用紫外分光光度法测定[28]。果实水分含量(%)计算方法:(烘干前样品质量-烘干后样品质量)/烘干前样品质量×100。
1.3 数据处理
使用Python 3.8.10 对原表格数据进行整理,使用Pandas V.1.3.1 和Numpy V.1.19.5 计算各描述性状分布频率以及各数值型性状的最小值、最大值、极差、标准差和变异系数。使用Vegan V.2.5.7计算描述型性状的Shannon-Wiener 信息指数H 和Simpson多样性指数D。通过R 语言V.4.1.4 采用层次聚类中离差平方和法对62份山楂种质资源进行聚类,判断各种质资源组成的相似性,对聚类结果进行分析,并绘制聚类图。利用R 语言V.4.1.4对21个数值性状进行相关性分析和主成分分析,对各步骤结果进行分析,并绘图。
2 结果与分析
2.1 表型性状多样性
2.1.1 描述型性状多样性 由表3 可知,21 个描述型性状中2 年生枝颜色、皮孔形状、皮孔密度、萼片状态、果皮颜色、果实风味等变异较大。
表3 62 份山楂种质资源性状频率分布及多样性
Table 3 Frequency distribution and diversity of phenotypic traits in 62 hawthorn germplasm resources

注:表中1~8 表示各描述型性状的分级情况,详见表2。性状分级最多为8 级。“-”表示没有相应的数值。
Note:1-8 indicate the recorded standard of descriptive phenotypic traits, which have been presented in Table 2.Descriptive phenotypic traits can be divided into 8 grades at most.“-”denotes no corresponding value.
描述型性状Descriptive trait 2年生枝颜色two years twig color(2YTC)皮孔形状Stomata shape(SS)皮孔密度Stomata density(SD)针刺Thorn(T)叶片形状Leaf shape(LS)叶基Leaf base(LB)叶尖Leaf apex(LA)叶缘锯齿Leaf margin(LM)叶片裂刻Leaf lobe(LL)果实形状Fruit shape(FS)果皮颜色Pericarp color(PC)果面光泽Surface state(ST)果面附属物Surface accessory(SA)果点大小Dot size(DS)果点颜色Dot color(DC)梗洼性状Stalk cavity(SC)梗基特征Stalk base(SB)萼片状态Sepal state(SS)萼筒形状Calyx tube shape(CTS)果肉颜色Pulp color(PC)果肉质地Pulp texture(PT)果肉风味Pulp flavor(PF)各级频率Frequency of classification/%1 31.58 3.70 30.19 93.18 10.24 1.21 12.96 27.71 5.49 46.99 4.82 88.55 75.16 21.69 9.04 5.42 32.53 15.34 43.98 59.04 50.60 12.65 2 3 4 5 6 H D 7————————-8————————-0.764 4 0.816 7 0.888 7 0.128 7 0.519 2 0.518 9 0.562 1 0.669 8 0.575 6 0.632 4 0.709 3 0.202 7 0.392 1 0.639 1 0.421 2 0.370 3 0.470 3 0.744 0 0.577 7 0.584 6 0.584 9 0.675 4 5.26 55.56 60.38 5.30 26.51 43.98 15.43 33.74 24.39 36.75 45.18 11.45 3.82 45.18 17.47 77.71 2.41 1.84 9.04 24.10 6.63 51.21 6.77 47.74 9.43 1.52 63.25 53.61 62.35 1.21 59.15 9.64 16.87-0.64 33.13 73.49 15.06 65.06 39.26 46.99 5.42 3.61 7.83 17.29 9.02 30.08——1.21 9.26 37.35 10.98 4.82 18.68-20.38————————1.21 14.46 0.60——--0.60-26.38-6.63 39.16 16.87 1.21-6.14-3.61-10.84——---2.45-1.21-0.60 5.52 3.07————1.583 1 0.530 1 0.535 3 0.285 0 0.875 0 0.802 0 1.068 1 1.143 3 1.056 6 1.178 4 1.398 3 0.355 7 0.695 8 1.056 4 0.748 4 0.723 1 0.734 8 1.608 7 0.933 4 1.165 2 1.011 7 1.375 6
2 年生枝颜色有灰白、紫褐、黄褐、红褐、黄棕、灰绿6 类,灰白与紫褐占比较高,分别为31.58%和30.08%。皮孔形状有椭圆形(55.56%)、近圆形(47.74%)和菱形(3.70%)。皮孔密度分为中(60.38%)、密(30.19%)、稀(9.43%)。针刺包括无针刺(93.18%)、少针刺(5.30%)和有针刺(1.52%)3类。
叶片形状包括三角状卵形、广卵圆形、卵形3类,三角状卵形占比最高(63.25%)。叶基形状包括楔形、宽楔形、截形和楔形下延4类。叶尖形状包括长突尖、短突尖、渐尖和急尖4类。叶缘锯齿有重锯齿、粗锐、细锐和钝圆4 类。叶片裂刻包括深裂、中裂、全裂和浅裂4类,深裂占比最高(59.15%)。
果实形状有近圆形、扁圆形、长圆形、卵圆形、倒卵圆形和椭圆形,以近圆形(46.99%)和扁圆形(36.75%)为主。果皮颜色有大红色、深红色、鲜红色、紫红色和橙红色5 类,大红色占比最高,为45.18%,橙红色占比最低,仅为4.82%。果皮状态包括平滑有光泽和粗糙无光泽2类。果面附属物包括无、苞片、残毛、果粉4类。果点大小包括大、中、小3类,占比分别为33.13%、45.18%和21.69%。果点颜色包括黄褐、黄白、灰褐3 类,以黄褐色为主(73.49%)。梗洼包括广浅、深广、平展、隆起和狭深5 类,广浅占比最高(77.71%),狭深占比最低,仅为0.6%。梗基特征包括有瘤起、无瘤起和基部肥大3类,有瘤起占比最高(65.06%)。萼片状态包括开张反卷、半开张反卷、开张平展、开张直立、闭合萼尖反卷、聚合、半开张直立、半开张平展8类,以开张反卷(39.26%)、半开张反卷(26.38%)、开张平展(15.34%)为主。萼筒形状有圆锥形、漏斗形、近圆形3类。
果肉颜色有绿白、黄白、粉白、橙黄、粉红、黄绿6类,绿白占比最高(59.04%)。果肉质地包括松软、较硬、绵面、质细4类,以松软为主(50.6%)。果肉风味包括酸甜适口、味酸稍甜、酸甜有果香、微酸味苦、微酸稍甜、味酸稍苦6类,酸甜适口占比最高(51.21%)。
由表3可知,信息指数H和遗传多样性指数D变化范围分别是0.285 0~1.608 7和0.202 7~0.764 4,其中萼片状态、2年生枝颜色、皮孔形状、皮孔密度、果皮颜色的信息指数分别为1.608 7、1.583 1、1.544、1.398 3,遗传多样性指数分别是0.744 0、0.764 4、0.737 3、0.709 3,在所有描述性状中数值都比较高,说明多样性较为丰富,另外,果肉风味、果肉颜色等信息指数和遗传多样性指数值也比较高,变异范围较大。
2.1.2 数值型性状多样性 62 份山楂种质资源的叶片、花、果实、种核等26个数值型性状多样性统计结果如表4所示,整体变异系数变化范围较大,资源多样性相对比较丰富。其中,果实水分含量的变异系数最小(5.86%),种仁率变异系数最大(79.91%)。
表4 62 份山楂种质资源26 个数值型性状多样性统计分析
Table 4 Analysis of diversity for 26 quantitative traits in 62 hawthorn germplasm resources
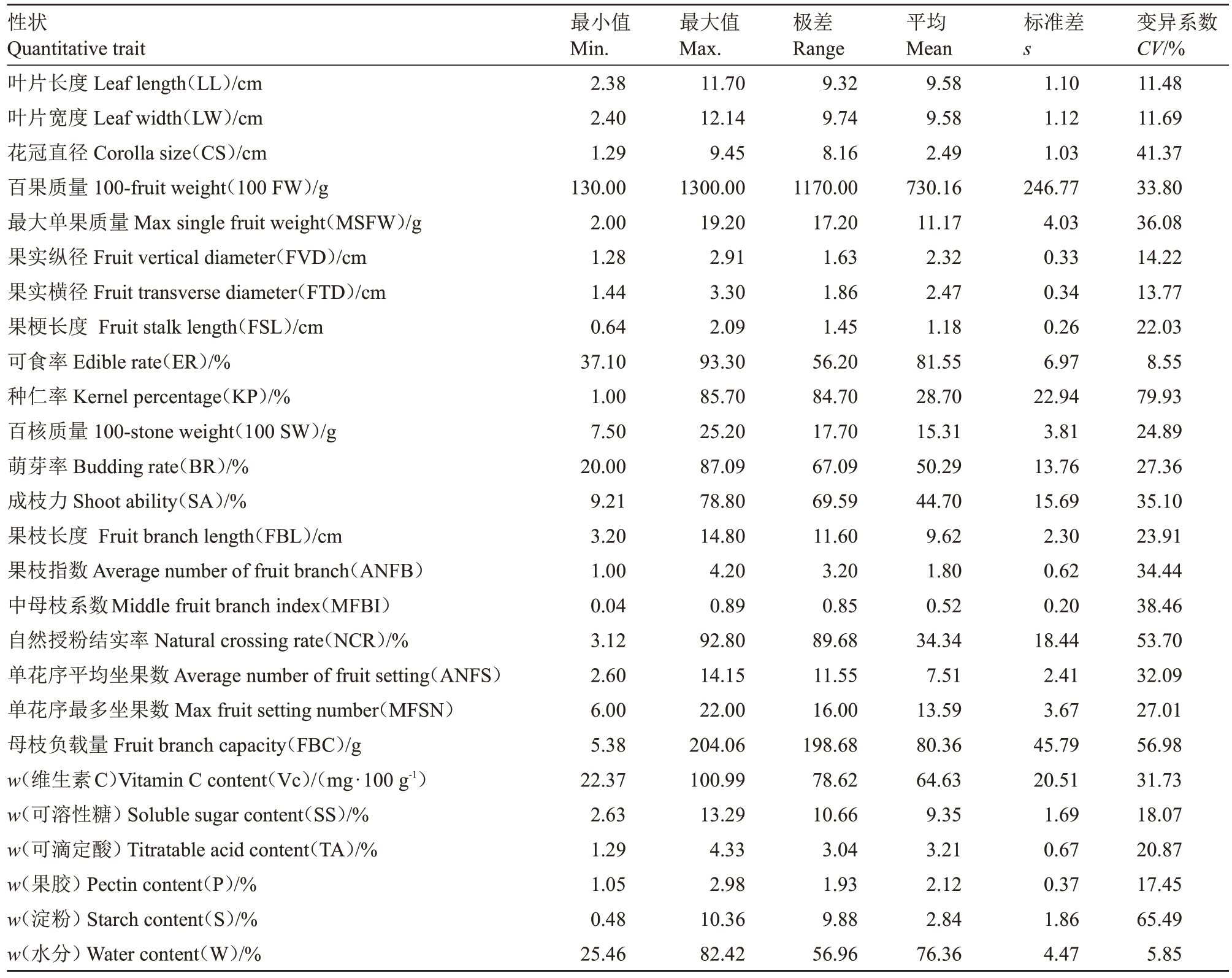
性状Quantitative trait叶片长度Leaf length(LL)/cm叶片宽度Leaf width(LW)/cm花冠直径Corolla size(CS)/cm百果质量100-fruit weight(100 FW)/g最大单果质量Max single fruit weight(MSFW)/g果实纵径Fruit vertical diameter(FVD)/cm果实横径Fruit transverse diameter(FTD)/cm果梗长度Fruit stalk length(FSL)/cm可食率Edible rate(ER)/%种仁率Kernel percentage(KP)/%百核质量100-stone weight(100 SW)/g萌芽率Budding rate(BR)/%成枝力Shoot ability(SA)/%果枝长度Fruit branch length(FBL)/cm果枝指数Average number of fruit branch(ANFB)中母枝系数Middle fruit branch index(MFBI)自然授粉结实率Natural crossing rate(NCR)/%单花序平均坐果数Average number of fruit setting(ANFS)单花序最多坐果数Max fruit setting number(MFSN)母枝负载量Fruit branch capacity(FBC)/g w(维生素C)Vitamin C content(Vc)/(mg·100 g-1)w(可溶性糖)Soluble sugar content(SS)/%w(可滴定酸)Titratable acid content(TA)/%w(果胶)Pectin content(P)/%w(淀粉)Starch content(S)/%w(水分)Water content(W)/%最小值Min.2.38 2.40 1.29 130.00 2.00 1.28 1.44 0.64 37.10 1.00 7.50 20.00 9.21 3.20 1.00 0.04 3.12 2.60 6.00 5.38 22.37 2.63 1.29 1.05 0.48 25.46最大值Max.11.70 12.14 9.45 1300.00 19.20 2.91 3.30 2.09 93.30 85.70 25.20 87.09 78.80 14.80 4.20 0.89 92.80 14.15 22.00 204.06 100.99 13.29 4.33 2.98 10.36 82.42极差Range 9.32 9.74 8.16 1170.00 17.20 1.63 1.86 1.45 56.20 84.70 17.70 67.09 69.59 11.60 3.20 0.85 89.68 11.55 16.00 198.68 78.62 10.66 3.04 1.93 9.88 56.96平均Mean 9.58 9.58 2.49 730.16 11.17 2.32 2.47 1.18 81.55 28.70 15.31 50.29 44.70 9.62 1.80 0.52 34.34 7.51 13.59 80.36 64.63 9.35 3.21 2.12 2.84 76.36标准差s 1.10 1.12 1.03 246.77 4.03 0.33 0.34 0.26 6.97 22.94 3.81 13.76 15.69 2.30 0.62 0.20 18.44 2.41 3.67 45.79 20.51 1.69 0.67 0.37 1.86 4.47变异系数CV/%11.48 11.69 41.37 33.80 36.08 14.22 13.77 22.03 8.55 79.93 24.89 27.36 35.10 23.91 34.44 38.46 53.70 32.09 27.01 56.98 31.73 18.07 20.87 17.45 65.49 5.85
在叶片性状中,叶片长度、叶片宽度的平均值分别为9.58 cm 和9.58 cm,变异系数分别为11.48%和11.69%。叶片长度最大的为敞口(11.7 cm),最小的为北早实生(2.38 cm)。叶片宽度最大的为大旺(12.14 cm),最小的为北早实生(2.4 cm)。在花性状中,花冠直径平均值为2.49 cm,变异系数为41.37%。
在种子性状中,种仁率、百核质量平均值分别为28.7%和15.31 g,其中种仁率变异系数较大,为79.93%,种仁率最高的是湖北2 号(85.7%),最低的是红瓤绵(1%)。
在枝条性状中,萌芽率、成枝力、结果枝长度、果枝指数、中母枝系数的平均值分别为50.29%、44.70%、9.62 cm、1.8 和0.52,其中成枝力、果枝指数和中母枝系数的变异系数较大,分别为35.10%、34.44%和38.46%,其他2 个指标的变异系数相差不大,分别为27.36%和23.90%。
在果实性状中,单果质量最小的为软籽山楂(2.00 g),最大的为京短2 号(19.20 g),单果质量平均值为11.17 g。果实纵横径的平均值分别为2.32 cm和2.47 cm,变异系数分别为14.22%和13.77%。果实可食率的平均值为81.55%,变异系数较小,仅为8.55。维生素C(Vc)、可溶性糖、可滴定酸、果胶、淀粉和水分含量是反映果实营养性状的主要指标,其平均值分别为64.63 mg·100 g-1、9.35%、3.21%、2.12%、2.84%、76.36%,其中淀粉含量变异系数最大(65.49%),水分含量变异系数最小(5.85%),可溶性糖、可滴定酸和果胶含量的变异系数相差不大,分别为18.07%、20.87%和17.45%。可溶性糖含量最高的为蟹子石4 号-1(13.29%),最低的为伏里红(2.63%)。可滴定酸含量最高的为大绵球(4.33%),最低的为795507(1.29%)。果胶含量最高的为辽宁11号(2.98%),最低的为山东大金星(1.05%)。
2.1.3 数值型性状相关性 对26个数值型性状进行相关性分析(图1)可知,62份山楂种质资源各数值型性状间大多存在显著或极显著相关性。叶片长度与叶片宽度、百果质量、最大单果质量、果实横径、果实纵径呈极显著正相关(p<0.01)。花冠直径与叶片长度、百果质量、最大单果质量、果实横径、果实纵径呈显著正相关(p<0.05)。最大单果质量、百果质量、果实横径、果实纵径、可食率间两两呈极显著或显著正相关。可食率与百核质量呈显著正相关。萌芽率与成枝力呈极显著负相关。果枝长度与叶片长度、叶片宽度、百果质量、最大单果质量、果实横径、果实纵径呈极显著正相关。果枝指数与自然授粉结实率、单花序平均坐果数、单花序最多坐果数、母枝负载量呈极显著正相关。果枝指数与中母枝系数呈极显著负相关。Vc与可溶性糖、可滴定酸含量呈极显著或显著正相关。可溶性糖含量与成枝力、自然授粉结实率、单花序平均坐果数、单花序最多坐果数、淀粉含量呈极显著负相关。可滴定酸含量与百果质量、最大单果质量、果实纵径、果实横径呈极显著正相关。

图1 62 份山楂种质资源26 个数值型性状相关性分析
Fig.1 Correlation analysis of 26 quantitative traits in 62 hawthorn germplasm resources
数值型性状详见表4。**p<0.01;*p<0.05。
Quantitative traits have been presented in Table 4.**p<0.01;*p<0.05.
2.2 山楂种质资源数值型性状聚类分析
2.2.1 R 型聚类分析 如图2 所示,在欧式距离12处可将62份山楂种质资源的26 个数值型性状分为4 类。第Ⅰ类包括果实可滴定酸含量、种子百核质量、果实百果质量、果实纵径、果实横径等9个性状,这些性状大多与果实有关。第Ⅱ类包括果实水分含量、花冠直径、淀粉含量、可食率、结果枝长度、叶片长度、叶片宽度7 个性状,这些性状大多与叶、花和果实有关。第Ⅲ类是与生物学特性相关的性状,包括种仁率、萌芽率、果枝指数、自然授粉结实率、单花序平均坐果数、单花序最多坐果数。第Ⅳ类大多与果实营养成分有关,包括果胶含量、Vc含量、可溶性糖含量、中母枝系数。R 型聚类分析的结果与相关性分析结果相吻合,即分成的4类中,每一类群中的各指标间均呈显著或极显著相关。
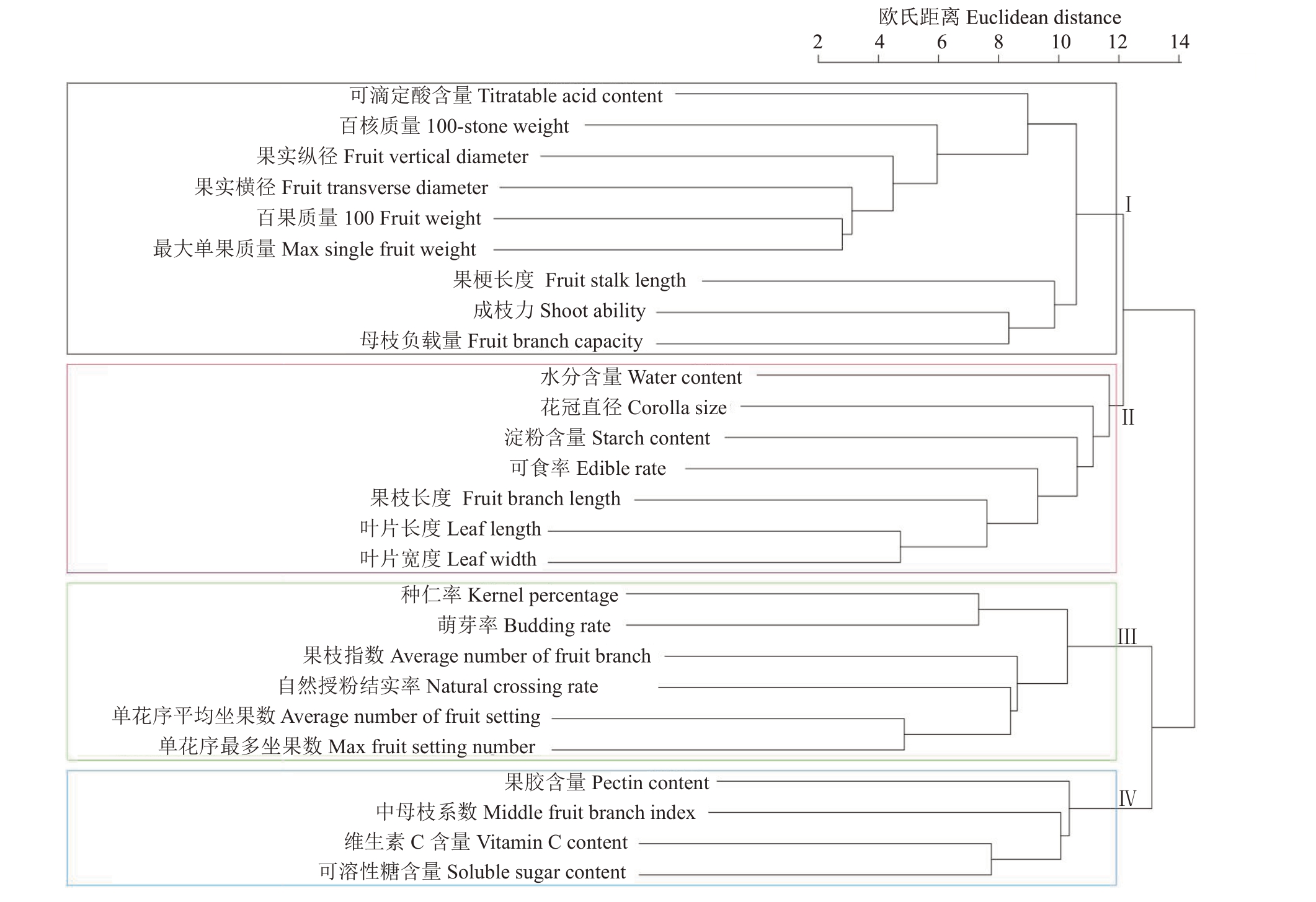
图2 62 份山楂26 个数值型性状R 型聚类分析
Fig.2 The dendrogram R cluster analysis of 26 quantitative traits in 62 hawthorn germplasm
2.2.2 离差平方和法聚类分析 如图3 所示,基于数值型性状的离差平方和法聚类,在欧式距离20处将62份山楂种质资源分成了3大类群。

图3 62 份山楂种质资源基于数值型性状的Ward 聚类分析
Fig.3 Ward cluster analysis based on quantitative traits of 62 hawthorn germplasm resources
数字代表种质资源编号同表1。下同。
The number represents the code of germplasm resources same Table 1.The same below.
第Ⅰ类群包括左伏1 号、204(A)、红肉伏里红、二乙子等14 个品种,其主要特征是叶片较小,平均叶片长度8.9 cm、叶片宽度9 cm,低于其他两个类群。果实较小,平均单果质量为5.2 g,果实横径1.8 cm、果实纵径2.0 cm。种仁率高于其他两个类群,平均种仁率为57%。Vc 含量低于其他类群,平均为49 mg·100 g-1。单花序平均坐果数较多,为9.5个。综合各性状,该类群各种质果实和叶片都较小,单花序平均坐果数较多,果实味酸稍甜。
第Ⅱ类群包括山东大棉球、临汾大金星、大糖球、艳果红等21个品种,其主要特征是叶片大,平均叶片长度10.1 cm、叶片宽度10.1 cm,高于其他两个类群。果实大,平均单果质量13.7 g,平均果实横径2.5 cm、纵径2.7 cm,在3 个类群中最大。平均种仁率为19.5%,低于其他类群。成枝力和母枝负载量高于其他类群,平均成枝力为53%,平均母枝负载量为101 g。单花序坐果数和Vc含量在3个类群中居中,单花序平均坐数为7.6 个,平均Vc 含量为61.6%。综合各性状,此类群各种质具有果实大、叶片大、平均坐果数较少、果实糖和Vc含量高等特性。
第Ⅲ类群包括燕瓤红、卧龙岗2 号、早红、豫北红等27 个品种,其主要特征是度较大,平均叶片长9.5 cm、叶片宽度9.5 cm,在3个类群中居中。果实较大,平均单果质量12.3 g,平均果实横径2.5 cm、纵径2.5 cm,低于第Ⅱ类群。种仁率低于第Ⅰ类群,平均种仁率为19.6%。单花序平均坐果数为6个,低于其他类群。Vc 含量在3 个类群中最高,平均为79.4 mg·100 g-1,75%的品种的Vc含量都超过了84%。综合各性状,第Ⅲ类群叶片和果实较大,单花序平均坐果数相较其他两类少,Vc含量是3个类群中最高的。
2.3 山楂种质资源数值型性状的主成分分析
对山楂种质资源的26 个数值型性状进行主成分分析,结果(表5)表明,前8 个主成分的特征值均大于1,以此作为主成分筛选的依据,共得到8 个主成分,它们的特征值分别为7.459 8、4.191 0、2.008 7、1.482 4、1.376 7、1.232 5、1.154 3、1.069 1,累计贡献率为76.825%,已包含了绝大多数表型性状的信息,可认为该8 个主成分可反映62 份山楂种质26 个数值型性状的主要特征信息。
表5 62 份山楂种质资源数值型性状的主成分分析
Table 5 Principal component analysis of quantitative traits of 62 hawthorn germplasm resources

注:下划线表示每组选取特征向量绝对值最大的2 个值,以反映其对应数值型性状的贡献率。
Note:The underline indicates that each group selects the two largest values of the absolute value of the eigenvector to reflect the contribution rate of its corresponding quantitative trait.
性状Trait叶片长度Leaf length(LL)/cm叶片宽度Leaf width(LW)/cm花冠直径Corolla size(CS)/cm百果质量100-fruit weight(100 FW)/g最大单果质量Max single fruit weight(MSFW)/g果实纵径Fruit vertical diameter(FVD)/cm果实横径Fruit transverse diameter(FTD)/cm果梗长度Fruit stalk length(FSL)/cm可食率Edible rate(ER)/%种仁率Kernel percentage(KP)/%百核质量100-stone weight(100 SW)/g萌芽率Budding rate(BR)/%成枝力Shoot ability(SA)/%自然授粉结实率Natural crossing rate(NCR)/%单花序平均坐果数Average number of fruit setting(ANFS)单花序最多坐果数Max fruit setting number(MFSN)果枝长度Fruit branch length(FBL)/cm果枝指数Average number of fruit branch(ANFB)中母枝系数Middle fruit branch index(MFBI)母枝负载量Fruit branch capacity(FBC)/g w(维生素C)Vitamin C content(Vc)/(mg·100 g-1)w(可溶性糖)Soluble sugar content(SS)/%w(可滴定酸)Titratable acid content(TA)/%w(果胶)Pectin content(P)/%w(淀粉)Starch content(S)/%w(水分)Water content(W)/%特征值Eigen value贡献率Contributive percentage/%累计贡献率Total percentage/%主成分Principal component PC1 0.259 8 0.229 7 0.102 9 0.801 1 PC2 0.108 5 0.196 8 0.007 4 0.022 1 PC3 0.258 3 0.302 7 0.009 0 0.028 3 PC4 0.074 4 0.065 3 0.035 2 0.025 0 PC5 0.076 6 0.041 6 0.0007 0.022 1 PC6 0.000 1 0.021 9 0.300 0 PC7 0.057 3 0.000 4 0.329 9 0.005 4 0.000 2 PC8 0.003 6 0.000 0 0.005 6 0.006 7 0.892 2 0.002 0 0.023 4 0.012 3 0.000 6 0.000 6 0.000 1 0.000 6 0.794 2 0.008 4 0.044 4 0.000 0 0.007 7 0.009 4 0.002 1 0.009 9 0.826 0 0.002 3 0.252 0 0.558 1 0.565 3 0.618 5 0.072 6 0.002 7 0.227 1 0.000 8 0.028 1 0.071 0 0.026 7 0.355 2 0.024 6 0.113 8 0.076 0 0.011 9 0.135 1 0.037 1 0.007 4 0.025 9 0.010 7 0.013 0 0.001 6 0.005 2 0.005 1 0.019 4 0.012 7 0.005 4 0.019 8 0.023 8 0.000 6 0.001 9 0.000 3 0.000 2 0.080 1 0.117 7 0.060 5 0.009 9 0.002 2 0.092 3 0.000 0 0.123 8 0.063 9 0.018 1 0.038 1 0.009 1 0.133 3 0.006 1 0.016 8 0.215 1 0.015 8 0.006 7 0.006 4 0.001 1 0.050 8 0.476 4 0.081 7 0.009 3 0.006 1 0.002 7 0.015 3 0.041 3 0.294 5 0.461 1 0.001 5 0.017 7 0.062 8 0.004 6 0.000 4 0.006 2 0.224 8 0.337 7 0.000 5 0.008 6 0.132 7 0.039 1 0.002 3 0.053 1 0.347 1 0.029 5 0.144 2 0.058 4 0.007 6 0.024 1 0.008 5 0.000 6 0.084 2 0.008 2 0.207 3 0.121 2 0.138 1 0.211 1 0.230 0 0.069 2 0.055 0 0.070 4 0.032 0 0.022 6 0.022 2 0.016 1 0.022 3 0.212 5 0.073 5 0.011 3 0.060 4 0.161 1 0.113 2 0.018 9 0.000 2 1.069 1 4.111 9 76.825 0 0.096 4 0.116 8 0.008 8 0.203 5 0.029 1 0.017 4 0.003 6 7.459 8 28.691 6 28.691 6 0.480 4 0.226 3 0.458 7 0.004 5 0.174 0 0.151 3 0.005 8 4.191 0 16.119 2 44.810 8 0.003 7 0.063 8 0.059 6 0.083 1 0.009 6 0.006 0 0.133 7 2.008 7 7.725 6 52.536 4 0.026 0 0.134 2 0.195 2 0.005 2 0.072 2 0.001 1 0.000 3 0.222 1 0.002 8 0.081 1 0.016 9 0.106 7 0.013 7 0.176 7 0.398 3 0.098 9 0.004 6 0.366 6 0.002 9 1.376 7 5.295 1 63.533 1 0.010 9 0.002 8 0.003 2 0.053 9 0.069 7 0.000 7 0.266 2 1.482 4 5.701 6 58.238 0 1.232 5 4.740 6 68.273 6 0.007 3 0.004 8 1.154 3 4.439 4 72.713 1
其中PC1贡献率达到了28.691 6%,根据特征向量绝对值大小得出,起决定作用的有最大单果质量、百果质量、果实纵径、果实横径等性状,主要反映果实大小因子;PC2 贡献率为16.119 2%,起决定作用的有母枝负载量、自然授粉结实率、单花序平均坐果数性状,主要反映果实产量因子;PC3 贡献率为7.7256%,起决定作用的有叶片宽度、叶片长度等性状,主要反映叶片大小因子;PC4贡献率为5.701 6%,起决定作用的有果实水分含量和果枝指数等性状,同样反映果实产量因子;PC5贡献率为5.295 1%,起决定作用的有淀粉、糖、Vc含量等性状,主要反映果实营养成分因子;PC6贡献率为4.740 6%,起决定作用的有花冠直径和果实水分含量等性状,主要反映花的性状因子;PC7贡献率为4.439 4%,起决定作用的有花冠直径、果胶等性状,同样反映花性状和果实营养成分因子;PC8贡献率为4.111 9,起决定作用的有可食率和中母枝系数,主要反映果实品质和产量因子。每个主成分按照特征向量绝对值由高到低选取2 个指标,前8 个主成分包括重复指标共筛选出14 个有代表性指标,分别是最大单果质量、果实横径、母枝负载量、单花序平均坐果数、叶片宽度、叶片长度、果实水分含量、果枝指数、淀粉含量、可溶性糖含量、花冠直径、果胶含量、可食率和中母枝系数,可作为山楂种质资源评选和选育鉴定工作的重要指标。
绘制不同种质主成分值样点图(图4)。图4 揭示了不同山楂种质之间的差异,其中类群Ⅰ主要分布于原点左侧,主要体现了第1主成分果实大小等性状特征,其果实、叶片均小于其他2个类群;类群Ⅱ各种质资源主要分布于原点上方,主要体现了第2主成分叶片大小等性状特征,其叶片在3个类群中最大;类群Ⅲ各种质资源主要分布在原点下方,主要体现了叶片和果实较大、可溶性糖和Vc含量高的特征。

图4 62 份山楂种质资源二维主坐标样点图
Fig.4 Principal coordinate two-dimensional plot of 62 hawthorngermplasm resources
Cos2 表示余弦的平方。数值表示样本与原点组成夹角的余弦值的平方。
Cos2.Squared cosine.The value means the squared cosine value of angle formatted by the sample and the origin of coordinates.
3 讨 论
3.1 山楂种质资源表型性状多样性
植物的表型性状具有直观、便于调查等特点,是种质资源性状多样性评价的主要特征指标,它是遗传因素与环境因素综合作用呈现出来的,反映了植物自身遗传因素与外部生活环境相互作用的结果,形态特征变化能反映遗传变异规律,形态特征的变异也具有适应环境的意义[29-32]。现代分子生物学技术的发展,使得分子标记技术在植物遗传多样性鉴定中的应用越来越广泛[33-35],但仍要与表型性状结合起来[14,16,35],表型性状遗传多样性不仅能反映表型遗传多样性的丰富程度,而且为分子生物学研究提供可靠的表型数据[14,17]。因此,在掌握种质资源表型性状多样性的基础上,结合分子生物学技术,可进一步进行种质创新,挖掘优异资源,为育种工作服务[15,35-36]。
本研究中选取62 份保存于北京市农林科学院林业果树研究所山楂资源圃的山楂种质资源,调查测定了48 个表型性状,涉及叶片、枝条、果实、种子等,内容较为全面系统,能够准确地评价62 份山楂种质资源的表型性状多样性。通过对22 个描述型表型性状进行Shannon-Wiener 信息指数H 和Simpson 遗传多样性指数D 分析,H 变化范围0.285 0~1.608 7,D 变化范围0.202 7~0.764 4,表明山楂种质资源在叶片、枝条、果实、种子等方面变异类型多、程度高、幅度大,存在丰富的表型遗传多样性。
表型性状变异是物种遗传变异的表现形式[13-14,37],变异系数(CV)通常被用作表征种质间遗传差异的主要指标,能够反映表型性状的离散程度以及在种质间的变异程度[14,38],还能够间接反映个体的表型多样性丰富程度。一般而言,遗传背景丰富的性状变异系数也较大,对进行种质鉴定评价有很好的参考意义[15,39]。本研究的62份山楂种质资源26个数值型性状中,变异系数为5.85%~79.91%,其中种仁率变异系数最大,可食率和果实水分含量变异系数较小,这与赵玉辉等[40]的研究结果一致。本研究所涉及的数值性状中,可食率、单果质量、百核质量、叶片宽度、叶片长度的变异系数依次降低,该结果与劳永春[41]的研究结果一致。
3.2 基于山楂种质表型性状多样性的综合评价
已有诸多研究利用主成分分析进行种质表型性状评价探讨[12,14-15,17],而主成分分析所筛选出的性状指标往往可通过对种质的聚类分析分组情况进行验证。本研究中,提取的8 个主成分所涵盖的性状有所差异,其所包含的表型性状因子可以作为山楂种质创新和亲本选择的主要性状指标。聚类分析是对研究对象的观察指标进行聚类,是对各性状间的关系进行讨论,从而得出其相关性,分类后可评价性状间的关联性,验证相关性分析和主成分分析结果,简化种质资源的筛选、评价指标。从R 型聚类树状图可以看出,在欧式距离12处可将26个山楂种质资源数值型性状分为4类。每一类群下各性状相关性较强,逻辑相关的有单果质量与果实纵横径、种仁率与自然授粉结实率、果枝指数与单花序平均坐果数等,相关性状之间存在必然联系,这与相关性分析的结果是相吻合的。在相关性分析、主成分分析的基础上,综合运用山楂表型性状的数值型性状对种质进行聚类,可将遗传距离较近、亲缘关系相似的种质从众多遗传背景复杂的种质中区分出来。本研究利用26 个数值型性状对62 份山楂种质资源进行聚类分析,得到3 个类群,初步明确了各类群特征,可以据此得到每个类群在育种中的利用价值。其中第Ⅰ类可用于选育种仁率高、坐果数多的品种;第Ⅱ类可用于选育丰产、可食率高、含糖量高的品种;第Ⅲ类可用于选育果大、Vc含量高的品种。
4 结 论
不同山楂种质表型性状差异较大,存在丰富的表型性状多样性。基于数值型性状的离差平方和法聚类,62份山楂种质可分为3个类群,初步明确了各类群特征,可以据此得到每个类群在育种中的利用价值。前8个主成分包括重复指标共筛选出14个代表性指标,分别是最大单果质量、果实横径、母枝负载量、单花序平均坐果数、叶片宽度、叶片长度、果实水分含量、果枝指数、淀粉含量、可溶性糖含量、花冠直径、果胶含量、可食率和中母枝系数,可作为山楂种质资源评价和选育鉴定工作的重要指标。
[1] 赵焕谆,丰宝田.中国果树志:山楂卷[M].北京:中国林业出版社,1996.ZHAO Huanzhun,FENG Baotian.Chinese fruit tree:Hawthorn[M].Beijing:China Forestry Publishing House,1996.
[2] 董文轩.中国果树科学与实践:山楂[M].西安:陕西科学技术出版社,2015.DONG Wenxuan.Chinese fruit tree science and practice:Hawthorn[M].Xi’an:Shaanxi Science and Technology Press,2015.
[3] XU J Y,ZHAO Y H,ZHANG X,ZHANG L J,HOU Y L,DONG W X.Transcriptome analysis and ultrastructure observation reveal that hawthorn fruit softening is due to cellulose/hemicellulose degradation[J].Frontiers in Plant Science,2016,7:1524.
[4] ZHENG G Q,DENG J,WEN L G,YOU L J,ZHAO Z G,ZHOU L.Release of phenolic compounds and antioxidant capacity of Chinese hawthorn“Crataegus pinnatifida”during in vitro digestion[J].Journal of Functional Foods,2018,40:76-85.
[5] 胡景辉,高露,雷雅坤,刘宁,李树仁,孙丽敏.河北省药食同源山楂产业发展路径及对策研究[J].华北农学报,2018,33(S):285-290.HU Jinghui,GAO Lu,LEI Yakun,LIU Ning,LI Shuren,SUN Limin.Study on the development path and countermeasures of medicinal and edible hawthorn industry in Hebei province[J].Acta Agriculturae Boreali-Sinica,2018,33(S):285-290.
[6] 魏树伟,王少敏,董冉,冉昆.山东省山楂产业现状、存在问题及对策[J].北方果树,2021(4):53-54.WEI Shuwei,WANG Shaomin,DONG Ran,RAN Kun.Present situation,existing problems and countermeasures of hawthorn industry in Shandong province[J].Northern Fruits,2021(4):53-54.
[7] 张育明,辛孝贵.山楂资源性状鉴定评价和优异种质筛选的研究[J].沈阳农业大学学报,1996,27(1):60-64.ZHANG Yuming,XIN Xiaogui.Characters identification and evaluation of Crataegus resources and screening of superior germplasms[J].Journal of Shenyang Agricultural University,1996,27(1):60-64.
[8] 齐秀娟,李作轩,徐善坤.山楂果实中可溶性糖与果皮色素的关系[J].果树学报,2005,22(1):81-83.QI Xiujuan,LI Zuoxuan,XU Shankun.Relationship between soluble sugars and peel pigments in hawthorn fruit[J].Journal of Fruit Science,2005,22(1):81-83.
[9] MA S L Y,LU Y M.Classification and phylogenetic analysis of Chinese hawthorn assessed by plant and pollen morphology[J/OL].Genetics and Molecular Research,2016,15(3):15038739.DOI:10.4238/gmr.15038739.
[10] SHENG F,CHEN S Y,TIAN J,LI P,QIN X,WANG L,LUO S P,LI J.Morphological and ISSR molecular markers reveal genetic diversity of wild hawthorns (Crataegus songorica K.Koch.)in Xinjiang,China[J].Journal of Integrative Agriculture,2017,16(11):2482-2495.
[11] DU X,ZHANG X,BU H D,ZHANG T C,LAO Y C,DONG W X.Molecular analysis of evolution and origins of cultivated hawthorn(Crataegus spp.)and related species in China[J].Frontiers in Plant Science,2019,10:443.
[12] 李清,郭禄芹,方晓霞,胡倩梅,杨世超,刘东明,杨路明,马长生.100 份西瓜种质果实品质相关性状的遗传多样性分析[J].中国瓜菜,2019,32(1):12-17.LI Qing,GUO Luqin,FANG Xiaoxia,HU Qianmei,YANG Shichao,LIU Dongming,YANG Luming,MA Changsheng.Genetic diversity analysis of fruit related traits of 100 watermelon germplasms[J].China Cucurbits and Vegetables,2019,32(1):12-17.
[13] 张静,白瑞,贾莹,温仕达,郎小平,许小勇.番茄种质资源的多样性和聚类分析[J].中国瓜菜,2018,31(2):11-14.ZHANG Jing,BAI Rui,JIAYing,WEN Shida,LANG Xiaoping,XU Xiaoyong.Diversity and cluster analysis of tomato germplasm resources[J].China Cucurbits and Vegetables,2018,31(2):11-14.
[14] 林存学,杨晓华,刘海荣.东北寒地96 份李种质资源表型性状遗传多样性分析[J].园艺学报,2020,47(10):1917-1929.LIN Cunxue,YANG Xiaohua,LIU Hairong.Genetic diversity analysis of 96 plum germplasm resources by phenotypic traits in northeast cold area[J].Acta Horticulturae Sinica,2020,47(10):1917-1929.
[15] 张斌斌,蔡志翔,沈志军,严娟,马瑞娟,俞明亮.观赏桃种质资源表型性状多样性评价[J].中国农业科学,2021,54(11):2406-2418.ZHANG Binbin,CAI Zhixiang,SHEN Zhijun,YAN Juan,MA Ruijuan,YU Mingliang.Diversity analysis of phenotypic characters in germplasm resources of ornamental peaches[J].Scientia Agricultura Sinica,2021,54(11):2406-2418.
[16] 赫卫,张慧.基于表型性状和SRAP 标记的观赏用辣椒种质资源遗传多样性分析[J].中国瓜菜,2022,35(1):16-23.HE Wei,ZHANG Hui.Analysis of genetic diversity of pepper germplasm resources for ornamental based on phenotypic traits and SRAP markers[J].China Cucurbits and Vegetables,2022,35(1):16-23.
[17] 孙珍珠,李秋月,王小柯,赵婉彤,薛杨,冯锦英,刘小丰,刘梦雨,江东.宽皮柑橘种质资源表型多样性分析及综合评价[J].中国农业科学,2017,50(22):4362-4383.SUN Zhenzhu,LI Qiuyue,WANG Xiaoke,ZHAO Wantong,XUE Yang,FENG Jinying,LIU Xiaofeng,LIU Mengyu,JIANG Dong.Comprehensive evaluation and phenotypic diversity analysis of germplasm resources in mandarin[J].Scientia Agricultura Sinica,2017,50(22):4362-4383.
[18] BIGARD A,BERHE D T,MAODDI E,SIRE Y,BOURSIQUOT J,OJEDA H,PEROS J,DOLIGEZ A,ROMIEU C,TORREGROSA L. Vitis vinifera L.fruit diversity to breed varieties anticipating climate changes[J].Frontiers in Plant Science,2018,9:455.
[19] MANCO R,BASILE B,CAPUOZZO C,SCOGNAMIGLIO P,FORLANI M,RAO R,CORRADO G.Molecular and phenotypic diversity of traditional European plum (Prunus domestica L.)germplasm of southern Italy[J].Sustainability,2019,11(15):4112.
[20] CAMPBELL D R.Using phenotypic manipulations to study multivariate selection of floral trait associations[J].Annals of Botany,2009,103(9):1557-1566.
[21] 姜英林,董文轩.山楂种质资源的表型多样性研究[J].北方果树,2009(1):8-10.JIANG Yinglin,DONG Wenxuan.Diversity analysis of morphological characters in hawthorn germplasm resources[J].Northern Fruits,2009(1):8-10.
[22] 孟庆杰,王光全.山楂种质果实营养成分分析及其资源利用研究[J].河北农业大学学报,2005,28(1):21-23.MENG Qingjie,WANG Guangquan.Studies on the composition of fruit nutrition matters and make use of resources in hawthorn germplasm[J].Journal of Agricultural University of Hebei,2005,28(1):21-23.
[23] 赵玉辉,王岗,苏凯,董文轩,郭印山.山楂种质资源遗传多样性的SRAP 分析[J].分子植物育种,2014,12(6):1281-1287.ZHAO Yuhui,WANG Gang,SU Kai,DONG Wenxuan,GUO Yinshan.Genetic diversity of hawthorn germplasms analyzed by SRAP markers[J].Molecular Plant Breeding,2014,12(6):1281-1287.
[24] 董文轩,吕德国,熊兴平,赵玉辉,江用文,高秀岩,马怀宇,秦嗣军,杜国栋.山楂种质资源描述规范[M].北京:中国农业出版社,2017.DONG Wenxuan,LÜ Deguo,XIONG Xingping,ZHAO Yuhui,JIANG Yongwen,GAO Xiuyan,MA Huaiyu,QIN Sijun,DU Guodong.Descriptors for hawthorn germplasm resources[M].Beijing:China Agriculture Press,2017.
[25] 李灿,胡田田,吴勇,钟永红,罗利华,张绍武.滴灌施肥技术参数对苹果品质的影响及综合评价[J].果树学报,2021,38(4):497-508.LI Can,HU Tiantian,WU Yong,ZHONG Yonghong,LUO Lihua,ZHANG Shaowu.Effects of drip fertigation technical parameters on apple fruit quality and comprehensive evaluation[J].Journal of Fruit Science,2021,38(4):497-508.
[26] 张英楠,陈曦,赵南晰,张成义.毛樱桃果胶的提取及含量测定[J].北华大学学报(自然科学版),2018,19(3):323-326.ZHANGYingnan,CHEN Xi,ZHAO Nanxi,ZHANG Chengyi.Extraction and determination of pectin from Cerasus tomentosa[J].Journal of Beihua University (Natural Science),2018,19(3):323-326.
[27] 张博华,张明,杨立风,门庆永,陈彩霞,王崇队,马超.膳食纤维的提取及其在食品中的应用研究[J].中国果菜,2019,39(4):1-5.ZHANG Bohua,ZHANG Ming,YANG Lifeng,MEN Qingyong,CHEN Caixia,WANG Chongdui,MA Chao.Research progress of dietary fiber extraction and its application in food industry[J].China Fruit&Vegetable,2019,39(4):1-5.
[28] 马宏飞,卢生有,韩秋菊,李薇.紫外分光光度法测定五种果蔬中维生素C 的含量[J].化学与生物工程,2012,29(8):92-94.MA Hongfei,LU Shengyou,HAN Qiuju,LI Wei.Determination of vitamin C content in five kinds of fruits and vegetables by UV spectrophotometry[J].Chemistry & Bioengineering,2012,29(8):92-94.
[29] COSMULESCU S,STEFANESCU D.Morphological variation among Persian walnut(Juglans regia)genotypes within the population and depending on climatic year[J].Scientia Horticulturae,2018,242:20-24.
[30] MAHMOODI R,DADPOUR M R,HASSANI D,ZEINALABEDINI M,VENDRAMIN E,MICALI S,NAHANDI F Z.Development of a core collection in Iranian walnut (Juglans regia L.) germplasm using the phenotypic diversity[J].Scientia Horticulturae,2019,249:439-448.
[31] 白羿雄,郑雪晴,姚有华,姚晓华,吴昆仑.青稞种质资源表型性状的遗传多样性分析及综合评价[J].中国农业科学,2019,52(23):4201-4214.BAI Yixiong,ZHENG Xueqing,YAO Youhua,YAO Xiaohua,WU Kunlun.Genetic diversity analysis and comprehensive evaluation of phenotypic traits in hulless barley germplasm resources[J].Scientia Agricultura Sinica,2019,52(23):4201-4214.
[32] 邓凤彬,罗立新,虎海防,欧阳叶青,袁雨婷,张锐.新疆野核桃坚果表型性状多样性分析[J].果树学报,2018,35(3):275-284.DENG Fengbin,LUO Lixin,HU Haifang,OUYANG Yeqing,YUAN Yuting,ZHANG Rui.Analysis of phenotypic diversity of nuts in wild walnut (Juglans cathayensis Dode) in Xinjiang[J].Journal of Fruit Science,2018,35(3):275-284.
[33] 高源,刘凤之,王昆,王大江,龚欣,刘立军.苹果部分种质资源分子身份证的构建[J].中国农业科学,2015,48(19):3887-3898.GAO Yuan,LIU Fengzhi,WANG Kun,WANG Dajing,GONG Xin,LIU Lijun.Establishment of molecular ID for some apple germplasm resources[J].Scientia Agricultura Sinica,2015,48(19):3887-3898.
[34] 张枭,杜潇,孙馨宇,王键,董文轩.利用SSR 标记构建部分山楂资源的基因身份证[J].沈阳农业大学学报,2021,52(2):153-159.ZHANG Xiao,DU Xiao,SUN Xinyu,WANG Jian,DONG Wenxuan.Construction of molecular identity for partial Crataegus resources basedon SSR markers[J].Journal of Shenyang Agricultural University,2021,52(2):153-159.
[35] 宗宇,王月,朱友银,邵姁,李永强,郭卫东.基于中国樱桃转录组的SSR 分子标记开发与鉴定[J].园艺学报,2016,43(8):1566-1576.ZONG Yu,WANG Yue,ZHU Youyin,SHAO Xu,LI Yongqiang,GUO Weidong.Development and validation of SSR markers based on transcriptomic data of Chinese cherry(Prunus pseudocerasus)[J].Acta Horticulturae Sinica,2016,43(8):1566-1576.
[36] PENG L,RU M,WANG B Q,WANG Y,LI B,YU J,LIANG Z S.Genetic diversity assessment of a germplasm collection of Salvia miltiorrhiza Bunge.based on morphology,ISSR and SRAP markers[J].Biochemical Systematics and Ecology,2014,55(2):84-92.
[37] 刁松锋,邵文豪,姜景民,董汝湘,孙洪刚.基于种实性状的无患子天然群体表型多样性研究[J].生态学报,2014,34(6):1451-1460.DIAO Songfeng,SHAO Wenhao,JIANG Jingmin,DONG Ruxiang,SUN Honggang.Phenotypic diversity in natural populations of Sapindus mukorossi based on fruit and seed traits[J].Acta Ecologica Sinica,2014,34(6):1451-1460.
[38] 童跃伟,唐杨,陈红,张涛,左江,吴健,周莉,周旺明,于大炮,代力民.红松种子园种群表型多样性研究[J].生态学报,2019,39(17):6341-6348.TONG Yuewei,TANG Yang,CHEN Hong,ZHANG Tao,ZUO Jiang,WU Jian,ZHOU Li,ZHOU Wangming,YU Dapao,DAI Limin.Phenotypic diversity of Pinus koraiensis populations in a seed orchard[J].Acta Ecologica Sinica,2019,39(17):6341-6348.
[39] ALIZADEH K,FATHOLAHI S,DA SILVA J A T.Variation in the fruit characteristics of local pear(Pyrus spp.)in the Northwest of Iran[J].Genetic Resources and Crop Evolution,2015,62(5):635-641.
[40] 赵玉辉,王岗,苏凯,董文轩,郭印山.山楂种质资源种核性状与果实性状的相关性研究[J].北方园艺,2014(19):1-4.ZHAO Yuhui,WANG Gang,SU Kai,DONG Wenxuan,GUO Yinshan.Study on the correlation between the traits of seed and fruit of hawthorn (C. pinnatifida Bge.) germplasm resource[J].Northern Horticulture,2014(19):1-4.
[41] 劳永春.山楂属种质资源形态学评价及疑似资源鉴定[D].沈阳:沈阳农业大学,2019.LAO Yongchun.Morphological evaluation of hawthorn germplasm resources and identification of suspected resources[D].Shenyang:Shenyang Agricultural University,2019.