苹果(Malus domestica)是世界上重要的栽培果树。2021 年12 月21 日联合国粮农组织(FAO,2020)发布的最新统计数据显示,2020 年我国苹果总产量约4050 万t,栽培面积约191 万hm2,分别占世界总产量和栽培面积的41.36%和46.85%,稳居世界第一。山东威海地理位置和自然条件得天独厚,十分适宜苹果栽培,辖区全部为原农业部确定的国家优势苹果栽培区,威海苹果于2007年即获得了国家地理标志商标[1]。果实成熟和衰老是一个伴随质量下降和造成采后损失的程序化过程[2],这个过程包括很多指标的变化,例如质地、风味和香气[3-5]。这些指标可通过测定果实大小、质量、可溶性固形物含量、可滴定酸含量、淀粉及挥发性物质来反映[6-8]。
采收时的成熟度是影响苹果品质和贮藏性的主要因素之一。在呼吸高峰采摘的果实是完全成熟并具有更好的感官质量[9],但其不易贮藏,在未销售前就会出现果实软化、果肉粉质等现象,严重影响其销售品质[10]。果实采摘过早会出现很小、颜色差、没有形成完整的风味。此外,采摘过早的果实在贮藏过程中患虎皮病和苦痘病等病害的风险更大[11]。因此,确定各个品种适宜的采收期具有重要的生产意义。
淀粉降解与果实的成熟和衰老过程密切相关。已有研究表明,淀粉降解可以为蔗糖产生和风味形成提供碳源[12-13]。发育的果实在树上利用光同化物以淀粉的形式积累碳水化合物,一旦从树体分离,淀粉就被用来为成熟和衰老的代谢过程提供可溶性糖[13]。此外,当在树上达到某个成熟阶段时,淀粉会水解成可溶性碳水化合物[12]。从淀粉中释放的糖最终是葡萄糖、果糖和蔗糖,它们用于呼吸作用并增强成熟果实的甜味[14]。已有研究报道,淀粉指数和背景颜色是嘎拉苹果基于平均消费者偏好最佳收获日期的最佳预测指标[15]。在澳洲青苹苹果中,淀粉染色可以作为一个成熟指标[16]。因此,用碘-淀粉染色法判断苹果成熟度是一种简便可靠的有效方法[15,17-18]。
目前尚未建立威海地区金冠、威海金和烟富3号苹果适宜采收期确立的技术标准。因此,笔者以3个苹果品种金冠、威海金和烟富3号为试材,通过构建发育期果实的淀粉染色图谱,同时结合发育期果实硬度、可溶性固形物含量、乙烯的释放速率、呼吸速率、纵横径及电子鼻分析等测定指标以确定金冠、威海金和烟富3号适宜的采收期及建立采收参考标准。
1 材料和方法
1.1 材料
金冠、威海金和烟富3 号苹果采自山东省威海市新元果业有限公司。3 个品种苹果的施肥、灌溉等栽培条件一致,均未套袋。每个品种在果园不同的种植区域随机选取长势相似、树体健壮、无病虫害苹果树,挂牌标记。于2020 年7 月31 日至11 月10日,每次采收间隔10 d,直至果实淀粉基本水解完为止。采收分别从每株苹果树随机采摘果个大小均匀的果实,当天带回实验室备用。
1.2 果实硬度的测定
根据Lu 等[19]的方法,使用CT3 质构分析仪(Brookfield,USA)测量硬度(11 mm 直径探头)。选取果实赤道部4个等距点测定。果实去皮1 mm,测量速度为1 mm·s-1,深度为10 mm。每个品种选取10个果实作为重复,每隔10 d进行1次测定。
1.3 果实乙烯释放速率的测定
参照Lu 等[19]方法,对采摘回实验室的3 个不同品种的苹果果实进行乙烯释放速率测定。每个品种选取9个果实,3个果实1组,3次重复,分别放置于3个密闭容器中1 h,抽取1 mL 气体样品注入GC-2010气相。
1.4 果实呼吸速率的测定
果实呼吸速率依照Wang 等[20]的方法,采用CAMBO 580CO2 分析仪(意大利)对样品进行测定。计算公式为:
呼吸速率=(C1-C0)/W·t。
式中:C1为测定时CO2释放量(mg),C0为初始测定CO2释放量(mg),W为鲜果质量(kg),t为测定时间(h)。
1.5 果实可溶性固形物(SSC)含量的测定
果实可溶性固形物含量应用数显手持糖度仪ATAGO PAL-1(日本)测定,果实赤道部位去果皮后果肉榨汁,每个果实4次重复,每次测定5个果实。
1.6 果实纵横径的测定
果实纵横径采用游标卡尺测量,每个品种随机取10个具有代表性的果实。
1.7 果实电子鼻测定
采用Analytics GmbH Portable Electronic Nose P/N510033 S/N 33193 PEN3(便携式电子鼻,德国)对3 个不同品种的苹果果实进行电子鼻测定,每个品种选取5个果实,分别单个放置于1 L烧杯中用保鲜膜封口,室温静置1 h,待样品挥发的气体达到平衡后用电子鼻检测,每个品种分别有5次重复。
电子鼻测定条件:传感器清洗时间为60 s,传感器归零时间为10 s,样品准备时间为5 s,分析采样时间为100 s,内部流量40 mL·min-1,进样流量200 mL·min-1。
1.8 淀粉图谱的制作
1.8.1 碘-碘化钾溶液配制 准确称取4.4 g 碘化钾,量取15 mL预热的蒸馏水搅拌使之完全溶解;再称取1.1 g 结晶,加入到已溶解的碘化钾溶液中,充分振荡至完全溶解,用蒸馏水定容至500 mL,并罐装于棕色瓶封闭,避光存放备用。
1.8.2 染色方法 将配制好的碘-碘化钾溶液倒入玻璃培养皿内,溶液深度为5~8 mm,把果实从中间横切,将带有果柄端的果实横切面浸入碘-碘化钾溶液中,计时1 min后取出。并拍照记录,用于之后淀粉染色图板的制作。
1.8.3 淀粉染色图谱制作 染色图谱共分为8个等级,从保留的样品图谱中选择8个有代表性的图谱,根据果实横切面染色程度,按照由浅到深、染色范围由大到小分为1~8 个等级。用Photoshop 制图软件制作出金冠、烟富3 号和威海金苹果的淀粉染色图谱。
1.9 数据处理
使 用Microsoft excel 和GraphPad Prism 8 进 行数据处理和作图;使用SPSS软件进行差异显著性分析;线性判别式分析使用软件为电子鼻设备自带Winmuster分析软件。
2 结果与分析
2.1 3个苹果品种淀粉染色图谱
如图1 所示,在果实发育早期,3 个品种果实横切面除果心部位外均被染成蓝黑色,随着成熟度逐渐增加,果实横切面染色面积逐渐缩小,染色程度逐渐变浅。3个苹果品种的果实在不同发育阶段染色部位均从果心向外颜色逐渐变浅,由此可得出淀粉的水解部位是从果心逐渐向外扩散的。其中,金冠在7月31日至8月31日即染色等级1~4时果实染色面积未出现明显变化,染色逐渐变浅,在9月10日染色面积减小至约80%,由果心向果皮变浅,并且在9月30日即染色等级7时染色面积大约占整个切面的20%,在10月10日即等级8时果实已经无法着色,金冠的变化趋势与何婉茹等[16]研究结果一致;烟富3号在8月20日至8月31日即染色等级1~2时果实染色面积未出现变化,9月10日即染色等级3时染色面积开始减小,同样由果心向果皮染色变浅,10月20日即等级7时染色面积减小至大约占横切面的10%,10月30日即染色等级8时果实染色面积趋于0;威海金苹果在8月20日至8月31日果实染色面积未出现变化,染色开始变浅,9月10日开始果实染色面积出现明显变化,染色面积缩小,由果心向果皮染色变浅,10月30日即等级7时染色面积大约占整个横切面的10%,11 月10 日即染色等级为8 时果实染色面积趋于0。这些结果说明,果实淀粉染色图谱可以科学客观地反映3个品种苹果果实成熟的进程。

图1 苹果果实切面淀粉染色图谱
Fig.1 Starch iodine staining pattern of apple fruit section
2.2 3个苹果品种发育阶段相关指标测定与分析
3个苹果品种发育阶段果实纵横径均呈上升趋势,在后期趋于平稳(图2~3)。其中,金冠果实纵径在9 月30 日达到最大值,果实横径在9 月30 日左右达到最大值(图3-A,B);威海金果实纵径和横径均在10月30日达到最大值(图3-C,D);烟富3号果实纵径和横径均在10 月20 日达到最大值(图3-E,F)。3个品种果实硬度整体呈下降趋势(图4-A、C、E),在发育阶段末期均保持稳定。其中,金冠的果实硬度下降到9 月30 日后保持稳定(图3-A),威海金和烟富3号分别下降至10月30日和10月20日后保持稳定(图4-C、E)。

图2 3 个苹果品种发育阶段果实表型
Fig.2 Fruit phenotype of three apple cultivars during development stage
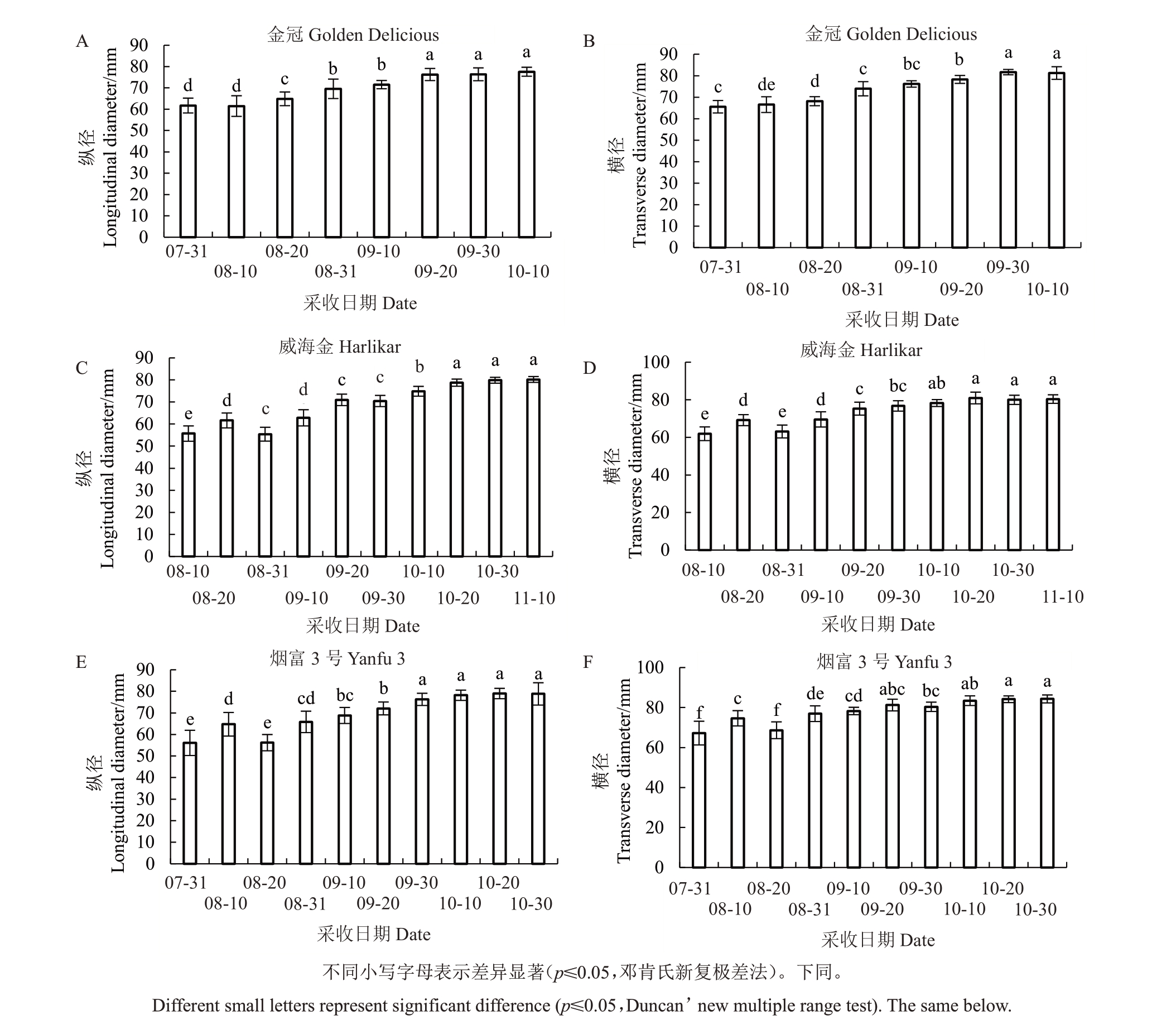
图3 3 个苹果品种发育阶段果实纵横径的变化
Fig.3 The changes of longitudinal and transverse diameter of fruit in threeapple cultivars during development

图4 3 个品种果实发育阶段硬度和可溶性固形物(SSC)的变化
Fig.4 The changes of fruit firmness and soluble solid contents(SSC)in three cultivarsduring fruit development
3 个苹果品种果实的SSC 整体呈上升趋势(图4-B、D、F)。金冠果实的SSC持续上升直至9月30日(图4-B);威海金果实的SSC 在10 月10 日迅速上升,持续上升直至11月10日(14.81%,图4-D);烟富3号果实的SSC在9月20日迅速上升至12.23%,随后缓慢增加至10 月20 日达到12.94%,9 月20 日至10月30日的SCC没有显著差异(p>0.05,图4-F)。
2.3 3个苹果品种发育阶段衰老相关指标的测定与分析
金冠、威海金和烟富3号的呼吸速率分别于8月20日、9月20日和8月20日出现呼吸高峰而后下降至趋于稳定(图5-A、C、E)。如图5-D~F 所示,3 个品种苹果的乙烯释放速率随着果实的成熟发育整体呈上升趋势。金冠的乙烯释放速率在7月31日至9月10日增长速率较为缓慢,9月20日显著上升(图5-B);威海金的乙烯释放速率8 月10 日至10 月20 日缓慢增长,于10月20日后显著上升(图5-D);烟富3号的乙烯释放速率整体呈上升趋势,至9 月30 以后趋于稳定(图5-F)。
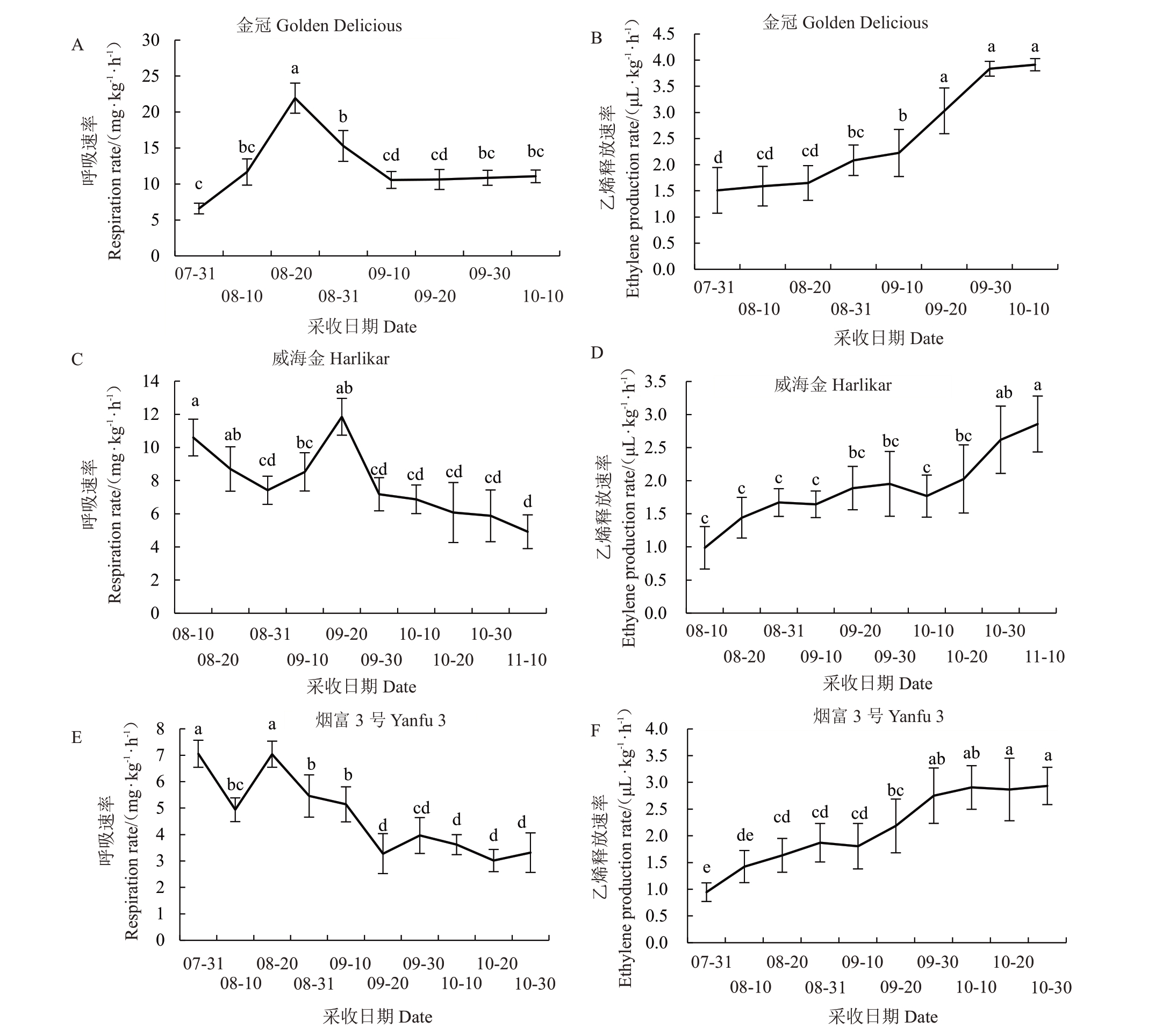
图5 3 个苹果品种发育阶段呼吸速率和乙烯释放速率的变化
Fig.5 The changes of respiration rate and ethylene production rate of fruit in three apple cultivars during fruit development
2.4 电子鼻对不同品种苹果主成分分析
2.4.1 载荷分析 利用电子鼻技术分析金冠、烟富3号和威海金苹果在发育阶段过程中挥发性物质变化的趋势,图6是3个不同品种在发育时期不同传感器响应值载荷分析,从金冠中可以很直观地看出对第1主成分贡献率最大的是8号传感器(W2S),其次是2 号(W5S)和7 号(W1W)传感器;对第2 主成分贡献率最大的是4 号传感器(W6S),其次是10 号传感器(W2S)。从烟富3号中可以很直观地看出对第1主成分贡献率最大的是2号传感器(W5S),其次是8号(W2S)和6号(W1S)传感器;对第2主成分贡献率最大的是4 号传感器(W6S),其次是10 号传感器(W3S)。从威海金可以很直观地看出对第1主成分贡献率最大的是1 号传感器(W1C),其次是5 号(W5C)、8 号(W2S)和6 号(W1S)传感器;对第2 主成分贡献率最大的是4 号传感器(W6S),其次是10号传感器(W3S)。8 号传感器(W2S)对应的挥发性物质是乙醇,7 号传感器(W1W)对应的挥发性物质是硫化物(H2S);2和6号传感器(W5S和W1S)对应的挥发性成分是氮氧化合物(NO2)和甲烷(CH4),4号和10 号传感器对应的挥发性物质是氢气和烷烃。结果表明,不同品种苹果在发育阶段挥发性物质有较大的不同,但是氢气和烷烃类挥发性物质在3个品种的苹果中有相似的占比。
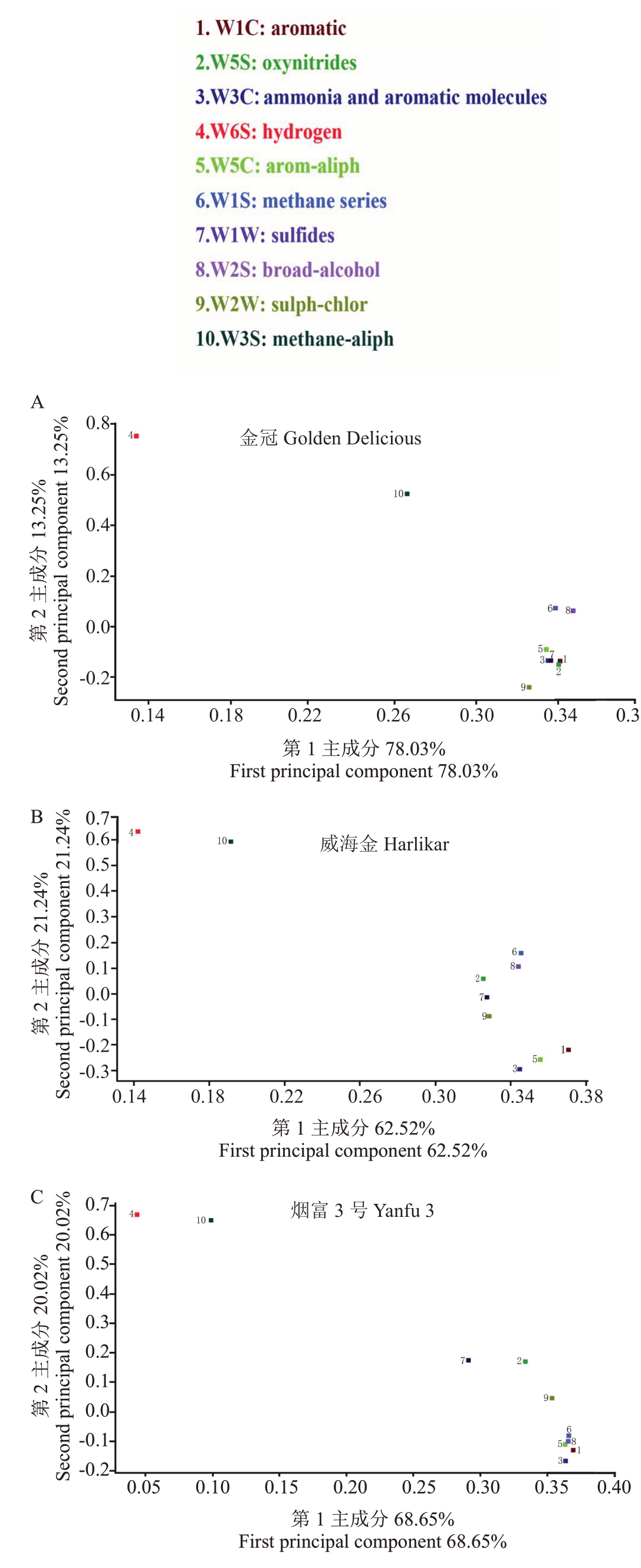
图6 电子鼻针对3 个苹果品种的10 个不同传感器响应值载荷分析
Fig.6 Loading analysis of three apple cultivars with 10 different sensors
2.4.2 线性判别分析(linear discriminant analysis,LDA)在本研究中,使用LDA 对不同发育阶段果实挥发性物质进行判别鉴定。从图7 可以看出金冠、烟富3 号和威海金苹果香气在不同发育阶段中可以被明显地区分,表明电子鼻可以很好地区分不同成熟期的苹果挥发性物质,可以用于确定果实的成熟度。横坐标代表第一主成分LD1 贡献率,纵坐标代表第二主成分LD2 贡献率,3 个品种的贡献率之和分别为91.86%(金冠,LD1:78.81%;LD2:13.05%)、87.46%(烟富3 号,LD1:68.45%;LD2:19.01%)、88.04%(威海金,LD1:66.71%;LD2:21.33%)。金冠果实在7月31日至8月31日期间香气 基 本 靠LD1 区 分;9 月10 日LD1 和LD2 贡 献 率大;9 月20 日至10 月10 日LD1 贡献率递减,表明金冠果实的嗅感品质在9月10日是一个转折点。烟富3号果实香气在发育前期(7月31日至9月20日)基本靠LD2区分;9月30日LD1和LD2贡献率降到最小;10 月10 日至10 月20 日LD1 和LD2 贡献率递增,表明烟富3 号果实香气从9 月30 日以后开始有规律富集(图7-A)。威海金果实香气在8月10日至10月10日没有明显规律;在10月20日至10月30日LD1和LD2贡献率递增,表明威海金果实的嗅感品质从10月10日以后开始有规律富集(图7-C)。
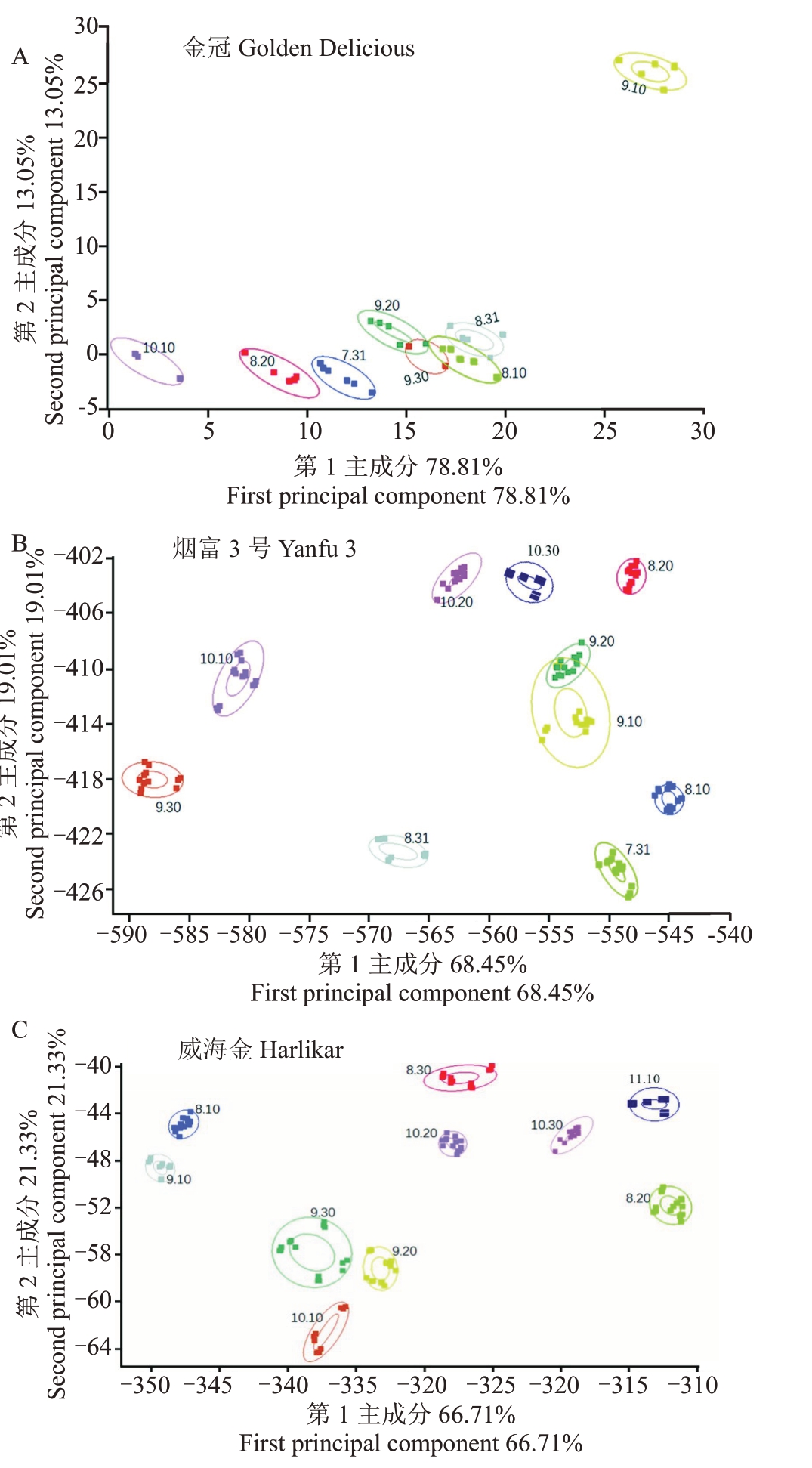
图7 3 个品种果实发育期阶段挥发性成分线性判别式分析(LDA)
Fig.7 Linear discriminant analysis(LDA)of volatile components in three cultivars during fruit development
3 讨 论
果实在树体上利用光同化物以淀粉的形式积累碳水化合物,采收后果实中淀粉会水解成可溶性糖[12-13]。从淀粉中最终释放出的葡萄糖、果糖和蔗糖,可用于呼吸作用并增强成熟果实的甜味[14]。用于测量淀粉分析的方法大多数涉及多糖的酸或酶水解和水解产物(如葡萄糖)的定量,在生产上使用不方便。碘可以将淀粉与多糖、单糖和二糖分开。淀粉与碘相互作用呈现黑色或黄褐色[21]。已有研究报道,碘-淀粉染色背景颜色可以用于鉴定嘎拉和澳洲青苹苹果的最佳采收期[15-16]。3 个品种的果实在经过碘-碘化钾溶液染色后,随着果实成熟程度增加,果实的染色程度由深至浅,染色面积由大到小,说明淀粉染色结果可以反映果实的不同发育时期。
碘-淀粉染色图谱已被应用于多个苹果品种采收期的确定。何婉茹等[17]对陕西地区金冠、乔纳金、富士和澳洲青苹进行研究,建立了这4 个品种的淀粉染色图谱。王瑞庆等[22]建立了嘎拉、秦冠和富士的淀粉染色图谱。刘慧等[23]建立了华硕苹果的淀粉染色图谱。这些淀粉染色图谱的建立为不同品种苹果科学采收提供了指导。目前尚未建立威海金和烟富3号苹果品种的碘-淀粉染色图谱。
9月30日,威海区域金冠果实的纵横径已达最大值;硬度已下降至较低值;可溶性固形物含量为13.94%,已达金冠果实商品采收标准;呼吸速率和乙烯释放速率较低,此后乙烯释放速率显著升高,不利于采后贮藏;此时,淀粉染色图谱显示部分淀粉已经水解,金冠的染色状态与何婉茹等[17]所制作的金冠采收时染色状态相似。因此,本研究将金冠果实采收期定于9月30日,此时对应采收期淀粉染色等级为7级。
10月30日,威海地区威海金果实的纵横径已达最大值;硬度已下降至较平稳值;且可溶性固形物含量为14.61%,已达威海金果实商品采收标准;呼吸速率和乙烯释放速率较低;此时,淀粉染色图谱显示大部分淀粉已经水解,说明威海金果实采收时应在淀粉基本完全水解阶段,只有少数染色出现在果皮周围。综上,认为威海金果实采收期定于10 月30日,此时对应采收期淀粉染色等级为7级。
10月20日,威海地区烟富3号果实的纵横径已达到最大值;硬度已下降至较稳定状态,此后硬度变化不显著;可溶性固形物含量为12.94%,已达到最大值,达到烟富3号果实商品采收要求;呼吸速率处于较低值;乙烯释放速率上升至较平稳值;根据淀粉染色图谱可知,此时果实内淀粉已基本完全水解,说明烟富3 号果实采收时应在淀粉基本全部水解阶段,仅有少部分染色出现于果皮周围。综上,认为烟富3号果实采收期定于10月20日,此时对应采收期淀粉染色等级为7级。
同时借助电子鼻分析3个品种苹果发育阶段果实的发挥性物质,金冠、烟富3号和威海金苹果香气在不同发育阶段中可以被明显地区分,表明电子鼻可以很好地区分不同发育期的苹果挥发性物质,可以用于辅助确定果实的成熟度。胡桂仙等[24]利用电子鼻对不同贮藏时间的柑橘进行检测,表明利用电子鼻可以无损检测柑橘的新鲜度;朱丹实等[25]对华富苹果常温贮藏过程中感官品质及挥发性物质变化的研究中,证明利用电子鼻通过主成分分析和线性分析可以对不同贮藏时间的苹果果实进行良好的区分;曹森等[26]利用电子鼻检测不同采收期天麻的香气成分,载荷分析表明不同传感器对不同采收期天麻有不同的贡献率;同时LDA 分析结果表明,利用电子鼻可以对不同采收期天麻进行有效区分。本研究中利用电子鼻检测3个苹果品种在发育阶段的挥发性物质,载荷分析和LDA 分析表明可以对3 个品种苹果的不同发育阶段进行良好的区分,证明电子鼻检测可以辅助确定苹果的适宜采收期。
4 结 论
果实淀粉染色图谱可以科学客观地反映苹果3个品种果实成熟的进程,同时结合生理指标和电子鼻分析,将金冠、威海金和烟富3号苹果果实的适宜采收期确定为9月30日、10月30日和10月20日,此时对应的淀粉染色等级均为7级。
[1] 于开禄.威海苹果生产现状及其发展走向[J].中国果业信息,2010,27(3):7-8.YU Kailu.Apple production status and development trend in Weihai[J].China Fruit Industry Information,2010,27(3):7-8.
[2] SEYMOUR G B,CHAPMAN N H,CHEW B L,ROSE J K C.Regulation of ripening and opportunities for control in tomato and other fruits[J].Plant Biotechnology Journal,2013,11(3):269-278.
[3] KLEE H J,GIOVANNONI J J.Genetics and control of tomato fruit ripening and quality attributes[J].Annual Review of Genetics,2011,45:41-59.
[4] PRASANNA V,PRABHA T N,THARANATHAN R N.Fruit ripening phenomena:An overview[J].Critical Reviews in Food Science and Nutrition,2007,47(1):1-19.
[5] BANGERTH F K,SONG J,STREIF J.Physiological impacts of fruit ripening and storage conditions on aroma volatile formation in apple and strawberry fruit: A review[J].Hortscience,2012,47(1):4-10.
[6] POURDARBANI R,SABZI S,JAROLMASJED S,PANAGOPOULOS T.Determination of the most effective wavelengths for prediction of Fuji apple starch and total soluble solids properties[J].Applied Sciences-Basel,2020,10(22):8145.
[7] LI A,CHEN J,LIN Q,ZHAO Y Y,DUAN Y Q,WAI S C,SONG C C,BI J F.Transcription factor MdWRKY32 participates in starch-sugar metabolism by binding to the MdBam5 promoter in apples during postharvest storage[J].Journal of Agricultural and Food Chemistry,2021,69(49):14906-14914.
[8] CONTRERAS C,BEAUDRY R.Lipoxygenase-associated apple volatiles and their relationship with aroma perception during ripening[J].Postharvest Biology and Technology,2013,82:28-38.
[9] CHALMERS D J,ROWAN K S.The climacteric in ripening tomato fruit[J].Plant Physiology,1971,48(3):235-240.
[10] KADER A A,HOLCROFT D M.Postharvest: An introduction to the physiology and handling of fruit,vegetables and ornamentals[J/OL].HortTechnology,1999,9(2): 299.DOI: 10.21273/HORTTECH.9.2.229
[11] PEIRS A,SCHEERLINCK N,PEREZ A B,JANCSóK P,NICOLAı¨ B M.Uncertainty analysis and modelling of the starch index during apple fruit maturation[J].Postharvest Biology and Technology,2002,26(2):199-207.
[12] DOERFLINGER F C,WATKINS C B,MILLER W B.Starch metabolism in apple fruit and its relationship with maturation and ripening[J].Hortscience,2013,48(9):S176-S177.
[13] DOERFLINGER F C,MILLER W B,NOCK J F,WATKINS C B.Variations in zonal fruit starch concentrations of apples-a developmental phenomenon or an indication of ripening?[J/OL].Horticulture Research,2015,2: 15047.DOI: 10.1038/HORTRES2015.47
[14] DOERFLINGER F C,WATKINS C B,MILLER W B.Starch metabolism in apple cultivars[J].Hortscience,2012,47(9):S263-S264.
[15] CASALS M,BONANY J,CARBO J,ALEGRE S,IGLESIAS I,MOLINA D,CASERO T,RECASENS I.Establishment of a criterion to determine the optimal harvest date of 'Gala' apples based on consumer preferences[J].Journal of Fruit and Ornamental Plant Research,2006,14(Suppl.2):53-63.
[16] WATKINS C B,REID M S,HARMAN J E,PADFIELD C A S.Starch iodine pattern as a maturity index for Granny Smith apples[J].New Zealand Journal of Agricultural Research,1982,25(4):587-592.
[17] 何婉茹,王俊峰,李高潮,任小林.不同苹果品种成熟期淀粉染色图谱的建立[J].北方园艺,2018(2):52-58.HE Wanru,WANG Junfeng,LI Gaochao,REN Xiaolin.Establishment of starch staining maps of different Apple cultivars at maturity stage[J].Northern Horticulture,2018(2):52-58.
[18] TRAVERS I,JACQUET A,BRISSET A,MAITE C.Relationship between the enzymatic determination of starch and the starch iodine index in two varieties of cider apple[J].Journal of the Science of Food and Agriculture,2002,82(9):983-989.
[19] LU G L,LI Z J,ZHANG X F,WANG R,YANG S L.Expression analysis of lignin-associated genes in hard end pear (Pyrus pyrifolia‘Whangkioeumbae’) and its response to calcium chloride treatment conditions[J].Journal of Plant Growth Regulation,2015,34(2):251-262.
[20] WANG Y,ZHANG X F,YANG S L,YUAN Y B.Lignin involvement in programmed changes in peach-fruit texture indicated by metabolite and transcriptome analyses[J].Journal of Agricultural and Food Chemistry,2018,66(48):12627-12640.
[21] FADÓN A E,RODRIGO G F J.Combining histochemical staining and image analysis to quantify starch in the ovary primordia of sweet cherry during winter dormancy[J].Journal of Visualized Experiments,2019.http://hdl.handle.net/10532/4598.
[22] 王瑞庆,马书尚,张继澍.淀粉-碘染色法确定苹果成熟度[J].西北农林科技大学学报(自然科学版),2010,38(9):81-86.WANG Ruiqing,MA Shushang,ZHANG Jishu.Determination of apple maturity by starch-iodine staining[J].Journal of Northwest A&F University(Natural Science Edition),2010,38(9):81-86.
[23] 刘慧,张静林,吕真真,杨文博,阎振立,张瑞萍,焦中高.‘华硕’苹果采收期判定及其对贮藏品质的影响[J].果树学报,2020,37(1):106-114.LIU Hui,ZHANG Jinglin,LÜ Zhenzhen,YANG Wenbo,YAN Zhenli,ZHANG Ruiping,JIAO Zhonggao.Harvesting date determination of‘Huashuo’apples and its effect on storage quality[J].Journal of Fruit Science,2020,37(1):106-114.
[24] 胡桂仙,王俊,海铮,王小骊.不同储藏时间柑橘电子鼻检测研究[J].浙江农业学报,2006(6):458-461.HU Guixian,WANG Jun,HAI Zheng,Wang Xiaoli.Study on electronic nose detection of citrus at different storage time[J].Acta Agriculturae Zhejiangensis,2006(6):458-461.
[25] 朱丹实,任晓俊,魏立威,许玲霞,曹雪慧,吕长鑫,陈敬鑫,励建荣.华富苹果常温贮藏过程中感官品质及挥发性风味物质变化[J].食品工业科技,2019,40(20):278-284.ZHU Danshi,REN Xiaojun,WEI Liwei,XU Lingxia,CAO Xuehui,LÜ Changxin,CHEN Jingxin,LI Jianrong.Changes of sensory quality and volatile flavor substances in Huafu apple during room temperature storage[J].Science and Technology of Food Industry,2019,40(20):278-284.
[26] 曹森,赵成飞,马风伟,马超,李莹,王瑞.基于电子鼻和GC-MS评价不同采收期天麻的芳香品质[J].北方园艺,2019(19):87-94.CAO Sen,ZHAO Chengfei,MA Fengwei,MA Chao,LI Ying,WANG Rui.Evaluation of aroma quality of Gastrodia elata at different harvesting stages based on electronic nose and GC-MS[J].Northern Horticulture,2019(19):87-94.