铁元素在植物体内参与多种生理生化反应,包括叶绿素合成、光合作用、呼吸作用和活性氧代谢等[1-3]。铁在土壤中的含量十分丰富,常以Fe3+形式存在,但是Fe3+在碱性和中性土壤中的溶解性和有效性低,限制了植物对Fe3+的吸收[4]。缺铁会导致植物叶片黄化,严重时会导致植物死亡[5]。因此,保证植物体内的铁稳态十分重要。
前人研究认为,缺铁条件下高等植物通过2 种独立机制分别吸收根际铁活化,即双子叶植物和非禾本科植物采用策略Ⅰ,禾本科植物采用策略Ⅱ[5-6]。其中,策略Ⅰ植物是将Fe3+还原成Fe2+吸收,策略Ⅱ植物是通过分泌麦根酸等Fe3+结合蛋白螯合Fe3+并吸收。草莓属于双子叶植物,所以,草莓铁吸收采用策略Ⅰ。策略Ⅰ植物根系对铁的吸收分为3个步骤:(1)H+-ATPase(p-type)向根际泵出质子(H+)酸化土壤,溶解Fe3+离子;(2)铁还原酶(ferricchelate reductase, FCR)将Fe3+还原为Fe2+;(3)铁转运体(iron-regulated transporter, IRT)转运Fe2+进入根系细胞[7-10]。碱性螺旋-环-螺旋(basic helix-loophelix, bHLH)转录因子普遍存在于植物中,在策略Ⅰ植物根系吸收铁的过程中起重要的转录调控作用[11],FIT(Fe-deficiency induced transcription factor)转录因子是策略Ⅰ植物调控根系铁吸收的关键转录因子[12-13]。bHLH 转录因子铁吸收调控网络的终点是FIT与其他转录因子形成二聚体调节AtAHA2、At-FRO2 和AtIRT1 基因的表达,以此控制策略Ⅰ植物的3 个铁吸收步骤来调控铁的稳态[3,14]。草莓中已分离出了与bHLH相关的同源基因[15],但有关FIT转录因子调控草莓根系铁吸收的报道仍鲜见,其是否参与铁吸收转运过程尚不明晰。
中国是草莓生产大国,在华北、西北地区盐碱性土壤以及设施盐渍化严重的地块,草莓易发生缺铁性黄化病。红颜作为草莓主栽品种,在盐碱性土壤中黄化症状尤其明显,严重影响植株正常生长进而降低果实品质和产量。笔者课题组前期进行了红颜草莓根系铁胁迫转录组分析试验,通过筛选差异基因发现1 个草莓bHLH 家族成员FaFIT 基因。进一步分析该基因在不同组织中的表达特性,通过拟南芥转基因初步验证其功能揭示FaFIT基因参与草莓根系铁吸收的作用,对于揭示草莓在盐碱土壤中的根系铁吸收调控机制具有重要的意义。
1 材料和方法
1.1 试验材料
红颜草莓(Fragaria × ananassa‘Benihoppe’)组培苗,选择生长良好、长势一致的2代组培继代繁殖苗,在生根培养基中生长20 d 生根后备用。继代繁殖苗由中国农业科学院郑州果树研究所草莓种质改良课题组遗传转化实验室提供。
转基因受体材料为野生型拟南芥(Arabidopsis thaliana)。生根培养基为1/2 MS 粉,0.1 mg·L-1 IBA,6 g·L-1 琼脂粉,30 g·L-1 蔗糖,调节pH=5.8。
1.2 方法
1.2.1 植物生长条件和处理 红颜草莓组培苗铁胁迫处理:缺铁、过量铁和高pH(pH=7.0 和pH=8.0)3种。试验设置3个重复。组培苗生长环境为23 ℃±1 ℃、16 h/8 h 光周期。采用1/2 MS 培养基,根据不同处理对培养基成分进行调整:
(1)缺铁胁迫处理培养基去除了EDTA-Fe(Fe-),加入50 mmol·L-1 菲洛嗪(ferrozine,FRZ);
(2)高pH值处理设置pH=7.0和pH=8.0;
(3)铁过量胁迫处理的EDTA-Fe浓度为1/2 MS培养基EDTA-Fe 浓度的5 倍(Fe 5×)和10 倍(Fe 10×);
(4)对照(CK)为pH=5.8、EDTA-Fe 浓度0.1 mmol·L-1的1/2 MS培养基。
拟南芥种植于人工气候室,25 ℃光照16 h,黑暗8 h,常规管理。
1.2.2 FaFIT基因克隆与生物信息学分析 在GDR
中(www.rosaceae.org)获取FaFIT 基因的编码区和启动子区(ATG 上游2 kb)的参考序列信息,并依此设计引物F1/R1 和F2/R2(表1),分别用于克隆FaFIT基因的编码序列和启动子序列。利用Predict-Protein(https://predictprotein.org)预测FaFIT 蛋白的二级结构,通过MEME(https://meme-suite.org)分析FaFIT蛋白的保守氨基酸序列,利用PlantCare(http://bioinformatics.psb.ugent.be)预测FaFIT 基因启动子元件。
表1 引物序列
Table 1 Sequence of primers
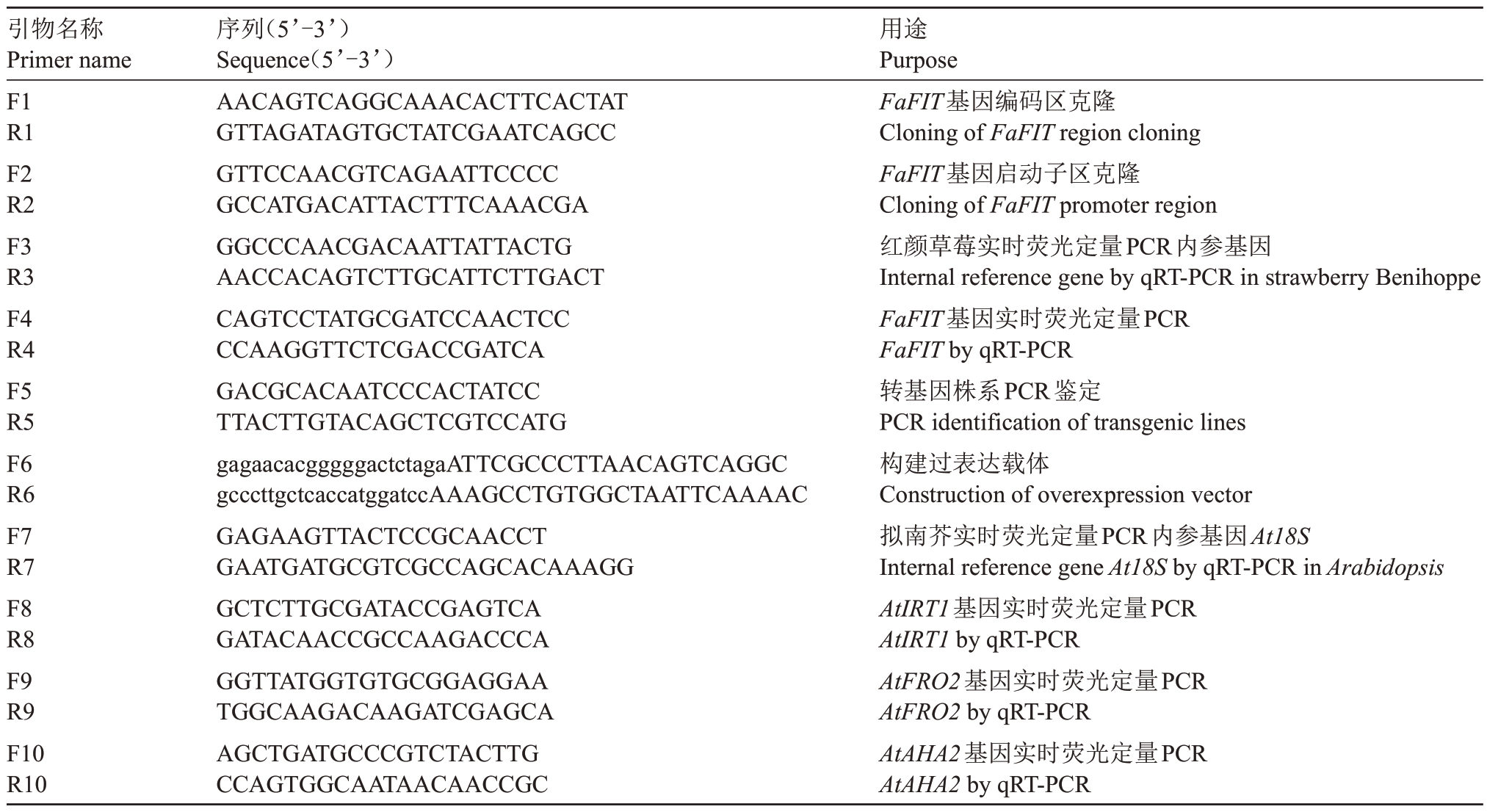
注:引物6 小写字母表示载体同源臂序列。
Note:The lowercase letters of primer 6 represent the homologous arm sequence of the vector.
引物名称Primer name F1 R1 F2 R2 F3 R3 F4 R4 F5 R5 F6 R6 F7 R7 F8 R8 F9 R9 F10 R10用途Purpose FaFIT基因编码区克隆Cloning of FaFIT region cloning FaFIT基因启动子区克隆Cloning of FaFIT promoter region红颜草莓实时荧光定量PCR内参基因Internal reference gene by qRT-PCR in strawberry Benihoppe FaFIT基因实时荧光定量PCR FaFIT by qRT-PCR转基因株系PCR鉴定PCR identification of transgenic lines构建过表达载体Construction of overexpression vector拟南芥实时荧光定量PCR内参基因At18S Internal reference gene At18S by qRT-PCR in Arabidopsis AtIRT1基因实时荧光定量PCR AtIRT1 by qRT-PCR AtFRO2基因实时荧光定量PCR AtFRO2 by qRT-PCR AtAHA2基因实时荧光定量PCR AtAHA2 by qRT-PCR序列(5’-3’)Sequence(5’-3’)AACAGTCAGGCAAACACTTCACTAT GTTAGATAGTGCTATCGAATCAGCC GTTCCAACGTCAGAATTCCCC GCCATGACATTACTTTCAAACGA GGCCCAACGACAATTATTACTG AACCACAGTCTTGCATTCTTGACT CAGTCCTATGCGATCCAACTCC CCAAGGTTCTCGACCGATCA GACGCACAATCCCACTATCC TTACTTGTACAGCTCGTCCATG gagaacacgggggactctagaATTCGCCCTTAACAGTCAGGC gcccttgctcaccatggatccAAAGCCTGTGGCTAATTCAAAAC GAGAAGTTACTCCGCAACCT GAATGATGCGTCGCCAGCACAAAGG GCTCTTGCGATACCGAGTCA GATACAACCGCCAAGACCCA GGTTATGGTGTGCGGAGGAA TGGCAAGACAAGATCGAGCA AGCTGATGCCCGTCTACTTG CCAGTGGCAATAACAACCGC
1.2.3 草莓RNA的提取及cDNA第1链的合成 提取组织总RNA(Omega),使用第1 链cDNA 合成试剂盒(天根生化科技有限公司)反转录。按照说明书的基因组DNA(gDNA)的去除体系配制去除混合液:5×gDNA Buffer 2 μL,Total RNA 50 ng~2 μg(根据浓度统一添加量),之后用RNase-Free ddH2O 补充体系至10 μL,充分混匀,1000 r·min-1离心10 s,并置于42 ℃,孵育3 min,然后放置于冰上。
按照说明书反转录反应体系在冰上配制反转录混合液:10×King RT Buffer 2 μL、FastKing RT Enzyme Mix 1 μL、FQ-RT Primer Mix 2 μL、RNase-Free ddH2O 5 μL。在每个gDNA 去除体系中加入10 μL 反转录混合液,充分混匀,形成20 μL 的反应体系,42 ℃,孵育15 min;95℃,孵育3 min 之后放置于冰上。
1.2.4 实时荧光定量PCR分析FaFIT基因的表达模式 将红颜草莓组培苗转移到胁迫处理培养基中处理10 d 后,取根、茎和叶分析FaFIT 基因表达模式,其中缺铁处理25 d后再次取根系分析FaFIT基因的表达模式。
将cDNA 稀释5 倍用MonAmpTM ChmoHS Qpcr Mix(莫纳生物科技有限公司)进行实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)确定基因表达水平,内参引物为F3/R3,qRT-PCR 引物为F4/R4(表1)。各试验步骤均根据试剂说明书进行。
在各处理第25天时取样,以分析各处理的表观症状。取新叶测定叶片铁含量与叶绿素含量,铁含量用邻二氮菲法测定[16-17],叶绿素含量用丙酮提取法[17]测定。
以上试验均进行3 次技术重复和3 个生物学重复。
1.2.5 拟南芥转基因阳性苗鉴定 以PBI-121-GFP
为载体,在BamHⅠ和XbaⅠ的2 个位点进行双酶切,使用引物(F6/R6,引物见表1)和同源重组酶(天根生化科技有限公司)将FaFIT 基因编码区插入BamHⅠ和XbaⅠ之间,构建35S::FaFIT-GFP融合过表达载体。
分别将空载和构建好的载体转入农杆菌GV3101 感受态(上海唯地生物技术有限公司)中,挑取阳性单克隆摇菌,通过蘸花法侵染拟南芥[18]。
将T0代种子用含50 mg·mL-1卡那霉素(Kanamycin)的1/2 MS培养基筛选阳性苗并种植,得到T1代种子,持续筛选种植获得T2代植株,使用引物F5/R5(表1)对阴性对照株系和阳性过表达株系进行鉴定。
1.2.6 拟南芥阳性株系铁吸收相关基因的表达分析 将拟南芥的阴性对照株系与阳性株系种植于1/2 MS 培养基中,取其根系,提取总RNA 并反转录合成cDNA,之后进行qRT-PCR(同1.4)。
以At18S 基因作为内参基因,引物为F7/R7(表1),使用2-△△Ct计算相对表达量,阴性植株为对照,每个样品进行3个生物学重复,通过引物F8/R8、F9/R9和F10/R10(表1)分析铁吸收相关基因AtIRT1、At-FRO2和AtAHA2表达情况,同时采用酶联免疫检测试剂盒(酶免实业有限公司)测定FCR 酶活性、IRT酶活性和H+-ATPase(p-type)酶活性。
1.2.7 拟南芥阳性株系铁吸收能力分析 将拟南芥阴性对照株系与阳性株系种植于pH=5.8 的1/2 MS 培养基中7 d,之后挑选长势一致苗转移到pH=5.8 和pH=8 的1/2 MS 培养基中生长7 d,取处理后的拟南芥叶片测定铁离子含量和叶绿素含量,方法同1.4。试验设计3 次技术重复和3 个生物学重复。
Fe2+含量可以通过菲啰嗪显色液[19]直观观察,显色液为乙酸-乙酸钠缓冲液(pH=4.6)配制1 mg·mL-1菲啰嗪一钠盐(CAS:69898-45-9)和25 mg·mL-1抗坏血酸混合溶液。取等量的拟南芥洗净培养基,放入显色液中进行显色反应。
1.2.8 数据统计 数据的分析采用IBM SPSS Statistics 26软件,图表的制作采用Excel office软件。
2 结果与分析
2.1 FaFIT基因克隆与生物信息学分析
如图1 所示,对红颜草莓缺铁胁迫根系转录组分析发现,其中1 个差异表达基因序列与maker-Fvb3-4-snap-gene-100.50(Fragaria × ananassa Camarosa Genome v1.0.a1 Transcripts)相 似 度 为99.02%。进一步搜索发现该基因与拟南芥AtFIT(GenBank 登录号:NM_179783.2)为同源基因,将该基因命名为FaFIT 基因(GenBank 登录号:XM_011472368.1)。序列分析表明,FaFIT 基因编码区序列全长1020 bp,推导编码339 个氨基酸,与拟南芥的基因序列和氨基酸序列相似度分别为52.87%和43.35%(图1-A)。FaFIT 蛋白结合域位于26~54位氨基酸,DNA 结合域在134~219 位氨基酸,α 螺旋-环-α 螺旋(helix-loop-helix,HLH)域位于224~295 位氨基酸(图1-B),因此可以确定FaFIT 属于bHLH 转录因子家族。FaFIT 基因启动子序列具有bHLH 转录因子DNA 结合元件(G-box)、转录起始元件(TATA-box、CAAT-box)、激素调控元件(CGTCA-motif、TGACG-motif)和干旱等逆境胁迫诱导元件(MYB、MYC)(图1-C),推测FaFIT 基因可能受到上游bHLH 转录因子、激素和非生物胁迫等因素的调控和诱导。

图1 FaFIT 氨基酸序列比对、蛋白结构和FaFIT 基因启动子顺式作用元件预测
Fig.1 Amino acid sequence alignment,protein structure and promoter cis acting element prediction of FaFIT
通过对多物种FIT 氨基酸序列比对分析,结果显示红颜草莓、海棠(Malus domestica)、桃(Prunus persica)、拟南芥(Arabidopsis thaliana)、番茄(Lycopersicon esculentum)的FIT 氨基酸序列的蛋白结合域、DNA 结合域和HLH 域在不同种之间相对保守(图1-A)。
2.2 FaFIT基因的表达模式分析
qRT-PCR 结果显示,FaFIT 基因在根系中特异表达(图2-A),因此在缺铁、铁过量和高pH 值处理中仅分析FaFIT 基因在根系中的表达模式。FaFIT基因受到缺铁胁迫和高pH值的诱导(图2-B~C),在缺铁胁迫10 d、25 d时FaFIT基因均高表达,在高pH值处理中随着pH 值的提高FaFIT 基因相对表达量也显著升高。但是在铁过量处理中,FaFIT 基因的相对表达量显著下降,几乎不表达(图2-D),说明过量的铁抑制FaFIT基因表达。

图2 不同胁迫处理FaFIT 的表达模式
Fig.2 Expression pattern of FaFIT genes under different stress in strawberry
A.FaFIT 基因在根、茎、叶中的表达模式;B.缺铁处理不同时间FaFIT 基因的表达模式;C.不同pH 处理FaFIT 基因的表达模式;D.不同铁过量倍数FaFIT 基因的表达模式。不同小写字母表示差异显著(p<0.05)。
A.Expression pattern of FaFIT in roots,stems and leaves;B.Expression pattern of FaFIT in iron deficiency treatment at different time;C.Expression pattern of FaFIT in different pH treatments; D.Expression patterns of FaFIT in different iron excess multiples.Different small letters indicate significant difference(p<0.05).
2.3 红颜草莓胁迫处理的生理响应
各处理25 d 后,红颜草莓产生了不同的表型症状。在缺铁和pH=8 处理下,红颜草莓的新叶出现了明显的缺铁性黄化症状(图3-A),同时Fe2+含量与叶绿素含量显著降低(图3-B~C)。但是在铁过量(Fe 10×)处理中,红颜草莓出现了明显的植株矮缩和根系变黑的症状(图3-A),过量的铁对草莓造成一定的毒害。同时,红颜草莓叶片Fe2+含量升高,但是叶绿素含量显著降低,说明过量的铁反而阻碍叶绿素的合成。

图3 红颜草莓在非生物胁迫下的表型症状与相关生理指标
Fig.3 Phenotypic symptoms and related physiological indexes of Benihoppe strawberry under abiotic stress
A.红颜草莓非生物胁迫的表型;B.红颜草莓非生物胁迫的叶片铁含量与叶绿素。小写字母表示显著性差异水平(p<0.05)。比例尺为1 cm。A.Phenotype of Benihoppe under abiotic stress;B.Iron content and chlorophyll in leaves of Benihoppe under abiotic stress.Small letters indicate the level of significant difference(p<0.05).Scale bar is 1 cm.
2.4 拟南芥异源表达FaFIT促进铁的吸收
转基因的拟南芥种子经过2 代的卡那霉素(Kanamycin)抗性筛选和PCR 检测筛选,鉴定出7个拟南芥转基因阳性株系,分别编号为OS#4、OS#5、OS#6、OS#7、OS#8、OS#9 和OS#10,其 中FaFIT 基因在OS#5、OS#6 和OS#8 中的相对表达量分别高于野生型60 倍、73 倍和83 倍(图4),因此选择这3 个株系在1/2MS 培养基中培养进行后续试验。
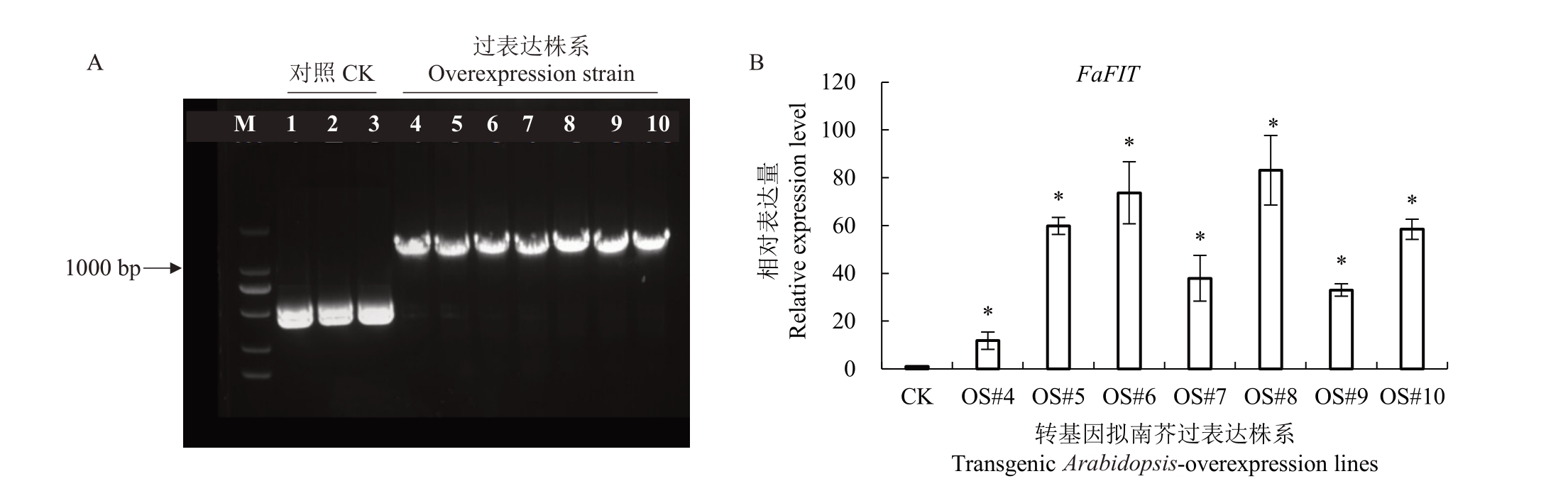
图4 拟南芥FaFIT 基因过表达阳性株系
Fig.4 Identification of Arabidopsis thaliana FaFIT-overexpression positive lines
A.转基因株系的PCR 检测;B.阳性株系的FaFIT 表达倍数检测。*表示与对照具有显著性差异(p<0.05)。下同。
A.Positive strains were detected by PCR.B.Overexpression multiples of FaFIT in the positive strains were detected.*indicates a significant difference from the control(p<0.05).The same below.
AtAHA2、AtFRO2 和AtIRT1 基因是与拟南芥根系铁吸收相关的3 个基因,分别合成H+-ATPase(ptype)、FCR和IRT蛋白,这3种蛋白在根系吸收铁通路中起作用。在3 个转FaFIT 阳性株系中测定这3个基因的相对表达量变化,结果表明,OS#5、OS#6和OS#8 的AtAHA2、AtFRO2 和AtIRT1 基因表达量显著高于对照株系(图5)。为了进一步了解过表达FaFIT 基因是否会在蛋白质水平产生影响,测定了H+-ATPase(p-type)、FCR和IRT蛋白的酶活性,结果显示,与对照组相比,阳性株系3种酶活性均显著增强(图6)。
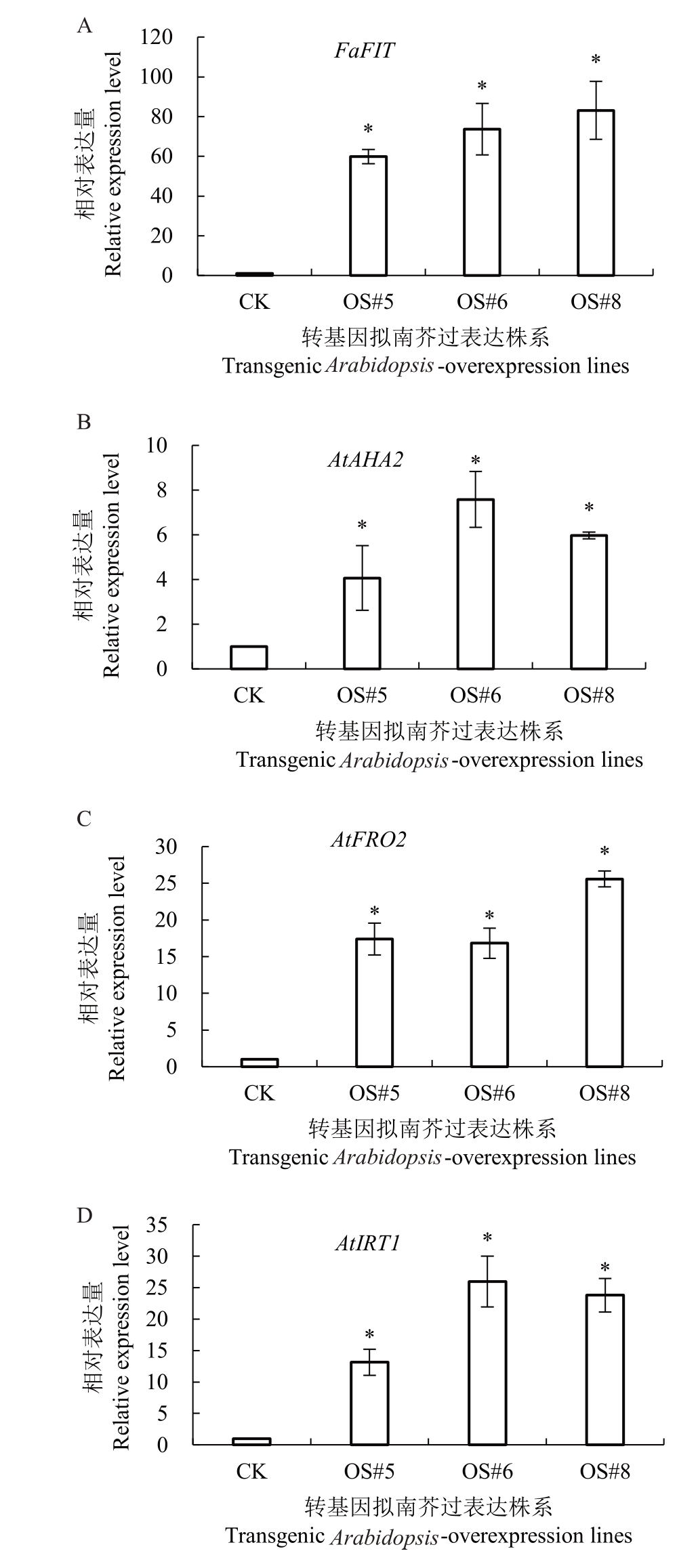
图5 拟南芥FaFIT 基因过表达株系铁吸收相关基因表达分析
Fig.5 Expression analysis of iron absorption related genes in Arabidopsis thaliana FaFIT-overexpression lines
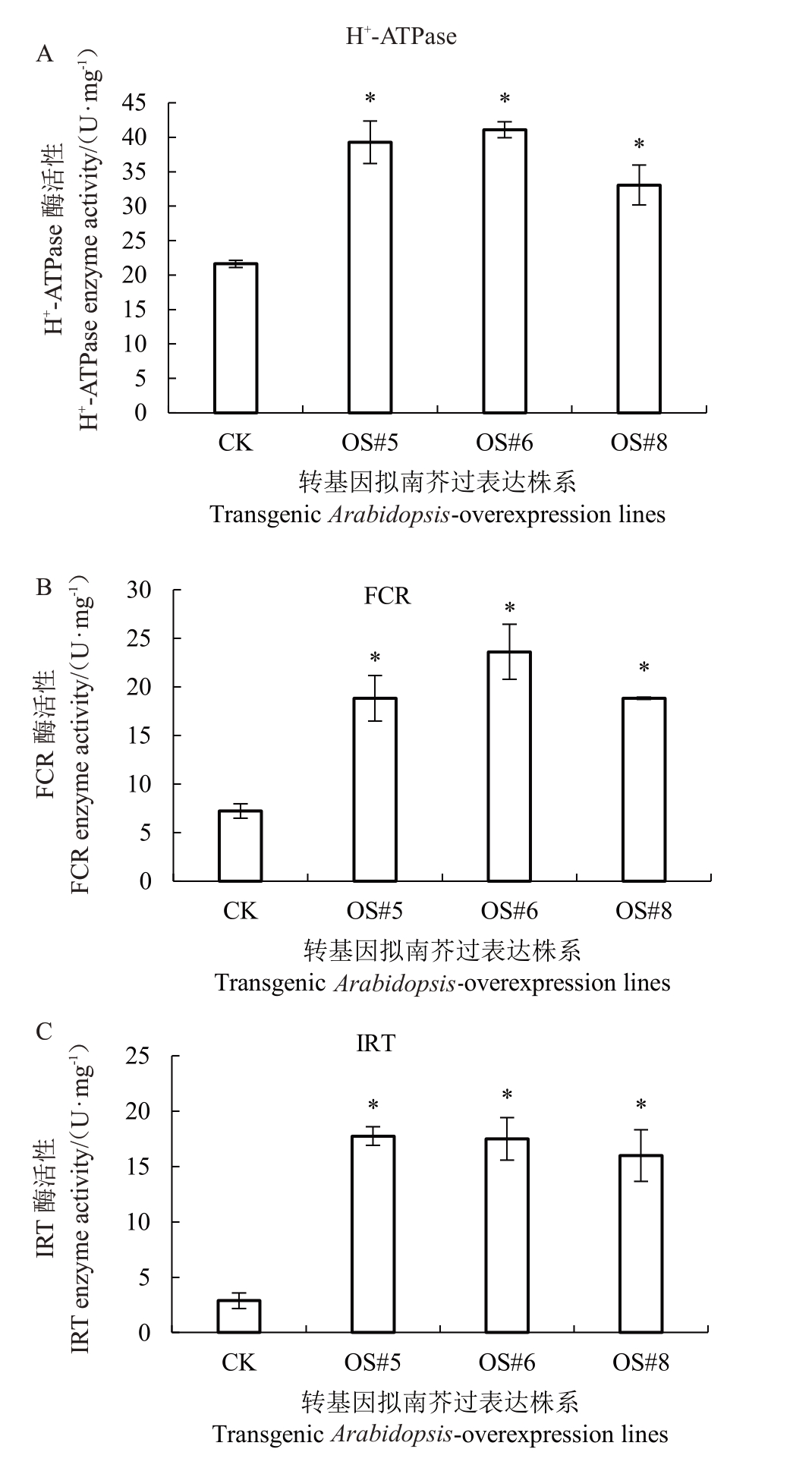
图6 拟南芥FaFIT 基因过表达株系的酶活性差异
Fig.6 Differences in enzyme activities of Arabidopsis thaliana FaFIT-overexpression lines
测定对照株系和阳性株系叶片的Fe2+积累量和叶绿素含量的结果显示,在1/2 MS培养基(pH=5.8)中,在叶色上过表达株系与阴性株系略有差异,过表达株系的叶片更绿一些(图7-A)。为了更直观地表现叶片Fe2+含量与叶绿素含量,进行了Fe2+显色试验。结果显示阳性株系比对照积累更多的Fe2+(离心管颜色越深代表Fe2+含量越高)(图7-B)。叶片Fe2+含量与叶绿素含量也证实过表达株系在叶片中积累了更多的铁,促进了叶绿素的合成(图7-C~D)。
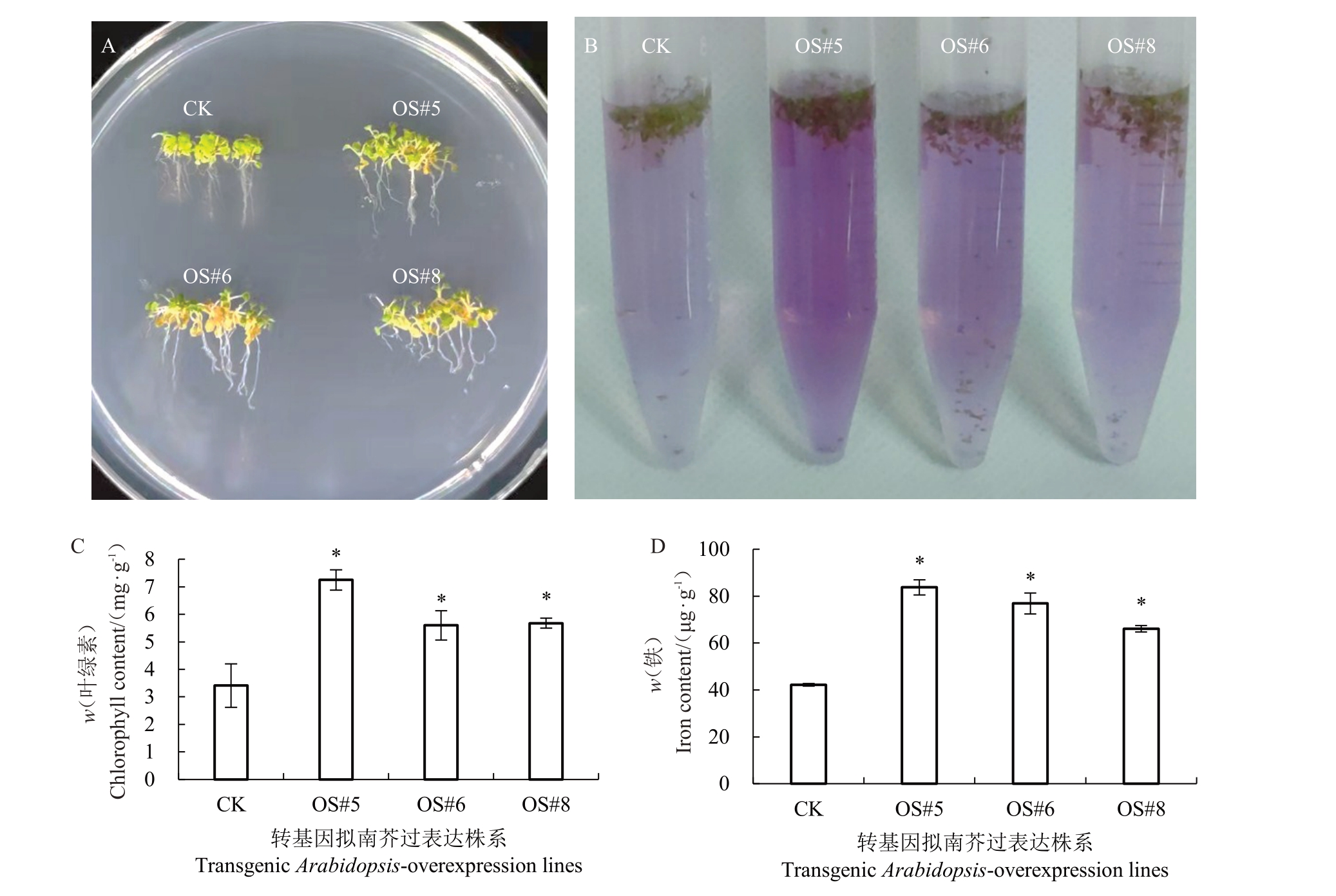
图7 FaFIT 基因过表达促进拟南芥铁积累
Fig.7 FaFIT overexpression promotes iron accumulation in Arabidopsis thaliana
对照株系和过表达株系在正常培养基中的表现。A.阳性株系表型;B.阳性株系Fe2+含量显色;C,D.阳性株系叶片叶绿素含量和Fe2+含量。下同。
Performance of control lines and FaFIT-overexpression lines in normal medium;A.Phenotype of positive strains;B.Fe2+content of positive lines was colored;C,D.Chlorophyll content and Fe2+content in leaves of positive lines.The same below.
为了明确FaFIT基因是否可以在pH=8的高pH值培养基中促进铁的吸收,将对照和阳性株系进行高pH值处理(图8)。在pH=8的培养基中大部分的铁形成难以吸收的沉淀。结果显示,在pH=8 的培养基中阴性对照株系Fe2+含量(图8-B~D)和叶绿素含量(图8-C)显著低于阳性株系,叶片出现黄化症状,而阳性株系叶片表现为绿色(图8-A)。以上结果表明在正常和高pH(pH=8)条件下过表达FaFIT基因均可以提高拟南芥对Fe3+的吸收能力,进而促进叶绿素合成。

图8 FaFIT 基因过表达促进拟南芥在碱性培养基中铁积累
Fig.8 FaFIT overexpression promotes iron accumulation in Arabidopsis thaliana in alkaline medium
3 讨 论
bHLH 是真核生物中广泛存在的一类转录因子,可通过与靶基因中的特定基序相互作用来调节基因表达。bHLH转录因子不仅普遍参与植物的生长和代谢,包括光形态发生、光信号转导和次生代谢,而且在植物对逆境胁迫的反应中也发挥着重要作用[20]。草莓FaFIT基因与拟南芥AtFIT1基因属于同源基因,二者保守区域的氨基酸序列相似度极高,FaFIT基因在草莓根系对铁的吸收过程中可能行使类似的功能。
高pH条件下会导致Fe3+沉淀,因此在缺铁胁迫和高pH这2种处理均会导致红颜草莓铁吸收困难,表现出相同的FaFIT 基因表达模式、铁离子含量和叶绿素含量变化。在铁过量胁迫处理中,FaFIT 基因的相对表达量显著下降,同时红颜草莓出现明显的毒害症状。铁过量培养基为低氧化还原电位和酸性pH 值,大部分Fe3+可被还原为Fe2+,因此存在过度吸收和随后氧化损伤的风险,尤其是在幼苗和早期营养阶段的过度吸收会严重阻碍植物的生长和发育[21-22]。因此铁过量胁迫中可能对草莓组培苗产生毒害作用并抑制FaFIT基因表达。
转基因拟南芥的铁积累量可以通过叶绿素水平来判断。植物中大部分的铁都存在于叶片中,铁是叶绿素合成的必需元素,缺铁会阻碍叶绿素的合成[7]。拟南芥在正常培养基(pH=5.8)中阳性株系体现出更多的铁积累量和叶绿素含量,推测是因为在拟南芥生长初期,叶片叶绿素含量尚未达到最高水平,过表达FaFIT 基因促进了叶片中Fe2+的积累,使叶片在生长早期就合成了较多的叶绿素,体现出比对照株系更多的Fe2+积累和更多的叶绿素含量。拟南芥对照株系在碱性培养基(pH=8.0)中表现为黄色,可能原因是pH值过高,拟南芥自身的AtFIT1基因不足以维持铁供应充足。这2 点都说明过表达FaFIT基因可提高拟南芥的铁吸收量。
草莓和拟南芥同属于策略Ⅰ植物,拟南芥根系吸收铁需要H+-ATPase(p-type)的酸化、FCR的还原和IRT 的铁转运3 个步骤,分别对应AtAHA2、At-FRO2 和AtIRT1 等3 个关键基因。因此研究FaFIT基因的功能需要这3个蛋白酶来验证。在拟南芥的阳性株系中,铁吸收3 个步骤对应的基因表达量水平(AtAHA、AtFRO2、AtIRT1)和蛋白酶活性均显著上升,叶片的Fe2+含量和叶绿素含量也表现出上升趋势。草莓同样具有AHA、FRO2、IRT1 基因,推测FaFIT 基因在草莓中也可以通过调控AHA、FRO2、IRT1 基因转录和翻译水平进而调控根系铁吸收。结果表明,FaFIT 基因与拟南芥AtFIT1 基因行使相似的功能,但是与FaFIT 蛋白互作的bHLH 及其他转录因子以及调控的下游基因尚不明确,有待进一步验证。
4 结 论
FaFIT 基因主要在草莓根中特异表达,受缺铁胁迫和高pH 值的正向诱导,在铁过量时被抑制表达。FaFIT 基因通过调节AHA、FRO2、IRT1 基因表达和H+-ATPase(p-type)、FCR 和IRT酶活性进而促进铁的吸收和积累,增加叶片叶绿素含量,提高在高pH值条件下铁的吸收能力。
[1] KOBAYASHI T,NISHIZAWA N K.Iron uptake,translocation,and regulation in higher plants[J].Annual Review of Plant Biology,2012,63:131-152.
[2] BALK J,SCHAEDLER T A.Iron cofactor assembly in plants[J].Annual Review of Plant Biology,2014,65:125-153.
[3] GAO F,DUBOS C.Transcriptional integration of plant responses to iron availability[J].Journal of Experimental Botany,2021,72(6):2056-2070.
[4] ZHANG N,SHANGGUAN Z,CHEN J.Molecular physiological mechanism and regulation of plant responses to iron deficiency stress[J].Journal of Plant Nutrition and Fertitizer,2018,24(5):1365-1377.
[5] PRASAD P V V,DJANAGUIRAMAN M.Iron Chlorosis[M]//THOMAS B,MURRAY B G,MURPHY D J.Encyclopedia of Applied Plant Sciences.2 ed.Oxford:Academic Press,2017:246-255.
[6] KROHLING C A,EUTRÓPIO F J,BERTOLAZI A A,DOBBSS L B,CAMPOSTRINI E,DIAS T,RAMOS A C.Ecophysiology of iron homeostasis in plants[J].Soil Science and Plant Nutrition,2016,62(1):39-47.
[7] COLANGELO E P,GUERINOT M L.The essential basic helixloop-helix protein FIT1 is required for the iron deficiency response[J].The Plant Cell,2004,16(12):3400-3412.
[8] WU H L,CHEN C L,DU J,LIU H,CUI Y,ZHANG Y,HE Y J,WANG Y Q,CHU C C,FENG Z Y,LI J M,LING H Q.Cooverexpression FIT with AtbHLH38 or AtbHLH39 in Arabidopsis-enhanced cadmium tolerance via increased cadmium sequestration in roots and improved iron homeostasis of shoots[J].Plant Physiology,2012,158(2):790-800.
[9] SIVITZ A B,HERMAND V,CURIE C,VERT G. Arabidopsis bHLH100 and bHLH101 control iron homeostasis via a FIT-independent pathway[J].PLoS One,2012,7(9):e44843.
[10] YUAN Y X,WU H L,WANG N,LI J,ZHAO W,DU J,WANG D,LING H-Q.FIT interacts with AtbHLH38 and AtbHLH39 in regulating iron uptake gene expression for iron homeostasis in Arabidopsis[J].Cell Research,2008,18(3):385-397.
[11] BRUMBAROVA T,BAUER P,IVANOV R.Molecular mechanisms governing Arabidopsis iron uptake[J].Trends in Plant Science,2015,20(2):124-133.
[12] WU H L,LING H Q.FIT-binding proteins and their functions in the regulation of Fe homeostasis[J].Frontiers in Plant Science,2019,10:844.
[13] JAKOBY M,WANG H Y,REIDT W,WEISSHAAR B,BAUER P.FRU (BHLH029) is required for induction of iron mobilization genes in Arabidopsis thaliana[J].FEBS Letters,2004,577(3):528-534.
[14] WANG N,CUI Y,LIU Y,FAN H,DU J,HUANG Z,YUAN Y,WU H,LING H Q.Requirement and functional redundancy of Ib subgroup bHLH proteins for iron deficiency responses and uptake in Arabidopsis thaliana[J].Molecular Plant,2013,6(2):503-513.
[15] CHIU L W,LI L.Characterization of the regulatory network of BoMYB2 in controlling anthocyanin biosynthesis in purple cauliflower[J].Planta,2012,236(4):1153-1164.
[16] 侯芳,郑伟.邻二氮菲法测铁的实验改进[J].广州化工,2019,47(8):134-136.HOU Fang,ZHENG Wei.Experiment improvement of determination of iron by phenanthroline spectrophotometry[J].Guangzhou Chemical Industry,2019,47(8):134-136.
[17] 李小方,张志良.植物生理学实验指导[M].北京:高等教育出版社,2016.LI Xiaofang,ZHANG Zhiliang.Experimental guidance of plant physiology[M].Beijing:Higher Education Press,2016.
[18] CLOUGH S J,BENTAF.Floral dip:Asimplified method forAgrobacterium-mediated transformation of Arabidopsis thaliana[J].The Plant Journal,1998,16(6):735-743.
[19] ZHAO Q,REN Y R,WANG Q J,YAO Y X,YOU C X,HAO Y J.Overexpression of MdbHLH104 gene enhances the tolerance to iron deficiency in apple[J].Plant Biotechnology Journal,2016,14(7):1633-1645.
[20] SUN X,WANG Y,SUI N.Transcriptional regulation of bHLH during plant response to stress[J].Biochemical and Biophysical Research Communications,2018,503(2):397-401.
[21] ONAGA G,DRAMÉ K N,ISMAIL A M.Understanding the regulation of iron nutrition:Can it contribute to improving iron toxicity tolerance in rice? [J].Functional Plant Biology,2016,43(8):709-726.
[22] KAR S,MAI H J,KHALOUF H,BEN ABDALLAH H,FLACHBART S,FINK- STRAUBE C,BRAEUTIGAM A,XIONG G,SHANG L,PANDA S K,BAUER P.Comparative transcriptomics of lowland rice varieties uncovers novel candidate genes for adaptive iron excess tolerance[J].Plant & Cell Physiology,2021,62(4):624-640.