新疆是我国最早栽培葡萄的地区和葡萄酒的发源地,亦是我国酿酒葡萄种植和酿造大省,对我国葡萄酒产业的发展发挥了巨大作用,具有不可替代的地位[1]。2019年,新疆酿酒葡萄种植面积达3.22万hm2,产量为33.8万t,主栽品种赤霞珠在当地有较好的栽培表现[2]。
嫁接原是为了防止根瘤蚜对欧洲葡萄园的破坏,嫁接技术挽救了当时世界的主要葡萄生产区,同时也推动了嫁接技术的相关研究[3]。现阶段砧木的使用是为了适应不同的生物(如土壤害虫)与非生物(如盐碱、水分或温度等)胁迫的生长环境[4-6]。同时砧木也可以赋予接穗生理过程上的优势,如生物量积累、葡萄新梢生长活力[7]。何旺等[8]通过砧木嫁接提高了接穗果实白藜芦醇等次生代谢物的含量。
葡萄的成熟过程不仅被环境因子调控,还被内源植物激素与多胺调控。植物激素与多胺都是由植物体内的很多重要的代谢途径中衍生出来的化合物,它们不仅可以调节植物生长和代谢,还与抗逆性密切相关[9]。在园艺植物果实中激素主要由种子产生[10]。王晓玥等[11]通过对葡萄新梢和叶片的研究发现,SO4砧木的嫁接亲和力强,其接穗在新梢生长期和转色期生长素(indole acetic acid,IAA)和赤霉素(gibberellins A3,GA3)含量相对较高;王利廷等[12]试验结果表明,外源脱落酸(abscisic acid,ABA)和2,4-表油菜素内酯(epibrassinolide,EBR)处理均能加速葡萄果实的发育,促进果实的成熟;潘学军等[13]研究结果证实多胺在不同葡萄品种的胚珠中均表现出先升后降的变化趋势。葡萄果实中酸的含量是衡量果实风味的重要指标,也是影响葡萄酒口感的关键因素,前人研究[14]发现,通过砧木嫁接能显著改变赤霞珠葡萄果实有机酸代谢水平。上述研究主要集中在砧木对接穗叶片或外源激素处理对果实生长发育的变化,而针对砧穗嫁接组合与葡萄浆果种子内源激素含量及多胺含量的变化的研究较少。笔者以赤霞珠葡萄作为接穗,5BB、SO4、河岸葡萄、140R、3309M 选作砧木进行嫁接,并在果实转色期至果实成熟过程中对果实的可滴定酸含量、还原糖含量和种子中ABA、GA3、IAA、腐胺(putrescine,Put)、亚精胺(spermidine,Spd)、精胺(spermine,Spm)含量进行测定,探讨不同砧穗组合嫁接后果实糖酸含量和种子中内源激素与多胺含量的变化,为丰富砧穗互作研究提供理论基础。
1 材料和方法
1.1 试验园和试验材料
试验园位于新疆石河子大学农学院葡萄栽培试验园,供试抗性砧木分别为5BB、SO4、140R、3309M、河岸葡萄(HA),材料来源于中国农业科学院郑州果树研究所,接穗材料为赤霞珠优系169。试验共设置6 个处理,分别为CS/5BB、CS/SO4、CS/140R、CS/3309M、CS/河岸葡萄和自根苗(CS,对照),于2014年定植在葡萄试验园。
1.2 试验设计
试验于2020 年7 月28 日(果实转色初期)开始第一次采样,每隔10 d采样1次,共计采样5次,直至2020年9月8日(果实成熟期)采样结束。每次取样时各处理随机采样,兼顾阴阳两面,采样后及时带回实验室。将果肉与种子准确分离速冻于液氮中,之后置于-80 ℃冰箱中。
1.3 试验方法
可滴定酸含量采用酸碱滴定法测定;还原糖含量采用3,5-二硝基水杨酸法测定。植物内源激素提取及测定参照张占畅等[15]的方法略作改动:取0.5 g材料在液氮保护下进行研磨,研磨成粉后加入10 mL预冷的80%甲醇溶液,置于4 ℃冰箱中静置10 h,在4 ℃条件下10 000 r·min-1离心15 min 后取上清液,5 mL 预冷的80%甲醇溶液再提取两次,每次1 h。合并上清液,将全部上清液使用旋蒸仪减压蒸发至原体积的1/3,加入等体积的石油醚脱色三次,弃醚相。使用0.1 mol·L-1的HCl溶液将滤液pH调至3,加入等体积的乙酸乙酯溶液涡旋静置3 min,取酯相,3次重复。将合并后的酯相减压蒸干,使用色谱级甲醇溶解,定容至1 mL,溶液过0.45 μm有机滤膜后使用岛津LC-2010AHT 型高效液相色谱仪测定。流动相的选择为V(甲醇)∶V(0.1%体积分数的甲酸水)=55∶45;流速为1.0 mL·min-1;柱温为25 ℃;波长选择双波长254 nm、210 nm 双波长;进样量:10 μL;色谱柱为C18反向柱(4.6 mm×250 nm,5 μm);植物内源多胺含量提取及测定参考程文翰等[16]的方法略做改动,取0.5 g 材料冰浴研磨,加入5 mL 预冷的5%(体积分数)高氯酸溶液,涡旋混匀后4 ℃浸提1.5 h,然后4 ℃、12 000 r·min-1离心15 min 取500 μL 上清液,加入10 μL 苯甲酰氯、1 mL 2 mol·L-1 NaOH 溶液涡旋混匀,在37 ℃烘箱中温浴30 min 进行衍生反应,反应后加入2 mL 乙醚、2 mL 饱和NaCl 溶液,混匀后4 ℃、5000 r·min-1离心5 min,取乙醚相1 mL 至2 mL 离心管,氮吹至干,加入色谱级甲醇500 μL涡旋溶解,过0.45 μm有机滤膜后使用Agilent 1200 型液相色谱仪测定。流动相的选择为V(甲醇)∶V(水)=60∶40;流速为1.0 mL·min-1;柱温为30 ℃;选择波长254 nm;进样量:10 μL;色谱柱为Agilent XDB-C18(4.6 mm ×150 nm,5 μm)。
1.4 试验试剂
超纯水(4 L),屈臣氏蒸馏水;甲醇(4 L)、苯甲酰氯(25 mL),Sigma公司;石油醚(500 mL),天津市富宇精细化工有限公司;乙酸乙酯(500 mL)、氢氧化钠(500 g),天津永晟精细化工有限公司;乙醚(500 mL),成都市科隆化学品有限公司;氯化钠(500 g),天津盛奥化学试剂有限公司;高氯酸(500 mL),成都金山化学试剂有限公司。
1.5 数据分析
数据使用SPSS 25.0 进行方差显著性分析和相关性分析,显著水平p<0.05,采用Excel 2010 对数据进行整理与作图,所有试验数据均为3 次重复。
2 结果与分析
2.1 不同砧木对赤霞珠葡萄可滴定酸含量的影响
不同砧木对赤霞珠葡萄可滴定酸含量的影响如图1所示。各处理可滴定酸含量随着果实成熟而下降,在果实成熟期达到最低值,在果实转色初期其大小顺序依次为CS>CS/5BB>CS/SO4>CS/140R>CS/3309M>CS/河岸葡萄,CS/河岸葡萄、CS/SO4、CS/140R 和CS/3309M 组合可滴定酸含量显著低于自根苗,CS/5BB 组合与自根苗差异不显著;在果实成熟期不同砧穗组合的可滴定酸含量大小顺序也发生了变化:CS>CS/5BB>CS/140R>CS/3309M>CS/SO4>CS/河岸葡萄,其中所有砧穗组合含量均与赤霞珠自根苗差异显著。在果实成熟期可滴定酸含量比自根苗对照降低19.09%~35.29%。各处理间方差从转色初期的0.57 降至果实成熟期的0.09,说明比起在果实成熟期,砧木对果实转色初期果实酸代谢影响更加明显。
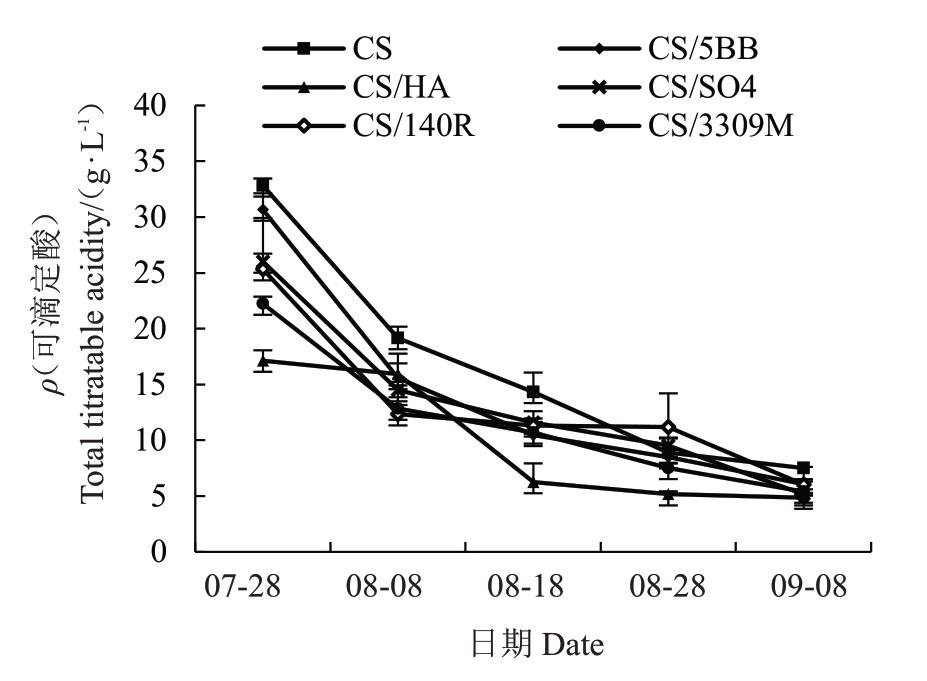
图1 不同砧木对赤霞珠葡萄果实可滴定酸含量的影响
Fig.1 Effects of different rootstocks on titratable acid content of Cabernet Sauvignon grapes
2.2 不同砧木对赤霞珠葡萄还原糖含量的影响
图2为不同砧木对赤霞珠葡萄果实还原糖含量的影响。所有处理从果实转色初期(7月28日)开始,果实还原糖含量上升,至成熟期达到最大值。在果实转色初期各砧穗组合果实还原糖含量从高到低依次为CS/河岸葡萄>CS/140R>CS/SO4>CS/3309M>CS/5BB>CS,其中CS/河岸葡萄、CS/140R、CS/SO4、CS/3309M处理中果实还原糖含量显著高于自根苗,平均高出对照26.21%,而CS/5BB含量和自根苗相比差异不显著;但随着果实成熟,果实还原糖逐渐积累,在成熟期果实还原糖含量高低依次为CS/140R>CS/河岸葡萄>CS/5BB>CS/SO4>CS/3309M>CS,其中仅有CS/140R组合处理显著高于对照,其含量(ρ)达到183.28 g·L-1,较自根苗还原糖含量提升12.56%。通过统计果实成熟过程中各处理间还原糖含量离散程度可以发现,处理间方差分别为17.78、11.04、4.55、4.72、7.0,说明砧木在转色初期对果实还原糖积累的影响更加明显。
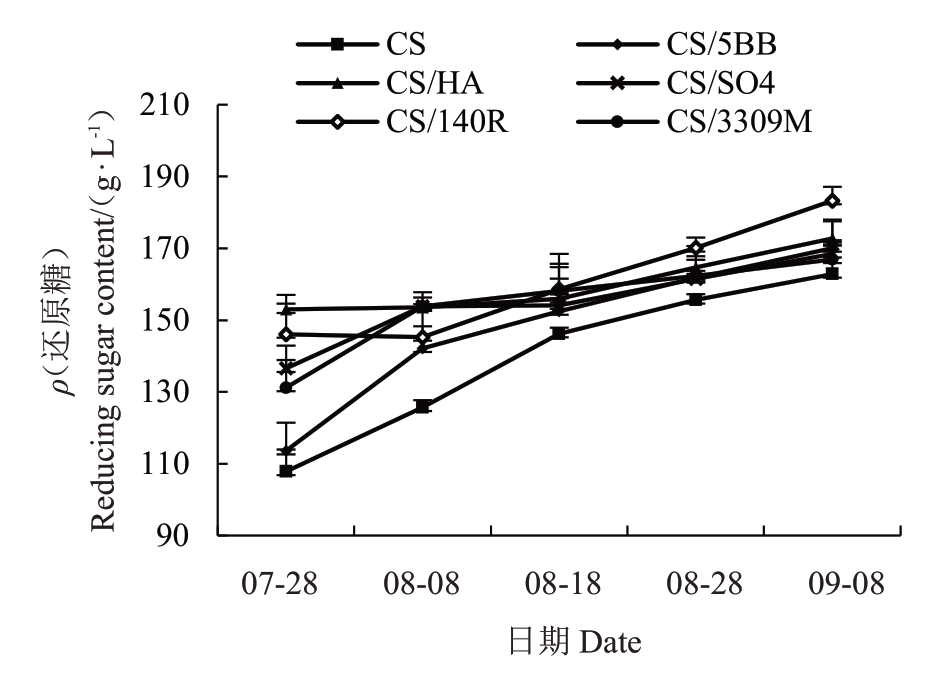
图2 不同砧木对赤霞珠葡萄果实还原糖含量的影响
Fig.2 Effects of different rootstocks on reducing sugar content of Cabernet Sauvignon grapes
2.3 不同砧木赤霞珠葡萄种子中内源激素含量的变化
GA3、IAA、ABA 均参与果实生长发育过程。通过HPLC 分析所得不同砧穗嫁接组合对赤霞珠葡萄种子中GA3、IAA、ABA 含量的影响如图3 所示。不同激素在种子中的变化均不相同,在种子中CS/河岸葡萄、CS/SO4、CS/140R 和CS/3309M 组合GA3 含量在果实转色过程中(7 月28 日至8 月18日)出现先上升后下降的趋势,而后8 月18 日至9月8日4个嫁接组合的种子GA3含量再次出现先增后降的趋势,GA3含量变化趋势整体呈‘M’型,而CS/5BB 和对照处理随着果实发育在8 月18 日GA3含量(w,后同)达到最大值(分别可为54.63 ng·g-1和51.97 ng·g-1),到成熟期后其含量迅速降低至最低水平。在果实完成转色过程中(7月28日至8月8日)各处理种子中GA3平均含量高低次序为CS/河岸葡萄>CS/3309M>CS/140R>CS/5BB>CS/SO4>CS,其中所有组合GA3含量显著高于对照,CS/河岸葡萄GA3平均含量最高(44.7 ng·g-1);而果实成熟期(9 月8 日)各砧穗组合中GA3含量持续下降,GA3 含量由高到低依次为CS/河岸葡萄>CS/3309M>CS/5BB>CS/140R>CS>CS/SO4,其中仅有CS/河岸葡萄组合GA3含量显著高于对照,其余4个砧穗嫁接组合与对照相比差异均不显著。随着果实发育各处理种子中IAA 含量逐渐降低,直到果实成熟期降至最低水平。在果实转色初期(7 月28日)各处理间IAA 含量出现差异从高到低依次为CS>CS/5BB>CS/SO4>CS/3309M>CS/140R>CS/河岸葡萄,自根苗含量最高,达到137.77 ng·g-1;CS/河岸葡萄组合含量最低,为106.23 ng·g-1;各砧穗组合含量与对照相比均差异显著,IAA 含量比较对照平均降低4.45%~22.89%;IAA 含量在果实成熟期高低次序变化为CS/5BB>CS>CS/河岸葡萄>CS/SO4>CS/140R>CS/3309M,其 中 CS/SO4、CS/140R 和CS/3309M 砧穗组合与对照相比差异显著,IAA 含量分别降至58.03 ng·g-1、55.97 ng·g-1 和53.67 ng·g-1,相比同时期对照处理IAA 含量平均降低9.09%~15.93%,CS/5BB 和CS/河岸葡萄与对照相比差异不显著。种子中ABA 含量变化趋势与GA3含量和IAA 含量均不同,在不同砧穗组合中,ABA 含量动态变化也不同,CS/河岸葡萄、CS/140R和CS/3309M组合从转色期开始ABA含量开始下降直到临近成熟期种子中ABA 含量开始上升,而CS/SO4、CS/5BB 与对照处理在7 月28 日至8 月8 日种子中ABA 含量上升,但在转色期到成熟期过程中ABA 含量持续下降,最后在果实成熟期ABA 含量又升高。在果实转色过程中(8 月8 日至8 月18 日)所有处理ABA 含量均处于下降趋势,此时不同砧穗组合间含量由高到低分别为CS>CS/SO4>CS/5BB>CS/3309M>CS/140R>CS/河岸葡萄,种子中ABA 含量平均下降了12.19%;5 种不同的砧穗组合ABA 含量与自根苗差异显著,其中ABA 含量最低的组合为CS/河岸葡萄(320.63 ng·g-1);而在果实成熟期各处理间ABA 含量与转色期明显不同,CS/140R 组合ABA 含量最高,CS/3309M、CS/SO4 和CS/河岸葡萄组合次之,CS/5BB 和自根苗种子中ABA含量最低,CS/140R、CS/3309M、CS/SO4和CS/河岸葡萄组合含量均显著高于自根苗,平均高出1.8%~5.63%,而CS/5BB 组合与自根苗种子中ABA含量差异并不显著。

图3 不同砧木对赤霞珠葡萄种子中GA3、IAA、ABA含量的影响
Fig.3 Effects of different rootstocks on GA3,IAA and ABA content in Grape seeds of cabernet Sauvignon
2.4 不同砧木赤霞珠葡萄种子中内源多胺的变化
多胺是植物生长与果实发育的重要调节物质,本研究测定了不同时期砧穗组合种子中Put、Spd、Spm含量,如图4所示,不同多胺有着不同的变化趋势。各砧穗组合中葡萄种子Put含量在果实转色过程中(7月28日—8月18日)出现先上升后降低的趋势,而随着果实转色的结束,各处理的种子Put含量开始下降,在果实成熟期降至所有时期中的最低水平。7月28日至8月8日,除对照处理外其他砧穗嫁接处理种子Put含量大幅上升,平均上升113.5%,而对照处理只上升了39.09%;在8月8日各砧穗组合中Put含量差异最大,其Put含量依次为:CS/河岸葡萄>CS/140R>CS/3309M>CS/SO4>CS/5BB>CS,所有砧穗组合Put含量显著高于对照,其中CS/河岸葡萄含量最高,达276.03 ng·g-1,较自根苗高出108.17%。各砧穗组合从果实转色期种子的Spd含量下降较快,而果实成熟期平稳下降,于9月8日降至最低水平,平均各处理降低490.91 ng·g-1。在果实转色初期,各砧穗组合种子中Spd 含量由高到低依次为CS>CS/5BB>CS/140R>CS/3309M>CS/SO4>CS/河岸葡萄,此时期所有砧穗组合中Spd含量都显著低于对照处理,对照处理Spd含量达878.63 ng·g-1;CS/河岸葡萄Spd 含量最低,为447.83 ng·g-1,到了果实成熟期,此时各砧穗嫁接组合种子中Spd含量发生变化,CS/140R组合中Spd含量最高,达226.07 ng·g-1;而CS/3309M 和对照含量最低,分别为128.43 ng·g-1和160.9 ng·g-1。种子中Spm含量变化呈现出先上升后降低的趋势,各砧穗组合种子中Spm含量峰值出现在果实成熟前(8 月28 日),从8 月8 日开始,所有处理Spm 含量快速上升,但果实成熟后不同砧穗组合的Spm含量快速降低。在果实转色初期各砧穗组合种子中Spm 含量高低次序为CS/3309M>CS/140R>CS/河岸葡萄>CS/5BB>CS/SO4>CS,所有砧穗嫁接组合种子中Spm 含量显著高于对照,其中CS/3309M组合Spm含量最高,达85.87 ng·g-1;对照组合含量最低,为41.3 ng·g-1。在果实成熟期,各砧穗组合种子中Spm 含量由高到低为CS/5BBB>CS>CS/3309M>CS/河岸葡萄>CS/SO4>CS/140R,其中CS/3309M、CS/河岸葡萄、CS/SO4和CS/140R组合含量显著低于对照,平均比对照降低51.29%,CS/140R组合种子中Spm 含量最低,为53.83 ng·g-1;而CS/5BB组合与对照含量并无显著性差异。

图4 不同砧木对赤霞珠葡萄种子中Put、Spd、Spm含量的影响
Fig.4 Effects of different rootstocks on the content of Put,Spd and Spm in grape seed of cabernet Sauvignon
2.5 不同砧木赤霞珠葡萄可滴定酸含量与种子中激素和多胺含量的相关性分析
利用SPSS分析了转色初期果实还原糖含量、可滴定酸含量与‘赤霞珠’葡萄种子中IAA、GA3、ABA、Put、Spd、Spm 含量的相关性关系。从表1 可以看出种子中GA3、ABA、Put 含量与果实还原糖含量呈极显著正相关(p<0.01);而种子中IAA、Spd 含量与还原糖含量呈极显著负相关(p<0.01)。与还原糖含量相关性分析结果不同的是,种子中GA3、ABA、Put含量均与可滴定酸含量呈极显著负相关(p<0.01);而种子中IAA、Spd含量与可滴定酸含量呈极显著正相关(p<0.01)。
表1 赤霞珠葡萄种子中激素和多胺含量与糖酸含量的相关性分析
Table 1 Correlation analysis of hormones and polyamines content with sugar&acid content in Cabernet Sauvignon Berries

注:*表示显著相关性(p<0.05),**表示极显著相关性(p<0.01)。
Note:*indicate correlation significant difference at p<0.05.**indicate extremely significant difference at p<0.01.
3 讨论
3.1 不同砧木对赤霞珠葡萄种子中激素含量的影响
在植物生长发育过程中,化学结构简单的激素发挥着重要的生理作用[17]。大量研究证明,激素能够调控植物种子萌发、营养生长、花芽分化、果实成熟、植株衰老[18-20]等生理过程。Massimiliano 等[21]通过分子和生化分析证实了葡萄浆果发育速度和生长素代谢调节之间存在联系。通过测定不同砧穗组合在从果实转色期到成熟期种子中GA3、IAA、ABA 含量变化,发现在种子中果实转色期的各类激素含量普遍高于果实成熟期,且通过砧木嫁接能改变种子中相关激素的代谢水平。本研究结果表明各砧穗组合种子中IAA 含量逐渐降低,且自根苗处理常处于同时期所有处理中的较高水平,前人研究[10]认为果实中的激素主要由种子产生,且IAA 抑制了葡萄果实成熟,这也更好地说明了成熟过程中种子中IAA 含量下降以及嫁接后各组合IAA 含量普遍低于同时期的对照处理的原因;在种子中不同砧穗组合中变化趋势复杂,但对比成熟期,转色过程中GA3 含量较高。前人研究[22-23]发现新合成的GA3影响IAA 代谢,表现出抑制植物生长,这解释了本研究中转色过程中GA3含量升高的现象,河岸葡萄、SO4、140R、3309M 砧木以提前种子GA3含量峰值出现的时间来抑制IAA 含量间接促进果实成熟;结合图1 和图2 可以发现,5BB 砧木在转色过程中相比其他砧木促进果实中糖积累与抑制酸代谢能力较差,这也与其种子中GA3含量出现的峰值时期晚于其他4 种砧穗组合有关;本研究结果表明,各砧穗组合ABA 含量总体呈转色期降低而成熟期略微上升的变化趋势,这与高江曼等[24]研究结果一致。Davies 等[25]研究指出,在葡萄果实转色前种子中会大量积累ABA,而随着成熟种子中的ABA 会转移至果肉和果皮中,本试验结果表明转色过程中各砧穗组合ABA 含量峰值出现在不同的日期,同时CS/河岸葡萄、CS/140R 和CS/3309M 组合于转色期还原糖积累优于其他处理,这可能与ABA 促进果实转色和糖积累有关。
3.2 不同砧木对赤霞珠葡萄种子中多胺含量的影响
多胺(polyamines,PAs)是一类存在于植物中的具有强生理活性的分子质量脂肪族含氮碱,常见的多胺有Put、Spd、Spm、尸胺(Cad)和鲱精胺(Agm)等[26]。多胺与高等植物的生长发育有着密切关系,近年的研究报告表明,多胺对园艺作物生长发育具有调控作用[27-28]。伊成勇等[29]认为果实快速生长期和缓慢生长期以Put 和Spd 为主,成熟前膨大期以Spd和Spm为主;Shiozaki等[30]证明葡萄果皮和种子中含有多胺,且果皮中游离的Put和Spd含量较高。
本试验在对葡萄不同时期多胺动态变化趋势的分析中发现,在葡萄种子中,Spd 含量持续降低,Put和Spm 含量出现先上升后降低的变化趋势,且Spm的峰值晚于Put的峰值出现时间。研究结果表明在果实转色期,所有嫁接组合种子中Put、Spm 含量与对照相比显著增加,而各砧穗组合种子中Spd 含量则显著低于对照,说明通过砧木嫁接明显改变了接穗中多胺的代谢水平,这与伊成勇等[31]的结论一致。田义等[32]研究结果表明,Put能促进果皮中花青苷的积累,这一发现解释了转色期种子中Put 含量上升的原因。汪开拓等[33]研究发现,外源Spd 能提高果实花色苷含量,但高浓度的Spd 反而不利于花色苷代谢,这很好地说明了各砧穗组合种子中Spd含量在转色期低于对照处理的原因。同时在果实成熟期各处理间Put、Spd 含量差异为全时期最小,笔者认为砧木嫁接主要影响了果实转色期多胺积累量,而果实进入成熟后多胺代谢回到了同一水平。
3.3 赤霞珠葡萄种子中激素和多胺含量与糖酸含量的相关性分析
相关性分析是衡量两个变量相关密切程度的一种分析方法。本试验通过SPSS 对各砧穗组合转色种子激素及多胺含量与糖酸含量进行相关性分析,结果发现GA3、ABA 和Put 均能促进果实还原糖的积累,抑制可滴定酸的产生。Falchi等[34]研究发现果皮和种子中ABA代谢和桃果实糖积累明显相关;同时赵亚蒙等[35]和蒋恩顺等[36]研究指出赤霉素处理能降低不同葡萄果实中总酸含量,提高还原糖含量;刘英甜等[37]研究发现Put 可以提高植物细胞中还原糖含量和蔗糖合成酶活性。以上研究与本研究结论相一致。而种子中Spd含量和还原糖积累呈负相关可能ABA 加速了乙烯合成,与Spd 合成引发竞争有关[30]。王西成等[38]研究发现NAA 能抑制还原糖积累,促进果实酸代谢,这与本研究种子IAA含量和果实糖酸含量的分析结果一致。
4 结论
通过测定不同砧穗组合转色期至成熟期的糖酸含量及各类激素和多胺含量,发现砧木能降低果实可滴定酸含量,提高还原糖含量,同时砧木能影响接穗种子中激素和多胺的代谢水平,砧木通过降低转色后种子IAA含量来抑制果实发育,促进果实成熟;在转色初期砧木通过提高果实中GA3含量来抑制IAA 的合成,间接促进果实成熟;在葡萄种子中,砧木能降低成熟过程中Spd含量,提高Spm含量。
[1] 江海清,杨和财.新疆葡萄酒产业规划的新视角[J].北方园艺,2016(20):182-186.JIANG Haiqing,YANG Hecai.New perspective of Wine Industrial planning in Xinjiang[J].Northern Horticulture,2016(20):182-186.
[2] 张锋.新疆葡萄酒产业价值链融合发展策略研究[J].中国酿造,2020,39(9):219-223.ZHANG Feng.Research on development strategies of industrial value chains’convergence of wine industry in Xinjiang[J].China Brewing,2020,39(9):219-223.
[3] 赵艳侠,张久慧,亓桂梅.葡萄砧木的应用研究现状及展望[J].北方园艺,2019(11):136-142.ZHAO Yanxia,ZHANG Jiuhui,QI Guimei.Research status and prospects of application of grape rootstocks[J].Northern Horticulture,2019(11):136-142.
[4] MARGUERIT E,BRENDEL O,LEBON E,LEEUWEN C V,OLLAT N.Rootstock control of scion transpiration and its acclimation to water deficit are controlled by different genes[J].New Phytologist,2012,2:416-429.
[5] LOVISOLO S C.Rootstock control of scion response to water stress in grapevine[J].Environmental and Experimental Botany,2013,93(3):20-26.
[6] 范宗民,孙军利,赵宝龙,刘怀锋,于坤,章智钧,刘晶晶.不同砧木‘赤霞珠’葡萄枝条抗寒性比较[J].果树学报,2020,37(2):65-75.FAN Zongmin,SUN Junli,ZHAO Baolong,LIU Huaifeng,YU Kun,ZHANG Zhijun,LIU Jingjing.Evaluation of cold resistance of one-year shoots from‘Cabernet Sauvignon’grape vine grafted on different rootstocks[J].Journal of Fruit Science,2020,37(2):65-75.
[7] 李超,白世践,耿新丽,陈光,赵荣华,蔡军社.不同砧木对‘赤霞珠’葡萄生长发育的影响[J].果树学报,2016,33(10):1241-1250.LI Chao,BAI Shijian,GENG Xinli,CHEN Guang,ZHAO Ronghua,CAI Junshe.Effects of rootstocks on growth and development of‘Cabernet Sauvignon’grape[J].Journal of Fruit Science,2016,33(10):1241-1250.
[8] 何旺,孙军利,赵宝龙,章智钧,刘连玲,潘立忠,常心怡.不同砧木对‘赤霞珠’葡萄果实白藜芦醇含量及其相关酶活性的影响[J].果树学报,2019,36(6):738-747.HE Wang,SUN Junli,ZHAO Baolong,ZHANG Zhijun,LIU Lianling,PAN Lizhong,CHANG Xinyi.Effects of rootstocks on the content of resveratrol and relative enzyme activities in‘Cabernet Sauvignon’grape[J].Journal of Fruit Science,2019,36(6):738-747.
[9] 闫帅,张少瑜,徐锴,袁继存,李晓光,周江涛,程存刚,赵德英.杜梨组培生根过程中多胺、内源激素及相关氧化酶活性的变化[J].果树学报,2019,36(3):318-326.YAN Shuai,ZHANG Shaoyu,XU Kai,YUAN Jicun,LI Xiaoguang,ZHOU Jiangtao,CHENG Cungang,ZHAO Deying.Dynamic changes in polyamines,endogenous hormones and oxidase activities during rooting of in vitro plantlets of Pyrus betulifolia Bunge[J].Journal of Fruit Science,2019,36(3):318-326.
[10] DAVIES C,NICHOLSON E,BOTTCHER C,BURBIDGE C,BASTIAN S,HARVEY E,HUANG A,TAYLOR D,BOSS P.Shiraz wines made from grape berries (Vitis vinifera) delayed in ripening by plant growth regulator treatment have elevated rotundone concentrations and“Pepper”flavor and aroma[J].Journal of Agricultural&Food Chemistry,2015,63(8):2137-2144.
[11] 王晓玥,张国军,孙磊,闫爱玲,王慧玲,任建成,徐海英.砧木对葡萄树体生长和内源激素的影响[J].园艺学报,2020,47(11):2107-2120.WANG Xiaoyue,ZHANG Guojun,SUN Lei,YAN Ailing,WANG Huiling,REN Jiancheng,XU Haiying.Effects of different rootstocks on the growth and endogenous hormones for grape cultivars[J].Acta Horticulturae Sinica,2020,47(11):2107-2120.
[12] 王利廷,高江曼,周亚丽,姜越,段冰冰,惠竹梅.外源ABA 和EBR 处理对酿酒葡萄‘赤霞珠’生长成熟的调控及内源激素的影响[J].北方园艺,2018(3):38-45.WANG Liting,GAO Jiangman,ZHOU Yali,JIANG Yue,DUAN Bingbing,HUI Zhumei.Effects of Exogenous ABA and EBR treatments on endogenous hormones and growth of‘Cabernet Sauvignon’of wine grape[J].Northern Horticulture,2018(3):38-45.
[13] 潘学军,李顺雨,张文娥,刘崇怀.种子败育型葡萄胚珠中内源多胺含量与胚珠发育及败育的关系[J].果树学报,2011,28(5):770-775.PAN Xuejun,LI Shunyu,ZHANG Wene,LIU Chonghuai.Endogenous polyamines in stenospermocarpic grape ovules and their relationship with ovule development and abortion[J].Journal of Fruit Science,2011,28(5):770-775.
[14] 沈碧薇,魏灵珠,崔鹏飞,程建徽,向江,吴江.不同砧木对‘瑞都红玉’葡萄生长结果与果实品质的影响[J].果树学报,2020,37(3):52-63.SHEN Biwei,WEI Lingzhu,CUI Pengfei,CHENG Jianhui,XIANG Jiang,WU Jiang.Effects of different rootstocks on the growth and berry quality in‘RuiduHongyu’grapevines[J].Journal of Fruit Science,2020,37(3):52-63.
[15] 张占畅,孙志红,郑小能,刘怀锋.高效液相色谱法测定库尔勒香梨幼果中的4 种内源激素[J].新疆农业科学,2017,54(5):886-892.ZHANG Zhanchang,SUN Zhihong,ZHENG Xiaoneng,LIU Huaifeng.Determination of four endogenous hormones in the young fruit of Korla Fragrant pear by high performance liquid chromatography (HPLC) [J].Xinjiang Agricultural Sciences,2017,54(5):886-892.
[16] CHENG W H,WANG F L,CHENG X Q,ZHU Q H,SUN Y Q,ZHU H G,SUN J.Polyamine and its metabolite H2O2 play a key role in the conversion of embryogenic callus into somatic embryos in upland cotton (Gossypium hirsutum L.)[J].Frontiers in Plant Science,2015,2:1063-1068.
[17] 段娜,贾玉奎,徐军,陈海玲,孙鹏.植物内源激素研究进展[J].中国农学通报,2015,31(2):159-165.DUAN Na,JIA Yukui,XU Jun,CHEN Hailing,SUN Peng.Research progress on plant endogenous hormones[J].Chinese Agricultural Science Bulletin,2015,31(2):159-165.
[18] GIRIBALDI M,LAURENCE G,DELROT S.Proteomic analysis of the effects of ABA treatments on ripening Vitis vinifera berries[J].Journal of Experimental Botany,2010,61(9): 2447-2458.
[19] 郑焕,任俊鹏,贾玥,章镇,陶建敏.葡萄雌能花新种质(‘2004-6-12’)花蕾发育过程中植物内源激素的变化[J].果树学报,2012,29(3):350-354.ZHENG Huan,REN Junpeng,JIA Yue,ZHANG Zhen,TAO Jianmin.Changes of phytohormone contents during anther abortion of male sterile new grapevine selection‘2004-6-12’[J].Journal of Fruit Science,2012,29(3):350-354.
[20] 李芳菲,马文瑶,程大伟,黄海娜,顾红,陈锦永,杨英军.植物生长调节物质对葡萄着色影响的研究进展[J].果树学报,2019,36(7):928-938.LI Fangfei,MA Wenyao,CHENG Dawei,HUANG Haina,GU Hong,CHEN Jinyong,YANG Yingjun.Advances in grape coloration regulated by plant growth regulators[J].Journal of Fruit Science,2019,36(7):928-938.
[21] MASSIMILIANO C,VANNOZZI A,FIORENZA Z,MOHAMED Z,ELIE M.Grapevine rootstocks differentially affect the rate of ripening and modulate auxin-related genes in Cabernet Sauvignon berries[J].Frontiers in Plant Science,2016,7(2):69-82.
[22] FUENTES S,LJUNG K,SOREFAN K,ALVEY E,HARBERD N P,OSTERGAARD L.Fruit growth in Arabidopsis occurs via DELLA-dependent and DELLA-independent gibberellin responses[J].The Plant Cell,2012,24(10):3982-3996.
[23] MCATEE P,KARIM S,SCHAFFER R,DAVID K.A dynamic interplay between phytohormones is required for fruit development,maturation,and ripening[J].Frontiers in Plant Science,2013,4(79):79.
[24] 高江曼,孟莹,刘庆,王童孟,刘美迎,李汶冰,惠竹梅,张振文.赤霞珠葡萄生长发育过程中内源激素的变化及其与果实成熟的关系[J].食品科学,2017,38(7):167-175.GAO Jiangman,MENG Ying,LIU Qing,WANG Tongmeng,LIU Meiying,LI Wenbing,HUI Zhumei,ZHANG Zhenwen.Changes in endogenous hormones during the development of Vitis vinifera L.cv.Cabernet Sauvignon and their relationship with berry ripening[J].Food Science,2017,38(7):167-175.
[25] DAVIES C,BOTTCHER C.Hormonal control of grape berry ripening[M].Grapevine Molecular Physiology &Biotechnology,2009:229-261.
[26] 向玥如,史端甫,冯怀章,倪萌,杨莉颖,贺利雄.多胺参与植物逆境响应过程的作用机理研究进展[J].湖南农业科学,2014(2):19-22.XIANG Yueru,SHI Duanfu,FENG Huaizhang,NI Meng,YANG Liying,HE Lixiong.Advances in the responding mechanism of polyamines to the abiotic stresses of plants[J].Hunan Agricultural Sciences,2014(2):19-22.
[27] 徐继忠,李晓东,张志华,陈海江,王艳辉.核桃雌雄异熟型品种花芽分化期叶片和芽内源多胺含量的变化[J].园艺学报,2006,33(2):363-365.XU Jizhong,LI Xiaodong,ZHANG Zhihua,CHEN Haijiang,WANG Yanhui.Changes of endogenous polyamines in leave and buds of dichogamous english walnut(Juglans regia L.)during flower bud differentiation[J].Acta Horticulturae Sinica,2006,33(2):363-365.
[28] 莫翱玮,沈元月.多胺氧化酶抑制剂对草莓果实成熟的影响[J].北京农学院学报,2020,35(4):39-42.MO Aowei,SHEN Yuanyue.Effects of polyamine oxidase inhibitors on strawberry fruit riping[J].Journal of Beijing University of Agriculture,2020,35(4):39-42.
[29] 伊成勇,张敏,韦军.柿果实和萼片发育与多胺代谢关系研究[J].江西农业大学学报,2019,41(6):1079-1085.YI Chengyong,ZHANG Min,WEI Jun.Studies on the relationships between the development and polyamine metabolism in persimmon fruits and calyxes[J].Acta Agriculturae Universitatis Jiangxiensis,2019,41(6):1079-1085.
[30] SHIOZAKI S,OGATA T,HORIUCHI S.Endogenous polyamines in the pericarp and seed of the grape berry during development and ripening[J].Scientia Horticulturae,2000,83(1):33-41.
[31] 伊成勇,孙权,张敏,韦军.柿砧穗亲和性与叶片内源多胺种类及含量的关系[J].植物生理学报,2019,55(8):1191-1196.YI Chengyong,SUN Quan,ZHANG Min,WEI Jun.Relationship between compatibility of rootstock-scion and the kinds and contents of endogenous polyamine in leaves of persimmon[J].Plant Physiology Journal,2019,55(8):1191-1196.
[32] 田义,王强,张利义,康国栋,杨玲,郝红梅,杨振英,丛佩华.外源腐胺促进苹果果皮花青苷积累的效应[J].植物学报,2009,44(3):310-316.TIAN Yi,WANG Qiang,ZHANG Liyi,KANG Guodong,YANG Ling,HAO Hongmei,YANG Zhenying,CONG Peihua.Promotion effect of exogenous putrescine on anthocyanin accumulation in‘Red Fuji’apple fruits[J].Chinese Bulletin of Botany,2009,44(3):310-316.
[33] 汪开拓,雷长毅,韦盼盼,刘群,黎春红,蒋永波.亚精胺处理对桃果实贮藏品质及内源乙烯和多胺代谢的影响[J].食品与发酵工业,2020,46(10):92-99.WANG Kaituo,LEI Changyi,WEI Panpan,LIU Qun,LI Chunhong,JIANG Yongbo.Effects of spermidine treatments on storage quality as well as metabolism of endogenous ethylene and polyamines in postharvest peaches[J].Food and Fermentation Industries,2020,46(10):92-99.
[34] FALCHI R,ZANON L,MARCO F D,NONIS A,PFEIFFER A,VIZZOTTO G.Tissue-specific and developmental expression pattern of abscisic acid biosynthetic genes in peach fruit: Possible role of the hormone in the coordinated growth of seed and mesocarp[J].Journal of Plant Growth Regulation,2013,32(3):519-532.
[35] 赵亚蒙,刘迪迪,梁攀,乐小凤,张振文.赤霉素对‘西拉’葡萄果穗及果实品质的影响[J].北方园艺,2018(5):64-68.ZHAO Yameng,LIU Didi,LIANG Pan,LE Xiaofeng,ZHANG Zhenwen.Effects of gibberellin on ear and fruit quality of‘Syrah’grape[J].Northern Horticulture,2018(5):64-68.
[36] 蒋恩顺,宋一超,刘雪丽,杜远鹏,李勃.赤霉素对美乐葡萄果穗长度及果实品质的影响[J].山东农业科学,2020,52(5):118-121.JIANG Enshun,SONG Yichao,LIU Xueli,DU Yuanpeng,LI Bo.Effects of gibberellin on ear length and fruit quality of Merlot grape[J].Shandong Agricultural Sciences,2020,52(5):118-121.
[37] 刘英甜,周文洋,孙菲菲,王京京,詹亚光,范桂枝.腐胺对白桦悬浮细胞蔗糖代谢和三萜积累影响的初步研究[J].中草药,2014,45(17):2534-2540.LIU Yingtian,ZHOU Wenyang,SUN Feifei,WANG Jingjing,ZHAN Yaguang,FAN Guizhi.Effects of putrescine on sucrose metabolism and triterpenoid accumulation in Betula platyphylla suspension cells[J].Chinese Traditional and Herbal Drugs,2014,45(17):2534-2540.
[38] 王西成,吴伟民,赵密珍,钱亚明,王壮伟.NAA 对葡萄果实中糖酸含量及相关基因表达的影响[J].园艺学报,2015,34(3):425-434.WANG Xicheng,WU Weimin,ZHAO Mizhen,QIAN Yaming,WANG Zhuangwei.Effects of NAA on sugar and acid content and related gene expression in grape fruits[J].Acta Horticulturae Sinica,2015,34(3):425-434.