桃(Prunus persica L.)原产于中国,是一种重要的温带落叶果树,主要经济种植区集中于南、北纬度23°~45°之间。桃树耐寒,冬季休眠期花芽可以忍受-23~-26 ℃低温,但在春季,花蕾的受冻温度为-1.7 ℃,开放花朵的受冻温度仅为-1.1 ℃[1]。由于开花较早,北方冷空气南下易使桃树遭受“倒春寒”危害,降低果实产量和品质。因此,研究如何提高桃树抵御早春低温寒害的能力具有重要生产意义。传统认知中,桃树属于先花后叶果树,然而由于全球气候变暖,近几年发现有一些品种出现了花叶同放,甚至先叶后花的现象[2]。而且,叶片是植物光合作用的主要场所,因此在研究“倒春寒”对桃树花期伤害时,不能忽略其对幼叶的影响。Khamis等[3]曾研究外源植物生长调节剂对桃树新梢抗寒性的影响,发现一定浓度矮壮素可以提高枝条耐寒性。谭秋平等[4]提出,展叶期喷施氯化胆碱可以提高油桃抗寒性。其他学者研究发现,喷施天达2116、碧护或爱多收等生长调节剂,可以减轻低温对桃花[5]、大樱桃[6]、葡萄幼叶[7]及西瓜幼苗[8]的伤害。倪鼎文等[9]用水杨酸(Salicylic acid,SA)溶液喷施现蕾期桃花,然后置于3 ℃条件下,发现一定浓度SA 可以提高桃花抗冷性。郜怀峰等[10]报道,春季萌芽后连续喷施一定浓度硼肥可以提高桃树幼苗耐寒性。以上研究喻示,利用外源物质提升果树预防春季寒害能力具有广阔应用前景。但是,相关研究还刚刚起步,离生产应用还比较遥远。
5-氨基乙酰丙酸(ALA)是生物体内所有四吡咯化合物,如叶绿素、亚血红素和光敏色素等生物合成的关键前体[11-12]。Hotta 等[13]最早发现,低浓度的ALA处理可以提高水稻幼苗的抗寒性。汪良驹等[14]发现,ALA能够提高甜瓜幼苗耐冷性。Wang等[15]认为ALA 处理可能通过提高PS Ⅱ反应中心受体侧电子传递链受体获得电子的能力,来促进低温下西瓜叶片的光合作用。Wang等[16]发现,ALA处理能提高小麦幼苗干旱胁迫下PsbA和PsbD的转录从而提高光合作用效率。在辣椒[17]上,ALA 可以提高低温胁迫下叶片抗氧化酶活性,降低膜脂过氧化产物丙二醛(Malondialdehyde,MDA)含量,维持生物膜系统稳定性。最近,田永强等[18]提出,ALA可以缓解低温胁迫对甜樱桃花器官的伤害效应。以上研究表明,ALA有望用于防御果树倒春寒危害。但是,ALA是否可以提高桃树忍耐春季低温胁迫能力尚未见报道。笔者以桃树幼叶为材料,研究了ALA预处理后不同时间以及低温胁迫不同时间对叶片叶绿素快速荧光特性、抗氧化酶活性等生理生化指标及相关基因表达的影响,以期为ALA提高桃树抵御早春低温寒害能力的生产应用提供理论依据。
1 材料和方法
1.1 试材及取样
于2020 年4 月17 日于南京农业大学校园内进行。所用材料为8年生霞脆桃。选取长势相似的桃树12株,分为4组,其中1、2组桃树按东西方位分为两部分,3、4 组按南北方位分为两部分,分别在4 组的东、西、南、北方位用50 mg·L-1 ALA 溶液均匀喷施于叶面,直至有液滴落下为止,树体另一半树叶则喷施等量清水。在ALA预处理后3、6、9和12 d时,避开处理交界区,分别随机采集新梢顶部的幼叶,装于塑料自封袋内迅速运回实验室,置于-6 ℃低温冰柜内进行低温处理,并分别于0、2、4、6 h后取出。其中一部分用于叶绿素快速荧光测定,另一部分用液氮速冻,置于-80 ℃超低温冰箱保存备用。
1.2 测定方法
叶绿素快速荧光诱导动力学曲线和820 nm 调制反射荧光曲线用英国Hansatech公司M-PEA多功能植物效率仪测定,荧光参数计算按照陈慧等[19]的方法进行。叶片相对电导率用雷磁DDSJ-318 型电导仪测定,可溶性糖用蒽酮比色法测定[20],可溶性蛋白质含量用考马斯亮蓝比色法测定[20],脯氨酸含量用茚三酮比色法测定[21],丙二醛(MDA)含量用硫代巴比妥酸法测定[21],过氧化物歧化酶(Peroxidase,POD)活性测定用愈创木酚法测定[22],超氧化物歧化酶(Superoxide dismutase,SOD)活性用氮蓝四唑(Nitro-blue tetrazolium,NBT)光化还原法测定[23],过氧化氢酶活性(Catalase,CAT)用高锰酸钾滴定法测定[20]。所有测定均3次以上重复,取平均值。
桃树叶片总RNA 采用BIOFIT RNA 试剂盒提取,用Primer 5.0 设计相关引物,由上海捷瑞生物技术公司合成(表1)。参照TransScript(One-Step gDNA Removal and cDNA Synthesis Supermix,Transgen Biotech)说明书去除基因组DNA 并合成cDNA。qRT-PCR 采用ChamQ Universal SYBR qPCR Master Mix(Vazyme)试剂盒混合反应体系后用ABI-QuantStudio 6Flex 实时荧光定量PCR 仪测定。用TEF作为桃叶内参基因,每个处理设置3次生物学重复。
表1 引物序列
Table 1 Sequences of primer

1.3 数据统计
数据处理用SPSS 23.0 软件进行方差分析和Duncan’s检验。当p<0.05时,认为试验效应显著;当p<0.01时,认为试验效应极显著。
2 结果与分析
2.1 ALA 预处理对桃树叶片叶绿素快速荧光曲线的影响
图1 是ALA 预处理3 d(图1-A)、6 d(图1-B)、9 d(图1-C)和12 d(图1-D)桃树离体叶片经-6 ℃低温处理0、2、4 和6 h 的叶绿素快速荧光OKJIP 诱导曲线。由图1-A 可以看出,ALA 预处理3 d 的桃叶片,常温(低温0 h)时,初始荧光(O 相,t=50 μs)、K相(t=300 μs)和J相(t=3 ms)荧光值与对照没有明显差异,但I 相(t=30 ms)和P 相(t ≈300 ms)荧光明显高于对照,表明ALA处理能够提高桃叶晚期荧光值。这一现象在低温2 h和4 h后的叶片中依然可见,但在6 h低温胁迫叶片中,ALA预处理与对照间晚期荧光值相差不大,而初始荧光值明显提高,暗示着光合系统已经受到伤害,说明ALA 预处理3 d 没有增强叶片抵抗-6 ℃低温胁迫6 h的能力。与此不完全相同的是ALA预处理6 d叶片,低温胁迫0~4 h叶片的I相和P相荧光值明显高于对照;低温6 h后,2种叶片I相和P相荧光值显著下降,而且没有明显差异,但是O相和K相荧光值显著上升,尤其是对照叶片,显著高于ALA预处理,说明对照叶片此时已经受到低温伤害,而ALA处理能提高叶片忍耐6 h、-6 ℃低温胁迫的能力。这一效应在ALA 预处理9 d 和12 d的叶片中更加明显。届时,ALA预处理叶片在6 h低温处理后的O相和K相荧光值显著低于对照,而I相和P相显著高于后者,说明ALA预处理6~12 d能显著提高桃树叶片忍耐达6 h、-6 ℃低温胁迫能力。

图1 ALA 预处理3(A)、6(B)、9(C)和12 d(D)后桃树叶片在--6 ℃低温胁迫下不同时间的叶绿素快速荧光动力学曲线
Fig.1 The chlorophyll fast fluorescence curves of peach leaves stressed at-6 ℃for different time which were pretreated by ALA solution for 3(A),6(B),9(C)and 12 days(D),respectively
图中数据为15 次生物学重复测定的结果。下同。
The data were measured by 15 biological repeats.The same below.
2.2 ALA预处理对桃树叶片820 nm调制式反射荧光曲线的影响
820 nm调制式反射荧光曲线(图2)反映了PSⅠ反应中心失去电子被氧化以及获得PS Ⅱ反应中心传递而来的电子被还原的过程。其中,MRo/MR 下降阶段反映了PSⅠ反应中心被氧化,上升阶段反映了被还原过程。如图2 所示,ALA 预处理叶片常温时MRo/MR最低值并不低于对照,甚至在3、6、9 d时还高于对照,暗示着ALA预处理并没有影响桃叶片PSⅠ反应失去电子被氧化的能力。但随着-6 ℃低温胁迫时间的延长,ALA 预处理叶片MRo/MR 最低值逐渐低于对照,最高值则高于对照。特别是低温6 h后,ALA预处理6、9和12 d叶片与对照均存在明显差异,说明ALA预处理6 d 便可提高桃叶片PSⅠ反应中心耐低温能力,而且时间越长,效应越显著。

图2 ALA 预处理3(A)、6(B)、9(C)和12 d(D)的桃树叶片经-6 ℃低温处理不同时间后的820 nm 调制反射荧光曲线
Fig.2 The 820 nm modulated reflection fluorescence curve of peach leaves stressed by-6 ℃chilling for different time which were pretreated by ALA for 3(A),6(B),9(C)and 12 days(D)
2.3 ALA预处理对桃树叶片PSII反应中心最大光化学效率的影响
图1 的OKJIP 曲线最大荧光(Fm)与初始荧光(Fo)的差值,被称为可变荧光(Fv),而Fv与Fm的比值Fv/Fm反映了光合系统Ⅱ(PS Ⅱ)反应中心最大光化学效率(φPo)。表2 列出ALA 预处理不同时间桃树叶片经-6 ℃低温胁迫不同时间后的φPo。从中可以看出,低温0 h 或2 h 的叶片,无论是否经ALA 预处理,其φPo没有显著差异,说明短时间-6 ℃低温胁迫没有引起桃树叶片PS Ⅱ反应中心明显伤害,ALA预处理也没有低温保护效应。低温胁迫4或6 h,ALA预处理3 d叶片φPo与对照间仍然没有显著差异,说明预处理3 d 不足以提高桃树叶片耐寒性。但是,ALA 预处理6 d 的叶片经低温胁迫6 h 后显著高于对照;预处理9 d 的叶片,低温胁迫4 h 或6 h 后φPo显著高于对照;预处理12 d的叶片,低温胁迫6 h后φPo也显著高于对照。这些结果说明,-6 ℃低温胁迫4 h 将伤害桃树叶片PS Ⅱ反应中心,ALA 预处理6 d可以显著提高桃树叶片PS Ⅱ反应中心忍受低温胁迫的能力。
表2 ALA 预处理对--6 ℃低温胁迫下桃树叶片PSII 反应中心最大光化学效率(φPo)的影响
Table 2 Effect of ALA pretreatment on the maximum photochemical efficiency(φPo)of PSII reaction center of peach leaves under-6 ℃chilling stress
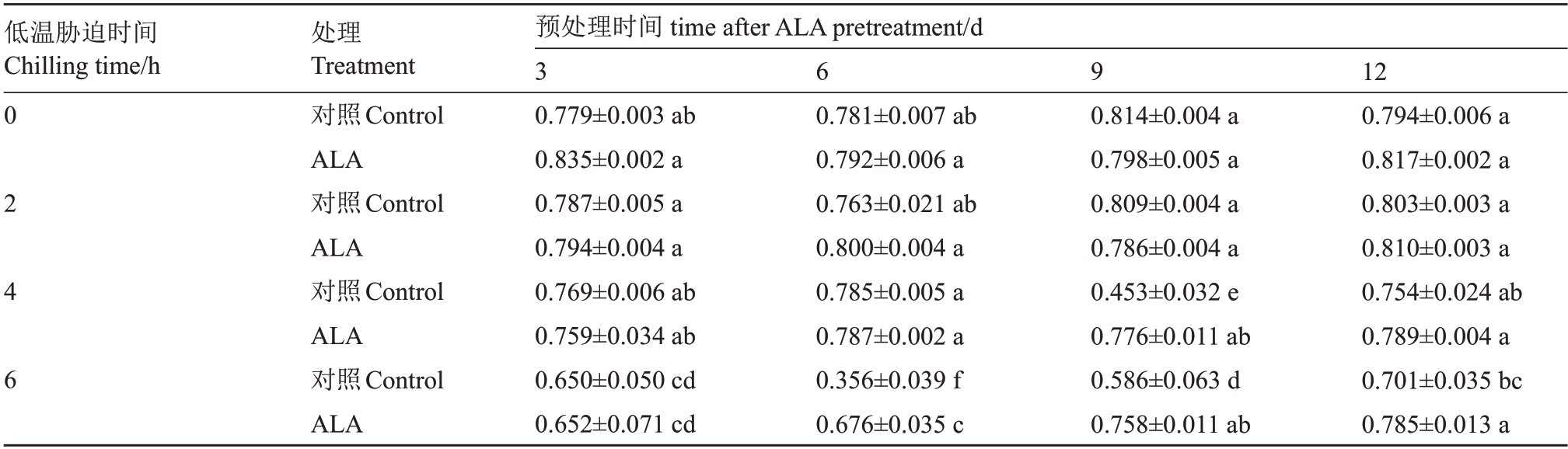
注:表中数据为15 次生物学重复测定获得的平均值±标准误。不同小写字母表示在p<0.05 水平上差异显著。
Note:The data are the means±SE of 15 biological repeated measurements.The same lowercases represent significant difference at p<0.05 level.
对表2 数据做三因素方差分析后发现,ALA 预处理、预处理时间以及低温时数都显著影响φPo,而且不同因素间存在互作关系(F>F0.01)。将不同预处理时间和低温时间的φPo平均值列入图3,可以看出,预处理3 d的φPo与对照间差异不显著,6 d和9 d时,则显著高于对照(p<0.05),暗示着利用ALA 提高桃树叶片PS Ⅱ反应中心对低温胁迫的忍耐力需要提早6~9 d预处理(图3-A)。图3-B显示,-6 ℃低温胁迫2 h没有显著影响桃树叶片φPo;低温胁迫4 h或6 h 后,对照叶片φPo显著下降,而ALA 预处理叶片可以维持较高水平,表明ALA预处理可以提高桃树叶片PS Ⅱ反应中心忍受4 h以上-6 ℃低温胁迫的能力。
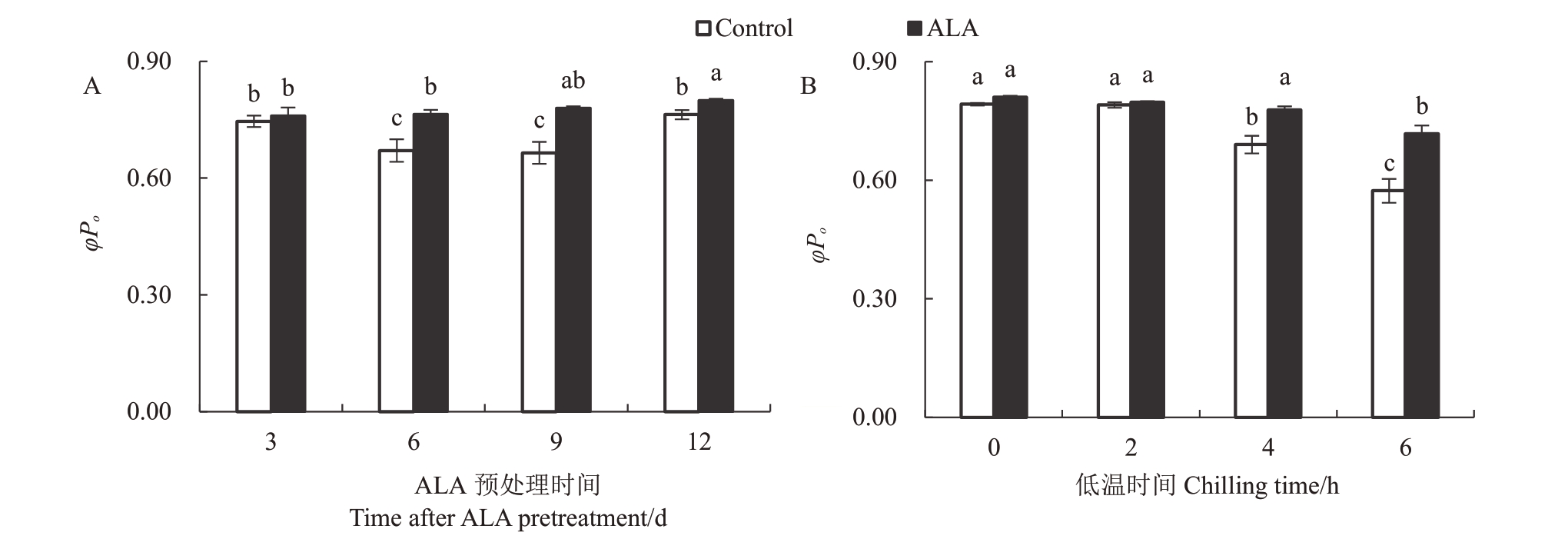
图3 ALA 预处理对桃树叶片--6 ℃低温胁迫下PS Ⅱ反应中心最大光化学效率(φPo)的影响
Fig.3 The effect of ALA pretreatment on the maximum photochemical efficiency(φPo)of PS Ⅱreaction center of leaves of peach stressed by-6 ℃chilling
图中数据为三因素方差分析后ALA 预处理天数(A)、低温胁迫时间(B)与ALA 处理间互作效应平均值±标准误。不同小写字母代表在p<0.05 水平上差异显著。下同。
The data are the means±SE of the interaction effects between the ALA pretreatment days(A),the chilling time(B)and ALA treatment after threefactor analysis of variance.The same lowercases represent significant difference at p<0.05.The same below.
2.4 ALA 预处理对桃树叶片PSII 反应中心还原末端电子受体的光化学效率(φRo)的影响
φRo是植物叶片PSⅠ反应中心还原末端电子受体的能力,用来反映PSⅠ反应中心最大光化学效率。三因素方差分析表明,桃树叶片φRo忍受-6 ℃低温胁迫的能力与ALA预处理时间有关,也与低温胁迫时间有关(F>F0.01),但与ALA预处理本身无关(F<F0.05)。但是,不同因素间存在极显著的互作效应(F>F0.01)。图4-A显示,除了预处理9 d的桃树叶片φRo显著高于对照外,其他时间φRo与对照均无显著差异。图4-B显示,经ALA预处理的桃树叶片在低温0 h或低温2 h时的φRo显著低于对照,但在低温胁迫4 h或6 h叶片中,φRo显著高于对照(p<0.05),说明ALA预处理对非胁迫环境或者胁迫不强条件下的φRo没有促进效应,但是能够显著提高胁迫环境下桃树叶片PSⅠ反应中心最大光化学效率。
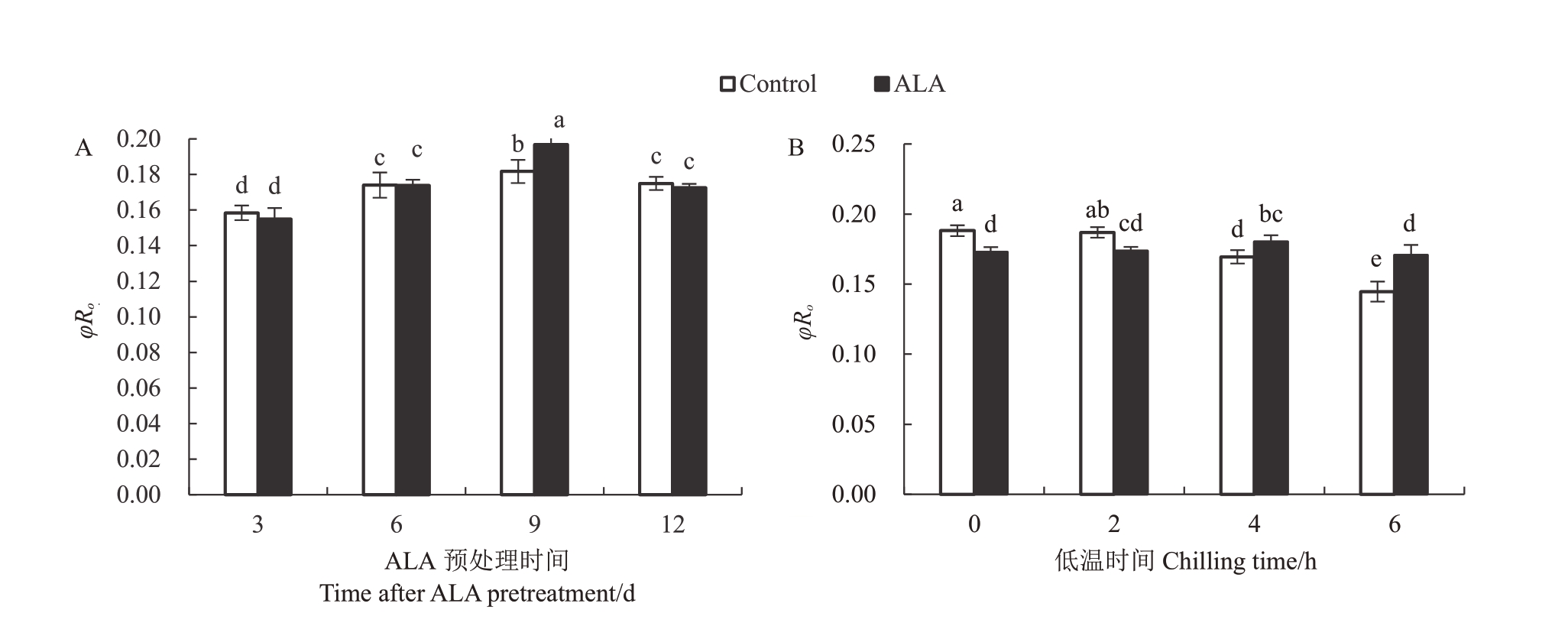
图4 ALA 预处理对桃树叶片--6 ℃低温胁迫下PSⅠ反应中心还原末端电子受体的光化学效率(φRo)的影响
Fig.4 The effect of ALA pretreatment on the photochemical efficiency(φRo)of reducing the end acceptors of PSI reaction center of peach leaves stressed by-6 ℃chilling
2.5 ALA预处理对桃树叶片PSⅠ反应中心失去电子被氧化的最大速率(VPSI)的影响
根据图2中820 nm调制反射荧光吸收曲线下降阶段MRo/MR可以计算出PSⅠ反应中心失去电子被氧化的最大速率VPSI。方差分析表明,ALA 预处理时间、低温胁迫时间以及ALA预处理本身均对桃树叶片VPSI有极显著影响,而且三者间存在互作效应(F>F0.01)。ALA 预处理的VPSI总平均值比对照高3.3%,达到显著差异水平(p<0.05)。图5-A 显示,ALA预处理3 d或6 d的桃树叶片VPSI与对照没有明显差异,但预处理9 d 或12 d 时,VPSI显著高于对照,说明ALA预处理9 d后能提高桃树叶片VPSI。图5-B显示,ALA 预处理叶片VPSI在低温0 或2 h 时并不高于对照,但在低温4 h或6 h后,ALA处理叶片VPSI显著高于对照(p<0.05),说明ALA 预处理可以缓解低温胁迫对桃树叶片PSⅠ反应中心传递电子还原末端电子受体的伤害效应。
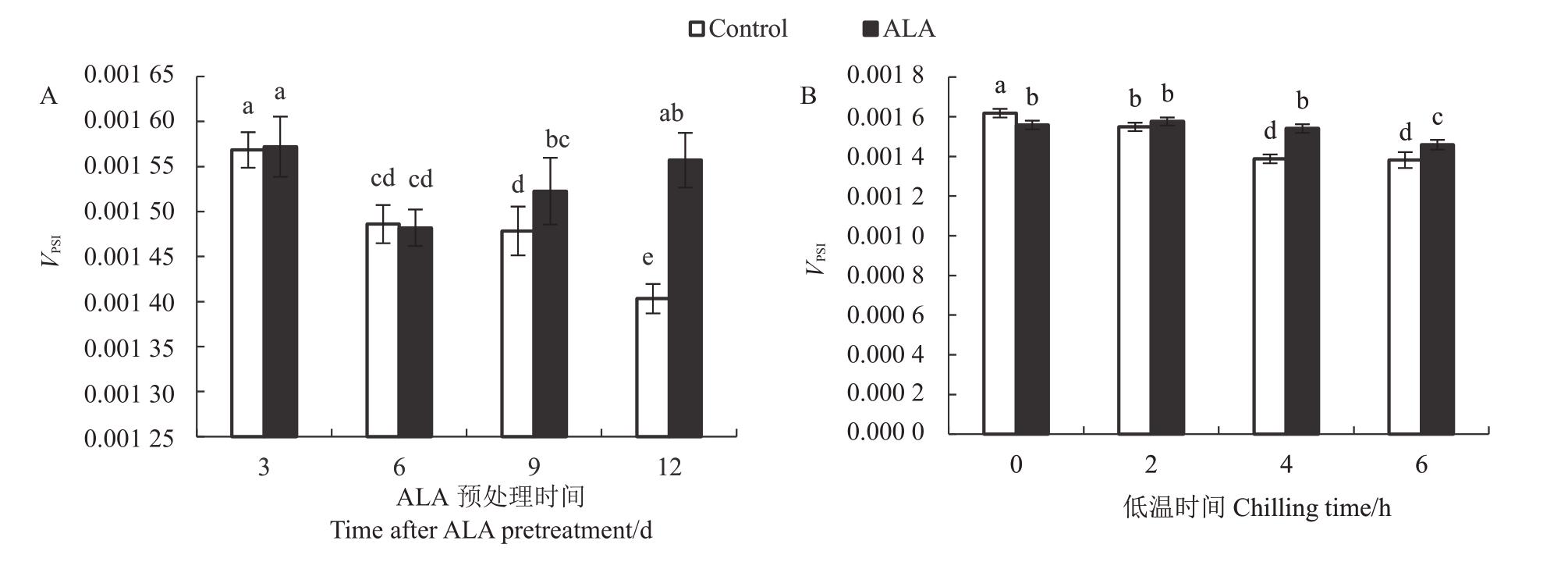
图5 ALA 预处理对桃树叶片--6 ℃低温胁迫下PSⅠ末端电子受体被还原的最大速率(VPSI)的影响
Fig.5 The effect of ALA pretreatment on the maximum rates of reducing end electron acceptors of PSⅠof peach leaves stressed by-6 ℃chilling
2.6 ALA 预处理对桃树叶片PSⅠ反应中心接收PS Ⅱ传递电子被还原的最大速率(VPSII-PSI)的影响
根据图2 中MRo/MR 曲线上升段,可以计算出PSII 反应中心传递而来的电子还原PSⅠ反应中心的最大速率VPSII-PSI。方差分析表明,ALA 预处理时间、低温胁迫时间以及ALA预处理本身均对桃树叶片VPSII-PSI有极显著影响,而且三者间存在互作效应(F>F0.01)。ALA 预处理的总平均值比对照高出15.8%(p<0.05)。显然,ALA 预处理对VPSII-PSI的保护效应远远大于VPSI,说明它对2 个光合系统,特别是PSII的保护效应更大。图6-A显示,除了ALA预处理3 d的桃树叶片VPSII-PSI显著低于对照外,其他时间点的VPSII-PSI总是处理高于对照,说明ALA 预处理显著提高桃树叶片PS Ⅱ与PSⅠ之间电子传递速率。图6-B显示,-6 ℃低温胁迫2 h,桃树叶片VPSII-PSI显著下降,而且随着胁迫时间延长而迅速降低。ALA 预处理显著提高低温胁迫下桃树叶片VPSII-PSI。这一效应在低温2 h 时便显现,4 h 时最明显,6 h 时依然存在,说明ALA 预处理可以保护桃树叶片,防止低温胁迫对2个光合系统之间电子传递产生伤害效应。
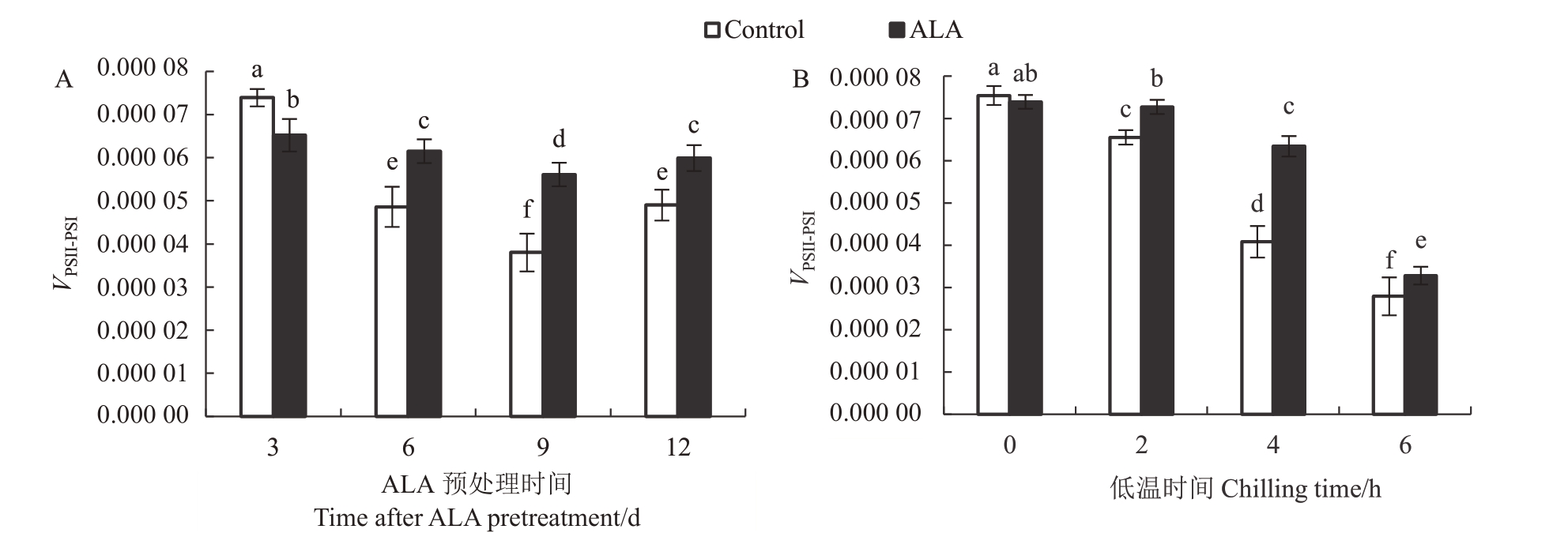
图6 ALA 预处理对桃树叶片--6 ℃低温胁迫下PS Ⅱ与PSⅠ之间电子传递最大速率(VPSII-PSI)的影响
Fig.6 The effect of ALA pretreatment on the maximum electron transfer rates between PS Ⅱand PSⅠof peach leaves stressed by-6 ℃chilling
2.7 ALA 预处理对桃树叶片相对电导率和渗透溶质的影响
鉴于ALA预处理6 d后桃树叶片耐寒性与对照间存在显著差异,笔者以该时期叶片为材料,分析其在低温胁迫下的生理生化变化。如图7-A 所示,随着低温时间延长,叶片相对电导率迅速上升,其中对照在2、4 和6 h 时分别比0 h 高出34.33%、47.37%和52.41%,而ALA 处理比0 h 分别高出15.27%、20.85%和43.92%。ALA 叶片受伤害程度显著低于对照。从图7-B 看,ALA 预处理显著提高早春时期桃树叶片可溶性糖含量(p<0.05),同时,低温胁迫也导致可溶性糖含量上升。与0 h相比,低温胁迫6 h时的对照和ALA 预处理叶片可溶性糖含量分别提高了28%和17%(p<0.05)。图7-C 显示,低温胁迫前,ALA预处理和对照叶片可溶性蛋白质含量没有显著差异,低温胁迫导致可溶性蛋白含量呈现先上升后下降的变化趋势。但是,对照叶片变化没有达到显著水平(p>0.05),而ALA 预处理叶片在低温处理后可溶性蛋白质含量显著高于常温(p<0.05),暗示着ALA 预处理叶片在低温胁迫下可能合成新的蛋白质。图7-D显示,常温下ALA预处理叶片与对照间游离脯氨酸含量没有明显差异。低温处理2 h时,对照叶片脯氨酸含量上升20%(p<0.05),此后又回落到常温水平;ALA预处理叶片在低温胁迫2 h时,脯氨酸含量上升33%,此后也有回落,但在6 h胁迫期间始终显著高于常温时(p<0.05),说明ALA预处理叶片可以积累更多游离脯氨酸。

图7 ALA 预处理6 d 后桃树叶片在-6 ℃低温胁迫下不同时间的相对电导率(A)及可溶性糖(B)、可溶性蛋白(C)和脯氨酸含量(D)的比较
Fig.7 Comparison of relative electrical conductivity(A),soluble sugars(B),soluble proteins(C)and proline content(D)of six-day ALA pretreated peach leaves under-6 ℃chilling for different times
2.8 ALA 预处理对桃树叶片抗氧化酶活性及丙二醛含量的影响
常温时,ALA 预处理6 d 就能显著提高桃树叶片超氧化物歧化酶(SOD)活性(图8-A)。低温胁迫后,桃树叶片SOD 活性呈现先上升后下降的趋势,但ALA 预处理叶片可以较长时间保持较高的酶活性,特别是胁迫4 h和6 h时,酶活性显著高于对照。过氧化物酶(POD)也有类似的变化趋势(图8-B)。但是,该酶活性在常温下,ALA 预处理与对照间没有明显差异;低温胁迫后,ALA 预处理叶片POD 活性迅速上升,并一直保持较高水平,而未经ALA 处理叶片POD 活性只有少量上升,6 h 时回落到常温水平,此时,ALA 预处理叶片POD 活性比未处理的高出1 倍。低温胁迫导致其CAT 活性逐渐下降(图8-C),但是ALA预处理叶片在低温胁迫4 h和6 h时CAT 活性显著高于对照。这些结果说明,低温胁迫导致桃树叶片抗氧化酶活性整体上呈下降趋势,尽管SOD 和POD 酶活性先有一定量上升,而ALA 预处理可以提高酶活性上升幅度和持续时间,降低酶活性下降幅度,从而有利于提高叶片抗氧化能力。从图8-D可以看出,常温下,ALA预处理叶片没有影响新梢叶片脂质过氧化产物丙二醛(MDA)含量,但是在-6 ℃低温下,ALA预处理叶片MDA含量几乎没有变化,而未经ALA 预处理叶片MDA 含量在低温处理2 h 时就显著上升,4 h 时比常温时高出30%,说明此时叶片细胞膜系统受到明显伤害。

图8 ALA 预处理6 d 后桃树叶片在--6 ℃低温下不同时间的SOD(A)、POD(B)、CAT(C)活性以及丙二醛含量(D)的比较
Fig.8 Comparison of superoxide dismutase(A),peroxidase(B),catalase activity(C)and malonaldehyde content(D)of sixday ALA pretreated peach leaves under-6 ℃chilling for different times
2.9 ALA预处理对桃树叶片PSII反应中心相关基因表达的影响
图9 显示,随着低温时间延长,对照叶片PsbA基因显著下调,ALA预处理在前2 h保持稳定,随后也显著下调,与对照间没有显著差异,说明编码PS Ⅱ反应中心核心蛋白D1 基因对低温敏感,ALA 没有保护该基因表达效应。PsbB 编码PS Ⅱ反应中心CP47亚基。低温0 h,ALA预处理叶片PsbB相对表达量略高于对照;随着胁迫时间延长,对照PsbB 表达量逐渐下降,而ALA预处理叶片在早期反而显著提高,即使低温6 h时也显著下降,但仍然高于对照,说明ALA 对该亚基基因表达的保护效应可能与PS Ⅱ活性有关。Psb28、PsbO、PsbR 和PsbY 分别编码PS Ⅱ中不同亚基。低温胁迫0~2 h 时,ALA 预处理对桃树叶片这些基因表达没有显著影响,但随着低温时间延长,ALA对它们的表达有着不同的促进效应,其中,Psb28、PsbR、PsbY 表达量在4 h 时显著高于对照,而PsbO 在低温4~6 h 时,ALA 处理叶片相对表达量均显著高于对照(p<0.05),说明低温胁迫抑制桃树叶片PS Ⅱ反应中心关键蛋白基因表达,而ALA预处理具有显著的保护效应。

图9 ALA 预处理6 d 后桃树叶片在-6 ℃低温下不同时间PSII 反应中心相关基因的表达的比较
Fig.9 Comparison of gene expressions of PSII reaction centers in six-day ALA pretreated peach leaves under-6 ℃chilling for different times
2.10 ALA预处理对桃树叶片中脯氨酸代谢相关基因表达的影响
P5CS1 和P5CR 分别编码脯氨酸生物合成关键酶Δ-吡咯琳-5-羧酸合成酶和还原酶,而PDH编码脯氨酸脱氢酶。如图10,随着低温胁迫时间延长,桃树叶片P5CS1 和P5CR 相对表达量逐渐降低,特别是低温4 h 后,相对表达量显著低于常温水平。ALA处理叶片2种基因表达量显著高于对照,相反,PDH 在低温4 h 时有一定下降,而ALA 处理叶片在6 h 时显著低于对照,说明ALA 处理可能促进低温下桃树叶片脯氨酸合成基因表达,抑制降解基因表达。
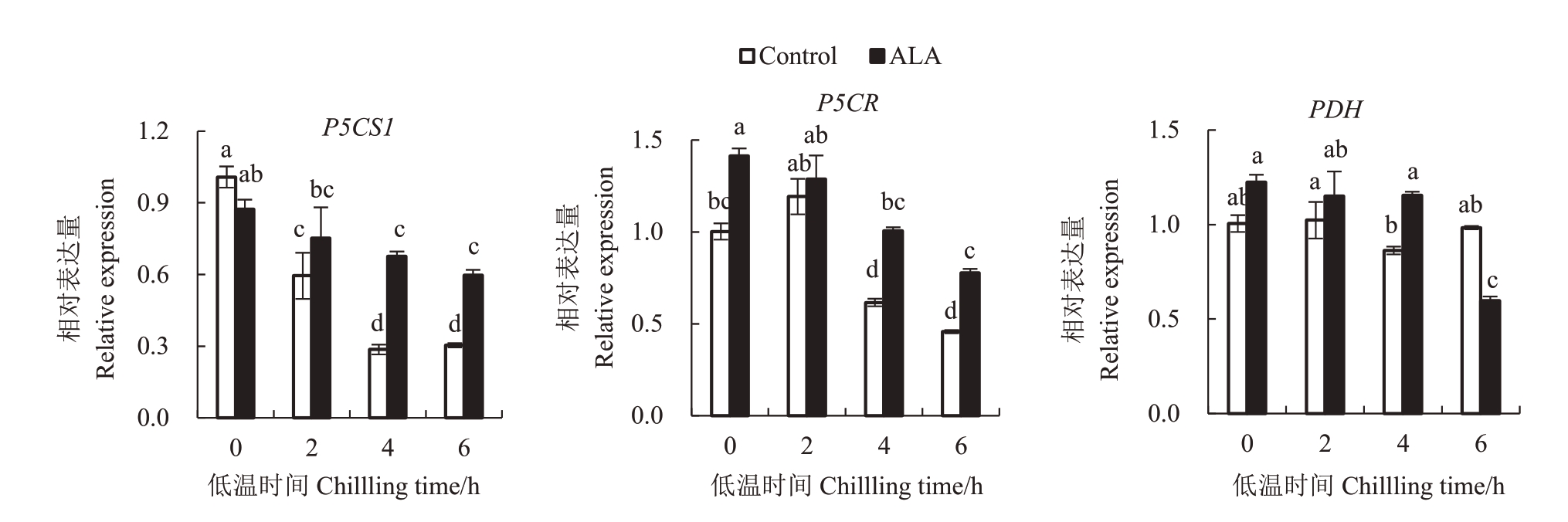
图10 ALA 预处理6 d 后桃树叶片在--6 ℃低温下不同时间脯氨酸代谢相关基因的相对表达
Fig.10 Relative expression of genes coding the key enzymes in proline metabolism in six-day ALA pretreated peach leaves stressed by-6 ℃chilling for different time
3 讨论
桃树比较耐寒,一般的冬季低温不至于引起严重冻害[24]。相比而言,春季晚霜往往是影响桃树生产的主要灾害[5]。因此研究早春寒害,研制御寒措施对于现代果树生产具有重要现实意义[6,10]。农业气象学上所谓的“倒春寒”是指北半球地区3月后气温回升较快,4至5月份气温较常年偏低2 ℃以上的天气现象[25],并不是绝对温度概念。但在果树上,春季萌芽特别是开花之后,突遇低温寒流,导致果树寒害,则称为“倒春寒”[26]。它有3 种类型。一是辐射型,气温降至-2~-1 ℃,主要发生在凌晨数小时;二是平流型,温度可降至-3~-5 ℃,持续时间更长;三是混合型,即辐射型与平流型同时发生,其时间更长,危害更重。本研究设计的低温为-6 ℃,最长时间为6 h,达到了一般性早春寒害的极限。在这种胁迫强度下ALA处理桃叶仍然保持一定活性,就可以抵抗绝大多数晚霜危害。
5-氨基乙酰丙酸(ALA)作为一种新型植物生长调节物质,已经被证明能够提高植物耐寒性[11-12,27]。田永强等[18]于春季开花前将樱桃花枝离体水培于人工培养箱中,外源喷施不同浓度ALA 溶液。盛花后,转移到-2 ℃低温条件下2 h,发现ALA可以提高樱桃花器耐寒性。作者提出,外源ALA可以提高低温胁迫下花柱和子房抗氧化酶活性,增加还原型抗坏血酸和还原型谷胱甘肽含量,减少活性氧含量,降低膜脂过氧化程度,暗示着ALA通过提高抗氧化酶活性来抵御果树倒春寒危害。本研究发现,ALA提高低温胁迫下桃树叶片SOD、POD 和CAT 活性,同时降低膜脂过氧化产物MDA 含量,说明ALA 提高植物抗氧化系统活性是其增强植物耐寒性的重要因素[28]。
利用植物效率仪和JIP分析技术来研究植物抗逆性已经有许多报道[29-30]。陈慧等[19]观察到,50 mg·L-1 ALA 溶液处理杜鹃和香樟,25 d 后采集叶片置于-20 ℃低温胁迫下10~30 min,ALA处理叶片可以维持较高的φPo和φRo,同时提高VPSI以及VPSII-PSI。这一现象在本试验中获得证实,ALA预处理桃树叶片在低温胁迫下φPo和φRo、VPSI和VPSII-PSI均显著高于对照。这些结果说明,桃树与杜鹃或香樟等树木一样,叶片ALA预处理可增强其耐寒性。然而,本试验中测定获得的许多荧光参数,如Wk、Mo、Vj并没有像前文[19]那样显示出符合规律的变化。比如,K 相相对荧光Wk,反映的是PS Ⅱ供体侧放氧复合体受抑活性。陈慧等[19]报道,经ALA处理的香樟和杜鹃叶片在低温胁迫下Wk低于对照,说明放氧复合体受抑程度下降。但在本研究中,经ALA处理的桃树叶片Wk并不低于对照,甚至还高于对照(数据未列出),说明这些荧光参数与前人报道不一致。类似情况存在于Mo,即PS Ⅱ反应中心关闭的最大速率。这可能与树种差异有关,更重要的,可能与ALA 预处理的时间或者低温胁迫时期有关。陈慧等[19]试验于4月21日用ALA处理,5月中旬采集叶片进行低温处理,此时叶片已经成熟,而本试验于4月中旬处理,且以幼叶为试材。因此,幼叶耐寒性除了与ALA 处理有关外,还可能与发育时期和组织成熟度有关。用植物效率仪和JIP分析法来研究早春叶片耐寒性时,部分荧光参数不符合一般性规律,需要根据情况综合分析。
前人[4,6]有关外源物质提高果树抗逆性研究多数没有注意使用时间。低温来临时才处理,植物没有吸收转化并诱导相应生理生化反应,其提高抗逆性能力有限[31]。吴雯雯等[32]提出,利用ALA 提高草莓耐盐性效应以预处理最好,直接处理的其次,盐后补施的效果较差。本研究结果符合前文报道。ALA预处理3 d,桃树叶片抗寒性未有体现;提早6 d处理,开始出现明显抗寒性;处理9 d时,效果更好;处理12 d,效果依然存在,但仅次于9 d。这些现象暗示,桃树上用ALA来抵御早春寒害需要提早1周处理,才能起到较好效果。
有关ALA提高桃树叶片耐寒性的机制,除了上面提到的抗氧化酶活性外,还与脯氨酸积累有关。刘辉等[33]曾报道,ALA 促进低温胁迫下茄子幼苗脯氨酸积累。本研究表明,ALA预处理叶片游离脯氨酸含量高于对照,低温胁迫后,两者差异越发显著。除此之外,ALA处理诱导P5CR表达显著上调,而在低温胁迫下,使P5CS1 和P5CR 均保持较高表达活性,相反,PDH 则表达下调。这些结果说明ALA 可能通过诱导桃树叶片脯氨酸积累抵御低温胁迫。
另外,鉴于ALA提高桃树叶片耐寒性与其增强PS Ⅱ反应中心活性有关,笔者分析了PS Ⅱ反应中心相关蛋白编码基因表达差异,结果发现,至少有5个基因表达受到ALA预处理的保护。PsbB编码PS Ⅱ反应中心CP47亚基,它是光合电子传递链的重要成员[34]。低温胁迫导致PsbB表达下调,而ALA预处理可以显著促进其表达上调,并抑制低温导致的表达下调。Psb28 编码一种类似于PS Ⅱ反应中心W 亚基蛋白,其功能与CP47 和PsaA/PsaB 合成有关,并维护PS Ⅱ超分子组织稳定性[35]。不过,-6 ℃低温2 h并没有影响Psb28表达,但低温4 h后基因表达显著下调,而ALA预处理可以维持较高的表达活性。类似情况表现在PsbR、PsbO和PsbY基因表达。PsbR、PsbO 与放氧复合体(OEC)的组装以及锰簇结合活性有关[36-37],PsbY 与Cytb559 的氧化还原控制有关[38]。许照耀等[37]报道,低温胁迫下白菜型冬油菜PsbR 表达下调,Pn和φPo下降,说明PsbR 表达对低温胁迫比较敏感。但是,笔者在分析荧光参数时却没有观察到ALA 可以缓解低温胁迫下桃树叶片Wk的上升(数据未列出)。因而,ALA对OEC活性的调节效应还有待研究。另外,PsbA编码PS Ⅱ核心蛋白D1,它在胁迫下迅速降解并重新合成以修复PS Ⅱ[39]。本文观察到低温胁迫导致桃树叶片PsbA表达受抑,特别是6 h时,说明它对低温十分敏感,ALA预处理没有提高该基因表达活性。也许这是叶片最终受冻的重要原因。
ALA可以提高叶片光合性能,促进碳水化合物积累[11]。本文观察到ALA 预处理的桃树叶片可溶性糖含量显著高于对照,这一现象无论是在低温胁迫前还是胁迫后均显著存在。糖分可以作为渗透调节溶质,提高细胞耐寒性。本研究中发现ALA处理叶片的相对电导率显著低于对照,可能与包括糖、脯氨酸和可溶性蛋白含量较高有关。
4 结论
综上所述,春季寒潮来临前,提前6 d 叶面喷施ALA 溶液可以提高桃树耐寒性。这种效应至少可以持续到第12天。ALA可以提高抗氧化酶活性,减少膜脂过氧化,诱导PS Ⅱ反应中心部分基因上调表达,提高叶片光合性能,上调脯氨酸合成基因表达,抑制降解基因表达,积累更多渗透调节溶质,从而缓解低温胁迫对桃树叶片的伤害。
[1] 陈杰忠.果树栽培学各论(南方本第四版)[M].北京:中国农业出版社,2011.CHEN Jiezhong.Fruits cultivation theory (For Southern,the fourth edition)[M].Beijing:China Agriculture Press,2011.
[2] 严娟,张明昊,蔡志翔,沈志军,马瑞娟,徐子媛,宿子文,俞明亮.需冷量和需热量差异对桃花叶物候进程的影响[J].植物遗传资源学报,2021,22(5):1281-1292.YAN Juan,ZHANG Minghao,CAI Zhixiang,SHEN Zhijun,MA Ruijuan,XU Ziyuan,SU Ziwen,YU Mingliang.Effects of chilling and heat requirement differences between peach floral bud and leaf bud on their phenological process[J].Journal of Plant Genetic Resources,2021,22(5):1281-1292.
[3] KHAMIS R,HOLUBOWICZ T,何忠春.叶面施用丁酰肼、乙烯利、脱落酸和矮壮素对桃树耐寒性的效应[J].福建热作科技,1987(1):51-53.KHAMIS R,HOLUBOWICZ T,HE Zhongchun.Effects of butyryl hydrazine,ethephon,abscisic acid and chlormequat on cold tolerance of peach trees[J].Fujian Science &Technology of Tropical Crops,1987(1):51-53.
[4] 谭秋平,李玲,李冬梅,陈修德,高东升.氯化胆碱对低温胁迫下油桃叶片膜系统的稳定作用[J].山东农业大学学报(自然科学版),2012,43(4):491-496.TAN Qiuping,LI Ling,LI Dongmei,CHEN Xiude,GAO Dongsheng.Choline chloride stability membrane system in nectarine leaf under chilling stress[J].Journal of Shandong Agricultural University(Natural Science Edition),2012,43(4):491-496.
[5] 刘兆宇,张晓煜,南学军,胡宏远.不同防霜剂对宁夏灌区桃花抵御霜冻的效果研究[J].山东农业科学,2020,52(4):131-135.LIU Zhaoyu,ZHANG Xiaoyu,NAN Xuejun,HU Hongyuan.Effects of different anti-frost reagents on peach blossom against frost in Ningxia irrigation region[J].Shandong Agricultural Sciences,2020,52(4):131-135.
[6] 施海燕,呼丽萍,侯亚茹.不同药剂组合对‘红灯’大樱桃花器官抗寒性的影响[J].果树学报,2014,31(1):91-95.SHI Haiyan,HU Liping,HOU Yaru.Effect of chemical spray on cold resistance of floral organ of‘Hongdeng’sweet cherry[J].Journal of Fruit Science,2014,31(1):91-95.
[7] 宋伟,孙鲁龙,杜远鹏,翟衡.不同防霜剂对赤霞珠葡萄幼叶抵御霜冻的效果研究[J].中外葡萄与葡萄酒,2016(1):6-9.SONG Wei,SUN Lulong,DU Yuanpeng,ZHAI Heng.Effects of different anti-frost agents on young leaves of Cabernet Sauvignon grapevine in resisting frost[J].Sino-Overseas Grapevine&Wine,2016(1):6-9.
[8] 李长根,孙兴祥,马江黎.6 种生长调节剂对西瓜低温胁迫的恢复效果[J].中国瓜菜,2019,32(8):120-123.LI Changgen,SUN Xingxiang,MA Jiangli.Effect of 6 growthregulating substances on watermelon recovery under low temperature stress[J].China Cucurbits and Vegetables,2019,32(8):120-123.
[9] 倪鼎文,李唯,杜志钊,柳永强,石丽娜,黄冰雪.外源SA 对白粉桃低温胁迫下花器的生理效应[J].甘肃农业大学学报,2007,42(6):53-56.NI Dingwen,LI Wei,DU Zhizhao,LIU Yongqiang,SHI Lina,HUANG Bingxue.Physiological effects of exogenous SA on the floral organs of the peach cultivar Amygdalus persica `Baifen'under low temperature stress[J].Journal of Gansu Agricultural University,2007,42(6):53-56.
[10] 郜怀峰,彭福田,肖元松,张亚飞,王国栋,孙希武,贺月.钼对桃树叶片低温伤害的缓解作用[J].植物营养与肥料学报,2019,25(7):1211-1221.GAO Huaifeng,PENG Futian,XIAO Yuansong,ZHANG Yafei,WANG Guodong,SUN Xiwu,HE Yue.Physiological and biological mechanisms of molybdenum on alleviating chilling stress of peach leaves[J].Journal of Plant Nutrition and Fertilizers,2019,25(7):1211-1221.
[11] 汪良驹,姜卫兵,章镇,姚泉洪,松井弘之,小原均.5-氨基乙酰丙酸的生物合成和生理活性及其在农业中的潜在应用[J].植物生理学通讯,2003,39(3):185-192.WANG Liangju,JIANG Weibing,ZHANG Zhen,YAO Quanhong,MATSUI Hiroyuki,OHARA Hitoshi.Biosynthesis and physiological activities of 5-aminolevulinic acid (ALA) and its potential application in agriculture[J].Plant Physiology Communication,2003,39(3):185-192.
[12] WU Y,LIAO W B,MOHAMMED MD,HU L L,YU J H.5-aminolevulinic acid (ALA) biosynthetic and metabolic pathways and its role in higher plants:a review[J].Plant Growth Regulation,2019,87(1):357-374.
[13] HOTTA Y,TANAKA T,LUOB S,TAKEUCHI Y,KONNAI M.Improvement of cold resistance in rice seedlings by 5-aminolevulinic acid[J].Journal of Pesticide Science,1998,23(1):29-33.
[14] 汪良驹,姜卫兵,黄保健.5-氨基乙酰丙酸对弱光下甜瓜幼苗光合作用和抗冷性的促进效应[J].园艺学报,2004,31(3):321-326.WANG Liangju,JIANG Weibin,HUANG Baojian.Promotion of photosynthesis by 5-aminolevulinic acid(ALA)during and after chilling stress in melon seedlings grown under low light condition[J].Acta Horticulturae Sinica,2004,31(3):321-326.
[15] WANG L J,JIANG W B,HUANG B J.Promotion of 5-aminolevulinic acid on photosynthesis of melon (Cucumis melo)seedlings under low light and chilling stress conditions[J].Physiologia Plantarum,2004,121(2):258-264.
[16] WANG Y,LI J,GU W R,ZHANG Q,TIAN L X,GUO S,WEI S.Exogenous application of 5-aminolevulinic acid improves lowtemperature stress tolerance of maize seedlings[J].Crop and Pasture Science,2018,69(6):587-593.
[17] 刘涛,郭世荣,徐刚,高文瑞,李德翠,王虹.5-氨基乙酰丙酸对辣椒植株低温胁迫伤害的缓解效应[J].西北植物学报,2010,30(10):2047-2053.LIU Tao,GUO Shirong,XU Gang,GAO Wenrui,LI Decui,WANG Hong.Mitigative effect of 5-aminolevulinic acid in pepper under low temperature stress[J].Acta Botanica Boreali-Occidentalia Sinica,2010,30(10):2047-2053.
[18] 田永强,聂国伟,李凯,张晓萍,戴丽蓉.5-氨基乙酰丙酸对甜樱桃花器官低温胁迫伤害的缓解效应[J].西北农业学报,2020,29(4):595-602.TIAN Yongqiang,NIE Guowei,LI Kai,ZHANG Xiaoping,DAI Lirong.Ameliorating effects of 5-aminolevulinic acid on damage to sweet cherry floral organ under low temperature stress[J].Acta Agriculturae Boreali-occidentalis Sinica,2020,29(4):595-602.
[19] 陈慧,徐丽,李旭,王冬云,安玉艳,汪良驹.5-氨基乙酰丙酸提高杜鹃和香樟叶片耐寒性效应[J].植物生理学报,2017,53(12):2103-2113.CHEN Hui,XU Li,LI Xu,WANG Dongyun,AN Yuyan,WANG Liangju.Promotive effect of 5-aminolevulinic acid on freezing tolerance of Rhododendron simsii and Cinnamomum camphora leaves[J].Plant Physiology Journal,2017,53(12):2103-2113.
[20] 李合生.植物生理生化实验技术原理和技术[M].北京:高等教育出版社,2000.LI Hesheng.Principles and techniques of plant physiological and biochemical experiments[M].Beijing:Higher Education Press,2000.
[21] 陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2002.CHEN Jianxun,WANG Xiaofeng.Plant physiology test guidance[M].Guangzhou:South China University of Technology Press,2002.
[22] KOCHBA J,LAVEE S,SPIEGEL-R P.Differences in peroxidase activity and isoenzymes in embryogenic and non-embryogenic‘Shamout’orange ovular callus lines[J].Plant and Cell Physiology,1977,18(2):463-467.
[23] CONSTANTINE N.GIANNOPOLITIS C N,RLES S K.Superoxide dismutases:II.Purification and quantitative relationship with water-soluble protein in seedling[J].Plant Physiology,1977,59(2):315-318.
[24] 刘志虎,王鸿,冯建森,马寿鹏,李宽莹.河西走廊桃抗寒性调查分析[J].中国果树,2020(6):102-106.LIU Zhihu,WANG Hong,FENG Jiansen,MA Shoupeng,LI Kuanying.Investigation and analysis of peach cold resistance in Hexi Corridor[J].China Fruits,2020(6):102-106.
[25] 李会敏.科学防控倒春寒[J].现代农村科技,2021(9):30.LI Huimin.Scientific prevention and control of the late spring coldness[J].Modern Rural Science and Technology,2021(9):30.
[26] 才兴文.果树晚霜冻害(倒春寒)及其应急措施[J].河北果树,2021(1):60.CAI Xingwen.Late frost damage (late spring coldness) and its emergency measures[J].Hebei Fruits,2021(1):60.
[27] 蒋文华,燕飞,付静,曲东,冯自立.外源5-氨基乙酰丙酸对低温胁迫下茶树光合特性的影响[J].西北农林科技大学学报(自然科学版),2020,48(10):108-115.JIANG Wenhua,YAN Fei,FU Jing,QU Dong,FENG Zili.Effects of exogenous 5-aminolevulinic acid on photosynthetic and physiological characteristics of tea plants under low temperature stress[J].Journal of Northwest A &F University (Natural Science Edition),2020,48(10):108-115.
[28] AKRAM N A,ASHRAF M.Regulation in plant stress tolerance by a potential plant growth regulator,5-aminolevulinic acid[J].Plant Growth Regulation,2013,32(3):663-679.
[29] 李鹏民,高辉远,STRASSER R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理与分子生物学学报,2005,28(6):559-566.LI Pengmin,GAO Huiyuan,STRASSER R J.Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study[J].Physiology and Molecular Biology of Plants,2005,28(6):559-566.
[30] 张雯婷,李鹏民.瞬时与延迟叶绿素荧光及820 nm 光反射动力学同步测量技术在光合作用研究中的应用[J].生物物理学报,2015,31(3):221-229.ZHANG Wenting,LI Pengmin.Application of simultaneous measurement of prompt and delayed chlorophyll fluorescence and the 820 nm reflection kinetics in photosynthesis study[J].Acta Biophysica Sinica,2015,31(3):221-229.
[31] 仝亚军,高玉录,刘孟龙,翟衡,孙庆华.喷布外源褪黑素对缓解葡萄叶片晚霜冻害的作用[J].落叶果树,2019,51(2):8-11.TONG Yajun,GAO Yulu,LIU Menglong,ZHAI Heng,SUN Qinghua.Effect of spray exogenous melatonin on relieving late frost damage in grape leaves[J].Deciduous Fruits,2019,51(2):8-11.
[32] 吴雯雯,安玉艳,汪良驹.5-氨基乙酰丙酸缓解‘红颜’草莓盐胁迫伤害的时间效应研究[J].园艺学报,2017,44(6):1038-1048.WU Wenwen,AN Yuyan,WANG Liangju.Study on time effects of exogenous 5-aminolevulinic acid treatment on alleviating salinity injury in‘Benihoppe’strawberry[J].Acta Horticulturae Sinica,2017,44(6):1038-1048.
[33] 刘辉,黄娟.5-氨基乙酰丙酸对茄子幼苗抗冷性的影响[J].长江蔬菜,2014(16):43-46.LIU Hui,HUANG Juan.Effects of 5-aminolevulinic acid on chilling tolerance of eggplant seedlings[J].Journal of Changjiang Vegetables,2014(16):43-46.
[34] 阿的鲁骥,周健,李洁,马丹炜.土荆芥化感胁迫下蚕豆叶绿体超微结构和光合关键基因表达的变化[J].西南农业学报,2018,31(12):2527-2532.ADE Luji,ZHOU Jian,LI Jie,MA Danwei.Effect of allelo-chemical stress from Chenopodium ambrosioides L. on chloroplast ultrastructure and photosynthetic key gene expression in leaves of Vicia faba seedlings[J].Southwest China Journal of Agricultural Sciences,2018,31(12):2527-2532.
[35] MARIKA D,ROMAN S,MARTIN T,JOSEF K.Psb28 protein is involved in the biogenesis of the photosystem II inner antenna CP47 (PsbB) in the cyanobacterium Synechocystis sp.PCC 6803[J].Plant Physiology,2009,149(2):1076-1086.
[36] JAMES B.Photosystem II:Its function,structure,and implications for artificial photosynthesis[J].Biochemistry (Moscow),2014,79(3):185-196.
[37] 许耀照,曾秀存,孙万仓,武军艳,方彦,刘自刚,马骊.白菜型冬油菜PsbR 基因的克隆及低温下表达分析[J].农业生物技术学报,2017,25(9):1423-1433.XU Yaozhao,ZENG Xiucun,SUN Wancang,WU Junyan,FANG Yan,LIU Zigang,MA Li.Cloning of PsbR Gene in winter turnip rape (Brassica campestris) and its expression analysis under low temperature stress[J].Journal of Agricultural Biotechnology,2017,25(9):1423-1433.
[38] LOTTA V S,SERENA S,JORG M,CHRISTIANE F,FIKRET M,WOLFGANG S.The PsbY protein of Arabidopsis photosystem II is important for the redox control of cytochrome b559[J].BBA-Bioenergetics,2016,2728(16):30536-9.
[39] LI J,SUN X W,ZHANG L X.Deg1 is involved in the degradation of the PsbO oxygen-evolving protein of photosystem Ⅱin Arabidopsis[J].Chinese Science Bulletin,2010,55(27):3145-3148.