苹果(Malus×domestica)是重要的温带果树之一。我国是世界上苹果栽培面积最大、产量最高的国家。近年来,由围小丛壳(Glomerella cingulata,无性态为炭疽菌属Colletotrichum spp.)侵染引起的苹果炭疽叶枯病(Glomerella leaf spot,GLS)成为我国苹果主产区一种危害严重的真菌性病害[1]。该病害于1988年在巴西首次被报道,经被侵染的嘎拉和金冠苹果的病原鉴定,确认其为围小丛壳[2- 3]。1997—1999 年在巴西6 个苹果产区均发现此病害,由于易感病品种嘎拉在巴西广泛种植,导致该病成为巴西苹果的主要病害[4-5]。1998 年在美国发现该病害[6]。2009 年后,在我国山东、陕西、河南等苹果主产区呈蔓延趋势[1]。不同苹果品种对炭疽叶枯病的抗性存在显著差异。金冠、嘎拉、秦冠和乔纳金等为高感品种,富士和红星等为高抗品种,尤其是富士在田间自然环境下几近免疫[7]。GLS主要危害苹果叶片,造成病叶早期干枯、脱落,发病严重时可导致苹果树90%以上的叶片脱落,也能侵染果实引起坏死性斑点,影响果实发育。该病害虽是我国近年新发病害,但其发展迅速、危害严重,尤其是夏季高温多雨的气候特别适宜GLS的流行[4]。GLS给中国苹果产业造成了巨大的经济损失,严重威胁着苹果产业的绿色健康可持续发展,因此对苹果炭疽叶枯病的防治十分重要。
目前,防治苹果炭疽叶枯病的主要方法是使用化学农药,但是过量使用农药会污染环境甚至危害人体健康[8]。植物免疫诱抗剂能诱导植物免疫系统启动,从而使植物获得或提高对病原菌的抗性,植物免疫诱抗剂的应用能大幅减少农药使用,减轻病虫害的发生,是减轻环境污染、解决农产品安全问题的有效途径[9]。甜菜碱(Glycine betaine,GB)是一种植物免疫诱抗剂,可以作为渗透调节物质参与植物细胞的渗透调节,亦可作为渗透保护物质来提高生物大分子结构和功能的稳定性[10],并且可以提高植株对金属离子[11]、盐[12-13]、低温[14]、干旱[15]等多种非生物逆境的抗性,在提高植物对生物胁迫的抵御能力中也起到了一定作用[16]。近年来,GB在不同植物上提高非生物胁迫抗性的研究较多,但在提高生物胁迫抗性的研究相对较少,更鲜有报道GB 对苹果炭疽叶枯病抗病性的影响。为了在绿色环保理念下提供一种有效防治苹果炭疽叶枯病的方法,笔者在本研究中拟通过外源喷施GB后对离体苹果叶片接种炭疽叶枯病原菌的方式,筛选出提高苹果叶片炭疽叶枯病抗性的最适GB浓度,并分析在GB最适浓度预处理下苹果叶片响应炭疽叶枯病病原菌侵染的过程中抗氧化酶系统相关酶的活性、内源激素和脯氨酸(Pro)含量以及病程相关基因表达量的动态变化,以期对苹果炭疽叶枯病的防治以及抗病机制的研究提供参考。
1 材料和方法
1.1 试验材料
试验材料嘎拉-3(GL-3)组培苗由沈阳农业大学提供,经继代培养和生根后,移栽至10 cm×10 cm营养钵中培养。当幼苗株高约20 cm 时进行试验处理。GLS病原菌由青岛农业大学植物医学学院李保华教授馈赠。
外源甜菜碱(GB),购自上海源叶生物科技有限公司,纯度为超纯(含量≥99%)。
1.2 苹果炭疽叶枯病病原菌的培养和离体叶片的接种
参考刘源霞等[7]的方法,将苹果炭疽叶枯病病原菌接种到PDA 固体培养基上,在25 ℃培养箱中黑暗培养3 d 进行病原菌的活化培养。苹果离体叶片接种试验参考刘源霞等[7]的方法进行,即挑取活化培养后的病原菌,配置成105个·mL-1浓度的孢子悬浮液,均匀喷施在嘎拉-3 组培苹果苗离体叶片的正反两面上并用湿棉花包裹叶柄,放入25 ℃、湿度95%、光照度10 000 lx和14 h/10 h(光照/黑暗)的恒温培养箱中培养发病。
1.3 外源喷施GB的处理方法
(1)GB 最适浓度筛选:挑选长势良好的嘎拉-3苹果幼苗30株,分为6组,每组5株幼苗,其中5组以不同浓度的GB溶液(0、1、2、4、6 mmol·L-1)连续2 d喷施幼苗的叶面和叶背,每天2次,剩余一组喷清水作为对照(CK)。GB 预处理结束后,各组取健康成熟叶片各15枚,对叶片进行炭疽叶枯病病原菌离体接种试验,方法见1.2,而CK组的15枚叶片不接病,用湿棉花包裹叶柄后置于相同环境中。7 d 后观察各组叶片发病情况,调查病斑面积,测定相对叶绿素含量(SPAD)和相对电导率(REC)生理指标,寻找发病程度最低的一组,以此筛选出外源喷施GB 后提高苹果炭疽叶枯病抗病性的最适浓度。
(2)GB 诱抗效应分析:选择120 株长势良好的嘎拉-3 苹果幼苗,分为4 组(即每组30 株)以进行不同的处理:①无外源GB+不接病组(CK组);②外源喷施GB+不接病组(CK+GB 组);③无外源GB+接病组(GLS 组);④外源喷施GB+接病组(GLS+GB组)。用筛选出的最适浓度GB 喷施预处理②和④组幼苗,处理方法见上,其余幼苗喷清水处理。GB喷施预处理结束后,每株取健康成熟叶片7枚(即每处理210枚叶片),对③和④组的苹果幼苗进行离体叶片接病,方法见1.2,同时对处理①和②的叶片用湿棉花包裹叶柄后置于相同环境中。接病后0、0.5、1、2、4和6 d,每处理取叶片30枚,用液氮冷冻后,置于-80 ℃冰箱中,用于测定生理指标和进行基因表达分析。第6 天,每处理取15 枚叶片用于调查病斑面积,其余15枚叶片用于测定REC。
1.4 病斑面积的测定
将叶片在EPSON PERFECTION V700 PHOTO扫描仪下扫描后,用Image J软件计算病斑面积。每处理测5枚叶片。
1.5 生理指标的测定
对外源喷施最适浓度2 mmol·L-1 GB的幼苗,进行苹果炭疽叶枯病诱抗效应分析,即对其抗氧化酶活性、内源激素含量和Pro含量进行测定。
REC、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的测定均参照高俊凤[17]的方法。用SPAD仪测定叶片SPAD值,在待测叶片上左右各测1次取平均值。每处理3次重复。
内源激素水杨酸(SA)、茉莉酸(JA)、脱落酸(ABA)含量、1-氨基环丙烷羧酸(ACC)和吲哚乙酸(IAA)的测定参考Guo等[18]的方法。称取0.1 g磨碎的冻样置于2 mL 离心管中,加入1 mL 提取液[甲醇、异丙醇体积比为20∶80 与1%冰醋酸],混匀后置于4 ℃冰箱内7 h, 离心后(12 000 r·min-1,10 min,4 ℃)收集上清液,经0.22 μm 尼龙过滤器过滤后用于测定。
Pro 的提取和测定根据Li 等[19]的方法。称取0.1 g 磨碎的冻样用1 mL 50%的乙醇水溶液(含0.1 mol·L-1 HCl)匀浆研磨,12 000 r·min-1离心10 min。上清液经0.22 μm水系过滤器过滤后用于测定。
内源激素和Pro 含量的测定均采用液相色谱-质谱联用技术(LC-MS,LC:AC,ExionLC;MS:Qtrap5500 AB Sciex),以流动相A(甲醇)和流动相B(0.1%甲酸)为洗脱液,流速为0.3 mL·min-1,样品注入体积为10 μL。每处理3次重复。
1.6 病程相关基因表达量的分析
将诱抗效应分析试验中的叶片样品提取RNA,经过反转录获得cDNA,以cDNA为模板,使用PR1、PR4、PR8、ERF3、PAL、几丁质酶、β-1,3-葡聚糖酶基因的荧光定量引物(表1),对其表达量进行qRTPCR测定。EF-1α为内参基因。
表1 实时荧光定量PCR 引物
Table 1 Quantitative real-time PCR primer sequence

?
1.7 数据统计与分析
利用SPSS 26.0软件统计所有数据,计算均值和标准差,用Tukey’s 法进行差异显著性分析(p <0.05)。使用Excel 2019软件作图。
2 结果与分析
2.1 外源喷施GB的最适浓度筛选
接种苹果炭疽叶枯病病原菌后,与CK组相比,不同浓度GB喷施处理组的叶片病斑面积有明显差异(图1-A)。与0 mmol·L-1浓度的GB处理组相比,浓度为1、2 和4 mmol·L-1 GB 处理组的平均病斑面积分别减小62.2%、95.9%和8.9%,而6 mmol·L-1 GB处理组增加34.2%(图1-B)。与0 mmol·L-1处理组相比,其余4组的叶片REC分别下降21.1%、88.4%、35.2%和2.0%,其中2 mmol·L-1 GB处理组显著降低(p <0.05)(图1-C)。1、2 和4 mmol·L-1处理组与0 mmol·L- 1 处理组相比,SPAD 平均增加0.8%、28.7%和5.4%,而6 mmol·L-1组平均减少7.0%,其中2 mmol·L-1 GB处理组显著增加(p <0.05)(图1-D)。以上结果表明,外源喷施2 mmol·L-1浓度的GB 溶液,可最大程度地缓解炭疽叶枯病病原菌对苹果叶片细胞造成的组织坏死和叶绿素降解。因此2 mmol·L-1是外源喷施GB 处理提高苹果炭疽叶枯病抗性的最适浓度。
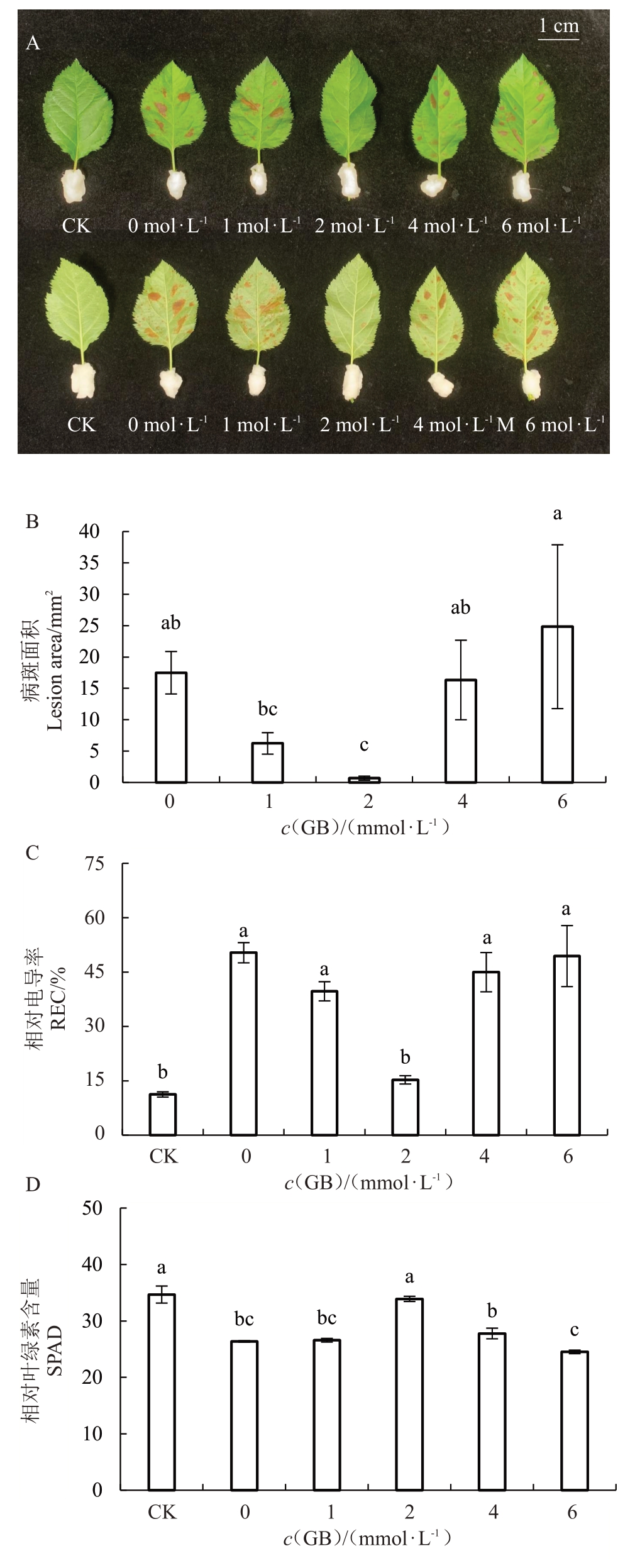
图1 外源喷施GB 处理最适浓度的筛选
Fig.1 Screening of optimum concentration of exogenous GB treatment
A.喷施不同浓度GB 后叶片的发病情况;B.病斑面积;C.相对电导率;D.相对叶绿素含量。
A. Phenotype of infection leaves after exogenous GB with different concentrations; B. Lesion area; C. Relative electrolytic leakage; D.SPAD.
2.2 外源喷施GB对接种苹果炭疽叶枯病病原菌的叶片抗病性的效应分析
2.2.1 外源喷施GB 对叶片病斑面积的影响 GLS组的叶片平均病斑面积为GLS+GB 组的24.4 倍,而GLS+GB 组的平均病斑面积与CK 组的差异不大。说明喷施GB可降低病原菌对叶片组织的破坏程度,降低叶片组织坏死的面积,有利于叶片抵抗苹果炭疽叶枯病病原菌的进一步侵染(图2)。

图2 外源喷施2 mmol·L-1 GB 对接种苹果炭疽叶枯病病原菌的离体叶片表型的影响
Fig.2 Effects of exogenous 2 mmol·L-1 GB on the phenotype of apple leaves after inoculation with G.cingulata
2.2.2 外源喷施GB 对叶片抗病响应中抗氧化酶活性的影响 随着苹果炭疽叶枯病病原菌侵染时间的延长,与CK 组相比,CK+GB 组、GLS 组和GLS+GB组的CAT酶活性分别增加231.1%、71.1%和353.3%,POD酶活性分别增加33.3%、132.9%和151.0%,SOD酶活性分别增加154.9%、194.9%和168.7%。GLS+GB组的抗氧化酶活性比GLS组增强的趋势更显著,且CK+GB 组比CK 组的抗氧化酶系统活性更高。说明喷施GB 可在病原菌入侵细胞组织后提高氧化酶系统活性从而快速清除活性氧等物质,保护蛋白等大分子物质及结构。同时,在正常条件下外源喷施GB 也可提高氧化酶活性,提前对外来病原菌的侵害做出防御(图3)。
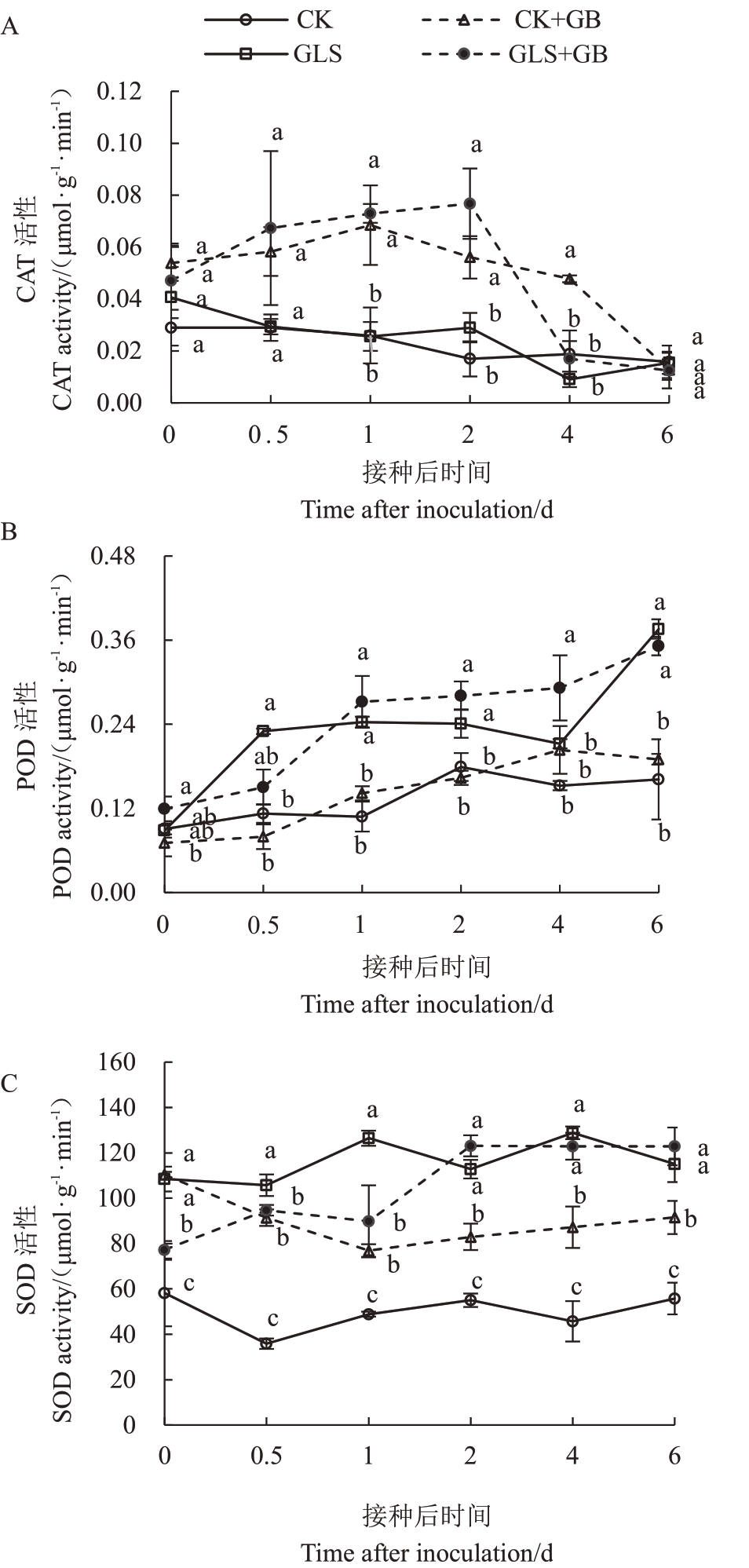
图3 外源喷施2 mmol·L-1 GB 对接种苹果炭疽叶枯病病原菌的离体叶片抗氧化酶活性的影响
Fig.3 Effects of exogenous 2 mmol·L-1 GB on the activity of antioxidant enzymes in apple leaves after inoculation with G.cingulata
2.2.3 外源喷施GB对叶片抗病响应中内源激素含量的影响 接种病原菌后,与CK 组相比,CK+GB组、GLS 组和GLS+GB 组的SA 含量均升高,且3 个处理组的SA 含量基本是随时间的增加而逐渐升高(图4-A)。CK+GB组一直比CK组的SA含量高,在接种第4天显著增加了1 513.7%。GLS+GB组也一直比GLS 组的SA 含量高,且增长幅度剧烈,在第2天显著增加了159.6%(p <0.05)(图4-A)。说明外源喷施GB能促进SA的生物合成,抵御苹果炭疽叶枯病病原菌的侵染。
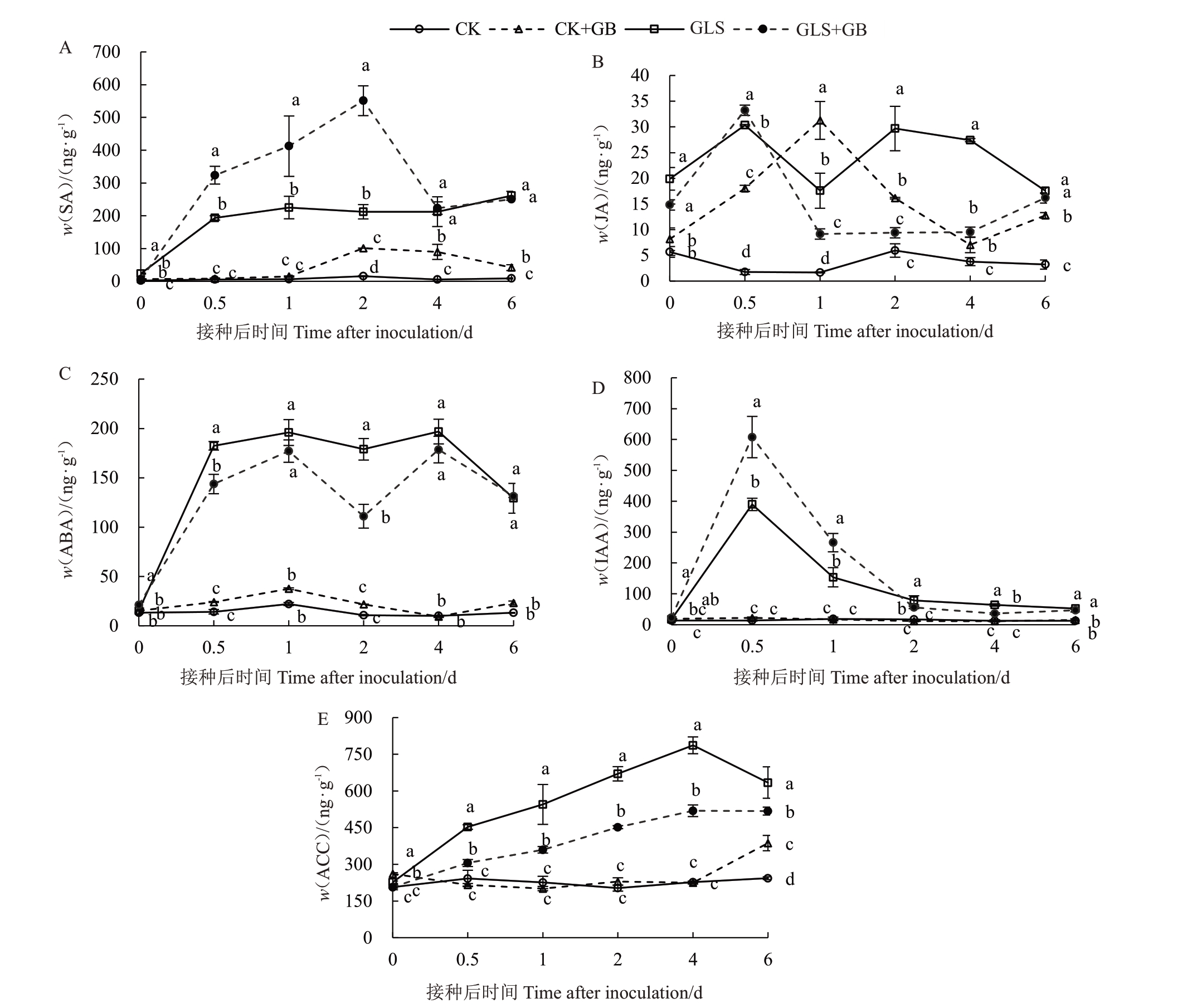
图4 外源喷施2 mmol·L-1 GB 对接种苹果炭疽叶枯病病原菌的离体叶片内源激素含量的影响
Fig.4 Effects of exogenous 2 mmol·L-1 GB on the content of endogenous hormones in apple leaves after inoculation with G.cingulata
与CK 组相比,其余3 个处理组的JA 含量均显著升高。由于JA与SA存在拮抗关系,在接种前期3个处理组的JA 含量均呈现先升高后下降的变化趋势(图4-B)。CK+GB组的JA含量在接种后1 d达到最高值且比CK 组显著增加了1746.5%(p <0.05)。GLS+GB 组与GLS 组的JA 含量在第0.5 天均达到峰值,此时GLS+GB组比GLS组显著增加了10.1%(p <0.05)。第0.5 天后二者含量下降,而GLS 组在第2 天又先上升后下降(图4-B)。说明外源喷施GB后能正向调节JA与SA的拮抗关系,减少JA 的合成,使GLS+GB 组在第0.5 天后始终保持JA含量的低水平状态。
与CK 组相比,GLS 组和GLS+GB 组的ABA 和ACC 含量显著上升,但GLS+GB 组比GLS 组的ABA 和ACC 含量更低,显著减少了37.9%和34.0%(p <0.05)。CK+GB 组与CK 组相比无显著差异(图4-C和4-D)。说明GB能抑制ABA和ACC的合成,减缓细胞组织衰老死亡的速度,延缓叶片衰老。
在病原菌侵染的过程中,IAA 属于合成受到抑制的激素。由图4-E 曲线趋势可知,GLS+GB 组与GLS 组相比,IAA 含量先达到最高值增加了83.1%后降低了55.0%,均达到显著水平(p <0.05)。CK+GB 组与CK 组相比,无显著差异(图4-E)。说明外源GB 在响应抗病通路中,能抑制IAA 合成,并促进IAA 快速降解,使组织细胞增殖分裂的速度减慢,以不利于病原菌菌丝透过细胞壁破坏细胞结构。
2.2.4 外源喷施GB 对叶片抗病响应中Pro 含量的影响 Pro 是参与植物抗病生理生化反应的重要氨基酸,在病原菌侵染植物组织过程中,植物体内会产生大量Pro。与CK组相比,GLS组和GLS+GB组均产生大量Pro,并且其含量随着时间的增加逐渐增多。除第0天和第4天外,GLS+GB组的Pro含量始终显著低于GLS 组(p <0.05),在第0.5、第1、第2和第6天分别减少了65.0%、76.6%、73.1%和71.2%;CK+GB 组的Pro 含量与CK 组无明显差异(图5)。说明苹果叶片在响应抗病反应中,Pro的合成能降低细胞渗透势来应对外界胁迫,但在正常条件下,外源GB并不能促进Pro的合成。
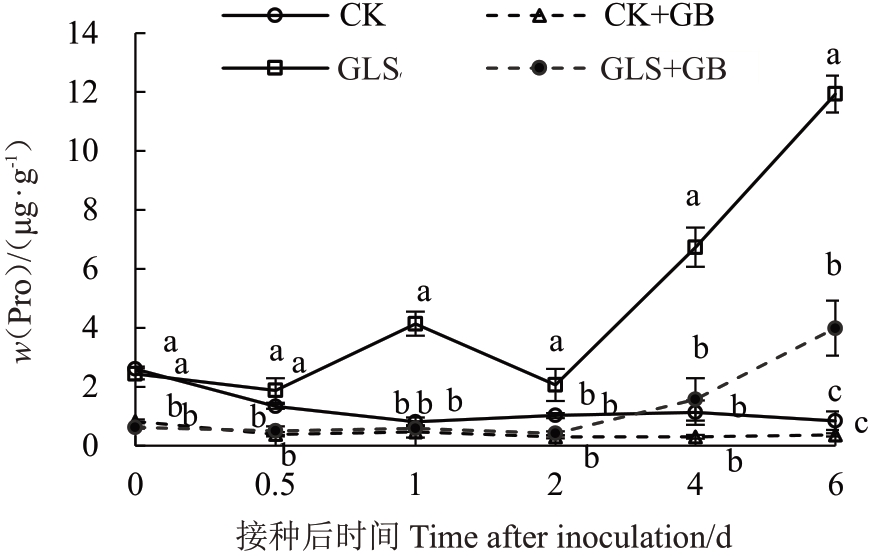
图5 外源喷施2 mmol·L-1 GB 对接种苹果炭疽叶枯病病原菌的离体叶片内源脯氨酸含量的影响
Fig.5 Effects of exogenous 2 mmol·L-1 GB on endogenous proline content in apple leaves after inoculation with G.cingulata
2.2.5 外源喷施GB对叶片抗病响应中病程相关基因表达量的影响 抗病相关蛋白在植物抵抗病原菌侵染过程中起到至关重要的作用,为了探讨外源GB诱导的苹果炭疽叶枯病抗病性是否有抗病相关蛋白和抗病途径关键基因的参与,对苹果的PR1、PR4、PR8、ERF3、PAL、几丁质酶、β-1,3-葡聚糖酶等7个基因,分别在CK组、CK+GB组、GLS组和GLS+GB组的6个时间点进行了表达量分析。结果(图6)表明,苹果炭疽叶枯病病原菌侵染后能够诱导以上7 个基因表达上调。除ERF3、几丁质酶和β-1,3-葡聚糖酶基因外,其他基因在第0.5、第1、第2、第4 和第6 天的表达量基本是GLS+GB 组高于GLS 组。而ERF3基因的表达量在GLS+GB组与GLS组无明显差异,β-1,3-葡聚糖酶基因的表达量在第0.5 和第2 天时,GLS+GB 组高于GLS 组,第4 天时GLS组高于GLS+GB组,其他时间点无明显差异。几丁质酶基因的表达量在第0.5、每1 和第2 天时GLS+GB 组高于GLS 组,第4 天时GLS 组高于GLS+GB组,其余时间点无明显差异。以上结果说明,外源喷施GB 处理能不同程度地提高苹果炭疽叶枯病病原菌侵染下叶片中病程相关基因的表达,促进抗病相关物质的合成,提高苹果叶片抵抗病原菌的能力。其中PR1、PR8、PAL、几丁质酶基因、β-1,3-葡聚糖酶基因比PR4和ERF3基因的抗病响应更为显著。
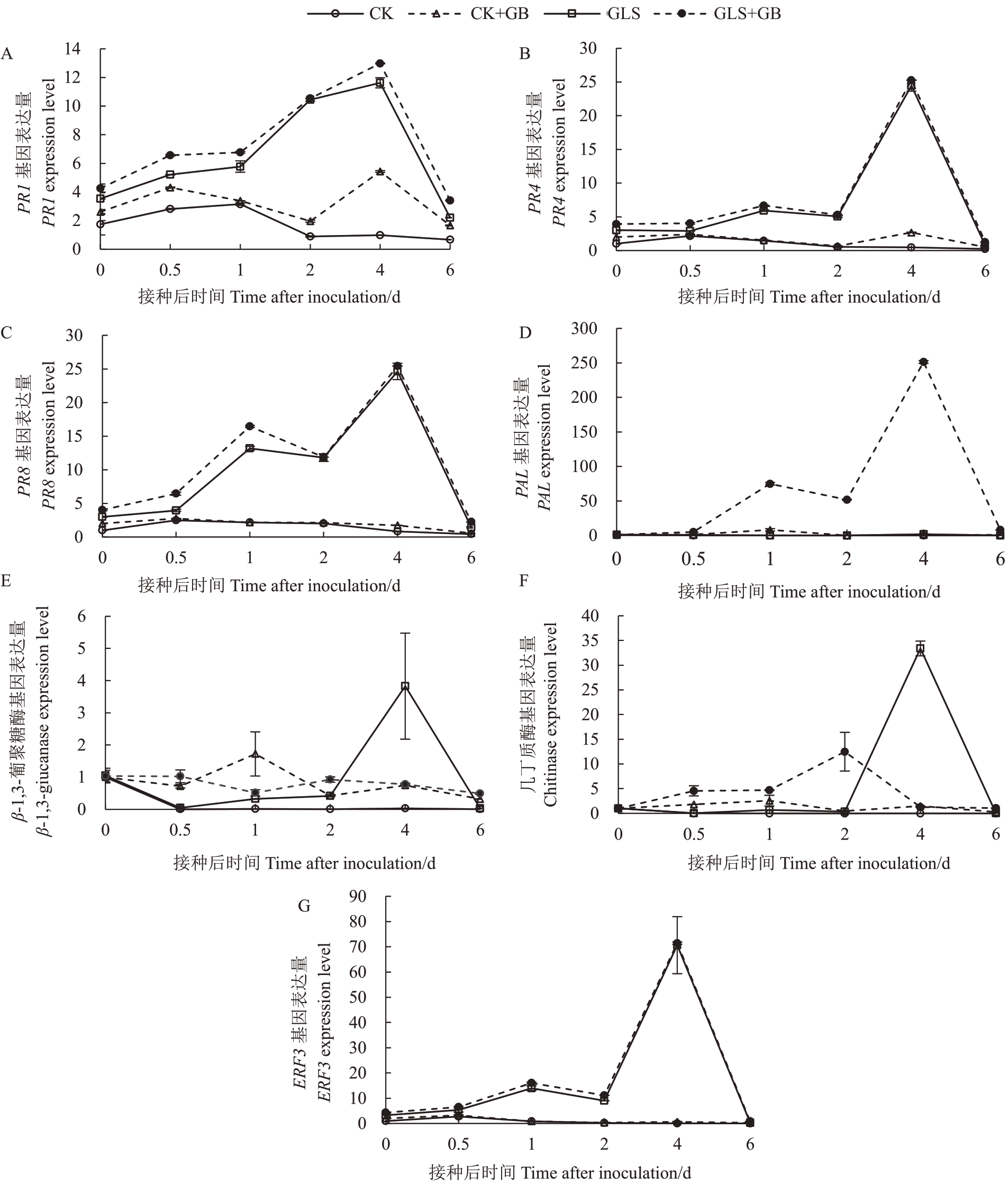
图6 外源喷施2 mmol·L-1 GB 对接种苹果炭疽叶枯病病原菌的离体叶片病程相关基因表达的影响
Fig.6 Effects of exogenous 2 mmol·L-1 GB on the expression of pathogenesis-related genes in apple leaves after inoculation with G.cingulata
3 讨 论
笔者在本研究中设置不同浓度梯度的外源喷施GB处理组(0、1、2、4、6 mmol·L-1),通过对接种苹果炭疽叶枯病病原菌叶片的病斑面积、REC 和SPAD等指标的分析,发现GB 可以显著延缓病原菌对苹果叶片的侵染过程,有效提高嘎拉-3 叶片对苹果炭疽叶枯病原菌的抗性,其中以外源喷施2 mmol·L-1浓度效果最佳,这与GB 提高西瓜抗枯萎病能力的研究结果一致[16]。进一步分析发现外源GB 不仅可显著降低接病苹果叶片的REC,提高抗氧化酶活性,还能显著提高SA和IAA含量,显著降低衰老相关激素的含量,也能提高病程相关蛋白基因的表达水平,表明外源喷施GB 有助于增强苹果叶片的免疫系统以抵御炭疽叶枯病病原菌的侵染。
ROS已被证明参与多种植物与病原菌的相互作用[20]。一般活性氧是在植物受到逆境胁迫时急剧产生,氧化清除系统平衡被打破,过量的活性氧造成细胞结构和功能发生氧化损伤,影响植物的正常生命活动。植物保护酶是植物抵御逆境伤害的第一道屏障,负责清除活性氧,包括POD、SOD、CAT等抗氧化酶。研究发现,通过外源施用GB,可以提高植物在胁迫下SOD、CAT、POD等抗氧化酶的活性[21-22],本研究与前人研究的结果一致,GLS+GB组的CAT、POD和SOD活性分别在第2、第6和第6天达到最大值,由此能推测出外源喷施2 mmol·L-1GB能在不同程度上有助于提高苹果叶片抗氧化酶系统的活性,清除活性氧对细胞结构和大分子活性物质的伤害。
SA、JA、ABA、乙烯和生长素参与了植物抗病反应,是植物抗病反应中的重要信号物质[23-25]。在病原菌侵染的过程中,SA 与JA 的信号防御途径发生拮抗作用[26],ABA 和ACC 会大量合成与积累,而IAA这种致病因子含量会下降[27]。本试验结果与前人相同,与GLS组相比GLS+GB组的SA含量增幅剧烈,在2 d 时迅速达到最大值,同时JA 增高后又迅速降低,推测外源GB可能增强了SA和JA途径的拮抗作用,进一步使SA的含量提升,更好地提高了植物抵御病原菌的能力。与GLS 组相比,GLS+GB 组的ABA 和ACC 含量分别在第2 天和第1 天出现降低的现象,这可能是因为GB 缓解了炭疽叶枯病病原菌造成的胁迫作用,或者GB 可能参与了抑制ABA和ACC的生物合成途径,最终达到减少叶片组织细胞衰老死亡的效果[28]。与GLS 组相比,GLS+GB 组的IAA含量在第1天和第2天之间出现转折,在第1天含量出现升高后又在第2 天迅速下降。由此推测,在苹果炭疽叶枯病病原菌侵染前期GB 响应了IAA合成抑制的信号,减缓或暂停细胞增殖过程,使病原菌不利于入侵及扩散,在某种程度上也起到了提高植物抗病性的效果。
Pro作为一种重要的渗透调节物质,当细胞受到渗透胁迫时Pro 被转运至细胞质,通过降低细胞渗透势,达到降低逆境对植物危害的作用[29]。本研究中,与GLS组相比,GLS+GB组的Pro含量出现降低的现象,且在第6 天2 组处理Pro 总量相差最多,这可能与外源GB在苹果炭疽叶枯病病原菌侵染初期诱导抗氧化酶系统活性迅速提高、产生大量SA 和JA 有关,从而缓解了病原入侵产生的生物胁迫,使Pro生物合成量下降。
病程相关蛋白PRs是植物免疫系统中抵御外来病原的重要组成部分,其中PR1主要参与SA抗病信号通路,PR4 主要参与JA 抗病信号通路[30]。接种苹果炭疽叶枯病病原菌后,病程相关蛋白基因大量表达,PR1、PR4、PR8、β-1,3-葡聚糖酶和几丁质酶基因的表达量随着病原菌侵染时间的增加逐渐升高。同时,抗病途径中合成苯丙氨酸解氨酶和乙烯的关键基因PAL和ERF3的表达量,也随着病原菌侵染时间的增加而升高。其中,与GLS 组相比,GLS+GB 组的PR1、PR8 和PAL 基因表达量最高,而ERF3 基因表达量差异不显著,β-1,3-葡聚糖酶和几丁质酶基因的表达量是抗病响应前期高,推测这有可能是外源喷施GB处理后炭疽叶枯病病原菌侵染趋势得到有效控制的结果。
4 结 论
筛选出2 mmol·L-1为外源喷施GB 提高苹果对炭疽叶枯病抗病性的最适浓度。叶片接种苹果炭疽叶枯病病原菌后,GB 参与了抗氧化酶系统的响应,促进SA和JA的积累,抑制ABA、ACC和IAA合成,提高抗病相关蛋白基因表达,最终使苹果炭疽叶枯病病原菌的生长繁殖在侵染初期被有效抑制,从而增强了苹果叶片对炭疽叶枯病的抗性。
[1] 马亚男,郭洁,李林光,翟浩,余贤美,张勇.苹果炭疽叶枯病研究进展[J].山东农业科学,2018,50(5):160-167.MA Yanan,GUO Jie,LI Linguang,ZHAI Hao,YU Xianmei,ZHANG Yong. Advances in research of apple Glomerella leaf spot[J].Shandong Agricultural Sciences,2018,50(5):160-167.
[2] LEITE J R P,TSUNETA M,KISHINO A Y.Ocorrência de mancha foliar de Glomerella em macieira no estado do Paraná[M].Paraná:Fundação Instituto Agronômico do Paraná,1988,81:6.
[3] GONZÁLEZ E. Characterization of isolates of Glomerella cingulata causal agent of Glomerella leaf spot and bitter rot of apples based on morphology and genetic,molecular,and pathogenicity tests[D].Raleigh:North Carolina State University,2003.
[4] CRUSIUS L U,FORCELINI C A,SANHUEZA R M V,FERNANDES J M C.Epidemiology of apple leaf spot[J].Fitopatologia Brasileira,2002,27(1):65-70.
[5] VELHO A C,STADNIK M J,CASANOVA L,MONDINO P,ALANIZ S. First report of Colletotrichum karstii causing Glomerella leaf spot on apple in Santa Catarina State,Brazil[J].Plant Disease,2014,98(1):157.
[6] GONZÁLEZ E,SUTTON T B. First report of Glomerella leaf spot(Glomerella cingulata)of apple in the United States[J].Plant Disease,1999,83(11):1074.
[7] 刘源霞,李保华,王彩虹,刘春晓,孔祥华,祝军,戴洪义.苹果对炭疽菌叶枯病抗性遗传的研究及其分子标记筛选[J].园艺学报,2015,42(11):2105-2112.LIU Yuanxia,LI Baohua,WANG Caihong,LIU Chunxiao,KONG Xianghua,ZHU Jun,DAI Hongyi. Genetic studies and molecular markers screening of apple resistance to Glomerella leaf spot[J].Acta Horticulturae Sinica,2015,42(11):2105-2112.
[8] 姜鹤,马杰,孟祥龙,曹克强,潘成国,王树桐.不同杀菌剂与波尔多液交替施用对苹果炭疽叶枯病的防治效果[J].中国植保导刊,2021,41(4):71-73.JIANG He,MA Jie,MENG Xianglong,CAO Keqiang,PAN Chengguo,WANG Shutong. Control effect of different fungicides and Bordeaux liquid on Glomerella leaf spot of apple[J].China Plant Protection,2021,41(4):71-73.
[9] 邱德文. 我国植物免疫诱导技术的研究现状与趋势分析[J].植物保护,2016,42(5):10-14.QIU Dewen.Research status and trend analysis of plant immune induction technology in China[J]. Plant Protection,2016,42(5):10-14.
[10] HUANG S,ZUO T,NI W Z. Important roles of glycinebetaine in stabilizing the structure and function of the photosystem Ⅱcomplex under abiotic stresses[J].Planta,2020,251(2):36.
[11] LI C Y,ZHANG T P,FENG P W,LI D X,BRESTIC M,LIU Y,YANG X H.Genetic engineering of glycinebetaine synthesis enhances cadmium tolerance in BADH-transgenic tobacco plants via reducing cadmium uptake and alleviating cadmium stress damage[J].Environmental and Experimental Botany,2021,191:104602.
[12] 徐婷.不同浓度甜菜碱对盐胁迫下薄皮甜瓜幼苗抗氧化系统的影响[J].安徽农业科学,2021,49(14):48-49.XU Ting.Effect of different concentrations of betaine on antioxidant system of melon seedlings under salt stress[J]. Journal of Anhui Agricultural Sciences,2021,49(14):48-49.
[13] JOKINEN K,SALOVAARA A K,WASONGA D O,EDELMANN M,SIMPURA I,MÄKELÄ P S A. Root-applied glycinebetaine decreases nitrate accumulation and improves quality in hydroponically grown lettuce[J].Food Chemistry,2022,366:130558.
[14] 顾开元,侯爽,陈锦芬,刘溶荣,邹聪明,徐照丽,谢小玉.外源甜菜碱对低温胁迫下烟草幼苗生理特性的影响[J].云南农业大学学报(自然科学),2021,36(2):283-290.GU Kaiyuan,HOU Shuang,CHEN Jinfen,LIU Rongrong,ZOU Congming,XU Zhaoli,XIE Xiaoyu. Effects of exogenous glycine betaine on the physiological characteristics of tobacco seedlings under low temperature stress[J].Journal of Yunnan Agricultural University(Natural Sciences),2021,36(2):283-290.
[15] 马明臻.干旱胁迫下外源甜菜碱对苹果叶片光合及相关特性的影响[J].中国南方果树,2016,45(5):113-116.MA Mingzhen. Effects of exogenous betaine on photosynthesis and related characteristics of apple leaves under drought stress[J].South China Fruits,2016,45(5):113-116.
[16] 徐子健,孙梦利,江雪飞.甜菜碱参与西瓜抗枯萎病的初步探究[J].热带作物学报,2018,39(2):355-360.XU Zijian,SUN Mengli,JIANG Xuefei.Preliminary study of betaine mediated resistance against fusarium wilt in watermelon[J].Chinese Journal of Tropical Crops,2018,39(2):355-360.
[17] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.GAO Junfeng. Experimental guidance in plant physiology[M].Beijing:Higher Education Publishing House,2006.
[18] GUO T L,WANG N,XUE Y C,GUAN Q M,NOCKER S V,MA F W,LIU C H.Overexpression of the RNA binding protein MhYTP1 in transgenic apple enhances drought tolerance and WUE by improving ABA level under drought condition[J].Plant Science,2019,280:397-407.
[19] LI Y X,LIU B Y,PENG Y X,LIU C L,ZHANG X Z,ZHANG Z J,LIANG W,MA F W,LI C Y. Exogenous GABA alleviates alkaline stress in Malus hupehensis by regulating the accumulation of organic acids[J]. Scientia Horticulturae,2020,261:108982.
[20] WOJTASZEK P. Oxidative burst:An early plant response to pathogen infection[J].Biochemical Journal,1997,322:681-692.
[21] ALSCHER R G,DONAHUE J L,CRAMER C L.Reactive oxygen species and antioxidants:Relationships in green cells[J].Physiologia Plantarum,1997,100(2):224-233.
[22] 柴文臣,阎世江.甜菜碱对干旱胁迫下茄子幼苗生长及生理指标的影响[J].中国瓜菜,2021,34(8):78-83.CHAI Wenchen,YAN Shijiang. Effect of betaine on the growth and physiological indexes of eggplant seedlings under drought stress[J].China Cucurbits and Vegetables,2021,34(8):78-83.
[23] LIAO,Y W K,CUI R R,XU X,CHENG Q,LI X G. Jasmonic acid and ethylene induced mitochondrial alternative oxidase stimulates Marssonina brunnea defense in poplar[J]. Plant and Cell Physiology,2020,61(12):2031-2042.
[24] ZHANG Y,SHI X P,LI B H,ZHANG Q M,LIANG W X,WANG C X. Salicylic acid confers enhanced resistance to Glomerella leaf spot in apple[J]. Plant Physiology and Biochemistry,2016,106:64-72.
[25] ASSELBERGH B,DE V D,HÖFTE M. Global switches and fine-tuning-ABA modulates plant pathogen defense[J]. Molecular Plant-Microbe Interactions,2008,21(6):709-719.
[26] SHAN D Q,WANG C Y,ZHENG X D,HU Z H,ZHU Y P,ZHAO Y,JIANG A W,ZHANG H X,SHI K,BAI Y X,YAN T C,WANG L,SUN Y Z,LI J F,ZHOU Z Y,GUO Y,KONG J.MKK4-MPK3-WRKY17-mediated salicylic acid degradation increases susceptibility to Glomerella leaf spot in apple[J]. Plant Physiology,2021,186(2):1202-1219.
[27] CUTLER S R,RODRIGUEZ,P L,FINKELSTEIN R R,ABRAMS S R. Abscisic acid:Emergence of a core signaling network[J].Annual Reviews Plant Biology,2010,61:651-679.
[28] FU J,LIU H B,LI Y,YU H H,LI X H,XIAO J H,WANG S P.Manipulating broad-spectrum disease resistance by suppressing pathogen-induced auxin accumulation in rice[J]. Plant Physiology,2011,155(1):589-602.
[29] LIANG X W,ZHANG L,NATARAJAN S K,BECKER D F.Proline mechanisms of stress survival[J]. Antioxidants and Redox Signaling,2013,19(9):998-1011.
[30] EL O M,EL R T A,RIGANO L,EL H A,RODRIGUEZ M C,DAAYF F,VOJNOV A,BOUARAB K.Botrytis cinerea manipulates the antagonistic effects between immune pathways to promote disease development in tomato[J].Plant Cell,2011,23(6):2405-2421.