胶孢炭疽菌(Colletotrichum gloeosporioides)是杧果炭疽病的主要致病菌,其寄主范围很广,可危害多种经济作物,严重影响果实的品质[1]。胶孢炭疽菌主要靠附着胞前端的侵染丝穿透寄主表皮侵染危害,其中附着胞中的黑色素能维持细胞壁的完整性,防止胞内甘油外排,促使附着胞内形成高膨压,从而助推病原菌侵入寄主[2]。黑色素不仅参与许多植物病原真菌致病性,还能增强真菌的抗逆性[3]。刺盘孢属(Colletotrichum)中的胞内黑色素多为二羟萘(dihydroxynaphthalene,DHN)黑色素,需要很多关键酶参与才能合成。其中,漆酶是合成终端酶,起氧化聚合作用,催化合成黑色素[4]。
漆酶属于含铜离子的多酚氧化酶,在多种生物中广泛存在。来源不同的漆酶虽然氨基酸序列相似性低,但是却具有相当高的铜离子结合位点保守性[5-6]。漆酶常以超基因家族的形式存在,成员几个至十余个不等,大部分缺失突变后会导致致病力显著下降[7-10]。漆酶是潜在的药物靶标,Almeida 等[11]从黑色素合成、毒性及敏感性等方面对新生隐球菌(Cryptococcus neoformans)漆酶基因lac1 突变体表型分析结果验证了这一点。Wang 等[12]发现以漆酶基因lcc1和lcc3为靶标的新抑制剂4-氯肉桂醛缩氨基硫脲(4-chlorocinnamaldehyde thiosemicarbazide,PMDD)具有一定的专一性,能明显抑制小麦全蚀病菌(Gaeumannomyces graminis var.tritici),但对炭疽菌等抑制效果一般。
漆酶可以在菌体内合成后并分泌到体外,因此属于胞外酶[5]。漆酶的表达除了受培养条件的影响外,还受多种外源物调控,且与外源物浓度相关。如1.25~2.50 mmol·L-1的Mn2+对白灵侧耳(Pleurotus tuliensis)漆酶有激活作用,5~10 mmol·L-1却表现抑制作用[13]。黄曲霉(Aspergillus flavus)漆酶活力在1 mmol·L-1的Cu2+下提高10 倍,在5 mmol·L-1时降低了58%,在10 mmol·L-1时接近无添加Cu2+情况[14]。Zn2+和Al3+等对平菇(Pleurotus ostreatus)漆酶酶活性有促进作用[15]。将阿魏蘑(Pleurotuseryngii var.ferulae)漆酶基因lacc2 和lacc6 在毕赤酵母中异源表达后,发现在1 mmol·L-1以下的K+、Cu2+、Co2+和Mn2+均会促进2 个同工酶酶活,直到5 mmol·L-1时酶活受到抑制;1 mmol · L- 1 的Fe2 +酶活抑制率接近100%[16]。同样,阴离子NO3-和SO42-对栓菌属(Trametes)漆酶酶活性有轻微的激活作用,Cl-抑制作用不明显,CO32-却显著抑制[17]。5 种有机物对T.velutina 5930漆酶的表达具有促进作用[18];0.5 mmol·L-1的L-半胱氨酸会完全抑制漆酶酶活性[16]。同类外源物对漆酶家族不同成员的调控也存在差异,白腐菌(Pleurotus ostreatus)所有漆酶基因受铜离子诱导呈现上调表达,而铁、锰、铬等其他金属离子只诱导部分漆酶基因转录水平上调;7 种芳香化合物能显著诱导所有漆酶基因上调表达,但存在差异;醇类诱导效应较弱[19]。可见,真菌漆酶基因的表达受外源金属阳离子、无机阴离子和有机物调控,且与外源物浓度有关,差异很大,但对胶孢炭疽菌而言,仍需分析外源物对其漆酶活性和家族基因表达调控方面的影响,以便为后续确定靶标和靶标抑制剂提供参考。
笔者实验室前期在杧果胶孢炭疽病菌中发现漆酶基因家族成员有13个,笔者拟开展27种外源物对该菌漆酶活性的影响,以及4 种代表性外源物对黑色素产量、附着胞形成和漆酶基因家族成员表达的影响,以揭示杧果胶孢炭疽病菌漆酶基因家族成员表达模式,为探究该家族在胶孢炭疽菌侵染杧果中的分子致病机制和研发新靶标杀菌剂或助剂提供依据。
1 材料和方法
1.1 材料
1.1.1 供试菌株 杧果胶孢炭疽病菌(C.gloeosporioides)A2 菌株,由中国热带农业科学院环境与植物保护研究所热带果树课题组提供,马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基试管斜面4 ℃保存。
1.1.2 供试试剂 MnSO4·H2O、CaSO4、CuSO4·5H2O、ZnSO4·7H2O、MgSO4·7H2O、K2SO4、Na2SO4、(NH4)2SO4、Fe2(SO4)3和FeSO4·7H2O为待测阳离子试剂,NaCl、Na2HPO4·12H2O、NaH2PO4·2H2O、Na2SO4、NaNO3、NaHCO3、Na2CO3和Na2SO3为待测阴离子试剂,香草酸、对羟基苯甲酸、肉桂酸、4-羟基-3-甲氧基肉桂酸甲酯、焦性没食子酸、二甲基亚砜、对甲氧基苯胺、白藜芦醇以及半胱氨酸为待测有机物试剂,均为国产分析纯。
漆酶酶活性试剂盒来源于苏州科铭生物技术有限公司。植物RNA 提取试剂盒、凝胶回收试剂盒、SuperReal PreMix Plus(SYBR Green)、FastKing RT Kit来源于Tiangen。
1.2 方法
1.2.1 外源物对杧果胶孢炭疽病菌胞外漆酶活性的作用(1)确定胞外漆酶产酶高峰期。分生孢子悬浮液的制备:将28 ℃180 r·min-1马铃薯葡萄糖(potato dextrose,PD)培养液培养3 d的A2,过滤离心后得分生孢子悬浮液,配成浓度为1.67×108 个·mL-1,以备后续使用。
在100 mL PD培养液中,加入1 mL杧果胶孢炭疽病菌分生孢子悬浮液(1.67×108 个·mL-1,下同),28 ℃180 r·min-1培养,分别在0、2、4、6、8、10、12 d取样,离心弃沉淀,所得上清液为胞外漆酶液。按漆酶酶活性试剂盒说明书测定漆酶酶活性,根据胞外漆酶曲线确定产漆酶高峰期。每组3 次重复,取平均值,下同。
(2)无机阴阳离子对胞外漆酶酶活性的作用参照付林俊等[17]的方法测定,配制各离子母液,再与漆酶酶液以3:2的体积比混合作为处理组,对照组以各离子和煮沸10 min灭活的酶液按同样比例混合,各离子终浓度为1、5、10 mmol·L-1,室温静置反应30 min,再按照漆酶试剂盒进行后续反应,测定并计算酶活性。每组3 次重复,空白对照组为相应量无菌水代替离子母液,下同。
(3)有机物对胞外漆酶酶活性的作用。对难溶于水的有机物用丙酮溶解,相应对照用等量丙酮代替。
分析上述结果,结合文献[12-14,16-17]选取促进和抑制明显的外源物进行后续试验。
1.2.2 代表性外源物对杧果胶孢炭疽病菌胞内漆酶酶活性的作用 将A2 菌饼(Φ=5 mm)接种于终浓度为1 mmol·L-1代表性外源物Cu2+、Mn2+、SO32-和半胱氨酸的PDA 平板上,28 ℃培养10 d,分别取0.1 g菌丝用液氮速冻后研磨成细粉,用漆酶测定试剂盒测定胞内漆酶的酶活性,即按菌丝质量(g):提取液(mL)为1∶10 的比例混合,冰浴匀浆5 min 后,4 ℃12 000 r·min-1离心30 min 获得上清液,用于测定胞内漆酶酶活性。
1.2.3 代表性外源物对杧果胶孢炭疽病菌黑色素产量的作用 参照Wei等[9]的方法,提取各处理等量菌丝体的胞内黑色素,计算黑色素含量(ρ)/(g·L-1)=OD400×0.105×N(N表示稀释倍数)。
1.2.4 代表性外源物对杧果胶孢炭疽病菌附着胞形成的作用 取10 μL杧果胶孢炭疽病菌分生孢子悬浮液分别与1 mL终浓度为1 mmol·L-1的Cu2+、Mn2+、SO32-以及半胱氨酸混匀,20倍镜下每视野约40个孢子,再参照肖春丽等[10]的方法观测附着胞的形成。
1.2.5 代表性外源物对杧果胶孢炭疽病菌漆酶基因家族成员表达的作用 将1 mL 杧果胶孢炭疽病菌分生孢子悬浮液接种于终浓度分别为1 mmol·L-1的Cu2+、Mn2+、SO32-以及半胱氨酸的PD 培养液中,180 r·min-1,28 ℃摇培3 d 后取菌丝提取总RNA 并反转录成cDNA,参考肖春丽等[10]的方法进行实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)分析。内参基因为18S rRNA,表1 为各引物序列,委托北京六合华大基因公司合成。
表1 qRT-PCR 引物
Table 1 Primers for qRT-PCR analysis

?
2 结果与分析
2.1 外源物对杧果胶孢炭疽病菌胞外漆酶活性的作用
2.1.1 确定胞外漆酶产酶高峰期 图1 表明,胞外漆酶酶活性达到全程最高峰是在培养杧果胶孢炭疽病菌至第10天的时候,故确定第10天为取样制备酶液的最佳时间。
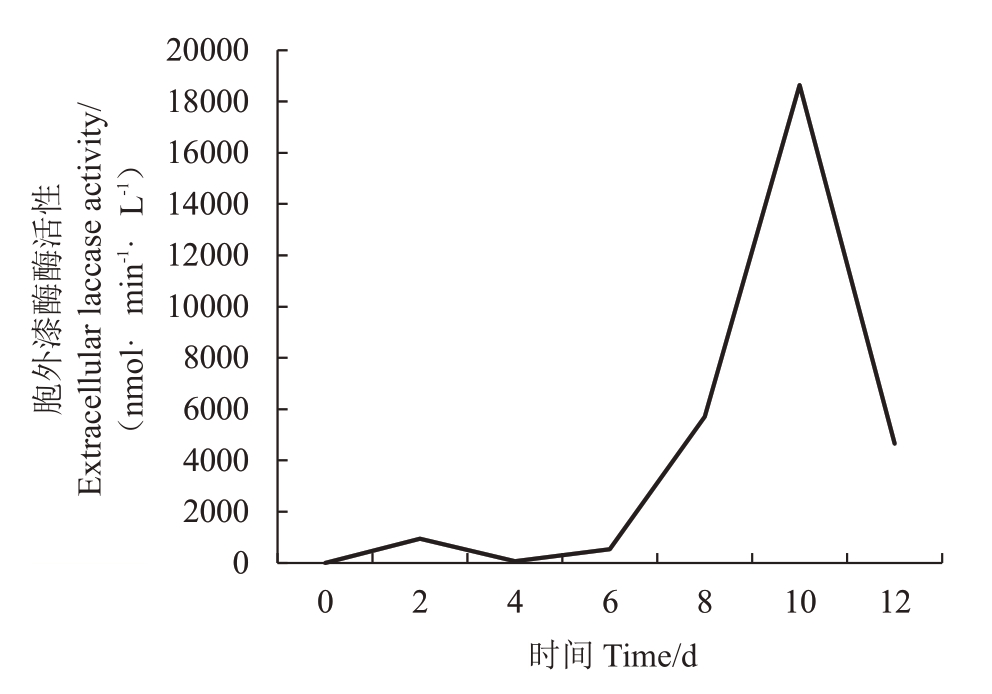
图1 杧果胶孢炭疽病菌A2 菌株胞外漆酶酶活性曲线
Fig.1 Extracellular laccase activity curve of C.gloeosporioides strain A2
2.1.2 阳离子对胞外漆酶酶活性的作用 图2 表明,对胞外漆酶酶活性作用,3个浓度的Ca2+均促进,相对酶活性达到了141%~157%,但只有1 mmol·L-1达到显著;1 mmol·L-1的Mn2+、Cu2+、Zn2+、Mg2+均起促进作用,其中Mn2+、Cu2+更显著,相对酶活性分别达到165%和142%,随着浓度继续增大时,酶活性受到明显抑制;各浓度的K+、Na+、NH4+、Fe3+和Fe2+均显著抑制,尤其是各浓度的Fe2+以及5、10 mmol·L-1的Fe3+处理后的相对酶活性不到10%。说明不同浓度各阳离子对杧果胶孢炭疽病菌胞外漆酶酶活性的影响差异较大,其中1 mmol·L-1的Mn2+、Cu2+和Ca2+促进作用更明显。
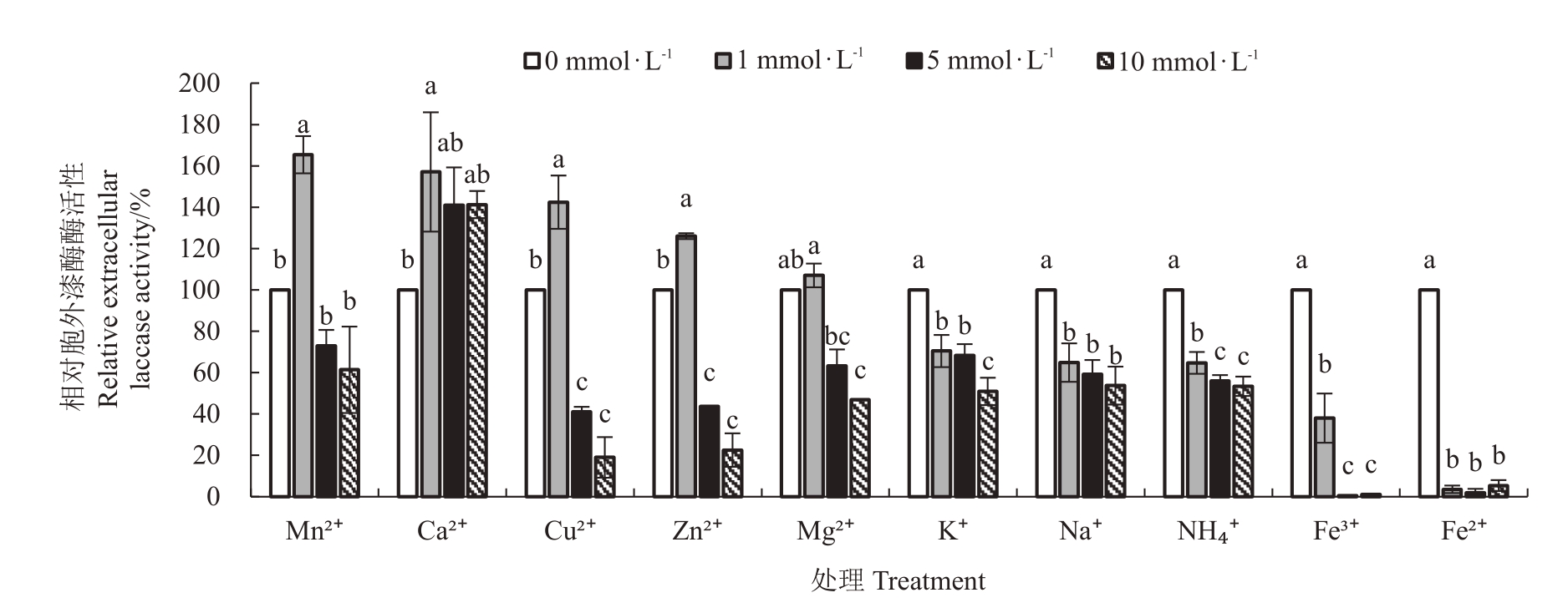
图2 无机阳离子对胞外漆酶酶活性的作用
Fig.2 Effect of inorganic cations on the activity of extracellular laccase
利用SPSS 数据软件进行方差分析,不同小写字母表示差异显著性(p <0.05)。下同。
Use SPSS data software for analysis of variance.Different small letters indicate significant difference(p <0.05),The same below.
2.1.3 阴离子对胞外漆酶酶活性的作用 图3 表明,3 个浓度下的阴离子Cl-、HPO42-、H2PO4-、SO42-、NO3-、HCO3-、CO32-和SO32-对杧果胶孢炭疽病菌漆酶胞外酶活性均有抑制作用,且大部分抑制作用与浓度成正相关,随浓度增加而增大。其中,3个浓度的SO32-和10 mmol·L-1 CO32-抑制作用尤为明显,抑制作用超过90%。
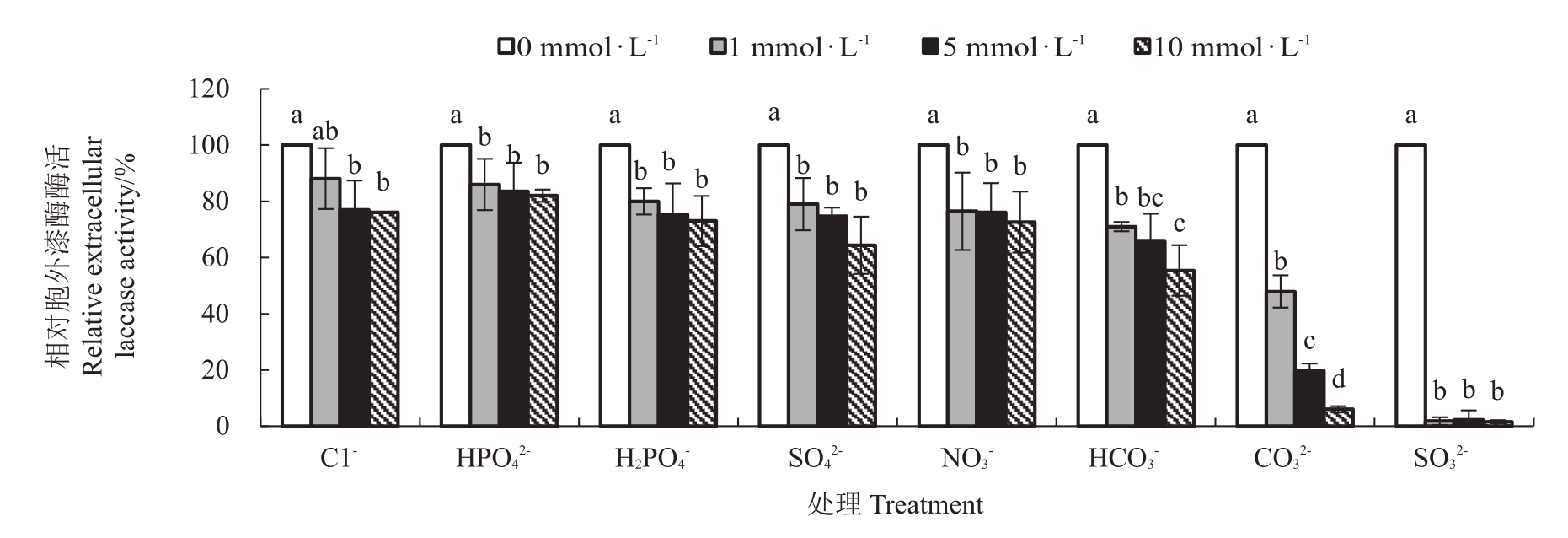
图3 无机阴离子对胞外漆酶酶活性的作用
Fig.3 Effect of inorganic anions on the activity of extracellular laccase
2.1.4 有机物对胞外漆酶酶活性的作用 图4 表明,不同浓度的有机物对杧果胶孢炭疽病菌胞外漆酶酶活性的作用不同。其中,除了10 mmol·L-1的4-羟基-3-甲氧基肉桂酸甲酯和焦性没食子酸表现出显著促进作用外,其他浓度的各有机物均表现显著抑制作用;尤其是半胱氨酸,抑制效果达90%;其次是10 mmol·L-1的对甲氧基苯胺和白藜芦醇,抑制效果在70%以上。

图4 有机物对胞外漆酶酶活性的作用
Fig.4 Effect of organic matter on the activity of extracellular laccase
2.2 代表性外源物对杧果胶孢炭疽病菌胞内漆酶酶活性的作用
图5表明,通过胞内漆酶测定发现,1 mmol·L-1的Cu2+、Mn2+起促进作用,其中Cu2+最明显,相对酶活性为149%;1 mmol·L-1的SO32-、半胱氨酸显著抑制,相对酶活性分别为74%和31%。
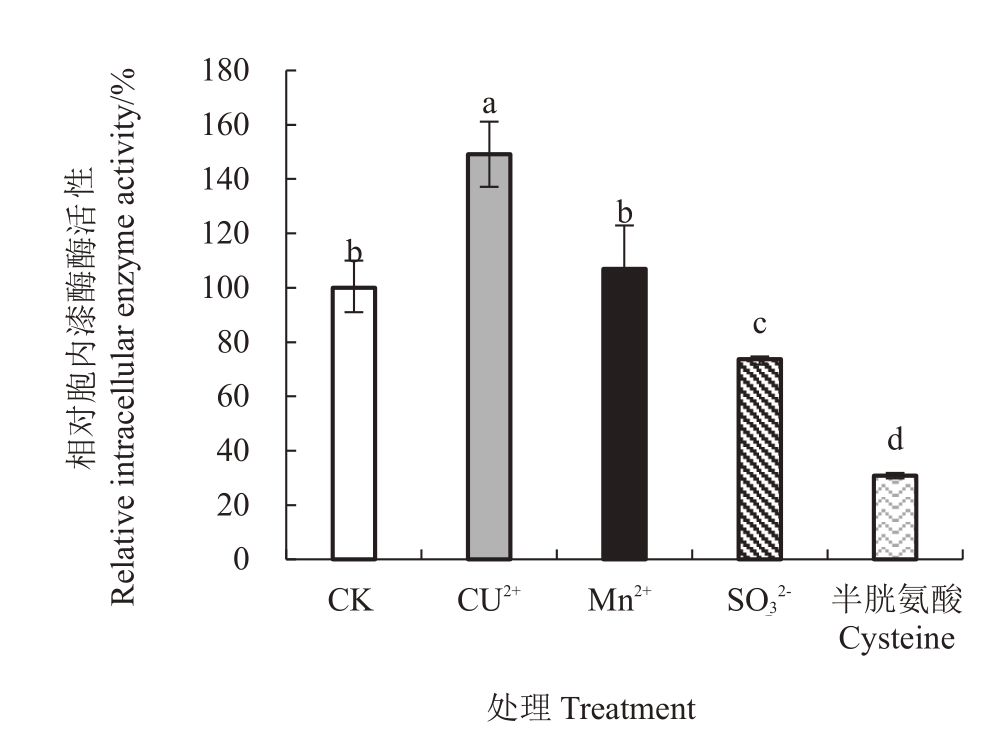
图5 代表性外源物对胞内漆酶酶活性的作用
Fig.5 Effect of representative exogenous substances on the intracellular laccasea ctivity
2.3 代表性外源物对杧果胶孢炭疽病菌黑色素产量的作用

图6表明,通过胞内黑色素含量分析发现,与对照组黑色素含量(w)(16.37 μg·g- 1)相比,只有1 mmol·L- 1 的Cu2 +处理组的黑色素含量增加了11.36%,达到了显著差异;与其他处理组差异不显著。可见,除Cu2+显著促进外,Mn2+、SO32-和半胱氨酸对杧果胶孢炭疽病菌黑色素的合成影响不明显。
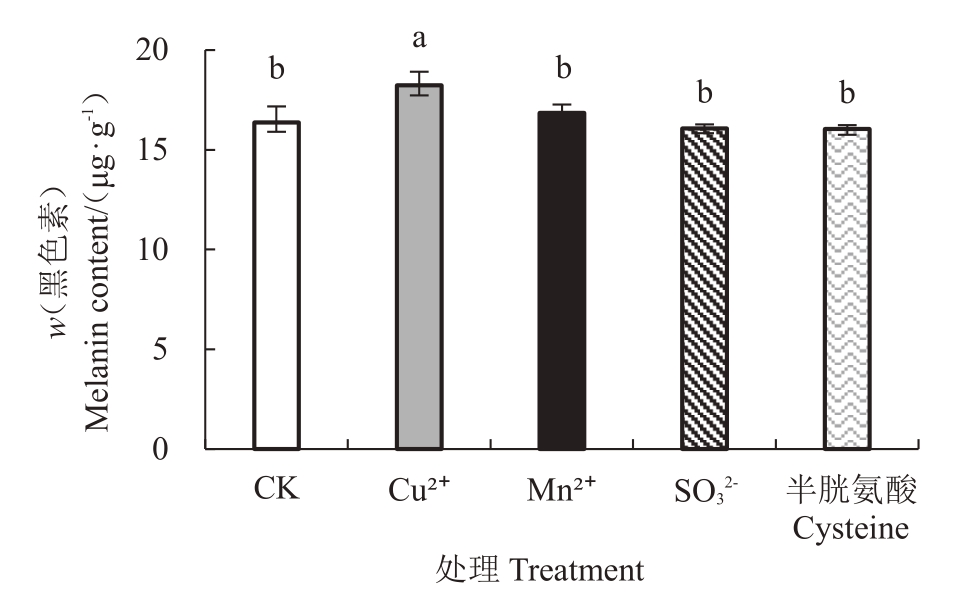
图6 代表性外源物黑色素产量的作用
Fig.6 Effect of representative exogenous substances on the melanin production
2.4 代表性外源物对杧果胶孢炭疽病菌附着胞形成的作用
图7表明,通过观察附着孢形成率发现,前4 h内各外源物处理组与对照组差异不明显,6 h时出现差异,Mn2+组和Cu2+组表现促进作用,SO32-组和半胱氨酸组表现抑制作用。

图7 代表性外源物对附着胞形成的作用
Fig.7 Effect of representative exogenous substances on appressorium formation
2.5 代表性外源物对杧果胶孢炭疽病菌漆酶基因家族成员表达的作用
图8表明,通过qRT-PCR 分析发现,1 mmol·L-1的Cu2+显著激活9/13 漆酶基因家族成员的转录活性,对1/13 成员显著抑制。1 mmol·L-1的Mn2+显著激活3/13 漆酶基因家族成员的转录活性,对2/13成员显著抑制。1 mmol·L-1的SO32-显著激活1/13漆酶基因家族成员的转录活性,对2/13 成员显著抑制。而1 mmol·L-1的半胱氨酸显著激活3/13漆酶基因家族成员的转录活性,对1/13成员显著抑制。

图8 代表性外源物对漆酶基因家族成员表达的作用
Fig.8 Effect of representative exogenous substances on the expression of laccase gene family members
1 mmol·L-1的Cu2+、Mn2+、SO32-和半胱氨酸均显著促进Cglac2 的表达(相对表达量提高了232%~612%)、显著抑制Cglac13(下降了97%~100%)和Cglac12(下降了64%~100%)的表达,对Cglac3表达无影响。但对其他漆酶基因家族成员的表达调控作用不同。Cu2+对Cglac1促进表达不显著,对Cglac4、Cglac5、Cglac7、Cglac8、Cglac9、Cglac10 和Cglac11显著促进表达,相对表达量比对照提高了68%~1468%,其中对Cglac6促进表达最明显;Mn2+显著促进Cglac6、Cglac8 和Cglac9 的表达,其中Cglac8 和Cglac9的相对表达量比对照提高了152%~226%,对Cglac1 抑制表达和对Cglac6 促进表达不显著,对Cglac4、Cglac5、Cglac7、Cglac10 和Cglac11 表达无影响;SO32-对Cglac1 和Cglac8 促进表达不显著,对Cglac4 显著抑制,对Cglac5、Cglac6、Cglac7、Cglac9、Cglac10、Cglac11 表达无影响;半胱氨酸显著促进Cglac8和Cglac9的表达,相对表达量比对照提高了146%~819%,对Cglac1抑制表达和对Cglac4促进表达不显著,对Cglac5、Cglac6、Cglac7、Cglac10和Cglac11无影响。总体来看,Cu2+对约3/4的漆酶基因家族成员促进表达;Mn2+、SO32-和半胱氨酸对约1/3的成员起促进作用,对23%的成员抑制表达,对其余成员调控没有影响。可见,Cu2+、Mn2+、SO32-和半胱氨酸对杧果胶孢炭疽病菌漆酶基因家族成员的调控作用并不相同。
3 讨 论
研究结果表明,供试的8种钠盐、10种硫酸盐和9 种有机物中,对杧果胶孢炭疽病菌胞外漆酶酶活性起抑制作用的有20 种,包括Fe2+、Fe3+、NH4+、Na+、K+、Cl-、SO32-、CO32-、HCO3-、SO42-、NO3-、H2PO4-、HPO42-、半胱氨酸、白藜芦醇、对甲氧基苯胺、对羟基苯甲酸、二甲基亚砜、肉桂酸和香草酸,其中Fe2+、Fe3+、SO32-和半胱氨酸的抑制作用尤为明显,抑制率超过90%;其余外源物的作用与浓度有关,3个浓度Ca2+均促进,而Mn2+、Cu2+、Zn2+和Mg2+在1 mmol·L-1时促进,而在5、10 mmol·L-1时抑制;4-羟基-3-甲氧基肉桂酸甲酯和焦性没食子酸在1、5 mmol·L-1时抑制表达,但在10 mmol·L-1浓度下明显促进表达。上述结果中,4-羟基-3-甲氧基肉桂酸甲酯、焦性没食子酸和对甲氧基苯胺的调控作用属于本文首次报道。Zn2+均促进漆酶酶活性的结果与文献[20-21]一致。Fe2 +、Fe3 +、CO32-、SO32-、半胱氨酸和二甲基亚砜均抑制的结果与文献[12-13,16-17,21]一致。Mn2+和Cu2+低浓度促进、高浓度抑制的特点与文献[13,16]一致,但与文献[20-21]报道的Mn2+和Cu2+始终促进漆酶酶活性有差异。本研究各浓度的K+、NO3-、SO42-、HCO3-、H2PO4-和HPO42-均表现抑制,但文献显示低浓度的K+会促进阿魏蘑漆酶基因lacc2和lacc6这2个同工酶酶活性,NO3-和SO42-对栓菌属(Trametes)漆酶酶活性有弱激活作用[17],HPO42-能促进漆酶降解活性,但HCO3-和H2PO4-没有显著影响[21],由此可知,同一外源物对不同来源的真菌漆酶酶活性的影响存在差异。
研究表明,对杧果胶孢炭疽病菌胞外漆酶酶活性的影响,阳离子中1 mmol·L-1的Mn2+、Cu2+促进作用更明显,阴离子中1 mmol·L-1的SO32-抑制作用尤为明显,大部分有机物表现抑制作用,其中半胱氨酸抑制最显著,而漆酶属于含铜离子的多酚氧化酶,Cu2+必不可少。因此,开展进一步试验时最终选择了Cu2+、Mn2+作为促进代表性阳离子外源物,SO32-作为抑制代表性阴离子外源物,半胱氨酸作为有机物抑制代表性外源物,并结合文献[12-14,16-17]确定用1 mmol·L-1的浓度以便对比分析。如果后续能通过搜索含这些抑制剂集团或成分的农药进行防病试验且证明有效,那么通过测定外源物对胞外漆酶酶活性的抑制效果或许会成为快速筛选漆酶靶标药剂一条捷径。
qRT-PCR 结果显示,Cu2+、Mn2+、SO32-和半胱氨酸对杧果胶孢炭疽病菌漆酶基因家族成员的调控并不相同,1 mmol·L-1的Cu2+对约3/4的漆酶基因家族成员促进表达,但对Cglac3 调控没有影响,对Cglac12 和Cglac13 反而抑制表达;1 mmol·L-1 的Mn2+、SO32-和半胱氨酸对约一半的成员调控没有影响,对约1/3 的成员促进表达,对23%的成员抑制表达,相比之下,本文推测Cglac2、Cglac12 和Cglac13很可能是这4 个外源物共同靶标,Cglac1、Cglac4、Cglac6、Cglac8 和Cglac9 只是部分外源物的靶标,Cglac5、Cglac7、Cglac10 和Cglac11 只是Cu2+的靶标,而Cglac3不是靶标。该推测尚需异源表达单个漆酶基因家族成员后进一步证实。类似的结果也出现在小麦全蚀病菌中,PMDD只作用于lcc1和lcc3,却对lcc1 的表达无影响[12];玉米大斑病菌(Setosphaeria turcica)3 个漆酶基因Stlac1、Stlac3 和Stlac5能被0.03%(φ)白藜芦醇诱导上调表达,Stlac1的表达却被抑制[22];铁、锰、铬等其他金属离子只诱导白腐菌部分漆酶基因转录水平上调[19]。可见,同一外源物对真菌漆酶基因家族成员的调控存在差异。这可能是来源不同的漆酶虽然具有相当高的铜离子结合位点的保守性,但因其氨基酸序列相似性低[6],使得漆酶的空间构象差异大;当外源物充当底物选择与漆酶活性中心[14]、周边酸性氨基酸残基ω-羧基阴离子[23]以及咪唑基配位体[14,17,24]结合,会促进或抑制漆酶的活性,进而反馈性影响上游漆酶基因家族成员的表达。
漆酶属于含铜离子的多酚氧化酶,Cu2+是漆酶活性的中心,也是漆酶的重要组成成分[14]。一定量的Cu2+能充当该漆酶的底物,诱导漆酶基因转录合成蛋白。然而5、10 mmol·L-1的Cu2+却对漆酶酶活性表现出抑制作用,可能有2个方面原因:①过多的Cu2+影响活性中心与底物的结合和反应速度;②过多的Cu2+影响漆酶分子的电荷分布和电子传递速度[25]。Gunne 等[26]研究一定阈值范围内的外源铜离子,起促进酶的活力,但超过一定的范围则对漆酶的反应不敏感,甚至起抑制作用。
Cu2+、Mn2+、SO32-和半胱氨酸处理组对杧果胶孢炭疽病菌胞内漆酶酶活性和附着胞形成率的影响与对胞外漆酶酶活性影响一致,都是Cu2+、Mn2+促进,SO32-和半胱氨酸抑制;但对黑色素合成有差异,Cu2+显著促进,Mn2+、SO32-和半胱氨酸无显著影响。这或许与外源物对13 个漆酶基因的表达调控漆酶酶活性的作用有关,最终体现在终端产物黑色素的合成上。
4 结 论
杧果胶孢炭疽病菌胞外漆酶产酶高峰期为第10 天。对该菌胞外漆酶活性具有明显抑制作用的外源物:阳离子有Fe2+、Fe3+、NH4+、Na+和K+,阴离子有SO32-、CO32-、HCO3-、SO42-、NO3-、H2PO4-和HPO42-,有机物有半胱氨酸、白藜芦醇、对甲氧基苯胺、对羟基苯甲酸、二甲基亚砜、肉桂酸和香草酸,其中Fe2+、Fe3+、SO32-、半胱氨酸的抑制作用尤为明显。3 个浓度的Ca2+均促进,而Mn2+、Cu2+、Zn2+和Mg2+在低浓度时起促进作用,高浓度时起抑制作用;相反,4-羟基-3-甲氧基肉桂酸甲酯和焦性没食子酸在低浓度促进,高浓度抑制。对胞内漆酶酶活性和附着胞形成率,1 mmol·L-1的Cu2+和Mn2+促进,SO32-和半胱氨酸抑制;对黑色素合成,1 mmol·L-1的Cu2+显著促进,而Mn2+、SO32-和半胱氨酸无显著影响。qRT-PCR 结果显示,1 mmol·L-1的Cu2+对约3/4的漆酶基因家族成员促进表达,Mn2+、SO32-和半胱氨酸对约1/3 的成员起促进作用,对23%的成员抑制。可见,同一外源物对杧果胶孢炭疽病菌漆酶活性和其漆酶基因家族成员的表达调控不同。
[1] 康浩,杨石有,苏初连,李馨,刘晓妹,蒲金基,张贺.氟硅唑和吡唑醚菌酯混配对芒果炭疽病菌的抑制作用[J].中国果菜,2017,37(8):24-27.KANG Hao,YANG Shiyou,SU Chulian,LI Xin,LIU Xiaomei,PU Jinji,ZHANG He. Inhibitory effect of flusilazole and pyraclostrobin against Colletotrichum gloeosporioides[J]. China Fruit Vegetable,2017,37(8):24-27.
[2] KOGEJ T,WHEELER M H,RIŽNER T L,GVNDA-CIMERMAN N. Evidence for 1,8-dihydroxynaphthalene melanin in three halophilic black yeasts grown under saline and non-saline conditions[J]. FEMS Microbiology Letters,2004,232(2):203-209.
[3] 樊荣,王春生,赵蕊,潘勇宏,龙友华,赵志博.植物病原真菌1,8-间苯二酚黑色素研究进展[J]. 微生物学通报,2020,47(11):3671-3677.FAN Rong,WANG Chunsheng,ZHAO Rui,PAN Yonghong,LONG Youhua,ZHAO Zhibo.Advances in 1,8-dihydroxynaphthalene melanin of plant fungal pathogens[J].Microbiology China,2020,47(11):3671-3677.
[4] GENTO T,YOUKI K,YOSHITAKA T,JAMES S,LEONARD F,IWAO F,OSAMU H,YASUYUKI K.Novel fungal transcriptional activators,Cmr1p of Colletotrichum lagenarium and Pig1p of Magnaporthe grisea,contain Cys2His2 zinc finger and Zn(II)2Cys6 binuclear cluster DNA-binding motifs and regulate transcription of melanin biosynthesis genes in a de[J].Molecular Microbiology,2002,38(5):940-954.
[5] 闫丽,吕静.漆酶的结构、功能及其应用进展[J].首都博物馆论丛,2020(1):290-299.YAN Li,LÜ Jing. The structure,function and application progress of laccase[J]. The Capital Museum Collection,2020(1):290-299.
[6] 陈新.稻瘟病菌两个漆酶基因功能分析[D].福州:福建农林大学,2008.CHEN Xin. Function analysis of two laccase genes in Magnaporthe grisea[D]. Fuzhou:Fujian Agriculture and Forestry University,2008.
[7] MA S X,CAO K K,LIU N,MENG C,CAO Z,DAI D,JIA H,ZANG J,LI Z,HAO Z,GU S,DONG J.The StLAC2 gene is required for cell wall integrity,DHN-melanin synthesis and the pathogenicity of Setosphaeria turcica[J]. Fungal Biology,2017,121(6/7):589-601.
[8] LIN S Y,OKUDA S,IKEDA K,OKUNO T,TAKANO Y.LAC2 encoding a secreted laccase is involved in appressorial melanization and conidial pigmentation in Colletotrichum orbiculare[J].Molecular Plant-Microbe Interactions:MPMI,2012,25(12):1552-1561.
[9] WEI Y X,PU J J,ZHANG H,LIU Y NZHOU F X,ZHANG K L,LIU X M.The laccase gene(LAC1)is essential for Colletotrichum gloeosporioides development and virulence on mango leaves and fruits[J]. Physiological and Molecular Plant Pathology,2017,99:55-64.
[10] 肖春丽,钟昌开,张梦婷,余姿蓉,董玲玲,谭晴,张贺,蒲金基,刘晓妹.漆酶基因Cglac10 的缺失对杧果炭疽病菌无性繁殖和侵染能力的影响[J].果树学报,2021,38(7):1066-1076.XIAO Chunli,ZHONG Changkai,ZHANG Mengting,YU Zirong,DONG Lingling,TAN Qing,ZHANG He,PU Jinji,LIU Xiaomei. Effects of deletion of laccase gene Cglac10 on the asexual reproduction and infection ability of Colletotrichum gloeosporioides[J]. Journal of Fruit Science,2021,38(7):1066-1076.
[11] ALMEIDA F,WOLF J M,CASADEVALL A.Virulence-associated enzymes of Cryptococcus neoformans[J]. Eukaryotic Cell,2015,14(12):1173-1185.
[12] WANG Z W,PENG Q,GAO X,ZHONG S,FANG Y,YANG X L,LING Y,LIU X L. Novel fungicide 4-chlorocinnamaldehyde thiosemicarbazide (PMDD) inhibits laccase and controls the causal agent of take-all disease in wheat,Gaeumannomyces graminis var. tritici[J]. Journal of American Chemical Society,2020,68:5318-5326.
[13] 刘芹,崔筱,孔维威,段亚魁,袁瑞奇,韩玉娥,康源春.白灵侧耳菌渣中漆酶的分离纯化与酶学性质[J].食用菌学报,2019,26(4):90-99.LIU Qin,CUI Xiao,KONG Weiwei,DUAN Yakui,YUAN Ruiqi,HAN Yu'e,KANG Yuanchun. Purification and characterization of a laccase from Pleurotus tuoliensis cultivation residue[J].Acta Edulis Fungi,2019,26(4):90-99.
[14] GOMAA O M,MOMTAZ O A. Copper induction and differential expression of laccase in Aspergillus flavus[J].Brazilian Journal of Microbiology,2015,46(1):285-292.
[15] 马倩倩. 白腐菌Pleurotus ostreatus 漆酶纯化和酶学性质研究[D].锦州:辽宁工业大学,2019.MA Qianqian. Purification and property of laccase from white rot fungus Pleurotus ostreatus[D]. Jinzhou:Liaoning University of Technology,2019.
[16] 苑畅,赵丽婷,顾正华,李由然,石贵阳,丁重阳.阿魏蘑漆酶同工酶的异源表达及酶学性质研究[J]. 食品与发酵工业,2020,46(13):10-17.YUAN Chang,ZHAO Liting,GU Zhenghua,LI Youran,SHI Guiyang,DING Chongyang.Heterologous expression and enzymatic properties of laccase isozymes of Pleurotus eryngii var.ferulae[J]. Food and Fermentation Industries,2020,46(13):10-17.
[17] 付林俊,刘海,张晓晴,张淑琴,任大军.不同离子对漆酶酶活的影响[J].化学试剂,2019,41(8):830-835.FU Linjun,LIU Hai,ZHANG Xiaoqing,ZHANG Shuqin,REN Dajun. Effect of different ions on laccase enzyme activity[J].Chemical Reagents,2019,41(8):830-835.
[18] YANG Y,WEI F X,ZHUO R,FAN F,LIU H,ZHANG C,MA L,JIANG M,ZHANG X.Enhancing the laccase production and laccase gene expression in the white-rot fungus Trametes velutina 5930 with great potential for biotechnological applications by different metal ions and aromatic compounds[J]. PLoS One,2013,8(11):79307.
[19] 卓睿. 白腐真菌漆酶及同工酶基因家族的克隆表达调控研究[D].武汉:华中科技大学,2015.ZHUO Rui. Cloning and transcriptional regulation analysis of laccase gene and laccase multi-gene family from white rot fungi[D].Wuhan:Huazhong University of Science and Technology,2015.
[20] 赵丽婷.共培养胶红酵母对阿魏蘑漆酶基因表达及其相关蛋白的影响[D].无锡:江南大学,2017.ZHAO Liting. Study on Pleurotus eryngii var. ferulae laccase gene expression and corresponding proteins effected by co-cultured rhodotorular mucilaginosa[D].Wuxi:Jiangnan University,2017.
[21] 路文硕,田兴军,王强.常见离子对漆酶降解活性艳蓝的调控作用[J].应用与环境生物学报,2019,25(4):959-965.LU Wenshuo,TIAN Xingjun,WANG Qiang. Regulation effects of common ions on the degradation rate of reactive brilliant blue decomposed by laccase[J].Chinese Journal of Applied and Environmental Biology,2019,25(4):959-965.
[22] 曹可可.大斑刚毛座腔菌漆酶基因功能验证及高产漆酶发酵条件优化[D].保定:河北农业大学,2015.CAO Keke. The function of laccase genes and optimization of fermentation condition for laccase production in Setosphaeria turcica[D].Baoding:Hebei Agricultural University,2015.
[23] SHI X Y,ZHANG L L,WU F,FU Y Y,YIN S J,SI Y X,PARK Y D. Kinetics for Cu2+ induced Sepia pharaonis arginine kinase inactivation and aggregation[J].International Journal of Biological Macromolecules,2016,91:926-933.
[24] BAYSAL E,HUISMAN T H. Detection of common deletional alpha-thalassemia-2 determinants by PCR[J].American Journal of Hematology,1994,46(3):208-213.
[25] 王习文,詹怀宇.Fe(Ⅱ)对漆酶催化活性的影响[J].生物技术,2003,13(3):13-14.WANG Xiwen,ZHAN Huaiyu.Effects of Fe2+ion on the catalytic oxidation by laccase[J].Biotechnology,2003,13(3):13-14.
[26] GUNNE M,AL-SULTANI D,URLACHER V B. Enhancement of copper content and specific activity of CotA laccase from Bacillus licheniformis by coexpression with CopZ copper chaperone in E. coli[J]. Journal of Biotechnology,2013,168(3):252-255.