杧果(Mangifera indica.L)被誉为“热带水果之王”,其香味诱人,果肉甜美细腻,深受消费者喜爱。杧果果实中的糖分积累为淀粉转化型[1],光合产物蔗糖从源运输到果实后,由蔗糖转化酶分解为葡萄糖和果糖,或由蔗糖合成酶分解为尿苷二磷酸葡萄糖和果糖[2-4],除用于果实生长发育和呼吸消耗外,多余部分主要转化为淀粉积累于果实中直至采收成熟期,采收后经过后熟将淀粉转化为可溶性糖。完熟杧果果实中主要可溶性糖为蔗糖、果糖和葡萄糖[5],其中果糖的甜度植最高[6]。在整个糖代谢过程中果糖代谢是基础,果糖在进入下一步代谢前必须由果糖激酶(fructokinase,FRK)或己糖激酶(hexokinase,HXK)进行磷酸化,而FRK 是催化果糖磷酸化的主要酶[7],在植物细胞中起调节果糖流量的作用。此外,FRK可作为植物的己糖感受器通过糖信号感受来调控植物生长[8]。
目前,已从拟南芥[9]、马铃薯[10-11]、番茄[12-14]、水稻[15]、甘蔗[16-17]、温州蜜柑[18]、木薯[19]和枇杷[20]等植物中克隆了FRK 基因。Kanayama 等[12]从番茄中克隆到了4个FRK基因LeFRK1、LeFRK2、LeFRK3和Le-FRK4,发现不同FRK 基因的表达具有组织特异性。Yao 等[19]在木薯中鉴定出的6 个FRK 基因(Me-FRK1~MeFRK6)在叶、茎、花和果实中表达模式也不同。Jiang 等[15]在水稻未成熟的种子中发现Os-FRKⅡ在发育中的水稻籽粒活性较高,OsFRKⅠ在未成熟的水稻籽粒中活性较低。在马铃薯中,FRK1在叶中活性较高,在块茎中活性较低,而FRK2在块茎中活性很高,在叶中却很难测到[11],在拟南芥中也同样发现FRK2在根中具有很强的活性,但在茎、叶等地上部位很难测到[9]。
不同植物果实中FRK 的表达模式不同,Qin等[20]发现枇杷EjFRK的表达量在果实发育早期高于成熟时期,与果糖含量变化趋势相反,在海巴戟[21]、温州蜜柑[18]、草莓[22]和杨梅[23]果实发育过程中也发现同样现象。但是,王卫平等[13]在番茄果实发育过程中发现,3 个FRK 基因的表达量在番茄果实发育过程中呈先上升后下降的趋势。此外,枸杞LbFRK7基因的表达量在果实发育过程中也是同样的变化趋势[24]。还有研究发现,在苹果果实发育过程中,Md-FK1的相对表达量从花后16 d至122 d缓慢增加,在果实成熟期达到最高峰,但MdFK2、MdFK3 和Md-FK4 在花后16 d 相对表达量最高,在果实成熟期表达量低[25]。
笔者团队前期研究发现,热农1号与台农1号的可溶性糖含量在果实不同发育阶段有显著差异,其中果糖差异最大[5],并基于转录组测序结果,鉴定出4个杧果FRK基因,其中2个FRK基因在2个品种间表达差异较显著。笔者在本研究中继续以热农1号和台农1号为材料,对这两个FRK基因进行克隆、分析,以期为后续杧果FRK基因功能分析和果实甜度遗传控制奠定基础。
1 材料和方法
1.1 试验材料
试验材料的采样地为中国热带农业科学院南亚热带作物研究所杧果种质资源圃,试验材料为低糖的热农1号与高糖的台农1号,每个品种选取幼果期(A:花后40 d左右)、果实膨大期(B)、青熟期(C:采收成熟期)和完熟期(D:食用成熟期,采收后1 周)4个时期分别取样,每次取样选取果形端正、无病虫害、大小均匀、成熟度一致的果实。去皮后将果肉切成2 cm3左右,用液氮速冻、研磨成粉末后-80 ℃贮存备用。
1.2 试剂
Ezup 柱式植物基因组DNA 抽提试剂盒和植物总RNA快速抽提试剂盒(生工生物工程(上海)股份有限公司);RevertAid First Strand cDNA Synthesis Kit(Thermo Fisher Scientific公司,美国);TransTaq®-T DNA Polymerase、pEASY®-Blunt 试剂盒(全式金生物科技有限公司);DM 2000 DNA Marker、pMDTM19-T Vector Cloning Kit、E.coli DH5α Competent Cells(宝日医生物技术(北京)有限公司);通用型DNA纯化回收试剂盒(天根生化科技(北京)有限公司);HiScript® Q RT SuperMix for qPCR、AceQ®qPCR SYBR Green Master Mix(南京诺唯赞生物科技股份有限公司),其余试剂均为国产分析纯(AR);采用Primer Premier 5.0 软件设计引物,委托生工生物工程(上海)股份有限公司合成,相关引物序列见表1。
表1 PCR 所用引物名称及序列
Table 1 Name and sequence of primer used in PCR

引物名称Primer name MiFRK1 F1 MiFRK1 R1 MiFRK1 F2 MiFRK1 R2 MiFRK2 F1 MiFRK2 R1 MiFRK2 F2 MiFRK2 R2 QMiFRK1 F1 QMiFRK1 R1 QMiFRK2 F1 QMiFRK2 R1 RtMiFRK1 F1 RtMiFRK1 R1 RtMiFRK2 F1 RtMiFRK2 R1 Actin F1 Actin R1序列Sequence CAATCCTTCTTGCTCTGCCTTTC GCATGGCAAACGGCAATTAAGTGTG GTCCTGCATCCGTTTTCCATTG GCTTGCATCTACAGCACTTCAG TGTCCCTTCCAATGGCTTCAAAC CCAAATGCTCAGGATCTGTGTG AGACTACCATTGTGGCCCTCTC ATCCAAGCCATCTTCTGTGGCA ATGGATATGAAAGCAGGATCTGGGA TTATGATGCAGCAACTGGTTCTAAG CTGTCCCTTCCAATGGCTTCAAAC TTAATATGCCCCTTTGATTAAGCTG CAACTCATCTTGCTGCCA CTTGACCCCATATGCTC ATGGCATCCTAACCTGAAG TGCATAGTAAAGCACCGAC AATGGAACTGGAATGGTCAAGGC TGCCAGATCTTCTCCATGTCATCCA引物用途Function DNA上游片段克隆Cloning DNA upstream fragments DNA下游片段克隆Cloning DNA downstream fragments DNA上游片段克隆Cloning DNA upstream fragments DNA下游片段克隆Cloning DNA downstream fragments cDNA全长克隆Cloning cDNA full-length cDNA全长克隆Cloning cDNA full-length实时荧光定量PCR Real-time fluorescence PCR实时荧光定量PCR Real-time fluorescence PCR内参基因实时荧光定量PCR Real-time fluorescent PCR of internal reference gene
1.3 2个品种MiFRK基因DNA全长的克隆
根据Ezup柱式植物基因组DNA抽提试剂盒说明书,分别取2个品种的幼果进行总DNA提取。用微量分光光度计检测提取DNA的浓度和纯度,并用1%的琼脂糖凝胶电泳检测其完整性。选择高质量DNA于-20 ℃保存。
根据前期试验获得的杧果转录组数据库,筛选转录组中与NCBI 中FPK 蛋白同源性较高且在2 个品种表达差异明显的2 个Unigene 片段,将筛选Unigene 片段与杧果基因组数据进行比对获得2个包含FPK 编码序列的DNA 序列,命名为Mi-FRK1 和MiFRK2,设计引物(表1),分别以2 个品种的DNA 作为模板进行PCR。在反应体系中加入1 μL 的DNA 模板、各1 μL 的MiFRK 的正向引物和反向引物、2.5 μL 10×TransTaq®-T Buffer、2 μL 2.5 mmol·L-1 dNTPs、0.5 μL TransTaq®-T DNA polymerase、加Nuclease-free Water至25 μL。PCR条件:94 ℃预变性2 min;94 ℃30 s、50~60 ℃30 s、72 ℃90 s,执行35 个循环;72 ℃延伸10 min。PCR 产物用1%的琼脂糖凝胶电泳检测。目的DNA片段利用通用型DNA 纯化回收试剂盒回收。将回收产物按pMDTM19-T Vector Cloning Kit 说明进行T 载体链接,转化大肠杆菌感受态细胞过夜培养,筛选白斑并进行菌液PCR鉴定,将阳性克隆菌液委托上海生物工程有限公司测定DNA 序列。所得到的结果用DNAMAN8 进行序列拼接,以进行后续的结果分析。
1.4 2个品种MiFRK基因cDNA全长的克隆
根据植物总RNA快速抽提试剂盒说明书,分别提取2 个品种4 个时期总RNA,总RNA 于-80 ℃保存,用微量分光光度计检测提取RNA 的浓度和纯度,采用1%琼脂糖凝胶电泳检测其完整性。等量吸取热农1号与台农1号4个时期的RNA混匀作为模板,根据RevertAid First Strand cDNA Synthesis Kit说明书分别合成热农1 号与台农1 号品种cDNA 第一链,反转录产物置于-20 ℃保存,备用。根据预测的编码区设计cDNA 全长引物,以反转录产物为模板进行PCR,回收、克隆并测序,操作同1.3。
1.5 2个品种MiFRK基因生物信息学分析
通过在线软件ProtParam(https://web.expasy.org/protparam/)预测蛋白结构,分析目的基因编码蛋白质的氨基酸组成、蛋白质相对分子质量、理论等电点及稳定性等参数;利用Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)在线预测蛋白质亚细胞定位情况;用TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行蛋白质跨膜结构分析;利用NCBI 的CD-Search 数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)检 索 并 分析蛋白的保守域;通过SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https://www.swissmodel.expasy.org/)软件分别预测分析蛋白质的二级结构及三级结构;用NCBI的蛋白质序列数据库进行Blastp(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp),筛选出同源性较高的FRK 蛋白,利用MEGA 7 软件构建Neighbor-Joining 系统进化树,bootstrap重复次数为1000次。
1.6 2个品种MiFRK基因的表达分析
根据得到的热农1 号和台农1 号cDNA 全长序列,分别设计适用于2 个品种的MiFRK1 和MiFRK2基因荧光定量PCR的特异性引物,将1.4获得的2个品种不同时期总RNA 定量至同一浓度,用HiScript® Q RT SuperMix for qPCR 反转录试剂盒合成cDNA,使用AceQ® qPCR SYBR Green Master Mix在Roche Lightcyler® 480 上进行qRT-PCR。反应体系20 μL:AceQ® qPCR SYBR Green Master Mix 10 μL,ddH2O 7 μL,cDNA 1 μL,正向引物和反向引物各1 μL。反应程序:94 ℃1 min;94 ℃10 s,55 ℃30 s,72 ℃1 min,40个循环;做熔解曲线分析,每个样品3 次重复,反应结束后通过2-ΔΔCt法计算基因的相对表达量。
1.7 2个品种不同果实发育期果糖含量分析
参考袁晖等[26]的方法对不同样品进行糖提取,过0.45 μm 滤膜,使用PE 高效液相色谱仪(美国PE公司制造)进行测定,参数为:Serise200 氨基酸柱,柱温35 ℃,流动相(乙腈、双蒸水体积比70∶30),流速1 mL·min-1,进样量20 μL。
2 结果与分析
2.1 杧果MiFRK基因DNA全长的克隆及分析
分别以2 个品种DNA 为模板,进行PCR 扩增,分别获得热农1 号和台农1 号的MiFRK1 F1R1、Mi-FRK1 F2R2、MiFRK1 F1R1 和MiFRK1 F2R2 片段,对测序的结果进行序列拼接得到的热农1号和台农1 号的MiFRK1 和MiFRK2 DNA 全长,分别命名为R-MiFRK1、T-MiFRK1、R-MiFRK2 和T-MiFRK2。长度 分 别 为3522、3522、3290 和3299 bp。经NCBI blastx 分析并结合杧果基因组数据,发现R-Mi-FRK1、T-MiFRK1 均含有6 个Exon、140 bp 3’-UTR以及886 bp 的5’-UTR,R-MiFRK2 和T-MiFRK2 均含有4个Exon和81 bp的3’-UTR(图1)。
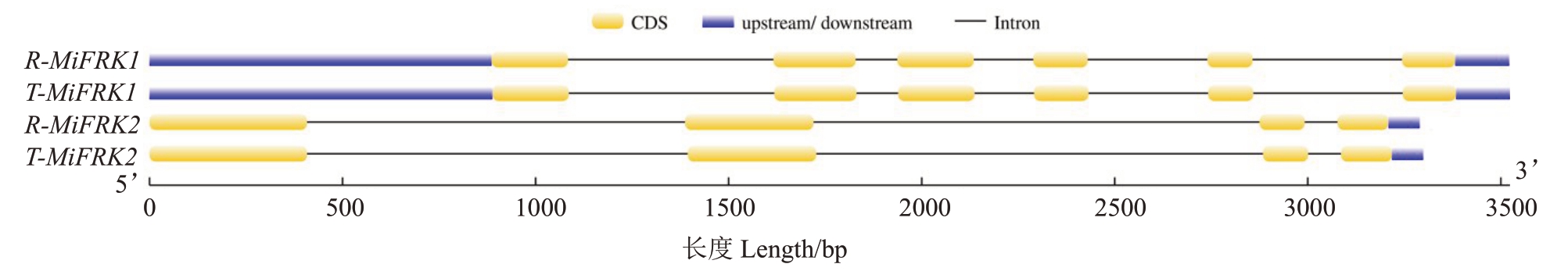
图1 杧果MiFRK 基因结构预测
Fig.1 Structural prediction of mango MiFRK gene
经比对发现R-MiFRK1与T-MiFRK1序列一致;R-MiFRK2 与T-MiFRK2 有69 个位点存在差异。SNP差异有56个,插入性位点13个(图2)。

图2 品种间存在显著差异的基因(MiFRK2)DNA 序列对比
Fig.2 DNA sequence comparison of MiFRK2(with significant differences)between two mango cultivars
绿色代表有差异。Green means different.
利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线分析软件对R-Mi-FRK1 和T-MiFRK1 启动子区序列进行分析,结果(图3)发现,R-MiFRK1 和T-MiFRK1 启动子区除典型的TATA-box 和CAAT-box 核心启动子元件外,均包含ABRE、CAT-box、MYC、P-box 和TCA-element元件。说明杧果MiFRK1 的表达受脱落酸、赤霉素和水杨酸的调控,同时与缺水、抗脱落酸及抗冻响应有关。

图3 MIFRK1 启动子元件分析
Fig.3 Promoter element analysis of MIFRK1
2.2 杧果MiFRK基因cDNA全长的克隆及分析
根据预测的编码区设计引物,分别以2 个品种RNA 反转录的cDNA 为模板,进行PCR 扩增,分别获得热农1 号和台农1 号的MiFRK1 和MiFRK2 cDNA 全长,测序结果与由拼接DNA 预测的一致。分别命名为R-MiFRK1、T-MiFRK1、R-MiFRK2 和TMiFRK2。R-MiFRK1 和T-MiFRK1 的ORF 均 为1005 bp,编码334个氨基酸,R-MiFRK2和T-MiFRK2的ORF 均为990 bp,编码329 个氨基酸。利用软件DNAMAN 8 对2 个品种的MiFRK1 和MiFRK2 氨基酸序列对比分析。根据图4 可知,R-MiFRK1 和TMiFRK1 氨基酸的相似度为100%,没有差异;R-Mi-FRK2 与T-MiFRK2 的氨基酸对比的相似度为97.87%,表示二者的氨基酸序列存在差异,差异位置为第33、87、139、252、277、293和317个氨基酸。

图4 MiFRK 编码的氨基酸序列对比
Fig.4 Amino acid sequence comparison encoded by MiFRK genes
2.3 杧果MiFRK编码氨基酸的生物信息学分析
2.3.1 杧果MiFRK 编码氨基酸酸理化性质分析利用ProtParam tool(http://web.expasy.org/protparam/)计算氨基酸理化参数,包括蛋白质的分子质量、理论等电点、不稳定系数、脂肪族氨基酸指数和平均疏水性指数(Grand average of hydropathicity,GRAVY)等。分析发现(表2),R-MiFRK1、T-MiFRK1、R-Mi-FRK2和T-MiFRK2的分子质量分别为35.79、35.79、35.05 和35.11 ku;等电点分别为5.62、5.62、5.27 和5.19;蛋白不稳定系数分别为30.55、30.55、18.10 和17.35,均为稳定性蛋白;脂肪族氨基酸指数与蛋白质的热稳定性相关,R-MiFRK1、T-MiFRK1、R-Mi-FRK2 和T-MiFRK2 蛋白的脂肪族氨基酸指数分别为94.97、94.97、100.88 和100.88,热稳定性较高;RMiFRK1、T-MiFRK1、R-MiFRK2 和T-MiFRK2 蛋白的分别为0.057、0.057、0.122和0.114,均为疏水性蛋白。利用Cell-PLoc 2.0 进行MiFRK 蛋白亚细胞定位预测,发现R-MiFRK1 和T-MiFRK1 可能定位于叶绿体和细胞质,R-MiFRK2可能定位于叶绿体,TMiFRK2 可能定位于叶绿体和线粒体。利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0/)工具对蛋白进行跨膜区结构预测,R-MiFRK、TMiFRK1、R-MiFRK2 和T-MiFRK2 均不具有跨膜区,表示所编码的蛋白均不是膜蛋白。
表2 不同杧果品种MiFRK 蛋白的理化性质
Table 2 Physicochemical properties of MiFRK proteins in different species of mango
MiFRK蛋白MiFRK protein R-MiFRK1 T-MiFRK1 R-MiFRK2 T-MiFRK2相对分子质量Molecular weight/ku 35.79 35.79 35.05 35.11理论等电点Theoretical pI 5.62 5.62 5.27 5.19不稳定系数Instability index 30.55 30.55 18.1 17.35脂肪族氨基酸指数Aliphatic index 94.97 94.97 100.88 100.88平均疏水指数Grand average of hydropathicity 0.057 0.057 0.122 0.114
2.3.2 杧果MiFRK蛋白结构域、二级结构和三级结构预测 利用NCBI 中的CD-Search 在线分析杧果MiFRK 蛋白保守结构域,结果(图5)显示2 个品种的MiFRK1 和MiFRK2 结构域相同,R-MiFRK1、TMiFRK1、R-MiFRK2 和T-MiFRK2 具有碳水化合物磷酸果糖激酶家族(PfkB family)的保守功能域,均包含3个底物结合区域、6个ATP结合位点和1个保守结构域PLN02323。推测R-MiFRK1、T-MiFRK1、R-MiFRK2 和T-MiFRK2 蛋白具有保守结构域的功能,属于FRK,对果糖具有高度特异性。

图5 杧果MiFRK 蛋白保守结构域
Fig.5 Conserved Domain of mango MiFRK
蛋白质的二级结构指的是蛋白质中局部存在的规则的结构元件,利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)网站进行氨基酸的二级结构预测。由图6可知,这4 个蛋白序列主要含有α-螺旋、延伸链和无规卷曲。R-MiFRK1 与T-MiFRK1 氨基酸序列中α-螺旋占38.92%;延伸链占20.66%;β-转角占6.29%;无规卷曲占34.13%。R-MiFRK2氨基酸序列中α-螺旋占38.91%;延伸链占19.45%;β-转角占6.69%;无规卷曲占34.95%。T-MiFRK2 氨基酸序列中α-螺旋占38.91%;延伸链占21.58%;β-转角占5.47%;无规卷曲占34.04%。
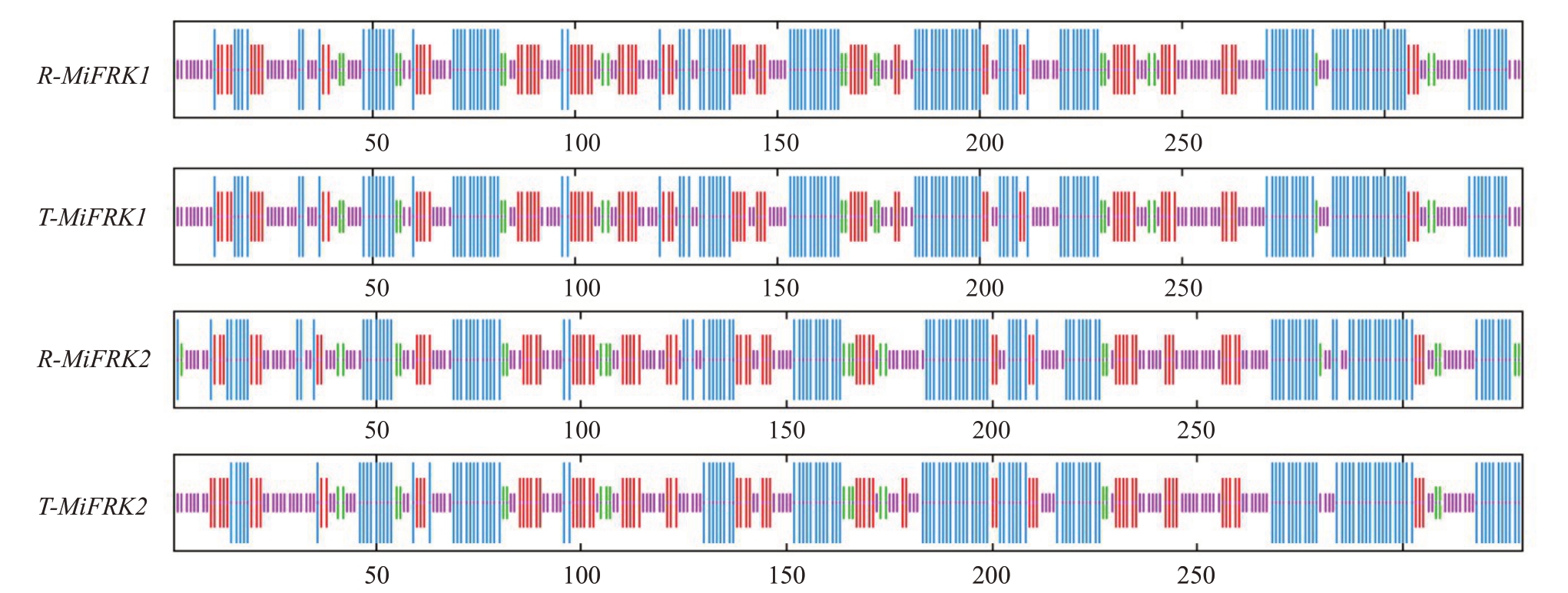
图6 MiFRK 蛋白质二级结构
Fig.6 Secondary structure of MiFRK proteins
蓝色.α-螺旋;红色.延伸链;绿色.β-转角;紫色.随机卷曲。
Blue.α-helix;Red.Extended strand;Green.β-turn;Purple.Random coil.
根据上述氨基酸序列,分别利用SWISS-MODEL(http://swissmodel.expasy.org/)构建蛋白三级模型(图7)。R-MiFRK1 和T-MiFRK1 三级结构一致,而R-MiFRK2 和T-MiFRK2 的三级结构有细微差别,并且R-MiFRK1、T-MiFRK1、R-MiFRK2和T-Mi-FRK2 四个蛋白均是以二聚体的形式存在,这与崔娜等[27]提到的一些植物FRK蛋白是以二聚体形式存在、其功能部位由相对分子质量为30~40 ku 的亚基组成的二聚体相吻合。
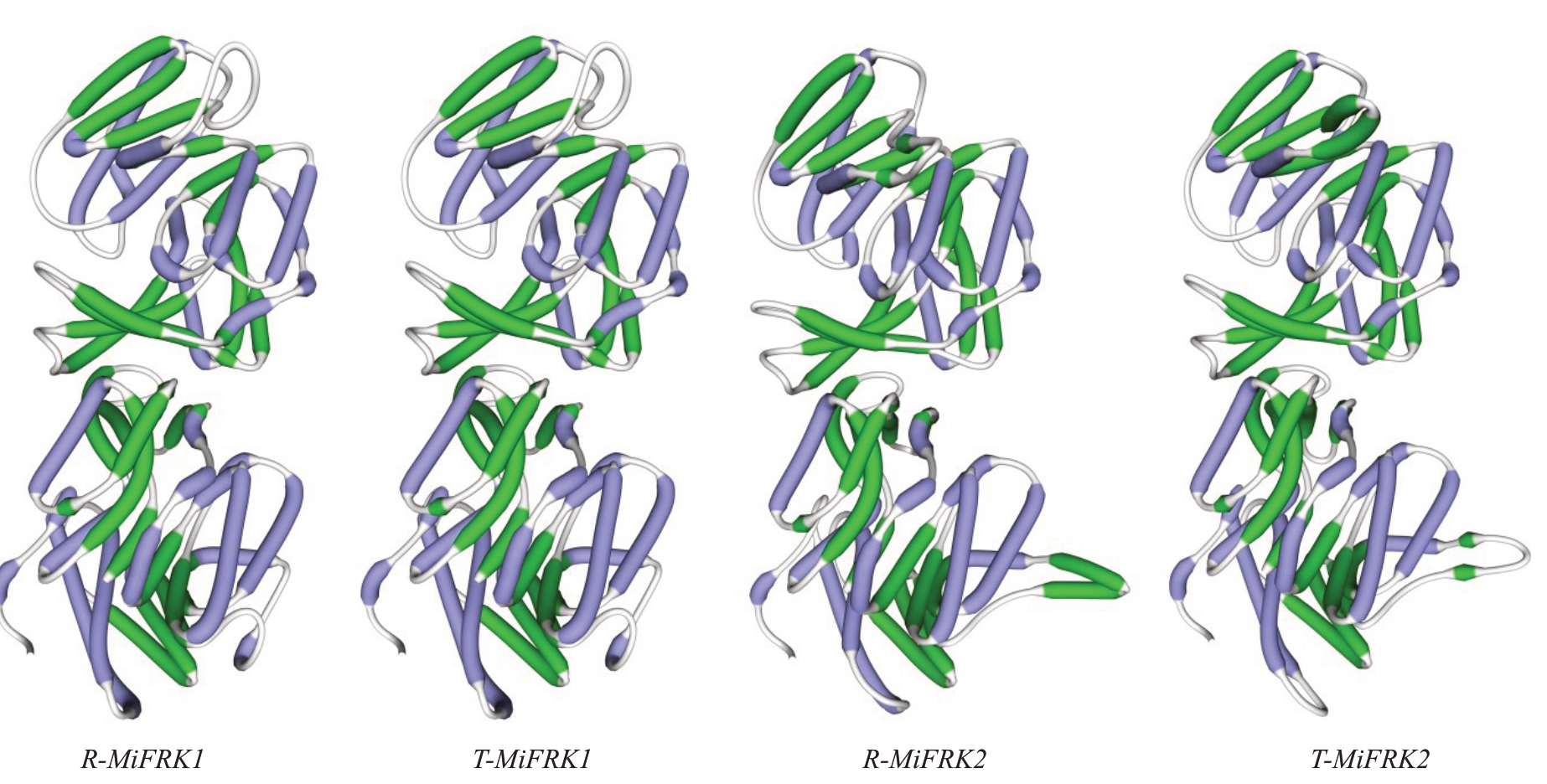
图7 MiFRK 蛋白质三级模型
Fig.7 Tertiary model of MiFRK proteins
2.3.3 杧果FRK 蛋白系统进化树分析 通过下载NCBI 中与MiFRK1 及MiFRK2 氨基酸序列相似度较高的其他植物FRK 蛋白序列,运用MEGA 7构建NJ 进化树,结果(图8)显示,2 个品种的MiFRK1 和MiFRK2分别聚在2个分支,MiFRK1与龙眼DiFRK(AEK21796.1)聚在一起,MiFRK2与美国山核桃Ci-FRK2(XP_042985185.1)、胡 桃 JrFRK2(XP_018839987.1)和 小 果 咖 啡 CaFRK2(XP_027119568.1)等较为相近,聚在一起。而且还发现亲缘关系相近物种的FRK蛋白一般聚在一个分支,表明FRK 基因在进化中较保守,这也与陈毅鸿等[17]研究的FRK 基因家族演化是很保守的结论相一致。而杧果MiFRK1 与MiFRK2 基因可能在果糖代谢过程中具有不同功能。

图8 杧果与其他植物FRK 蛋白系统进化树分析
Fig.8 Phylogentic tree of FRK proteins in mango and other plants
2.4 杧果FRK基因不同果实发育时期表达模式
利用qRT-PCR 检测MiFRK 基因在杧果高糖和低糖2 个品种不同果期中表达情况,结果见图9。MiFRK1 和MiFRK2 基因在不同果实发育时期具有不同的表达模式。MiFRK1在果实从幼果到完熟过程中的相对表达量呈先降低后升高趋势,且Mi-FRK1在热农1号各时期的相对表达量均大于台农1号,并在热农1 号中变化较显著。MiFRK2 在热农1号和台农1 号中均是在幼果中相对表达量高,且在热农1号中的相对表达量明显大于台农1号;接下来在果实膨大期降低,随后,MiFRK2 在热农1 号青熟期的相对表达量上升,在完熟果中下降,而MiFRK2在台农1 号青熟期和完熟期的相对表达量与热农1号相反,青熟期的相对表达量继续下降,在完熟果中表达量上升且高于热农1号。
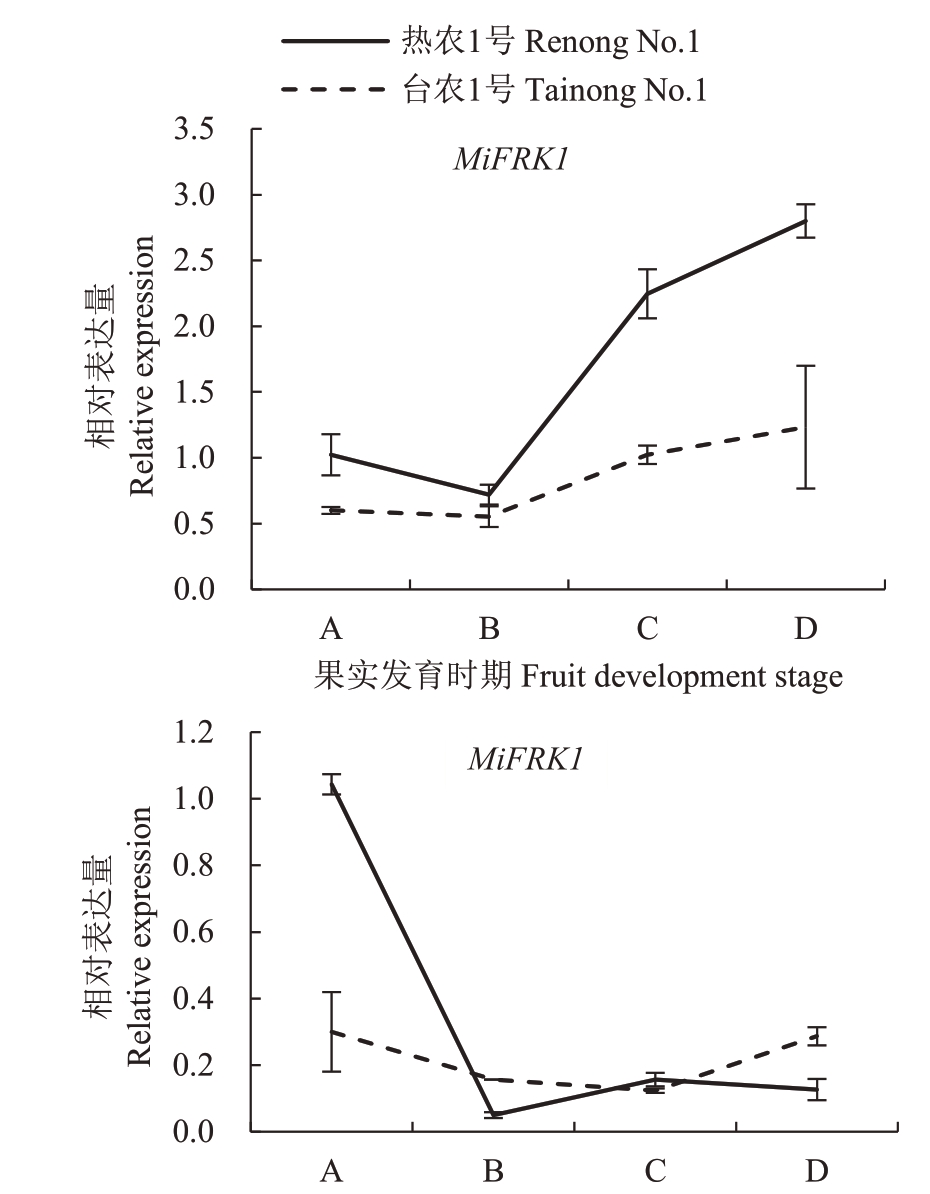
图9 不同果实发育时期MiFRKs 基因的表达模式
Fig.9 Expression pattern of MiFRKs of mango at different fruit development stages
果实发育时期Fruit development stage
2.5 不同果实发育时期果糖含量变化
基于高效液相色谱法对2个品种不同时期的果糖含量进行分析(图10)。从幼果期到果实膨大期,2个品种的果糖含量呈升高趋势,且台农1号中的果糖低于热农1号,随后,台农1号中的果糖含量继续升高,而热农1 号中的果糖含量呈下降趋势。相关性分析发现,热农1号中MiFRK1的相对表达量与果糖含量呈负相关(-0.798),而台农1号中MiFRK1的相对表达量与果糖含量呈显著正相关(0.979*)。2 个品种中MiFRK2 的相对表达量与果糖含量未达到显著相关水平,但是从幼果期到青熟期MiFRK2的相对表达量与果糖含量变化趋势相反,从青熟期到完熟期的后熟过程中变化趋势一致。
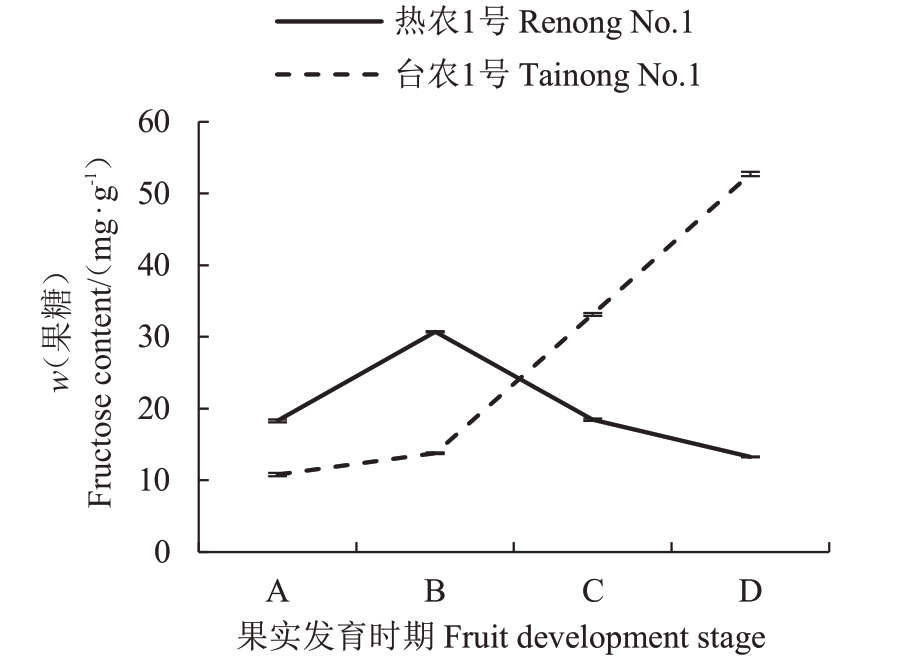
图10 不同果实发育时期果糖含量
Fig.10 Fructose content of mango during fruit ripening
3 讨 论
为深入分析关键MiFRK 基因在高糖和低糖杧果品种中的差异,笔者对筛选的2 个MiFRK 基因MiFRK1 和MiFRK2 在高糖和低糖2 个品种中的基因结构、蛋白性质及结构和表达模式差异进行了分析。研究发现,2 个品种MiFRK1 基因序列一致,所编码的氨基酸一致。对启动子区序列进行分析发现,启动子区除典型的TATA-box 和CAAT-box 核心启动子元件外,均包含ABRE、CAT-box、MYC、Pbox 和TCA-element 元件,说明杧果MiFRK1 的表达受脱落酸、赤霉素和水杨酸的调控,同时与缺水、抗脱落酸及抗冻响应有关。在其他果树中也有报道脱落酸[28]、赤霉素[29]、水杨酸[30]和干旱[31]均与果实的糖分积累有关。MiFRK2 基因序列在2 个品种间有多个差异位点,致使R-MiFRK2与T-MiFRK2所编码的氨基酸相似度仅为97.87%,推测MiFRK2 在2 个杧果品种糖代谢调控中的作用有差异。
生物信息学分析发现R-MiFRK1、T-MiFRK1、R-MiFRK2 和T-MiFRK2 的蛋白分子质量在35.05~35.79 ku 之间,等电点为5.19~5.62,与番茄[13]、马铃薯[10]和枸杞[24]等基本一致,并处在Pego等[8]描述的植物FRK 单体分子质量范围34~37 ku 内。进一步分析发现这4 个MiFRK 均为热稳定性较高的稳定性蛋白,而且是不含跨膜结构的疏水性蛋白,这与枸杞LbFRK7[24]以及草莓FaFRK3[22]等FRK蛋白一致。
利 用Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)进行MiFRK蛋白亚细胞定位预测,发现R-MiFRK1 和T-MiFRK1 定位于叶绿体和细胞质,R-MiFRK2 定位于叶绿体,T-MiFRK2 定位于叶绿体和线粒体。而有学者已经证明番茄Sl-FRK3(Solyc02g091490)定位于叶绿体[14],但在拟南芥中,Gilkerson 等[32]鉴定并命名了7 个FRK 基因(At5g51830、At2g31390、At1g66430、At4g10260、At1g06020、At1g06030 和 At3g59480),其 中At1g66430(AtFRK3)定位于质体,其余6个为细胞质FRK。说明同一植物不同FRK 可能作用于不同位置。杧果MiFRK1可能在叶绿体和细胞质均发挥作用,而R-MiFRK2 主要作用于叶绿体,T-MiFRK2 可能同时作用于叶绿体和线粒体。
FRK 在果糖代谢中起着关键作用,表达模式分析发现,MiFRK1 在2 个品种幼果期相对表达量低,而在青熟果和完熟果中具有较高的相对表达量,这与苹果MdFK1[25]的表达模式一致,且在热农1 号中的相对表达量高于台农1号,相关性分析发现,热农1 号中MiFRK1 的相对表达量与果糖含量呈负相关(-0.798),而台农1号中MiFRK1的相对表达量与果糖呈显著正相关(0.979*),说明MiFRK1在2个品种果糖差异中起到了重要作用。MiFRK2的表达模式恰恰相反,在热农1 号幼果期相对表达量高于成熟果,这与枇杷EjFRK[20]、海巴戟McFRK2[21]、柑橘Cu-FRK1 和Cufrk2[18]、红颜草莓FaFRK3 基因[22]、杨梅MrFPK2[23]、苹果MdFK2、MdFK3和MdFK4[25]的表达模式一样,而且从青熟到完熟呈下降趋势。但是笔者发现MiFRK2 在台农1 号不同果期相对表达量变化较小,从幼果期到青熟期呈下降趋势,后熟过程中表达量升高。而且从幼果期到青熟期,2 个品种中MiFRK2的相对表达量与果糖含量的相对表达量和果糖含量变化趋势相反,说明在这个果实发育阶段,MiFRK2 可能在杧果果糖降解中发挥一定作用,且其表达水平受到果糖含量的抑制[33,9]。
4 结 论
杧果果糖激酶MiFRK1可能受脱落酸、赤霉素、水杨酸及逆境调控以二聚体的形式在叶绿体和细胞质发挥作用,MiFRK2在2个品种中的基因序列及表达模式差异大,可能以二聚体的形式在叶绿体和线粒体发挥作用。MiFRK1 和MiFRK2 均在2 个杧果品种果糖含量差异调控中起到一定作用。
[1] FUCHS Y,PESIS E,ZAUBERMAN G.Changes in amylase activity,starch and sugars contents in mango fruit pulp[J].Scientia Horticulturae,1980,13(2):155-160.
[2] OFFER C E,PATRICK J W. Cellular pathway and hormonal control of short distance transfer in sink regions[J]. Plant Biology,1986,1:295-306.
[3] 齐红岩,李天来,刘海涛,张洁.番茄不同部位中糖含量和相关酶活性的研究[J].园艺学报,2005,32(2):239-243.QI Hongyan,LI Tianlai,LIU Haitao,ZHANG Jie. Studies on carbohydrate content and sucrose-metabolizing enzymes activities in different parts of tomato[J]. Acta Horticulturae Sinica,2005,32(2):239-243.
[4] 崔娜,李天来,赵聚勇.外源生长素PCPA 对番茄果实蔗糖代谢的影响[J].北方园艺,2008(5):8-12.CUI Na,LI Tianlai,ZHAO Juyong. Effects on sucrose metabolism of tomato fruit by PCPA treatment[J]. Northern Horticulture,2008(5):8-12.
[5] LI L,WU H X,MA X W,XU W T,LIANG Q Z,ZHAN R L,WANG S B.Transcriptional mechanism of differential sugar accumulation in pulp of two contrasting mango (Mangifera indica L.)cultivars[J].Genomics,2020,112(6):4505-4515.
[6] 姚改芳,张绍铃,曹玉芬,刘军,吴俊,袁江,张虎平,肖长城.不同栽培种梨果实中可溶性糖组分及含量特征[J].中国农业科学,2010,43(20):4229-4237.YAO Gaifang,ZHANG Shaoling,CAO Yufen,LIU Jun,WU Jun,YUAN Jiang,ZHANG Huping,XIAO Changcheng. Characteristics of components and contents of soluble sugars in pear fruits from different species[J]. Scientia Agricultura Sinica,2010,43(20):4229-4237.
[7] GRANOT D.Role of tomato hexose kinases[J].Functional Plant Biology,2007,34(6):564-570.
[8] PEGO J V,SMEEKENS S. Plant fructokinases:A sweet family get-together[J].Trends in Plant Science,2000,5(12):531-536.
[9] GONZALI S,PISTELLI L,DE BELLIS L,ALPI A. Characterization of two Arabidopsis thaliana fructokinase[J]. Plant Science,2001,160(6):1107-1114.
[10] SMITH S B,TAYLOR M A,BURCH L R,DAVIES H V.Primary structure and characterization of a cDNA clone of fructokinase from potato (Solanum tuberosum L. cv. Record)[J]. Plant Physiology,1993,102(3):1043-1043.
[11] TAYLOR M A,ROSS H A,GARDNER A,DAVIES H V.Characterisation of a cDNA encoding fructokinase from potato(Solanum tuberosum L.)[J]. Journal of Plant Physiology,1995,145(3):253-256.
[12] KANAYAMA Y,DAI N,GRANOT D,PETREIKOV M,SCHAFFER A,BENNETT A B. Divergent fructokinase genes are differentially expressed in tomato[J]. Plant Physiology,1997,113(4):1379-1384.
[13] 王卫平,崔娜,于志海,白丽萍,李天来.番茄果实果糖激酶基因的克隆及其表达分析[J].华北农学报,2011,26(3):11-15.WANG Weiping,CUI Na,YU Zhihai,BAI Liping,LI Tianlai.Cloning and expression analysis of fructokinase gene (FRK)from tomato fruit[J].Acta Agriculturae Boreali-Sinica,2011,26(3):11-15.
[14] GERMAN M A,ASHER I,PETREIKOV M,DAI N,SCHAFFER A A,GRANOT D. Cloning,expression and characterization of LeFRK3,the fourth tomato (Lycopersicon esculentum Mill.) gene encoding fructokinase[J]. Plant Science,2004,166(2):285-291.
[15] JIANG H W,DIAN W M,LIU F Y,WU P.Isolation and characterization of two fructokinase cDNA clones from rice[J]. Phytochemistry,2003,62(1):47-52.
[16] HOEPFNER S W,BOTHA F C. Expression of fructokinase isoforms in the sugarcane culm[J]. Plant Physiology and Biochemisty,2003,41(8):741-747.
[17] 陈毅鸿,张积森.植物果糖激酶基因家族演化及其功能[J].分子植物育种,2016,14(2):359-369.CHEN Yihong,ZHANG Jisen.A review for gene evolution and functional study in plant fructokinase[J].Molecular Plant Breeding,2016,14(2):359-369.
[18] QIN Q P,ZHANG S L,CHEN J W,XIE M,JIN Y F,CHEN K S,SYED A.Isolation and expression analysis of fructokinase genes from citrus[J].Acta Botanica Sinica,2004,46(12):1408-1415.
[19] YAO Y,GENG M T,WU X H,SUN C,WANG Y L,CHEN X,SHANG L,LU X H,LI Z,LI R M,FU S P,DUAN R J,LIU J,HU X W,GUO J C. Identification,expression,and functional analysis of the fructokinase gene family in Cassava[J]. International Journal of Molecular Sciences,2017,18(11):2398.
[20] QIN Q P,CUI Y Y,ZHANG L L,LIN F F,LAI Q X. Isolation and induced expression of a fructokinase gene from loquat[J].Russian Journal of Plant Physiology,2014,61(3):289-297.
[21] 王青芬,宫树森,白艳,刘念,王培源,吴田.海巴戟果实发育过程中果糖、果糖激酶及其基因的变化[J].热带亚热带植物学报,2022,30(1):63-69.WANG Qingfen,GONG Shusen,BAI Yan,LIU nian,WANG Peiyuan,WU Tian. Changes in fructose,fructokinase and its gene in Morinda citrifolia during fruit development[J]. Journal of Tropical and Subtropical Botany,2022,30(1):63-69.
[22] 吕文远,张丽勍,高清华,段可.‘红颜’草莓中果糖激酶基因FaFRK3 的克隆与表达分析[J].上海农业学报,2020,36(6):1-5.LÜ Wenyuan,ZHANG Liqing,GAO Qinghua,DUAN Ke.Cloning and expression analysis of fructokinase gene FaFRK3 from‘Benihoppe’strawberry[J]. Acta Agriculturae Shanghai,2020,36(6):1-5.
[23] 陈馨,施丽愉,邵佳蓉,陈伟,郑永华,杨震峰.杨梅果糖激酶基因MrFRK2 的克隆及在成熟期果实中的表达分析[J].园艺学报,2016,43(8):1585-1592.CHEN Xin,SHI Liyu,SHAO Jiarong,CHEN Wei,ZHENG Yonghua,YANG Zhenfeng. Molecular cloning and expression analysis of MrFRK2 in Chinese bayberry during fruit ripening[J].Acta Horticulturae Sinica,2016,43(8):1585-1592.
[24] 赵建华,尹跃,李浩霞,王亚军,李彦龙,安巍.枸杞果糖激酶基因LbFRK7 的克隆及表达分析[J].西北植物学报,2018,38(5):816-822.ZHAO Jianhua,YIN Yue,LI Haoxia,WANG Yajun,LI Yanlong,AN Wei. Cloning and expression analysis of fructokinase gene(LbFRK7)from wolfberry(Lycium barbarum Linn.)[J].Acta Botanica Boreali-Occidentalia Sinica,2018,38(5):816-822.
[25] 刘凤丽.苹果MdFKs 基因的表达分析与原核表达[D].杨凌:西北农林科技大学,2015.LIU Fengli. The expression analysis of apple (Malus domestic)MdFKs genes and prokaryotic expression[D]. Yangling:Northwest A&F University,2015.
[26] 袁晖,韦云,李馨玥,李俊才,王爱德.‘南果梨’及其芽变‘南红梨’果实中糖分积累与相关基因表达差异分析[J].果树学报,2017,34(5):534-540.YUAN Hui,WEI Yun,LI Xinyue,LI Juncai,WANG Aide. Differences in sugar accumulation and the related gene expression in fruit development between‘Nanguo’and its mutant‘Nanhong’pears[J].Journal of Fruit Science,2017,34(5):534-540.
[27] 崔娜,王卫平,林凤,白丽萍,张玉龙.植物果糖激酶的研究进展[J].中国农学通报,2010,26(14):41-47.CUI Na,WANG Weiping,LIN Feng,BAI Liping,ZHANG Yulong. Update on fructokinase in higher plants[J]. Chinese Agricultural Science Bulletin,2010,26(14):41-47.
[28] 王贵元,夏仁学,曾祥国,吴强盛.外源脱落酸和赤霉素对红肉脐橙果肉糖含量的影响[J]. 农业科学与技术(英文版),2014,15(1):47-51.WANG Guiyuan,XIA Renxue,ZENG Xiangguo,WU Qiangsheng. Dynamic changes of sugar concentrations in pulp of‘Cara cara’navel orange (Citrus. sinensis L. Osbeck) after application by exogenous ABA and GA3[J]. Agricultural Science and Technology,2014,15(1):47-51.
[29] 李节法,杨琪,虞秀明,王磊,王世平,许文平,张才喜.赤霉素对梨糖代谢及其关键酶基因表达的影响[J].上海交通大学学报(农业科学版),2015,33(3):21-28.LI Jiefa,YANF Qi,YU Xiuming,WANG Lei,WANG Shiping,XU Wenping,ZHANG Caixi. Influence of cibberellins on sugar mrtabolism and related gene expression in fruit of pear (Pyrus pyrifolia)[J]. Journal of Shanghai Jiaotong University (Agricultural Science),2015,33(3):21-28.
[30] 刘晓峰,李昌亨,穆卫,温鹏飞.水杨酸对赤霞珠葡萄果实内在品质的影响[J].山西农业大学学报(自然科学版),2014,34(3):258-261.LIU Xiaofeng,LI Changheng,MU Wei,WEN Pengfei. Influence of salicylic acid on the internal qualities of grape berry cv.Cabernet Sauvignon[J]. Journal of Shanxi Agricultural University(Natural Science Edition),2014,34(3):258-261.
[31] 龚成宇,王毅,宋海岩,杨科,陶海青,刘俊宏,龚荣高.干旱胁迫对黄果柑果实品质及糖酸代谢酶活性的影响[J].西南农业学报,2021,34(2):272-278.GONG Chengyu,WANG Yi,SONG Haiyan,YANG Ke,TAO Haiqing,LIU Junhong,GONG Ronggao. Effects of drought stress on fruit quality and enzyme activity of glycolic acid metabolism in Huangguogan fruit[J]. Southwest China Journal of Agricultural Sciences,2021,34(2):272-278.
[32] GILKERSON J,PEREZ-RUIZ J M,CHORY J,CALLIS J. The plastid-localized pfkB-type carbohydrate kinases FRUCTOKINASE-LIKE 1 and 2 are essential for growth and development of Arabidopsis thaliana[J]. BMC Plant Biology,2012,12(1):102.
[33] SCHAFFER A A,PETREIKOV M. Sucrose-to-starch metabolism in tomato fruit undergoing transient starch accumulation[J].Plant physiology,1997,113(3):739-746.