桃[Prunus persica(L.)Batsch]属蔷薇科李属,原产于我国西部,是我国仅次于苹果、梨的第三大落叶果树[1]。随着日益增长的市场需求和日趋紧张的土地资源,连作障碍已成为制约我国桃产业可持续发展的重要因素[2-3]。连作障碍又称再植病害,即果园刨除老树栽种新树时,幼树表现出根系发育不良,生长缓慢,植株矮小,抗性降低,甚至整株死亡的现象[2-4]。连作障碍现象由来已久,在苹果、桃和葡萄等多种果树上均有发生[5-8],但是发生成因复杂,不同物种及不同地区间的形成因素也有所差异。大量研究表明引起连作障碍的因素主要包括(1)化感作用(自毒作用);(2)土壤微生物群落结构的变化;(3)土壤理化性质劣变[9-11]。由于化感作用(自毒作用)范围广泛且机制复杂,被认为是导致连作障碍普遍存在的重要因素之一[2-4]。植物化感作用是指植物通过淋溶、挥发、根系分泌和残茬腐解等方式向环境中释放特定的次生物质(化感物质)从而直接或间接影响邻近或下茬同种或不同种植物萌发和生长的效应[12]。当这种效应为抑制作用时,又称为自毒作用,引起自毒作用的物质被称为自毒物质[13-14]。自毒物质种类繁多,主要可分为酚类、萜和类萜、甾族化合物和生物碱等[12]。自毒物质可直接影响植物生长发育,如对羟基苯甲酸可以通过抑制糖基转移酶和呼吸酶活性,破坏DNA 和蛋白质结构,进而抑制植物种子萌发[15]。一定浓度的根皮苷可以降低三羧酸循环中相关酶的活性,导致平邑甜茶根系呼吸速率下降,从而影响根系生长[4]。外源苯甲酸处理可显著降低桃苗的光合作用,抑制幼苗生长[2-3]。
桃是一种典型的生氰植物,其体内含有丰富的生氰糖苷,主要包括苦杏仁苷和野黑樱苷[16-17]。植物中的生氰糖苷类物质并不稳定,当根系受到机械损伤时,细胞中的β-葡萄糖苷酶会水解生氰糖苷进而产生氰化物(CN-)[2,18]。同时,土壤中存在一些微生物可以降解根系残茬中的生氰糖苷而产生CN-[2-3]。CN-是一种剧毒物质,可直接抑制线粒体呼吸电子传递链中细胞色素c 氧化酶的活性,导致细胞呼吸受阻,ATP 合成减少[18]。前人[19-20]研究发现,桃根系及残茬中无毒的生氰糖苷降解所产生的CN-是引起桃连作障碍的主要自毒物质之一。目前有关桃连作障碍的研究多集中于自毒酚酸类物质和土壤微生态等方面,而CN-相关的研究相对较少。鉴于此,笔者测定了桃树土壤及根系中CN-含量,并以毛桃的萌发种子为试材,分析了外源CN-处理后桃根系表型、根系中过氧化氢和丙二醛含量、抗氧化酶活性及相关基因的表达水平、代谢物变化情况等,以期探究桃根系对CN-的生理和代谢响应。研究结果有助于阐明CN-介导的桃连作障碍的发生机制,并将为缓解桃连作障碍提供新思路。
1 材料和方法
1.1 试验材料
土壤材料:2010 年3 月随机选取华中农业大学果树标本园内生长整齐一致的5年生毛桃砧木6株,选取其中3 株移除地上部分,待其完全死亡后,于2011 年3 月在距离死树和活树树干50 cm 的东南西北4个方向,分别挖取3个土层(0~20 cm,20~40 cm,40~60 cm)的土壤,同时取距离粗根(Φ >10 mm)不同水平距离(0~5 cm,5~10 cm,10~15 cm)的土壤。此外,分别于2011、2012 和2013 年5 月采集每株死树与活树0~20 cm土层的根围土。将所有同类型的土壤分别均匀混合,用于CN-含量测定。
植物材料:将死树根系按粗度分为细根(Φ <5 mm)、中根(5 mm ≤Φ ≤10 mm)和粗根(Φ >10 mm),75 ℃烘干后磨成粉末,用于CN-含量的测定。毛桃种子于湿润河沙中4 ℃层积3 个月,待种子露白后,去掉内果皮备用。莴苣种子购买于四川种都高科种业有限公司。
1.2 试验处理
毛桃种子露白后,去掉内果皮备用。设定4 个浓度氰化物(实验室保存的氰化钾,纯度>99.5%)处理:0(对照)、0.25、0.5和1.0 mmol·L-1。处理时先在24 cm×24 cm 的培养皿中放置3 层无菌滤纸,然后每个培养皿中放入10颗生长一致的毛桃种子,在种子上覆盖一层无菌纱布,随后向培养皿中分别加入50 mL 各个浓度的氰化物液体,培养皿放置于25 ℃,70%湿度,光照16 h/黑暗8 h,光照度300µmol·m-2·s-1的培养箱中。5 d 后,统计根系长度和侧根数量;同时将0(对照)和0.5 mmol·L-1氰化物处理的桃根系放入液氮速冻后置于-80 ℃冷冻保存备用。每个处理均设置3次重复。
莴苣种子毒性测试时,先在每个培养皿(Φ =9 cm)中放置2张无菌滤纸,然后加入15 mL浓度为0(对照)和0.5 mmol·L-1的氰化物处理溶液,随后每皿中放入50 颗健壮饱满的莴苣种子。放置于上述培养箱中,每天记录种子萌发数量至第5 天。观察莴苣根系生长情况时,先将种子放至在湿润的无菌滤纸上催芽,待种子萌发后,移至含有0(对照)和0.5 mmol·L-1 CN-的培养皿中生长,10 d 后测定幼苗根系长度和鲜质量。每个处理均设置3次重复。
1.3 试验指标与测定方法
1.3.1 CN-含量测定 土壤和根系中CN-含量使用Spectroquant 氰化物试剂盒(MerckKGaA,德国)进行测定[21]。
1.3.2 形态指标和化感效应敏感指数(ASI)分析用直尺和天平分别测定根系长度和幼苗鲜质量。莴
参照王鸿等[22]的方法,将桃根系长度及侧根数量的数据转化为ASI 以分析氰化物处理的化感强度:ASI=1-C/T(T ≥C)或ASI=T/C-1(T <C),其中C为对照值,T为处理值。当0 ≤ASI <1时,化感物质具有促进作用;当-1 <ASI <0 时,化感物质具有抑制作用。ASI绝对值越大,说明化感效应越强。
1.3.3 根系石蜡切片观察 操作步骤参照吴秀文[23]的方法,略有改动。将桃根尖用一级水洗净,在FAA 固定液中固定24 h,经过脱水、透明、浸蜡、包埋、切片、粘片、脱蜡、复水、番红固绿染色、脱水封片等步骤处理。最后将切片置于荧光显微镜(NIKON ECLIPSE CI,日本)下观察拍照。
1.3.4 过氧化氢(H2O2)、丙二醛(MDA)含量和抗氧化酶活性测定 H2O2 和MDA 含量及过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)活性使用南京建成生物工程公司的相应试剂盒进行测定。取研磨后的样品0.1 g,加入预冷的生理盐水涡旋混匀,随后3500 r·min-1离心10 min,取上清液进行测定,测定方法详见产品说明书。
1.3.5 RNA 提取、cDNA 合成和实时荧光定量PCR(qRT-PCR) 桃根系RNA使用EASY spin Plus植物RNA 快速提取试剂盒(艾德莱,中国)进行提取,提取方法详见产品说明书。使用Nanodrop 2000(Thermo Scientific,美国)测定RNA 浓度,并通过1%琼脂糖凝胶电泳确认RNA 的完整性。取1 µg RNA 通过PrimeScript® RT reagent Kit with gDNA Eraser(TaKaRa,日本)试剂盒用进行cDNA合成,具体操作步骤参见说明书。采用qRT-PCR 进行基因表达量分析,具体操作方法参照张贺[24]。使用桃PpTEF2基因作为内参基因[17],qRT-PCR所用基因序列(表1)来自NCBI(https://www.ncbi.nlm.nih.gov)核酸数据库,引物通过Primer3Plus(http://www.primer3plus.com)设计,基因相对表达水平采用2-ΔΔCt方法计算。
表1 实时荧光定量PCR 引物
Table 1 Primers for qRT-PCR
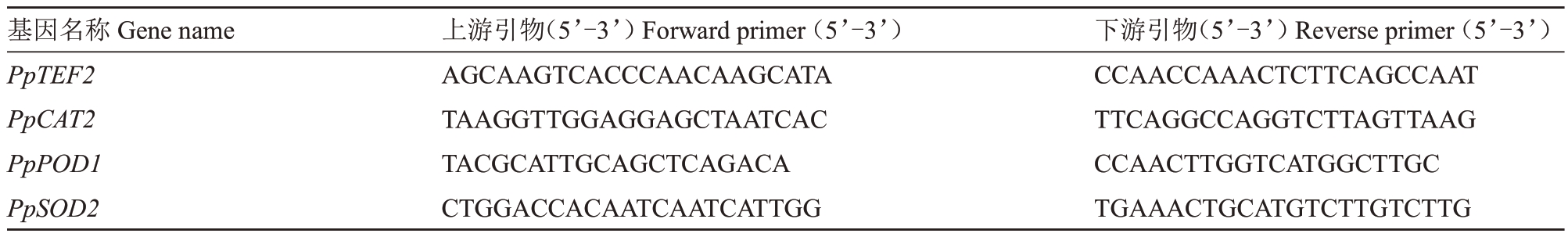
基因名称Gene name PpTEF2 PpCAT2 PpPOD1 PpSOD2上游引物(5’-3’)Forward primer(5’-3’)AGCAAGTCACCCAACAAGCATA TAAGGTTGGAGGAGCTAATCAC TACGCATTGCAGCTCAGACA CTGGACCACAATCAATCATTGG下游引物(5’-3’)Reverse primer(5’-3’)CCAACCAAACTCTTCAGCCAAT TTCAGGCCAGGTCTTAGTTAAG CCAACTTGGTCATGGCTTGC TGAAACTGCATGTCTTGTCTTG
1.3.6 根系代谢物提取和测定 参照张丽[25]的方法,稍作修改。取液氮充分研磨的桃根系组织0.3 g,加入2.7 mL 预冷的甲醇(国药集团,中国),混匀后加入300 µL 核糖醇内标(0.2 mg·mL-1;Sigma,美国),充分振荡混匀。随后,将样品置于超声波清洗仪中4 ℃处理15 min,70 ℃水浴15 min,-20 ℃冰箱放置6 h,取出后4 ℃,5000 r·min-1离心15 min,吸取上清100 µL 于1.5 mL 离心管中,30 ℃真空浓缩干燥后加入80 µL BSTFA + 1% TMSC(Sigma,美国)。随后,将离心管置于真空干燥箱中,30 ℃孵育30 min,最后用0.22µmol·L-1微孔滤膜过滤样品,以待上样。气相色谱-质谱联用仪(GC-MS)(Thermo Scientific,美国)采用DB-5MS 毛细管柱(30 m ×0.25 mm × 0.25 µm;Agilent,美国),进样口温度:230℃,传输线温度:250 ℃。氦气(>99.999%)作为载气,流速:1.2 mL·min-1。梯度程序:100 ℃,1 min,以3 ℃·min-1升温至184 ℃,0.5 ℃·min-1升温至190 ℃保持1 min。进样方式:GC 自动进样器进样,进样量:1µL,扫描范围为m/z 45~600 amu。
1.4 数据处理与统计分析
应用GraphPad Prism 8 进行数据统计和作图,数据以平均值±标准误表示。使用t检验分析2个样本之间的显著性,*和**分别表示p <0.05 和p <0.01 显著性水平。多样本间进行单因素方差分析(One-way ANOVA),并采用Tukey 法进行差异显著性检验,不同字母表示p <0.05显著性水平。
2 结果与分析
2.1 桃树土壤和根系中的CN-含量
如图1 所示,CN-主要分布在0~40 cm 土层中,且死树土壤中CN-含量是活树土壤中的2.20倍。土壤中CN-主要存在于根系附近,距离根系越近,CN-含量越高。死树距粗根0~5 cm的土壤中CN-含量是活树的2.27 倍。随着时间推移,土壤中CN-含量呈现上升趋势。相比于2011年,2013年时死树和活树0~20 cm 土层的根围土中CN-含量分别增加了18.68%和10.78%。死树细根(Φ <5 mm)中CN-含量显著高于中根(5 mm ≤Φ ≤10 mm)和粗根(Φ >10 mm)。
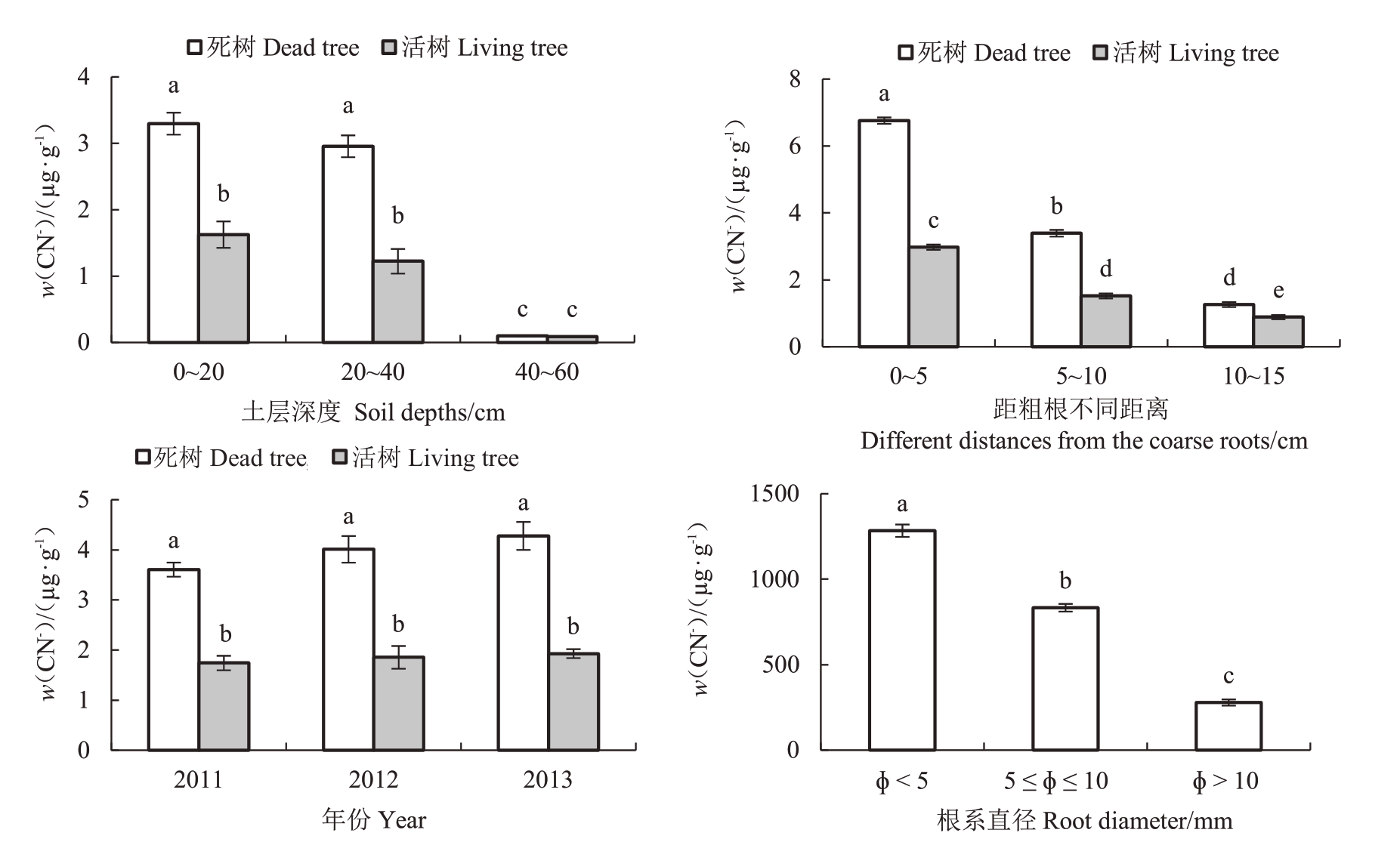
图1 桃树土壤和根系中的CN-含量
Fig.1 CN-contents in soil and roots of peach trees
不同小写字母表示p <0.05 水平下差异显著。下同。
Different small letters indicate a significant statistical difference at p <0.05.The same below.
2.2 不同浓度CN-处理对桃根系生长的影响
如图2所示,低浓度CN-(0.25 mmol·L-1)促进桃根系生长,随着CN-处理浓度升高,根系生长受到显著抑制。与对照相比,0.5 mmol·L-1 CN-处理下,根系长度和侧根数量分别显著减少了67.54%和48.57%;1.0 mmol·L-1 CN-处理下,桃根系受到严重破坏,根尖坏死。采用石蜡切片进一步观察CN-处理引起的根尖细胞结构的变化。根尖组织的横切和纵切图显示:0.5 mmol·L-1 CN-处理后,桃根尖表皮细胞排列松散,部分细胞破裂脱落,细胞间隙变大。CN-处理对桃根系生长具有强烈的化感效应。根长度的ASI 范围为-0.92~0.34,侧根数量的ASI 范围为-0.73~0.25。0.25 mmol·L-1 CN-处理下ASI 大于0,为促进作用;0.5 和1.0 mmol·L-1 CN-处理下,ASI小于0,为抑制作用。
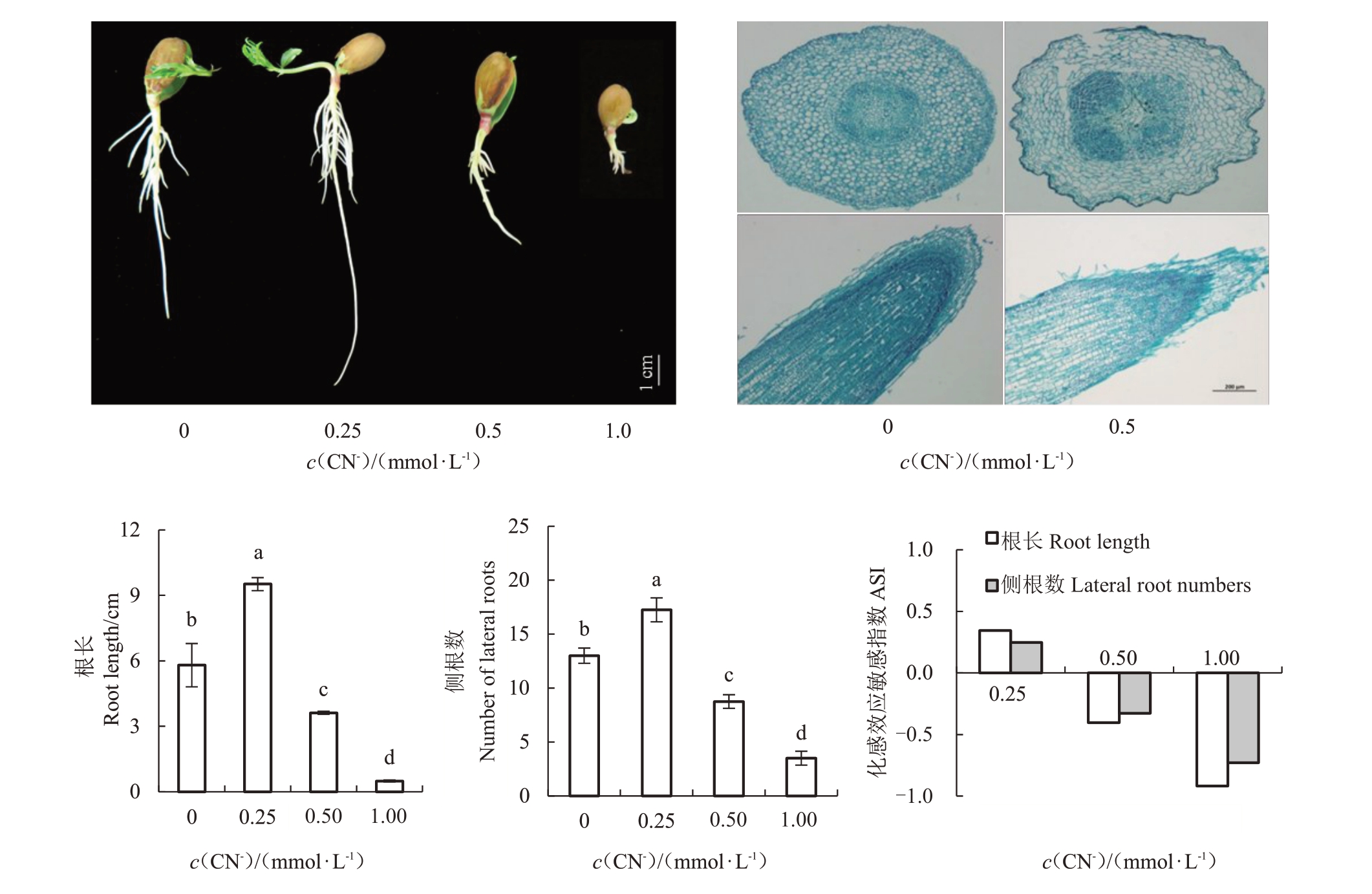
图2 外源CN-处理对桃根系生长的影响
Fig.2 Effects of exogenous CN-treatment on peach root growth
2.3 CN-处理对莴苣种子萌发的影响
莴苣是国际上通用的化感模式植物,由于其具有对化感物质敏感、生长快而整齐等特点,因此经常被用来检测目标物质是否具有化感效应[2]。如图3所示,0.5 mmol·L-1 CN-处理显著抑制莴苣种子萌发。第5 天时,0.5 mmol·L-1 CN-处理下种子发芽率相比于对照显著降低了13.39%。此外,0.5 mmol·L-1 CN-处理抑制莴苣根系生长,降低生物量。处理后10 d,莴苣种子的根系长度和鲜质量相比于对照显著减少了89.94%和53.52%。
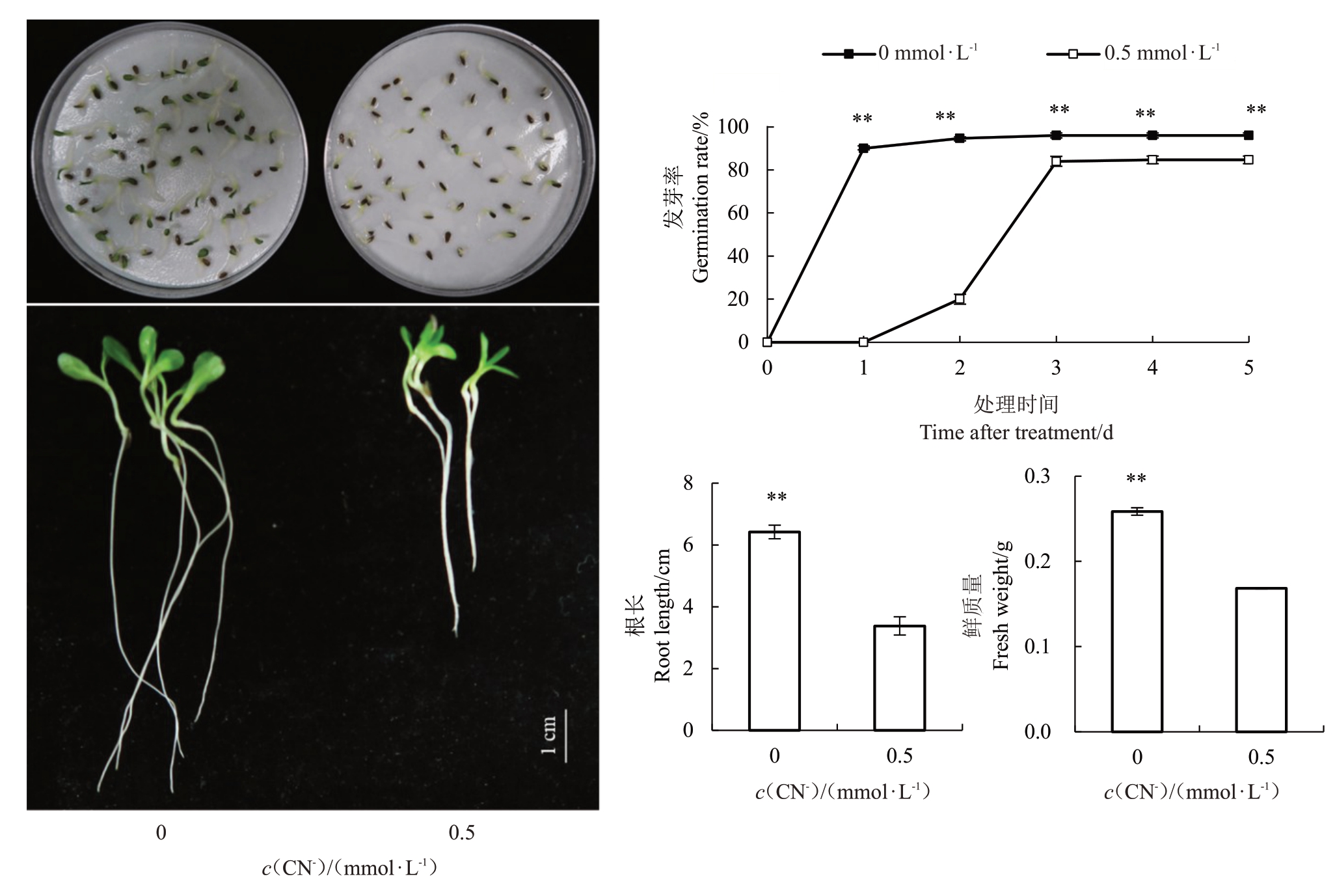
图3 外源CN-处理对莴苣种子萌发的影响
Fig.3 Effects of exogenous CN-treatment on seed germination of lettuce
*和**分别表示p<0.05 和p <0.01 水平下差异显著。下同。
Asterisks indicate a significant difference at*p <0.05 and**p <0.01.The same below.
2.4 CN-处理对桃根系中H2O2和MDA含量的影响
植物在自毒胁迫下会产生大量活性氧(ROS),ROS过度积累将加剧细胞氧化应激,并有可能对脂类、蛋白质、核酸产生氧化损伤,从而严重影响植物体正常的生命活动[26]。如图4所示,经0.5 mmol·L-1 CN-处理后,桃根系中H2O2和MDA含量相比于对照显著增加了63.13%和32.84%。
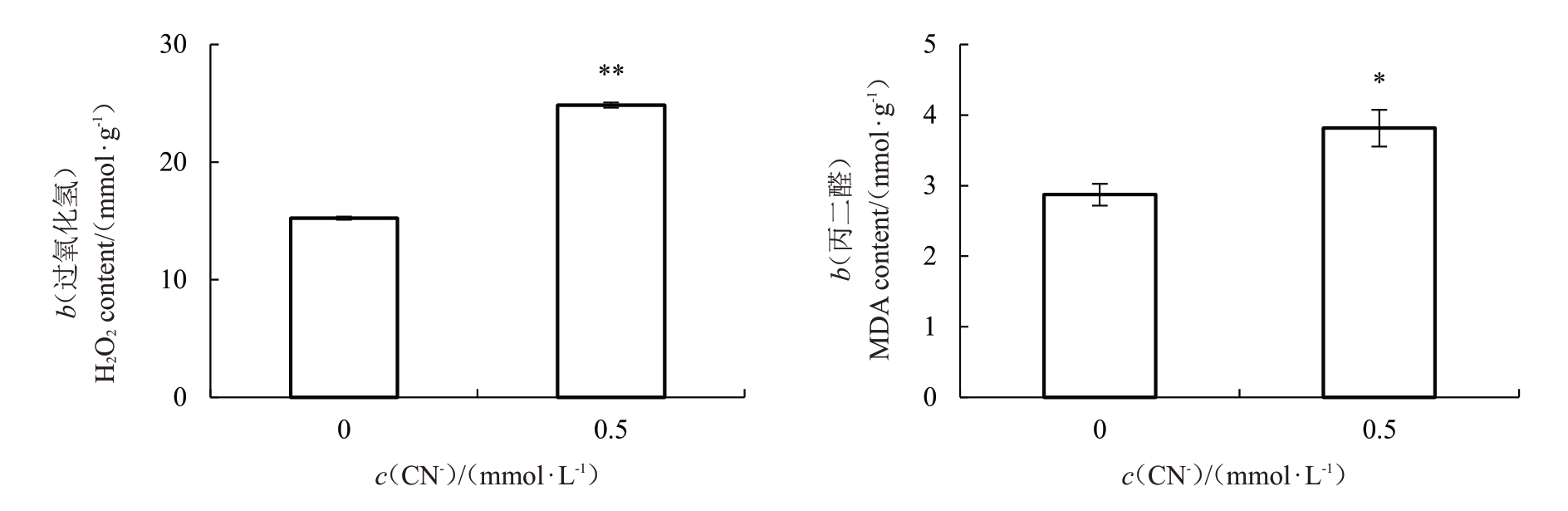
图4 外源CN-处理对桃根系中过氧化氢和丙二醛含量的影响
Fig.4 Effects of exogenous CN-treatment on the contents of H2O2 and MDA in peach roots
2.5 CN-处理对桃根系抗氧化酶活性及相关基因表达的影响
在长期的进化过程中,植物体内演变出了两种主要的ROS清除途径。一种是酶促系统,另一种是非酶促系统[24]。酶促系统中主要包括一些抗氧化酶类,如SOD、CAT 和POD 等[27]。如图5 所示,氰化物处理后,桃根系中抗氧化酶活性升高。第5天时,与对照相比,0.5 mmol·L-1 CN-处理下桃根系中CAT、POD 和SOD 活性分别显著升高了9.49、3.06 和0.78倍。进一步使用qRT-PCR 检测根系中抗氧化酶活性相关基因的表达情况。相比于对照,PpCAT2、Pp-POD1和PpSOD2的表达量在处理1、3和5 d均显著升高。
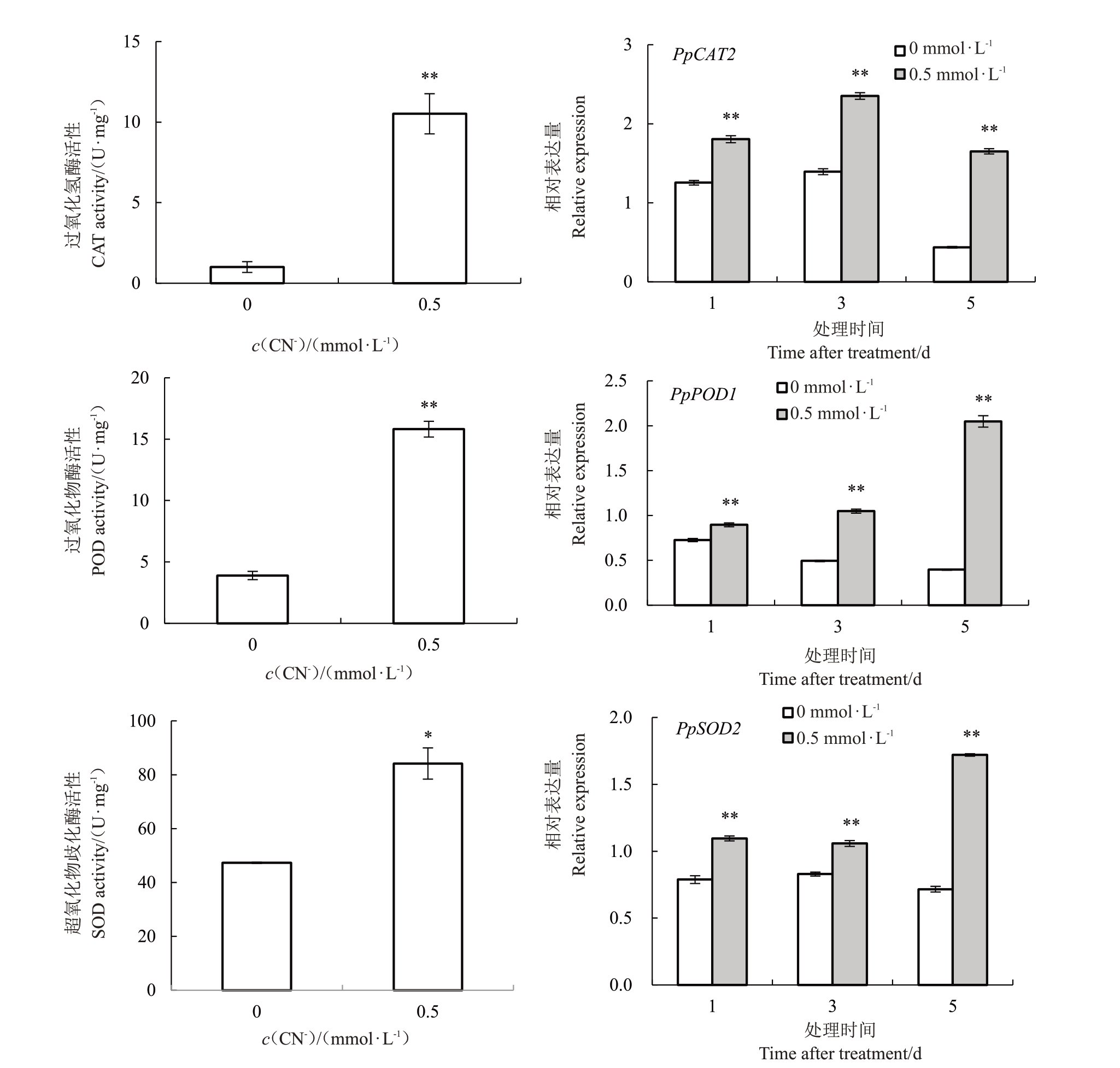
图5 外源CN-处理对桃根系抗氧化酶活性及相关基因表达量的影响
Fig.5 Effects of exogenous CN-treatment on the antioxidant enzymes activity and their encoding genes expression in peach roots
2.6 CN-处理对桃根系代谢物的影响
为进一步了解桃对外源氰化物的响应机制,采用GC-MS 方法分析了0(对照)和0.5 mmol·L-1 CN-处理下桃根系中代谢物的变化情况。如图6 所示,共鉴定出25 个差异代谢物,其中有15 个代谢物上调,10 个代谢物下调。差异代谢物主要包括氨基酸、碳水化合物、脂肪酸和有机酸等。从图7可以看出,氰化物处理后,根系中大部分氨基酸含量显著升高,其中包括甘氨酸、丝氨酸、丙氨酸、缬氨酸、苏氨酸、天冬酰胺、γ-氨基丁酸(GABA)、谷氨酸和脯氨酸。此外,CN-处理的根系中葡萄糖、果糖、木糖和棕榈酸含量显著降低。参与三羧酸循环的柠檬酸、琥珀酸和苹果酸含量分别比对照显著增加了4.39、2.44和1.33倍。
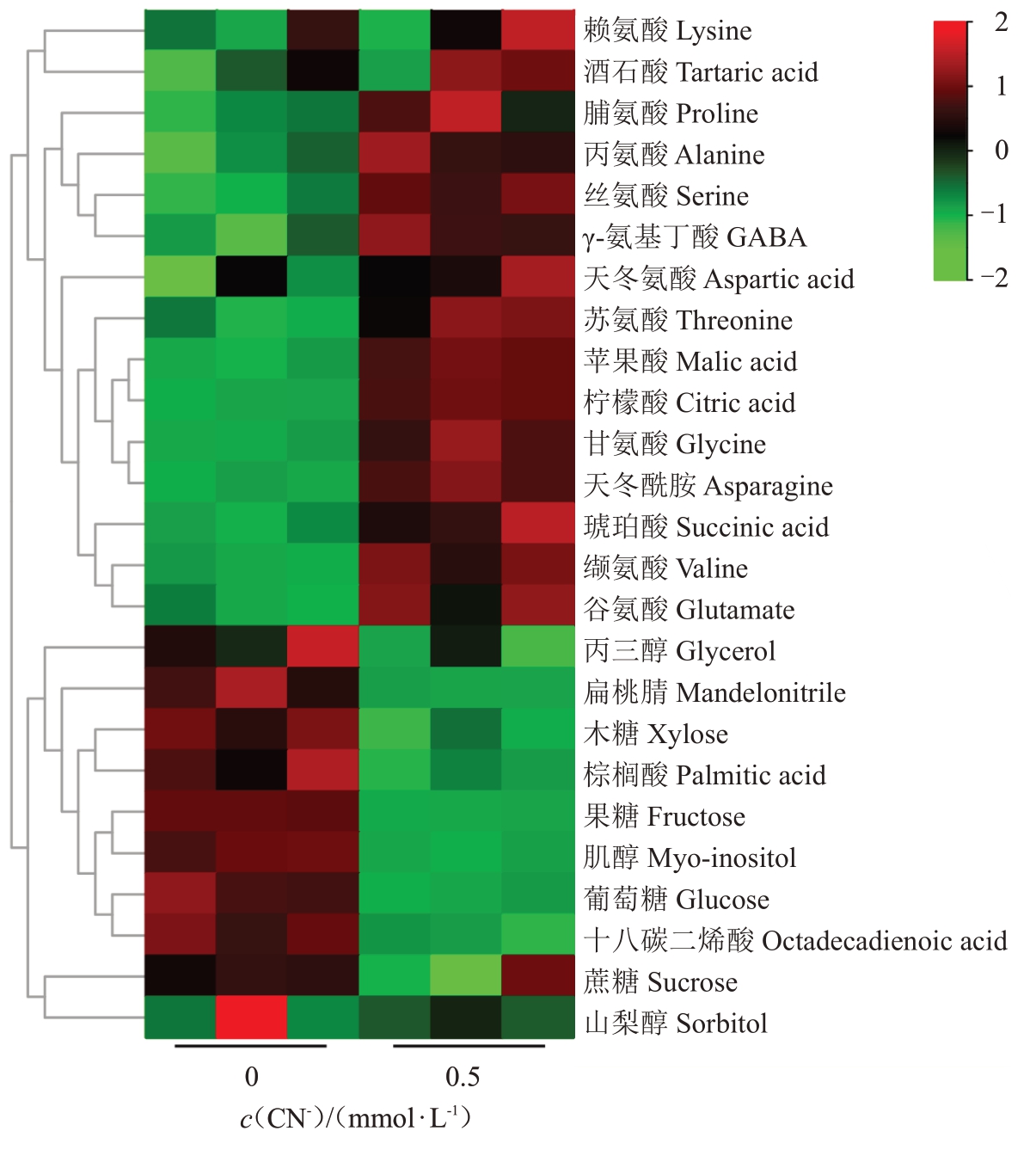
图6 外源CN-处理对桃根系代谢物的影响
Fig.6 Effects of exogenous CN-treatment on metabolites of peach roots
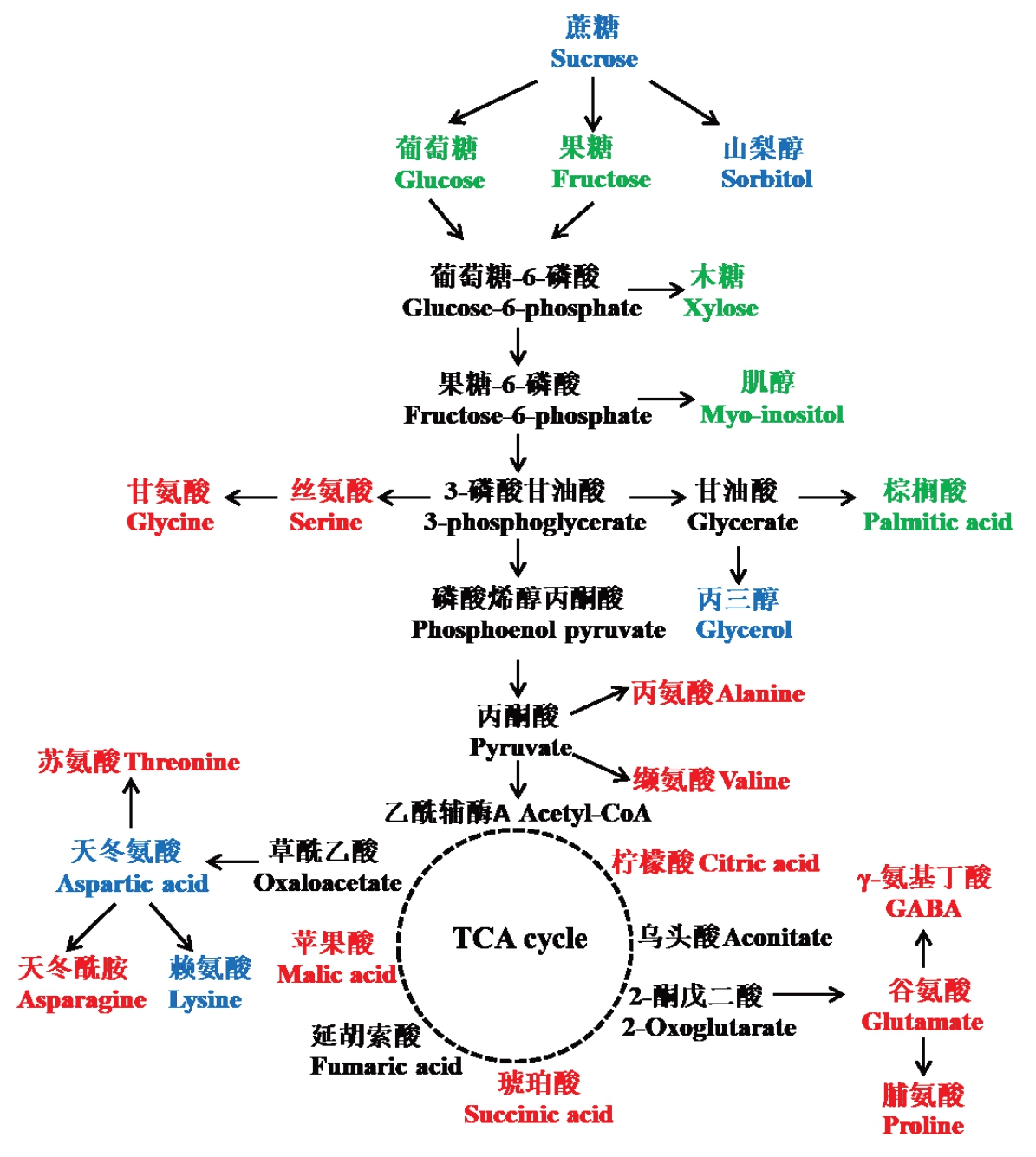
图7 外源CN-处理下桃根系代谢通路图
Fig.7 Schematic diagram of proposed metabolic pathways in the CN--treated peach roots
红色和绿色代表显著增加或减少的代谢物;蓝色代表无显著变化的代谢物;黑色代表没有检测到的代谢物。
Red and green colors represent significantly increased or decreased metabolites;blue represents no significantly changed metabolites;and black denotes undetected metabolites.
3 讨 论
土壤中自毒物质积累是导致连作障碍的主要原因之一,而植物根系分泌物和残根腐解物是土壤中自毒物质的主要来源[2]。前人[28]研究表明,土壤中自毒物质分布具有空间异质性,距离根系越远,黑胡桃木土壤中胡桃醌的含量越低。桃是浅根性果树,根系主要分布于地下40 cm 以上土层[29]。本研究中发现,CN-主要存在于0~40 cm 土层中,且随着离根系距离的增加,土壤中CN-含量逐渐减少,说明土壤中CN-主要来源于桃树根系,并会受到根系分布情况的影响。死树土壤中CN-含量显著高于活树,说明树体死亡后,土壤中的残根腐解将释放大量CN-。在笔者的其他研究中[2-3],土壤中CN-含量随年份而增加,符合前人所述自毒物质具有时间累积效应。此外,死树细根中CN-含量显著高于中根和粗根,推测可能是由于细根中韧皮部占比高,而CN-主要分布于根系韧皮部[14]。
根系是植物直接与土壤接触的部位,也是植物抵抗自毒作用的第一道防线[26]。肉桂酸是黄瓜根系分泌的主要自毒物质之一,李娟起[30]研究发现,肉桂酸处理显著降低黄瓜根系生长速率,减少侧根数量。苹果连作栽培显著影响植株根系构型,降低根系活力[31]。一定浓度的苯甲酸显著抑制桃种子萌发后的根系生长,导致根尖表皮皱缩,组织细胞破裂[3]。有趣的是,自毒物质对植物根系的作用机制与自毒物质的浓度密切相关,低浓度促进和高浓度抑制的现象普遍存在[9]。本研究中,低浓度CN-(0.25 mmol·L-1)处理促进桃根系生长,随着处理浓度升高又表现出显著的抑制作用。0.5 mmol·L-1 CN-处理下,桃根系长度和侧根数量明显降低,石蜡切片结果显示根尖细胞受损严重。化感效应敏感指数表明CN-处理具有“低浓度促进生长,高浓度抑制生长”的特点。自毒物质也可显著抑制植物种子萌发。Zhang等[32]研究发现,甜瓜植株水提物显著降低甜瓜种子的发芽指数,并抑制种子萌发后生长。500 mg·L-1苯甲酸处理莴苣种子3 d后种子发芽率、发芽指数和活力指数接近于0[33]。本研究中用莴苣种子测试了外源CN-处理对种子萌发的影响,结果显示0.5 mmol·L-1CN-可显著降低种子萌发率,并抑制萌发后的根系生长和幼苗生物量。
已有研究表明,根系中ROS过度积累而引发的氧化损伤是导致自毒作用的一个重要因素[26,34]。甜瓜根系分泌物可以诱导根系中ROS 过度积累和脂质过氧化,从而抑制幼苗生长[26]。自毒胁迫后,莴苣根系中H2O2、超氧阴离子及MDA 含量显著增加[35]。本研究中,0.5 mmol·L-1CN-处理显著增加桃根系中H2O2和MDA含量,表明CN-处理会扰乱根系中ROS代谢,诱发膜脂过氧化。在不利环境下,植物可以通过调节自身抗氧化酶活性和抗氧化剂含量等方式来调节体内的ROS代谢[24,36]。孙鑫等[37]研究发现,对羟基苯甲酸处理后葡萄根系中SOD 活性呈现出先上升后下降的趋势。肉桂酸处理下黄瓜叶片中抗氧化酶SOD、POD和CAT的活性明显升高[38]。自毒胁迫下,甜瓜中CmFe-SOD基因表达量显著上升,进而引起SOD活性变化[36]。本研究中,0.5 mmol·L-1CN-处理显著增加了根系中CAT、POD 和SOD 的活性,qRT-PCR结果显示这3种抗氧化酶相应基因的表达量均显著升高,表明CN-在诱导ROS 大量产生的同时激活了桃根系内抗氧化系统,以增强ROS 清除能力。长期自毒胁迫下,植物根系生理生化进程严重受阻,细胞内抗氧化系统被破坏[37]。有关长期CN-处理后植物体内抗氧化系统的情况仍需要进一步研究。
逆境胁迫下植物体内代谢物的重塑将在很大程度上反映植物对逆境条件的响应和防御机制[39]。氨基酸在植物生长发育及逆境适应中发挥重要的作用[40]。前人[41]研究发现,缺硼显著提高了枳壳砧木中甘氨酸、天冬酰胺、GABA、脯氨酸、缬氨酸等氨基酸含量。中度和重度碱胁迫显著改变了狗牙根中代谢物水平,其中氨基酸(如缬氨酸、甘氨酸、脯氨酸和天冬酰胺)的含量均显著增加[40]。在本研究中,0.5 mmol·L-1CN-处理显著增加了包括甘氨酸、丝氨酸、缬氨酸、天冬酰胺、GABA和脯氨酸等大部分氨基酸的含量。其中脯氨酸作为一种重要的渗透调节物质,具有维持细胞膜完整性的功能,而GABA 是胁迫条件下的标志物,其含量增加与细胞中ROS过量积累密切相关[41]。因此,氨基酸水平的显著变化一方面是桃根系对CN-处理的一种适应性反应,有利于降低CN-的毒害作用;另一方面表明CN-处理显著干扰了根系中的氮代谢途径。此外,有研究报道[42],根系分泌物会影响受体植物中碳水化合物的水平。在笔者的研究中,经CN-处理后,桃根系中许多糖和有机酸含量发生显著变化,这表明CN-显著干扰了根系中的碳代谢途径。氨基酸和碳水化合物是植物生命周期中的重要代谢产物,也是维持植物体内氮和碳代谢的基础[40]。在CN-处理后,桃根系内氨基酸和碳水化合物水平的显著变化,说明根系中氮和碳代谢遭遇了明显干扰,这可能是CN-影响植物正常生长发育的原因之一,但尚需进一步证实。
4 结 论
土壤中CN-含量与桃树根系的分布和残根腐解相关;CN-处理表现出低浓度促进、高浓度抑制根系长生长的特点;0.5 mmol · L-1 CN-处理显著增加桃根系中H2O2和MDA含量,并诱导CAT、POD和SOD的活性及相应基因表达量显著升高;CN-处理后,根系中氨基酸和碳水化合物代谢受到干扰。
[1] 俞明亮,王力荣,王志强,彭福田,张帆,叶正文.新中国果树科学研究70 年:桃[J].果树学报,2019,36(10):1283-1291.YU Mingliang,WANG Lirong,WANG Zhiqiang,PENG Futian,ZHANG Fan,YE Zhengwen. Fruit scientific research in New China in the past 70 years:Peach[J]. Journal of Fruit Science,2019,36(10):1283-1291.
[2] 朱炜.桃树根系自毒物质及自毒作用生理生化机制研究[D].武汉:华中农业大学,2016.ZHU Wei. Studies on autotoxic chemicals in peach roots and their physiological and biochemical mechanism on peach seedlings[D].Wuhan:Huazhong Agricultural University,2016.
[3] 何昊.桃根泌自毒物质苯甲酸降解菌的分离鉴定及应用潜力研究[D].武汉:华中农业大学,2019.HE Hao.Isolation and evaluation of benzoic acid-degrading bacteria from peach rhizosphere for application[D]. Wuhan:Huazhong Agricultural University,2019.
[4] 尹承苗,王玫,王嘉艳,陈学森,沈向,张民,毛志泉.苹果连作障碍研究进展[J].园艺学报,2017,44(11):2215-2230.YIN Chengmiao,WANG Mei,WANG Jiayan,CHEN Xuesen,SHEN Xiang,ZHANG Min,MAO Zhiquan. The research advance on apple replant disease[J]. Acta Horticulturae Sinica,2017,44(11):2215-2230.
[5] 闫助冰,王玫,明常军,姜远茂,沈向,陈学森,尹承苗,毛志泉.贝莱斯芽孢杆菌XC1 的筛选、鉴定及其对苹果连作障碍的影响[J].园艺学报,2021,48(3):409-420.YAN Zhubing,WANG Mei,MING Changjun,JANG Yuanmao,SHEN Xiang,CHEN Xuesen,YIN Chengmiao,MAO Zhiquan.Screening and identification of bacillus velezensis XC1 and its influence on apple replant disease[J].Acta Horticulturae Sinica,2021,48(3):409-420.
[6] LI C,ZHAO Q,GAO T T,WANG H Y,ZHANG Z J,LIANG B W,WEI Z W,LIU C H,MA F W.The mitigation effects of exogenous melatonin on replant disease in apple[J]. Journal of Pineal Research,2018,65(4):e12523.
[7] 王志强,牛良,鲁振华,崔国朝,曾文芳,潘磊,宗学普.抗重茬桃砧木新品种‘中桃砧1 号’的选育[J]. 果树学报,2016,33(4):504-508.WANG Zhiqiang,NIU Liang,LU Zhenhua,CUI Guochao,ZENG Wenfang,PAN Lei,ZONG Xuepu. Breeding report on‘CPR1’,a replanting-tolerant rootstock for peach[J].Journal of Fruit Science,2016,33(4):504-508.
[8] 郭修武,李娜,李坤,郭印山,李成祥,谢洪刚.葡萄根系分泌物主效自毒物质的初步分离与鉴定[J]. 果树学报,2012,29(5):861-866.GUO Xiuwu,LI Nan,LI Kun,GUO Yinshan,LI Chengxiang,XIE Honggang. Initial isolation and identification of the main toxic material in root exudation of Vitis vinifera[J]. Journal of Fruit Science,2012,29(5):861-866.
[9] 齐永志,孙雅如,王冰,郭邯菲,马可,甄文超.草莓根系分泌物和腐解物化感作用研究进展[J]. 园艺学报,2021,48(4):778-790.QI Yongzhi,SUN Yaru,WANG Bing,GUO Hanfei,MA Ke,ZHEN Wenchao. Research progress on allelopathy of root exudates and decompositions of strawberry[J]. Acta Horticulturae Sinica,2021,48(4):778-790.
[10] 张立恒,杨凤英,马海峰,赵娜.果树连作障碍研究进展[J].落叶果树,2019,51(3):28-31.ZHANG Liheng,YANG Fengying,MA Haifeng,ZHAO Na.The research advance on replant problem of fruit trees[J].Deciduous Fruits,2019,51(3):28-31.
[11] 姜伟涛,李前进,王海燕,陈冉,相立,刘恩太,陈学森,沈向,尹承苗,毛志泉.硫磺对苹果连作土壤环境及平邑甜茶幼苗生长的影响[J].园艺学报,2020,47(7):1225-1236.JIANG Weitao,LI Qianjin,WANG Haiyan,CHEN Ran,XIANG Li,LIU Entai,CHEN Xuesen,SHEN Xiang,YIN Chengmiao,MAO Zhiquan. Effect of sulfur on apple replanted soil environment and growth of Malus hupehensis seedlings[J].Acta Horticulturae Sinica,2020,47(7):1225-1236.
[12] 孔垂华. 植物种间和种内的化学作用[J]. 应用生态学报,2020,31(7):2141-2150.KONG Chuihua. Inter-specific and intra-specific chemical interactions among plants[J]. Chinese Journal of Applied Ecology,2020,31(7):2141-2150.
[13] 吕剑.外源硅缓解CA 诱导的黄瓜自毒胁迫的生理与分子机制[D].兰州:甘肃农业大学,2020.LÜ Jian.The physiological and molecular mechanisms of exogenous silicon alleviating CA-induced autotoxicity stress in cucumber (Cucumis sativus L)[D]. Lanzhou:Gansu Agricultural University,2020
[14] ZHU W,LIU J W,YE J L,LI G H. Effects of phytotoxic extracts from peach root bark and benzoic acid on peach seedlings growth,photosynthesis,antioxidance and ultrastructure properties[J].Scientia Horticulturae,2017,215:49-58.
[15] WU F H,DING Y Q,NIE Y X,WANG X J,AN Y Q,ROESSNER U,WALKER R,DU B H,BAI J G.Plant metabolomics integrated with transcriptomics and rhizospheric bacterial community indicates the mitigation effects of Klebsiella oxytoca P620 on p-hydroxybenzoic acid stress in cucumber[J].Journal of Hazardous Materials,2021,415:125756.
[16] 董晓民,高晓兰,刘伟,李桂祥,李淼,张安宁.桃连作障碍中自毒作用的研究进展[J].黑龙江农业科学,2021(2):123-126.DONG Xiaoming,GAO Xiaolan,LIU Wei,LI Guixiang,LI Miao,ZHANG Anning.The research advance on autotoxicity in peach replant problem[J]. Heilongjiang Agricultural Sciences,2021(2):123-126.
[17] SHEN W Q,LIU D,ZHANG H,ZHU W,HE H Z,LI G H,LIU J W. Overexpression of β-cyanoalanine synthase of Prunus persica increases salt tolerance by modulating ROS metabolism and ion homeostasis[J]. Environmental and Experimental Botany,2021,186:104431.
[18] 余璐璐,刘杨,徐飞.氰化物的来源及其在植物中的功能研究进展[J].生命科学,2019,31(2):128-134.YU Lulu,LIU Yang,XU Fei.The source of cyanide and its function in plants[J].Chinese Bulletin of Life Sciences,2019,31(2):128-134.
[19] 张江红,彭福田,蒋晓梅,李民吉,王中堂.桃树枝条还田对土壤自毒物质、微生物及植株生长的影响[J]. 植物生态学报,2016,40(2):140-150.ZHANG Jianghong,PENG Futian,JIANG Xiaomei,LI Minji,WANG Zhongtang.Effects of peach branches returning on autotoxins and microbes in soil and tree growth of peaches[J]. Chinese Journal of Plant Ecology,2016,40(2):140-150.
[20] 高寒.不同栽培模式对桃连作障碍的缓解作用[D].扬州:扬州大学,2020.GAO Han. Alleviating effect of different cultivation modes on peach continuous cropping obstacle[D]. Yangzhou:Yangzhou University,2020.
[21] RUMBERGER A,MERWIN I A,THIES J E.Microbial community development in the rhizosphere of apple trees at a replant disease site[J].Soil Biology and Biochemistry,2007,39(7):645-1654.
[22] 王鸿,张雪冰,张帆.几种酚酸类物质对山桃种子萌发后根系的化感效应[J].果树学报,2017,34(11):1443-1449.WANG Hong,ZHANG Xuebing,ZHANG Fan. Allelopathy effect of some phenolic acids on roots of germinated Prunus davidiana (Carr.) Franch seeds[J]. Journal of Fruit Science,2017,34(11):1443-1449.
[23] 吴秀文.缺硼胁迫下柑橘枳砧根系细胞特性及非靶标和靶标代谢组学分析[D].武汉:华中农业大学,2018.WU Xiuwen.Analysis of cell characteristics,non-target metabonomics and target metabonomics in roots of trifoliate orange rootstock under boron deficiency[D].Wuhan:Huazhong Agricultural University,2018.
[24] 张贺.三个ROS 应答基因在流胶病菌侵染桃树过程中的功能分析[D].武汉:华中农业大学,2020.ZHANG He. Functional analysis of three responsive genes of Lasiodiplodia theobromae during infection[D]. Wuhan:Huazhong Agricultural University,2020.
[25] 张丽.低温和桃胶涂膜对桃果实采后成熟衰老的调控及其机制[D].武汉:华中农业大学,2020.ZHANG Li. The regulation and mechanism of low temperature and peach-gum coating on postharvest peach ripening and senescence[D].Wuhan:Huazhong Agricultural University,2020.
[26] ZHANG Z Z,ZHANG Z D,HAN X Y,WU J H,ZHANG L Z,WANG J R,WANG-PRUSKI G. Specific response mechanism to autotoxicity in melon (Cucumis melo L.) root revealed by physiological analyses combined with transcriptome profiling[J]. Ecotoxicology and Environmental Safety,2020,200:110779.
[27] ZHANG H,ZHANG D M,WANG F,HSIANG T,LIU J W,LI G H. Lasiodiplodia theobromae-induced alteration in ROS metabolism and its relation to gummosis development in Prunus persica[J].Plant Physiology and Biochemistry,2020,154:43-53.
[28] JOSE S,GILLESPIE A R.Allelopathy in black walnut (Juglans nigra L.) alley cropping. I. Spatio-temporal variation in soil juglone in a black walnut-corn (Zea mays L.) alley cropping system in the midwestern USA[J]. Plant and Soil,1998,203(2):191-197.
[29] 徐艳如.桃根系分布特点及其对不同施肥处理的反应[D].泰安:山东农业大学,2011.XU Yanru. Peach root distribution character and its response to different kinds of fertilizer[D]. Taian:Shandong Agricultural University,2011.
[30] 李娟起.褪黑素缓解自毒物质胁迫下黄瓜种子萌发和幼苗生长的相关生理机制[D].北京:中国农业大学,2017.LI Juanqi. Physiological mechanism of melatonin allevuated seed germination and seedling growth of cucumber under autotoxin stress[D].Beijing:China Agricultural University,2017.
[31] 王功帅,马子清,潘凤兵,田长平,陈杰,王金政,陈学森,尹承苗,毛志泉.连作对土壤微生物及平邑甜茶幼苗氮吸收、分配和利用的影响[J].植物营养与肥料学报,2019,25(3):481-488.WANG Gongshuai,MA Ziqing,PAN Fengbing,TIAN Changping,CHEN Jie,WANG Jinzheng,CHEN Xuesen,YIN Chengmiao,MAO Zhiquan.Effect of apple replanting on soil microorganism and nitrogen absorption,distribution,utilization of Malus hupehensis Rehd. seedlings[J]. Journal of Plant Nutrition and Fertilizers,2019,25(3):481-488.
[32] ZHANG Z Z,FAN J R,WU J H,ZHANG L Z,WANG J R,ZHANG B B,WANG-PRUSKI G. Alleviating effect of silicon on melon seed germination under autotoxicity stress[J].Ecotoxicology and Environmental Safety,2020,188:109901.
[33] HE H,ZHU W,NOOR I,LIU J W,LI G H. Pseudomonas putida WH-B3 degrades benzoic acid and alleviates its autotoxicity to peach [Prunus persica (L.) Batsch] seedlings grown in replanted soil[J].Scientia Horticulturae,2019,255:183-192.
[34] XIN A Y,LI X Z,JIN H,YANG X Y,ZHAO R M,LIU J K,QIN B.The accumulation of reactive oxygen species in root tips caused by autotoxic allelochemicals-a significant factor for replant problem of Angelica sinensis (Oliv.) Diels[J]. Industrial Crops and Products,2019,138:111432.
[35] TALUKDER M R,ASADUZZAMAN M,UENO M,TANAKA H,ASAO T.Alleviation of allelochemical stress-induced growth inhibition and oxidative damage in lettuce under closed hydroponics through electro- degradation[J]. Horticultural Science,2020,47(1):53-68.
[36] 张政达,王景荣,陈丽辉,樊佳茹,韩晓云,王革伏,张志忠.甜瓜自毒胁迫响应基因CmFe-SOD 的克隆及表达分析[J].果树学报,2018,35(11):1335-1343.ZHANG Zhengda,WANG Jingrong,CHEN Lihui,FAN Jiaru,HAN Xiaoyun,WANG Gefu,ZHANG Zhizhong. Cloning and expression analysis of CmFe-SOD gene related to autotoxicity stress in Cucumis melo L[J]. Journal of Fruit Science,2018,35(11):1335-1343.
[37] 孙鑫,刘倩文,李坤,郭修武,郭印山,刘镇东.外源对羟基苯甲酸对葡萄植株生长及根系分泌特性的影响[J].中外葡萄与葡萄酒,2018(4):12-17.SUN Xin,LIU Qianwen,LI Kun,GUO Xiuwu,GUO Yinshan,LIU Zhendong. Effect of exogenous 4-hydroxybenzoic acid on grapevine growth and root exudating characteristic[J]. Sino-Overseas Grapevine&Wine,2018(4):12-17.
[38] YANG P,NAWAZ M A,LI F X,BAI L S,LI J.Brassinosteroids regulate antioxidant system and protect chloroplast ultrastructure of autotoxicity- stressed cucumber (Cucumis sativus L.)seedlings[J].Agronomy,2019,9(5):265.
[39] 张凤,陈伟.代谢组学在植物逆境生物学中的研究进展[J].生物技术通报,2021,37(8):1-11.ZHANG Feng,CHEN Wei. Research progress of metabolomics in plant stress biology[J]. Biotechnology Bulletin,2021,37(8):1-11.
[40] YE T T,WANG Y P,FENG Y Q,CHAN Z L.Physiological and metabolomic responses of bermudagrass (Cynodon dactylon) to alkali stress[J].Physiologia Plantarum,2021,171(1):22-33.
[41] 董肖昌.不同柑橘砧木对缺硼的响应差异及结构变化与代谢机制[D].武汉:华中农业大学,2016.DONG Xiaochang. Different response and structure change and metabolic mechanism of different citrus rootstock under boron deficiency[D].Wuhan:Huazhong Agricultural University,2016.
[42] 丁海燕.大蒜根系分泌物对不同受体蔬菜及其土壤的化感效应[D].杨凌:西北农林科技大学,2017.DING Haiyan. The allelopathic effect of garlic root exudate on different vegetables and their soil chemical and biological properties[D].Yangling:Northwest A&F University,2017.