我国是柑橘的主产国之一,良好的生态环境是柑橘正常生长、果实品质形成的重要因素。干旱、低温和高盐等各种非生物胁迫严重制约了柑橘生长发育、产量品质及地理分布,造成了巨大的经济损失[1]。WOX(WUSCHEL-related homeobox)家族基因编码的转录因子是植物特异性转录因子,具有60个或61 个氨基酸组成的“螺旋-环-螺旋-转角-螺旋(helix-loop-helix-turn-helix)”的保守结构域[2]。WOX 家族基因在植物中广泛存在,目前已在拟南芥、玉米、藜麦、蓖麻和茶树等多种植物中得到鉴定。系统进化分析发现,植物WOX 家族蛋白可分为三个独立的进化支,即现代进化支、中间进化支和古代进化支[3]。有研究表明,植物WOX家族基因具有调控植物器官发育和抗逆性的重要功能。例如:拟南芥AtWUS和AtWOX5分别在顶端分生组织、胚珠、花药和根尖分生组织表达,具有调控这些组织发育的功能[4];AtWOX1 与AtWOX3 可以调控侧生器官的横向发育;AtWOX2 在植物形成胚的过程中起促进作用[5];AtWOX4 和AtWOX14 对维管束形成层和原形成层的分化起重要作用[6-7];AtWOX6 抑制器官原基的成熟分化,调控子房发育,还能响应低温胁迫[8];AtWOX7 在拟南芥侧根发育中起重要作用[9];AtWOX8和AtWOX9都在拟南芥胚中表达,并维持胚发育[10-11];AtWOX11 与AtWOX12 促进根系发育和愈伤组织形成[12];水稻OsWOX11 调控水稻根的发育,增强转基因水稻的抗旱性[13-14];AtWOX13 促进侧根的发育和花器官的形成[15];甜橙CsWUS的异位过表达限制了转基因植株叶片、雌蕊和子房的正常发育[16]。
枳是抗逆性较强的柑橘砧木,常用于提高柑橘栽培品种的抗逆性。笔者利用生物信息学技术对枳WOX家族基因进行鉴定,并对该家族基因的基本信息、系统进化发育、蛋白保守结构域、基因结构、启动子顺势作用元件、共线性等进行详细的研究。同时,使用实时荧光定量PCR(Quantitative real-time PCR,qRT-PCR)分析枳WOX家族基因在干旱、高盐、低温和ABA 等多种非生物胁迫下的表达模式。笔者旨在阐明枳WOX 家族基因在植物中的系统进化、蛋白结构特征及非生物胁迫下的表达模式,为进一步研究枳WOX家族基因在柑橘逆境响应中的功能提供理论依据。
1 材料和方法
1.1 枳WOX家族基因的鉴定及理化性质分析
从甜橙基因组数据库(http://citrus.hzau.edu.cn/orange/index.php)下载枳(Poncirus trifoliata)和甜橙(Citrus sinensis)基因组数据[17]。从拟南芥(Arabidopsis thaliana)数据库(http://www.arabidopsis.org/)下载的拟南芥WOX家族蛋白序列为参考序列。利用以下方法鉴定枳WOX 家族基因。首先,使用拟南芥和甜橙中已经鉴定出的15 个和11 个WOX 家族蛋白序列,通过BLASTP 比对枳基因组数据库中匹配的蛋白序列,得到候选基因的蛋白序列。其次,从Pfam 数据库(http://pfam.xfam.org/)下载所有物种WOX 结构域序列(PF00046),利用Hmmer3.3.2(http://hmmer.janelia.org/)构建隐马氏模型,得到候选基因。使用SMART(http://smart.embl-heidelberg.de/)进行保守结构域检索,最终确定枳WOX家族所有基因。使用ExPASy ProtParam 网站(https://web.expasy.org/protparam/)对鉴定出的枳WOX 家族蛋白进行理化性质分析,包括分子质量、氨基酸数、等电点预测[18]。利用WOLF-PSORT(https://www.genscript.com/wolf-psort.html)对该家族蛋白进行亚细胞定位分析[19]。
1.2 枳WOX家族蛋白系统进化分析
从Phytozome 数据库(https://phytozome.jgi.doe.gov/pz/portal.html)中获得水稻(Oryza sativa)和克里曼丁橘(Citrus clementina)WOX 家族蛋白序列。葡萄(Vitis vinifera)WOX 家族蛋白序列来源于葡萄基因组数据库(http://plants.ensembl.org/Vitis_vinifera/Info/Index)。通过MEGA X 软件中的邻接法(Neighbor-joining)对拟南芥、水稻、甜橙、克里曼丁橘、葡萄和枳6种植物的WOX家族蛋白进行系统进化树的构建,参数设置中Bootstrap次数为1000[20]。
1.3 枳WOX家族蛋白保守结构域、基因结构、保守基序分析
利用DNAMAN 和Jalview 软件对枳WOX 家族蛋白保守结构域序列进行多重比对。通过在线网站GSDS数据库(http://gsds.gao-lab.org/)对基因结构进行预测分析。使用在线软件MEME(https://memesuite.org/meme/tools/meme)分析枳WOX家族蛋白保守基序,其中基序数量设置为10,基序宽度为6~100[21]。
1.4 枳WOX家族基因启动子顺式作用元件分析与miRNA预测
从枳基因组中提取枳WOX家族基因起始密码子上游2000 bp 序列,并提交至PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)网站预测启动子的顺式作用元件,并通过TBtools软件对其进行可视化[22-23]。利用植物小分子RNA靶标分析在线网站psRNATarget(http://plantgrn.noble.org/ psRNATarget/)对与枳WOX 家族基因相关的miRNA 进行预测[24]。
1.5 枳WOX家族基因染色体定位和共线性分析
使用MPtrcan X 程序对枳WOX 家族基因复制重复事件进行鉴定。利用TBtools 进行拟南芥、水稻、甜橙、克里曼丁橘、葡萄和枳WOX 家族基因之间的共线性可视化展示。
1.6 密码子使用偏好性分析
利用CondonW 1.4 软件对枳WOX 家族基因进行密码子使用偏好性相关指数计算,得到密码子偏好性的相关数据。
1.7 枳WOX家族基因表达分析
将在营养土中生长90 d的枳幼苗置于Hoagland营养液中,在培养室(25 ℃,相对湿度80%,光照/黑暗时数为16 h/8 h)培养7 d。再将植株分别置于4 ℃(低温)以及含有20% PEG 6000(模拟干旱)、250 mmol·L-1 NaCl(高盐)和100µmol·L-1 ABA(脱落酸)的Hoagland营养液中进行胁迫处理。以正常生长条件下的营养液培养枳幼苗为对照,各种胁迫处理不同时间(0、1、3、6、12 和24 h)后采集叶、茎和根,每个处理设3 个生物学重复。采集的样品迅速用液氮冷冻后放置在-80 ℃冰箱保存备用。
使用EastepTM总RNA提取试剂盒(普洛麦格,中国)提取各组织总RNA。通过凝胶电泳检测RNA质量,F-4500型超微量分光光度检测RNA浓度,cDNA 第一链合成使用M5 Super plus qPCR RT kit with gDNA remover 试剂盒(聚合美,中国)。利用Primer premier 5.0 软件对枳WOX 家族基因的CDS序列设计qRT-PCR 特异性引物(表1)。以cDNA 为模板,使用2×Realtime PCR Super mix(SYBRgreen with anti-Taq)试剂盒(聚合美,中国),在BIO-RAD CFX 96 实时荧光定量PCR 仪上进行qRT-PCR 扩增。以枳PtrActin 为内参基因。qRT-PCR 体系为10 μL 2×Realtime PCR Super mix,1 μL cDNA,上下游引物各0.5 μL,8 μL ddH2O,共20 μL。反应程序为95 ℃60 s;95 ℃10 s,58 ℃5 s,72 ℃12 s 40 个循环。实验设置3 次生物学重复,使用2-ΔΔCT方法分析基因的相对表达量。
表1 枳WOX 家族基因qRT-PCR 引物
Table 1 qRT-PCR primers of WOX family genes in trifoliate orange

基因名称Gene name PtrActin PtrWUS PtrWOX1 PtrWOX3 PtrWOX4 PtrWOX5 PtrWOX6 PtrWOX9 PtrWOX10 PtrWOX11 PtrWOX13上游引物序列(5’-3’)Forward primer sequences(5’-3’)CATCCCTCAGCACCTTCC GTAGCAGTGTTGTTGGCG ATGAAGCAGCAGCGGGAGAAATAC AGCAAGAGAGAGGCAAAA CTCACGCTTGGCTGTAAACG GCCGAGCACCGATCAGATTCAG ACAGACAAAGAACTGGGCACCTTC CCTACAACACTCACCACCACCAATG AGAGGCAGTTTCAGCAAGAT TGCTGGCTCTTCTTCATTTT CCAAAAGGAAGCAGTTAGTG下游引物序列(5’-3’)Forward primer sequences(5’-3’)CCAACCTTAGCACTTCTCC ATGGGAAAGAGAGGGAGG TGTTGGTGTTGGAGCTGTCTGATG TTAGAAAAGGAACCACCG GTTCGCATTCCTCCCCTGTA ATACTTTGCGACGCTTCTGTCTCTC TTCCCTCCCATCAAATTGTGTCCAC CTGGGCTGCGTTCTTCACATCC CTCATTCCAGCGATTTCATT CTGATGGGCATAACATTGAT AGTGGTCTTGTGTTCGTCAT
1.8 数据整理与统计分析方法
利用Microsoft Excel 软件进行数据统计和图表绘制。利用DPS 数据处理软件对数据进行差异显著性分析,p <0.05表示差异显著。
2 结果与分析
2.1 枳WOX家族基因的鉴定及蛋白理化性质分析
从枳基因组中共鉴定出了10 个枳WOX 家族基因。根据与拟南芥同源基因的相似性对这10 个基因进行命名(PtrWUS、PtrWOX1、PtrWOX3~PtrWOX6、PtrWOX9~PtrWOX11 和PtrWOX13)。枳WOX 家族基因CDS 序列长度差异较大,其中PtrWOX5 的CDS 序列最长,为1659 bp。PtrWOX3的CDS 序列最短,为624 bp。枳WOX 家族基因编码的氨基酸长度在207~552 aa 之间;蛋白的分子质量在23.893~62.676 ku 之间;理论等电点在5.46~9.44之间。不稳定指数在45.92~67.29之间,值均高于40,为不稳定蛋白,亲水性平均系数都在-1.124~-0.496 之间,均为负值,为亲水蛋白。这个结果表明枳WOX家族基因均为不稳定的亲水性蛋白。亚细胞定位预测分析表明,枳WOX 家族蛋白主要定位于细胞核,少部分定位于叶绿体、细胞骨架和过氧物酶体等(表2)。
表2 枳WOX 家族基因理化性质分析
Table 2 Physical and chemical properties of WOX family genes in trifoliate orange
注:nucl.细胞核;cyto.细胞骨架;plas.质膜;mito.线粒体;pero.过氧物酶体;chlo.叶绿体;vacu.液泡。
Note:nucl.nucleus;cyto.cytoskeleton;plas.plasma membrane;mito.mitochondrion;pero.peroxisome;chlo.chloroplast;vacu.vacuole.
基因名称Gene name PtrWUS PtrWOX1 PtrWOX3 PtrWOX4 PtrWOX5 PtrWOX6 PtrWOX9 PtrWOX10 PtrWOX11 PtrWOX13登录号Accession No.Pt7g019810.1 Pt1g010260.1 Pt8g009240.1 Pt5g004640.2 Pt4g022160.1 Pt2g018980.1 Pt2g025130.1 Pt5g000680.1 Pt3g028530.1 Pt7g020570.3编码区CDS Length/bp 879 1065 624 654 1659 1011 1095 702 882 873氨基酸数No.of amino acids 292 354 207 217 552 336 364 233 293 290分子质量Molecular weight/ku 31.892 40.119 23.893 24.849 62.676 38.604 40.194 26.731 32.348 32.143等电点pI 6.45 6.16 9.44 9.24 5.94 6.65 6.56 5.46 6.97 5.99不稳定系数Instability index(II)48.50 53.90 67.29 62.02 45.92 61.96 62.10 51.89 56.90 46.58亲水性Gravy-0.928-0.878-0.766-0.963-0.568-1.124-0.541-0.788-0.496-0.749亚细胞定位Subcellular location nucl:13 nucl:13 nucl:9,cyto:3,plas:1 nucl:10,mito:3 cyto:8,nucl:5 nucl:13 pero:7,nucl:3.5,cyto_nucl:2.5,ito:2 nucl:13 nucl:11,chlo:1,vacu:1 nucl:13
2.2 枳WOX家族蛋白的系统进化分析
利用MEGA X软件构建了拟南芥、水稻、甜橙、克里曼丁橘、葡萄与枳的WOX 家族蛋白的系统进化树(图1)。根据拟南芥WOX 家族蛋白进化谱系的典型分支可将枳WOX家族蛋白分为现代进化支(PtrWUS、PtrWOX1、PtrWOX3~PtrWOX6)、中间进化支(PtrWOX9 和PtrWOX11)和古代进化支(PtrWOX10 和PtrWOX13)。聚类到同一分支的蛋白结构具有较高的同源性,可能具有相似的功能。进化树结果显示,枳WOX 家族蛋白与同科植物甜橙和克里曼丁橘WOX家族蛋白的亲缘关系近于拟南芥、葡萄和水稻WOX家族蛋白。在3个进化支中都包含这6个物种的WOX家族蛋白,表明物种的分化时间迟于WOX家族蛋白的分化时间。
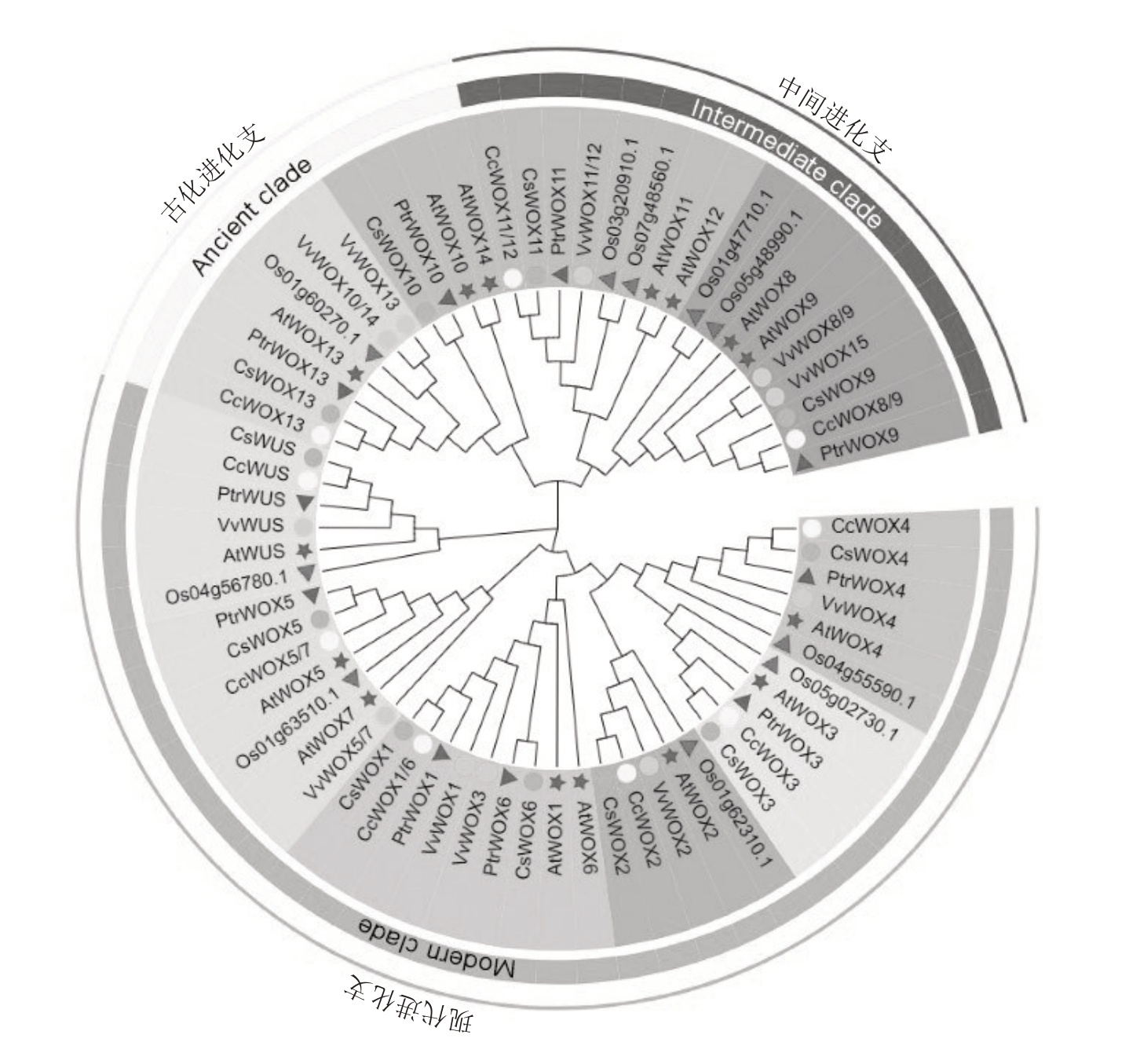
图1 拟南芥(At)、水稻(Os)、甜橙(Cs)、克里曼丁橘(Cc)、葡萄(Vv)与枳(Ptr)WOX 蛋白系统进化树
Fig.1 Phylogenetic analysis of WOX proteins in Arabidopsis thaliana(At),Oryza sativa(Os),Citrus sinensis(Cs),Citrus clementina(Cc),Vitis vinifera(Vv)and Poncirus trifoliata(Ptr)
2.3 枳WOX家族蛋白保守结构域、基因结构、保守基序分析
对枳WOX 家族蛋白多重序列比对结果表明,枳WOX家族蛋白大部分含有由60个氨基酸残基序列折叠形成的“螺旋-环-螺旋-转角-螺旋(helix-loophelix-turn-helix)”保守结构域,其中PtrWUS 有61个氨基酸残基,多一个N 残基(图2)。这一同源异型结构域在各种植物中都很保守,说明该结构域对植物WOX 家族蛋白的功能完整具有重要作用[25]。另外,该结构域包含了已报道的保守位点[26],包括helix l中的Q、L位点,helix 3中的V、W、F、Q、N和R等位点(图2)。这个结果说明这些位点在枳WOX 家族成员中同样保守。

图2 枳WOX 家族蛋白同源异型结构域分析
Fig.2 Homeodomain domain analysis of WOX family proteins in trifoliate orange
分析基因结构有助于揭示基因家族的进化规律。通过分析枳WOX 家族基因的基因结构,并结合MEGA X软件构建的枳WOX家族基因系统进化树来反映枳WOX基因家族不同亚族成员间的结构关系。结果表明,枳WOX 家族基因内含子数目为1~5 个,外显子数目为2~6 个,只有PtrWOX4、PtrWOX10 和PtrWOX13 基因同时含有5’UTR 和3’UTR。枳WOX家族蛋白可分为3个进化支,同一进化支的基因结构较为相似,不同进化支间的成员间有较大差异。另外,PtrWOX4 和PtrWOX10 的内含子和外显子的数量和排列顺序一致,只有长度差异。PtrWOX1和PtrWOX6这2个基因的外显子的数量和排列顺序都相似,只是内含子长度不同(图3-A)。
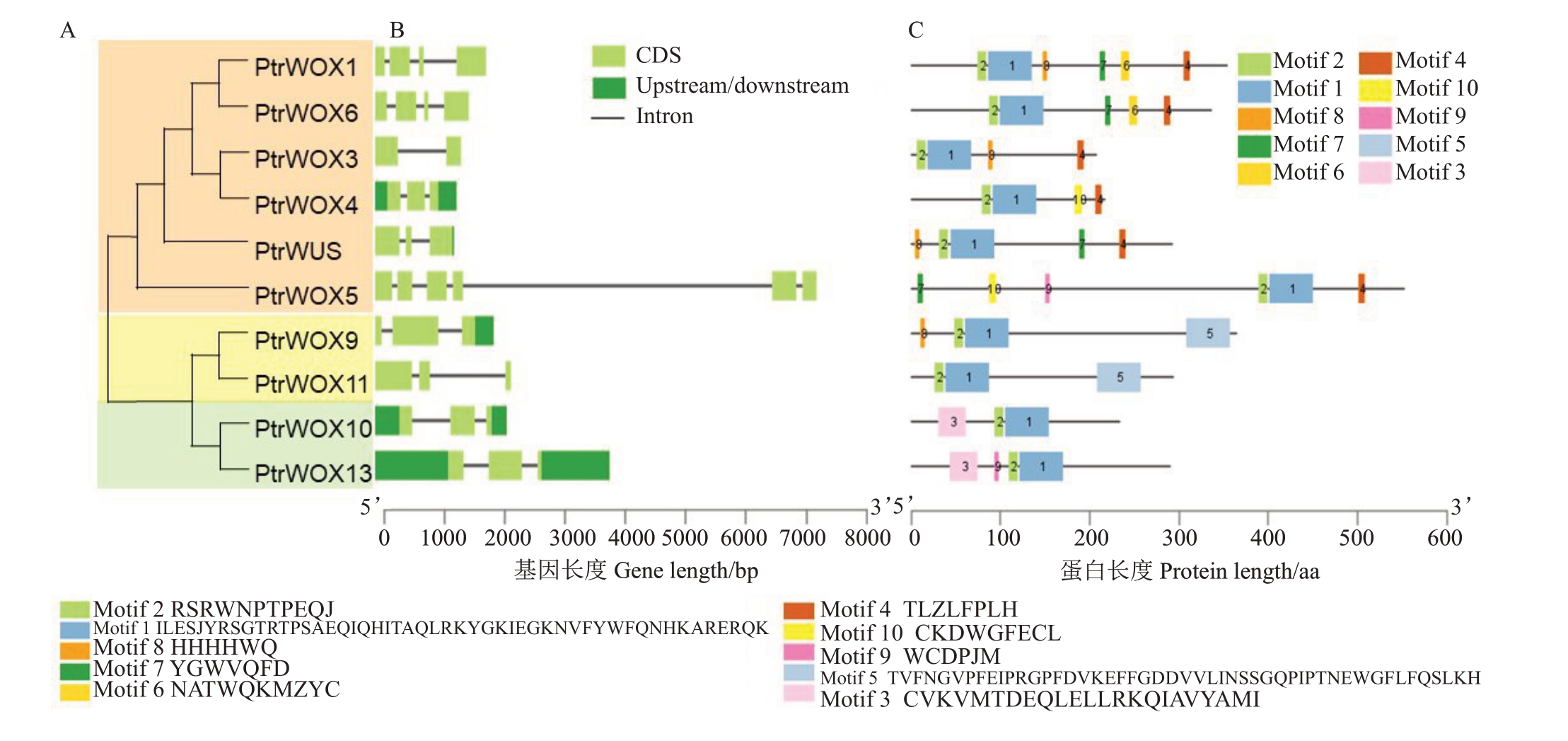
图3 枳WOX 家族基因蛋白系统发育树(A)、基因结构(B)和蛋白保守基序(C)分析
Fig.3 Analysis of phylogenetic tree(A),gene structure(B)and protein conserved motifs(C)of the WOX family genes in trifoliate orange
CDS、upstream/downstream 和黑线分别表示外显子、上游/下游和内含子。
CDS,upstream/downstream and black line indicate exon,upstream/downstream and intron respectively.
利用MEME在线软件对枳WOX家族蛋白进行保守基序分析,结果表明,枳WOX家族蛋白序列皆包含保守元件Motif1和Motif2,为“螺旋-环-螺旋-转角-螺旋(Helix-loop-helix-turn-helix)”的保守同源异型结构域。枳WOX 家族蛋白的现代进化支成员(PtrWUS、PtrWOX1、PtrWOX3~PtrWOX6)都含有Motif4(TLZLFPLH),为WUS-box 基序(TLXLFPXX,X 为任一氨基酸),这个基序在古代进化支和中间进化支中均未发现;Motif5 只分布于中间进化支成员(PtrWOX9和PtrWOX11)的C端;古代进化支的成员(PtrWOX10 和PtrWOX13)在N 端都有Motif3,该结构域由23个氨基酸残基组成(图3-B)。这个研究结果表明,枳WOX 家族蛋白不同进化支含有不同的保守基序,相同进化支基序结构相似,这也反映出构建的系统进化分析结果可靠。
2.4 枳WOX家族基因启动子顺式作用元件分析与miRNA的预测
从枳基因组数据库提取枳WOX家族基因起始密码子上游2000 bp启动子序列进行分析,预测启动子上的顺式作用元件。通过PlantCARE 网站分析,发现枳WOX家族基因启动子上存在基础顺式作用元件以及光响应、生长发育、植物激素响应及逆境胁迫响应等顺式作用元件。例如,与植物生长发育调控相关元件包括分生组织表达相关的元件(CATbox)和参与昼夜节律调控的顺式调控元件(circadian);植物激素调控元件中的脱落酸响应元件(ABRE);与逆境胁迫相关的干旱胁迫响应元件(MBS)、干旱和盐胁迫响应元件(DRE1)、低温胁迫响应元件(TCA、LTR 和MYC)、逆境胁迫响应元件(STRE)、损伤响应元件(WRE3 和WUN-motif)、防御与应激响应元件(TC-rich repeats)(图4-A)。从数量和分布来看,10 个枳WOX 家族基因启动子的顺式作用元件差异较大。除PtrWOX5 和PtrWOX11外,其余8 个基因均含有ABRE 元件。该家族基因的启动子中都至少含有一个MYC元件,并且是逆境胁迫响应元件中数量最多的元件。数量最少的为干旱和盐胁迫诱导元件DRE1,只有1 个(图4-B)。启动子分析结果表明,枳WOX 家族基因启动子序列含有生长发育、内源激素响应和逆境胁迫响应等顺式作用元件,可能参与调控柑橘生长发育、激素和逆境胁迫响应。

图4 枳WOX 家族基因启动子的顺式作用元件预测
Fig.4 Prediction of cis-acting elements on the promoter of WOX family genes in trifoliate orange
microRNA(miRNA)是调控基因表达的一类非编码的低分子RNA。本研究预测了可能与枳和同源基因甜橙WOX 家族基因相关联的miRNA。依据前人关于miRNA在植物逆境胁迫响应的研究,在预测中发现了一些可能参与逆境响应并调控植物WOX 家族基因表达的miRNA,包括仅对干旱胁迫有调控作用的miR394,参与调控干旱和低温胁迫响应的miR403,以及参与调控干旱、低温和盐胁迫的miR408(表3)。推测这些miRNA 可能通过调控枳WOX家族基因表达来响应非生物胁迫。
表3 与枳和甜橙WOX 家族基因相关的miRNA
Table 3 The prediction of miRNA related to WOX family genes in trifoliate orange and sweet orange

靶基因Target gene PtrWOX3(Cs8g17610.1)PtrWOX4(Cs3g23280.1)PtrWOX10(Cs3g27390.1)PtrWOX11(Cs5g27430.1)PtrWOX13(Cs1g26550.1)miRNA 名称miRNA name csi-miR477b csi-miR408 csi-miR1515 csi-miR403 csi-miR3948 csi-miR394 csi-miR394 csi-miR1515 csi-miR482c csi-miR827抑制类型Inhibition降解Cleavage降解Cleavage降解Cleavage降解Cleavage翻译Translation降解Cleavage翻译Translation降解Cleavage翻译Translation降解Cleavage
2.5 枳WOX家族基因染色体定位和共线性分析
为了进一步解析枳WOX 家族基因的进化关系,基于枳基因组注释信息,对枳WOX家族基因进行了染色体定位分析和物种内共线性分析。染色体定位分析结果表明,10 个枳WOX 家族基因不均等分布在7 条染色体上,分别定位于1 号染色体(PtrWOX1)、2 号染色体(PtrWOX6 和PtrWOX9)、3号染色体(PtrWOX11)、4 号染色体(PtrWOX5)、5 号染色体(PtrWOX4 和PtrWOX10)、7 号染色体(PtrWUS 和PtrWOX13)和8 号染色体(PtrWOX3)。同时,物种内共线性分析观察到10 个基因中仅有PtrWOX1 和PtrWOX6、PtrWOX10 和PtrWOX13 这2个片段重复事件,说明在该基因进化的过程中存在基因复制(图5-A)。
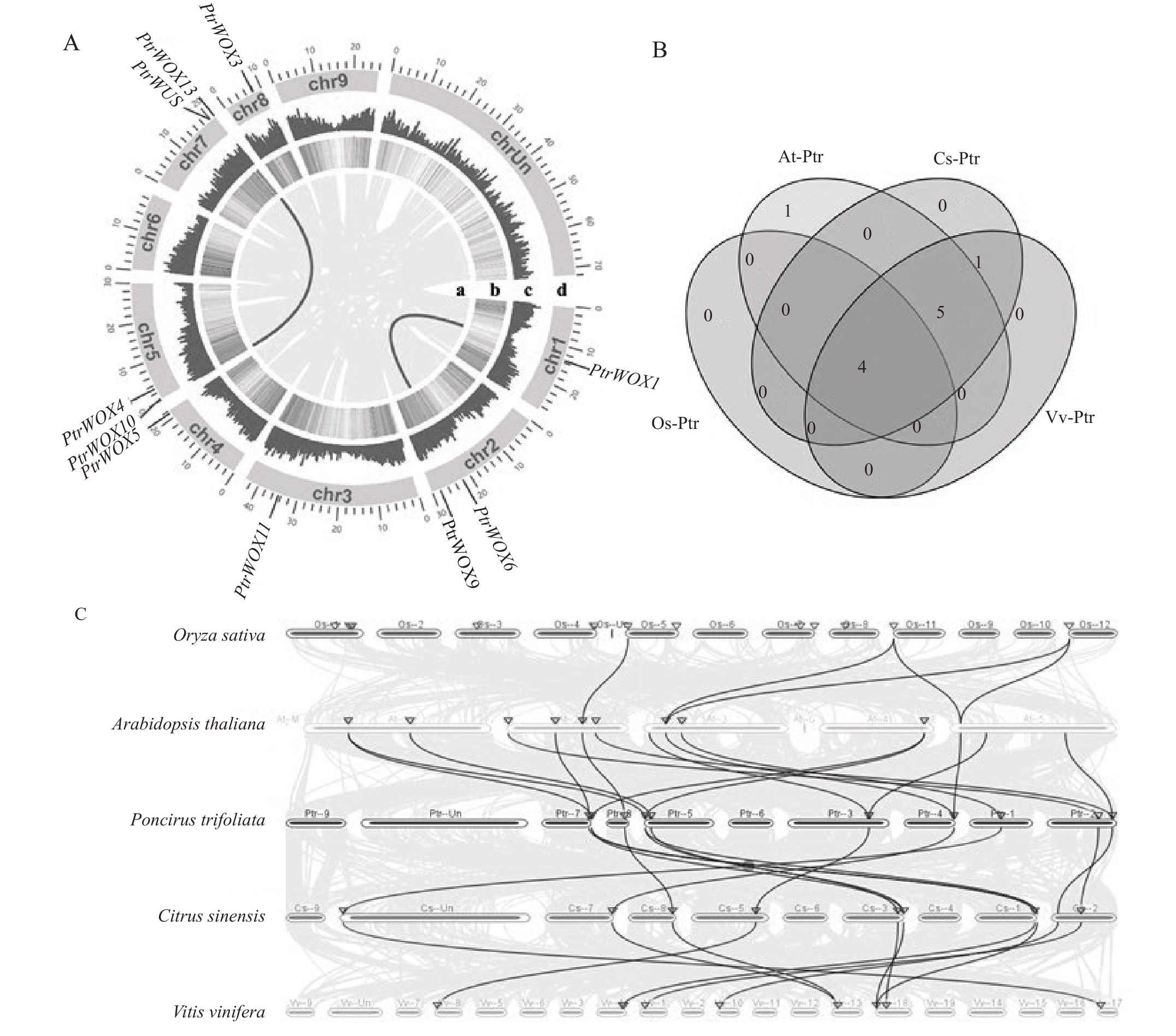
图5 枳WOX 家族基因染色体定位和共线性分析
Fig.5 Chromosome localization and synteny analysis of WOX family genes in trifoliate orange
A. 枳WOX 基因组特征。(a)基因组内同源区段,(b)和(c)基因密度,(d)染色体。B. 枳WOX 家族基因和其他4 个物种之间的直系同源基因。C. 拟南芥(At)、水稻(Os)、柑橘(Cs)、葡萄(Vv)与枳(Ptr)的WOX 基因共线性分析。
A.WOX genome features in trifoliate orange.(a)homologous segments in the genome,(b)and(c)gene density,(d)chromosome.B.WOX family genes and orthologous genes among 4 other species. C. Syntenty analysis of WOX genes from Arabidopsis thaliana (At) Citrus sinensis(Cs), Oryza sativa(Os),Vitis vinifera(Vv)and Poncirus trifoliata(Ptr).
为了进一步阐明WOX基因在不同物种间的进化关系,利用MCScan X 对双子叶植物的枳、拟南芥、甜橙、葡萄以及单子叶植物的水稻中的WOX家族基因进行共线性比较分析。结果表明,枳WOX家族基因中有4 个基因(PtrWOX3~PtrWOX5、PtrWOX9)能在其他4 个物种中找到直系同源基因(图5-B)。与水稻(4 对)相比,枳与拟南芥、甜橙和葡萄(各10 对)中具有更多的WOX 同源基因对(图5-C)。这个结果说明,相较单子叶植物,枳WOX家族基因与双子叶植物存在更多的同源基因和更近的亲缘关系。
2.6 密码子使用偏好性分析
枳WOX家族的GC平均含量为0.448;第3位密码子碱基组成中T(T3s)均值为0.423,A(A3s)均值为0.358,C(C3s)均值为0.259,G(G3s)均值为0.245,表明该基因中密码子第3 位偏好使用A 和T碱基。密码子适应指数(CAI)范围在0.172~0.263之间,平均值为0.219;密码子偏爱指数(CBI)范围在-0.128~0.193 之间,平均值为-0.024;最优密码子使用频率(Fop)范围在0.344~0.557 之间,平均值为0.419;有效密码子数(Nc)范围为为43.89~57.18,其平均值为52.08,(ENC>45);说明该基因组编码序列的密码子偏好性较弱(表4)。
表4 枳WOX 家族基因密码子偏好性分析
Table 4 Analysis of codon bias of WOX family genes in trifoliate orange
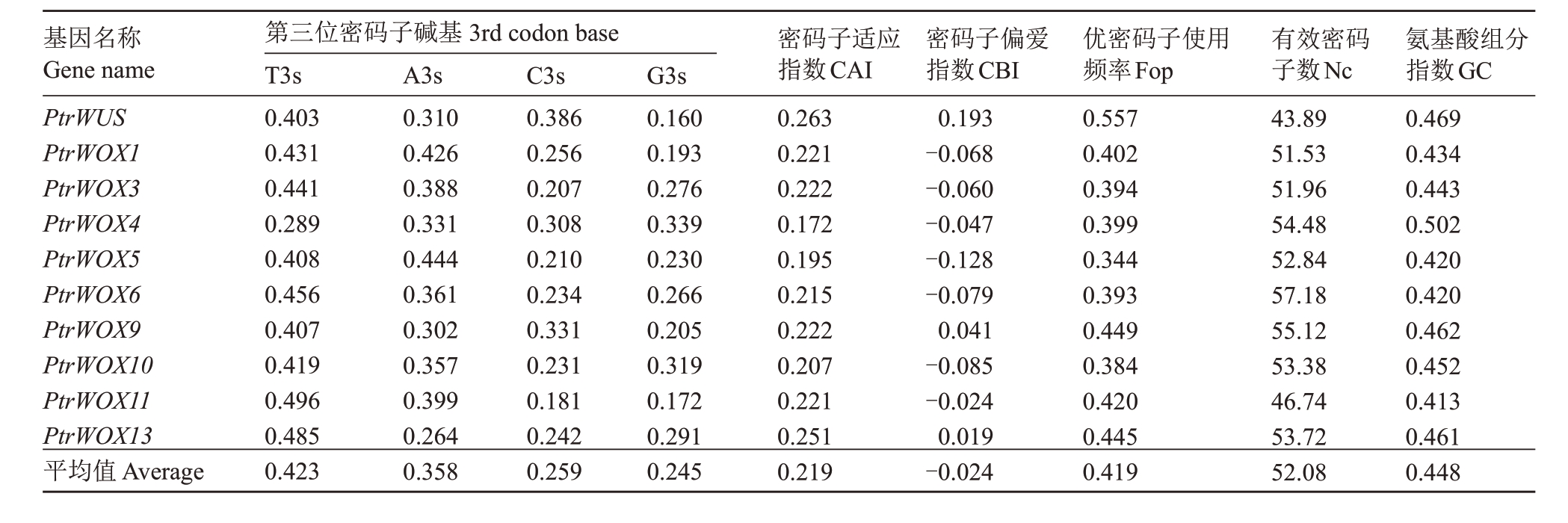
基因名称Gene name PtrWUS PtrWOX1 PtrWOX3 PtrWOX4 PtrWOX5 PtrWOX6 PtrWOX9 PtrWOX10 PtrWOX11 PtrWOX13平均值Average第三位密码子碱基3rd codon base T3s 0.403 0.431 0.441 0.289 0.408 0.456 0.407 0.419 0.496 0.485 0.423 A3s 0.310 0.426 0.388 0.331 0.444 0.361 0.302 0.357 0.399 0.264 0.358 C3s 0.386 0.256 0.207 0.308 0.210 0.234 0.331 0.231 0.181 0.242 0.259 G3s 0.160 0.193 0.276 0.339 0.230 0.266 0.205 0.319 0.172 0.291 0.245密码子适应指数CAI 0.263 0.221 0.222 0.172 0.195 0.215 0.222 0.207 0.221 0.251 0.219密码子偏爱指数CBI 0.193-0.068-0.060-0.047-0.128-0.079 0.041-0.085-0.024 0.019-0.024优密码子使用频率Fop 0.557 0.402 0.394 0.399 0.344 0.393 0.449 0.384 0.420 0.445 0.419有效密码子数Nc 43.89 51.53 51.96 54.48 52.84 57.18 55.12 53.38 46.74 53.72 52.08氨基酸组分指数GC 0.469 0.434 0.443 0.502 0.420 0.420 0.462 0.452 0.413 0.461 0.448
2.7 枳WOX家族基因的组织特异性表达分析
为研究枳WOX 家族基因在叶、茎和根中的表达差异,对枳WOX 家族基因进行表达分析。结果显示,10个基因在枳叶、茎和根中均有表达,且表达模式存在一定差异。PtrWUS、PtrWOX1、PtrWOX9和PtrWOX11 在根中表达量相对较高,其中PtrWUS和PtrWOX1在叶中表达最低;PtrWOX3和PtrWOX6在茎中表达量最低;PtrWOX5 在叶和茎中表达量高于根(图6);PtrWOX4、PtrWOX10和PtrWOX13在茎中的表达量高于其他组织。综上所述,不同枳WOX家族基因在不同组织中存在表达差异。
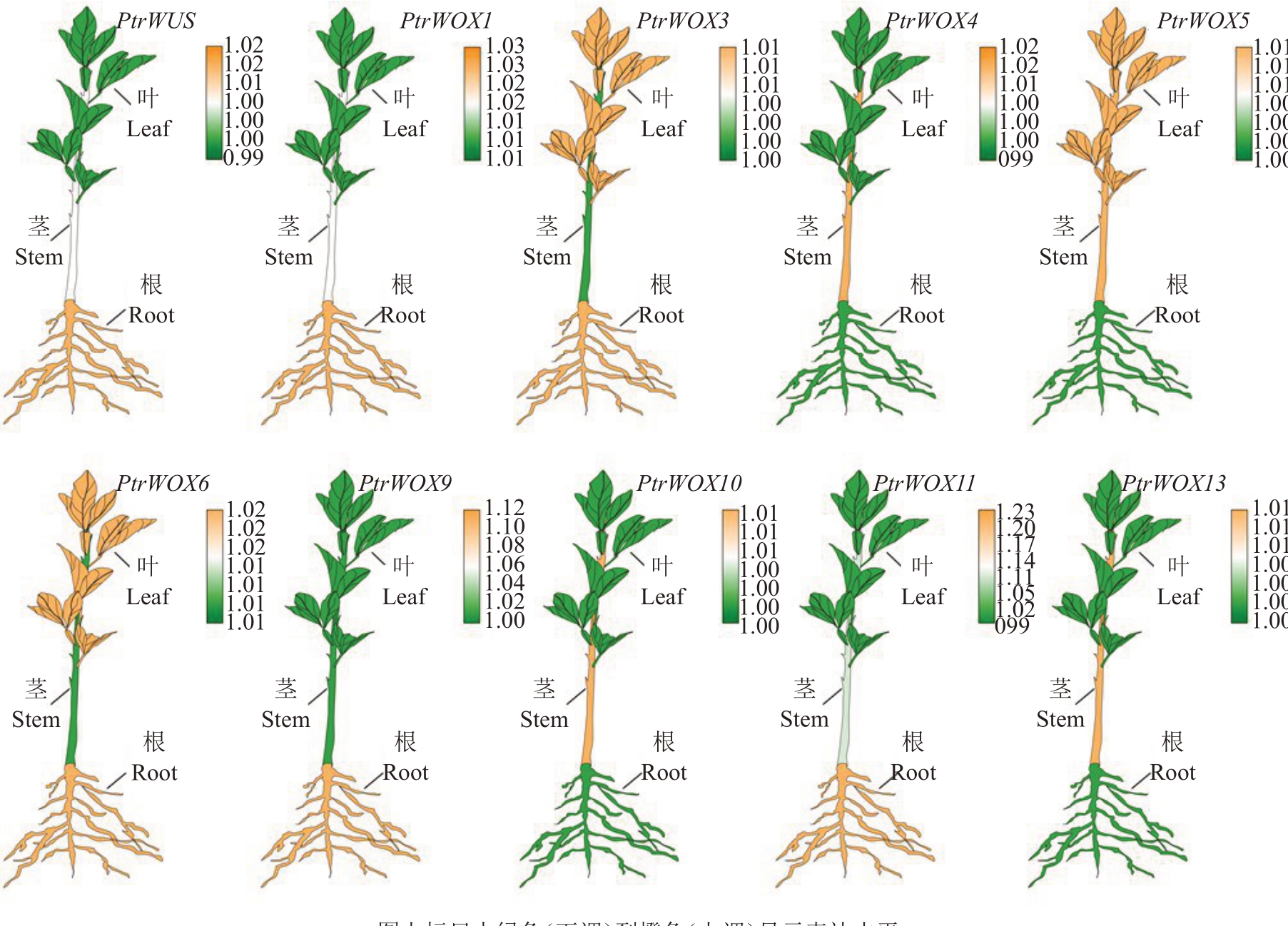
图6 枳WOX 家族基因不同组织中表达量热图
Fig.6 Heat map of expression levels in different tissues of WOX family genes from trifoliate orange
图上标尺中绿色(下调)到橙色(上调)显示表达水平。
The scale bar on the graph shows the expression level from green(down-regulated)to orange(up-regulated).
2.8 枳WOX家族基因在非生物胁迫下的表达分析
采用qRT-PCR 分析了干旱(20%PEG 6000)、高盐(250 mmol·L-1 NaCl)、低温(4 ℃)和脱落酸(100µmol·L-1ABA)胁迫下,枳WOX家族基因在枳叶、茎和根中的表达模式。
干旱处理后,PtrWUS、PtrWOX4 和PtrWOX10在根、茎和叶中的表达总体呈下调趋势,表达量低于处理前。在处理6 h 时,PtrWOX1、PtrWOX5 和PtrWOX6 在根中的表达量显著上调并达到峰值。茎中的PtrWOX5 在处理3 h 后表达量显著上调,随后显著下调,但该基因在叶片中表达量变化不显著。枳叶和茎中PtrWOX1表达量无显著变化,整体呈下调趋势。茎中PtrWOX3在处理1 h后表达量显著上调,随后显著下调。根中PtrWOX3和PtrWOX9的表达量总体呈现“M”形双峰变化趋势。这两个基因在叶中表达变化不如根中剧烈,且均呈下调趋势。PtrWOX11 在根中处理3 h 后表达显著上调,表达量是处理前的11 倍。该基因在叶中也能被干旱诱导表达,并呈现双峰形式,在处理后3 h和12 h分别达到峰值。PtrWOX11 在茎中的表达量无显著变化。干旱处理后,PtrWOX13 在根中处理3 h 后表达量显著上调并达到峰值,但在叶和茎中表达量总体呈下调趋势(图7)。
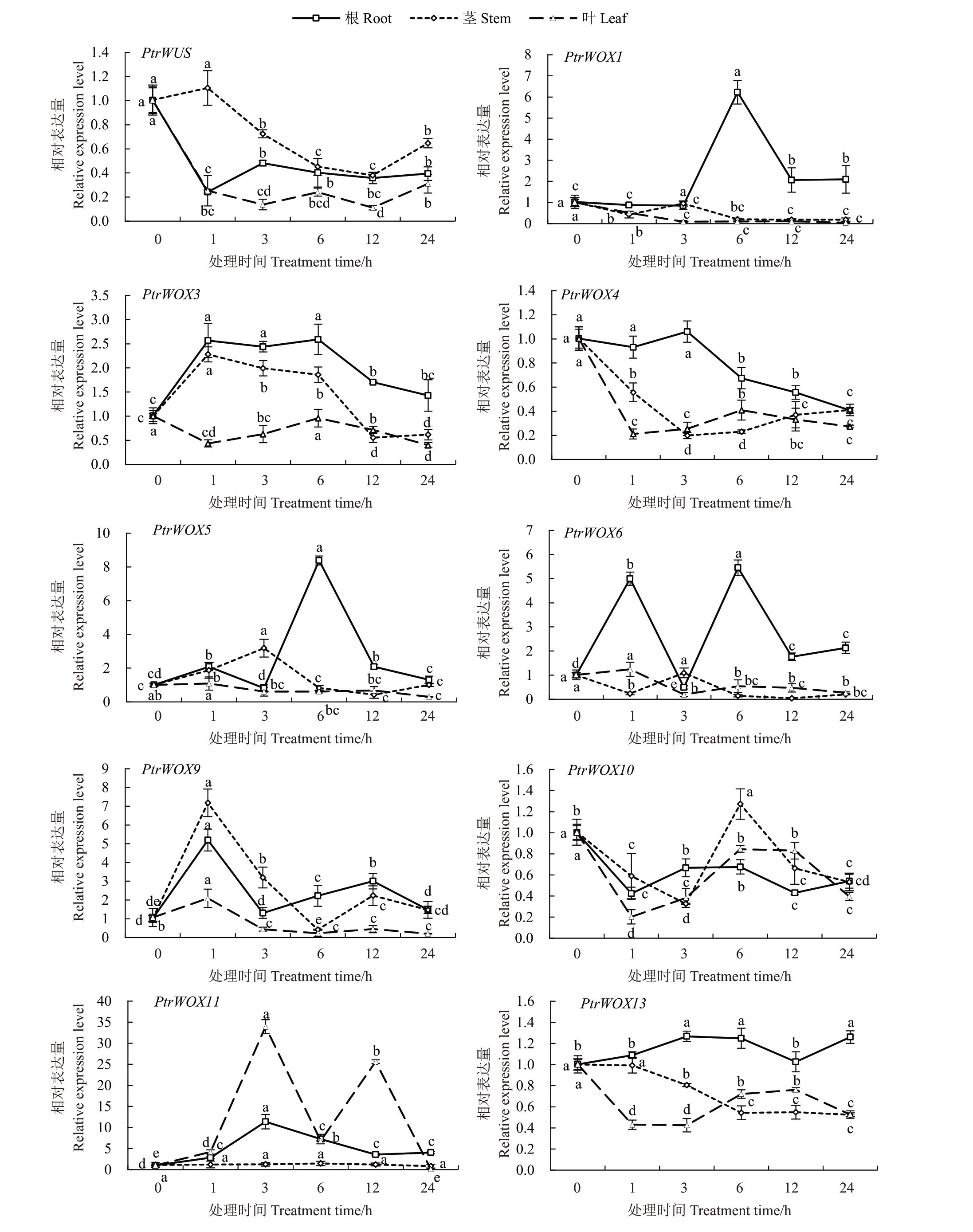
图7 PtrWOXs 在干旱胁迫下的表达分析
Fig.7 Expression analysis of PtrWOXs under drought stress
在盐处理下,PtrWUS在根中处理3 h、茎中处理24 h 时的表达量高于处理前,叶中呈现表达量显著下降趋势。盐处理1 h 后,PtrWOX1、PtrWOX5 和PtrWOX6 在根中表达量显著上调,并在3 h 达到峰值,处理6 h后表达量显著下调,并在24 h显著上调达到第二个峰值。茎中的PtrWOX1在处理6 h时表达量显著上调,随后显著下调。而该基因在叶中表达下调。盐处理6 h 后,PtrWOX5 在茎中表达显著上调,随后显著下调,24 h 后又显著上调并达到峰值。在叶中,PtrWOX5 的表达量在处理3~24 h呈现显著上调趋势。PtrWOX6 的表达量在茎中变化不显著,但在叶中处理6~24 h 呈现显著上调趋势。PtrWOX4 和PtrWOX10 在根、茎和叶中的表达量均低于处理前,总体呈下调趋势。盐处理不同时间后,PtrWOX3 能够在根和叶中被强烈诱导表达,但在茎中,PtrWOX3表达量显著下调。而PtrWOX11在根、茎和叶中的表达量均显著高于处理前。在根中,PtrWOX9 在处理后1 h 表达量显著上调,随后显著下调,并在处理后12 h 后再次上升。在叶和茎中,PtrWOX9 在盐处理后表达量变化不显著,并在处理后一定时间内高于处理前。根中的PtrWOX13在盐处理6 h 时表达量显著上调,随后显著下调,24 h 又上升。茎和叶中的PtrWOX13的表达量在盐处理后与处理前差异不显著(图8)。
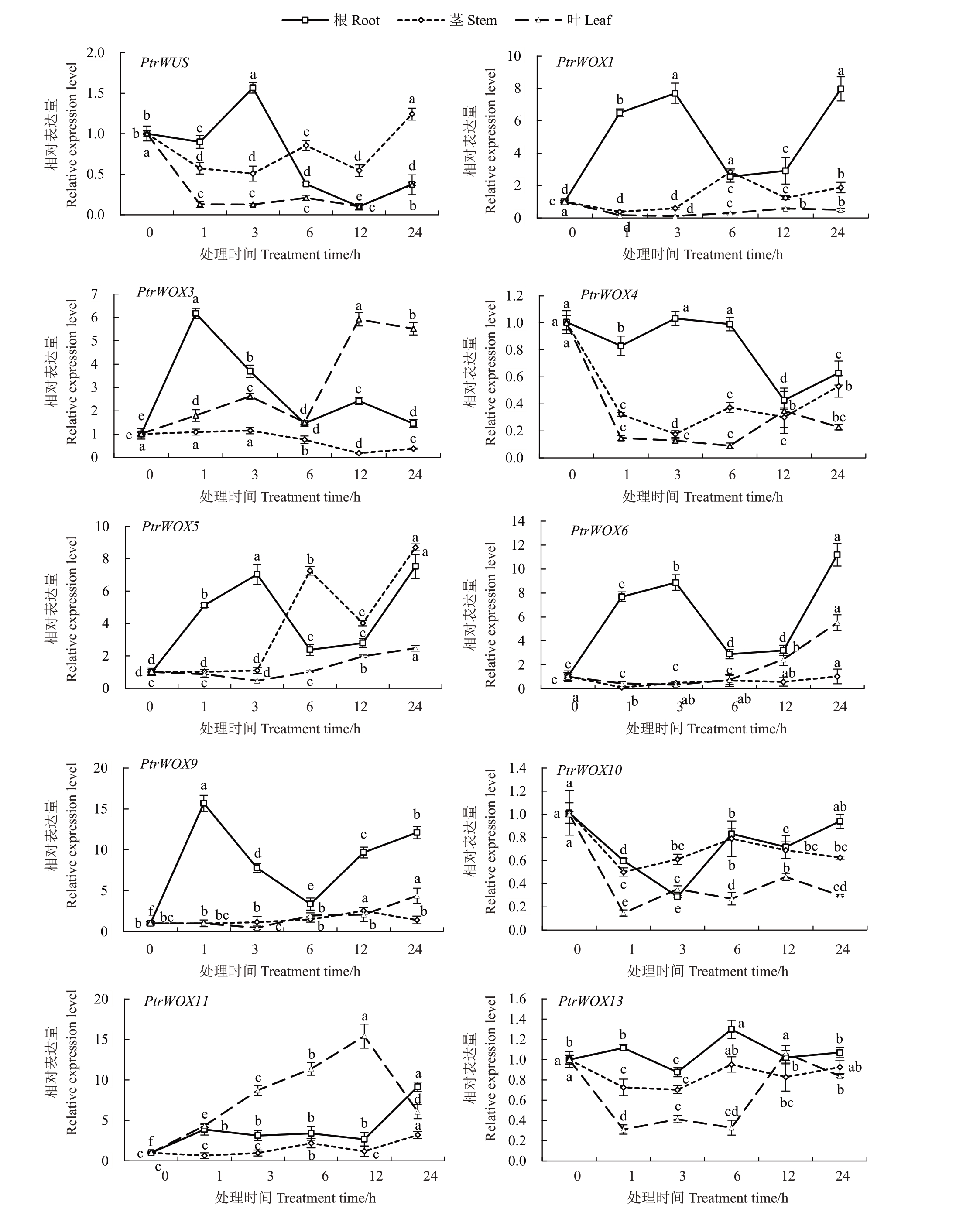
图8 PtrWOXs 在盐胁迫下的表达分析
Fig.8 Expression analysis of PtrWOXs under salt stress
低温处理3 h 后,根中PtrWOX1、PtrWOX5 和PtrWOX6表达量显著上调并达到峰值,6 h时显著下调,6~24 h 时表达量呈现先显著上调后显著下调趋势。这3 个基因在茎中处理6 h 时,表达量达到峰值,随后下调。PtrWOX1 在叶中表达变化不显著。而叶中PtrWOX5 表达在处理后12 h 达到峰值。叶中PtrWOX6 表达在处理6~24 h 后表达量逐渐上调。低温处理1 h 后,PtrWOX3 在叶中表达显著上调,6 h 达到峰值,随后显著下调。在根和茎中,PtrWOX3 表达变化不显著。低温处理后,PtrWOX4和PtrWOX10在根、茎、叶中均呈显著下调趋势。低温处理1 h 后,根中PtrWOX9 表达上升,3 h 达到峰值。叶和茎中PtrWOX9 表达无显著变化。根中PtrWOX11 表达在低温处理1 h 后达到峰值,随后下调。叶中PtrWOX11 和根中PtrWOX13 表达在低温处理1 h 后显著上调,随后显著下调,6 h 后达到峰值,随后再次显著下调。PtrWOX11在茎中表达量无显著变化。茎中PtrWOX13表达在低温处理后呈显著下降趋势。叶中PtrWOX13表达先显著下调后显著上调再显著下调,但各时间点表达量均不超过处理前(图9)。
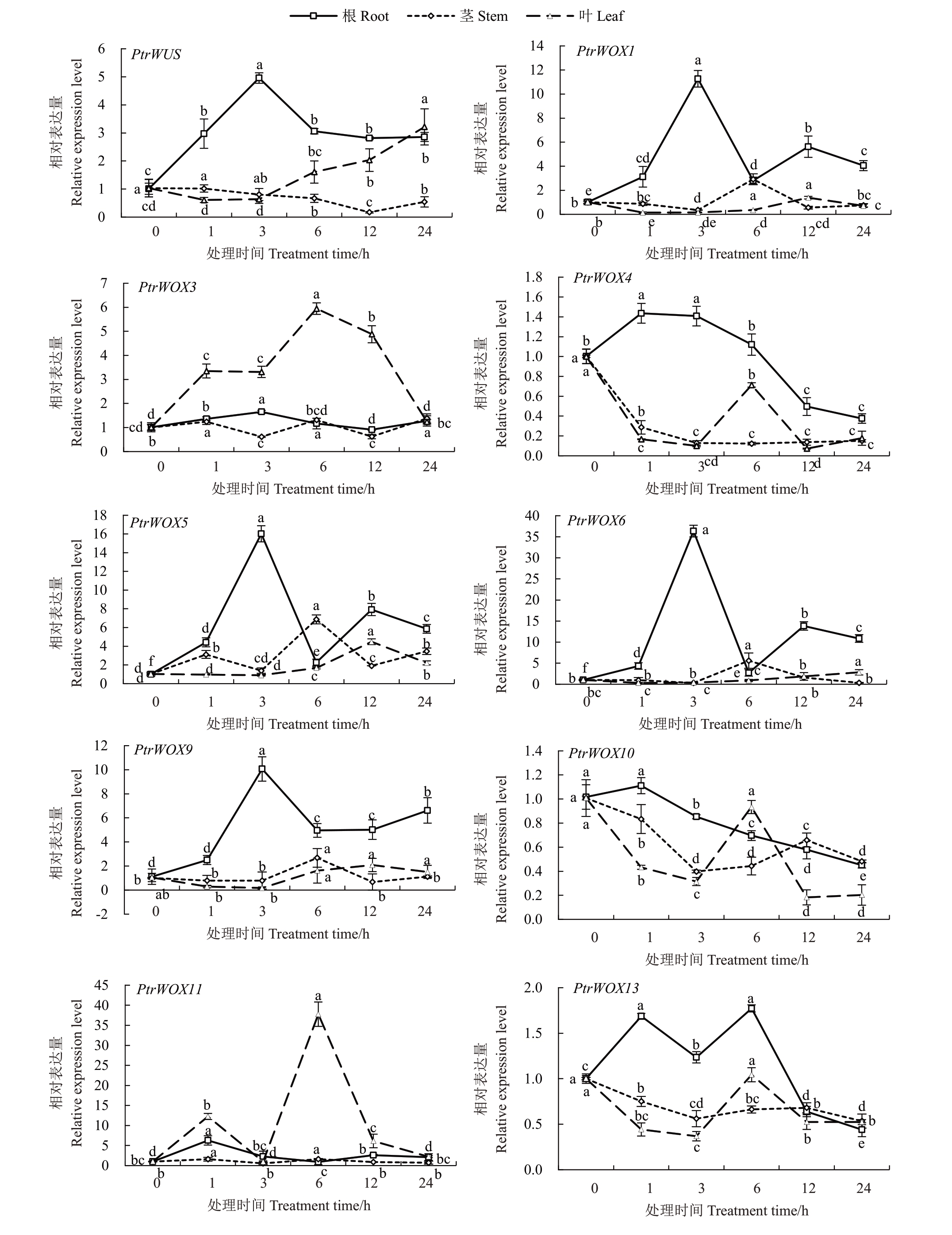
图9 PtrWOXs 在低温胁迫下的表达分析
Fig.9 Expression analysis of PtrWOXs under cold stress
在ABA处理下,根中PtrWUS的表达量在6 h达到峰值,随后显著下调。该基因在茎中表达量高于处理前,在叶中表达量呈现先显著下调后显著上调的变化趋势,但各时间点表达量都不超过处理前。PtrWOX1 和PtrWOX9 在根中的表达量呈显著上调趋势。它们在叶和茎中的表达量无显著变化。ABA处理后,三种组织中的PtrWOX3基因表达量总体上呈先显著上调后显著下调的趋势。ABA 处理后1 h 后,根中的PtrWOX4、PtrWOX11 和PtrWOX13的表达量分别在处理12 h和6 h后达到峰值,随后显著下调。叶和茎中,PtrWOX4 和PtrWOX13 表达变化不显著,且呈显著下调趋势。而PtrWOX11 在叶中的表达量高于处理前。在ABA 处理1 h 后,根和茎中的PtrWOX5表达显著上调,其中茎中PtrWOX5在12 h 达到峰值后再次显著下调。PtrWOX5 在叶中的表达变化不显著。PtrWOX6 的表达量在根中呈波动变化趋势,但在各处理时间点均高于处理前。该基因在叶和茎中表达变化无显著差异。PtrWOX10 的表达量在三种组织中均呈现先显著下调后显著上调再显著下调的趋势,但在处理6 h的茎中,PtrWOX10的表达高于处理前(图10)。

图10 PtrWOXs 在脱落酸胁迫下的表达分析
Fig.10 Expression analysis of PtrWOXs under ABA stress
综上所述,除PtrWOX5 基因在叶、茎和根中均可以被高盐、冷和脱落酸这3 种非生物胁迫诱导表达外,其余枳WOX 家族基因均在不同的组织中被多种非生物胁迫诱导表达。值得注意的是,4 种非生物胁迫处理后,多数枳WOX 家族基因在根中的表达变化程度高于叶和茎中,且PtrWOX1、PtrWOX3、PtrWOX6、PtrWOX9 和PtrWOX11 可以在根中被4种非生物胁迫诱导表达,PtrWOX13基因在根中可以被干旱和高盐这2 种非生物胁迫诱导表达,说明WOX 家族基因可能主要在枳根系抵御非生物胁迫的过程中发挥重要的作用。
3 讨 论
WOX转录因子家族在植物体内广泛存在,目前已在拟南芥[27]、番茄[28]、葡萄[29]、鹰嘴豆[30]、蓖麻[31]、苹果[32]、星油藤[33]、麻疯树[34]、铁皮石斛[35]和甜橙[16]等植物中分别鉴定到15、10、10、17、11、12、9、12、9 和11个成员。本研究利用生物信息学的方法,基于枳全基因组数据库鉴定出了10个枳WOX家族基因。蛋白质理化性质分析结果显示,枳WOX 家族基因编码的蛋白均为不稳定的亲水性蛋白。枳WOX家族蛋白主要定位于细胞核中,表明该家族蛋白主要在细胞核中发挥作用。系统进化树分析结果显示,枳WOX 家族分为3 个进化分支,分别是现代进化分支、中间进化分支和祖先进化分支,这与其他植物WOX家族蛋白进化树分支相同[36]。在枳WOX家族蛋白的系统进化树中,枳与同属柑橘类植物的甜橙和克里曼丁橘的亲缘关系最近,与单子叶植物水稻的亲缘关系远于双子叶植物拟南芥和葡萄,进一步说明植物WOX 家族基因的分化早于物种的分化,这与星油藤WOX 家族基因的结果一致[33]。通过MEME 分析枳WOX 家族蛋白的保守基序,发现所有蛋白均含有Motif 1 和Motif 2,这两个基序组成“螺旋-环-螺旋-转角-螺旋(Helix-loop-helix-turn-helix)”的保守同源异型结构域。枳WOX家族蛋白进化树中每个分支蛋白都有特异性的保守基序,与进化树分类结果相一致,反映了系统发育树分析结果的可靠性。枳WOX 家族基因内含子数目为1~5个。通过MCScanX 对多种植物WOX 家族基因进行共线性比较分析,结果表明枳WOX 家族蛋白与双子叶植物有更近的亲缘关系,这与进化树分析结果一致。密码子偏好性分析显示,枳WOX 家族基因的密码子使用偏好性较弱。
组织特异性表达分析表明,枳WOX 家族基因在叶、茎和根这3个组织中均有表达,其中PtrWUS、PtrWOX1、PtrWOX9 和PtrWOX11 在根中表达量最高。与本研究结果一致,PtrWOX9同源基因小麦Ta-WOX9 在根中表达量较高[37]。而PtrWOX11 在拟南芥中的同源基因AtWOX11[38]和水稻中的同源基因OsWOX11 均具有调控根系发育的功能,表明PtrWOX11 基因也可能在柑橘根系发育中起重要作用。但是,与本研究结果不同,PtrWUS 在甜橙中的同源基因CsWUS在茎中的表达量最高;PtrWOX1的同源基因番茄SlWOX1和葡萄VvWOX1在叶片中表达量较高[28-29]。PtrWOX3和PtrWOX6与星油藤中的同源基因PvoWOX3和PvoWOX6在茎中表达量较高不同。这些结果说明WOX家族基因在不同植物种类中组织表达特异性存在差异。PtrWOX5 与在葡萄中的同源基因VvWOX5/7在叶中有较高表达结果相似。PtrWOX4 在茎中的表达量高于其他组织,与拟南芥AtWOX4 和星油藤PvoWOX4 相似,说明PtrWOX4可能与AtWOX4和PvoWOX4功能类似,参与调控茎形成层分生组织的发育[39-40]。PtrWOX10与它在苹果中的同源基因MdWOX10在茎中表达量高于叶和根的表达模式相同。PtrWOX13 与甜橙CsWOX13同样都在茎中的表达量高于叶片和根,表明它们可能具有相似的功能[16]。有研究表明,植物WOX 家族转录因子在调控植物组织发育以及植物对逆境胁迫的响应过程中起重要的作用[41]。本研究从枳WOX家族基因启动子区域鉴定出多种植物生长发育、激素和逆境胁迫响应相关的调控元件,表明枳WOX家族基因可能也具有调控柑橘组织生长发育及逆境响应等功能。为进一步验证枳WOX家族基因对非生物胁迫的响应,使用qRT-PCR检测了干旱、高盐、低温和ABA处理后枳WOX家族基因在枳叶、茎、根中的表达模式。研究结果表明,在高盐、低温和脱落酸这3 种非生物胁迫处理后,PtrWOX5 基因在叶、茎和根中的表达均显著上升,说明PtrWOX5 基因可能在枳响应非生物胁迫过程中发挥了重要的作用。与本研究结果一致,水稻Os-WOX5 能被盐胁迫诱导后表达上调[42]。有研究表明,蒺藜苜蓿MtWOX1 在干旱、高盐和ABA 处理条件下表达量显著上升[30]。水稻中OsWOX9B 在低温处理后的根中表达量显著提高[10,42]。水稻OsWOX11基因具有增强转基因植物根系发育和抗旱性的功能[14]。与前人的报道类似,本研究表明PtrWOX1、PtrWOX6、PtrWOX9 和PtrWOX11 基因在根中表达量最高,且主要在根中被4 种非生物胁迫强烈诱导表达,说明这些基因可能通过调控根系发育来响应非生物胁迫。PtrWOX13 基因在根中可以被干旱和高盐诱导表达。与本研究结果类似,PtrWOX13 在麻疯树中的同源基因JcWOX6在根中也能对干旱和盐胁迫作出响应[34]。值得注意的是,有些枳WOX基因在不同的组织中表达模式不同。例如,4 种非生物胁迫处理后,PtrWOX4 和PtrWOX13 在叶和茎中下调表达。但是在根中,PtrWOX4 和PtrWOX13 分别可以被1种和2种非生物胁迫诱导表达,说明这两个基因在不同的组织中对非生物胁迫的响应不同。
本研究在全基因组水平对枳WOX家族基因进行了鉴定和详细的生物信息学分析。同时,对枳WOX 家族基因组织表达特性和在不同组织中对非生物胁迫的响应进行了研究,筛选出了可以响应非生物胁迫的枳WOX 家族基因,为进一步鉴定枳WOX家族基因调控柑橘抗逆性的功能提供了依据。
[1] BECHTOLD U,FIELD B. Molecular mechanisms controlling plant growth during abiotic stress[J]. Journal of Experimental Botany,2018,69(11):2753-2758.
[2] VAN DER GRAAFF E,LAUX T,RENSING S A.The WUS homeobox-containing(WOX) protein family[J]. Genome Biology,2009,10(12):248.
[3] ZHANG X,ZONG J,LIU J H,YIN J Y,ZHANG D B.Genomewide analysis of WOX gene family in rice,sorghum,maize,Arabidopsis and poplar[J]. Journal of Integrative Plant Biology,2010,52(11):1016-1026.
[4] SCHOOF H,LENHARD M,HAECKER A,MAYER K F X,JÜRGENS G,LAUX T. The stem cell population of Arabidopsis shoot meristems is maintained by a regulatory loop between the CLAVATA and WUSCHEL genes[J]. Cell,2000,100(6):635-644.
[5] SHIMIZU R,JI J B,KELSEY E,OHTSU K,SCHNABLE P S,SCANLON M J.Tissue specificity and evolution of meristematic WOX3 function[J].Plant Physiol,2009,149(2):841-850.
[6] HIRAKAWA Y,KONDO Y,FUKUDA H.TDIF peptide signaling regulates vascular stem cell proliferation via the WOX4 homeobox gene in Arabidopsis[J]. The Plant Cell,2010,22(8):2618-2629.
[7] DEVEAUX Y,TOFFANO-NIOCHE C,CLAISSE G,THAREAU V,MORIN H,LAUFS P,MOREAU H,KREIS M,LECHARNY A. Genes of the most conserved WOX clade in plants affect root and flower development in Arabidopsis[J].BMC Evolutionary Biology,2008,8(1):291.
[8] PARK S O,ZHENG Z G,OPPENHEIMER D G,HAUSER B A. The PRETTY FEW SEEDS2 gene encodes an Arabidopsis homeodomain protein that regulates ovule development[J]. Development,2005,132(4):841-849.
[9] KONG D,HAO Y,CUI H. The WUSCHEL related homeobox protein WOX7 regulates the sugar response of lateral root development in Arabidopsis thaliana[J]. Molecular Plant,2016,9(2):261-270.
[10] WU X L,DABI T,WEIGEL D.Requirement of homeobox gene STIMPY/WOX9 for Arabidopsis meristem growth and maintenance[J].Currenr Biology,2005,15(5):436-440.
[11] UEDA M,ZHANG Z,LAUX T. Transcriptional activation of Arabidopsis axis patterning genes WOX8/9 links zygote polarity to embryo development[J]. Developmental Cell,2011,20(2):264-270.
[12] LIU J C,SHENG L H,XU Y Q,LI J Q,YANG Z N,HUANG H,XU L.WOX11 and 12 are involved in the first-step cell fate transition during de novo root organogenesis in Arabidopsis[J].The Plant Cell,2014,26(3):1081-1093.
[13] ZHAO Y,HU Y F,DAI M Q,HUANG L M,ZHOU D X. The WUSCHEL-related homeobox gene WOX11 is required to activate shoot-borne crown root development in rice[J]. Plant Cell,2009,21(3):736-748.
[14] JIANG W,ZHOU S L,ZHANG Q,SONG H Z,ZHOU D X,ZHAO Y. Transcriptional regulatory network of WOX11 is involved in the control of crown root development,cytokinin signals,and redox in rice[J]. Journal of Experimental Botany,2017,68(11) :2787-2798.
[15] ROMERA-BRANCHAT M,RIPOLL J J,YANOFSKY M F,PELAZ S. The WOX13 homeobox gene promotes replum formation in the Arabidopsis thaliana fruit[J]. The Plant Journal,2013,73(1):37-49.
[16] KHAN F S,ZENG R F,GAN Z M,ZHANG J Z,HU C G. Genome-wide identification and expression profiling of the WOX gene family in Citrus sinensis and functional analysis of a CsWUS member[J]. International Journal of Molecular Sciences,2021,22(9):4919.
[17] XU Q,CHEN L L,RUAN X A,CHEN D J. The draft genome of sweet orange(Citrus sinensis)[J]. Nature Genetics,2013,45(1):59-66.
[18] ARTIMO P,JONNALAGEDDA M,ARNOLD K,BARATIN D,CSARDI G,DE CASTRO E,DUVAUD S,FLEGEL V,FORTIER A,GASTEIGER E,GROSDIDIER A,HERNANDEZ C,IOANNIDIS V,KUZNETSOV D,LIECHTI R,MORETTI S,MOSTAGUIR K,REDASCHI N,ROSSIER G,XENARIOS I,STOCKINGER H. ExPASy:SIB bioinformatics resource portal[J]. Nucleic Acids Research,2012,40(W1):W597-W603.
[19] HORTON P,PARK K J,OBAYASHI T,FUJITA N,HARADA H,ADAMS-COLLIER C J,NAKAI K. WoLF PSORT:Protein localization predictor[J]. Nucleic Acids Research,2007,35(W1):W585-W587.
[20] KUMAR S,STECHER G,TAMURA K. MEGA7:Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J].Molecular Biology and Evolution,2016,33(7):1870-1874.
[21] BAILEY T L,WILLIAMS N,MISLEH C,LI W W.MEME:discovering and analyzing DNA and protein sequence motifs[J].Nucleic Acids Research,2006,34(W1):W369-W373.
[22] LESCOT M,DHAIS P,THIJS G,MARCHAL K,MOREAU Y,VAN P,ROUZ P,ROMBAUTS S. PlantCARE,a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Research,2002,30(1):325-327.
[23] CHEN C,CHEN H,ZHANG Y,THOMAS H R,FRANK M H,HE Y H,XIA R. TBtools- an integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant,2020,13(8):1194-1202.
[24] DAI X B,ZHUANG Z H,ZHAO P X C. psRNATarget:a plant small RNA target analysis server(2017 release)[J]. Nucleic Acids Research,2018,46(W1):W49-W54.
[25] LIAN G B,DING Z W,WANG Q,ZHANG D B,XU J.Origins and evolution of WUSCHEL-related homeobox protein family in plant kingdom[J].The Scientific World Journal,2014(2):983-990.
[26] MUKHERJEE K,BROCCHIERI L,BÜRGLIN T R.A comprehensive classification and evolutionary analysis of plant homeobox genes[J]. Molecular Biology and Evolution,2009,26(12):2775-2794.
[27] HAECKER A,GROSS-HARDT R,GEIGES B,SARKAR A,BREUNINGER H,HERRMANN M,LAUX T. Expression dynamics of WOX genes mark cell fate decisions during early embryonic patterning in Arabidopsis thaliana[J]. Development,2004,131(3):657-668.
[28] 李晓旭,刘成,李伟,张增林,高晓明,周慧,郭永峰. 番茄WOX 转录因子家族的鉴定及其进化、表达分析[J].遗传,2005,38(5):444-460.LI Xiaoxu,LIU Cheng,LI Wei,Zhang Zenglin,GAO Xiaoming,ZHOU Hui,GUO Yongfeng. Genome-wide identification,phylogenetic analysis and expression profiling of the WOX family genes in Solanum lycopersicum[J]. Hereditas,2016,38(5):444-460.
[29] 王鹏飞,吴新颖,杨立英,王显苏,张倩倩,陈迎春,王珊,慕茜,陈万钧,王咏梅. 葡萄WUSCHEL-related homeobox(WOX)家族基因鉴定与分析[J].中外葡萄与葡萄酒,2018(3):16-23.WANG Pengfei,WU Xinyin,YANG Liying,WANG Xiansu,ZHANG Qianqian,CHEN Yingchun,WANG Shan,MU Qian,CHEN Wanjun,WANG Yongmei. Identification and ananlysis of grape WUSCHEL-related homebox(WOX) family genes[J].Sino-Overseas Grapevine&Wine,2018(3):16-23.
[30] 张洪涛.鹰嘴豆WOX 转录因子基因家族全基因组分析[J].分子植物育种,2018,16(10):3113-3120.ZHANG Hongtao. Genomic analysis of chicckpea WOX transcription factor gene family[J].Molecular Plant Breeding,2018,16(10):3113-3120.
[31] 韩雯毓,李国瑞,风兰,闫星伊,白英俊,李孟建,孙佳欣,陈永胜.蓖麻WOX 转录因子家族成员的全基因组分析及逆境胁迫响应[J].核农学报,2019,33(10):1921-1927.HAN Wenyu,LI Guorui,FENG Lan,YAN Xingyi,BAI Yingjun,LI Mengjian,SUN Jiaxin,CHEN Yongsheng. Genomewide analysis of members of the castor bean WOX transcription factor family and their response to stress[J]. Journal of Nuclear Agricultural Sciences,2019,33(10):1921-1927.
[32] 王楚堃,韩朋良,王咏梅,王鹏飞,胡大刚. 苹果WUSCHELrelated homeobox(WOX)家族基因的鉴定与分析[J].园艺学报,2019,46(6):1021-1032.WANG Chukun,HAN Pengliang,WANG Yongmei,WANG Pengfei,HU Dagang. Genome-wide identification and analysis of apple WUSCHEL-related homeobox(WOX) family genes[J].Acta Horticulturae Sinica,2019,46(6):1021-1032.
[33] 郭亚静,付乾堂,胡晓笛,陈茂盛,潘帮珍,陶彦彬,何惠英,徐增富.星油藤WOX 基因家族成员的鉴定及其表达谱分析[J].分子植物育种,2020,18(12):3907-3915.GUO Yajing,FU Qiantang,HU Xiaodi,CHEN Maosheng,PAN Bangzhen,TAO Yanbin,HE Huiyin,XU Zengfu. Identification and expression analysis of WOX family genes in Sacha Inchi(Plukenetia volubilis) [J]. Molecular Plant Breeding,2020,18(12):3907-3915.
[34] TANG Y H,LI H,GUAN Y X,LI S,XUN C F,DONG Y Y,HUO R,GUO Y X,BAO X X,PEI E Q,SHEN Q M,ZHOU H,LIAO J J. Genome-wide identification of the physic nut WUSCHEL-Related homeobox gene family and functional analysis of the abiotic stress responsive gene JcWOX5[J]. Frontiers in Genetics,2020,11:670.
[35] 曾丹琦,张明泽,何春梅,王浩斌,俞振明,司灿,赵聪慧,李冬妹,段俊.铁皮石斛WOX 转录因子的鉴定和分析[J].热带亚热带植物学报,2021,29(3):301-310.ZENG Danqi,ZHANG Mingze,HE Chunmei,WANG Haobin,YU Zhenming,SI Can,ZHAO Conghui,LI Dongmei,DUAN Jun. Identification and analysis of WOX transcription factor in den-drobium officinale[J]. Journal of Tropical and Subtropical Botany,2021,29(3):301-310.
[36] HOLLAND PW H.Evolution of homeobox genes[J].Wiley Interdisciplinary Reviews-Developmental Biology,2012,2(1):31-45.
[37] LI Z,LIU D,XIA Y,LI Z L,JING D D,DU J J,NIU N,SHOUCAI M,WANG J W,SONG Y L,YANG Z Q,ZHANG G H.Identification of the WUSCHEL- Related Homeobox(WOX)Gene family,and interaction and functional analysis of Ta-WOX9 and TaWUS in wheat[J].International Journal of Molecular Sciences,2020,21(5):1581.
[38] ZHANG Z J,LAUX T. The asymmetric division of the Arabidopsis zygote:From cell polarity to an embryo axis[J]. Sexual Plant Reproduction,2011,24(2):161-169.
[39] SUER S,AGUSTI J,SANCHEZ P,SCHWARZ M,GREB T.WOX4 imparts auxin responsiveness to cambium cells in Arabidopsis[J].Plant Cell,2011,233(9):3247-3259.
[40] KUCUKOGLU M,NILSSON J,ZHENG B,CHAABOUNI S,NILSSON O. WUSCHEL-RELATED HOMEOBOX4(WOX4)-like genes regulate cambial cell division activity and secondary growth in Populus trees[J]. New Phytologist,2017,215(2):642-657.
[41] PARK J,AHMED N U,JUNG H,ARASAN S K,CHUNG M,CHO Y,WATANABE M,NOU I. Identification and characterization of LIM gene family in Brassica rapa[J]. BMC Genomics,2014,15(1):641.
[42] CHENG S F,HUANG Y L,ZHU N,ZHAO Y. The rice WUSCHEL-related homeobox genes are involved in reproductive organ development,hormone signaling and abiotic stress response[J].Gene,2014,549(2):66-74.