沃柑(Orah)是坦普尔橘橙和丹西红橘的杂交品种,由中国农业科学院柑桔研究所引进,具高产、优质等特点[1]。近年来,沃柑已成为我国发展速度最快的晚熟柑橘品种,但对柑橘溃疡病极敏感,感病后易造成严重减产、品质不佳等不良后果[2]。柑橘溃疡病(Citrus bacterial canker,CBC)是由地毯草黄单胞菌柑橘致病变种(Xanthomonas citri subsp.citri,Xcc)引起的一种世界性检疫性病害,目前对柑橘溃疡病菌的遗传背景已有大量研究[3]。该病原菌侵入寄主植物后常定殖于维管束与细胞间隙,通常只侵染发展到一定阶段的幼嫩组织,侵染后轻则引起落叶、落果,重则导致植株死亡[4]。目前生产上主要通过喷施化学药剂和改善栽培措施来防治柑橘溃疡病,但防治效果不佳,并未从根本上解决问题[5]。利用植物自身抗病基因培育抗病品种是有效安全地控制病害的重要措施之一[6]。潘贞珍等[7]在沃柑叶片结构和生化物质与柑橘溃疡病抗性的相关性方面已做了一定研究,为抗溃疡病种质资源创新利用和抗病品种早期选择提供了参考,但对沃柑的具体感病机制仍不清楚。
利用RNA-Seq 技术在转录组水平分析挖掘抗病基因的研究已在猕猴桃[8]、葡萄[9]、柑橘[10]等果树中展开。筛选出了一些抗感溃疡病的基因,并探明了这些基因的功能和作用机制,初步构建了柑橘响应溃疡病侵染的抗性调控网络。如华中农业大学研究者利用抗病品种金橘和感病品种甜橙做比较,运用转录学分析这两个品种对溃疡病菌的差异表达基因,分别发现了794和1324个差异表达基因,为深入了解溃疡病的反应提供了信息基础[11]。西南大学和中国农业科学院柑桔研究所的研究者们对抗感溃疡病的基因也做了多方面的研究,通过对抗感溃疡病基因进行基因功能分析和作用机制探明,初步构建了柑橘响应柑橘溃疡病侵染的抗性调控网络。如:Zou 等[12]以溃疡病易感品种万金城橙为外植体,构建CsLOB1过表达和RNAi-沉默的转基因植株进行研究,结果表明溃疡病感病基因CsLOB1 是通过调节细胞壁重塑和植物激素信号通路的细胞增生来促进感病的。王丽娟等[13]对柑橘溃疡病感病基因Cs-WRKY22进行基因功能研究,结果表明CsWRKY22可能受到病原菌、光信号、生长素、赤霉素和脱落酸等多种信号途径的调控,进而增强柑橘的抗病能力。Li 等[14]对柑橘溃疡病抗性基因CsPrx25 进行研究,结果显示CsPrx25 是一个典型的过氧化物酶基因,可通过调控转基因植株PRX和SOD的活性重建植株活性氧水平,促进超敏反应,提高植株的溃疡病抗性。因此,利用转录组技术更好地研究柑橘与病原菌互作时分子水平上的变化,进而推测其互作机制并挖掘出相关抗病基因,有助于更好地了解柑橘溃疡病的抗感机制,促进柑橘抗病育种的发展。
当前采用抗性品种及感病品种作为研究材料来探明溃疡病侵染后的分子机制已有报道,但针对极感病品种沃柑的相关研究还未见报道。沃柑是广西第二大主栽品种,栽培面积约13.33 万hm2,挖掘重要的抗感病基因,对沃柑产业健康发展和抗病育种具有重要意义。笔者在本研究中以极易感病沃柑为试材,分别对接种后0、2、4、6和8 d的沃柑叶片转录组表达进行分析,研究了溃疡病菌侵染易感品种沃柑后不同时间节点下转录组的表达情况,研究结果为阐明柑橘感病品种溃疡病抗性差异的分子机制提供了新视角,为柑橘抗溃疡病育种提供基因基础和理论参考。
1 材料和方法
1.1 材料
供试材料为5 年生沃柑植株,地点位于广西大学农学院科研基地。
1.2 柑橘溃疡病菌的分离纯化
摘取有典型柑橘溃疡病病斑的沃柑叶片,用75%的酒精擦洗干净叶表面,并用无菌水冲洗3次,擦干。用已灭菌的剪刀剪下1 cm2左右的带病斑的叶片放入已灭菌的研钵中,加入1 mL的无菌水研磨成匀浆,将匀浆转入无菌离心管中,4000 r·min-1离心1 min,留上清液。用接种环蘸取上清液接种于NA培养基上,2 d后可见明显菌落,挑取具有典型柑橘溃疡病病菌菌落特征的单菌落进行多次纯化后保存备用。
1.3 柑橘溃疡病菌的分子生物学鉴定
1.3.1 病原菌DNA的提取 使用Biospin细菌基因组DNA抽提试剂盒提取病原菌的DNA。
1.3.2 对病原菌进行16S/23S、gyrB 基因的序列分析 以提取的病原菌的DNA为模板,用不同的特异性引物对其进行PCR 扩增。本文所用引物为Sylvain 等[15]针对16S/23S 的部分基因设计的P-X-16SFb/P-X-23S-Rb,高爽等[16]针对gyrB基因设计的引物对GGS1F/GGS2R(引物详情见表1)。
表1 PCR 引物表
Table 1 The primer sequence of PCR
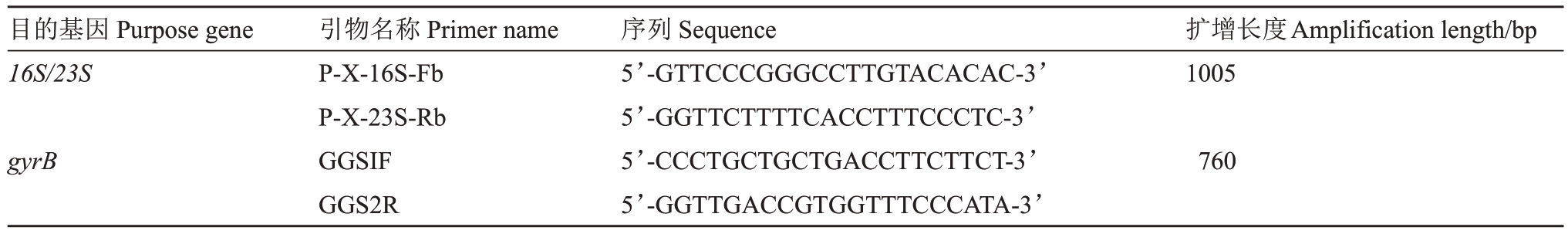
目的基因Purpose gene 16S/23S扩增长度Amplification length/bp 1005 gyrB引物名称Primer name P-X-16S-Fb P-X-23S-Rb GGSIF GGS2R序列Sequence 5’-GTTCCCGGGCCTTGTACACAC-3’5’-GGTTCTTTTCACCTTTCCCTC-3’5’-CCCTGCTGCTGACCTTCTTCT-3’5’-GGTTGACCGTGGTTTCCCATA-3’760
PCR 反应体系总体积为25 μL,其中包含上下引物各1 μL、2.5 μL 的10×PCR Buffer 缓冲液(含Mg2+)、0.5 μL的Taq polymerase、0.5 μL的10 mmol·L-1 dNTP、DNA模板2 μL、其余体积为ddH2O。
对不同的特异性引物对进行PCR扩增结束后,每份样品取5 μL 产物配3 μL DNA Marker 进行1%琼脂糖凝胶电泳检测,观察电泳结果,确认扩增成功后,将产物送往上海生工测序,将返回序列在NCBI用BLAST对比分析。
1.4 采样及样本的制备
选取长势良好、树体健壮的沃柑植株统一进行重剪,待整齐出梢后,以叶脉为中心,采用活体注射接种法在叶片一侧接种无菌水作为对照(CK),另一侧接种柑橘溃疡病菌作为试验处理(JZY)。分别于接种后0、2、4、6、8 d 进行采样,每个样品设3 次重复,并记录观察发病情况。用无菌水冲洗干净接种叶片,剪去叶脉,将对照样(CK)和试验处理样(JZY)分别用锡纸包好,液氮处理后放入-80 ℃保存。
1.5 RNA提取、文库构建及测序
采用Trizol法提取基因组柑橘总RNA。转录组的测序工作由北京诺禾致源生物信息科技有限公司处理完成。质量合格的mRNA 经由Oligo(dT)的磁珠富集,fragmentation buffer 打断成短片段,依序合成cDNA,经由AMPure XP beads 筛选片段、PCR 扩增得到最终文库。使用测序平台Novaseq 6000获得原始数据,质控后得到clean reads。
1.6 差异表达基因筛选
基因表达水平阈值选用FPKM>1。clean reads用DESeq 标准化后使用DESeq 软件进行差异表达分析,使用BH计算FDR,负二项分布计算pvalue,差异基因筛选标准为p值<0.05。
1.7 差异表达基因GO富集分析
通过GOseq 软件对差异基因进行GO 富集分析,并基于Gene Ontology 对差异基因进行功能注释。使用阈值:FDR≤0.05。
1.8 差异表达基因KEGG富集分析
使用KOBAS(2.0)进行Pathway富集分析,并基于KEGG 数据库对所得差异基因进行代谢途径分析。使用阈值:Corrected p-Value<0.05。
1.9 qRT-PCR验证
随机选取两个在接种后2、4、6 和8 d 时均表达差异的基因,验证其在接种后2、4、6 和8 d 时表达量,RNA提取方法仍采用Trizol法,使用18srRNA作为内参基因,采用2-△CT法,并换算为log2FC,计算基因相对表达水平,引物序列见表2。
表2 PCR 引物信息
Table 2 The primer sequence of PCR
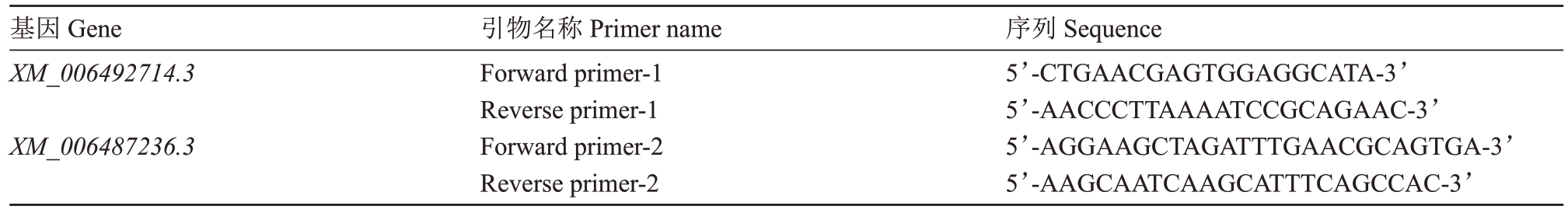
基因Gene XM_006492714.3 XM_006487236.3引物名称Primer name Forward primer-1 Reverse primer-1 Forward primer-2 Reverse primer-2序列Sequence 5’-CTGAACGAGTGGAGGCATA-3’5’-AACCCTTAAAATCCGCAGAAC-3’5’-AGGAAGCTAGATTTGAACGCAGTGA-3’5’-AAGCAATCAAGCATTTCAGCCAC-3’
2 结果与分析
2.1 病原菌的分离纯化及鉴定
2.1.1 病原菌的分离纯化 从广西大学科研基地采集病叶,柑橘溃疡病在基地发病状况如图1-A~B。稀释分离柑橘溃疡病菌,1 d可见培养基上长出散落微小菌落,2 d 可见颜色大小不一的菌落,从中挑选出具有典型柑橘溃疡病菌菌落形态的单菌落进行纯化。柑橘溃疡病菌在NA 培养基上生长呈现出黄色、隆起、有光泽、质地黏稠的菌落形态(图1-C)。

图1 沃柑溃疡病田间症状及分离后菌落形态
Fig.1 Orah field symptom map of citrus canker
A.沃柑叶片田间发病症状;B.沃柑果实田间发病症状;C.柑橘溃疡病菌在NA 培养基上培养的菌落形态。
A.Orah canker symptom of leaf in field; B.Orah canker symptoms of fruit in the field; C.Colony morphology of Xanthomonas citri subsp. citri cultured on NA medium.
2.1.2 病原菌的分子生物学鉴定 提取出病原菌的DNA 后,用GGS1F/GGS2R、P-X-16S-Fb/P-X-23S-Rb 这两对特异性引物来进行PCR 扩增检测。电泳结果如图2,可知待测菌株由引物GGS1F/GGS2R扩增出来的片段在750 bp附近,与柑橘溃疡病菌在该引物下扩增出的条带大小760 bp 相吻合。引物P-X-16S-Fb/P-X-23S-Rb 扩增出的条带在1000 bp附近,与柑橘溃疡病菌在该引物下扩增出的条带大小1005 bp相吻合。可初步判定病原菌为柑橘溃疡病菌。将PCR产物送上海生工测序,用所得序列上传NCBI 的GenBank 数据库,登录号为MH276957、MH276956。与公开已知的柑橘溃疡病菌全长序列进行Blsat比对,同源性达99%。结合特异性引物PCR扩增电泳结果,可推断分离出来的病原菌为柑橘溃疡病菌(Xanthomonas citri subsp.citri)。
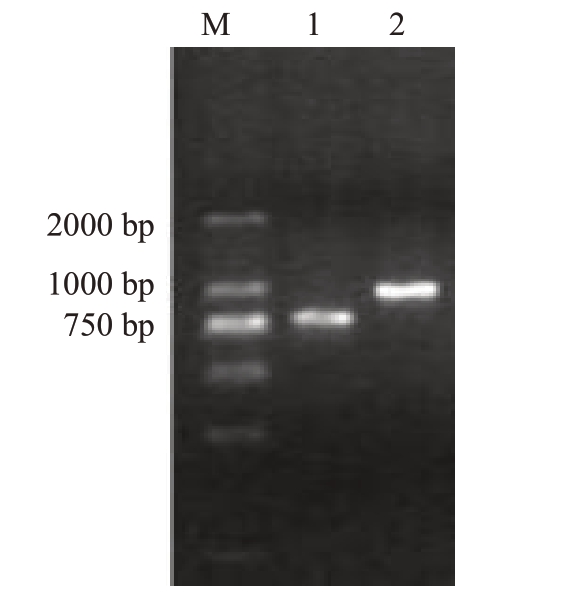
图2 不同引物PCR 扩增电泳
Fig.2 PCR amplification electrophoresis with different primers
M.DNA Mark;1.GGS1F/GGS2R 引物对;2.P-X-16S-Fb/P-X-23SRb 引物对。
M.DNA Mark; 1.GGS1F/GGS2R Primer pairs; 2.P-X- 16S-Fb/PX-23S-Rb Primer pairs.
2.2 转录组数据质量分析
对接种溃疡病菌后0、2、4、6 和8 d 的沃柑叶片样品进行转录组测序,每个样品3次重复,所得数据取重复均值后得表3。从碱基含量与错误率等方面对原始数据进行了质量评估。其中,获得原始数据在46 538 959~54 504 629 之间,约有97%为过滤序列;Q 值均大于93%,转录组测序质量达标,所得数据可用于后续各类分析。将Clean reads比对到甜橙基因组上,比对率在92%左右。各样品的CG 含量约为43%。
表3 沃柑响应溃疡病不同时段的转录组测序数据质量分析
Table 3 Quality analysis of transcriptome sequencing data treated at indicated post inoculation days of Xanthomonas citri subsp.citri
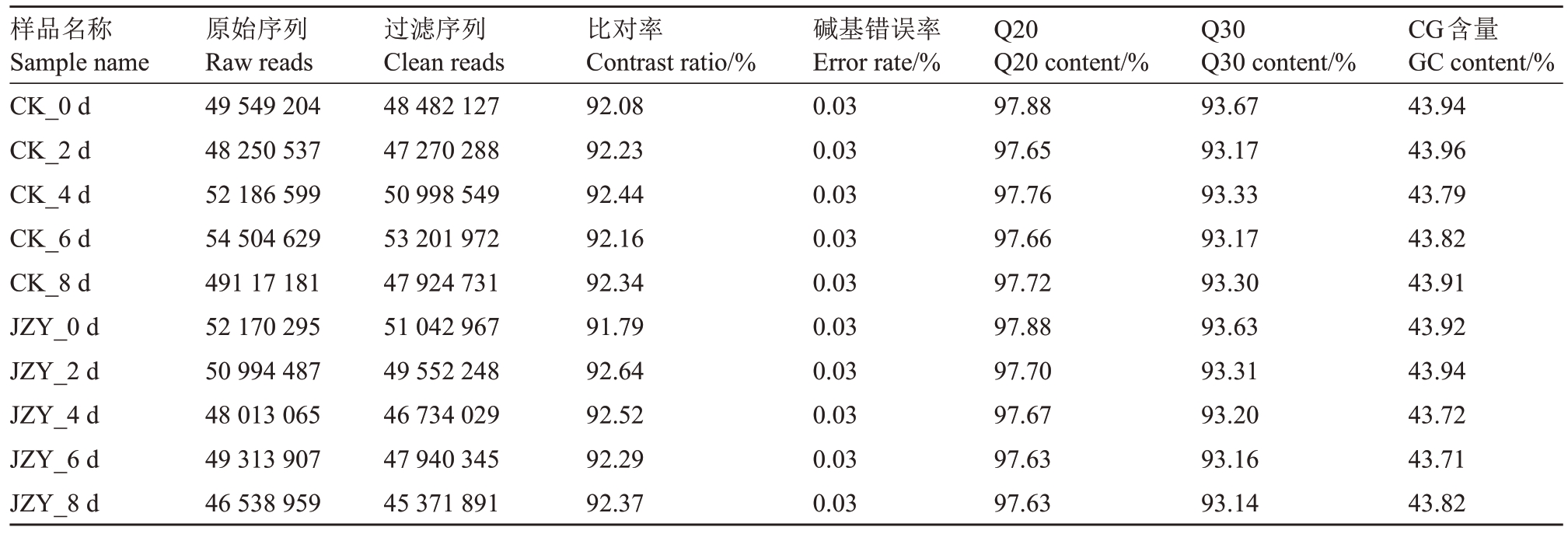
样品名称Sample name CK_0 d CK_2 d CK_4 d CK_6 d CK_8 d JZY_0 d JZY_2 d JZY_4 d JZY_6 d JZY_8 d原始序列Raw reads 49 549 204 48 250 537 52 186 599 54 504 629 491 17 181 52 170 295 50 994 487 48 013 065 49 313 907 46 538 959过滤序列Clean reads 48 482 127 47 270 288 50 998 549 53 201 972 47 924 731 51 042 967 49 552 248 46 734 029 47 940 345 45 371 891比对率Contrast ratio/%92.08 92.23 92.44 92.16 92.34 91.79 92.64 92.52 92.29 92.37碱基错误率Error rate/%0.03 0.03 0.03 0.03 0.03 0.03 0.03 0.03 0.03 0.03 Q20 Q20 content/%97.88 97.65 97.76 97.66 97.72 97.88 97.70 97.67 97.63 97.63 Q30 Q30 content/%93.67 93.17 93.33 93.17 93.30 93.63 93.31 93.20 93.16 93.14 CG含量GC content/%43.94 43.96 43.79 43.82 43.91 43.92 43.94 43.72 43.71 43.82
2.3 差异表达基因分析
由火山图可知,接种后0 d(图3-A),DEGs总数达到2个,其中表达水平上调1个,下调1个;接种后2 d(图3-B),DEGs总数达到1290个,其中表达水平上调947 个,下调343 个;接种后4 d(图3-C),DEGs总数达到1834 个,其中表达水平上调1081 个,下调753 个;接种后6 d(图3-D),DEGs 总数达到959 个,其中表达水平上调656 个,下调303 个;接种后8 d(图3-E),DEGs 总数达到4016 个,其中表达水平上调2108个,下调1908个。
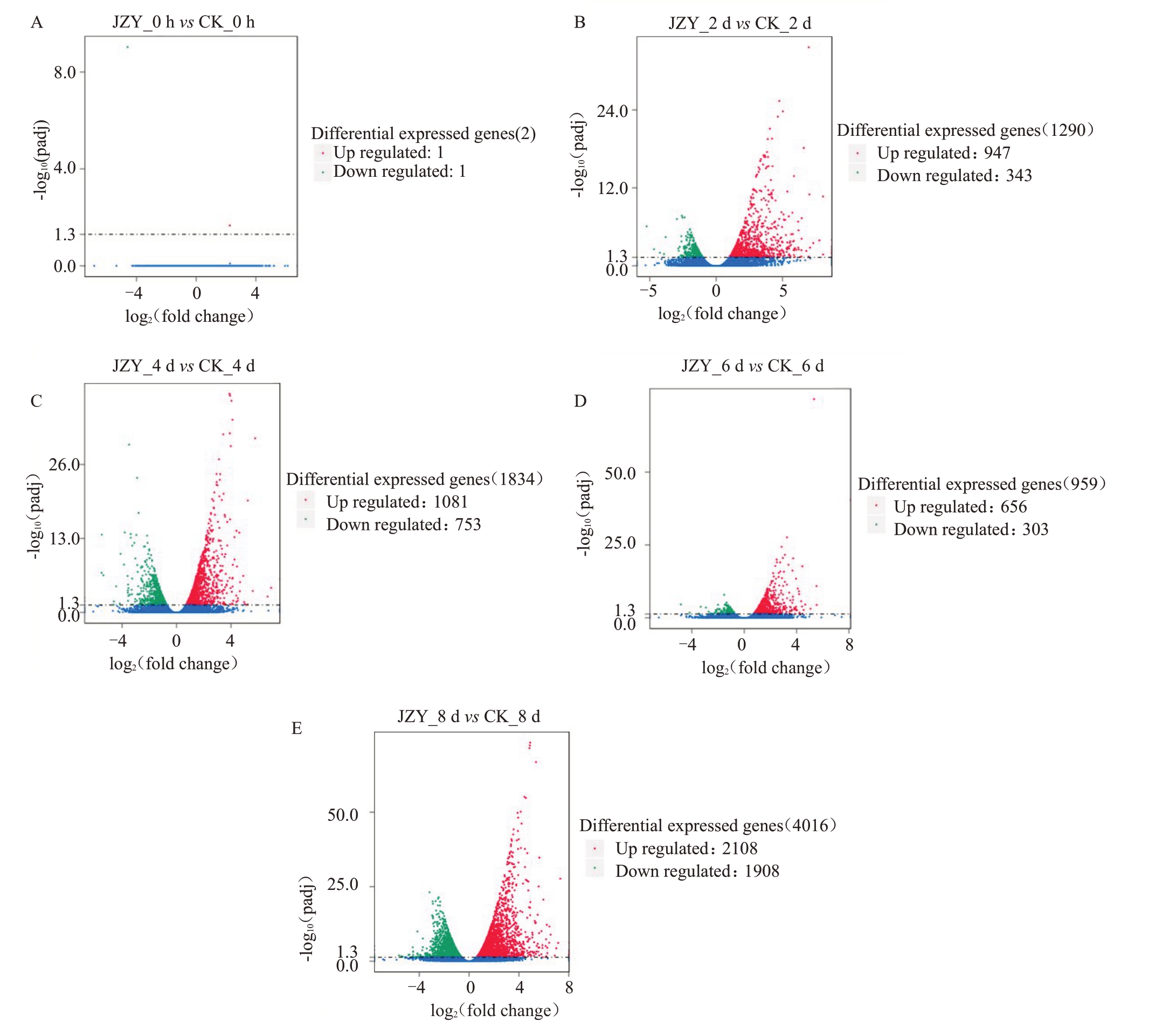
图3 差异基因火山图
Fig.3 Volcano map of differential genes
2.4 差异表达基因韦恩图
对readcount进行标准化后,差异基因筛选标准采用p <0.05。对各组差异基因进行韦恩图分析(图4),可知共有374个差异基因在接种后2、4、6和8 d时均差异显著。
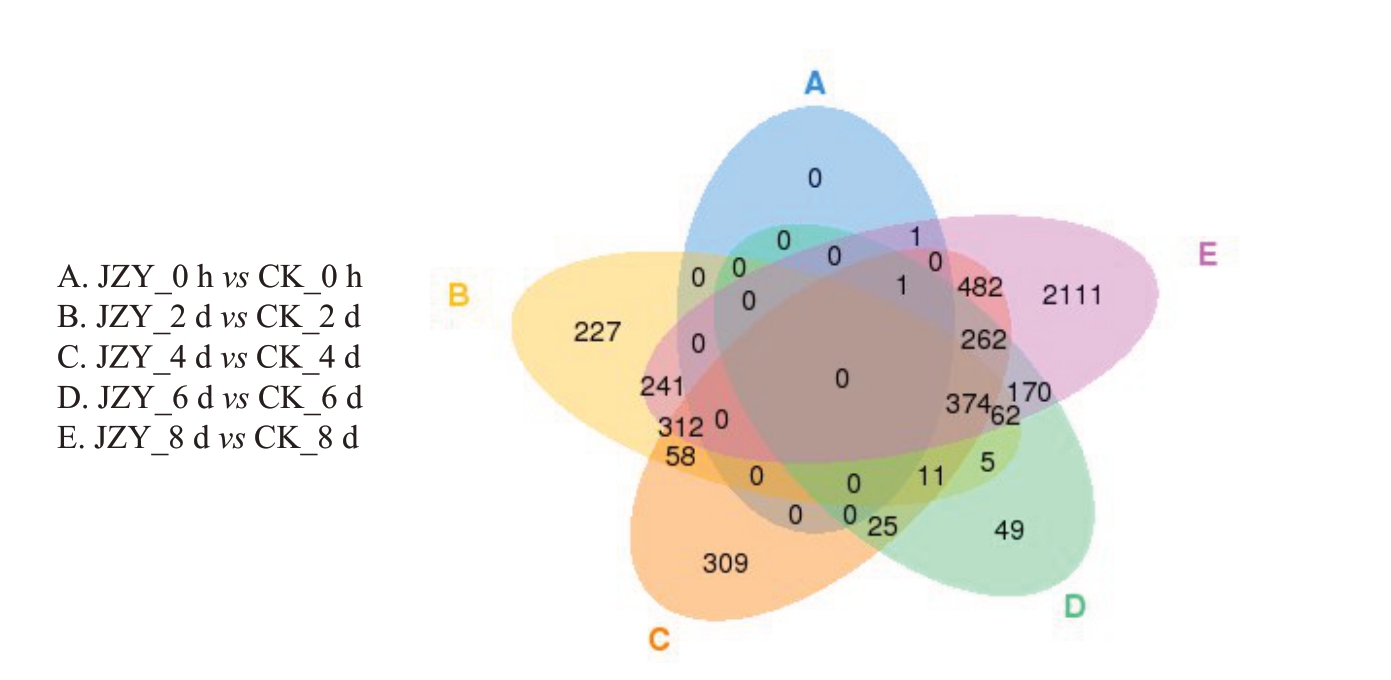
图4 差异表达基因维恩图
Fig.4 Venn diagram of differentially expressed genes
2.5 差异表达基因GO功能富集分析
为找出沃柑响应柑橘溃疡病菌的入侵所表达的差异基因的主要功能,本试验对各样本的转录组中的差异基因进行了GO 功能富集分析,富集分析结果如图5 所示。JZY_0 h vs CK_0 h 的GO 功能富集分析结果显示(图5-A),仅一个基因富集到分子功能,涉及条目为蛋白质结合、绑定、分子功能。JZY_2 d vs CK_2 d 的GO 功能富集分析结果显示(图5-B),差异基因主要注释到生物学过程中的生物进程、代谢、蛋白质修饰、磷代谢等;分子功能中的催化活性、转移酶活性、离子结合等。JZY_4 d vs CK_4 d 的GO 功能富集分析结果显示(图5-C),差异基因主要注释到生物学过程中的生物进程、代谢、蛋白质修饰、磷酸化作用;细胞组分中的光合膜、光系统、类囊体;分子功能中的催化活性、转移酶活性、氧化还原酶活性等。JZY_6 d vs CK_6 d的GO功能富集分析结果显示(图5-D),差异基因主要注释到生物学过程中的生物进程、代谢、磷酸化作用、氧化还原进程等;细胞组分中的类囊体部分、类囊体、光合膜;分子功能中的催化活性、氧化还原酶活性、蛋白激酶活性等。JZY_8 d vs CK_8 d的GO功能富集分析结果显示(图5-E),差异基因主要注释到生物学过程中的生物进程、代谢、单一有机体代谢进程、氧化还原进程等;细胞组分中的类囊体部分、类囊体、光合膜;分子功能中的催化活性、氧化还原酶活性、转移酶活性等。由此可假设在溃疡病侵入后最先由注释到生物进程的基因开始响应。其中在各个时期均表达差异的374 个基因共有169 个注释到生物进程中、48个注释到细胞组分中、234个注释到分子功能中。
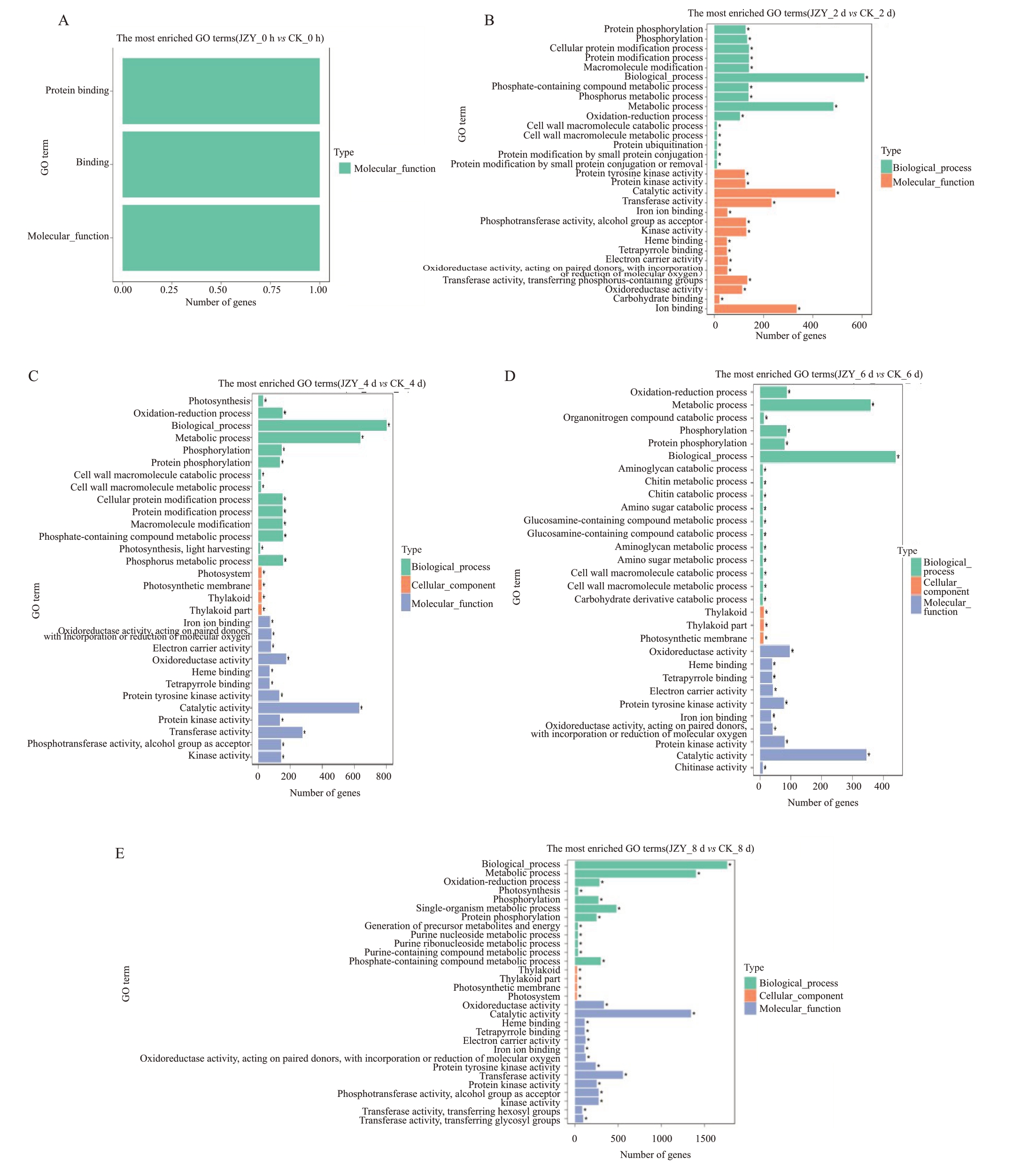
图5 差异基因GO 富集柱状图
Fig.5 Histogram of GO enrichment of differentially expressed genes
横坐标为GO 三个大类的下一层级的GO term;纵坐标分别为注释到该term 下(包括该term 的子term)的基因个数以及其占具有GO 注释的基因数目的比例;3 种不同分类表示GO term 的三种基本分类(从上到下依次为生物学过程、细胞成分、分子功能)。
The abscissa is Go term at the next level of the three categories of Go;The ordinate is the number of genes annotated to the term(including the sub term of the term) and its proportion in the number of genes annotated with Go;Three different classifications represent three basic classifications of goterm(From top to bottom are biological processes,cellular components and molecular functions).
2.6 差异表达基因KEGG注释分析
对所得差异基因进行KEGG 注释分析,所得部分结果如图6所示。JZY_0 h vs CK_0 h的KEGG注释分析结果显示(图6-A),差异基因注释到谷氨酸代谢通路。JZY_2 d vs CK_2 d 的KEGG 注释分析结果显示(图6-B),所有差异基因主要注释到次生代谢物的生物合成与代谢途径,且在次生代谢物的生物合成中显著富集,下调基因显著富集到光合作用通路,上调基因显著富集到植物与病原体相互作用通路与次生代谢物的生物合成。JZY_4 d vs CK_4 d的KEGG 注释分析结果显示(图6-C),所有差异基因主要显著富集在次生代谢物的生物合成与代谢途径、氨基糖和核苷酸糖代谢、苯丙素生物合成、光合作用、光合作用-触角蛋白等,下调基因显著富集到光合作用、光合作用-触角蛋白等,上调基因显著富集到次生代谢物的生物合成、类黄酮生物合成、谷胱甘肽代谢、苯丙氨酸代谢、苯丙素生物合成、植物与病原体相互作用、二苯乙烯、二芳基庚烷和姜酚的生物合成等。JZY_6 d vs CK_6 d 的KEGG 注释分析结果显示(图6-D),所有差异基因主要显著富集在次生代谢物的生物合成与代谢途径、苯丙素生物合成、光合作用,下调基因显著富集到光合作用等通路,上调基因显著富集到的通路主要与接种4 d上调基因富集到的通路相同。JZY_8 d vs CK_8 d 的KEGG注释分析结果显示(图6-E),所有差异基因主要显著富集在氨基酸的生物合成、次生代谢物的生物合成与代谢途径、光合生物的碳固定、碳代谢、糖酵解/糖异生、苯丙素生物合成等通路;下调基因主要显著富集在光合作用、光合作用-触角蛋白、卟啉和叶绿素代谢、乙醛酸和二羧酸的代谢、果糖和甘露糖代谢、碳代谢、光合生物的碳固定等,上调基因显著富集到次生代谢物的生物合成、氨基酸的生物合成、碳代谢、糖酵解/糖异生、苯丙素生物合成。上述结果表明,各时期差异基因富集到的代谢通路较相似。
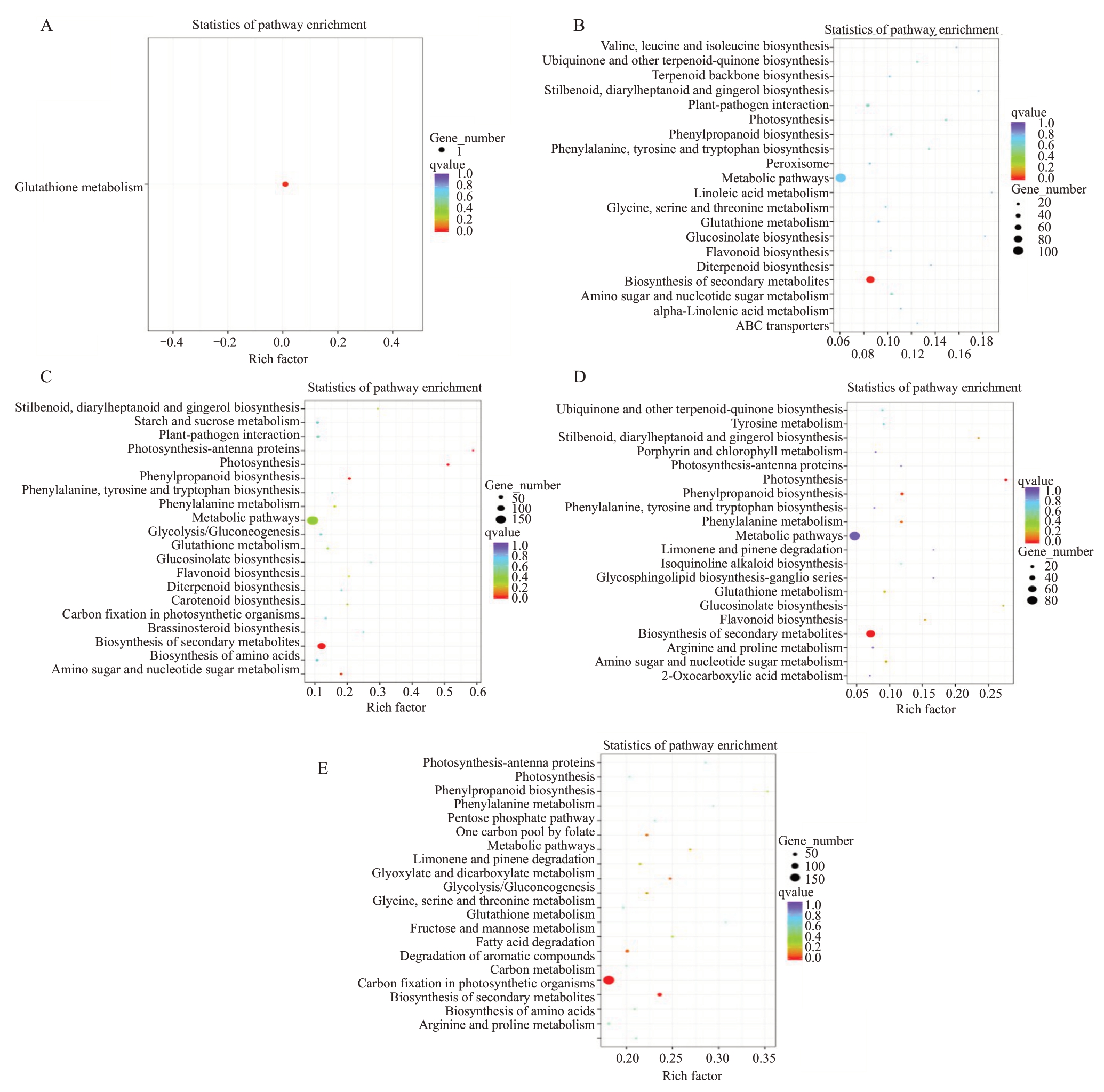
图6 差异基因KEGG 富集图
Fig.6 KEGG enrichment diagram of differentially expressed genes
圆点所在的位置代表着富集的条目,圆点的大小表示差异基因的数量。
The location of the dots represents the enriched entries,and the size of the dots indicates the number of differential genes.
2.7 qRT-PCR验证
qRT-PCR 验证所得结果如图7,其变化趋势与转录组结果相同,转录组结果可信。
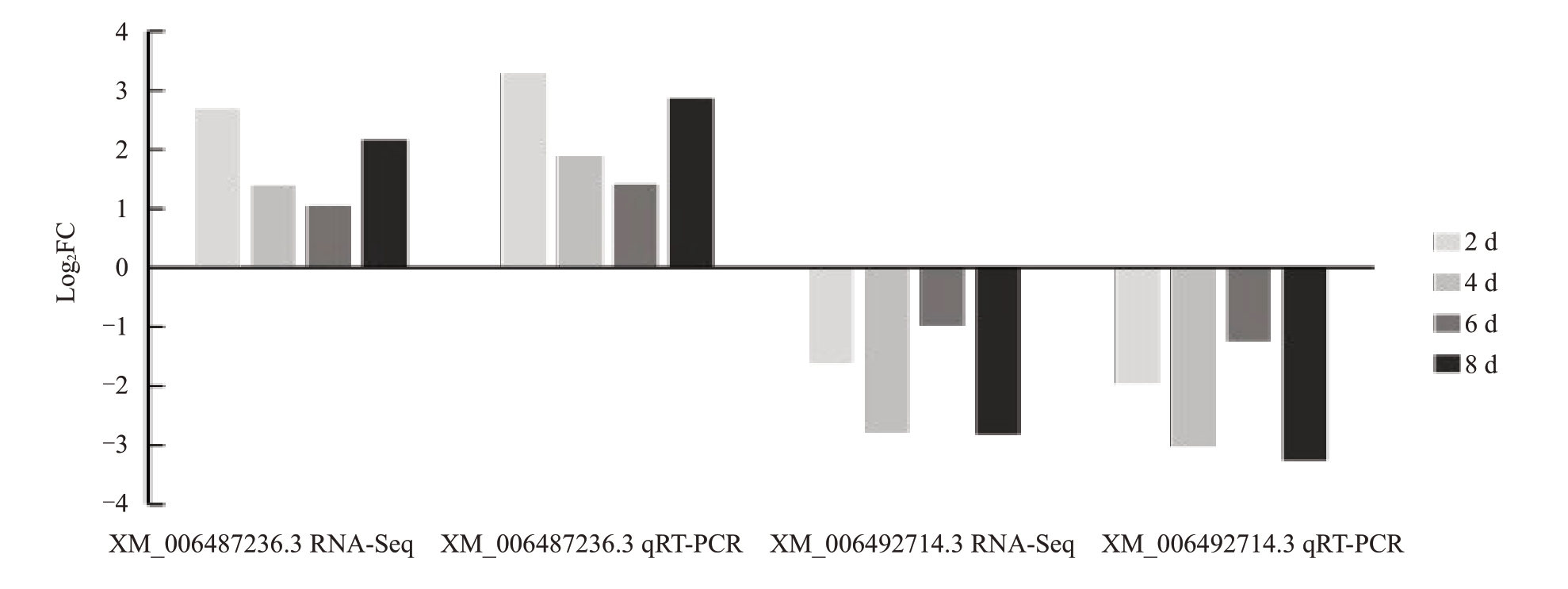
图7 qRT-PCR 验证
Fig.7 Verification of qRT-PCR
图为采用qRT-PCR 验证柑橘溃疡病菌侵染沃柑叶片2 d、4 d、6 d、8 d 基因表达情况,基因(XM_006492714.3)和基因(XM_006487236.3)在柑橘溃疡病菌侵染后各时期基因表达趋势与转录组测序结果一致。
q-RT-PCR was used to verify the gene expression of 2 d,4 d,6 d and 8 d of citrus ulcerative pathogen infected Wogan leaves.The gene expression trend of XM_006492714.3 and XM_006487236.3 in each period after infection was consistent with the transcriptome sequencing results.
2.8 差异表达基因的功能鉴定
通过对KEGG 富集通路进一步分析,发现接种柑橘溃疡病菌后各时期差异表达基因涉及的代谢通路较多。以下主要对与病害防卫反应相关的四条途径进行分析,分别是植物病原体相互作用通路、过氧化物酶体代谢通路、植物激素信号转导途径、蛋白质内质网合成途径。
2.8.1 植物病原体相互作用通路差异基因分析 钙依赖蛋白质激酶(CDPK)在接种后的2、4、6、8 d 时被激活,分别编码了2 条、3 条、2 条、4 条基因(XM_006489866.2、XM_006475016.3,gene- LOC10260-8900、XM_006475016.3、XM_0064815- 69.3,gene-LOC102630231、gene-LOC102608900,XM_006475-016.3、gene-LOC102630231、XM_0064-86512.3、gene-LOC102628905),其中基因(XM_006475016.3)在接种溃疡病后的2、4、8 d 时均显著上调,基因(gene-LOC102608900)在接种后的2、6 d时均显著上调;氧化酶基因家族(RBOH)编码的2 条基因(XM_006487593.2、XM_006476418.3)在接种溃疡病后的2、4、6、8 d时均显著上调。
2.8.2 过氧化物酶体代谢通路差异基因分析 酰辅酶A 氧化酶(ACOX)、过氧化物酶肌氨酸氧化酶抗体(PIPOX)在接种后8 d被激活,分别编码了1条上调基因(XM_006464151.3、XM_006483479.3),可推断其通过调节下游酶活性来降低接种溃疡病后的危害,从而在沃柑抗感溃疡病上起重要作用。
2.8.3 植物激素信号转导途径差异基因分析 植物生长素原初反应基因(GH3)在接种后的2、4、8 d时均编码了相同的1 条显著上调基因(XM_006486899.3),GH3 基因编码的是一类催化生长素和氨基酸进行偶联的酶,可推测在接种柑橘溃疡病菌后GH3 基因被激活并参与了沃柑对柑橘溃疡病的胁迫响应,对沃柑的生长发育及抗感性增强有着重要作用;AUX/LAA 家族编码的基因在生长素响应基因的表达调控过程中起着核心作用,AUX/LAA基因在接种后的4、6、8 d 时分别编码了2、1、4 条基因(XM_006465374.3、XM_006489439.3,XM_0064-65374.3,XM_006479536.3、XM_006465374.3、XM_006465637.3、XM_006489439.3),其中基因(XM_006465374.3)为3个时段共同的显著上调基因;水杨酸反应相关的标靶基因(PR-1)在沃柑接种柑橘溃疡病菌后的4、6、8 d分别编码了2、2、3条基因(XM_006486757.2、XM_006486759.3,XM_006486757.2、XM_006486759.3,XM_025101990.1、XM_006486-757.2、XM_006486759.3),其中基因(XM_006486-757.2、XM_006486759.3)为3 个时段共同的显著上调基因,推测其在沃柑受到病原物侵染时会大量表达,会在抗溃疡病下游发挥作用,直接限制病原物的侵染。
2.8.4 蛋白质内质网合成途径的差异基因分析 热休克蛋白家族中的HSP70、HSP40 基因在接种后的8 d 时被激活,分别编码1 条上调基因(XM_015532667.2、XM_006479993.3),糖蛋白糖基转移酶(UGGT)也在接种后的8 d 时被激活,编码了1 条上调基因(XM_006470961.3)。推测蛋白质内质网合成途径被激活并参与了沃柑对溃疡病的抗逆响应。
3 讨 论
植物在与病原体协同进化过程中会进化出先天的免疫系统来抵御病原体的感染[17]。植物通过呼吸爆发氧化酶(RBOH)的活性产生活性氧(ROS),活性氧可以作为信号分子诱导气孔关闭和系统获得抗性等其他免疫反应在植物免疫系统的多个层面发挥着重要作用[18-19]。钙依赖蛋白质激酶(CDPK)是植物钙信号传导过程中关键的蛋白激酶,在逆境胁迫信号传导过程中起到重要作用[20]。本研究发现,沃柑受到柑橘溃疡病菌的侵染后,CDPK 编码的基因(XM_006475016.3)在接种后的2、4、6、8 d时均显著上调,其中基因(gene-LOC102608900)在接种溃疡病 后 的2、4、8 d 时 均 显 著 上 调,基 因(gene-LOC102608900)在接种后的2、6 d时均显著上调;呼吸爆发氧化酶(RBOH)编码的2 条基因(XM_006487593.2、XM_006476418.3)在接种溃疡病后的2、4、6、8 d时均显著上调。由此推测,植物病原体相互作用通路下的差异表达基因,可能通过调控活性氧合成水平,促进超敏化反应,从而提高对溃疡病的抗性。
过氧化物酶体(peroxisome)是真核生物中普遍存在的一类单层膜细胞器,内含多种参与重要代谢过程的酶类,如脂肪酸β-氧化、乙醛酸循环、胆固醇合成、活性氧的生成与降解等[21]。近年来,病原真菌过氧化物酶体相关基因的功能研究亦获得重大进展。目前为止,过氧化物酶体在稻瘟病菌、瓜类炭疽病菌等植物病原真菌致病过程中发挥重要作用[22-25]。本研究发现,沃柑接种柑橘溃疡病后,酰辅酶A 氧化酶(ACOX)、过氧化物酶体肌氨酸氧化酶抗体(PIPOX)在接种后8 d被激活,各编码了1条上调基因(XM_006464151.3、XM_006483479.3),由此推测,其通过调节下游酶活性来降低接种溃疡病后的危害,从而在沃柑抗感溃疡病上起到重要作用。
植物激素是可通过参与大量的信号通路调控的简单低分子化合物,在植物各生理过程中发挥着重要作用,亦可作为在植物防卫反应中激活植物抗病反应的关键信号[26]。本研究发现,沃柑接种柑橘溃疡病后,在植物激素的信号转导途径中初步筛选出3类主要的差异基因,分别为GH3、AUX/LAA和PR-1。植物生长素原初反应基因(GH3)在接种后的2、4、8 d 时均编码了1 条显著上调基因(XM_006486899.3),GH3 基因编码的是一类催化生长素和氨基酸进行偶联的酶,推测在接种溃疡病后GH3基因被激活并参与了沃柑对柑橘溃疡病的胁迫响应,对沃柑的生长发育及抗感性增强有着重要作用;AUX/LAA家族编码的基因在生长素响应基因的表达调控过程中起着核心作用,AUX/LAA 基因在接种后的4、6、8 d时分别编码了2条、1条、4条基因,其中基因(XM_006465374.3)为3 个时段共同的显著上调基因;水杨酸反应相关的标靶基因(PR-1)在沃柑接种溃疡病后的4、6、8 d 分别编码了2、2、3 条基因 ,其 中 基 因(XM_006486757.2 和 XM_006486759.3)为3 个时段共同的显著上调基因。由此推测,在沃柑受到病原物侵染时,植物激素信号转导途径中抗病反应的关键信号被激活,从而起到了良好的防卫反应作用,直接限制了病原物的侵染。
内质网由一个连续的膜状细胞网组成的封闭管道系统,是蛋白质加工折叠的关键场所[27-28]。本研究中内质网差异表达基因所对应的表达蛋白主要有热激蛋白(Hsp20、Hsp40、Hsp70、Hsp90)和结合免疫球蛋 白(Bip)。热 激 蛋 白(Hsp20、Hsp40、Hsp70、Hsp90)在细胞中可以作为“分子伴侣”参与合成中的多肽反应,使其正确折叠;它还能够帮助新生肽穿过细胞膜结构,使蛋白质运转到细胞的不同部位发生作用;在高温等胁迫环境中,热激蛋白可以组织热变性蛋白的聚集,阻止蛋白的不可逆变性或有利于蛋白质变性后的复性[29]。BiP 蛋白是内质网腔内最丰富的分子伴侣,它能与进入内质网腔内的新生肽结合并阻止它们在内置网腔内聚集,能参与内质网蛋白折叠[30]。完成折叠的糖蛋白的转运是在检测员UGGT 的监控下完成的,正确折叠的糖蛋白会转运至高尔基体进一步加工,不完全折叠或错误折叠的蛋白可以被UGGT 通过暴露在表面的疏水残基识别,进行重新折叠;所以UGGT在蛋白质输出内质网过程中发挥着重要的质量监控作用[31-32]。笔者在本研究中发现,通过对蛋白质内质网合成通路的差异基因进一步分析,热休克蛋白家族中的HSP70 和HSP40 在接种后8 d 被激活,各编码1 条上调基因(XM_015532667.2 和XM_006479993.3),糖蛋白糖基转移酶(UGGT)也在接种后8 d 被激活,编码了1条上调基因(XM_006470961.3)。由此推测,在蛋白质内质网合成通路后期被激活的HSP70、HSP40 和UGGT基因,其响应蛋白质的合成,可以作为抗感溃疡病的候选基因。
4 结 论
溃疡病菌侵入沃柑叶片后产生了一些复杂的响应反应,分析筛选得到了在接种2、4、6、8 d后均表达差异的374个基因,其中上调基因为61个,下调基因为313 个。并对差异表达基因进行了GO 注释和KEGG 通路富集性分析,得到不同危害时段参与植物激素信号转导、植物病原体相互作用、过氧化物酶体、蛋白质内质网合成等途径的多个差异表达基因,进一步分析这些抗病相关通路和基因,为深入研究相关基因功能和柑橘抗感溃疡病的机制提供了参考。
[1]江东,曹立.晚熟高糖杂柑品种‘沃柑’在重庆的引种表现[J].中国南方果树,2011,40(5):33-34.JIANG Dong,CAO Li.Introduction and performance of late maturing high-sugar mixed citrus cultivar‘Orah’in Chongqing[J].South China Fruits,2011,40(5):33-34.
[2]黄海生,唐东坚.沃柑在南宁种植表现及早结丰产优质栽培技术[J].广西农学报,2015,30(5):56-59.HUANG Haisheng,TANG Dongjian.Orah planting in Nanning showed early yield and high quality cultivation techniques[J].Journal of Guangxi Agriculture,2015,30(5):56-59.
[3]岑铭松.柑橘溃疡病的LAMP 快速检测及生物防治初步研究[D].杭州:浙江大学,2017.CEN Mingsong.Rapid detection by Loop-Mediated Isothermal Amplification (LAMP) and biocontrol of Citrus Canker[D].HangZhou:Zhejiang University,2017.
[4]GRAHAM J H,GOTTWALD T R,CUBERO J,ACHOR D S.Xanthomonas axonopodis pv. citri: factors affecting successful eradication of citrus canker[J].Molecular Plant Pathology,2004,5(1):1-15.
[5]姚廷山,周彦,周常勇.柑橘溃疡病菌分化及防治研究进展[J].园艺学报,2015,42(9):1699-1706.YAO Tingshan,ZHOU Yan,ZHOU Changyong.Research development of the differentiation and control of Citrus Bacterial Canker Disease[J].Acta Horticulturae Sinica,2015,42(9):1699-1706.
[6]SUN X D,ZHOU S M,MENG F L,LIU S Q.De novo assembly and characterization of the garlic (Allium sativum) bud transcriptome by Illumina sequencing[J].Plant Cell Reports,2012,31(10):1823-1828.
[7]潘贞珍,黄运鹏,黄桂香,杨翠红,何新华.3 个柑橘品种叶片结构和生化物质与柑橘溃疡病抗性的相关性研究[J].中国果树,2020(4):31-36.PAN Zhenzhen,HUANG Yunpeng,HUANG Guixiang,YANG Cuihong,HE Xinhua.Correlation research of leaf structure and biochemical substances of three varieties of citrus with the resistance to citrus canker[J].China Fruits,2020(4):31-36.
[8]井赵斌.猕猴桃抗溃疡病转录组分析和基因功能注释[J].分子植物育种,2021,19(6):1830-1838.JING Zhaobin.Transcriptome analysis and gene function annotation of kiwifruit psa resistance[J].Molecular Plant Breeding,2021,19(6):1830-1838.
[9]张玮.葡萄溃疡病菌侵染葡萄的组学基础与分子机制的初步研究[D].北京:中国农业大学,2018.ZHANG Wei.Preliminary study on molecular mechanisns and omics of Lasiodiplodia theobromae infecting grapevine[D].Bei-Jing:China Agricultural University,2018.
[10]DENG B,WANG W J,RUAN C Q,DENG L L,YAO S X,ZENG K F.Involvement of CsWRKY70 in salicylic acid-induced citrus fruit resistance against Penicillium digitatum[J].Horticulture Research,2020,7(1):157.
[11]FU X Z,GONG X Q,ZHANG Y X.,WANG Y,LIU J H.Different transcriptional response to Xanthomonas citri subsp.citri between kumquat and sweet orange with contrasting canker toler-ance[J].PLoS One,2012,7(7):e41790.
[12]ZOU X P,DU M X,LIU Y N,WU L,XU L Z,LONG Q,PENG A H,HE Y R,ANDRADE M,CHEN S C.CsLOB1 regulates susceptibility to citrus canker through promoting cell proliferation in citrus[J].The Plant Journal,2021,106(4):1039-1057.
[13]王丽娟,龙俊宏,谢竹,吴柳,彭爱红,何永睿,龙琴,陈善春,邹修平.CsWRKY22 启动子的克隆及响应柑橘溃疡病菌侵染的表达特征[J].园艺学报,2019,46(4):677-690.WANG Lijuan,LONG Junhong,XIE Zhu,WU Liu,PENG Aihong,HE Yongrui,LONG Qin,CHEN Shanchun,ZOU Xiuping.Cloning and expression characteristics of CsWRKY22 promoters in response to Xanthomonas citri subsp. citri[J].Acta Horticulturae Sinica,2019,46(4):677-690.
[14]LI Q,QIN X J,QI J J,DOU W F,DUNAND C,CHEN S C,HE Y R.CsPrx25, a class III peroxidase in Citrus sinensis,confers resistance to citrus bacterial canker through the maintenance of ROS homeostasis and cell wall lignification[J].Horticulture Research,2020,7(1):192.
[15]SYLVAIN B, CHARLES M, JEAN-LOUP N.Structure and oigin of Xanthomonas arboricola pv. pruni populations causing bacterial spot of stone fruit trees in Western Europe[J].Phytopathology,2005,95(9):1081-1088.
[16]高爽,陈武,戴良英.湖南省柑橘溃疡病菌gyrB 和16S rRNA的扩增和序列分析[J].江苏农业科学,2016,44(5):76-78.GAO Shuang,CHEN Wu,DAI Liangying.Amplification and sequence analysis of gyrB and 16S rRNA in citrus ulcer bacteria in Hunan Province [J].Jiangsu Agricultural Sciences, 2016, 44(5):76-78.
[17]SCHWESSINGER B,RONALD P C.Plant innate immunity:perception of conserved Microbial Signatures[J].Annual Review of Plant Biology,2012,63(1):451-482.
[18]吴庆丽,谭晓荣.活性氧在农作物抗病中的作用[J].河南工业大学学报(自然科学版),2008,29(3):81-86.WU Qingli,TAN Xiaorong.Role of reactive oxygen species in crop disease resistance[J].Journal of Henan University of Technology(Natural Science Edition),2008,29(3):81-86.
[19]LI P,ZHAO L L,QI F,HTWE N M P S,LI Q Y,ZHANG D W,LIN F C,SHANG-GUAN K K,LIANG Y.The receptor-like cytoplasmic kinase RIPK regulates broad-spectrum ROS signaling in multiple layers of plant immune system[J].Molecular plant,2021,14(10):1652-1667.
[20]王月,侯和胜.植物环核苷酸门控通道(CNGC)基因家族的结构与功能[J].植物生理学通讯,2007,43(1):1-8.WANG Yue,HOU Hesheng.Structure and function of plant Cyclic Nucleotide-gated Channel (CNGC) gene family[J].Plant Physiology Communications,2007,43(1):1-8.
[21]高飞雁,李玲,王教瑜,王艳丽,孙国昌.PEX 基因在过氧化物酶体形成及真菌致病性中的作用[J].遗传,2017,39(10):908-917.GAO Feiyan,LI Ling,WANG Jiaoyu,WANG Yanli,SUN Guochang.The functions of PEX genes in peroxisome biogenesis and pathogenicity in phytopathogenic fungi[J].Hereditas,2017,39(10):908-917.
[22]KUBO Y,FUJIHARA N,HARATA K,NEUMANN U,ROBIN G P,O’CONNELL R. Colletotrichum orbiculare FAM1 Encodes a novel woronin body-associated Pex22 peroxin required for appressorium-mediated plant infection[J].mBio,2015,6(5):e01305-15.
[23]WANG J Y,LI L,ZHANG Z,QIU H P,LI D M,FANG Y,JIANG H,CHAI R Y,MAO X Q,WANG Y L,SUN G C.One of Three Pex11 Family members is required for peroxisomal proliferation and full virulence of the rice blast fungus Magnaporthe oryzae[J].PLoS One,2015,10(7):e0134249.
[24]HYNES M J,MURRAY S L,KHEW G S,DAVIS M A.Genetic analysis of the role of peroxisomes in the utilization of acetate and fatty acids in Aspergillus nidulans[J].Genetics,2008,178(3):1355-1369.
[25]MANAGADZE D,WÜRTZ C,WIESE S,SCHNEIDER M,GIRZALSKY W,MEYER H E,ERDMANN R,WARSCHEID B,ROTTENSTEINER H.Identification of PEX33,a novel component of the peroxisomal docking complex in the filamentous fungus Neurospora crassa[J].European Journal of Cell Biology,2010,89(12):955-964.
[26]PIETERSE C M J,VAN DER DOES D,ZAMIOUDIS C,LEON-REYES A,VAN WEES S C M.Hormonal modulation of plant immunity[J].Annual Review of Cell and Developmental Biology,2012,28(1):489-521.
[27]WALTER P,RON D.The unfolded protein response:from stress pathway to homeostatic regulation[J].Science,2011,334(6059):1081-1086.
[28]YAMAGUCHI T,BLUMWALD E.Developing salt- tolerant crop plants:challenges and opportunities[J].Trends in Plant Science,2005,10(12):615-620.
[29]王义菊.过量表达小分子热激蛋白对番茄耐热性的影响[D].济南:山东师范大学,2005.WANG Yiju.The effects of overexpression of small heat shock proteins on the thermotolerence in tomato[D].Jinan:Shandong Normal University,2005.
[30]OTERO J H,LIZÁK B,HENDERSHOT L M.Life and death of a BiP substrate[J].Seminars in Cell and Developmental Biology,2010,21(5):472-478.
[31]SHUKLA S,MACLENNAN G,MARENGO S,SEFTEL A,RESNICK M,GUPTA S.Genetic abnormalities in prostate cancer[J].Current Genomics,2004,5(1):67-83.
[32]CARAMELO J J,CASTRO O A,ALONSO L G,DE PRATGAY G,PARODI A J.UDP-Glc: glycoprotein glucosyltransferase recognizes structured and solvent accessible hydrophobic patches in molten globule-like folding intermediates[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(1):86-91.