新疆库尔勒香梨(P. bretschneideri Rehd.)为蔷薇科(Rosaceae)梨属(Pyrus spp.)植物,是新疆特有的梨品种,产业化水平居新疆水果之首[1-2],具有细嫩多汁、香味浓郁、皮薄质脆等特点[3]。库尔勒香梨所创造的经济效益占新疆特色林果产业的比重稳步增加,已经成为当地经济重要支柱产业[4]。
酚类物质是一类重要的植物次生代谢物质,广泛存在于植物组织中,具有抗氧化、抗病毒、降血脂、保护心血管和抗癌等多种功能活性[5]。酚类物质对植物的生长发育和调节[6]、果蔬产品的褐变[7]、基因表达[8-9]、清除机体内自由基和延缓机体衰老[10-12]都有重要影响,其包含酚酸类、黄酮类、单宁类和花色苷类等[13]。目前,关于香梨研究集中在酚类物质(多酚、黄酮和酚酸类化合物)的提取、含量组分测定、贮藏、生物活性等方面。乌英等[14]以乙醇为溶剂,采用超声辅助法确定了库尔勒香梨果皮和果肉总黄酮的最佳提取工艺,在此工艺下果皮和果肉的总黄酮提取量分别为5.12、1.79 mg∙g-1。Lin 等[15]基于LCDAD-ESI/MS 检测方法,对16 种梨果皮中的酚类物质进行分析,鉴定出32 种酚类物质,并且主要酚类物质为熊果苷和绿原酸。Kolniakostek[16]通过LCPDA-QTOF/MS 检测方法,对10 个梨品种果皮中的生物活性成分进行分析,鉴定出44 种酚类化合物。Wang 等[17]利用LC-ESI-QTOF-MS/MS 检测方法,对5 个梨品种中的酚类化合物进行分析,鉴定出73 种酚类化合物,且绿原酸的含量明显更高。王震涛等[18]基于香梨贮藏过程中随时间-温度的变化情况,建立品质指标变化动力学模型,其实测值与预测值相关系数R均大于0.97。杜林笑等[19]得出1-MCP处理可以保持库尔勒香梨果实抗氧化酶活性和品质,延缓果实衰老的进程。Kolniakostek 等[20]分析了5个不同梨品种果实的酚类物质与抗氧化能力的关系,其中DPPH 自由基清除能力主要受儿茶素和原花青素化合物的影响,FRAP 与槲皮素和熊果苷衍生物的相关度最高。Li等[21]研究了8个梨品种中酚类物质及其抗氧化活性,发现熊果苷和儿茶素是8个梨品种的主要酚类化合物,并且认为梨果实酚类物质含量与抗氧化活性呈正相关。但是目前关于库尔勒香梨果实不同组织部位酚类物质含量及其抗氧化活性方面的研究鲜有报道。
因此,笔者以期通过分析库尔勒香梨果实在发育过程中不同组织部位的总黄酮、总酚、单体酚类物质含量和抗氧化能力(DPPH 自由基清除能力、ABTS+自由基清除能力和FARP),结合酚类物质与抗氧化之间的相关性分析,明确库尔勒香梨果实发育过程中酚类物质的分布及变化趋势,将梨果产品加工所产生的皮渣、果心等废弃物作为酚类物质提取的原料,提高梨果整体利用率,为减少环境污染做出贡献,并为寻找科学的调控方法及产品加工提供理论依据。
1 材料和方法
1.1 材料
库尔勒香梨采摘于新疆阿拉尔市塔里木大学梨园,于花后85 d 开始采样,每次间隔15 d,从梨园随机选择5 株生长良好的梨树,从植株外围不同方位随机采取20~30个大小均一、无病虫害的果实,直至库尔勒香梨果实成熟(2020年6月28日、7月13日、7月28日、8月28日、9月12日,分别对应文中S1、S2、S3、S4、S5),共5次采样。采摘后的果实立即放入装有冰袋的保温箱中带回实验室备用。
1.2 试剂与仪器
2,2-二氮-双(3-乙基苯并噻唑-6-磺酸)铵盐(ABTS):美国Sigma 公司;1,1-二苯基-2-三硝基苯肼(DPPH)、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox):阿拉丁试剂(上海)有限公司;2,4,6-三吡啶基三嗪[2,4.6-tris(2-pyridy1)-1,3.5-triazine,TPTZ]、熊果苷、绿原酸、儿茶素、表儿茶素、芦丁、山奈酚-3-O-芸香糖苷、槲皮苷、槲皮素鼠李糖苷:上海源叶生物有限公司。乙醇、甲醇、硝酸铝、氢氧化钠、亚硝酸钠:天津市致远化学试剂有限公司。
FC-188多歧管普通型冷冻干燥机:河北国辉实验仪器有限公司;TGL-16M 台式高速冷冻离心机:上海安亭科学仪器厂;PT-3502C 全波长酶标仪:北京普天新桥技术有限公司;UV-2600 型紫外分光光度计:岛津仪器(苏州)有限公司;LC-20A液相色谱、RID20A检测器:日本岛津。
1.3 方法
1.3.1 样品处理 先将梨果洗净、沥干后,分成果皮、果肉、心外果肉(果心线以内)和果心4 个部位,在-80 ℃条件下预冷冻24 h,然后真空冷冻干燥48 h获得冻干样品,再用组织破碎机粉碎,置于-20 ℃贮藏备用。
1.3.2 酚类物质的提取 参照姜喜等[22]的方法提取酚类物质,称取一定量的样品,用80%甲醇室温超声萃取30 min,离心后取上清液(提取液)-20 ℃冷藏备用。提取液用于总黄酮、总酚、ABTS+、DPPH、FRAP及多酚类物质含量的测定。
1.3.3 活性成分测定(1)总黄酮的测定。采用硝酸铝显色法测定总黄酮含量,吸取0.6 mL 提取液0.5 mL 5%NaNO3溶液,加入15 mL离心管中,摇匀,常温反应6 min,加入0.5 mL 10%Al(NO3)3溶液,混匀后常温反应6 min,放入4 mL 4%NaOH 溶液,常温反应15 min,以甲醇为对照,在500 nm 波长处测定样品的吸光值,重复测定4次。以芦丁为标准品,结果以mg∙g-1表示。
(2)总酚含量的测定。采用Foline-Ciocalteu 比色法测定总酚含量,吸取0.2 mL提取液,加入10 mL蒸馏水和2 mol·L-1的Folin-Ciocalteu 试剂,混匀后静置5 min,加入1.0 mL 15%Na2CO3溶液,混匀,室温下避光反应45 min。以没食子酸为标准品,在751 nm处测定样品的吸光度值,重复测定4次,结果以mg·g-1 表示。
1.3.4 游离多酚的测定 参照Pu 等[23]的方法测定样品中的游离多酚含量,酚类物质含量以μg·g-1表示。
1.3.5 抗氧化活性的测定 DPPH 自由基清除能力、ABTS+自由基清除能力、FRAP 的测定参考蒲云峰等[24]的方法。
1.3.6 数据处理 所有数据平行测定4 次,结果采用-X±SD表示。采用SPSS 25统计软件进行方差分析和相关性分析,并进行Duncan’s 多重比较(p <0.05)。
2 结果与分析
2.1 库尔勒香梨果实不同组织部位总黄酮及总酚含量的变化
库尔勒香梨果实不同部位总黄酮、总酚含量变化如图1和图2所示。经统计分析可以看出,库尔勒香梨果心的总黄酮、总酚含量呈现逐渐下降的趋势,果皮、果肉和心外果肉的总黄酮、总酚含量先上升后下降,且在果实成熟时稍有回升的变化趋势。香梨幼果果皮、果肉、心外果肉和果心总黄酮、总酚含量最高,总黄酮含量(w,后同)为18.52、7.43、7.93、45.99 mg·g-1,分别是果实成熟时期的2.09、7.08、4.75、13.22 倍,总 酚 含 量 为21.32、2.39、3.01、27.41 mg∙g-1,分别是果实成熟时期的2.14、19.92、8.14、6.72倍,差异显著。库尔勒香梨果皮和果心的总黄酮、总酚含量显著高于果肉和心外果肉(p <0.05),与果皮和果心相比,果肉和心外果肉的总黄酮含量低59.88%~83.84%,总酚含量果肉与心外果肉比果皮和果心低88.79%~91.28%,果肉和心外果肉总黄酮和总酚含量差异不显著(p >0.05),心外果肉的总黄酮和总酚含量仅为果肉的1.07倍和1.26倍。
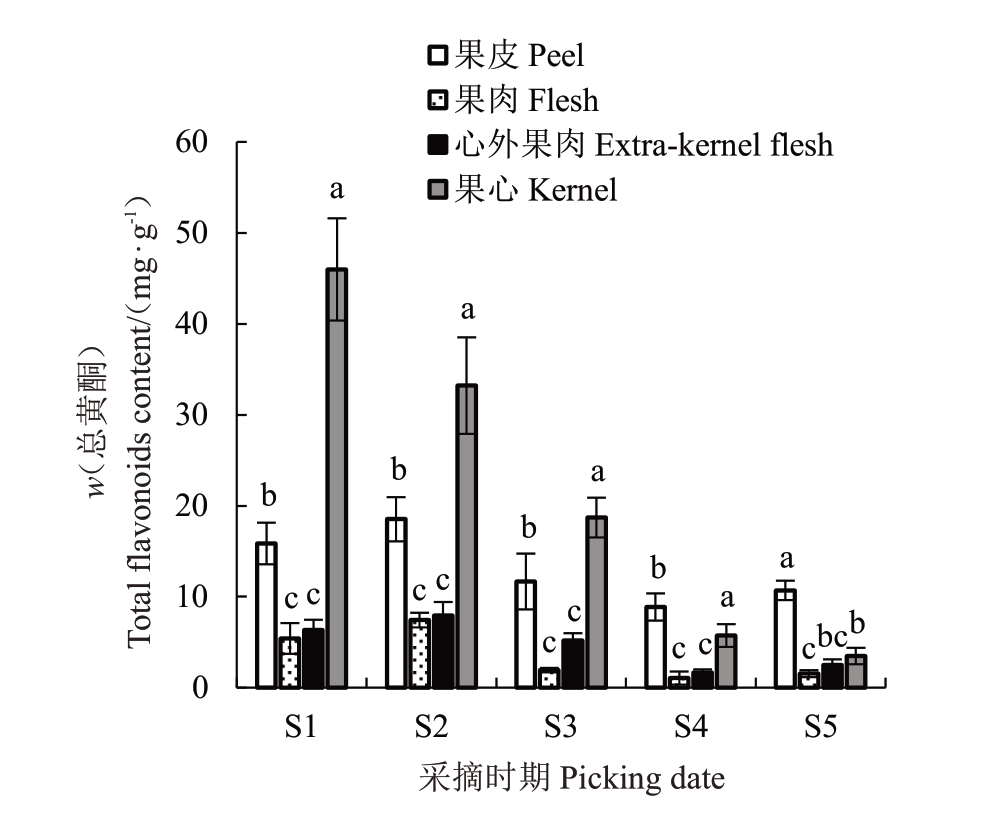
图1 库尔勒香梨果实不同组织部位总黄酮的变化
Fig.1 Changes of total flavonoids in different issue of Kuerlexiangli pear fruit
不同小写字母表示同一时期不同果实部位在p < 0.05 差异显著。下同。
Different small letters indicate that different fruit parts in the same period have significant difference at p<0.05.The same below.
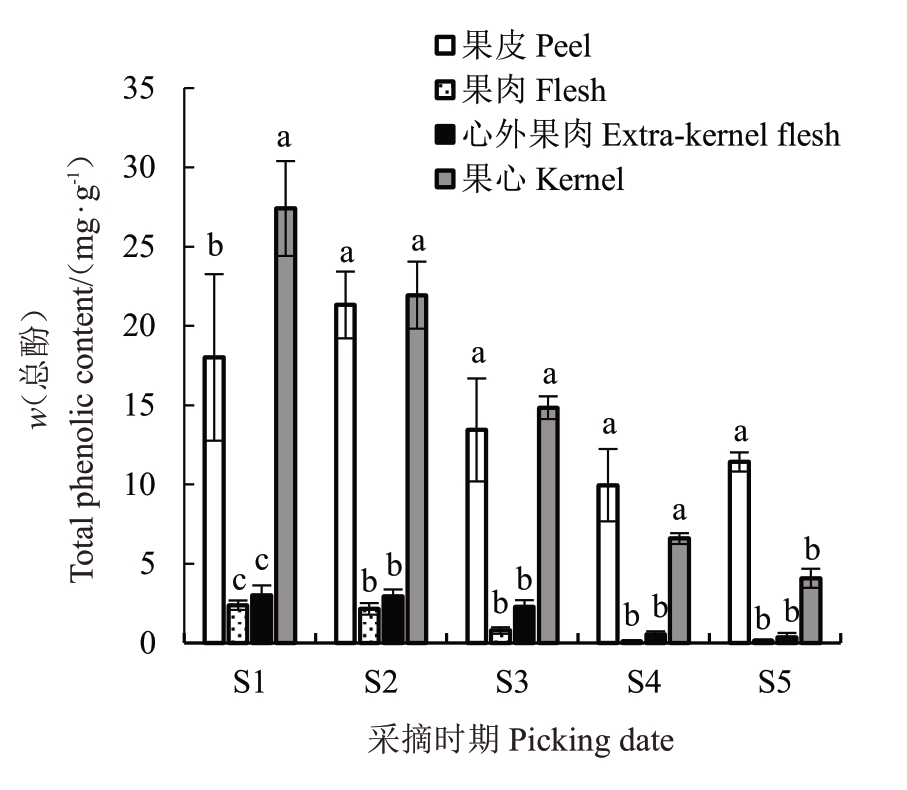
图2 库尔勒香梨果实不同组织部位总酚的变化
Fig.2 Changes of total phenols in different issue of Kuerlexiangli pear fruit
总体上,库尔勒香梨果实发育前期中不同组织部位的总黄酮和总酚含量由高到低次序为果心>果皮>心外果肉>果肉,而在果实发育成熟时果皮的总黄酮和总酚含量大于果心,为梨果实不同组织部位的酚类物质动态含量测定提供了理论依据。
2.2 发育期不同部位单体酚类含量的变化
由表1 可以看出,库尔勒香梨果实中检测出熊果苷、绿原酸、儿茶素、表儿茶素、山奈酚-双脱氧己糖苷、芦丁、山奈酚-3-O-芸香糖苷、槲皮苷、槲皮素鼠李糖苷、异鼠李糖-3-O 芸香糖苷、山奈酚-3-O-葡萄糖苷、异鼠李素-3-O-葡萄糖苷、山奈酚-3-乙酰葡萄糖苷、异鼠李素-3-乙酰己糖苷14 种酚类物质,且在生长发育过程中,不同果实部位的酚类物质含量存在差异。在香梨果皮中,熊果苷含量最高,在3 662.13~20 850.57 μg·g-1之间,其次是绿原酸,含量最低的是异鼠李素-3-乙酰己糖苷;其中儿茶素和槲皮苷含量逐渐下降,在S1时期含量最高,表儿茶素、山奈酚-双脱氧己糖苷、山奈酚-3-O-芸香糖苷、槲皮素鼠李糖苷、异鼠李素-3-乙酰己糖苷、异鼠李糖-3-O-芸香糖苷和异鼠李素-3-O-葡萄糖苷含量呈现先上升后下降的趋势,均在S2~S3 时期最高,熊果苷、绿原酸、芦丁和山奈酚-3-O-葡萄糖苷含量在整个生长发育期波动较大,山奈酚-3-乙酰葡萄糖苷只在生长发育前期检测出较高含量,后期未检测出,说明其可能是只存在于果实幼果期的一种酚类物质。在香梨果心中,绿原酸含量最高,在977.44~1 736.77 μg·g-1之间,其次是熊果苷;其中山奈酚-双脱氧己糖苷、槲皮苷、山奈酚-3-O-芸香糖苷、槲皮素鼠李糖苷、山奈酚-3-O-葡萄糖苷、山奈酚-3-乙酰葡萄糖苷、异鼠李素-3-乙酰己糖苷均未被检测出。除了熊果苷、绿原酸、儿茶素、表儿茶素、异鼠李糖-3-O-芸香糖苷和异鼠李素-3-O-葡萄糖苷在果肉和心外果肉中被检测出,其余8 种酚类物质均未被检测出。以上说明不同酚类物质在果实不同部位的含量分布不同,且酚类物质主要分布在果皮和果心中。虽然这14 中单体酚类物质含量相差很大,但变化趋势总体是随着果实的成熟含量降低,这与总酚、总黄酮含量的变化趋势一致,其原因可能是成熟时期果实增大,细胞内含水量较高。
表1 发育期库尔勒香梨果实不同部位单体酚类含量的变化
Table 1 Changes of the content of monomer phenols in Kuerlexiangli pear fruits during development
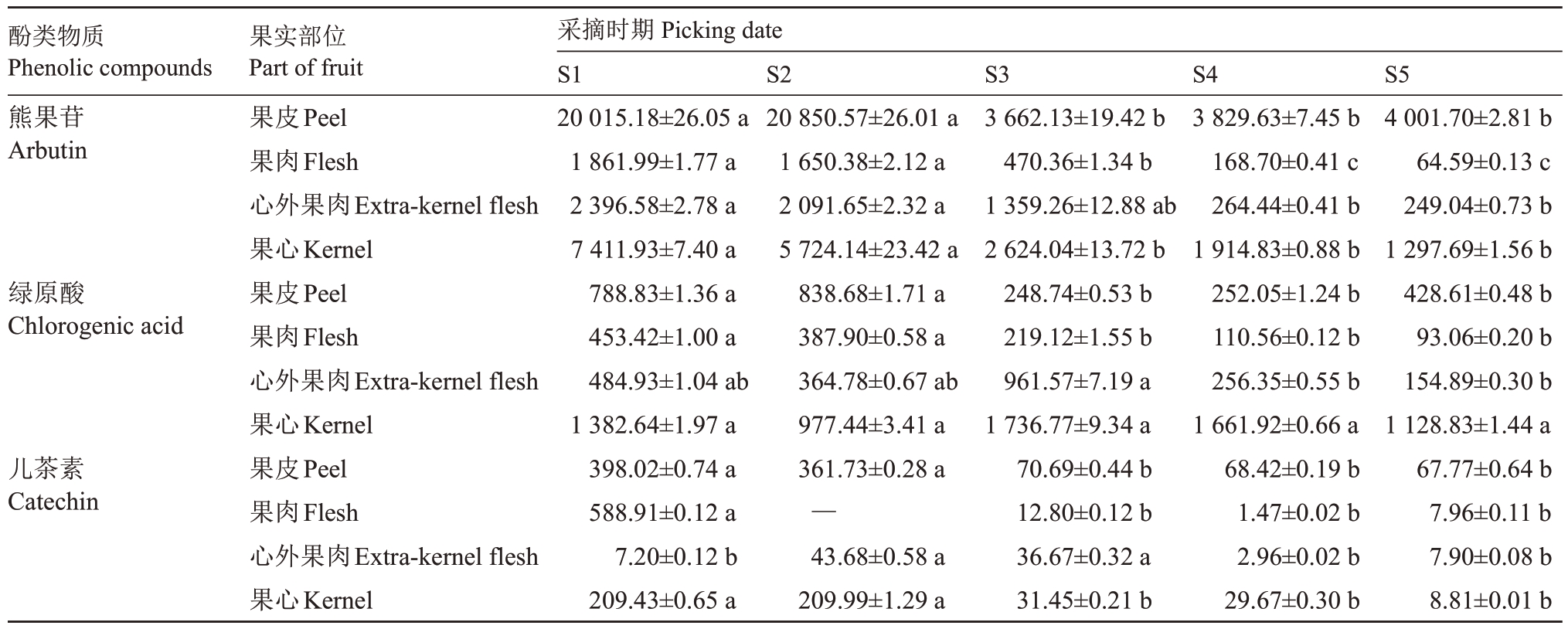
酚类物质Phenolic compounds果实部位Part of fruit采摘时期Picking date S1 S2 S3 S4 S5熊果苷Arbutin绿原酸Chlorogenic acid儿茶素Catechin果皮Peel果肉Flesh心外果肉Extra-kernel flesh果心Kernel果皮Peel果肉Flesh心外果肉Extra-kernel flesh果心Kernel果皮Peel果肉Flesh心外果肉Extra-kernel flesh果心Kernel 20 015.18±26.05 a 1 861.99±1.77 a 2 396.58±2.78 a 7 411.93±7.40 a 788.83±1.36 a 453.42±1.00 a 484.93±1.04 ab 1 382.64±1.97 a 398.02±0.74 a 588.91±0.12 a 7.20±0.12 b 209.43±0.65 a 20 850.57±26.01 a 1 650.38±2.12 a 2 091.65±2.32 a 5 724.14±23.42 a 838.68±1.71 a 387.90±0.58 a 364.78±0.67 ab 977.44±3.41 a 361.73±0.28 a—43.68±0.58 a 209.99±1.29 a 3 662.13±19.42 b 470.36±1.34 b 1 359.26±12.88 ab 2 624.04±13.72 b 248.74±0.53 b 219.12±1.55 b 961.57±7.19 a 1 736.77±9.34 a 70.69±0.44 b 12.80±0.12 b 36.67±0.32 a 31.45±0.21 b 3 829.63±7.45 b 168.70±0.41 c 264.44±0.41 b 1 914.83±0.88 b 252.05±1.24 b 110.56±0.12 b 256.35±0.55 b 1 661.92±0.66 a 68.42±0.19 b 1.47±0.02 b 2.96±0.02 b 29.67±0.30 b 4 001.70±2.81 b 64.59±0.13 c 249.04±0.73 b 1 297.69±1.56 b 428.61±0.48 b 93.06±0.20 b 154.89±0.30 b 1 128.83±1.44 a 67.77±0.64 b 7.96±0.11 b 7.90±0.08 b 8.81±0.01 b
续表Continued Table
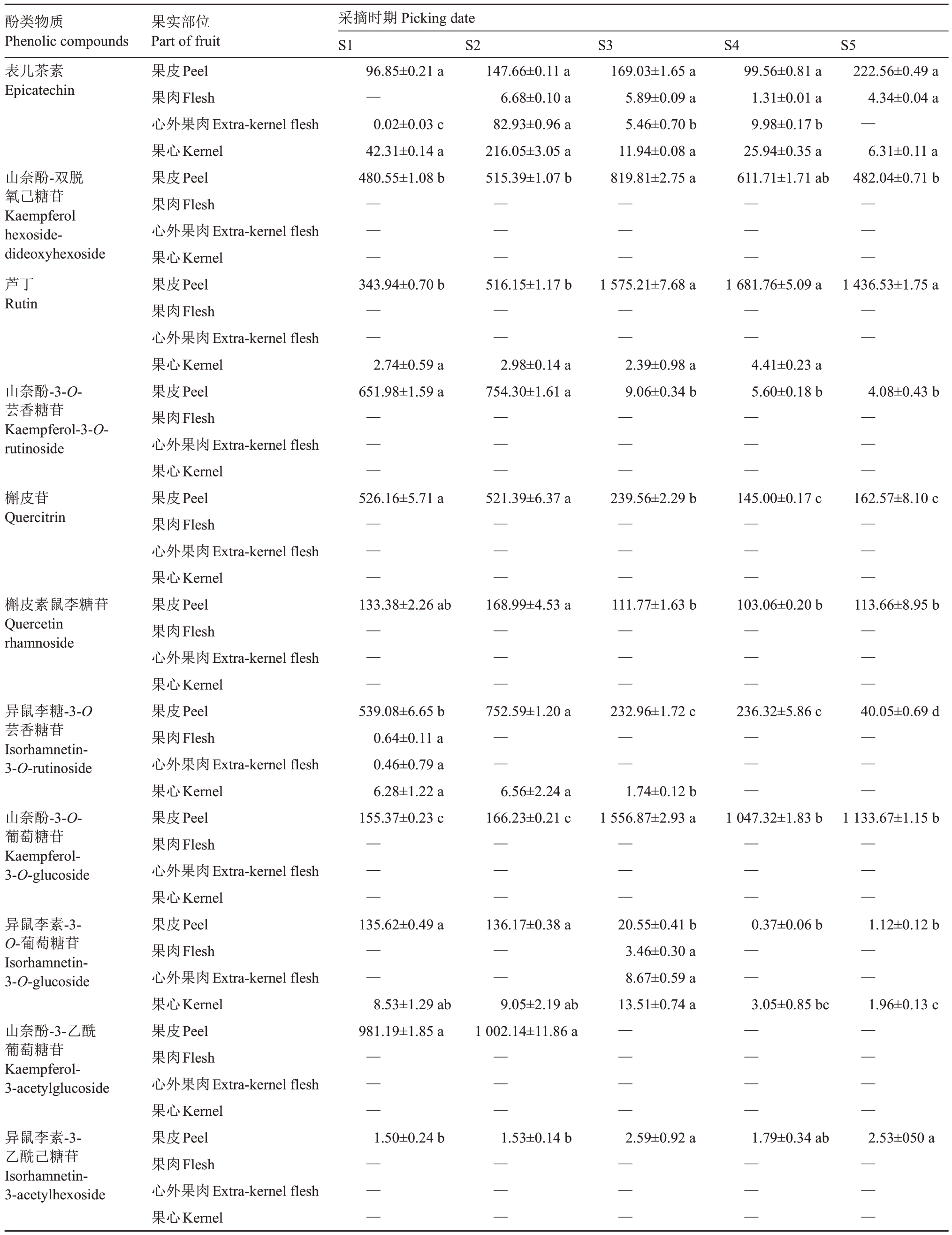
注:同列不同小写字母表示梨不同生长阶段差异显著(p<0.05)。“—”表示含量较低,未被检测出。
Note:Different small letters in the same column indicated significant differences in pear growth stages(p<0.05).“—”indicate the content ie low and not detected.
酚类物质Phenolic compounds果实部位Part of fruit采摘时期Picking date S1 S2 S3 S4 S5表儿茶素Epicatechin山奈酚-双脱氧己糖苷Kaempferol hexosidedideoxyhexoside芦丁Rutin 96.85±0.21 a—0.02±0.03 c 42.31±0.14 a 480.55±1.08 b 147.66±0.11 a 6.68±0.10 a 82.93±0.96 a 216.05±3.05 a 515.39±1.07 b果皮Peel果肉Flesh心外果肉Extra-kernel flesh果心Kernel果皮Peel果肉Flesh心外果肉Extra-kernel flesh果心Kernel果皮Peel果肉Flesh心外果肉Extra-kernel flesh果心Kernel果皮Peel果肉Flesh心外果肉Extra-kernel flesh果心Kernel果皮Peel果肉Flesh心外果肉Extra-kernel flesh果心Kernel果皮Peel果肉Flesh心外果肉Extra-kernel flesh果心Kernel果皮Peel果肉Flesh心外果肉Extra-kernel flesh果心Kernel果皮Peel果肉Flesh心外果肉Extra-kernel flesh果心Kernel果皮Peel果肉Flesh心外果肉Extra-kernel flesh果心Kernel果皮Peel果肉Flesh心外果肉Extra-kernel flesh果心Kernel果皮Peel果肉Flesh心外果肉Extra-kernel flesh果心Kernel 169.03±1.65 a 5.89±0.09 a 5.46±0.70 b 11.94±0.08 a 819.81±2.75 a 99.56±0.81 a 1.31±0.01 a 9.98±0.17 b 25.94±0.35 a 611.71±1.71 ab 222.56±0.49 a 4.34±0.04 a—6.31±0.11 a 482.04±0.71 b— —— —— —— —— —343.94±0.70 b 516.15±1.17 b 1 575.21±7.68 a 1 681.76±5.09 a 1 436.53±1.75 a——————a2.39±0.98 a4.41±0.23 a a9.06±0.34 b5.60±0.18 b 4.08±0.43 b——————a 239.56±2.29 b 145.00±0.17 c 162.57±8.10 c——————a 111.77±1.63 b 103.06±0.20 b 113.66±8.95 b——————a 232.96±1.72 c 236.32±5.86 c 40.05±0.69 d————a1.74±0.12 b— —c1 556.87±2.93 a 1 047.32±1.83 b 1 133.67±1.15 b——————a 20.55±0.41 b0.37±0.06 b 1.12±0.12 b 3.46±0.30 a— —8.67±0.59 a— —ab13.51±0.74 a3.05±0.85 bc 1.96±0.13 c a— — ————b 2.59±0.92 a 1.79±0.34 ab 2.53±050 a———————山奈酚-3-O-芸香糖苷Kaempferol-3-Orutinoside 2.74±0.59 a 651.98±1.59 a 2.98±0.14 754.30±1.61 — —— —槲皮苷Quercitrin 526.16±5.71 a 521.39±6.37 — —— —槲皮素鼠李糖苷Quercetin rhamnoside 133.38±2.26 ab 168.99±4.53 — —— —异鼠李糖-3-O芸香糖苷Isorhamnetin-3-O-rutinoside 752.59±1.20 539.08±6.65 b 0.64±0.11 a 0.46±0.79 a 6.28±1.22 a 155.37±0.23 c——山奈酚-3-O-葡萄糖苷Kaempferol-3-O-glucoside 6.56±2.24 166.23±0.21 — —— —异鼠李素-3-O-葡萄糖苷Isorhamnetin-3-O-glucoside 135.62±0.49 a 136.17±0.38 ————8.53±1.29 ab 981.19±1.85 a 9.05±2.19 1 002.14±11.86山奈酚-3-乙酰葡萄糖苷Kaempferol-3-acetylglucoside— —— —异鼠李素-3-乙酰己糖苷Isorhamnetin-3-acetylhexoside 1.50±0.24 b 1.53±0.14 — —— — — — —
2.3 生长发育时期果实抗氧化能力的变化
由图3所示,随着生长发育时期的不同,库尔勒香梨果实不同组织部位ABTS+自由基清除能力呈现先升高后降低的变化趋势。其中香梨果皮的ABTS+自由基清除能力最强,在S2 清除能力达到最高(18.11 μmol·g-1),其次是果心(15.92 μmol·g-1),果肉和心外果肉的清除能力相对较弱(7.54 μmol·g-1和7.62 μmol·g-1),果皮和果心提取物的ABTS+自由基清除能力是果肉与心外果肉的2.25 倍左右,具有显著差异(p <0.05)。
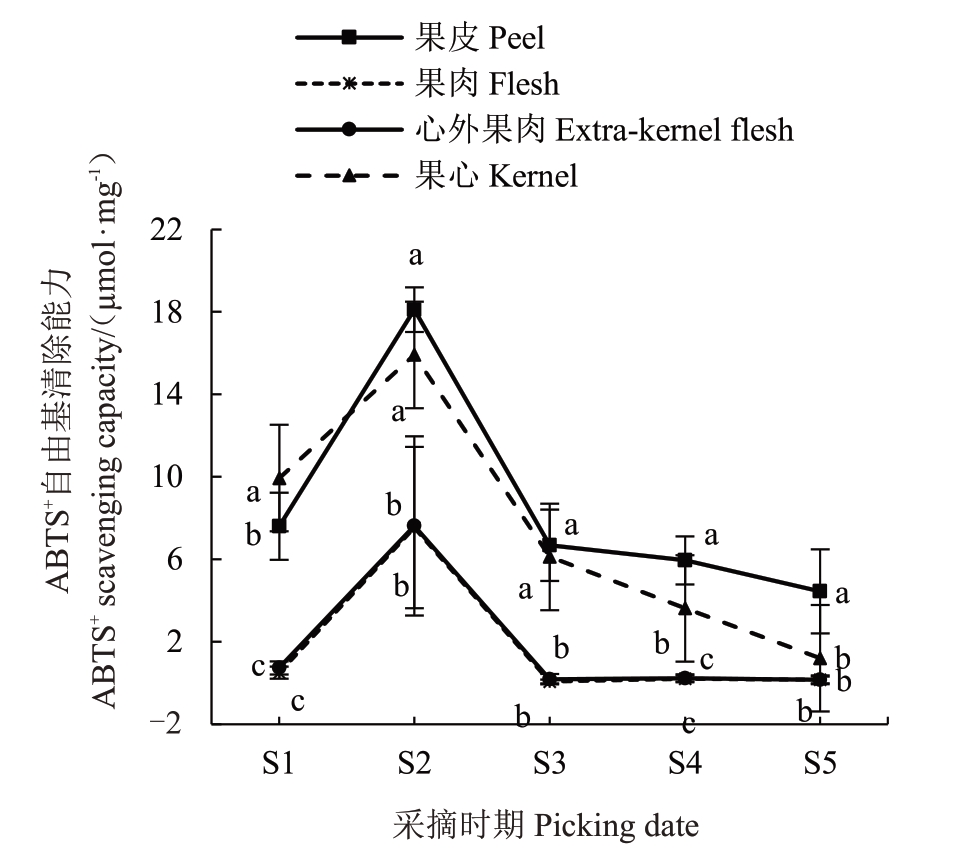
图3 库尔勒香梨果实ABTS+自由基清除能力的变化
Fig.3 Changes of ABTS+free radical scavenging ability of Kuerlexiangli pear fruit
由图4 所示,库尔勒香梨果实不同组织部位DPPH自由基清除能力变化趋势与ABTS+自由基清除能力相似,在S2 果皮、果肉和心外果肉的DPPH自由基清除能力达到峰值,分别为25.39、10.51、12.47 μmol·g-1,而果心的峰值往后推迟至S3,为30.99 μmol·g-1,库尔勒香梨果心的DPPH 自由基清除能力最高,分别是果皮、果肉和心外果肉的1.22、2.95、2.49倍,这说明库尔勒香梨果皮、果肉、心外果肉和果心的DPPH 自由基清除能力具有显著差异(p <0.05)。
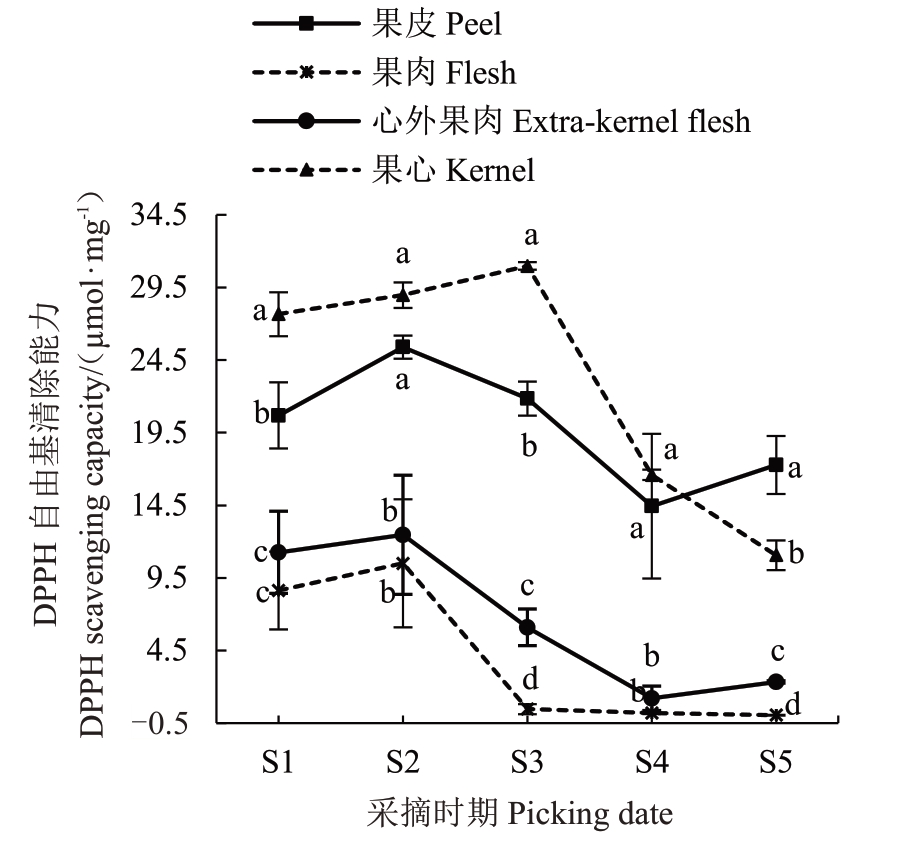
图4 库尔勒香梨果实DPPH 自由基清除能力的变化
Fig.4 Changes of DPPH free radical scavenging ability of kuerlexiangli pear fruit
由图5可以看出,随着生长发育时期的不同,库尔勒香梨果实不同组织部位的FRAP 呈现下降趋势,果心的铁还原能力最强,为13.41 μmol·g-1;其次是果皮,峰值为7.88 μmol·g-1;果肉和心外果肉的铁还原能力最弱,仅为果心的9.47%~9.61%,具有显著差异(p <0.05)。
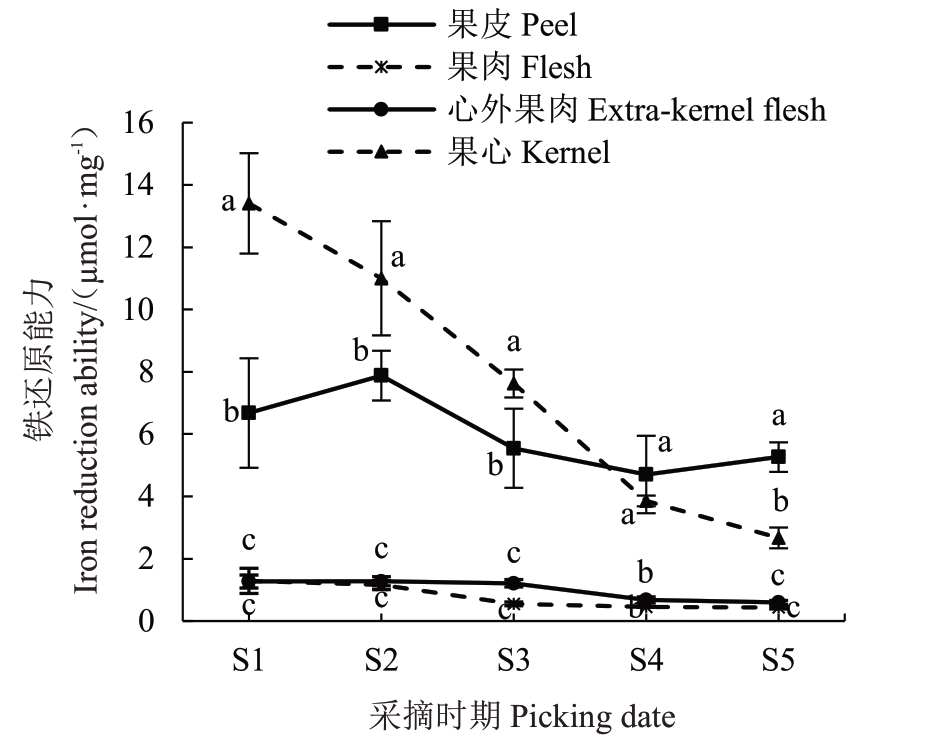
图5 库尔勒香梨果实FRAP 的变化
Fig.5 Changes of FRAP of Kuerlexiangli pear fruit
总体看来,库尔勒香梨果实中不同组织部位ABTS+自由基清除能力由高到低均为:果皮>果心>心外果肉>果肉;DPPH 自由基清除能力和FRAP 由高到低均为:果心>果皮>心外果肉>果肉,且两者变化趋势与总酚、总黄酮含量一致,说明果心和果皮的抗氧化能力较强,其提取物可用于医药、美妆领域。
2.4 香梨酚类物质与抗氧化活性的相关分析
利用系统软件对库尔勒香梨果实各部位酚类物质与抗氧化活性进行相关性分析。由表2 可以看出,库尔勒香梨果实中总酚、总黄酮、绿原酸、熊果苷、儿茶素、山奈酚-3-O芸香糖苷、槲皮苷、槲皮素鼠李糖苷、异鼠李糖-3-O-芸香糖苷、异鼠李素-3-O-葡萄糖苷、山奈酚-3-乙酰葡萄糖苷含量与抗氧化活性均呈正相关,与FRAP 铁还原能力呈显著正相关(p <0.05)或极显著正相关(p <0.01),相关系数由大到小为:总酚>总黄酮>槲皮素鼠李糖苷>山奈酚-3-O-芸香糖苷>槲皮苷>异鼠李素-3-O-葡萄糖苷>熊果苷>异鼠李糖-3-O-芸香糖苷、山奈酚-3-乙酰葡萄糖苷>绿原酸>儿茶素。梨果实DPPH自由基清除能力与总黄酮呈显著正相关(p <0.05)。ABTS+自由基清除能力与槲皮素鼠李糖苷、异鼠李糖-3-O-芸香糖苷呈显著正相关(p <0.05),文献中报道[22]芦丁、山奈酚-3-O-葡萄糖苷与DPPH 自由基清除能力和ABTS+自由基清除能力的相关性不显著,笔者在本研究中也证明了表儿茶素、山奈酚-双脱氧己糖苷、芦丁、山奈酚-3-O-葡萄糖苷和异鼠李素-3-乙酰己糖苷含量与抗氧化能力的相关性不显著,并且发现FRAP 与芦丁、山奈酚-3-O-葡萄糖苷含量呈显著正相关(p <0.05),说明了不同的酚类物质其作用也不同,因此对于酚类物质抗氧化能力的评价需要综合性分析。库尔勒香梨果实各部位酚类物质含量与抗氧化活性相关系数由小到大为:FRAP>DPPH 自由基清除能力>ABTS+自由基清除能力,在Kolniakostek[25]的研究中也表明了酚类物质的FRAP 明显高于DPPH 自由基清除能力,说明FRAP 是体现库尔勒香梨果实酚类物质抗氧化活性的重要指标。
表2 库尔勒香梨酚类物质与抗氧化活性的相关性分析
Table 2 Correlation analysis of phenolic compounds and antioxidant activity of Kuerlexiangli pear
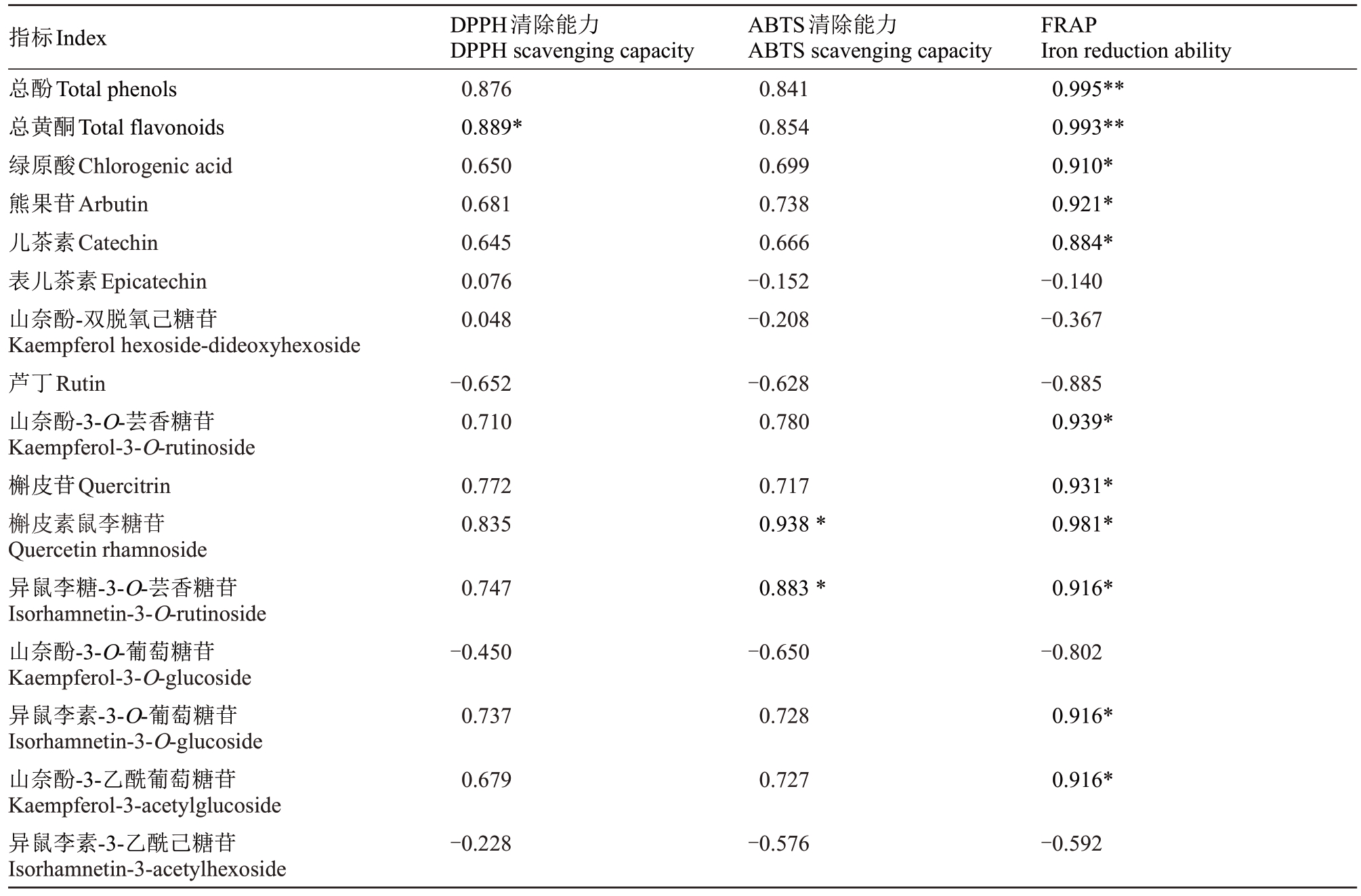
注:*表示显著相关(p<0.05),**表示极显著相关(p<0.01)。
Note:*indicated significant differences at p<0.05,**indicated extremely significant differences at p<0.01.
指标Index总酚Total phenols总黄酮Total flavonoids绿原酸Chlorogenic acid熊果苷Arbutin儿茶素Catechin表儿茶素Epicatechin山奈酚-双脱氧己糖苷Kaempferol hexoside-dideoxyhexoside芦丁Rutin山奈酚-3-O-芸香糖苷Kaempferol-3-O-rutinoside槲皮苷Quercitrin槲皮素鼠李糖苷Quercetin rhamnoside异鼠李糖-3-O-芸香糖苷Isorhamnetin-3-O-rutinoside山奈酚-3-O-葡萄糖苷Kaempferol-3-O-glucoside异鼠李素-3-O-葡萄糖苷Isorhamnetin-3-O-glucoside山奈酚-3-乙酰葡萄糖苷Kaempferol-3-acetylglucoside异鼠李素-3-乙酰己糖苷Isorhamnetin-3-acetylhexoside DPPH清除能力DPPH scavenging capacity 0.876 0.889*0.650 0.681 0.645 0.076 0.048 ABTS清除能力ABTS scavenging capacity 0.841 0.854 0.699 0.738 0.666-0.152-0.208 FRAP Iron reduction ability 0.995**0.993**0.910*0.921*0.884*-0.140-0.367-0.652 0.710-0.628 0.780-0.885 0.939*0.772 0.835 0.717 0.938*0.931*0.981*0.747 0.883*0.916*-0.450-0.650-0.802 0.737 0.728 0.916*0.679 0.727 0.916*-0.228-0.576-0.592
3 讨 论
酚类物质是植物中最重要、分布和研究最广泛的次生代谢物质,可参与植物生殖发育,协助其抗逆,各类植物在不同的时期表现出不同的积累含量。库尔勒香梨在生长发育时期,果心的总黄酮、总酚含量逐渐下降,果皮、果肉和心外果肉的总黄酮、总酚含量变化呈S 形波动,这与赵金伟等[26]对苹果梨果皮和果肉的总黄酮、总酚含量变化趋势的研究稍有不同,但都是幼果期含量最高,成熟期含量最低,分析其原因可能是果实发育早期酚类物质合成比较迅速,而后期逐渐变缓或停止,同时酚类物质的转化加快,从而造成总量的下降,这也与Harel 等[27]和王思新等[28]的推理相一致。在库尔勒香梨果实发育过程中,不同组织部位酚类物质含量有明显差异,香梨果实发育前期果心的酚类物质含量高于果皮,在果心中总黄酮含量是果皮的1.60~2.90倍,总酚含量是果皮的1.03~1.52 倍,目前有关梨品种中果皮、果肉、心外果肉和果心酚类物质含量的动态研究较少,不过有大量梨果实褐变方面的研究表明,果实的褐变与酚类物质有密切关系,或许可以从这一方面进行探讨,其中,梨果实中果肉与果心是褐变的主要组织部位,李月圆[29]在对鸭梨果心褐变的研究中发现,早采鸭梨保持了较高的POD 活性,其褐变指数最低,这说明早期的鸭梨果心酚类物质含量较高,抗氧化活性较强。而在果实成熟时期果皮的总酚、总黄酮和酚类物质含量均高于果心,这与马利华等[30]和Kolniakostek[25]等研究的成熟时期黄冠梨和Radana 梨果皮的总黄酮和总酚含量大于果心的结果一致。在库尔勒香梨果实发育过程中主要的单体酚类物质是熊果苷和绿原酸,熊果苷在果皮中的含量最高,绿原酸则主要分布在果心中,这与王鑫等[31]研究的绿宝石梨的结果一致,但笔者对酚类物质在果实各组织部位的分布进行了研究,丰富了梨果实中酚类物质的含量及分布情况。
果实的抗氧化是酚类物质共同作用的结果,其中DPPH法、ABTS+法和FRAP法是评价体外抗氧化活性最主要的方法之一,可以间接反映抗氧化能力,是酚类物质最重要的性质[22];尽管在库尔勒香梨果实生长发育过程中,果实不同部位抗氧化活性(DPPH 自由基清除能力、FARP 和ABTS+自由基清除能力)呈现了不完全一致的变化趋势,但香梨果实的抗氧化能力均为果皮和果心最强;库尔勒香梨果实中总酚、总黄酮对果实各部位的抗氧化活性的贡献最大,其中与FRAP相关程度最高(相关系数R在0.9左右),其次为DPPH自由基清除能力,相关性最低的是ABTS+自由基清除能力,与安景舒等[32]报道的5种梨果皮和果心中的总酚、总黄酮含量与DPPH自由基清除能力和FRAP 呈及显著正相关(p <0.01)一致,这说明DPPH 自由基清除能力和FRAP可以很好地体现香梨的抗氧化能力。
4 结 论
在库尔勒香梨果实生长发育过程中,总酚和总黄酮含量整体呈现由高到低的变化趋势。不同果实部位的总酚和总黄酮含量差异显著。库尔勒香梨果实表现出较高的抗氧化活性,其中果心的抗氧化活性最高。库尔勒香梨的抗氧化能力与总酚、总黄酮以及部分单体酚类物质含量呈显著正相关。南疆是我国库尔勒香梨种植面积及产量最大的地区,研究结果一方面明确了库尔勒香梨酚类物质含量及抗氧化能力的变化趋势,为酚类物质的提取提供了材料来源,另一方面也为梨果产品加工所产生的皮渣、果心等废弃物的利用提供了理论依据。
[1]刘艳,吴运建.库尔勒香梨研究进展[J].新疆农垦科技,2015,38(2):23-26.LIUYan,WUYunjian.Research progress of Korla fragrant pear[J].Xinjiang Agricultural Reclamation Science and Technology,2015,38(2):23-26.
[2]陈学森,王楠,张宗营,冯守千,陈晓流,毛志泉.仁果类果树资源育种研究进展Ⅰ:我国梨种质资源、品质发育及遗传育种研究进展[J].植物遗传资源学报,2019,20(4):791-800.CHEN Xuesen,WANG Nan,ZHANG Zongying,FENG Shouqian,CHEN Xiaoliu,MAO Zhiquan.Progress on the resource and breeding of kernel fruitsⅠ:Progress on the germplasm resources,quality development and genetics and breeding of pear in China[J].Journal of Plant Genetic Resources,2019,20(4):791-800.
[3]张芳,未志胜,王鹏,李凯旋,詹萍,田洪磊.基于BP 神经网络和遗传算法的库尔勒香梨挥发性物质萃取条件的优化[J].中国农业科学,2018,51(23):35-47.ZHANG Fang,WEI Zhisheng,WANG Peng,LI Kaixuan,ZHAN Ping,TIAN Honglei.Using neural network coupled genetic algorithm to optimize the spme conditions of volatile compounds in korla pear[J].Scientia Agricultura Sinica,2018,51(23):35-47.
[4]广新梅,徐崇志,王绪春,兰海鹏,刘扬.采摘期内库尔勒香梨品质指标变化规律及相关关系[J].江苏农业科学,2018,46(19):118-121.GUANG Xinmei,XU Chongzhi,WANG Xuchun,LAN Haipeng,LIU Yang.Variation of Korla fragrant pear quality index during picking period and related relationships[J].Jiangsu Agricultural Sciences,2018,46(19):118-121.
[5]陈源,潘鹤立,尤有利,吴玉华,潘东明,余文权.不同成熟期金柑果实酚类物质含量的动态变化规律[J].福建农业科技,2020(11):7-11.CHEN Yuan,PAN Heli,YOU Youli,WU Yuhua,PAN Dongming,YU Wenquan.The dynamic changes of phenolic substance content in kumquat fruits at different maturity stages[J].Fujian Agricultural Science and Technology,2020(11):7-11.
[6]仉劲,李国清,于清伟,毕研文,陈宝芳.不同采收时期金银花中化学成分及其相关酶活性分析[J].中国农学通报,2019,35(19):73-77.ZHANG Jin,LI Guoqing,YU Qingwei,BI Yanwen,CHEN Baofang.Chemical components and relevant enzyme activity of lonicera japonica at different harvest stages[J].Chinese Agricultural Science Bulletin,2019,35(19):73-77.
[7]陈国刚,王祯丽,童军茂.库尔勒香梨采后果实褐变与多酚氧化酶、酚类物质及细胞膜结构的关系[J].中国农学通报,2005,21(8):83-85.CHEN Guogang,WANG Zhenli,TONG Junmao.Relationship among postharvest browning of Pyrus bretschneideri Rehd.,polyhenol oxidase,phenolics compound,cell membrane structure[J].Chinese Agricultural Science Bulletin,2005,21(8):83-85.
[8]刘思凡,刘子雨,李萍,吴莉,黄浩然,单守明.欧山种葡萄果实成熟期酚类物质含量及其合成相关基因表达量的比较[J].湖南农业大学学报(自然科学版),2021,47(1):30-34.LIU Sifan,LIU Ziyu,LI Ping,WU Li,HUANG Haoran,SHAN Shouming.Comparison of the content of phenolic compounds and the expression levels of their biosynthesis related genes in ripening stage of Vitis vinifera × Vitis amurensis red grape[J].Journal of Hunan Agricultural University (Natural Sciences),2021,47(1):30-34.
[9]HE Jingang,CHENG Yudou,GUAN Junfeng,GE Wenya,ZHAO Zhe.Changes of chlorogenic acid content and its synthesis-associated genes expression in Xuehua pear fruit during development[J].Journal of Integrative Agriculture,2017,16(2):471-477.
[10]冯丽,宋曙辉,赵霖,徐桂花.植物多酚种类及其生理功能的研究进展[J].江西农业学报,2007,19(10):105-107.FENG Li,SONG Shuhui,ZHAO Lin,XU Guihua.Progress in plant polyphenols and their physiological functions[J].Journal of Jiangxi Agriculture,2007,19(10):105-107.
[11]朱洁,王红宝,孔佳君,宋小飞,陶书田.梨幼果多酚的纯化及其抗氧化性[J].食品科学,2017,38(5):14-20.ZHU Jie,WANG Hongbao,KONG Jiajun,SONG Xiaofei,TAO Shutian.Purifification and antioxidant activity of polyphenols from young pear fruits[J].Food Science,2017,38(5):14-20.
[12]侯玉茹,李文生,王宝刚,苗飞,杨军军,石磊.不同品种梨果实贮藏期间抗氧化活性及品质分析[J].食品工业科技,2015,36(2):335-338.HOU Yuru,LI Wensheng,WANG Baogang,MIAO Fei,YANG Junjun,SHI Lei.Study on antioxidant activity and quality of different pears during storage[J].Science and Technology of Food Industry,2015,36(2):335-338.
[13]吴燕华,刘文力,阎红,李楠,蔡同一.高效液相色谱法测定苹果中的酚类物质[J].分析化学,2002(7):826-828.WU Yanhua,LIU Wenli,YAN Hong,LI Nan,CAI Tongyi.Determination of the phenolic compounds in apple juice by high performance liquid chromatography[J].Chinese Journal of Analytical Chemistry,2002(7):826-828.
[14]乌英,解云,古娜娜·对山别克,海力茜·陶尔大洪.超声波辅助提取库尔勒香梨果肉和果皮中总黄酮的工艺研究[J].安徽农业科学,2014,42(26):9148-9152.WU Ying,XIE Yun,Gunana·Duishanbieke,Hailixi·Taoerdahong.Ultrasonic-assisted extraction of total flavonoids from the pulp and peel of Korla fragrant pear[J].Journal of Anhui Agricultural Sciences,2014,42(26):9148-9152.
[15]LIN L Z,HARNLY J M.Phenolic compounds and chromatographic profiles of pear skins(Pyrus spp.)[J].Journal of Agricultural and Food Chemistry,2008,56(19):9094-9101.
[16]KOLNIAKOSTEK J.Content of bioactive compounds and antioxidant capacity in skin tissues of pear[J].Journal of Functional Foods,2016,23(2):40-51.
[17]WANG Z N,BARROW C J,DUNSHEA F R,SULERIA H A R.A comparative investigation on phenolic composition,characterization and antioxidant potentials of five different australian grown pear varieties[J].Antioxidants,2021,10(2):151.
[18]王震涛,兰海鹏,牛浩,张宏,曾勇,张永成,刘扬.库尔勒香梨贮藏品质的量化评价方法[J].现代食品科技,2020,36(5):138-147.WANG Zhentao,LAN Haipeng,NIU Hao,ZHANG Hong,ZENG Yong,ZHANG Yongcheng,LIU Yang.A method for the quantitative evaluation of storage quality of Korla fragrant pear[J].Modern Food Science and Technology,2020,36(5):138-147.
[19]杜林笑,赵晓敏,李丹,马楠,李学文.1-MCP 处理保持库尔勒香梨常温贮藏抗氧化酶活性与品质的关系[J].现代食品科技,2018,34(11):95-102.DU Linxiao,ZHAO Xiaomin,LI Dan,MA Nan,LI Xuewen.Relationship between 1-MCP treatment and antioxidant enzyme activities and quality of Korla fragrant pear during room-temperature storage[J].Modern Food Science and Technology,2018,34(11):95-102.
[20]KOLNIAKOSTEK J,KŁOPOTOWSKA D,RUTKOWSKI K P.Bioactive compounds and health-promoting properties of pear(Pyrus communis L.)fruits[J].Molecules,2020,25(19):4444.
[21]LI X,WANG T T,ZHOU B,GAO W Y,CAO J G,HUANG L Q.Chemical composition and anti-inflammatory and antioxidant activities of eight pear cultivars[J].Journal of Agricultural and Food Chemistry,2012,60(35):8738-8744.
[22]姜喜,唐章虎,吴翠云,王鑫,蒲云峰,郭丽.3 个梨品种果实发育过程中酚类物质及其抗氧化能力分析[J].食品科学,2021,1-12.http://kns.cnki.net/kcms/detail/11.2206.TS.20210108.1523.010.html.JIANG Xi,TANG Zhanghu,WU Cuiyun,WANG Xin,PU Yunfeng,GUO Li.Analysis of phenolic substances and antioxidant capacity of three pear fruits during development[J].Food Science,2021,1-12.http://kns.cnki.net/kcms/detail/11.2206.TS.20210108.1523.010.html.
[23]PU Y F,DING T,ZHONG J J,WANG W J,YE X L,LIU D H.Effect of harvest,drying and storage on the bitterness,moisture,sugars,free amino acids and phenolic compounds of jujube fruit(Zizyphus jujuba cv.Junzao)[J].Journal of the Science of Food and Agriculture,2018,98(2):628-634.
[24]蒲云峰,丁甜,钟建军,王文骏,叶兴乾,刘东红.新疆12 种干果的营养品质及抗氧化分析[J].中国食品学报,2019,19(5):287-294.PU Yunfeng,DING Tian,ZHONG Jianjun,WANG Wenjun,YE Xingqian,LIU Donghong.Analysis of nutrition quality and antioxidant capability of 12 species of dried fruits in Xinjiang[J].Journal of Chinese Institute of Food Science and Technology,2019,19(5):287-294.
[25]KOLNIAKOSTEK J.Chemical composition and antioxidant capacityofdifferentanatomicalpartsofpear(PyruscommunisL.)[J].Food Chemistry,2016,203(2):491-497.
[26]赵金伟,李范洙,崔泰花,张先.苹果梨生育期酚类物质的分析[J].食品工业科技,2009,30(9):105-107.ZHAO Jinwei,LI Fanzhu,CUI Taihua,ZHANG Xian.Analysis of phenolic compounds in apple-pear fruit during the growth period[J].Science and Technology of Food Industry,2009,30(9):105-107.
[27]HAREL E,MAYER A M,SHAIN Y.Catechol oxidases,endogenous sub-strates and browning in developing apples[J].Journal of the Science of Food and Agriculture,1966,17(9):389-392.
[28]王思新,刘杰超,焦中高,张顺妮,杨丽.苹果中多酚物质及其在果实发育过程中的变化[J].果树学报,2003,20(6):427-431.WANG Sixin,LIU Jiechao,JIAO Zhonggao,ZHANG Shunni,YANG Li.Polyphenols in apples and their changes during fruit development[J].Journal of Fruit Science,2003,20(6):427-431.
[29]李月圆.降温方式与采收成熟度对鸭梨果心褐变及相关基因的影响[D].太原:山西农业大学,2019.LI Yueyuan.Effect of cooling mode and harvesting maturity on browning of duck pear fruit hearts and related genes[D].Taiyuan:Shanxi Agricultural University,2019.
[30]马利华,秦卫东,陈学红.梨皮与梨心提取物抗氧化活性的研究[J].农业机械,2011(29):156-158.MA Lihua,QIN Weidong,CHEN Xuehong.Study on the antioxidant activity of pear peel and pear seed extract[J].Agricultural Machinery,2011(29):156-158.
[31]王鑫,姜喜,于军,蒲云峰,林彩霞,吴翠云.绿宝石梨果实发育期酚类物质的动态变化及其抗氧化活性[J].塔里木大学学报,2021,33(2):25-31.WANG Xin,JIANG Xi,YU Jun,PU Yunfeng,LIN Caixia,WU Cuiyun.The dynamic changes of phenolic compounds and their antioxidant activities during fruit development of Lubaoshi pear[J].Journal of Tarim University,2021,33(2):25-31.
[32]安景舒,关晔晴,程玉豆,牟德华,关军锋.5 个梨品种果实不同部位的总酚、黄酮含量及其抗氧化能力分析[J].保鲜与加工,2020,20(3):162-166.AN Jingshu,GUAN Yeqing,CHENG Yudou,MOU Dehua,GUAN Junfeng.Analysis of total phenolics and flavonoids contents and their antioxidant capacity in different parts of five pear varieties[J].Storage and Process,2020,20(3):162-166.