多聚半乳糖醛酸酶(polygalacturonase,PG)是一种果胶酶,能够催化多聚半乳糖醛酸的分解,广泛存在于植物、细菌及真菌中,在种子萌发、器官脱落、荚果和花药开裂及果实软化等方面具有重要作用[1-2]。研究发现,病原菌在侵染宿主植物时可分泌多聚半乳糖醛酸酶来降解宿主细胞的细胞壁,致使病程进一步发展[3]。按照水解方式的不同,PG 分为内切半乳糖醛酸酶(endo-PG)、外切半乳糖醛酸酶(exo-PG)和鼠李糖半乳糖苷酶(olio-PG),其能够在不同部位对α-(1-4)聚半乳糖苷键进行催化水解[4-6]。
PG 作为大基因家族在植物发育不同阶段和不同组织中均有表达。同时,PG 基因家族在玉米、油菜和很多木本树的花粉中都具有高水平的活性,表明其在花粉发育和授粉过程中可能起着一定作用[7–9]。此外,PG 基因家族还参与了果实的成熟软化[10]。研究发现,长把梨在采后贮藏过程中果肉的PG活性迅速提高,从而影响其果实质地及组织的稳固结构[11];Huang等[12]在猕猴桃果实中发现3个与果实软化密切相关的PG 基因(AcPG4、AcPG18 和AcPG8);匡盛[13]也发现猕猴桃海沃德和红阳果实中PG活性与果胶降解和果实软化显著相关;研究表明,较低的PG 活性可提高番茄果实硬度并降低果实的软化和开裂,同时通过反义RNA转化技术减少PG活性水平从而显著降低番茄果实裂果[14-15];在荔枝和西瓜的研究中发现易裂品种果皮PG 活性明显高于抗裂品种[16-17]。在许多物种果实的脱落区检测到高表达的PG,例如在桃成熟果实基部的脱落区发现PG高水平表达,油棕果实也出现同样的现象[18-19]。在豆荚的开裂区鉴定到编码假定裂开区专化表达PG的cDNA,说明PG对豆荚的裂开起作用[20]。目前,已在苹果[21]、桃[22]、葡萄[23]、枣[24]、杧果[25]等多种果树中鉴定了PG基因家族功能及表达模式。
莲雾[Syzygium samarangense(Bl.)Merr.et Perry]是 桃 金 娘 科(Myrtaceae)蒲 桃 属(Syzygium Gaertn.)热带果树。莲雾果皮薄,在果实发育中后期易发生裂果,不仅严重影响果实的外观品质和产量,并且裂果后果实易发生不同程度的贮存病害,进而大大缩短果实的贮藏期和保质期[26-27]。Lu等[28]研究推测,莲雾在果实成熟过程中PG活性的增加导致细胞壁的软化,从而降低果皮弹性,导致果实开裂。脱落酸(Abscisic acid,ABA)可以抑制植物生长,参与器官衰老、种子休眠和果实开裂。枣开裂的果皮中ABA含量显著高于非开裂部位[29]。李建国等[30]研究发现喷洒ABA 可以增加荔枝果实的膨大率和开裂率。笔者在本研究中通过生物信息学的方法鉴定莲雾PG 基因家族,进行了系统演化和表达模式的分析,为进一步研究莲雾PG基因在果实发育中的作用提供依据。
1 材料和方法
1.1 材料
在莲雾果实转色期,用100 μmol·L-1的外源脱落酸(abscisic acid,ABA)喷施莲雾果实,以喷施蒸馏水为对照,处理2 组。其中一组1 h、4 d、7 d、10 d后采集果皮,每个时间段设3个生物学重复,每个重复混合称取果皮100 g,立即置于液氮中速冻,–80 ℃保存备用。另一组10 d后统计果实裂果情况。
果皮PG 酶活性采用索莱宝的PG 活性检测试剂盒检测。酶活性定义:在40 ℃、pH 6.0 的条件下,每mL 样本每h 分解多聚半乳糖醛酸产生1 μmol 的半乳糖醛酸定义为1个酶活性单位。测定540 nm处的吸光度,记为A测定管、A对照管、A空白管、A标准管,计算ΔA=A 测定管-A 对照管,ΔA 标准=A 标准管-A空白管。以各个标准溶液的浓度为x轴,其对应的ΔA 标准为y 轴,绘制标准曲线,得到标准方程y=kx+b,将ΔA带入方程得到x(μmol·mL-1)。PG酶活性/(U·mL-1)=x×V 样/V 样/T=0.5x(V 样:反应体系中样本体积,0.05 mL;T:酶促反应时间,2 h)。采用SPSS 软件对同一时间点内试验组与对照组进行差异显著性分析,p<0.05表示结果具有差异显著性。
外源ABA 处理后莲雾果皮转录组和莲雾基因组数据来源于莲雾课题组(福建省农业科学院果树所),其中莲雾基因组数据正在整理,准备发表。
1.2 SsPGs 基因家族成员的鉴定及蛋白理化性质分析
以拟南芥PG蛋白[31]的氨基酸序列作为参照,利用Pfam(http://pfam.xfam.org/)数据库下载的PG 蛋白特征结构域Glyco_hydro_28(PF00295)隐马尔可夫模型进一步确认,使用TBtool[32]软件的Blast 功能进行莲雾PG 全基因组鉴定,共鉴定出32 个SsPGs。此外,At4g20050(AtQRT3)[33]虽不含有PG基因特征结构域,但已被证明为PG基因,因此对其在莲雾基因组中进行单独同源基因比对,共鉴定到2 个与之对应的基因。进一步利用Pfam数据库和NCBI(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)在线网站对34 个SsPGs 基因的候选蛋白保守结构域进行验证,剔除过短、严重缺失PG蛋白保守结构域的基因,最后从莲雾全基因组中共鉴定出25个PG 基因。利用Expasy Protoparam(https://web.expasy.org/protparam/)在线网站预测莲雾PG蛋白长度、相对分子质量、理论等电点以及不稳定系数。
1.3 SsPGs基因家族成员共线性分析
利用TBtool软件,使用其Advanced Circos和Dual Systeny Plotter功能分别对鉴定序列进行物种内和物种间共线性分析;使用其Simple Ka/Ks Calculator(NG)计算共线性基因对之间Ka、Ks和Ka/Ks值。
1.4 系统进化树的构建
从 EnsemblPlants(http://plants.ensembl.org/index.html)下载获得拟南芥(Arabidopsis thaliana)、番茄(Solanum lycopersicum)、苹果(Malus domestica Golden)、葡萄(Vitis vinifera)的PG 蛋白序列。使用ClustalX2 软件对拟南芥、番茄、葡萄、枣、苹果PG蛋白和莲雾PG候选蛋白进行多重序列比对,利用TBtool 软件,采用最大似然估计法(maximum likelihood)构建系统进化树(Bootstrap 值为1000 次),并利用ITOL(https://itol.embl.de)进行分类和注释。
1.5 SsPGs基因家族结构与保守基序分析
使用ClustalX2对莲雾PG候选蛋白进行多重序列比对,采用系统默认参数,利用GENEDOC对比对结果进行标识和美化。利用在线网站MEME(https://memesuite.org/me-me/tools/meme)鉴定SsPGs 保守基序(最大基序参数为10,其余采用默认参数)。利用TBtools 绘制SsPGs基因结构和保守基序示意图。
1.6 SsPGs基因家族启动子顺式作用元件分析
利用TBtool从莲雾基因组中获得SsPGs基因翻译起始位点的2000 bp 上游序列。使用在线顺式元件分析网站PlantCARE(http://bionformatics.psb.ugent.be/webtools/plantca-re/html)预测启动子区顺式作用元件,通过TBtools对预测结果可视化。
1.7 SsPGs基因家族表达分析
从莲雾转录组数据中提取SsPGs在不同组织器官(根、茎、叶、花、子房和果肉)特异性表达的RPKM值,从外源ABA 处理后果皮的转录组数据中提取SsPGs 特异性表达的FPKM 值。利用TBtools 绘制热图,分析SsPGs各成员的表达趋势。
1.8 SsPGs 基因家族成员在外源ABA 处理下的qRT-PCR分析
采用诺唯赞的MiPure Cell/Tissue miRNA Kit(离心柱型)试剂盒提取总RNA,采用诺唯赞的HiScript ⅢRT SuperMix for qPCR(+g DNA wiper)试剂盒反转录获得cDNA。利用Primer 5.0 和TBtool 的Primer Check (Simple e-PCR)功能对所选序列进行qRT-PCR 引物设计和筛选(表1)。以EF-1ɑ 为内参基因[34],荧光定量PCR 仪为QuantStudioTM 7 Flex Real-Time PCR System。反应体系为10 μL:2×ChamQ Universal SYBR qPCR Master mix 5 μL,100 μg·L-1 cDNA模板1 μL,10 μmol·L-1的上下游引物各0.4 μL,ddH2O 加至10 μL。反应程序为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火34 s,循环次数40;95 ℃变性15 s,60 ℃退火60 s,95 ℃变性15 s。相对表达量用2-ΔΔCt法计算。采用SPSS软件进行差异显著性分析,p <0.05表示结果具有差异显著性。
表1 荧光定量PCR 引物
Table 1 Primers for qRT-PCR
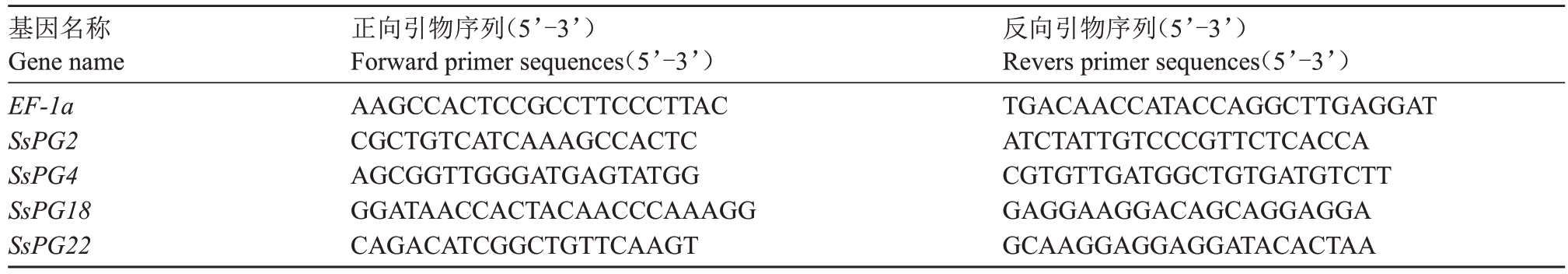
基因名称Gene name EF-1ɑ SsPG2 SsPG4 SsPG18 SsPG22正向引物序列(5’-3’)Forward primer sequences(5’-3’)AAGCCACTCCGCCTTCCCTTAC CGCTGTCATCAAAGCCACTC AGCGGTTGGGATGAGTATGG GGATAACCACTACAACCCAAAGG CAGACATCGGCTGTTCAAGT反向引物序列(5’-3’)Revers primer sequences(5’-3’)TGACAACCATACCAGGCTTGAGGAT ATCTATTGTCCCGTTCTCACCA CGTGTTGATGGCTGTGATGTCTT GAGGAAGGACAGCAGGAGGA GCAAGGAGGAGGATACACTAA
2 结果与分析
2.1 SsPGs 基因家族成员的鉴定及蛋白理化性质分析
用拟南芥PG 蛋白序列作为查询序列在莲雾全基因组中共鉴定出25 个PG 基因。其中,SsPGs 基因家族成员主要分布在2~41号染色体上,并根据从上到下在染色体上的位置分别命名为SsPG1~SsPG25(图1)。其中,18和41号染色体分别有5个SsPGs基因;2、5、25和35号染色体分别有4、2、3和2个SsPGs基因;9、15、21和37号染色体上分别只有1 个SsPGs 基因。SsPGs 在染色体上呈不均匀分布,且大多数基因分布在染色体两端。2 号染色体上的SsPG3 与SsPG4 和18 号染色体上的SsPG12与SsPG13发生串联重复现象。
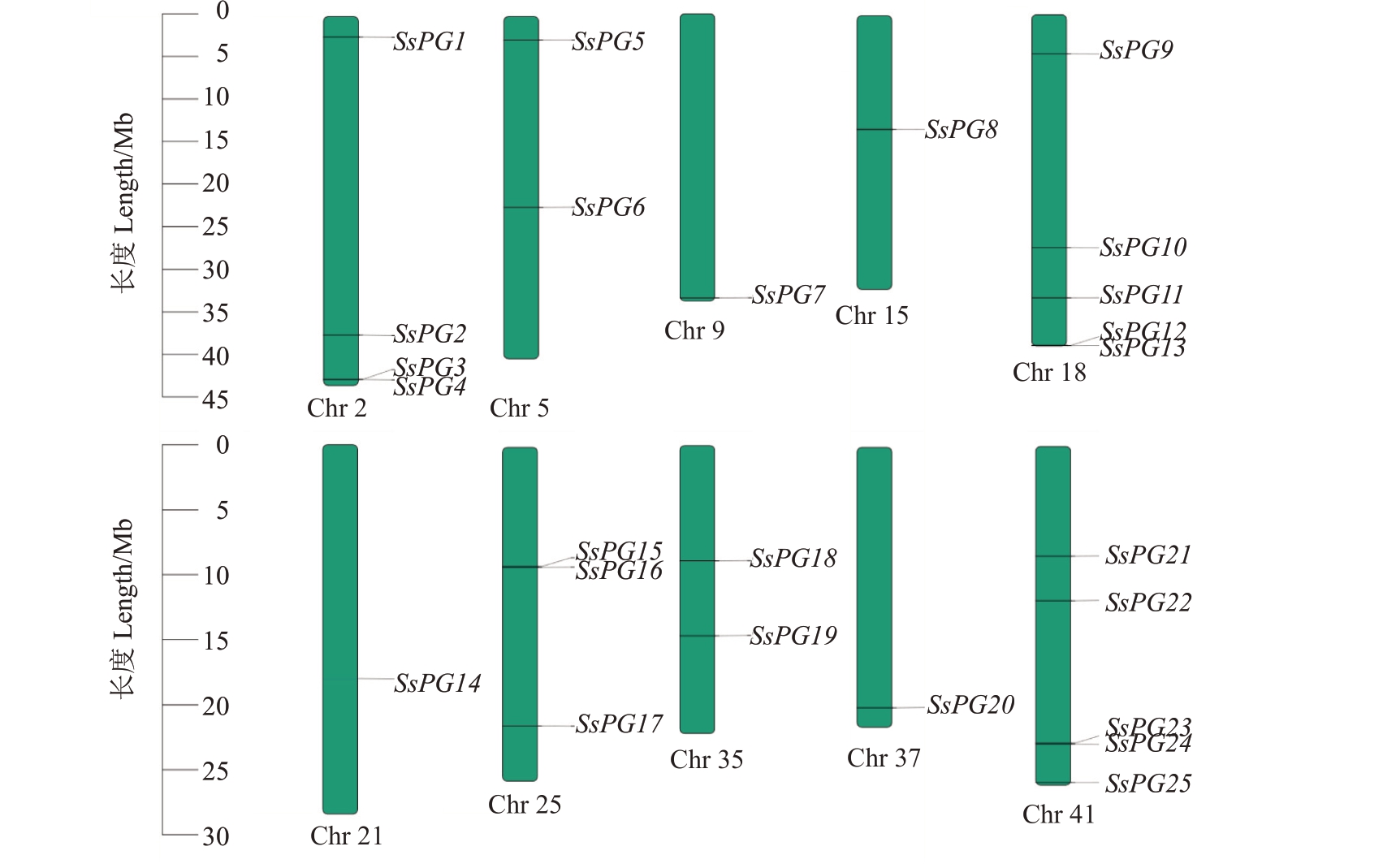
图1 SsPGs 基因家族在染色体的分布
Fig.1 The distribution of SsPGs in chromosomes of wax apple[Syzygium samarangense(Bl.)Merr.et Perry]
表2列出了25个SsPGs基因家族蛋白的物理和化学性质,包括等电点(isoelectric point,pI)、分子质量和编码序列(coding sequence,CDS)长度。分析结果显示,CDS长度从262(SsPG2)~781 aa(SsPG8)不等,平均为464 aa;最低分子质量为28.27 ku(SsPG2),最高分子质量为84 ku(SsPG8);pI值介于5.16(SsPG6)~9.67(SsPG15)之间,其中53.84%显酸性,46.16%显碱性,说明SsPGs基因家族蛋白酸碱性差异较大;不稳定系数介于27.48(SsPG9)~59.88(SsPG6)之间,由于不稳定系数小于40代表稳定,大于40为不稳定,因此有14个SsPGs基因家族蛋白稳定,11 个SsPGs 基因家族蛋白不稳定;41 号染色体上的SsPG23 与SsPG24 具有相同的CDS 长度、外显子数和蛋白序列,但是基因长度不一样,说明他们可能是同源基因,具有相同的功能。
表2 SsPGs 基因家族蛋白理化性质
Table 2 The physicochemical property of protein of SsPGs
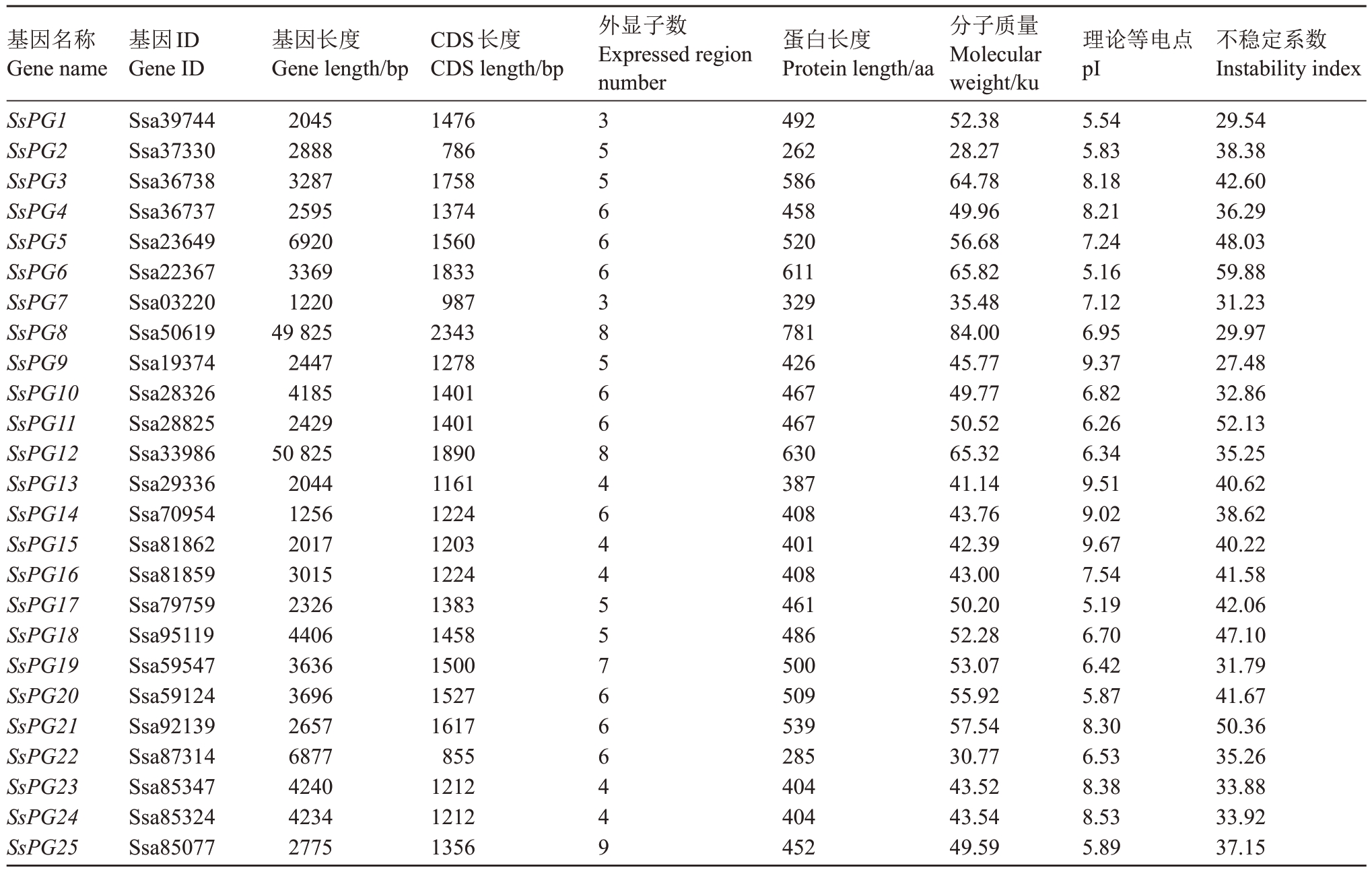
基因名称Gene name SsPG1 SsPG2 SsPG3 SsPG4 SsPG5 SsPG6 SsPG7 SsPG8 SsPG9 SsPG10 SsPG11 SsPG12 SsPG13 SsPG14 SsPG15 SsPG16 SsPG17 SsPG18 SsPG19 SsPG20 SsPG21 SsPG22 SsPG23 SsPG24 SsPG25基因ID Gene ID Ssa39744 Ssa37330 Ssa36738 Ssa36737 Ssa23649 Ssa22367 Ssa03220 Ssa50619 Ssa19374 Ssa28326 Ssa28825 Ssa33986 Ssa29336 Ssa70954 Ssa81862 Ssa81859 Ssa79759 Ssa95119 Ssa59547 Ssa59124 Ssa92139 Ssa87314 Ssa85347 Ssa85324 Ssa85077基因长度Gene length/bp 2045 2888 3287 2595 6920 3369 1220 49 825 2447 4185 2429 50 825 2044 1256 2017 3015 2326 4406 3636 3696 2657 6877 4240 4234 2775 CDS长度CDS length/bp 1476 786 1758 1374 1560 1833 987 2343 1278 1401 1401 1890 1161 1224 1203 1224 1383 1458 1500 1527 1617 855 1212 1212 1356外显子数Expressed region number 3 5 5 6 6 6 3 8 5 6 6 8 4 6 4 4 5 5 7 6 6 6 4 4 9蛋白长度Protein length/aa 492 262 586 458 520 611 329 781 426 467 467 630 387 408 401 408 461 486 500 509 539 285 404 404 452分子质量Molecular weight/ku 52.38 28.27 64.78 49.96 56.68 65.82 35.48 84.00 45.77 49.77 50.52 65.32 41.14 43.76 42.39 43.00 50.20 52.28 53.07 55.92 57.54 30.77 43.52 43.54 49.59理论等电点pI 5.54 5.83 8.18 8.21 7.24 5.16 7.12 6.95 9.37 6.82 6.26 6.34 9.51 9.02 9.67 7.54 5.19 6.70 6.42 5.87 8.30 6.53 8.38 8.53 5.89不稳定系数Instability index 29.54 38.38 42.60 36.29 48.03 59.88 31.23 29.97 27.48 32.86 52.13 35.25 40.62 38.62 40.22 41.58 42.06 47.10 31.79 41.67 50.36 35.26 33.88 33.92 37.15
2.2 SsPGs基因家族成员共线性分析
对莲雾PG 基因进行组内基因共线性分析,结果显示有3 对共线性关系(图2),分别为SsPG17/SsPG20、SsPG19/SsPG21 和SsPG21/SsPG5,说明在进化过程中出现了基因片段重复和基因串联重复。进一步对莲雾PG 基因与其他4 个物种进行物种间共线性分析,结果(图3)发现有96对共线性关系,其中拟南芥19 对、番茄14 对、苹果34 对和葡萄23 对。莲雾和苹果PG 基因之间共线性关系最强,葡萄次之,可能由于二者是木本和木质藤本,进而体现了物种之间的分类关系。
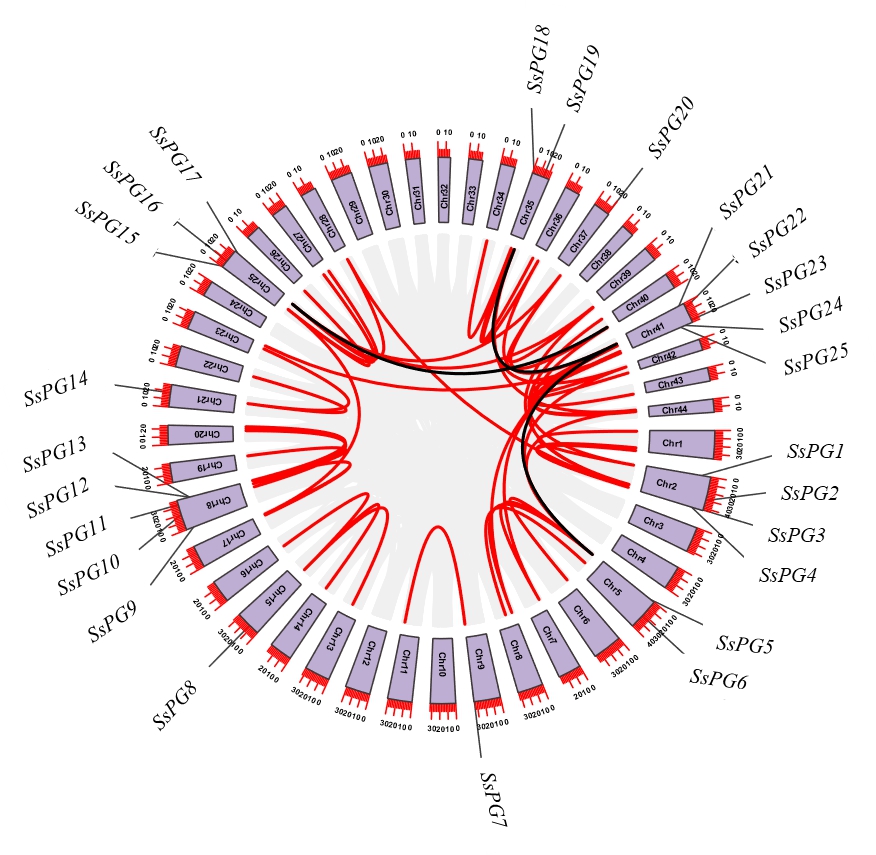
图2 SsPGs 基因家族共线性分析
Fig.2 Collinear distribution of SsPGs
图外圈数字表示染色体长度(Mb);紫色框里代表染色体序号;灰色线代表莲雾基因组内所有共线性区域;红色线代表莲雾基因组内PG 基因共线性区域;黑色线代表PG 基因家族内基因共线性对。
The number in the outer circle represents the chromosome length (Mb);The purple box represents the chromosome number ;Gray lines represent all synteny blocks and red lines represent duplicated PG gene pairs in the wax apple [Syzygium samarangense (Bl.) Merr.et Perry]genome, while black lines highlight the syntenic PG gene pairs in the family

图3 莲雾与拟南芥、番茄、苹果、葡萄之间PG 基因的线性分析
Fig.3 Synteny analysis of PG genes between wax apple[Syzygium samarangense(Bl.)Merr.et Perry]and Arabidopsis,tomato,apple and grape
蓝色代表莲雾染色体序号;绿色分别代表拟南芥、番茄、苹果、葡萄的染色体序号;灰色线代表莲雾和拟南芥、番茄、苹果、葡萄基因组内的共线性对;红色线代表PG 基因共线性对。
The blue represents the chromosome number of lotus mist;the green represents the chromosome numbers of Arabidopsis,tomato,apple and grape respectively;gray lines in the background indicate the collinear blocks with wax apple and Arabidopsis,tomato,apple,and grape,while the red lines hi ghlight the syntenic PG gene.
Ka/Ks 是2 个蛋白编码基因的非同义替换值(Ka)和同义替换值(Ks)的比值[35]。数值大小可以判断是否有选择压力作用于这个蛋白质编码基因,从而反映物种的进化选择。利用TBtool 软件计算莲雾与拟南芥、番茄、苹果、葡萄PG基因家族同源基因Ka、Ks 以及Ka/Ks 值。如表3 所示,有些共线性的基因对Ks值为NaN,导致Ka/Ks值也为NaN。出现NaN 表示基因上绝大部分可发生同义突变位点都发生了同义突变,也就是说序列分歧度太大,进化距离很远。在苹果和葡萄中出现了较少的Ks 值为NaN,进一步说明莲雾与其进化距离较近。所有Ka/Ks值均小于1,说明PG基因家族在进化过程中主要受纯化选择作用的影响。
表3 莲雾与拟南芥、番茄、苹果、葡萄PG 基因家族同源基因Ka/Ks 值
Table 3 The Ka/Ks analysis of PG homologous gene pair in Arabidopsis thaliana,Solanum lycopersicum,Malus domestica Golden,Vitis vinifera with Syzygium samarangense(Bl.)Merr.et Perry
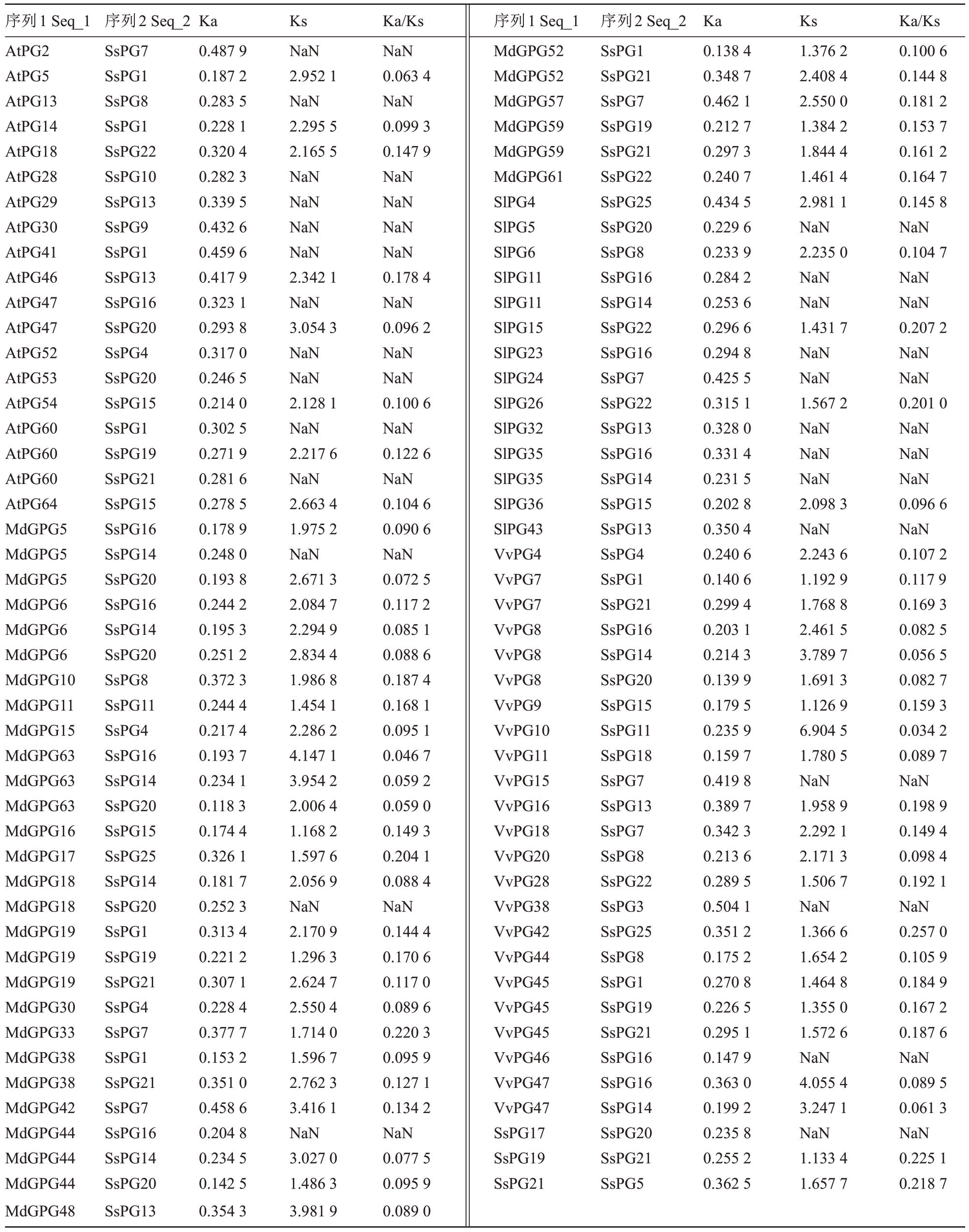
注:NaN 表示无数据。
Note:The NaN represents no data.
序列1 Seq_1 AtPG2 AtPG5 AtPG13 AtPG14 AtPG18 AtPG28 AtPG29 AtPG30 AtPG41 AtPG46 AtPG47 AtPG47 AtPG52 AtPG53 AtPG54 AtPG60 AtPG60 AtPG60 AtPG64 MdGPG5 MdGPG5 MdGPG5 MdGPG6 MdGPG6 MdGPG6 MdGPG10 MdGPG11 MdGPG15 MdGPG63 MdGPG63 MdGPG63 MdGPG16 MdGPG17 MdGPG18 MdGPG18 MdGPG19 MdGPG19 MdGPG19 MdGPG30 MdGPG33 MdGPG38 MdGPG38 MdGPG42 MdGPG44 MdGPG44 MdGPG44 MdGPG48序列2 Seq_2 SsPG7 SsPG1 SsPG8 SsPG1 SsPG22 SsPG10 SsPG13 SsPG9 SsPG1 SsPG13 SsPG16 SsPG20 SsPG4 SsPG20 SsPG15 SsPG1 SsPG19 SsPG21 SsPG15 SsPG16 SsPG14 SsPG20 SsPG16 SsPG14 SsPG20 SsPG8 SsPG11 SsPG4 SsPG16 SsPG14 SsPG20 SsPG15 SsPG25 SsPG14 SsPG20 SsPG1 SsPG19 SsPG21 SsPG4 SsPG7 SsPG1 SsPG21 SsPG7 SsPG16 SsPG14 SsPG20 SsPG13 Ka 0.487 9 0.187 2 0.283 5 0.228 1 0.320 4 0.282 3 0.339 5 0.432 6 0.459 6 0.417 9 0.323 1 0.293 8 0.317 0 0.246 5 0.214 0 0.302 5 0.271 9 0.281 6 0.278 5 0.178 9 0.248 0 0.193 8 0.244 2 0.195 3 0.251 2 0.372 3 0.244 4 0.217 4 0.193 7 0.234 1 0.118 3 0.174 4 0.326 1 0.181 7 0.252 3 0.313 4 0.221 2 0.307 1 0.228 4 0.377 7 0.153 2 0.351 0 0.458 6 0.204 8 0.234 5 0.142 5 0.354 3 Ks NaN 2.952 1 NaN 2.295 5 2.165 5 NaN NaN NaN NaN 2.342 1 NaN 3.054 3 NaN NaN 2.128 1 NaN 2.217 6 NaN 2.663 4 1.975 2 NaN 2.671 3 2.084 7 2.294 9 2.834 4 1.986 8 1.454 1 2.286 2 4.147 1 3.954 2 2.006 4 1.168 2 1.597 6 2.056 9 NaN 2.170 9 1.296 3 2.624 7 2.550 4 1.714 0 1.596 7 2.762 3 3.416 1 NaN 3.027 0 1.486 3 3.981 9 Ka/Ks NaN 0.063 4 NaN 0.099 3 0.147 9 NaN NaN NaN NaN 0.178 4 NaN 0.096 2 NaN NaN 0.100 6 NaN 0.122 6 NaN 0.104 6 0.090 6 NaN 0.072 5 0.117 2 0.085 1 0.088 6 0.187 4 0.168 1 0.095 1 0.046 7 0.059 2 0.059 0 0.149 3 0.204 1 0.088 4 NaN 0.144 4 0.170 6 0.117 0 0.089 6 0.220 3 0.095 9 0.127 1 0.134 2 NaN 0.077 5 0.095 9 0.089 0序列1 Seq_1 MdGPG52 MdGPG52 MdGPG57 MdGPG59 MdGPG59 MdGPG61 SlPG4 SlPG5 SlPG6 SlPG11 SlPG11 SlPG15 SlPG23 SlPG24 SlPG26 SlPG32 SlPG35 SlPG35 SlPG36 SlPG43 VvPG4 VvPG7 VvPG7 VvPG8 VvPG8 VvPG8 VvPG9 VvPG10 VvPG11 VvPG15 VvPG16 VvPG18 VvPG20 VvPG28 VvPG38 VvPG42 VvPG44 VvPG45 VvPG45 VvPG45 VvPG46 VvPG47 VvPG47 SsPG17 SsPG19 SsPG21序列2 Seq_2 SsPG1 SsPG21 SsPG7 SsPG19 SsPG21 SsPG22 SsPG25 SsPG20 SsPG8 SsPG16 SsPG14 SsPG22 SsPG16 SsPG7 SsPG22 SsPG13 SsPG16 SsPG14 SsPG15 SsPG13 SsPG4 SsPG1 SsPG21 SsPG16 SsPG14 SsPG20 SsPG15 SsPG11 SsPG18 SsPG7 SsPG13 SsPG7 SsPG8 SsPG22 SsPG3 SsPG25 SsPG8 SsPG1 SsPG19 SsPG21 SsPG16 SsPG16 SsPG14 SsPG20 SsPG21 SsPG5 Ka 0.138 4 0.348 7 0.462 1 0.212 7 0.297 3 0.240 7 0.434 5 0.229 6 0.233 9 0.284 2 0.253 6 0.296 6 0.294 8 0.425 5 0.315 1 0.328 0 0.331 4 0.231 5 0.202 8 0.350 4 0.240 6 0.140 6 0.299 4 0.203 1 0.214 3 0.139 9 0.179 5 0.235 9 0.159 7 0.419 8 0.389 7 0.342 3 0.213 6 0.289 5 0.504 1 0.351 2 0.175 2 0.270 8 0.226 5 0.295 1 0.147 9 0.363 0 0.199 2 0.235 8 0.255 2 0.362 5 Ks 1.376 2 2.408 4 2.550 0 1.384 2 1.844 4 1.461 4 2.981 1 NaN 2.235 0 NaN NaN 1.431 7 NaN NaN 1.567 2 NaN NaN NaN 2.098 3 NaN 2.243 6 1.192 9 1.768 8 2.461 5 3.789 7 1.691 3 1.126 9 6.904 5 1.780 5 NaN 1.958 9 2.292 1 2.171 3 1.506 7 NaN 1.366 6 1.654 2 1.464 8 1.355 0 1.572 6 NaN 4.055 4 3.247 1 NaN 1.133 4 1.657 7 Ka/Ks 0.100 6 0.144 8 0.181 2 0.153 7 0.161 2 0.164 7 0.145 8 NaN 0.104 7 NaN NaN 0.207 2 NaN NaN 0.201 0 NaN NaN NaN 0.096 6 NaN 0.107 2 0.117 9 0.169 3 0.082 5 0.056 5 0.082 7 0.159 3 0.034 2 0.089 7 NaN 0.198 9 0.149 4 0.098 4 0.192 1 NaN 0.257 0 0.105 9 0.184 9 0.167 2 0.187 6 NaN 0.089 5 0.061 3 NaN 0.225 1 0.218 7
2.3 系统进化树的构建
为了研究莲雾PG 基因家族的进化系统关系,用ClustalX2 软件对25 个SsPGs、68 个拟南芥AtPGs、63 个苹果MdPGs、49 个番茄SlPGs、49 个葡萄VvPGs和58个枣ZjPGs的基因家族蛋白序列进行多序列比对。在序列比对过程中,发现冬枣基因组中有大量PG 基因家族重复序列。构建6 个物种的系统进化树(图4)。根据前人对植物PG 基因家族的分类[36-37],将进化树分为Group A~G 7 个组。SsPGs基因家族成员存在于除Group F 外的其他6 个分组。其中,Group A 有5 个SsPGs 基因家族成员,分别是SsPG5、SsPG6、SsPG11、SsPG19 和SsPG21,与果实脱落有关;Group B 有2 个SsPGs 基因家族成员,分别是SsPG22和SsPG25,与果实发育和果荚开裂有关;Group C 有6 个SsPGs 基因家族成员,分别是SsPG12、SsPG13、SsPG15、SsPG16、SsPG23 和SsPG24,在花粉、花药或其他组织中有较高表达;Group D 有5 个SsPGs 基因家族成员,分别是SsPG7、SsPG8、SsPG9、SsPG10 和SsPG14;Group E有6个SsPGs基因家族成员,分别是SsPG2、SsPG3、SsPG4、SsPG17、SsPG18 和SsPG20;Group G 虽然没有PG基因家族的4个高度保守结构域,但也证明是PG 基因家族,仅找到1 个SsPGs 基因家族成员为SsPG1。

图4 拟南芥(At)、番茄(Sl)、葡萄(Vv)、苹果(Md)、枣(Zj)和莲雾(Ss)PG 家族系统进化树
Fig.4 An unrooted phylogenetic tree representing relationships of PGs in Arabidopsis thaliana(At),Solanum lycopersicum(Sl),Vitis vinifera L.(Vv),Malus domestica(Md),Ziziphus jujuba(Zj)and wax apple[Syzygium samarangense(Bl.)Merr.et Perry](Ss)
2.4 SsPGs基因家族蛋白保守基序分析
研究发现PG 基因家族蛋白具有4 个高度保守的蛋白基序(Ⅰ~Ⅳ),即S294PNTDGIH301、G318DDC321、C338GPGHG343 和R376lK378[38]。 采 用GeneDoc 2.7.0对25个莲雾PG基因家族蛋白进行多重序列比对(图5)。结果发现,大部分SsPGs基因家族蛋白都具有4 个典型的保守结构域,而SsPG3、SsPG4、SsPG17只具有保守结构域Ⅰ和Ⅱ,SsPG2只具有保守结构域Ⅰ,SsPG1 不具有4 个保守结构域。此外,一部分SsPGs 基因家族蛋白保守基序中个别氨基酸发生变异,如S294PNTDGIH301 中的S变成A,G318DDC321 中C 变成L,C338GPGHG343中的第2 个G 变成S 等。利用MEME 在线工具和TBtools 软件,对25 个莲雾PG 蛋白进行保守基序的搜索与分析,得到5个保守基序,即motif 1~motif 5(图6-A、D)。分析结果显示,motif 1、motif 2为PG基因家族蛋白的保守基序,分别对应R37lK378 和C33GPGH-G34,S294PNTDGIH301和G318DDC321。除上述4个保守基序以外,motif 3、motif 4和motif 5也具有较高的保守性(图6-B),可能与SsPGs基因家族蛋白自身的特异性有关。为了解莲雾PG基因家族的序列特征,通过比较相应的基因组DNA 序列,获得了SsPGs基因的外显子和内含子结构。结果显示,25个莲雾PG基因家族均具有外显子和内含子,数量3~8 个不等。其中,SsPG8 含有外显子的数量最多(8 个),SsPG7 含有外显子的数量最少(3 个)(图6-C)。SsPG8 和SsPG12 的内含子比较长,SsPG23和SsPG24具有相同的遗传结构。

图5 莲雾PG 基因家族多序列比对
Fig.5 The multiple alignment of sequence of SsPGs
黄色、绿色、黑色色块分别代表碱基保守程度由低到高;黑线区域表示SsPGs 保守结构域(Domain Ⅰ~Ⅳ)。
The yellow, green and black color blocks represent the degree of base conservation from low to high ;The black line represents the conserved domain of SsPGs(DomainⅠ-Ⅳ).
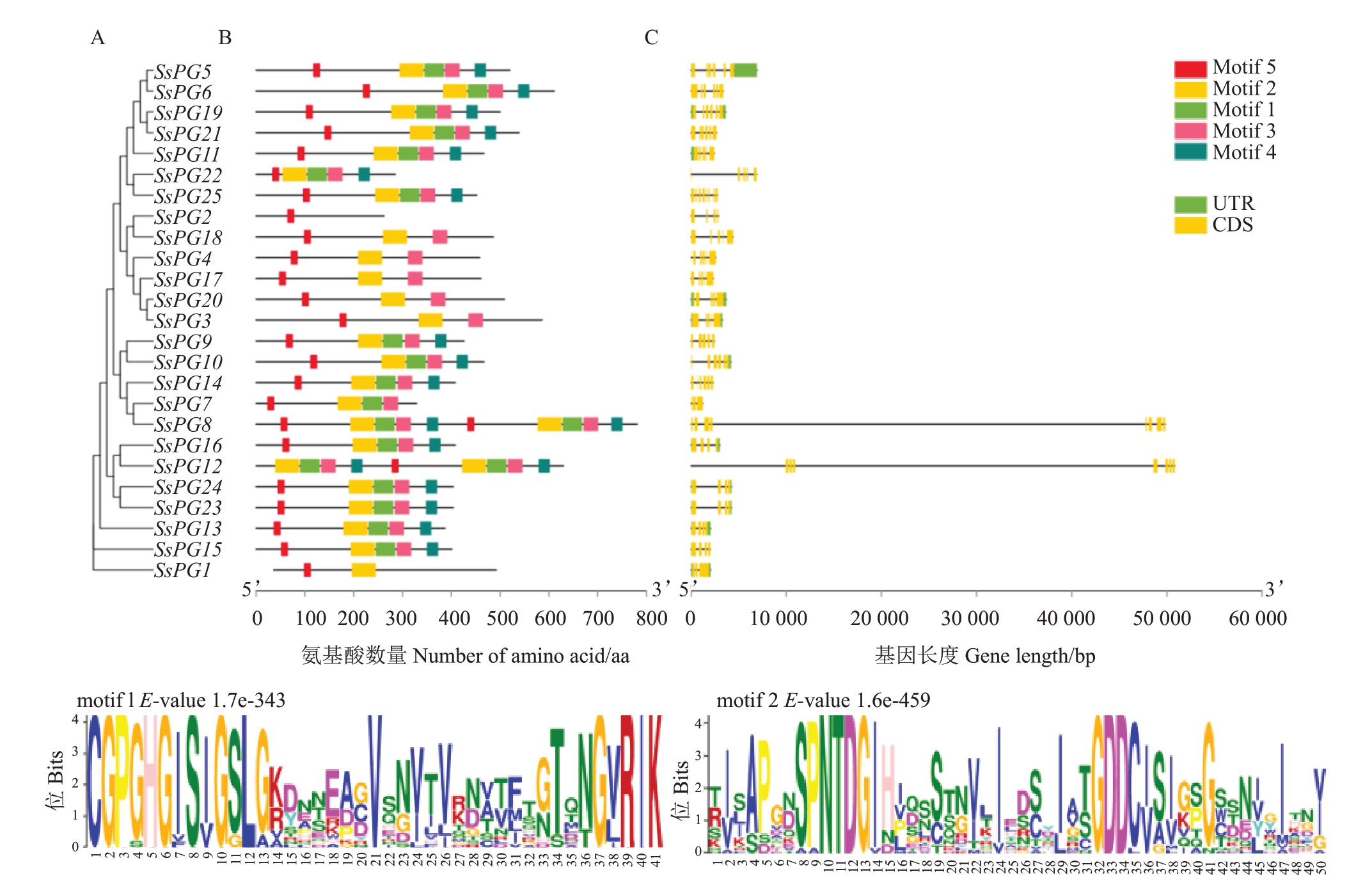
图6 SsPGs 基因家族成员进化树(A)、保守基序分布(B)、基因结构(C)及典型保守基序(D)
Fig.6 Phylogenetic tree(A),distribution of conserved motifs(B),gene structure(C)and typical conserved motifs(D)of SsPGs
UTR、CDS 和黑线分别表示非编码区、编码区和内含子。
UTR,CDS and black lines represent non-coding region,coding region and intron,respectively.
2.5 SsPGs基因家族启动子顺式作用元件分析
对SsPGs基因家族启动子上游2 kb区域进行顺式作用元件分析,结果显示,SsPGs基因家族含有激素应答元件、光响应和低温响应等11类非生物胁迫作用元件(图7)。其中,SsPG1、SsPG6和SsPG10等共15 个SsPGs 均含有赤霉素响应元件(GA);SsPG7、SsPG9 和SsPG11 等共12 个SsPGs 均含有生长素响应元件(Auxin);除SsPG4、SsPG5 和SsPG10外其他共22 个均含有茉莉酸甲酯相应元件(Me-JA);大部分SsPGs 都含有脱落酸诱导响应元件(ABA)。SsPG2启动子序列所含的响应元件种类最多为8个,SsPG12启动子序列所含的响应元件种类最少为3 个;SsPG23 和SsPG24 启动子序列出现响应元件的位置相同,但是响应元件的类型不尽相同。
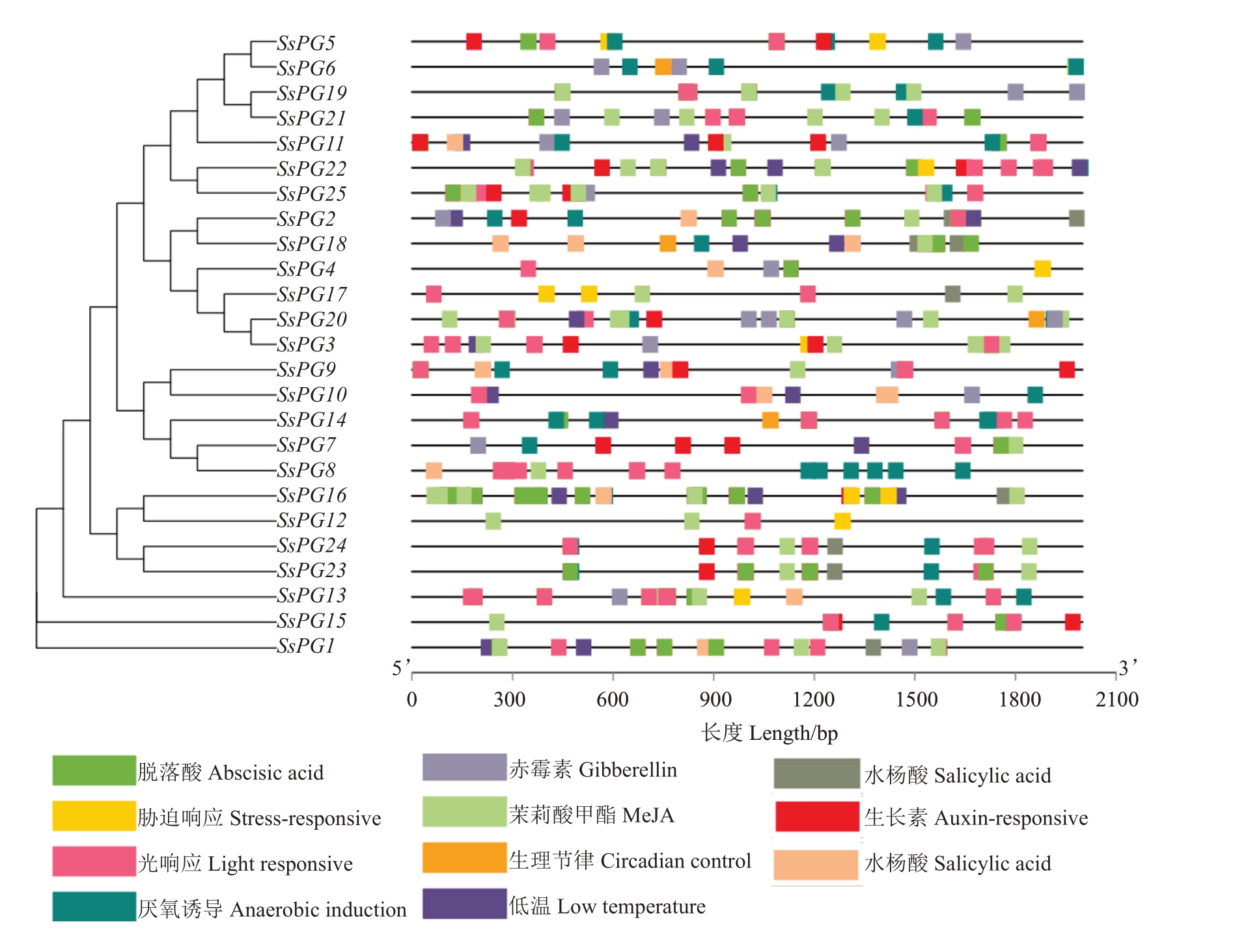
图7 SsPGs 基因家族各成员启动子区顺式作用元件种类
Fig.7 Types of cis-acting elements in promoters of SsPGs
2.6 SsPGs基因家族不同部位表达分析
为进一步分析SsPGs基因家族成员在不同组织器官中的表达情况,对莲雾不同组织转录组数据进行分析,用RPKM(reads per kilobase per million mapped reads)值代表相对表达量制作了聚类分析热图(图8)。其中RPKM值>5为高表达,为方便查看,以2为底,取RPKM值的对数,即对数值>2.3为高表达。由图可知,SsPGs 基因家族成员表达具有组织特异性,其中SsPG12、SsPG13 和SsPG24 在根中特异性表达,SsPG25 在根和果肉中特异性表达;Group E 中的SsPG2 和SsPG4 在根、茎、叶、花、子房和果肉中均是高表达;SsPG3 在除子房外的其他5个组织中高表达;SsPG5 在茎和叶中高表达;SsPG22 在果肉和叶子中高表达;GroupG 中的SsPG1 在花中高表达;SsPG20 在根中高表达;SsPG18 和SsPG19 在 子 房 中 低 表 达;SsPG6、SsPG11、SsPG15、SsPG16、SsPG17、SsPG21、SsPG23和GroupD 在根、茎、叶、花、子房和果肉中极低或没有表达。
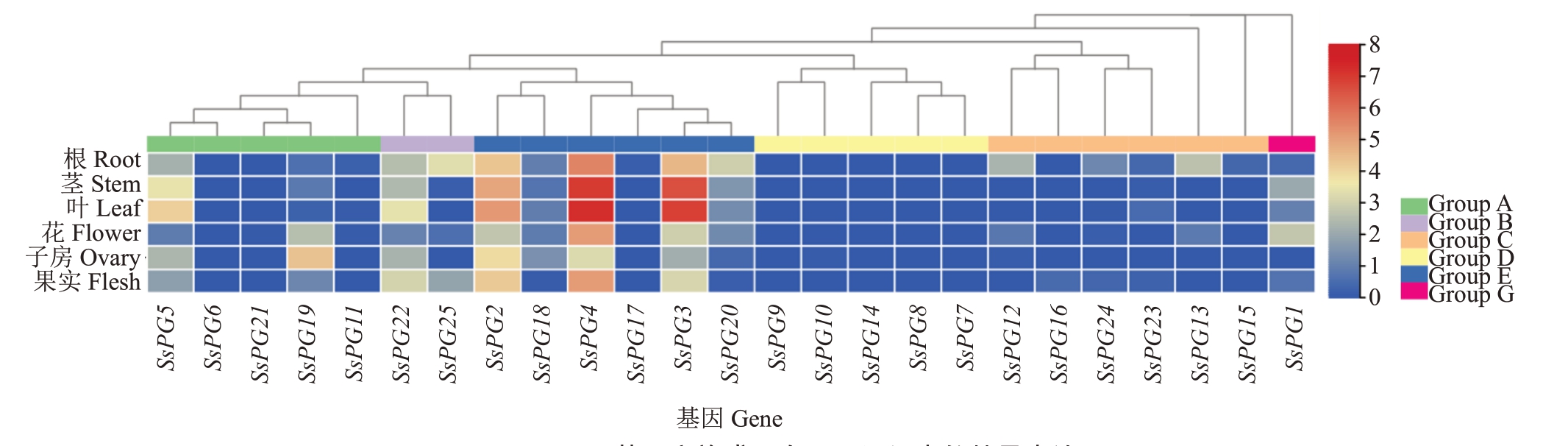
图8 SsPGs 基因家族成员在不同组织中的特异表达
Fig.8 The specific expression of SsPGs in different tissues
2.7 外源ABA处理后SsPGs基因家族表达分析
2.7.1 ABA处理对PG酶活性的影响 顺式表达元件预测结果中,大部分SsPGs 基因家族成员都含有脱落酸响应元件(ABA)。为了初步验证预测结果,在莲雾果实转色期对其喷施浓度为100µmol·L-1的ABA,对照组喷施蒸馏水。结果显示,与对照组相比PG活性在1 h和4 d显著增加,在10 d显著降低。表明外源ABA处理对PG活性有显著的影响(图9)。
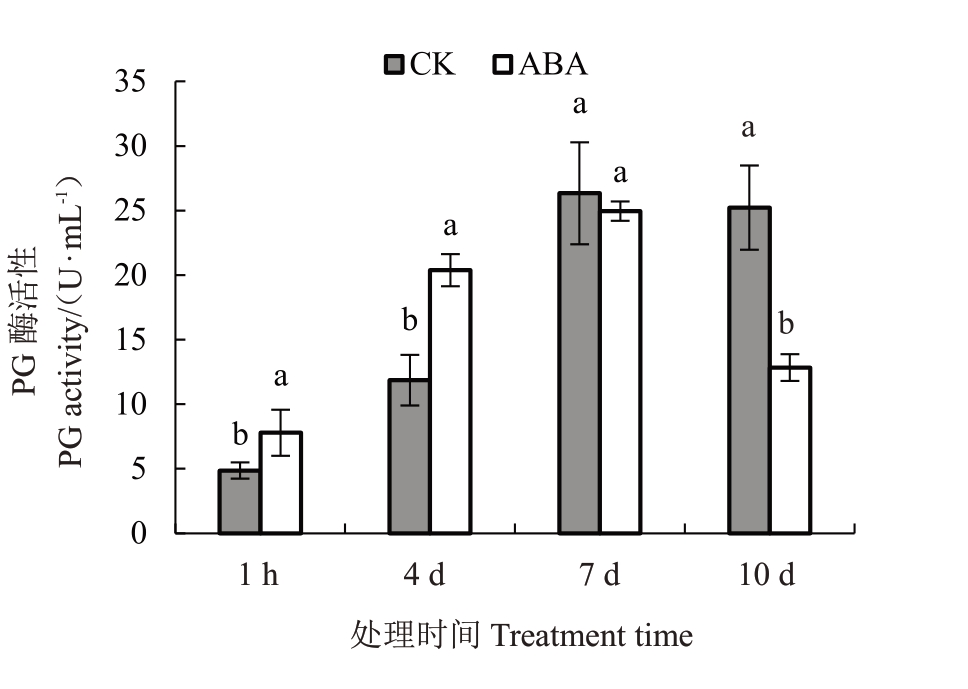
图9 莲雾果实成熟过程中外源ABA 处理对PG 活性的影响
Fig.9 Effects of exogenous ABA on the PG activity in wax apple(Syzygium samarangense)during ripening
不同小写字母表示在p <0.05 差异显著。下同。
Different small letters indicate significant difference at p <0.05.The same below.
2.7.2 ABA 处理对莲雾果实裂果的影响 ABA 处理10 d后,果实裂果情况如表4所示。其中,对照组有7 个裂果,裂果率为14%;处理组有21 个裂果,裂果率为42%。处理组裂果率明显高于对照组。
表4 外源ABA 处理10 d 后果实裂果情况
Table 4 Fruit cracking rate after ABA treatment for 10 days

处理Treatment对照组CK处理组ABA裂果数Dehiscent fruit number 7 21不裂果数Indehiscent fruit number 43 29裂果率Dehiscent fruit rate/%14 42
2.7.3 ABA 处理对SsPGs 基因家族成员的影响ABA处理后果皮的转录组数据显示,在果皮中表达的SsPGs 基因家族成员包括SsPG1~SsPG5(除SsPG3 外)以及SsPG17~ SsPG25(除SsPG21 外)共12 个,与果肉相比多了SsPG17 而少了SsPG3 和SsPG16,这可能是组织表达差异所致(图10)。喷施蒸馏水后,除SsPG2、SsPG4、SsPG18 和SsPG22 外,其他8个基因在果皮中未表达或仅在某个阶段有极低的相对表达量。喷施ABA 后,SsPG2、SsPG4、SsPG18 和SsPG22 都呈波动变化。其中,SsPG4 在1 h时相对表达量最高,SsPG2和SsPG22在4 d时相对表达量最高,SsPG18 在10 d 时相对表达量最高。与对照组相比,喷施ABA 明显促进SsPG2 的表达,抑制了SsPG18 的表达。SsPG4 的相对表达量在对照和ABA处理中均是最高的。
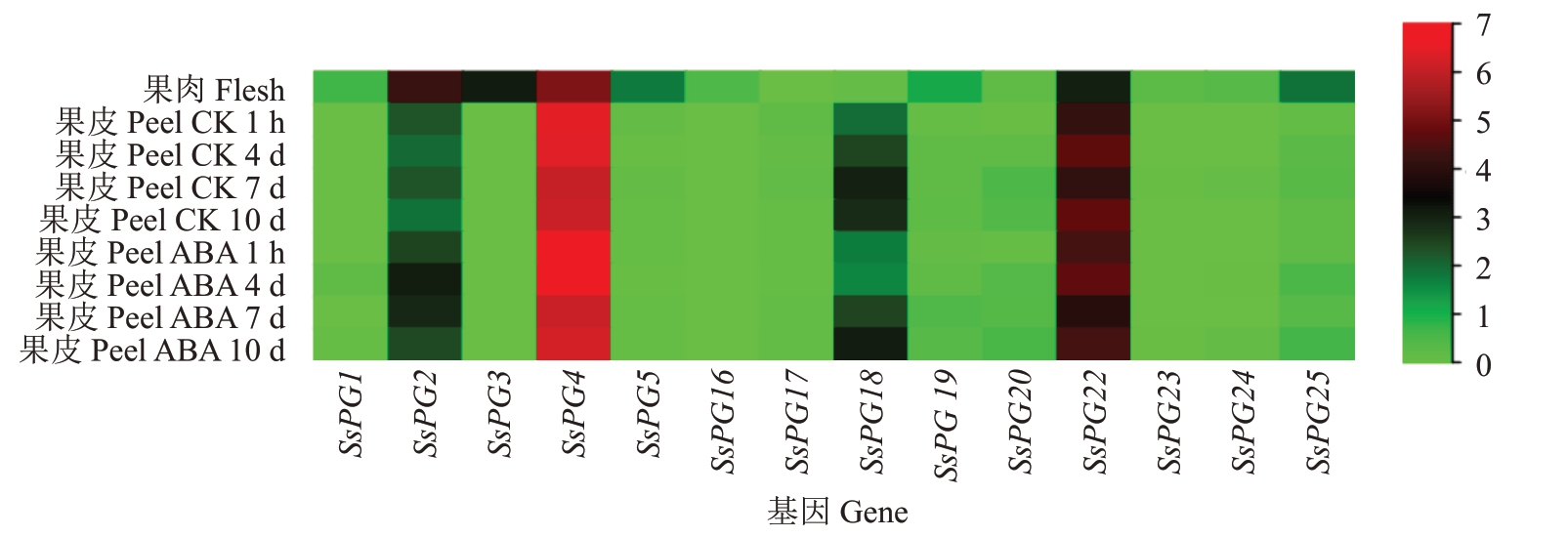
图10 ABA 处理后果皮中SsPGs 基因家族成员的表达分析
Fig.10 Expression analysis of SsPGs in peel after ABA treatment
2.8 SsPGs 基因家族成员在外源ABA 处理下的qRT-PCR分析
结合外源ABA 处理后果皮的转录组数据进行分析,挑选4 个有一定表达的SsPGs 基因家族成员(SsPG2、SsPG4、SsPG18 和SsPG22),其中SsPG4 的相对表达量最高,SsPG2的相对表达量外源ABA处理后均高于对照组,SsPG18 和SsPG22 的相对表达量在外源ABA处理7 d显著抑制(图10)。进一步利用qRT-PCR 验证这4 个基因的表达趋势,结果显示外源ABA 处理后SsPG2 和SsPG4 在1 h、4 d、7 d、10 d均有所上调;SsPG18在4、7 d显著下调,在10 d显著上调;SsPG22 在7 d 显著下调。随着处理时间的增加,SsPG2的相对表达量呈现“升-降-升”趋势,在4 d 达到峰值;SsPG4 和SsPG18 的相对表达量呈“降-升”趋势;SsPG22的表达趋势与SsPG2相同(图11)。
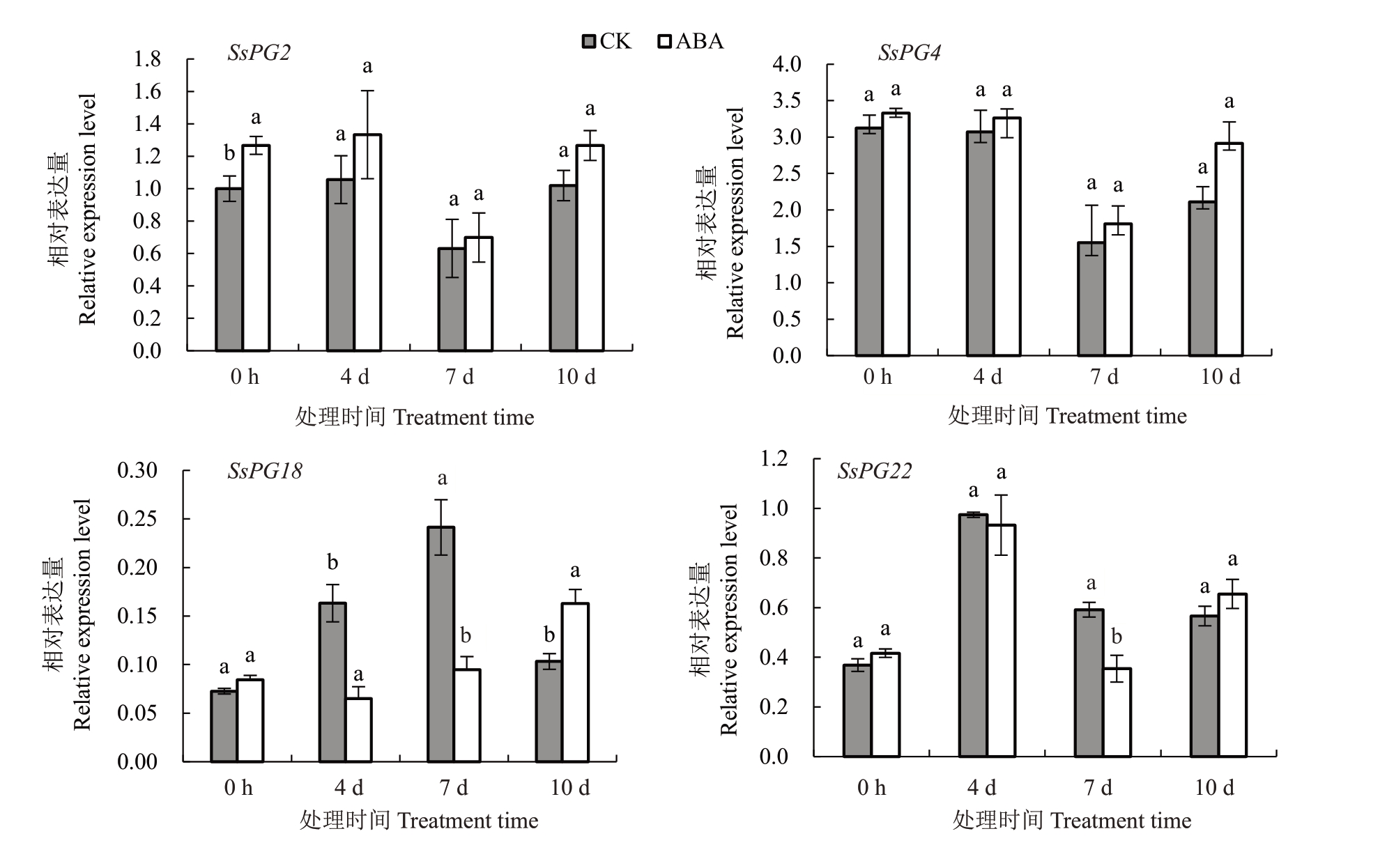
图11 ABA 处理条件下SsPGs 在果皮中的相对表达量
Fig.11 Expression level of SsPGs in peel after ABA treatment
设SsPG2 在CK 1 h 的相对表达量为1,4 个基因各个时间点均与其比较。
The relative expression of SsPG2 at CK 1 h was set as 1 with which the four genes at each time point were compared.
3 讨 论
植物中的基因组复制可以是大规模的如全基因组复制,也可以是小规模的如串联和片段复制[39]。基因复制事件加快了基因家族的快速扩张和演变。本研究在莲雾基因组数据库中共鉴定出25个SsPGs基因家族成员,分别位于10 条染色体上,其中染色体2和18上都出现了基因的串联重复和片段重复现象;在桃的PG 基因家族研究中也发现了大量串联重复基因簇[22],表明该现象可能促进SsPGs 基因家族的扩张和功能多样化。莲雾中PG基因家族成员数量差不多是桃的1/3,推测进化过程中莲雾对于转录调控的需求没有桃那么大。通过系统进化树关系分析,SsPGs 基因家族成员被分为7 组(Group A~G),与苹果、桃、枣和拟南芥等其他物种的PGs系统发育分类相同。其中在不具有PG基因家族特征结构的Group G 仅找到1 个SsPGs 成员(SsPG1),推测其可能发挥着某种特定的功能;在与果实发育和果荚开裂有关的Group B中找到2个SsPGs成员,分别是SsPG22和SsPG25,同时SsPG22在果肉和果皮中也有一定的表达水平,预示其可能与果实开裂有关。
基因结构是研究多基因家族的重要基础,在其进化中起关键作用[40]。分析结果显示,SsPGs 基因家族的蛋白基序出现明显的区组性序列同源性和保守性,所有基因都含有内含子,且大都具有4个保守基序(除SsPG1 外),说明这些基因在进化过程中可能发挥相同的功能。共线性结果显示,SsPGs 基因家族与拟南芥、番茄、苹果和葡萄都具有共线性关系,说明可能源于同一祖先基因。莲雾PG 基因家族中有2对Ka/Ks值小于1,表明其受纯化选择作用的影响。Motif分析结果显示,SsPGs基因家族成员含有5 个保守基序,其中motif 1、motif 2 与PG 基因家族蛋白的4个保守基序一致;此外,motif 5存在于所有SsPGs 基因家族成员,说明其保守性程度高。在杧果PG 基因家族研究中也发现一些特有的基序[21],推测其可能在进化过程中起着某种特定功能。
SsPGs的表达模式为进一步研究其生物学功能提供了依据。在本研究中,SsPG2、SsPG4、SsPG18和SsPG19 在花和子房中表达,SsPG22 在果肉中表达,说明SsPGs 可能与果实的发育有关。SsPG12、SsPG13 和SsPG24 在 根 中 特 异 性 表 达,SsPG2、SsPG3 和SsPG5 在茎和叶中高表达,表明SsPGs 可能与营养生长有关。这些研究结果说明,SsPGs 在营养和生殖生长过程中可能具有不同的功能,参与不同的信号转导途径。
为研究SsPGs 的表达调控,笔者对SsPGs 基因家族启动子区域的顺式调控元件进行预测分析。结果显示,SsPGs 的顺式调控元件主要有植物激素应答元件、光诱导和逆境胁迫相关元件3 种。大部分SsPGs 都含有脱落酸诱导响应元件(ABA);SsPG2启动子序列所含的响应元件种类最多,推测其可能参与多种逆境胁迫。启动子区的许多顺式作用元件可以协调基因的表达,因此通过验证SsPGs 的表达模式来研究基因的功能是很有意义的。研究发现,外源ABA 处理会促进赤霞珠葡萄果实的成熟和多聚半乳糖醛酸酶基因的表达[41],同样在杧果果实成熟过程中也会使PG活性增加[42],从而增加果实开裂的概率。进一步研究莲雾对ABA的响应,对转色期果实的果皮进行喷施外源激素ABA 处理。结果表明,喷施外源激素ABA 1 h 后,与对照组相比SsPG2、SsPG4、SsPG18 和SsPG22 相对表达量均有所上升,此时果皮PG活性也显著提高,因此笔者推测SsPG2、SsPG4、SsPG18 和SsPG22 的表达可能促进了PG活性的提高。另外,SsPG4的相对表达量最高,进一步推测SsPG4 可能是主效基因,对PG 活性的提高起主要作用。PG活性在4 d时可能达到了负反馈调节机制的临界值,触发了负反馈调节机制,SsPG2 和SsPG4 的表达开始受抑制,相对表达量下降;在7 d时PG活性达到最大值,抑制达到最强,相对表达量达到最低值;随后PG活性开始下降,相对表达量又开始增加。在处理7 d后试验组SsPG18和SsPG22 的相对表达量显著低于对照组,笔者推测SsPG18和SsPG22可能是非主效基因,但SsPG18对负反馈调节更加灵敏,在4 d时表达就受到抑制,相对表达量显著降低;在10 d时PG活性低于临界值,抑制作用减弱,相对表达量又开始上升。笔者推测SsPG2、SsPG4、SsPG18和SsPG22可能是引起PG活性明显变化,从而引起果实开裂的关键基因。本研究为进一步了解SsPGs基因家族在果实发育过程中的潜在调控机制奠定了基础。
4 结 论
从莲雾基因组中鉴定出25 个PG 基因家族成员,均包含内含子,分布于Group A~E、G 共6 个组中。其中SsPG2、SsPG4、SsPG18 和SsPG22 在莲雾PG 活性的变化和果实的开裂中可能起重要作用。SsPGs在营养和生殖生长过程中可能具有不同的功能,参与不同的信号转导途径。
[1]KE X B,WANG H,LI Y,ZHU B,ZANG Y X,HE Y,CAO J S,ZHU Z J,YU Y J.Genome-wide identification and analysis of polygalacturonase genes in Solanum lycopersicum[J].Interna-tional Journal of Molecular Sciences,2018,19(8):2290.
[2]ROBERTS J A,ELLIOTT K A,GONZALEZ-CARRANZA Z H.Abscission,dehiscence,and other cell separation processes[J].Annual Review of Plant Biology,2002,53(1):131-158.
[3]张小秋,宋修鹏,陈冠州,王泽平,雷敬超,梁永检,李杨瑞,黄冬梅,颜梅新.植物病原菌多聚半乳糖醛酸酶的研究简述[J].广西糖业,2020,113(4):49-53.ZHANG Xiaoqiu,SONG Xiupeng,CHEN Guanzhou,WANG Zeping,LEI Jingchao,LIANG Yongjian,LI Yangrui,HUANG Dongmei,YAN Meixin.Introduction to the research of polygalacturonase in phytopathogen[J].Guangxi Sugar Industry,2020,113(4):49-53.
[4]GRIERSON D,TUCKER G A,KEEN J,RAY J,BIRD CR,SCHUCH W.Sequencing and identification of a cDNA clone for tomato polygalacturonase[J].Nucleic Acids Research,1986,14(21):8595-8602.
[5]MARKOVIČ O,JANEČEK Š.Pectin degrading glycoside hydrolases of family 28:Sequence-structural features,specificities and evolution[J].Protein Engineering,2001,14(9):615-631.
[6]段学武,张昭其,季作梁.PG 酶与果实的成熟软化[J].果树学报,2001,18(4):229-233.DUAN Xuewu,ZHANG Zhaoqi,JI Zuoliang.Advances in research on the relationship between polygalcturonase and fruit softening[J].Journal of Fruit Science,2001,18(4):229-233.
[7]PRESSEY R.Polygalacturonase in tree pollens[J].Phytochemistry,1991,30(6):1753-1755.
[8]TEBBUTT S J,ROGERS H J,LONSDALE D M.Characterization of a tobacco gene encoding a pollen-specific polygalacturonase[J].Plant Molecular Biology,1994,25(2):283-297.
[9]SANDER L,CHILD R,ULVSKOV P,ALBRECHTSEN M,BORKHARDT B.Analysis of a dehiscence zone endo-polygalacturonase in oilseed rape (Brassica napus) and Arabidopsis thaliana:evidence for roles in cell separation in dehiscence and abscission zones,and in stylar tissues during pollen tube growth[J].Plant Molecular Biology,2001,46(4):469-479.
[10]白延红,马胜利,秦静远,侯喜萍.多聚半乳糖醛酸酶(PG)对果实成熟软化的影响[J].陕西农业科学,2008,54(4):86-88.BAI Yanhong,MA Shengli,QIN Jingyuan,HOU Xiping.Effects of polygalacturonase (PG) on fruit ripening and softening[J].Shaanxi Agricultural Science,2008,54(4):86-88.
[11]周宏伟,吴耕西.长把梨贮藏中多聚半乳糖醛酸酶与果胶甲酯酶的作用[J].山东农业大学学报(自然科学版),1992,23(1):67-70.ZHOU Hongwei,WU Gengxi.Effect of polygalacturonase and pectin esterase on storage of long-stalk pear[J].Journal of Shandong Agricultural University(Natural Science Edition),1992,23(1):67-70.
[12]HUANG W J,CHEN M Y,ZHAO T T,HAN F,ZHANG Q,LIU X L,JIANG C Y,ZHONG C H.Genome-wide identification and expression analysis of polygalacturonase gene family in kiwifruit (Actinidia chinensis) during fruit softening[J].Plants,2020,9(3):327.
[13]匡盛.果胶降解相关PG/GAL 与猕猴桃果实后熟软化[D].杭州:浙江大学,2017.KUANG Sheng.The relation of PG/GAL and kiwifruit postharvest ripening[D].Hangzhou:Zhejiang University,2017.
[14]ZEEN Y,ZHEN W,CHUAN Z,ENMEI H,RONG Z,FANGLING J.The composition of pericarp,cell aging,and changes in water absorption in two tomato genotypes:Mechanism,factors,and potential role in fruit cracking[J].Acta Physiologiae Plantarum,2016,38(9):1-16.
[15]SCHUCH W,KANCZLER J,ROBERTSON D,HOBSON G,TUCKER G,GRIERSON D,BRIGHTL S,BIRD C.Fruit quality characteristics of transgenic tomato fruit with altered polygalacturonase activity[J].Hortscience,1991,26:1517-1520.
[16]李建国,黄旭明,黄辉白.裂果易发性不同的荔枝品种果皮中细胞壁代谢酶活性的比较[J].植物生理与分子生物学学报,2003,29(2):141-146.LI Jianguo,HUANG Xuming,HUANG Huibai.Comparison of the activity of enzymes related to cell wall metabolism in pericarp between litchi cultivars susceptible and resistant to fruit cracking[J].Journal of Plant Physiology and Molecular Biology,2003,29(2):141-146.
[17]高美玲,于长宝,魏晓明,李佳益,刘岩.抗裂与易裂果西瓜果皮解剖结构及酶活性比较[J].北方园艺,2016(20):92-96.GAO Meiling,YU Changbao,WEI Xiaoming,LI Jiayi,LIU Yan.Comparison of peel anatomical structure and enzyme activity between anti cracking and easy cracking watermelon[J].Northern Horticulture,2016(20):92-96.
[18]BONGHI C,RASCIO N,RAMINA A,CASADORO G.Cellulase and polygalacturonase involvement in the abscission of leaf and fruit explants of peach[J].Plant Molecular Biology,1992,20(5):839-848.
[19]ROONGSATTHAM P,MORCILLO F,JANTASURIYARAT C,PIZOT M,MOUSSU S,JAYAWEERA D,COLLIN M,GONZALEZ-CARRANZA Z H,AMBLARD P,TREGEAR J W,TRAGOONRUNG S,VERDEIL J L,TRANBARGER T J.Temporal and spatial expression of polygalacturonase gene family members reveals divergent regulation during fleshy fruit ripening and abscission in the monocot species oil palm[J].BMC Plant Biology,2012,12:150.
[20]MEAKIN P J,ROBERTS J A.Anatomical and biochemical changes associated with the induction of oilseed rape (Brassica napus) pod dehiscence by Dasineura brassicae (Winn.)[J].Annals of Botany,1991,67(3):193-197.
[21]陈鸿飞,邵红霞,樊胜,马娟娟,张东,韩明玉.苹果全基因组多聚半乳糖醛酸酶基因家族的鉴定及进化分析[J].园艺学报,2016,43(10):1863-1877.CHEN Hongfei,SHAO Hongxia,FAN Sheng,MA Juanjuan,ZHANG Dong,HAN Mingyu.Identification and phylogenetic analysis of the polygalacturonase gene family in apple[J].Acta Horticulturae Sinica,2016,43(10):1863-1877.
[22]霍如雪,刘振宁,杨青,王光全.桃PG 基因家族的鉴定与分析[J].江苏农业科学,2016,44(6):33-40.HUO Ruxue,LIU Zhenning,YANG Qing,WANG Guangquan.Identification and analysis of PG gene family in peach[J].Jiangsu Agricultural Science,2016,44(6):33-40.
[23]KHAN N,FATIMA F,HAIDER M S,SHAZADEE H,LIU Z,ZHENG T,FANG J.Genome-wide identification and expression profiling of the polygalacturonase (PG) and pectin methy-lesterase(PME)genes in grapevine(Vitis vinifera L.)[J].International Journal of Molecular Sciences,2019,20(13):3180.
[24]何颖,宋爽,李美育,薄文浩,李颖岳,曹明,王爱华,李国强,刘晓宇,庞晓明.枣多聚半乳糖醛酸酶基因家族的鉴定及表达分析[J].分子植物育种,2021,19(5):1442-1450.HE Ying,SONG Shuang,LI Meiyu,BO Wenhao,LI Yingyue,CAO Ming,WANG Aihua,LI Guogiang,LIU Xiaoyu,PANG Xiaoming.Identification and expression analysis of the polygalacturonase gene family in Chinese jujube(Ziziphus jujuba Mill.)[J].Molecular Plant Breeding,2021,19(5):1442-1450.
[25]代学慧,雷亚欣,黄小镂,丛汉卿,罗海燕,陈业渊.红象牙杧果果实PG 基因家族鉴定及基因功能分析[J/OL].基因组学与应用生物学:1-17[2021-08-09].http://kns.cnki.net/kcms/detail/45.1369.Q.20210430.1629.010.html.DAI Xuehui,LEI Yaxin,HUANG Xiaolou,CONG Hanqing,LUO Haiyan,CHEN Yeyuan.Identification and functional analysis of PG gene family in Hong Xiangya mango (Mangifera indica L.)fruit[J/OL].Genomics and Applied Biology:1-17[2021-08-09].http://kns.cnki.net/kcms/detail/45.1369.Q.20210430.1629.010.html.
[26]李伟才,谢江辉,陈佳瑛,张秀梅,弓德强.果树裂果机理及防治措施研究进展[J].热带农业科学,2007,27(1):55-60.LI Weicai,XIE Jianghui,CHEN Jiaying,ZHANG Xiumei,GONG Deqiang.Advances on the mechanism and preventing measures of cracking fruit[J].Tropical Agricultural Science Technology,2007,27(1):55-60.
[27]魏秀清,许玲,章希娟,陆东和,许家辉.贮藏温度对‘农科二号’莲雾采后生理及品质的影响[J].保鲜与加工,2020,20(5):55-59.WEI Xiuging,XU Ling,ZHANG Xijuan,LU Donghe,XU Jiahui.The influence of storage temperature on post-harvest physiology and quality of‘Nongke 2’wax apple[J].Storage and Process,2020,20(5):55-59.
[28]LU P L,LIN C H.Physiology of fruit cracking in wax apple(Syzygium samarangense) [J].Botanica Orientalis Journal of Plant Science,2012,8:70-76.
[29]王建宇.枣裂果生理特征及转录组和蛋白组学分析[D].塔里木:塔里木大学,2020.WANG Jianyu.Physiological characteristics, transcriptome and proteomic analysis of jujube fruit cracking[D].Tarim:Tarim University,2020.
[30]李建国,黄辉白,袁荣才,高飞飞.荔枝裂果与果实生长及水分吸收动力学的关系[J].华南农业大学学报,1992,13(4):129-135.LI Jianguo, HUANG Huibai, YUAN Rongcai, GAO Feifei.Litchi fruit cracking in relation to fruit growth and water-uptake kinetics[J].Journal of South China Agricultural University,1992,13(4):129-135.
[31]YU Y,LIANG Y,LV M,WU J,LU G,CAO J.Genome-wide identification and characterization of polygalacturonase genes in Cucumis sativus and Citrullus lanatus[J].Plant Physiology &Biochemistry,2014,74:263-275.
[32]CHEN C J,CHEN H,ZHANG Y,THOMAS H R,FRANK M H,HE Y,XIA R.TBtools:An integrative toolkit developed for interactive analyses of big biological data[J].Molecular Plant,2020,13(8):1194-1202.
[33]RHEE S Y,OSBORNE E,POINDEXTER P D,SOMERVILLE C R.Microspore separation in the quartet 3 mutants of Arabidopsis is impaired by a defect in a developmentally regulated polygalacturonase required for pollen mother cell wall degradation[J].Plant Physiology,2003,133(3):1170-1180.
[34]HAO Y,CHEN F,WU G,GAO W.Impact of postharvest nitric oxide treatment on lignin biosynthesis-related genes in wax apple (Syzygium samarangense) fruit[J].Journal of Agricultural &Food Chemistry,2016,64(45):8483-8490.
[35]YANG Z H,WONG W S W,NIELSEN R.Bayes empirical bayes inference of amino acid sites under positive selection[J].Molecular Biology&Evolution,2005,22(4):1107-1118.
[36]HADFIELD K A.Polygalacturonase gene expression in ripe melon fruit supports a role for polygalacturonase in ripening-associated pectin disassembly[J].Plant Physiology,1998,117(2):363-373.
[37]TORKI M,MANDARON P,MACHE R,FALCONET D.Characterization of a ubiquitous expressed gene family encoding polygalacturonase in Arabidopsis thaliana[J].Gene,2000,242(1/2):427-436.
[38]魏潇,刘威生,刘宁,章秋平,张玉萍,刘硕,刘有春.果实软化相关PG 基因的进化分析和基因组定位[J].园艺学报,2011,38(9):1791-1799.WEI Xiao,LIU Weisheng,LIU Ning,ZHANG Qiuping,ZHANG Yuping,LIU Shuo,LIU Youchun.Phylogenetic analysis and genomic localization of polygalacturonase genes related to fruit softening[J].Acta Horticulturae Sinica,2011,38(9):1791-1799.
[39]JANSSEN B J,THODEY K,SCHAFFER R J,ALBA R,BALAKRISHNAN L,BISHOP R,BOWEN J H,CROWHURST R N,GLEAVE A P,LEDGER S,MCARTNEY S,PICHLER F B,SNOWDEN K C,WARD S.Global gene expression analysis of apple fruit development from the floral bud to ripe fruit[J].BMC Plant Biology,2008,8:16.
[40]JI X R,YU Y H,NI P Y,ZHANG G H,GUO D L.Genomewide identification of small heat-shock protein (HSP20) gene family in grape and expression profile during berry development[J].BMC Plant Biology,2019,19(1):433.
[41]KOYAMA K,SADAMATSU K,GOTO-YAMAMOTO N.Abscisic acid stimulated ripening and gene expression in berry skins of the Cabernet Sauvignon grape[J].Functional & Integrative Genomics,2010,10(3):367-381.
[42]周玉婵,唐友林,谭兴杰,郭俊彦.采后ABA、GA3对杧果细胞壁降解酶、类胡萝卜素含量的作用[J].植物生理学,1996,22(4):421-426.ZHOU Yuchan,TANG Youlin,TAN Xingjie,GUO Junyan.Effects of exogenous ABA,GA3,and cell-wall-degrading enzyme activity,carotenoid content in ripening mango fruit[J].Acta Phytophysiologica Sinica,1996,22(4):421-426.