蛋白磷酸酶2C(2C type protein phosphatases,PP2C)是依赖Mg2+或Mn2+的单体酶,属于丝氨酸/苏氨酸蛋白磷酸酶(serine/threonine protein phosphatases, STPs)家族中的小亚族,进化保守,广泛存在于古细菌、细菌、真菌、植物和动物中[1]。相较于其他生物,植物中PP2C蛋白数量最为丰富[2]。大部分植物PP2C蛋白的C端有保守的催化区域,而N端则是保守性不强、长度不一的延伸区域,这些延伸区域含有跨膜区域、激酶互作区域等与胞内信号相关的序列[3]。
研究发现,拟南芥(Arabidopsis thaliana)中共鉴定出80个PP2C基因家族成员,并将其划分为12个亚族(A~L)[4]。其中,A亚族的PP2C蛋白(如ABI1、ABI2 和AHG1)通过与脱落酸(abscisic acid,ABA)受体蛋白PYR/PYL/RCAR结合来负向调控ABA信号[5];B 亚族的PP2C 蛋白被证明参与或介导了丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号传递[6];C亚族的PP2C蛋白与花器发育相关[7];而关于其他亚族的PP2C 蛋白研究较少。PP2C基因家族成员在低温、高温以及干旱等非生物胁迫过程中也发挥重要的调控作用。利用转基因技术将玉米的ZmPP2C2基因转入烟草后,发现转基因植株较对照具有更高的发芽率和抗氧化酶活性以及更低的电解质渗透率和丙二醛(malondialdehyde,MDA)含量,这表明ZmPP2C2蛋白在烟草耐冷过程中起着积极的调节作用[8];在葡萄中通过基因芯片表达谱分析发现,葡萄C 亚族在响应低温胁迫过程中主要起正调控作用[9];Zhang等[10]对构树的研究中发现,在低温4 ℃处理下,被检测的18 个BpPP2Cs基因家族成员中有4个成员上调表达,且有2个基因在低温处理6 h 时磷酸化水平上升,初步证明了PP2C基因介导植株冷胁迫的过程;在对二穗短柄草的研究中发现,包括高温42 ℃和低温4 ℃在内的非生物胁迫下,几乎所有的BdPP2Cs基因都呈现上调表达的趋势[1];过表达ZmPP2C-A10转基因拟南芥株较对照更易失水,使其对干旱更敏感[11];在小麦中,TaPP2C-a10 蛋白与TaDOG1L1、TaDOG1L4 蛋白相互作用后会导致种子在萌发阶段耐旱性降低[12]。还有研究发现,水稻PP2C基因家族成员BIPP2C2a基因在烟草中的异位表达使植株对烟草花叶病毒的抗病性增强,提示OsBIPP2C2a 基因可能通过激活防御反应在抗病性中发挥重要作用[13]。
柑橘是全球产量最大的水果,也是我国南方栽培面积最大、经济地位最重要的果树[14]。然而,柑橘对栽培条件要求较高,易受低温、高温、干旱、盐害和病虫害等胁迫的影响,严重制约了柑橘产业的健康发展[15]。因此,开展柑橘抗逆方面的研究工作尤为重要。枳作为柑橘种植中广泛应用的砧木,其抗性好,是挑选柑橘抗性基因的理想材料。笔者在本研究中基于枳基因组数据,利用生物信息学方法对PtrPP2C 基因家族成员进行系统性分析,并对不同胁迫处理下的枳叶片相对表达量进行分析,以深入了解PtrPP2C 基因家族,探究PtrPP2C 基因家族成员响应多种胁迫的可能性,为抗性基因的挖掘和抗性机制的解析奠定基础。
1 材料和方法
1.1 植物材料与处理
试验于2021 年夏季在赣南师范大学国家脐橙工程技术研究中心果树逆境生理实验室进行。试验材料为1 年生枳组培盆栽苗(规格30 cm×28 cm,基质为草炭、蛭石和珍珠岩按体积比3∶1∶1 混合),在处理前进行常规管理,保证其生长良好。温度胁迫植株置于培养箱(光照度1500~2000 lx,相对湿度80%)分别进行(4±1)℃低温和(38.0±0.5)℃高温处理;干旱胁迫处理植株置于装满Hoagland营养液的塑料容器(36 cm×33 cm×26 cm)中,用ACO-318 型打氧机(广东海利)供氧,干旱处理为15%PEG6000。每个处理均设置3 次生物学重复,并分别在处理后0、3、6 和12 h 共4 个时间点剪取枳苗嫩叶片,经液氮速冻后置于-80 ℃冰箱保存。
1.2 枳PP2C基因家族的鉴定
从柑橘基因组数据库(http://citrus.hzau.edu.cn/)下载枳蛋白质序列文件,在Pfam(http://pfam.xfam.org/)下载PP2C 蛋白结构域(PF00481)的hmm 文件,利用HMMER 3.0 在E-value<1×10-6条件下进行枳PP2C 全基因组鉴定。进一步使用Pfam、CDD(https://www.ncbi.nlm.nih.gov/cdd/term)和InterPro(https://www.ebi.ac.uk/interpro/search/sequence/) 进行蛋白结构域验证,剔除不含PP2C结构域的蛋白序列,得到的枳PP2C 基因家族成员按照其在染色体上位置依次进行命名。在ExPASy ProtParam 网站(https://web.expasy.org/protparam/)对PtrPP2C 蛋 白序列的氨基酸数、等电点、分子质量、不稳定系数、亲水性及脂肪系数进行分析,亚细胞定位通过WoLF PSORT(https://psort.hgc.jp/)进行预测。
1.3 枳PP2C基因家族成员染色体定位及系统进化分析
从柑橘基因组数据库下载枳基因组注释文件,使用TBtools 从枳基因组注释文件中提取染色体长度信息和PP2C 基因在染色体上位置信息,利用Map MG2C在线工具(http://mg2c.iask.in/mg2c_v2.0/)绘制PtrPP2Cs在染色体上的位置。经查阅文献,得到80 个拟南芥(Arabidopsis thaliana)PP2C 基因序列号,在拟南芥数据库(https://www.arabidopsis.org/)中下载其蛋白序列,同时参照前人命名方式对其命名[16]。然后基于邻接法(neighbor-joining method,NJ),使用MEGA 7.0 软件构建系统进化发育树,Bootstrap值重复1000次,其他参数为默认值。
1.4 枳PP2C基因家族成员的基因结构与蛋白保守基序分析
根据PtrPP2Cs 的编码序列(coding sequence,CDS)及其基因组DNA 序列,运用GSDS v2.0 在线软件(http://gsds.gao-lab.org/)绘制基因结构分布图。PtrPP2C蛋白的保守基序分析通过MEME在线网 站(https://meme- suite.org/meme/tools/meme)完成,基序最大数量设置为14,保存结果数据,使用TBtools对其结果进行可视化。
1.5 枳PP2C基因家族成员的共线性分析
使用Tbtools中的Advanced Circos分析PtrPP2Cs在进化过程中可能发生的基因复制事件,并筛选基因复制对信息。然后使用TBtools 中的Dual Systeny Plot for Mcscanx 分析枳与拟南芥、水稻中PP2C基因的共线性,并筛选基因复制对信息。
1.6 枳PP2C基因家族成员的二级结构和启动子顺式作用元件预测
利用SOPMA 在线软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对PtrPP2C 蛋白的二级结构进行预测分析。使用TBtools提取PtrPP2Cs起始密码子上游2000 bp的序列用于启动子分析,将序列提交至PlantCARE 在线网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行启动子顺式作用元件预测,最后使用Excel统计分析数据并制图。
1.7 枳PP2C基因家族成员的组织特异性分析
从NCBI Short Read Archive database(SRA)(https://www.ncbi.nlm.nih.gov/sra/)分别下载枳中根(检索号SRR5572297)、茎(检索号SRR1947307)、叶(检索号SRR7738121)、花芽(检索号SRR3924380)和果实(检索号SRR7743799)共5 个组织的转录组数据,确定PtrPP2Cs 的FPKM(fragments per kilobase per million mapped fragments)值。使用TBtools 绘制热图,红色表示基因表达上调,绿色则表示下调。
1.8 枳PP2C基因家族成员在不同非生物胁迫处理下的实时荧光定量PCR分析
使用植物总RNA提取试剂盒(SIMGEN,杭州)提取处理后的枳叶片总RNA,测定总RNA 浓度并检测其质量后使用cDNA 第一链合成试剂盒(SIMGEN,杭州)反转录合成第一链cDNA,-20 ℃保存、备用。使用Beacon Designer 7.0 软件设计实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)引物(表1),由生工生物工程(上海)股份有限公司合成,使用LightCycler480 型仪器(Roche, Basel, Switzerland)检测不同胁迫处理下PtrPP2Cs 相对表达量。反应体系为:2×SYBR Green PCR Mix(SIMGEN,杭州)5 μL,10 μmol·L-1正反向引物各0.5 μL,cDNA 和ddH2O 各2 μL。反应程序为:95 ℃预变性2 min,95 ℃变性20 s,60 ℃退火20 s,72 ℃延伸30 s,40 个循环。内参基因为柑橘ACTB[17],每个反应设定3 次技术重复。采用2- △△Ct 法[18]计算PtrPP2Cs的相对表达量,使用DPS 9.01软件分析基因表达间的差异显著性(p <0.05),利用SigmaPlot 14.0软件作图。
表1 枳PP2C 基因家族成员的qRT-PCR 引物信息
Table 1 qRT-PCR primer information of PtrPP2C family members
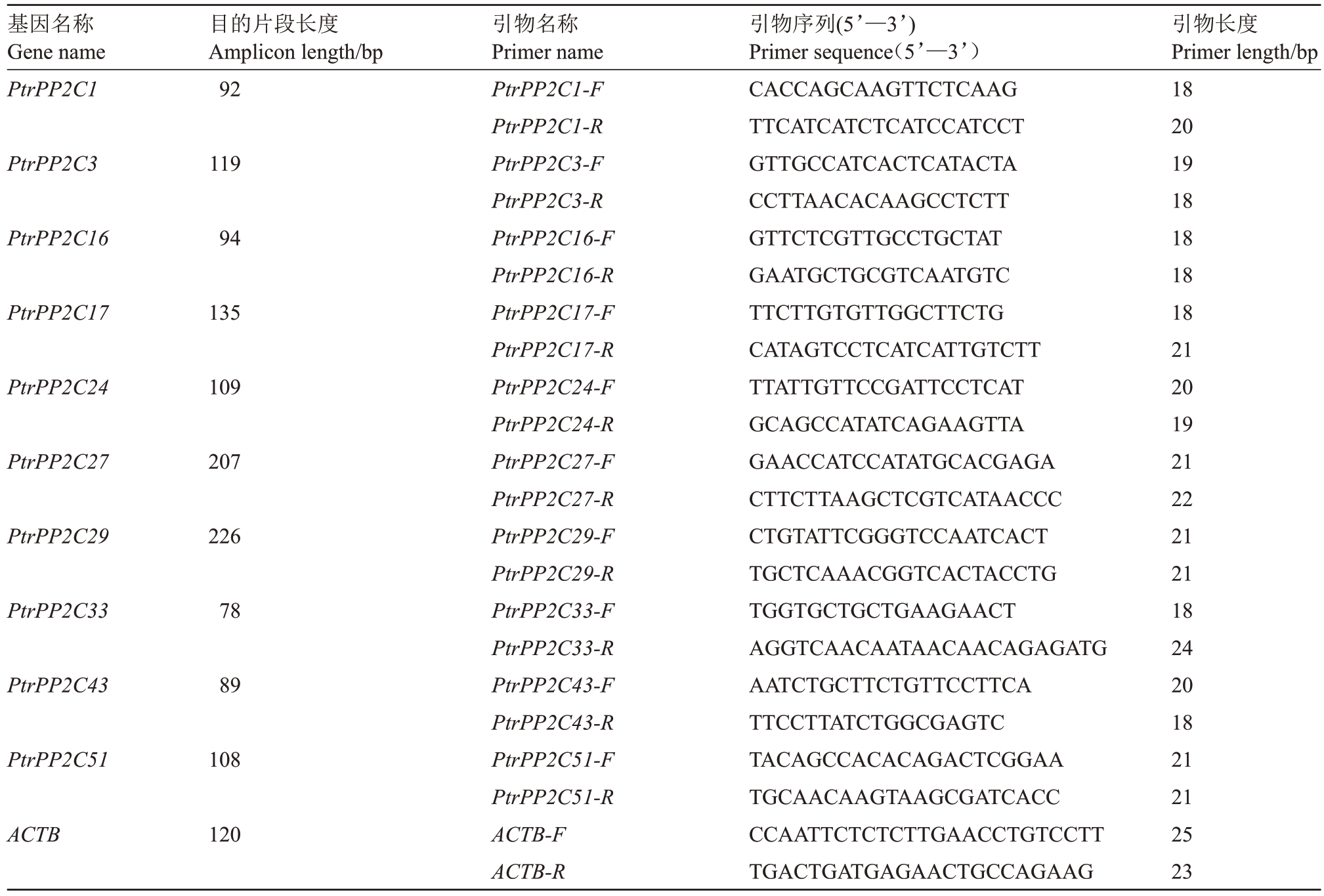
基因名称Gene name PtrPP2C1目的片段长度Amplicon length/bp 92 PtrPP2C3 119 PtrPP2C16 94 PtrPP2C17 135 PtrPP2C24 109 PtrPP2C27 207 PtrPP2C29 226 PtrPP2C33 78 PtrPP2C43 89 PtrPP2C51 108 ACTB 120引物名称Primer name PtrPP2C1-F PtrPP2C1-R PtrPP2C3-F PtrPP2C3-R PtrPP2C16-F PtrPP2C16-R PtrPP2C17-F PtrPP2C17-R PtrPP2C24-F PtrPP2C24-R PtrPP2C27-F PtrPP2C27-R PtrPP2C29-F PtrPP2C29-R PtrPP2C33-F PtrPP2C33-R PtrPP2C43-F PtrPP2C43-R PtrPP2C51-F PtrPP2C51-R ACTB-F ACTB-R引物序列(5’—3’)Primer sequence(5’—3’)CACCAGCAAGTTCTCAAG TTCATCATCTCATCCATCCT GTTGCCATCACTCATACTA CCTTAACACAAGCCTCTT GTTCTCGTTGCCTGCTAT GAATGCTGCGTCAATGTC TTCTTGTGTTGGCTTCTG CATAGTCCTCATCATTGTCTT TTATTGTTCCGATTCCTCAT GCAGCCATATCAGAAGTTA GAACCATCCATATGCACGAGA CTTCTTAAGCTCGTCATAACCC CTGTATTCGGGTCCAATCACT TGCTCAAACGGTCACTACCTG TGGTGCTGCTGAAGAACT AGGTCAACAATAACAACAGAGATG AATCTGCTTCTGTTCCTTCA TTCCTTATCTGGCGAGTC TACAGCCACACAGACTCGGAA TGCAACAAGTAAGCGATCACC CCAATTCTCTCTTGAACCTGTCCTT TGACTGATGAGAACTGCCAGAAG引物长度Primer length/bp 18 20 19 18 18 18 18 21 20 19 21 22 21 21 18 24 20 18 21 21 25 23
2 结果与分析
2.1 枳PP2C基因家族的鉴定与分析
从枳基因组中共鉴定出53 个PtrPP2C 基因家族成员,根据其在染色体上的位置信息依次命名为PtrPP2C1~PtrPP2C53(表2)。PtrPP2C基因家族成员蛋白序列差异较大,氨基酸数目在235~1184 aa;等电点在4.82~9.47,其中PtrPP2C10、PtrPP2C12、PtrPP2C17、PtrPP2C19、PtrPP2C23、PtrPP2C24、PtrPP2C28、PtrPP2C36、PtrPP2C37、PtrPP2C38、PtrPP2C41、PtrPP2C45、PtrPP2C47 和PtrPP2C53 等电点大于7,为碱性蛋白,其余39个成员均为酸性蛋白;分子质量最大的为127.95 ku,最小的为25.90 ku,平均分子质量为76.93 ku;53个PtrPP2C蛋白中,稳定蛋白约占32.08%(17 个),不稳定蛋白约占67.92%(36 个),表明枳中PP2C 蛋白以不稳定蛋白为主;蛋白亲水性为-0.547~-0.022,均小于0,为亲水性蛋白;脂肪系数介于68.43~98.53 之间,平均脂肪系数为83.48。亚细胞定位预测的结果显示,PtrPP2C 蛋白分别被定位到了叶绿体(25 个)、细胞质(12个)、细胞核(9个)、线粒体(3个)、过氧化物酶体(2个)、细胞外基质(1个)和质膜(1个)中。
表2 枳PP2C 基因家族成员信息
Table 2 The information of PtrPP2C family members

注:Nucl.细胞核;Cyto.细胞质;Chlo.叶绿体;Pero.过氧化物酶体;Mito.线粒体;Extr.细胞外基质;Plas.质膜。
Note:Nucl.Nucleus;Cyto.Cytoplasm;Chlo.Chloroplast;Pero.Peroxisome;Mito.Mitochondrion;Extr.Extracellular;Plas.Plasma membrane.
基因名称Gene name PtrPP2C1 PtrPP2C2 PtrPP2C3 PtrPP2C4 PtrPP2C5 PtrPP2C6 PtrPP2C7 PtrPP2C8 PtrPP2C9 PtrPP2C10 PtrPP2C11 PtrPP2C12 PtrPP2C13 PtrPP2C14 PtrPP2C15 PtrPP2C16 PtrPP2C17 PtrPP2C18 PtrPP2C19 PtrPP2C20 PtrPP2C21 PtrPP2C22 PtrPP2C23 PtrPP2C24 PtrPP2C25 PtrPP2C26 PtrPP2C27 PtrPP2C28 PtrPP2C29 PtrPP2C30 PtrPP2C31 PtrPP2C32 PtrPP2C33 PtrPP2C34 PtrPP2C35 PtrPP2C36 PtrPP2C37 PtrPP2C38 PtrPP2C39 PtrPP2C40 PtrPP2C41 PtrPP2C42 PtrPP2C43 PtrPP2C44 PtrPP2C45 PtrPP2C46 PtrPP2C47 PtrPP2C48 PtrPP2C49 PtrPP2C50 PtrPP2C51 PtrPP2C52 PtrPP2C53亚细胞定位Subcellular localization Nucl Cyto Chlo Chlo Chlo Cyto Cyto Cyto Chlo Cyto Chlo Chlo Chlo Cyto Cyto Chlo Nucl Pero Chlo Nucl Chlo Chlo Chlo Chlo Cyto Chlo Mito Cyto Nucl Chlo Chlo Nucl Nucl Chlo Cyto Chlo Chlo Mito Cyto Chlo Pero Nucl Nucl Chlo Chlo Nucl Mito Chlo Chlo Chlo Cyto Extr Plas登录号Gene ID Pt1g000910.2 Pt1g001260.1 Pt1g004280.1 Pt1g007580.2 Pt1g007890.1 Pt1g009990.1 Pt1g011360.1 Pt1g016350.1 Pt1g023450.1 Pt2g011050.1 Pt2g011520.1 Pt2g020070.1 Pt3g016390.1 Pt3g022860.1 Pt3g024080.1 Pt3g031650.2 Pt4g006290.1 Pt4g016480.1 Pt4g021610.1 Pt4g022540.1 Pt5g004220.1 Pt5g007310.1 Pt5g009690.1 Pt5g013020.1 Pt5g013120.1 Pt6g005610.1 Pt6g009610.1 Pt6g012140.1 Pt6g015590.1 Pt6g016590.1 Pt6g018470.1 Pt7g005700.1 Pt7g010990.1 Pt7g012930.1 Pt7g016560.1 Pt7g021110.1 Pt8g001190.1 Pt8g003220.1 Pt8g010880.1 Pt8g012080.1 Pt9g001110.1 Pt9g002760.1 Pt9g003660.1 Pt9g004660.1 Pt9g008100.1 Pt9g018140.1 Pt9g018150.1 Pt9g018480.1 Pt9g020950.1 PtUn012080.1 PtUn026560.1 PtUn034640.1 PtUn034650.1氨基酸数目Amino acid number/aa 362 292 329 1082 394 334 235 818 550 283 470 428 389 679 663 1103 430 654 370 412 429 316 282 427 368 659 390 434 679 386 491 377 479 544 380 474 397 382 429 399 463 478 419 584 274 438 402 352 370 296 292 1184 441等电点pI 5.14 4.90 6.15 5.33 4.86 6.33 4.82 5.57 4.89 8.28 5.31 8.43 5.52 6.49 6.35 6.03 7.10 6.44 7.08 6.23 5.17 5.20 7.74 7.51 6.60 6.02 6.90 7.92 5.66 6.19 5.66 5.08 5.59 5.01 6.77 9.02 8.17 8.83 5.51 5.88 9.28 4.92 4.90 6.09 9.47 5.39 8.95 5.15 6.27 5.99 4.90 6.32 8.67分子质量Molecular weight/ku 39.78 31.36 36.01 119.90 43.23 36.86 25.90 90.83 59.68 31.20 51.88 46.35 42.67 74.75 73.03 124.68 47.10 73.72 39.93 45.13 46.75 34.24 30.75 45.83 40.67 73.33 44.06 48.23 75.37 43.61 53.99 41.26 52.93 58.75 42.40 52.68 44.18 42.59 46.95 43.10 51.99 52.25 45.92 64.16 30.67 48.01 43.75 39.15 40.13 32.33 31.36 127.95 48.92不稳定系数Instability index 40.42 39.57 35.08 41.22 59.54 47.93 43.72 42.35 46.43 33.90 44.63 35.49 40.06 35.95 34.07 40.78 47.09 44.45 37.04 56.75 41.14 34.01 41.02 32.10 39.59 41.74 51.08 41.88 37.42 38.11 43.60 32.95 44.02 42.74 42.11 48.13 48.28 49.52 41.91 65.01 41.21 37.71 32.02 44.78 40.17 66.67 55.82 38.60 42.84 41.94 39.57 47.31 52.99亲水性GRAVY-0.449-0.279-0.169-0.217-0.231-0.383-0.195-0.272-0.128-0.294-0.495-0.239-0.027-0.211-0.187-0.368-0.399-0.371-0.296-0.396-0.355-0.279-0.358-0.130-0.237-0.197-0.204-0.466-0.547-0.366-0.446-0.417-0.403-0.136-0.165-0.288-0.298-0.266-0.428-0.268-0.359-0.232-0.369-0.171-0.420-0.464-0.310-0.397-0.022-0.061-0.279-0.256-0.119脂肪系数Aliphatic index 70.36 79.52 92.67 88.91 85.30 86.74 91.28 89.32 90.00 88.87 68.43 85.00 98.53 87.04 88.85 79.54 76.44 83.94 78.27 79.95 80.49 80.00 81.24 88.13 77.12 91.78 91.21 75.74 74.82 82.82 75.48 74.80 77.41 94.08 95.95 86.75 88.09 91.10 73.85 80.90 85.27 86.09 75.30 91.51 80.80 73.97 84.45 78.64 93.35 95.91 79.52 78.85 88.68
2.2 枳PP2C基因家族成员的染色体定位及系统进化分析
53 个PtrPP2C 基因家族成员被不均等地定位到10条染色体上(图1)。Chr 1和Chr 9上含有数量最多的PtrPP2Cs(9 个),其次是含6 个PtrPP2Cs 的Chr 6,Chr 5和Chr 7上均含有5个PtrPP2Cs,Chr 3、Chr 4、Chr 8 和Chr Un 上均含有4 个PtrPP2Cs,含PtrPP2Cs 数量最少的染色体为Chr 2,仅含有3 个PtrPP2Cs。总的来看,染色体的长度与其含有的PtrPP2Cs数量无正相关联系。此外,同一条染色体上的基因在进化树中大多不属于同一亚族,推测同一条染色体上的不同基因可能行使不同的功能。
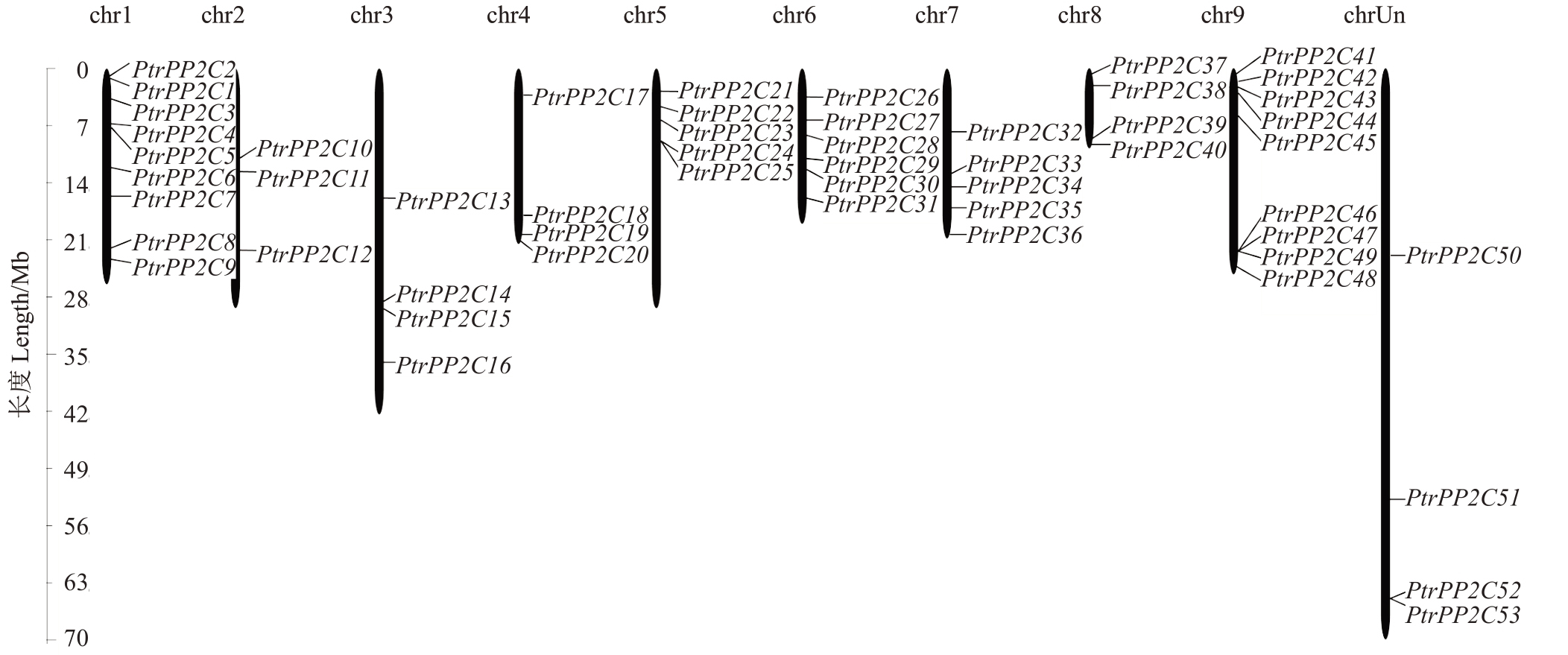
图1 枳PP2C 基因家族成员在染色体上的分布
Fig.1 Chromosome distribution of PtrPP2C family members
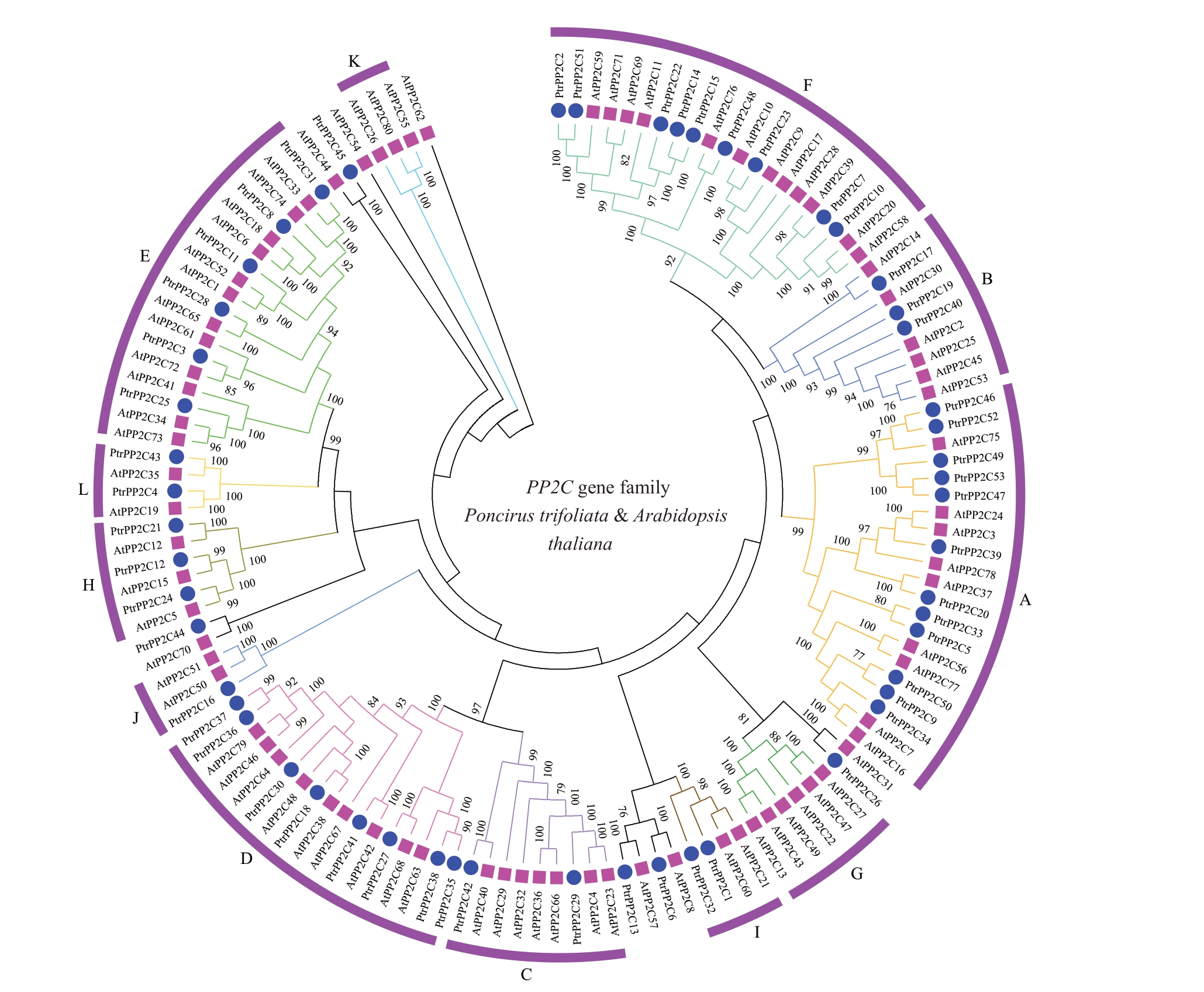
图2 枳与拟南芥PP2C 基因家族成员系统发育进化树
Fig.2 Phylogenetic trees of PP2C family members between Poncirus trifoliata(Ptr)and Arabidopsis thaliana(At)
分支上数值表示大于75%的自展支持率。
The number of the branches indicate the bootstrap confidence values over 75%.
为了明确枳中PP2C 基因家族成员的进化关系,将拟南芥和枳中PP2C 基因的蛋白序列合并构建系统发育树。结果显示,供试PP2C 基因共分为12 个亚族(A~L),而枳PP2C 基因被分到10 个亚族中。其中A 亚族的PtrPP2Cs 数量最多,达到12 个,其数量显著高于其他亚族,推测A 亚族可能为枳中最重要的亚族;而J亚族的PtrPP2Cs数量最少,仅有1个;G和K亚族中则没有PtrPP2Cs。此外还有5个PtrPP2Cs (PtrPP2C6、 PtrPP2C13、 PtrPP2C26、PtrPP2C44 和PtrPP2C45)未分入任何一个亚族中,单独形成分支,其进化关系有待进一步分析。
2.3 枳PP2C基因家族成员的基因结构分析
为了解PtrPP2Cs的基因结构,对其基因序列的内含子和外显子组成进行分析(图3)。结果显示,所有PtrPP2Cs 中的内含子与外显子均交叉镶嵌在一条完整的基因序列上。PtrPP2Cs 的内含子数量2~19个不等,约81.13%(43个)的PtrPP2Cs含有2~7个内含子。其中,PtrPP2C16的内含子数量最多,达到19 个;其次是PtrPP2C4,内含子有14 个;PtrPP2C7、PtrPP2C14、PtrPP2C15、PtrPP2C20、PtrPP2C39、PtrPP2C42和PtrPP2C43内含子数量最少,均为2 个;包含3 个内含子的基因达到17 个,这可能与PtrPP2Cs 基因结构相对保守有关。系统发育树中同属一个亚族的PtrPP2Cs 通常含有相似的内含子-外显子结构,如在D 亚族中约87.5%(7 个)的PtrPP2Cs含有4个内含子。

图3 枳PP2C 基因家族成员的基因结构
Fig.3 Gene structure of PtrPP2C family members
数值表示1000 次重复抽样所得75%以上的置信度。
The number represent the percentage of 1000 bootstrap replications,only above 75%was showed.
2.4 枳PP2C蛋白的保守基序分析
为进一步探究PtrPP2C 蛋白的序列特征,对PtrPP2C 蛋白保守基序组成进行分析,得到14 个保守Motif(图4)。结果显示,不同PtrPP2C 蛋白的Motif 数量相差较大,为5~11 个。其中,PtrPP2C44和PtrPP2C45 均含5 个Motif,为所有蛋白中所含Motif 数量最少的;其余大部分(19 个)PtrPP2C 蛋白都含有9 个Motif,推测其可能与基因的进化有关。Motif 2 和Motif 3 在所有PtrPP2C 蛋白中均存在,Motif 1、Motif 4、Motif 5、Motif 6、Motif 7、Motif 11和Motif 12 在大部分PtrPP2C 蛋白中都存在,Motif 8、Motif 9 和Motif 13 存在于D 亚族中,Motif 10 存在于F 和L 亚族中,Motif 14 则仅存在于A 亚族中。该现象可能是不同亚族行使不同的功能所致。此外,PtrPP2C19 的Motif 数量相比同一亚族的其他基因有缺失,这可能是基因串联重复过程中碱基丢失导致的;94.34%(50个)的PtrPP2C蛋白C端是Motif 6,且该氨基酸序列高度保守。
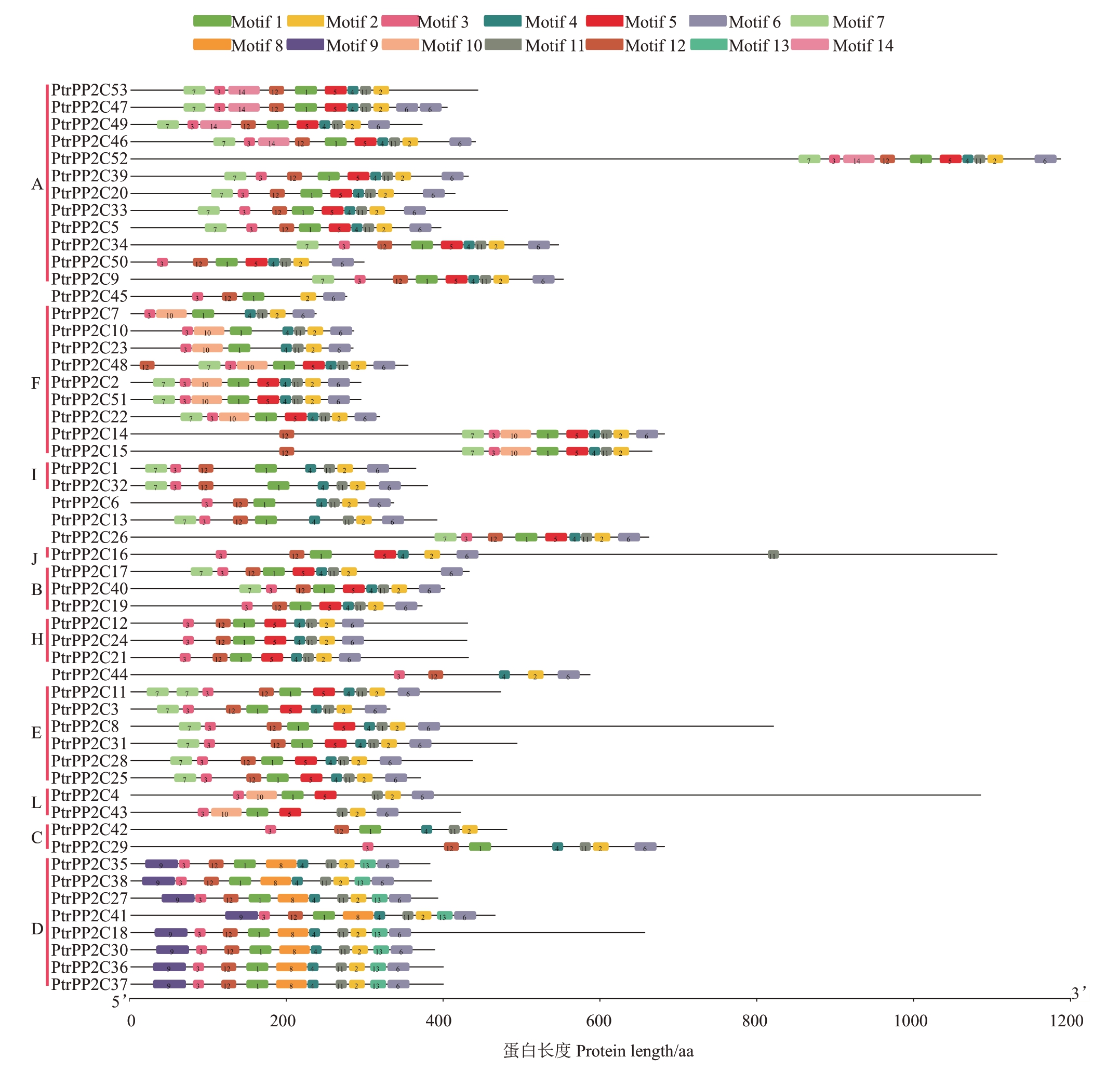
图4 枳PP2C 基因家族成员保守基序分布
Fig.4 Distribution of conserved motifs within PtrPP2C family members
2.5 枳PP2C基因家族成员的共线性分析
为进一步探索枳PP2C 基因家族成员的进化,对枳基因组进行共线性分析(图5)。结果显示,53个PtrPP2Cs 中共鉴定出了10 对片段复制基因,分别 为PtrPP2C1/PtrPP2C32、PtrPP2C2/PtrPP2C51、PtrPP2C5/PtrPP2C33、PtrPP2C7/PtrPP2C10、PtrPP-2C9/PtrPP2C34、PtrPP2C14/PtrPP2C15、PtrPP2C18/PtrPP2C30、PtrPP2C19/PtrPP2C40、PtrPP2C20/Ptr-PP2C39 和PtrPP2C35/PtrPP2C38。10 条染色体中仅Chr 5和Chr 9这2条染色体上无PtrPP2C片段复制基因;Chr 1上含有最多的片段复制基因,达5个;其次是Chr 7,片段复制基因数量为4个。
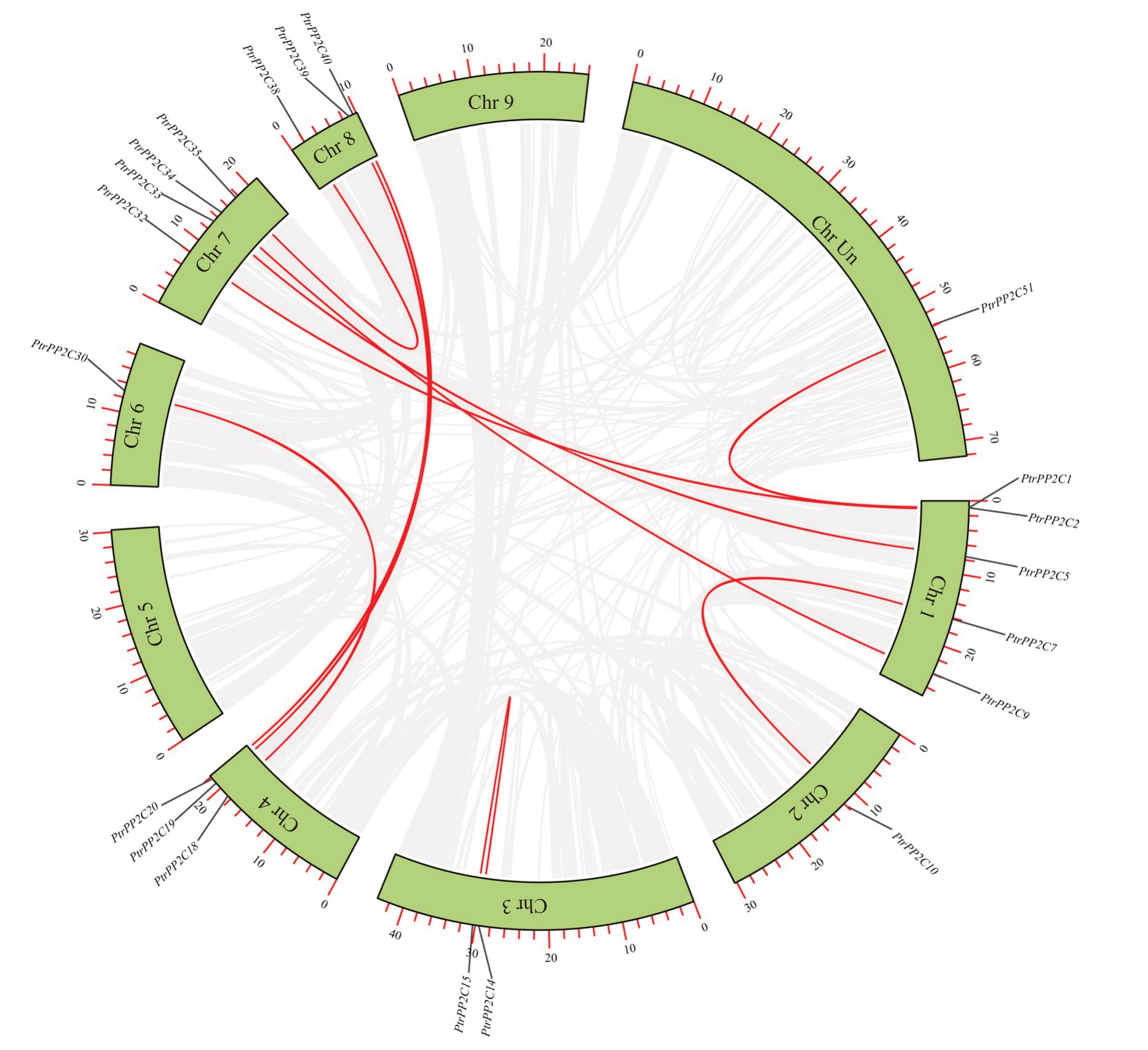
图5 枳PP2C 基因家族成员共线性分析
Fig.5 Collinear distribution of PtrPP2C family members
Chr 1~Chr Un 代表枳10 条染色体;0~70 代表染色体长度,单位为Mb;红色线连接的基因存在共线关系。下同。
Chr 1-Chr Un represent ten Poncirus trifoliata chromosomes;0-70 represent chromosome length,the unit is Mb;The genes connected by red lines have a collinear relationship.The same as below.
为进一步阐明PP2C基因在不同物种间的进化关系,对枳、拟南芥和水稻进行共线分析(图6)。结果显示,枳与拟南芥、水稻2种物种间均表现出共线性关系,并分别具有43 和27 个有共线性关系的PtrPP2Cs,其 中 仅11 个PtrPP2Cs(PtrPP2C3、PtrPP2C4、PtrPP2C19、PtrPP2C23、PtrPP2C28、PtrPP2C29、PtrPP2C36、PtrPP2C38、PtrPP2C39、PtrPP2C40 和PtrPP2C43)在拟南芥和水稻中同时具有同源关系。
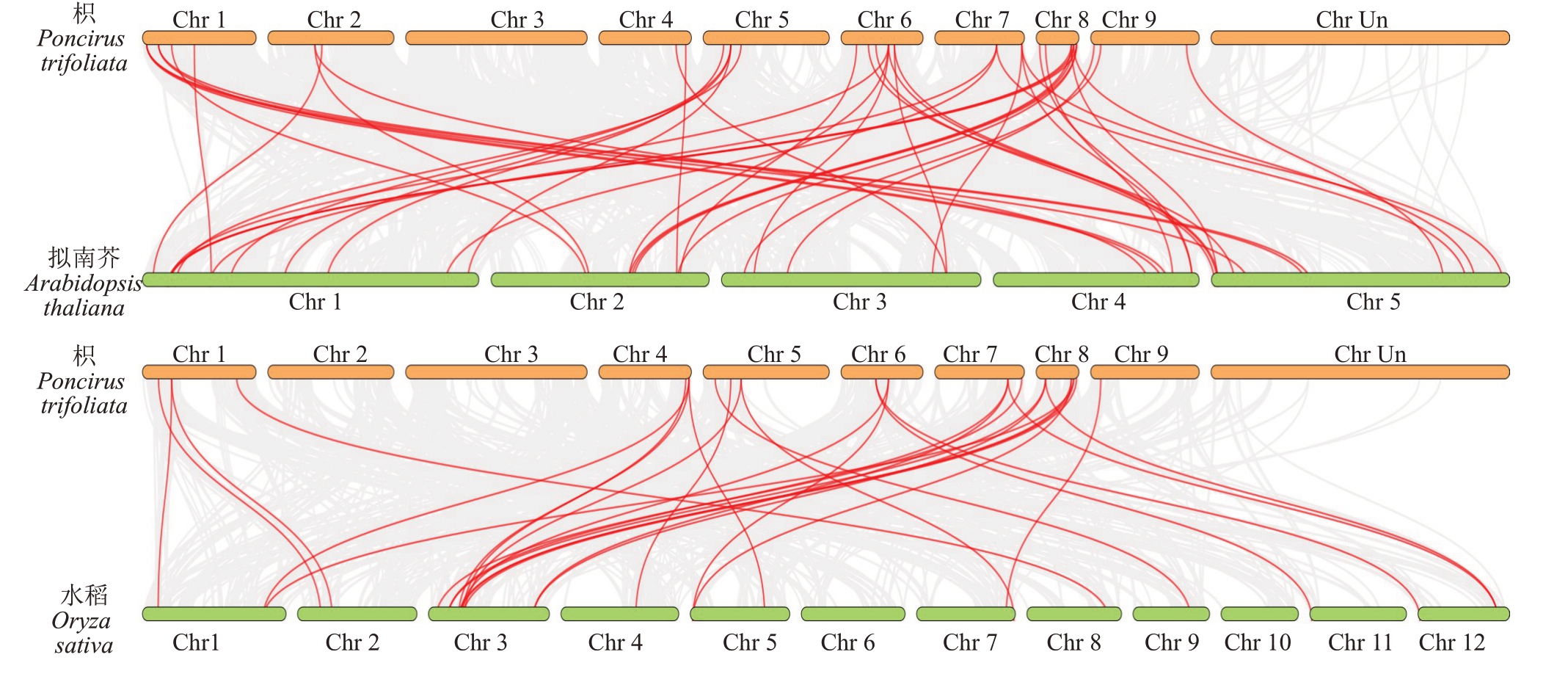
图6 枳、拟南芥和水稻PP2C 基因家族成员的同源性分析
Fig.6 Synteny analysis of PP2C family members between Poncirus trifoliata,Arabidopsis thaliana and Oryza sativa
2.6 枳PP2C基因家族成员的二级结构
PtrPP2C蛋白的二级结构预测结果(表3)显示,53个PtrPP2C蛋白的二级结构均存在α-螺旋(α-helix)、β-转角(β-turn)和无规则卷曲(random coil)现象。其中,无规则卷曲所占比例为24.26%~54.20%,是PtrPP2C蛋白结构的重要组成部分;α-螺旋和β-转角所占比例较少,分别为23.87%~43.83%和4.00%~10.21%。
表3 枳PP2C 基因家族成员的二级结构组成
Table 3 Secondary structure of PtrPP2C family members %
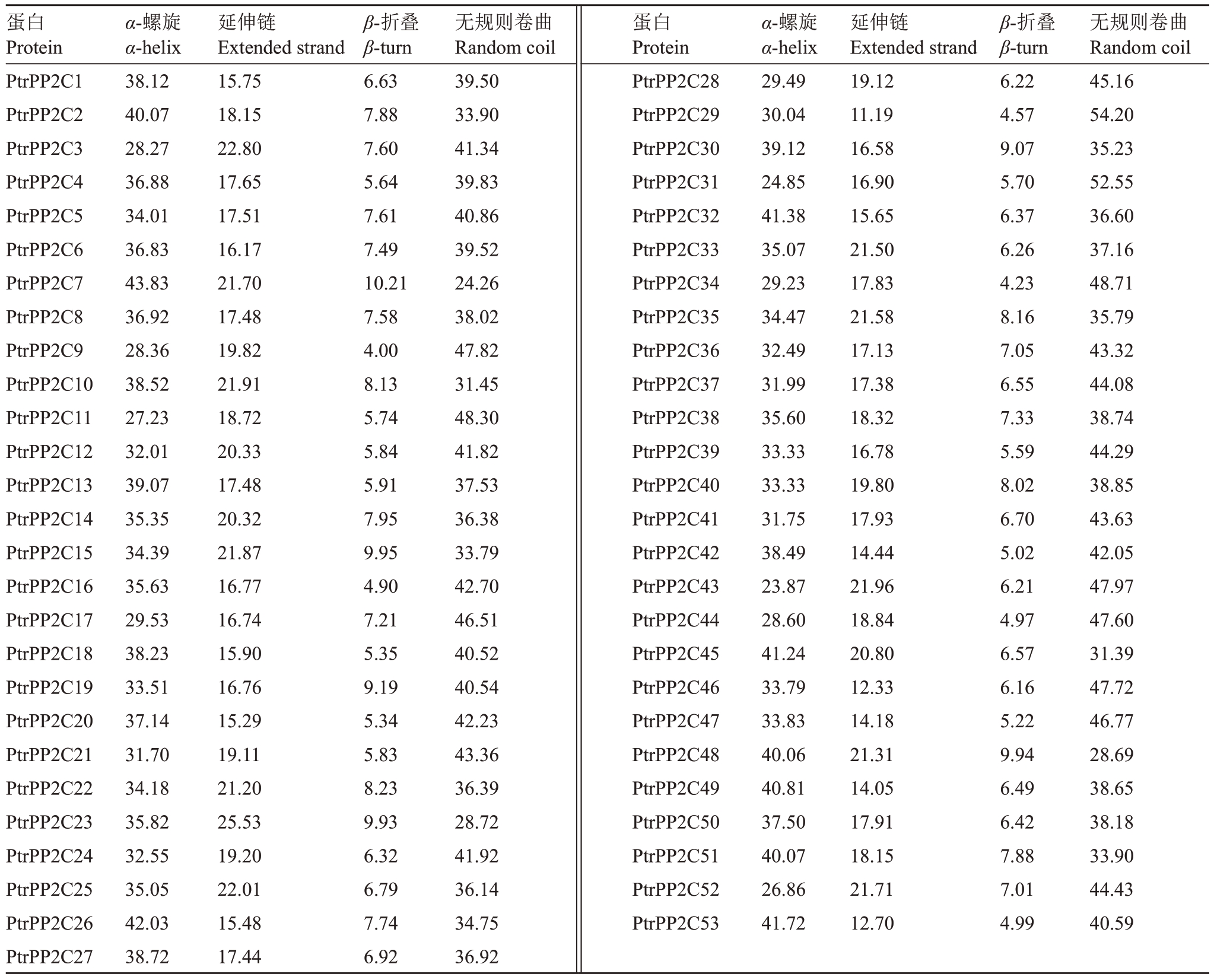
蛋白Protein PtrPP2C1 PtrPP2C2 PtrPP2C3 PtrPP2C4 PtrPP2C5 PtrPP2C6 PtrPP2C7 PtrPP2C8 PtrPP2C9 PtrPP2C10 PtrPP2C11 PtrPP2C12 PtrPP2C13 PtrPP2C14 PtrPP2C15 PtrPP2C16 PtrPP2C17 PtrPP2C18 PtrPP2C19 PtrPP2C20 PtrPP2C21 PtrPP2C22 PtrPP2C23 PtrPP2C24 PtrPP2C25 PtrPP2C26 PtrPP2C27 α-螺旋α-helix 38.12 40.07 28.27 36.88 34.01 36.83 43.83 36.92 28.36 38.52 27.23 32.01 39.07 35.35 34.39 35.63 29.53 38.23 33.51 37.14 31.70 34.18 35.82 32.55 35.05 42.03 38.72延伸链Extended strand 15.75 18.15 22.80 17.65 17.51 16.17 21.70 17.48 19.82 21.91 18.72 20.33 17.48 20.32 21.87 16.77 16.74 15.90 16.76 15.29 19.11 21.20 25.53 19.20 22.01 15.48 17.44 β-折叠β-turn 6.63 7.88 7.60 5.64 7.61 7.49 10.21 7.58 4.00 8.13 5.74 5.84 5.91 7.95 9.95 4.90 7.21 5.35 9.19 5.34 5.83 8.23 9.93 6.32 6.79 7.74 6.92无规则卷曲Random coil 39.50 33.90 41.34 39.83 40.86 39.52 24.26 38.02 47.82 31.45 48.30 41.82 37.53 36.38 33.79 42.70 46.51 40.52 40.54 42.23 43.36 36.39 28.72 41.92 36.14 34.75 36.92蛋白Protein PtrPP2C28 PtrPP2C29 PtrPP2C30 PtrPP2C31 PtrPP2C32 PtrPP2C33 PtrPP2C34 PtrPP2C35 PtrPP2C36 PtrPP2C37 PtrPP2C38 PtrPP2C39 PtrPP2C40 PtrPP2C41 PtrPP2C42 PtrPP2C43 PtrPP2C44 PtrPP2C45 PtrPP2C46 PtrPP2C47 PtrPP2C48 PtrPP2C49 PtrPP2C50 PtrPP2C51 PtrPP2C52 PtrPP2C53 α-螺旋α-helix 29.49 30.04 39.12 24.85 41.38 35.07 29.23 34.47 32.49 31.99 35.60 33.33 33.33 31.75 38.49 23.87 28.60 41.24 33.79 33.83 40.06 40.81 37.50 40.07 26.86 41.72延伸链Extended strand 19.12 11.19 16.58 16.90 15.65 21.50 17.83 21.58 17.13 17.38 18.32 16.78 19.80 17.93 14.44 21.96 18.84 20.80 12.33 14.18 21.31 14.05 17.91 18.15 21.71 12.70 β-折叠β-turn 6.22 4.57 9.07 5.70 6.37 6.26 4.23 8.16 7.05 6.55 7.33 5.59 8.02 6.70 5.02 6.21 4.97 6.57 6.16 5.22 9.94 6.49 6.42 7.88 7.01 4.99无规则卷曲Random coil 45.16 54.20 35.23 52.55 36.60 37.16 48.71 35.79 43.32 44.08 38.74 44.29 38.85 43.63 42.05 47.97 47.60 31.39 47.72 46.77 28.69 38.65 38.18 33.90 44.43 40.59
2.7 枳PP2C基因家族成员的启动子顺式作用元件分析
通过对PtrPP2Cs 启动子顺式作用元件进行预测和分析(图7),发现其中含有大量的光响应元件、激素响应元件及与逆境胁迫相关的响应元件。分别有81.13%(43 个)、73.58%(39 个)、60.38%(32 个)、50.94%(27个)和37.74%(20个)的PtrPP2Cs启动子中含有脱落酸、茉莉酸甲酯、赤霉素、水杨酸和生长素响应元件;分别有81.13%(43 个)、52.72%(29个)、41.51%(22个)和35.85%(19个)的PtrPP2Cs启动子中含有参与厌氧胁迫、干旱胁迫、防御与胁迫以及低温胁迫的响应元件。另外,少部分PtrPP2Cs启动子中还含有缺氧诱导、昼夜控制、分生组织表达、类黄酮生物合成和玉米醇溶蛋白代谢相关的组织生长发育以及特异性响应元件。这些结果表明,PtrPP2Cs在响应光调控、激素诱导和逆境胁迫的过程中可能发挥重要的调控作用。

图7 枳PP2C 基因家族成员启动子顺式作用元件种类和数量
Fig.7 Types and numbers of cis-acting elements in promoters of PtrPP2C family members
2.8 枳PP2C基因家族成员的组织特异性表达
为了明确PtrPP2Cs 在枳不同组织(根、茎、叶、花芽和果实)中的表达水平,基于转录组数据库FPKM值绘制PtrPP2Cs相对表达量热图(图8)。结果显示,PtrPP2Cs在枳不同组织中均有不同程度的表达。其中,PtrPP2Cs 在花芽中特异表达的基因最多,达到25 个,相对表达量最高的为PtrPP2C39,属于A 亚族;在根中特异表达的基因有24 个,相对表达量最高的为PtrPP2C38,属于D亚族;在果实中特异表达的基因有17 个,相对表达量最高的为PtrPP2C10,属于F 亚族;在叶中特异表达的基因有15个,相对表达量最高的也为PtrPP2C10;在茎中特异表达的基因数量最少,仅有13 个,相对表达量最高的为PtrPP2C48,属于F 亚族。该结果暗示PtrPP2Cs 在枳生长发育过程中可能发挥不同的调控作用。

图8 枳PP2C 基因家族成员在不同组织的表达
Fig.8 Different tissue expression analysis of PtrPP2C family members
2.9 枳PP2C基因家族成员在不同非生物胁迫处理下的表达模式分析
结合PtrPP2Cs 的系统进化分析结果与启动子顺式作用元件预测结果,从10 个亚族中各挑选1 个成员共计10 个基因,利用qRT-PCR 检测干旱、低温和高温胁迫处理下的PtrPP2Cs 相对表达量是否存在显著差异(图9)。在低温胁迫条件下,10 个PtrPP2Cs的相对表达量呈现持续上调的趋势,均在低温处理12 h 达到峰值,上调1.7~56.8 倍。在高温胁迫条件下,10个PtrPP2Cs表达呈现2种不同的表达模式,分别为持续上调(PtrPP2C3、PtrPP2C16、PtrPP2C24、PtrPP2C27、PtrPP2C29、PtrPP2C33、PtrPP2C43和PtrPP2C51)和持续下调(PtrPP2C1和PtrPP2C17);其 中,PtrPP2C27、PtrPP2C29 和PtrPP2C33显著上调,分别上调了21.6、195.1和21.7倍,而PtrPP2C1和PtrPP2C17的相对表达量分别仅为对照的37.7%和21.9%。在干旱胁迫条件下,10个PtrPP2Cs 同样表现出2 种不同的表达模式,除PtrPP2C27 持续下调以外,其余9 个基因相对表达量均呈持续上调趋势,在整个胁迫过程中PtrPP2C1、PtrPP2C3、PtrPP2C16、PtrPP2C17、PtrPP2C24、PtrPP2C29、PtrPP2C33、PtrPP2C43 和PtrPP2C51 在干旱处理12 h 相对表达量达到最高,上调2.6~5.8倍。
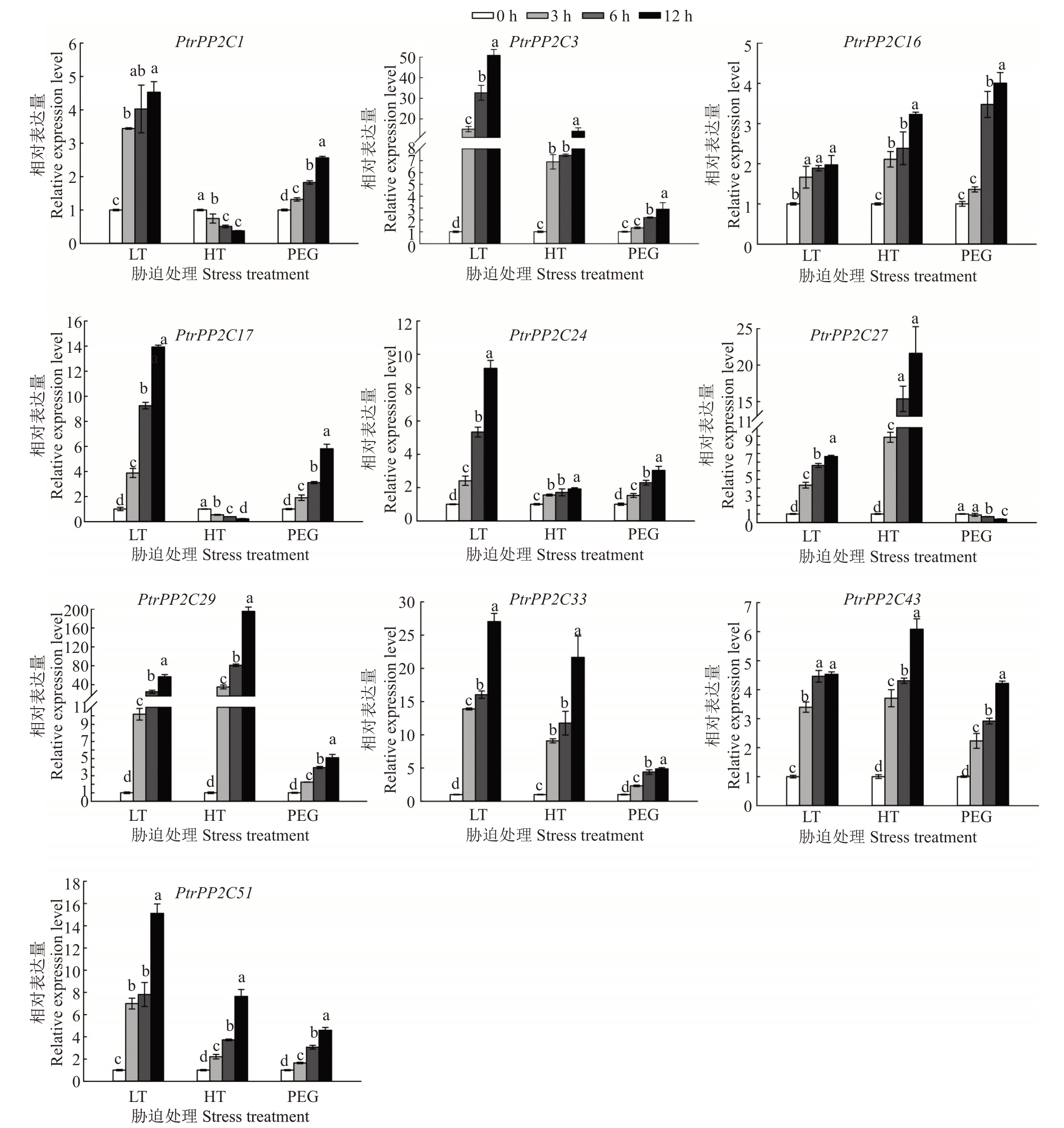
图9 枳PP2C 基因家族成员在不同非生物胁迫处理下的相对表达量
Fig.9 Relative expression of PtrPP2C family members under different stress treatments
不同小写字母表示在p <0.05 水平上显著差异;LT.(4±1)℃低温处理;HT.(38.0±0.5)℃高温处理;PEG.15%PEG6000 溶液处理,模拟干旱环境。
Different small letters indicate significant differences at the 0.05 level;LT.Low temperature;HT.High temperature;PEG.Water culture with 15%PEG solution,simulated arid environment.
3 讨 论
3.1 枳PP2C基因家族成员的鉴定与结构分析
PP2C 基因家族作为植物最大的蛋白磷酸酶家族,通过催化已磷酸化的蛋白质分子发生去磷酸化反应而调节植物代谢活动[19]。在不同植物中,PP2C基因家族的基因数量差异较大,如拟南芥有80 个,水稻有90 个,玉米则有104 个[20]。本研究从枳基因组中共鉴定获得53个PtrPP2Cs。PtrPP2C蛋白的氨基酸数、等电点及相对分子质量都存在较大差异,这可能与其功能多样性有关。在基因结构上,PtrPP2Cs的内含子数量在2~19个之间,外显子数量在3~20 个之间,与谷子PP2C 基因家族相似[7]。此外,PtrPP2C家族中存在10对片段复制基因,其中6对存在于PtrPP2Cs 的A 和F 亚族成员之间,推测枳为适应外界环境变化在进化过程中发生PP2C基因家族尤其是A和F亚族成员的复制事件,暗示这2个亚族成员在枳响应逆境胁迫过程中可能发挥重要作用。
系统进化分析显示,PtrPP2Cs可以分为10个亚族(A、B、C、D、E、F、H、I、J 和L)。与拟南芥相比,PtrPP2Cs没有分布在全部12个亚族中,G和K亚族中均没有PtrPP2Cs,这与葡萄中的研究结果相似[9]。研究表明,同一亚族的基因在基因结构和基序组成上具有较高的相似性[21]。本研究发现属于同一亚族的大部分PtrPP2Cs 也具有相似的基因结构和基序组成,暗示属于同一亚族的PtrPP2Cs可能具有相似的功能。然而,个别PtrPP2Cs的基因结构和同一亚族的其余PtrPP2Cs 相比存在差异,如PtrPP2C8 的外显子数量相比同一亚族的其他基因有所增加,推测其可能是同一亚族不同基因在进化过程中出现了内含子的增加。
3.2 枳PP2C基因家族成员在不同组织及非生物胁迫下的表达
同一物种不同PP2C 基因之间以及不同物种PP2C 基因之间在不同组织器官的表达存在差异。如在苹果中,MdPP2C-Like在根中表达水平较高,而在果实中低表达[22];草莓中,FvPP2C1在花药和花瓣中的相对表达量显著高于其在叶片、心皮和表皮中的相对表达量,FvPP2C10 在花药、花瓣和心皮中的相对表达量较高[23];苦荞中,FtPP2C08 在花和果实中的相对表达量较高,FtPP2C38在果实中的相对表达量是其在叶中相对表达量的1715 倍,而FtPP2C39 在根中高表达[24]。本研究结果也表明,PtrPP2Cs 的表达具有明显的组织表达特异性,如PtrPP2C10在果实和叶中高表达,而在花芽、根和茎中的相对表达量较低;PtrPP2C38 在根中的相对表达量显著高于其在花芽、果实、叶和茎中的相对表达量;PtrPP2C32 在果实、叶和茎中的相对表达量较高,而在花芽和根中低表达。
植物对于寒冷、高温与干旱等非生物胁迫的响应机制已被广泛研究[25]。有研究表明,PP2C基因主要通过ABA 通路和MAPK 通路参与低温胁迫响应[26],在拟南芥[27]和构树[10]中均有部分PP2C基因在受到低温胁迫后出现上调表达的趋势,这与本研究在枳中的结果一致,说明PtrPP2Cs也可能通过调节MAPK通路等形式参与枳抵抗低温胁迫的响应。已知PP2C基因的表达对干旱胁迫也存在明显的调控作用[28]。本研究结果表明,10 个PtrPP2Cs 中有9 个基因表达上调,说明多数PtrPP2Cs在干旱胁迫过程中可能具有重要的调控作用。此外,笔者分析PtrPP2Cs在高温处理条件下的表达水平发现,不同的基因出现不同的表达模式,在陆地棉中也出现过类似的结果[29]。综上结果表明,PtrPP2Cs在低温、高温和干旱胁迫中发挥重要作用,但尚需大量的研究工作才能揭示其在枳生长与逆境胁迫抵抗中具体的功能机制。
4 结 论
从枳基因组中鉴定出53个PtrPP2Cs,分析了其理化性质、进化关系、保守基序和表达谱等,并从中挑选10 个基因,通过qRT-PCR 检测了其在干旱、低温和高温胁迫处理下的表达水平,为系统研究PtrPP2C基因家族的功能奠定了基础。
[1]CAO J M,JIANG M,LI P,CHU Z Q.Genome-wide identification and evolutionary analyses of the PP2C gene family with their expression profiling in response to multiple stresses in Brachypodium distachyon[J].BMC Genomics,2016,17(1):175-191.
[2]SINGH A,PANDEY A,SRIVASTAVA A K,TRAN L S P,PANDEY G K.Plant protein phosphatases 2C:From genomic diversity to functional multiplicity and importance in stress management[J].Critical Reviews in Biotechnology,2016,36(6):1023-1035.
[3]胡秋涛,侯丹,赵钟毓,魏涵天,林新春.毛竹PP2C 基因家族鉴定与表达分析[J].农业生物技术学报,2020,28(10):1776-1787.HU Qiutao,HOU Dan,ZHAO Zhongyu,WEI Hantian,LIN Xinchun.Identification and expression analysis of PP2C gene family in Phyllostachys edulis[J].Journal of Agricultural Biotechnology,2020,28(10):1776-1787.
[4]FUCHS S,GRILL E,MESKIENE I,SCHWEIGHOFER A.Type 2C protein phosphatases in plants[J].FEBS Journal,2013,280(2):681-693.
[5]SINGH A,JHA S K,BAGRI J,PANDEY G K.ABA inducible rice protein phosphatase 2C confers ABA insensitivity and abiotic stress tolerance in Arabidopsis[J].PLoS One,2015,10(4):1-24.
[6]张冬,李晓娜,肖厚贞,陆燕茜,张宇,王萌.巴西橡胶树6 个PP2C 家族基因成员分子信息学与抗旱功能分析[J].植物研究,2017,37(5):730-737.ZHANG Dong,LI Xiaona,XIAO Houzhen,LU Yanxi,ZHANG Yu,WANG Meng.Bioinformatics and drought tolerance of PP2C gene family members in Hevea brasiliensis Muell.Arg.[J].Bulletin of Botanical Research,2017,37(5):730-737.
[7]闵东红,薛飞洋,马亚男,陈明,徐兆师,李连城,刁现民,贾冠清,马有志.谷子PP2C 基因家族的特性[J].作物学报,2013,39(12):2135-2144.MIN Donghong,XUE Feiyang,MA Yanan,CHEN Ming,XU Zhaoshi,LI Liancheng,DIAO Xianmin,JIA Guanqing,MA Youzhi.Characteristics of PP2C gene family in foxtail millet(Setaria italica) [J].Acta Agronomica Sinica,2013,39(12):2135-2144.
[8]HU X L,LIU L X,XIAO B L,LI D P,XING X,KONG X P,LI D Q.Enhanced tolerance to low temperature in tobacco by overexpression of a new maize protein phosphatase 2C,ZmPP2C2[J].Journal of Plant Physiology,2010,167(15):1307-1315.
[9]何红红,路志浩,马宗桓,梁国平,马丽娟,万鹏,毛娟.葡萄PP2C 家族基因的鉴定与表达分析[J].园艺学报,2018,45(7):1237-1250.HE Honghong,LU Zhihao,MA Zonghuan,LIANG Guoping,MA Lijuan,WAN Peng,MAO Juan.Genome-wide identification and expression analysis of the PP2C gene family in Vitis vinifera[J].Acta Horticulturae Sinica,2018,45(7):1237-1250.
[10]ZHANG B H,CHEN N Z,PENG X J,SHEN S H.Identification of the PP2C gene family in paper mulberry(Broussonetia papyrifera) and its roles in the regulation mechanism of the response to cold stress[J].Biotechnology Letters,2021,43(5):1089-1102.
[11]XIANG Y L,SUN X P,GAO S,QIN F,DAI M Q.Deletion of an endoplasmic reticulum stress response element in a ZmPP2CA gene facilitates drought tolerance of maize seedlings[J].Molecular Plant,2017,10(3):456-469.
[12]陈耘蕊,毛志君,李兆伟,范凯.植物蛋白磷酸酶2C 结构和功能的研究现状与进展[J].浙江大学学报(农业与生命科学版),2021,47(1):11-20.CHEN Yunrui,MAO Zhijun,LI Zhaowei,FAN Kai.Research status and progress in structure and function of protein phospha-tase 2C in plants[J].Journal of Zhejiang University (Agriculture&Life Sciences),2021,47(1):11-20.
[13]HU X B,ZHANG H J,LI G J,YANG Y X,ZHENG Z,SONG F M.Ectopic expression of a rice protein phosphatase 2C gene Os-BIPP2C2 in tobacco improves disease resistance[J].Plant Cell Reports,2009,28(6):985-995.
[14]郭文武,叶俊丽,邓秀新.新中国果树科学研究70 年:柑橘[J].果树学报,2019,36(10):1264-1272.GUO Wenwu,YE Junli,DENG Xiuxin.Fruit scientific research in New China in the past 70 years:Citrus[J].Journal of Fruit Science,2019,36(10):1264-1272.
[15]张庆华.枳两个基因PtrABF 和PtrCDPK 转化枳的抗逆功能及其作用机制解析[D].武汉:华中农业大学,2015.ZHANG Qinghua.Functional characterization of stress- response and elucidation of mechanism underling the enhanced stress tolerance of PtrABF and PtrCDPK in Poncirus trifoliata[D].Wuhan:Huazhong Agricultural University,2015.
[16]XUE T T,WANG D,ZHANG S Z,EHLTING J,NI F,JAKAB S,ZHENG C C,ZHONG Y.Genome-wide and expression analysis of protein phosphatase 2C in rice and Arabidopsis[J].BMC Genomics,2008,9(1):550-570.
[17]严佳文.柑橘内参基因筛选及转pthA 基因甜橙的表达分析[D].长沙:湖南农业大学,2010.YAN Jiawen.Selection of reference genes in citrus and expression of pthA gene in transgenic sweet orange[D].Changsha:Hunan Agricultural University,2010.
[18]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2- ΔΔCt method[J].Methods,2001,25(4):402-408.
[19]KHAN N,KE H,HU C M,NASERI E,HAIDER M S,AYAZ A,AMJAD K W,WANG J J,HOU X L.Genome-wide identification,evolution,and transcriptional profiling of PP2C gene family in Brassica rapa[J].BioMed Research International,2019(2019):2965035.
[20]YANG Q,LIU K,NIU X C,WANG Q,WAN Y Q,YANG F Y,LI G J,WANG Y F,WANG R G.Genome-wide identification of PP2C genes and their expression profiling in response to drought and cold stresses in Medicago truncatula[J].Scientific Reports,2018,8:12841.
[21]阮城城,胡福初,罗志文,王祥和,郭利军,李玉静,范鸿雁,韩冰,陈哲,张治礼.菠萝TCP 基因家族的鉴定及成花诱导阶段的表达谱分析[J].果树学报,2020,37(11):1623-1635.RUAN Chengcheng,HU Fuchu,LUO Zhiwen,WANG Xianghe,GUO Lijun,LI Yujing,FAN Hongyan,HAN Bing,CHEN Zhe,ZHANG Zhili.Genome-wide identification of pineapple TCP gene family and analysis of expression profile in flower induction stage[J].Journal of Fruit Science,2020,37(11):1623-1635.
[22]张春玲,周李杰,王桂栾,李媛媛,王小非,郝玉金.苹果蛋白磷酸酶基因MdPP2C-Like 的克隆及其对ABA 的响应分析[J].园艺学报,2018,45(7):1225-1236.ZHANG Chunling,ZHOU Lijie,WANG Guiluan,LI Yuanyuan,WANG Xiaofei,HAO Yujin.Molecular cloning of protein phosphatase gene MdPP2C-Like in apple and the response analysis of ABA[J].Acta Horticulturae Sinica,2018,45(7):1225-1236.
[23]HAIDER M S,KHAN N,PERVAIZ T,LIU Z J,NASIM M,JOGAIAH S,MUSHTAQ N,JIU S T,FANG J G.Genomewide identification,evolution,and molecular characterization of the PP2C gene family in woodland strawberry[J].Gene,2019,702:27-35.
[24]刘耀东,肖书雅,王安虎,刘宇,方阳,李小意,刘志斌,李旭峰,王健美,杨毅.苦荞蛋白磷酸酶2C 家族的鉴定及表达分析[J].四川大学学报(自然科学版),2021,58(4):163-171.LIU Yaodong,XIAO Shuya,WANG Anhu,LIU Yu,FANG Yang,LI Xiaoyi,LIU Zhibin,LI Xufeng,WANG Jianmei,YANG Yi.Genome-wide identification and expression analysis of protein phosphatase 2C family in Tartary buckwheat[J].Journal of Sichuan University (Natural Science Edition),2021,58(4):163-171.
[25]种康,王台,钱前,王小菁,左建儒,顾红雅,姜里文,陈之端,白永飞,杨淑华,孔宏智,陈凡,萧浪涛.2014 年中国植物科学若干领域重要研究进展[J].植物学报,2015,50(4):412-459.CHONG Kang,WANG Tai,QIAN Qian,WANG Xiaojing,ZUO Jianru,GU Hongya,JIANG Liwen,CHEN Zhiduan,BAI Yongfei,YANG Shuhua,KONG Hongzhi,CHEN Fan,XIAO Langtao.Research advances on plant science in China in 2014[J].Chinese Bulletin of Botany,2015,50(4):412-459.
[26]杜驰,张富春.植物蛋白磷酸酶2C 在非生物胁迫信号通路中的调控作用[J].生物技术通报,2014(8):16-22.DU Chi,ZHANG Fuchun.Protein phosphatases ⅡC in plants are involved in abiotic stress tolerance of several signaling pathways[J].Biotechnology Bulletin,2014(8):16-22.
[27]SCHWEIGHOFER A,HIRT H,MESKIENE I.Plant PP2C phosphatases:emerging functions in stress signaling[J].Trends in Plant Science,2004,9(5):236-243.
[28]BHASKARA G B,WEN T N,NGUYEN T T,VERSLUES P E.Protein phosphatase 2Cs and Microtubule-Associated Stress Protein 1 control microtubule stability,plant growth,and drought response[J].The Plant Cell,2017,29(1):169-191.
[29]SHAZADEE H,KHAN N,WANG J J,WANG C C,ZENG J G,HUANG Z Y,WANG X Y.Identification and expression profiling of protein phosphatases (PP2C) gene family in Gossypium hirsutum L.[J].International Journal of Molecular Sciences,2019,20:1395-1411.