芽变主要是芽分生组织细胞中的遗传物质发生改变,是自然界一种较为常见的现象,较多果树品种是基于芽变选育出来的[1]。其中,作为世界上最古老、最有经济价值的树种之一的葡萄(Vitis L.),一些优良栽培品种就源于芽变选育[2],如巨峰、玫瑰香、夏黑的一些芽变品种,已在生产中推广、种植[3]。随着高通量测序技术的快速发展,人们在对芽变品种进行利用的同时,深入研究了芽变的分子机制,以期了解芽变发生的规律。笔者在本文中将归纳引起葡萄芽变的原因及鉴定方法,分析芽变性状变异机制,为今后的葡萄芽变育种等工作提供参考。
1 体细胞突变
DNA序列的改变造成体细胞突变,从而引起原有植株发生变异,进而形成芽变[4]。目前通过体细胞突变形成的芽变品种较多(表1)。体细胞突变通常发生在顶端分生组织的一些细胞中,导致嵌合体的发生。在葡萄中,顶端分生组织主要由两个细胞层(L1、L2)组成。L1层主要调控表皮等其他外部组织,L2 层参与内部组织的调控[5]。组织发生层理论显示,突变时间不同导致不同嵌合体的形成。周缘嵌合体的形成主要是由于突变时间发生时间较早并且处于某个组织的中间位置;而扇形嵌合体的出现主要是由于突变较晚且不处于中间位置[6]。
表1 葡萄芽变类型及品种
Table 1 Types of grape bud mutant and varieties

与其他果树不同的是,葡萄芽变主要是在周缘嵌合体两层细胞层间存在遗传差异[8]。体细胞突变一般会对植株的单一性状造成改变,并不会引起整株植物的多个性状发生改变,它们只改变单层细胞,致使出现周缘嵌合现象,但这种现象并不会改变整个植株的多个性状,且在整个生长期间都比较稳定。此外,嵌合体中的细胞重新排列组合会引起整株植物基因型匀化[9]。
周缘嵌合体可能会导致同一个基因座上出现两个及两个以上的等位基因。Franks 等[10]使用PinotMeunier及其芽变材料对体细胞突变进行研究,将体细胞胚胎中的两层细胞分离开,不同细胞层具有特异的DNA 图谱,表明了不同细胞层间存在遗传差异。葡萄的嵌合机制不仅能修饰基因型,还能影响葡萄的改良。Hocquigny 等[8]研究发现,黑比诺(Pinot)无性繁殖体产生遗传多样性的主要原因是第三个等位基因出现在本应有两个杂合位点的位置。对霞多丽芽变研究发现其表型变异不是由两个不同的细胞层L1 和L2 之间相互作用引起的[11];通过SNV基因分型法证明Nebbiolo 芽变的基因型不同于母本,芽变的基因型主要是由于L1 层的改变[12](图1)。体细胞突变作为芽变产生的最主要原因,其L1层及L2层变异引起芽变的机制仍需深入研究。
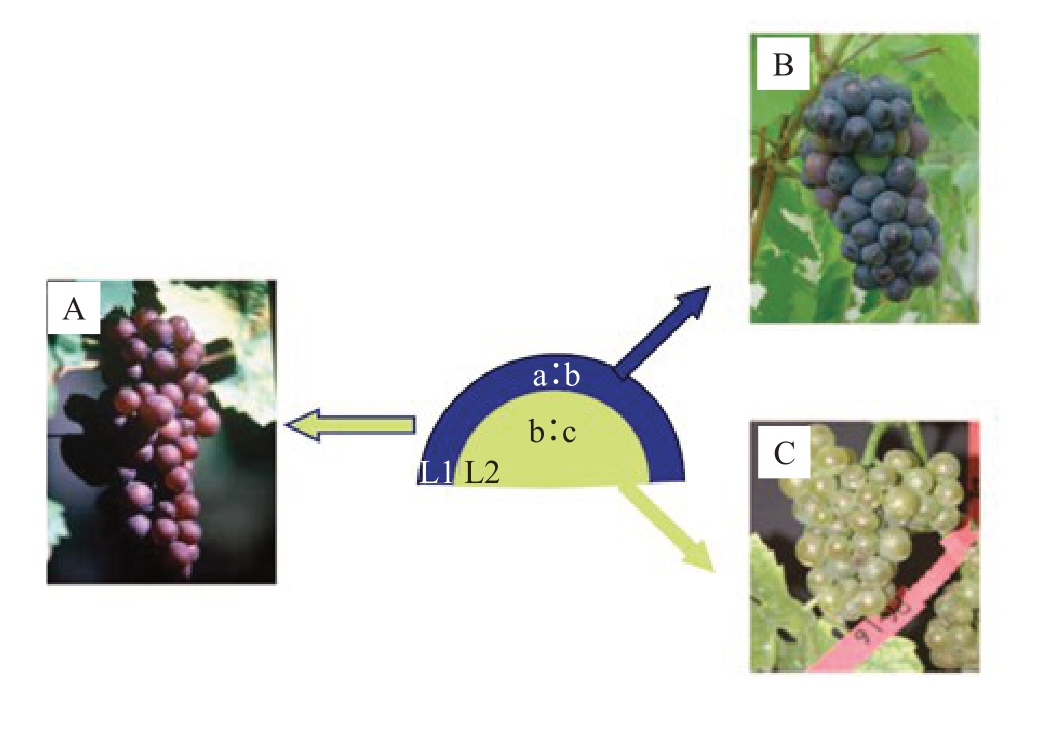
图1 L1、L2 层细胞突变改变表型[12]
Fig.1 Mutations in L1 and L2 cells resulted in the variations of phenotype
2 葡萄芽变的鉴定
2.1 形态学鉴定
芽变的遗传类别改变主要由染色体结构变异、基因突变、核外突变和染色体数目引起。芽变后葡萄植株多种性状都会发生变异,如成熟期变异、果型变异、果实及颜色变异、果实无核变异。但通过比对亲本及芽变的萌芽期、新梢颜色、叶片大小、果实颜色、果实成熟期、新梢节腹侧间颜色等性状可对芽变进行迅速辨别[13]。在目前发现的芽变品种中,变异的性状可以分为成熟期变异、果型变异、果实及颜色变异、无核变异等。
形态学性状的完善为芽变鉴定提供了可靠的依据,但表型的改变往往是基因与环境共同作用的结果。形态特征的改变易受外界条件的影响,会使鉴定结果出现偏差。
2.2 孢粉学鉴定
植物花粉是由花器官发育而成的,具有高度的保守性和稳定性[14]。因此可以通过花粉形态、大小、花粉粒极轴长/赤道轴长等对花粉进行鉴定。目前,在孢粉学的研究中主要突出孢粉的形态类型、孢粉的大小、孢粉的外壁纹饰,以及孢粉壁的内部结构。李学强等[15]对巨峰及其芽变98-2的孢粉进行分析,发现其主要差异在花粉大小、形态及花粉粒极轴长/赤道轴长。但传统的孢粉学鉴定仅通过花粉粒的形态特征而不关注花粉的内部结构特征,导致鉴定结果不够全面。
2.3 同工酶鉴定
同工酶是高等植物中普遍存在的蛋白质分子,具有不同的结构和相同的催化作用。其基于不同蛋白质形成不同的蛋白质区带谱进行鉴定[16]。目前常用于同工酶鉴定的酶类主要有过氧化氢酶、酯酶以及过氧化物酶。李学强等[15]使用POD 同工酶对巨峰及其芽变98-2分析发现酶谱存在差异,表明巨峰及其芽变98-2 间存在差异。由于每种同工酶代表基因数量有限,并不能全面反映遗传差异,故可作为辅助鉴定方法。
2.4 分子标记鉴定
分子标记(molecular marker)主要应用于植物性状及基因型变异的检测。芽变产生的本质主要是遗传物质的变化,因此可以利用染色体和DNA分子水平的方式,来避免形态学、孢粉学和同工酶鉴定等方法的缺点,达到鉴定芽变的目的。DNA分子标记是通过一定的方法或技术手段,在DNA分子水平上揭示个体或群体间DNA片段差异的一种遗传标记,在对芽变品种的鉴定中,已开发出多种DNA分子标记并应用于鉴定中[17-22](表2)。
表2 葡萄芽变鉴定品种及应用
Table 2 Variety and application of grape bud mutant identification

王西平等[23]对早熟芽变品种早生高墨及其亲本高墨进行鉴定,发现引物OPG06 及OPW02 能有效区分开高墨及早生高墨,张国海[24]应用RAPD 分子标记能有效鉴定出巨峰和京亚的芽变品种。然而在使用RAPD 分子标记技术对芽变品种进行鉴定时,由于大部分引物标记为显性标记,并不适用于对多数芽变品种进行鉴定。
石艳艳[25]利用iPBS(Inter-Primer Binding Site)技术分别对峰早和巨峰、洛浦早生和京亚进行区分鉴定,峰早和巨峰之间有12 个iPBS 引物均表现出不同的差异条带,洛浦早生和京亚之间有9 个iPBS引物表现出不同程度的差异性。李琳[26]从50 条ISSR(Inter-Simple Sequence Repeat)引物筛选出29条ISSR 引物及7 对引物组合,同时使用引物BC825能区分巨峰及其芽变品种峰早。Guo 等[27]利用SRAP(Sequence Related Amplified Polymorphism)分子标记方法对鲜食品种中的3个芽变品种进行鉴定。DNA分子标记是区分芽变的一个重要手段,但是目前仍然没有筛选出一些特定引物用来区分芽变品种。
3 葡萄芽变性状变异机制
3.1 果实颜色变异
果实颜色变异主要与花色苷和花青素的积累有关,同时果实颜色的变化也有助于人们对品种的区分。自从葡萄驯化以来,人们就用果实颜色的不同来区分品种。葡萄果实的颜色是由花色苷在果皮和果肉中的积累引起的。而花色苷是由苯丙烷合成途径和类黄酮生物合成途径完成的[28]。Carrier等[29]通过对黑比诺及其3个克隆体的全基因组序列比较发现,平均每Mb 分别有1.6 个和5.1 个SNP 缺失。Vezzulli 等[30]对黑比诺的5 个核心SNP 位点进行测序分析,结果表明这5 个SNP 区域具有一种特异性的遗传结构,在黑比诺、灰比诺、白比诺中总有一个等位基因的表达量偏低。
Kobayashi 等[31]对白皮及红皮葡萄研究发现,UFGT基因调控白皮和红皮葡萄果实中花青素的合成,红皮葡萄中的UFGT 基因表达量高于白皮葡萄果实,但其编码序列和启动子无任何差别,表明葡萄果皮由白变红主要是调控UFGT基因的上下游基因突变引起的。同时结果表明VvmybA1 作为主要的调控基因,在类黄酮糖基转移酶UFGT 基因的表达中起着重要作用,并影响花青素的合成。研究表明白色葡萄品种的出现主要是由于反转录转座子Gret1插入到VvmybA1基因的启动子区域中;而红色突变主要是由于反转录转座子Gret1 未插入到VvmybA1 基因中。反转录转座子Gret1 是否插入到VvmybA1 基因是调控果皮颜色的关键,其主要是通过抑制花青素生物合成基因的表达,从而产生葡萄果色芽变[32-35]。
在人们开始关注葡萄颜色变异时,主要研究变异中花青素含量的变化,目前更多的学者开始关注基因是如何参与到花青素的生物合成中,并对调控通路、遗传机制及分子机制进行深入研究。
3.2 葡萄花序和果穗变异
葡萄果穗主要由葡萄果粒组成,花序及果实的大小、坐果率的高低影响果穗的形状和大小。在种植和生产上,酿酒葡萄的果穗小且紧凑,鲜食葡萄的果穗大且稀疏。这主要是由于在葡萄的驯化和筛选过程中,基因的表达模式及表达量不同从而导致葡萄花序及果穗变异的产生。
在对果穗变异及其亲本研究中发现,赤霉素的负调节基因VvGAI1 参与调控果穗的大小,同时对VvGAI1 基因进行序列多态性分析时发现单个基因对葡萄穗质量、出汁率、风味等性状影响较小[36]。Hall 等[37]等研究发现,花序轴韧皮部的坏死导致浆果中水分和糖分不再积累,但花序轴韧皮部的坏死并不影响种子在果实中的发育。Chatelet 等[38]通过对体细胞突变进行诱导,得到了4 种不同于亲本的花序表型,发现体细胞突变导致拟南芥成花基因AG、SEP 和AGL13的同源因子VvMADS-box1、2 和3在花发育过程中表达模式发生了转化,而VvMADSbox基因的表达模式与相应的亲本相似。
葡萄花序发育早期出现的表型变化主要跟葡萄重复分生组织(RRM)相关,变异品种花序发育期延长,导致开花延迟,从而影响果穗的发育和果实的成熟。佳丽酿(Carignan)RRM 表现型的出现主要与VvTFL1A 基因表达量的增高密切相关,归其原因主要是VvTFL1A 基因中的一个二级转座子插入[39]。Fernandez 等[40]通过转录组学及分子生物学的方法研究发现,将二级转座子Hatvine1-rrm 插入到VvTFL1A基因的启动子,可以上调茎尖营养及生殖器官的VvTFL1A等位基因的表达。
3.3 成熟期变异
果实成熟是一个复杂的过程,涉及到许多高度协调的生理和生化变化,进而影响果实的外观。果实成熟包括果皮颜色的一系列变化,可溶性糖的积累、酸的减少、香气化合物的增加[41]。果实糖、酸的变化主要是一些调控基因的表达所引起的。目前对与成熟期相关的芽变品种和原有品种差异表达进行分析,结果表明大多数差异基因与果实生长发育的生物合成途径有关。植物信号转导途径在果实成熟过程中有着至关重要的作用。特别是ETH 和ABA在调节果实发育中起到决定性作用[42]。植物激素ETH和ABA促进果实的成熟,而IAA抑制果实的成熟和着色[43]。
巨峰的芽变品种峰早较巨峰提前成熟30 d,郭大龙等[2]根据E-L 系统对巨峰及峰早浆果不同发育时期的生理指标进行测定,研究表明峰早中的花色素含量及果实软化相关的半乳糖醛酸酶活性增长速率均明显高于巨峰并参与到果实成熟过程中;同时,Xi等[44]研究巨峰及峰早成熟过程中代谢相关酶和活性氧(ROS)的变化,结果表明峰早果实中的活性氧水平总高于巨峰,活性氧参与并促进果实的成熟。石艳艳[25]通过MSAP 分子标记技术,对甲基化率进行分析,结果表明芽变的甲基化率低于亲本,果实提早成熟主要是某些基因发生了脱甲基化。Guo等[45]对巨峰及峰早果实不同发育时期进行转录组测序,发现有3 个基因表达量差异较为显著,其中与活性氧相关基因VIT_214s0030g00950的表达量主要在巨峰中表达较高,但在始熟期时低于峰早。Xu等[46]在对夏黑及其早熟芽变分析中发现夏黑中SNP 位点突变主要集中在其18号染色体,在其芽变中SNP位点突变主要集中在其17号染色体。
3.4 果型变异
果树中花授粉受精后果实开始生长,这是一种较为特别的特化结构[47]。果实的生长发育过程可分为两个阶段,即细胞分裂期与细胞膨大期。在果实发育阶段,成熟后果实的形状与大小主要根据细胞的数目与大小所决定。目前在对葡萄的研究中,果型主要依靠杂交后代与实生后代进行选育并研究,但一些葡萄品种中果型发生了变异。
利用无核白芽变选育出了长粒无核白、大粒无核白等芽变品种,通过对无核白及其芽变对比分析发现芽变品种中白藜芦醇含量较高,而总酚含量较低。瘦肉果突变(flb)最早于1996 年在白玉霓(Ungi Blanc)中发现,后来被鉴定为遗传性嵌合体,在对葡萄果实发育及大小研究中,为一种优良的实验材料。其主要是由于亲本植株在花期前子房开始皱缩,发育出特殊的中果皮,致使产生的后代坐果异常,产生瘦肉果突变[48]。
瘦肉果突变为果肉形态的分子调控机制提供了有利的基因型。通过亲本与瘦肉果突变体果实成熟期对比发现,与亲本相比,瘦肉果突变中液泡较多,细胞特异性受损导致中果皮发育不全[49]。同时在瘦肉果突变及亲本的基因组中发现,转录因子VvMADS9 表达量较高,而在亲本中并不表达,因此浆果形态的变异可能与转录因子VvMADS9的表达相关[50]。
3.5 无核变异
无核是鲜食葡萄最有价值的品质特征之一,世界上对无核葡萄品种的需求也不断增长。目前已有一些品种发生了从有核到无核的突变[51],如Emperor、Go Haskells No.45、Chasselas、Concord、Catawba、Mustat、Hamburg、Tokay、Red Muscadel 和Liatiko等[52]。无核突变体与亲本相比果实质量下降,对亲本及无核芽变测序发现一些差异基因主要富集在花粉和胚珠发育途径[53],在基因组上存在一些SNP 位点的变异及Indel[54]。在对差异基因分析时发现,B3转录因子基因家族在生长和发育中发挥着特定的作用,一些基因在无核突变体及其亲本中差异表达[55]。同时在VvAGL11 基因区域鉴定出多个SNP位点变异,对VvAGL11进行验证发现在种子发育关键时期,无核突变体中VvAGL11 基因未表达,表明VvAGL11基因为无核主要的候选基因[56]。
3.6 植株结构变异
在极少数情况下,芽变可以改变植株的表型结构。Pinot Meunier 是黑比诺的芽变品种,其特点是叶子和茎上密布着毛状体,卷须转变为花序[57]。有时在Pinot Meunier 上会出现缺乏毛状表型的叶扇区,这表明它是具有突变体L1的周缘嵌合体。事实上,从L1或L2层再生的植株表明L1衍生的植株是有毛的,而L2衍生的植株是无毛的[10]。同时发现L1层的变异植株节间较短,具有矮化作用。利用赤霉素(GA)对矮化植株进行处理发现其并不是赤霉素(GA)生物合成突变体。该突变是由VvGAI高度保守的DELLA 域中的非同义SNP 引起的,该域编码GA关键响应蛋白的成员[58]。
3.7 倍性变异
葡萄二倍体自然突变为多倍体途径主要有体细胞融合、体细胞加倍和配子加倍三种[59]。目前突变为三倍体的较少,主要的突变类型为二倍体突变为四倍体。选择四倍体的优良芽变是改良葡萄品种的重要途径之一。异常的环境更易诱导突变,自然突变是自然发生的,不受人为控制。通过自然芽变筛选培育葡萄多倍体新品种,速度缓慢,随机性大[60]。
4 展 望
芽变选育因简便、实用性等优势特点,一直是果树品种选育的重要途径。芽变品种在提供新的表型的同时,还保留了原有亲本的理想性状,这也是很多栽培品种源自于芽变的原因。目前果树上存在很多的芽变品种,而葡萄通过芽变选育的品种多达50个。但是目前依然通过形态学及多种DNA 分子标记法对芽变进行鉴定。是否有一些特定的引物对芽变品种进行区分鉴定,目前尚未可知。随着高通量测序的发展,相信这一问题可以得到很好地解决。目前存在着多种多样的芽变品种,不同的基因参与到不同的调控中。通过对葡萄芽变及其亲本的研究,已经发现一些基因在芽变表型的调控中起着关键作用,如ERF相关基因可能引起夏黑早熟芽变的成熟期提前、VvAGL11 基因为葡萄无核突变体关键候选基因。但这些基因在芽变中的作用机制仍不明确。
未来随着技术的发展,对芽变的机制研究方向主要是:(1)如何区分芽变及其亲本;(2)对芽变及其亲本甲基化、单核苷酸多态性(SNP)、结构变异位点(SV)等的研究;(3)具体性状的芽变机制;(4)如何将研究结果运用到育种上,定向培育出优良的芽变品种。
[1] 伊华林,邓秀新.培养三倍体柑橘植株的研究[J].遗传,1998,20(S1):3-5.YI Hualin,DENG Xiuxin.Study on culturing citrus triploid plantlets with somatic hybrid as male parent[J].Hereditas,1998,20(S1):3-5.
[2] 郭大龙,郭明晓,张国海.葡萄早熟芽变与其亲本果实发育特征比较分析[J].植物生理学报,2014,50(11):1733-1741.GUO Dalong,GUO Mingxiao,ZHANG Guohai.Comparisons of berry development characteristics between the early ripening bud mutants of grape and their parents[J].Plant Physiology Journal,2014,50(11):1733-1741.
[3] 吴潇,齐开杰,殷豪,张绍铃.诱变技术在落叶果树育种中的应用[J].园艺学报,2016,43(9):1633-1652.WU Xiao,QI Kaijie,YIN Hao,ZHANG Shaoling.Applying of the induced mutant techniques in the breeding of deciduous fruit tree varieties[J].Acta Horticulturae Sinica,2016,43(9):1633-1652.
[4] 杜晓云,宋来庆,赵玲玲,刘美英,唐岩,孙燕霞,姜中武,束怀瑞.红富士苹果芽变系DNA 甲基化研究[J].园艺学报,2019,46(1):107-120.DU Xiaoyun,SONG Laiqing,ZHAO Lingling,LIU Meiying,TANG Yan,SUN Yanxia,JIANG Zhongwu,SHU Huairui.DNA methylation in red Fuji apple bud sports lines[J].Acta Horticulturae Sinica,2019,46(1):107-120.
[5] THOMPSON M M,OLMO H P.Cytohistological studies of cytochimeric and tetraploid grapes[J].American Journal of Botany,1963,50:901-906.
[6] STENKAMP S,BECKER M S,HILL B,BLAICH R,FORNECK A.Clonal variation and stability assay of chimeric pinot meunier (Vitis vinifera L.) and descending sports[J].Euphytica,2009,165(1),197.
[7] THOMPSON M M,OLMO H P.Cytohistological studies of cytochimeric and tetraploid grapes[J].American Journal of Botany,1963,50:901-906.
[8] HOCQUIGNY S,PELSY F,DUMAS V,KINDT S,HELOIR M-C,MERDINOGLU D.Diversification within grapevine cultivars goes through chimeric states[J].Genome,2004,47(3):579-589.
[9] PELSY F.Molecular and cellular mechanisms of diversity within grapevine varieties[J].Heredity,2010,104(4):331-340.
[10] FRANKS T,BOTTA R,THOMAS M R,FRANKS J.Chimerism in grapevines:Implications for cultivar identity,ancestry and genetic improvement[J].Theoretical &Applied Genetics,2002,104(2/3):192-199.
[11] BERTSCH C,KIEFFER F,MAILLOT P,FARINE S,BUTTERLIN G,MERDINOGLU D,WALTER B.Genetic chimerism of Vitis vinifera cv.Chardonnay 96 is maintained through organogenesis but not somatic embryogenesis[J].BMC Plant Biology,2005,5:20.
[12] GAMBINO G,MOINE A,BOCCACCI P,PERRONE I,PAGLIARANI C.Somatic embryogenesis is an effective strategy for dissecting chimerism phenomena in Vitis vinifera cv.Nebbiolo[J].Plant Cell Reports,2021,40(1):205-211.
[13] 刘崇怀,冯建灿,姜建福.中国葡萄属植物形态学聚类分组研究[J].植物遗传资源学报,2011,12(6):847-852.LIU Chonghuai,FENG Jiancan,JIANG Jianfu.Cluster analysis of chinese wild grape species based on morphological characters[J].Journal of Plant Genetic Resources,2011,12(6):847-852.
[14] 王晨宇.基于形态、孢粉学和SSR 标记的玉兰亚属分类研究[D].北京:北京林业大学,2018.WANG Chenyu.The studies on taxonomy of subgenus yulania based on morphology,palyology and SSR markers [D] .Beijing:Beijing Forestry University,2018.
[15] 李学强,李秀珍,张国海.巨峰葡萄早熟性芽变98-2的孢粉学及同工酶研究[J].果树学报,2008,25(6):937-940.LI Xueqiang,LI Xiuzhen,ZHANG Guohai.Study on the palynology and isoenzyme of grape cultivar Kyoho’s early maturing sport 98-2[J].Journal of Fruit Science,2008,25(6):937-940.
[16] 张玉刚,郭绍霞.葡萄种质资源鉴定方法研究进展[J].江西农业学报,2005,17(1):70-74.ZHANG Yugang,GUO Shaoxia.Research advances in method of identification for gemplasm of grapes(Vitis L.)[J].Acta Agriculturae Jiangxi,2005,17(1):70-74.
[17] 闫鹏,骆强伟,廖康,孙锋.无核白葡萄芽变系的植物学性状特征及RAPD 标记研究[J].新疆农业科学,2010,47(1):110-114.YAN Peng,LUO Qiangwei,LIAO Kang,SUN Feng.Research on botanical characteristers and RAPD marker of thomson seedless bud variation[J].Xinjiang Agricultural Sciences,2010,47(1):110-114.
[18] WEI L,CAO Y,CHENG J,XIANG J,SHEN B,WU J.Comparative transcriptome analyses of a table grape‘Summer black’and its early-ripening mutant‘Tiangong moyu’identify candidate genes potentially involved in berry development and ripening[J].Journal of Plant Interactions,2020,15(1):213-222.
[19] 竺啸恒.葡萄芽变‘11-06-25’的遗传鉴定和农艺性状比较[D].杭州:浙江大学,2018.ZHU Xiaoheng.Genetic identification and agronomic traits comparison of grape bud sport strain‘11-06-25’[D].Hangzhou:Zhejiang University,2018.
[20] 江楠.葡萄黑色芽变品种巴西(Brazil)果皮颜色突变的分子机制初探[D].南京:南京农业大学,2013.JIANG Nan.Study of color mutant of grape berry skin in black-‘Brazil’and its molecular mechanism[D].Nanjing:Nanjing Agricultural University,2013.
[21] 赵明,何海旺,武鹏,龙芳,邹瑜,李贤高,潘永杰,林志诚,林茜,潘曦.两性花毛葡萄野酿2 号芽变株系Y137的鉴定及评价[J].南方农业学报,2018,49(9):1691-1697.ZHAO Ming,HE Haiwang,WU Peng,LONG Fang,ZOU Yu,LI Xiangao,PAN Yongjie,LIN Zhicheng,LIN Qian,PAN Xi.Identification and evaluation of Y137,a bud mutant strain of hermaphrodite-flower Vitis quinquangularis Rehd.Yeniang No.2[J].Journal of Southern Agriculture,2018,49(9):1691-1697.
[22] 钱春.白香蕉葡萄芽变突变体鉴定及四倍体诱导研究[D].重庆:西南大学,2006.QIAN Chun.Studies on identifying and tetraploid inducing in bud mutant of‘White banana’grape[D].Chongqing:Southwest University,2006.
[23] 王西平,王跃进,张剑侠,徐炎,杨克强.葡萄早熟芽变品种‘早生高墨’的RAPD 分析[J].西北植物学报,2003,23(3):473-476.WANG Xiping,WANG Yuejin,ZHANG Jianxia,XU Yan,YANG Keqiang.Randomly amplified polymorphic DNA(RAPD) analysis of Vitis early-ripening mutant cultivar‘Early Takasumi’[J].Acta Botanica Boreali-Occidentalia Sinica,2003,23(3):473-476.
[24] 张国海.两个早熟葡萄芽变品种生物学特性研究与分子鉴定[D].武汉:华中农业大学,2010.ZHANG Guohai.Studies on the biologicale haracteristies and moledular identification of two early-ripening bud mutant grape varieties[D].Wuhan:Huazhong Agricultural University,2010.
[25] 石艳艳.葡萄早熟芽变及其亲本基因组差异分析[D].洛阳:河南科技大学,2015.SHI Yanyan.The comparing analysis of the genomic difference of grape early bud mutant and its parents [D].Luoyang:Henan University of Science and Technology,2015.
[26] 李琳.巨峰葡萄芽变株系的鉴定及分子标记分析[D].金华:浙江师范大学,2013.LI Lin.Identifying and molecular marker analysis in bud mutant of‘Kyoho’grape[D].Jinhua:Zhejiang Normal University,2013.
[27] GUO D L,ZHANG J Y,LIU C H,ZHANG G H,LI M,ZHANG Q.Genetic variability and relationships between and within grape cultivated varieties and wild species based on SRAP markers[J].Tree Genetics &Genomes,2012,8(4):789-800.
[28] WINKEL-SHIRLEY B.Flavonoid biosynthesis:A colorful model for genetics,biochemistry,cell biology,and biotechnology[J].Plant Physiology,2001,126(2):485-493.
[29] CARRIER G,LE CUNFF L,DEREEPER A,LEGRAND D,SABOT F,BOUCHEZ O,AUDEGUIN L,BOURSIQUOT J M,THIS P.Transposable elements are a major cause of somatic polymorphism in Vitis vinifera L.[J].PLoS One,2012,7(3):e32973.
[30] VEZZULLI S,LEONARDELLI L,MALOSSINI U,STEFANINI M,VELASCO R,MOSER C.Pinot blanc and Pinot gris arose as independent somatic mutants of Pinot noir[J].Journal of Experimental Botany,2012,63(18):6359-6369.
[31] KOBAYASHI S,YAMAMOTO N G,HIROCHIKA H.Association of VvmybA1 gene expression with anthocyanin production in grape(Vitis vinifera)skin-color mutants[J].Journal of the Japanese Society for Horticultural Science,2005,74(3):196-203.
[32] KOBAYASHI S,GOTO-YAMAMOTO N,HIROCHIKA H.Retrotransposon-induced mutants in grape skin color[J].Science,2004,304(5673):982.
[33] LIJAVETZKY D,RUIZ-GARCÍA L,CABEZAS J A,DE ANDRÉS M T,BRAVO G,IBÁÑEZ A,CARREÑO J,CABELLO F,IBÁÑEZ J,MARTÍNEZ-ZAPATER J M.Molecular genetics of berry colour variation in table grape[J].Molecular Genetics&Genomics,2006,276(5):427-435.
[34] WALKER A R,LEE E,BOGS J,MCDAVID D A,THOMAS M R,ROBINSON S P.White grapes arose through the mutant of two similar and adjacent regulatory genes[J].Plant Journal,2007,49(5):772-785.
[35] WALKER A R,LEE E,ROBINSON S P.Two new grape cultivars,bud sports of Cabernet Sauvignon bearing pale-coloured berries,are the result of deletion of two regulatory genes of the berry colour locus[J].Plant Molecular Biology,2006,62(4/5):623-635.
[36] VARGAS A M,CUNFF L,THIS P,J IBÁEZ,ANDRÉS M T.VvGAI1 polymorphisms associate with variation for berry traits in grapevine[J].Euphytica,2013,191(1):85-98.
[37] HALL G E,BONDADA B R,KELLER M.Loss of rachis cell viability is associated with ripening disorders in grapes[J].Journal of Experimental Botany,2011,62(3):1145-1153.
[38] CHATELET P,LAUCOU V,FERNANDEZ L,SREEKANTAN L,LACOMBE T,MARTINEZ-ZAPATER J M,THOMAS M R,TORREGROSA L.Characterization of Vitis vinifera L.somatic variants exhibiting abnormal flower development patterns [J].Journal of Experimental Botany,2007,58(15/16):4107-4118.
[39] FERNANDEZ L,TORREGROSA L,SEGURA V,BOUQUET A,MARTINEZ-ZAPATER J M.Transposon-induced gene activation as a mechanism generating cluster shape somatic variation in grapevine[J].Plant Journal,2010,61(4):545-557.
[40] FERNANDEZ L,CHAÏB J,MARTINEZ-ZAPATER J M,THOMAS M R,TORREGROSA L.Mis-expression of a PISTILLATA-like MADS box gene prevents fruit development in grapevine[J].Plant Journal,2013,73(6):918-928.
[41] 吕英民,张大鹏.果实发育过程中糖的积累[J].植物生理学通讯.2000,36(3):258-265.LÜ Yingmin,ZHANG Dapeng.Accumulation of sugars in developing fruits[J].Plant Physiology Communications,2000,36(3):258-265.
[42] DAVIES C,BOSS P K,ROBINSON S P.Treatment of grape berries,a nonclimacteric fruit with a synthetic auxin,retards ripening and alters the expression of developmentally regulated genes[J].Plant Physiology,1997,115(3):1155-1161.
[43] SYMONS G M,DAVIES C,SHAVRUKOV Y,DRY I B,REID J B,THOMAS M R.Grapes on steroids:Brassinosteroids are involved in grape berry ripening[J].Plant Physiology,2006,140(1):150-158.
[44] XI F F,GUO L L,YU Y H,WANG Y,LI Q,ZHAO H L,ZHANG G H,GUO D L.Comparison of reactive oxygen species metabolism during grape berry development between‘Kyoho’and its early ripening bud mutant‘Fengzao’[J].Plant Physiology Biochemistry,2017,118:634-642.
[45] GUO D L,XI F F,YU Y H,ZHANG X Y,ZHANG G H,ZHONG G Y.Comparative RNA-Seq profiling of berry development between table grape‘Kyoho’and its early-ripening mutant‘Fengzao’[J].BMC Genomics,2016,17(1):795.
[46] XU Y,GAO Z,TAO J,JIANG W,ZHANG S,WANG Q,QU S.Genome-wide detection of SNP and SV variations to reveal early ripening-related genes in grape[J].PLoS One,2016,11(2):e147749.
[47] HOUEL C,BOUNON R,CHAÏB J,GUICHARD C,PÉROS J P,BACILIERI R,DEREEPER A,CANAGUIER A,LACOMBE T,N'DIAYE A,LE PASLIER M C,VERNEREY M S,CORITON O,BRUNEL D,THIS P,TORREGROSA L,ADAM-BLONDON A F.Patterns of sequence polymorphism in the fleshless berry locus in cultivated and wild Vitis vinifera accessions[J].BMC Plant Biology,2010,10(1):284.
[48] FERNANDEZ L,DOLIGEZ A,LOPEZ G,THOMAS M R,BOUQUET A,TORREGROSA L.Somatic chimerism,genetic inheritance,and mapping of the fleshless berry (flb) mutant in grapevine(Vitis vinifera L.)[J].Genome,2006,49(7):721-728.
[49] FERNANDEZ L,ROMIEU C,MOING A,BOUQUET A,MAUCOURT M,THOMAS M R,TORREGROSA L.The grapevine fleshless berry mutant:A unique genotype to investigate differences between fleshy and nonfleshy fruit[J].Plant Physiology,2006,140(2):537-547.
[50] FERNANDEZ L,TORREGROSA L,TERRIER N,SREEKANTAN L,GRIMPLET J,DAVIES C,THOMAS M R,ROMIEU C,AGEORGES A.Identification of genes associated with flesh morphogenesis during grapevine fruit development[J].Plant Molecular Biology,2007,63(3):307-323.
[51] SABIR A.Xenia and metaxenia in grapes:differences in berry and seed characteristics of maternal grape cv.‘Narince’(Vitis vinifera L.) as influenced by different pollen sources[J].Plant Biology,2015,17(2):567-573.
[52] 崔梦杰,王晨,张文颖,汤崴,朱旭东,李晓鹏,房经贵.无核葡萄研究进展[J].植物生理学报,2017,53(3):317-330.CUI Mengjie,WANG Chen,ZHANG Wenying,TANG Wei,ZHU Xudong,LI Xiaopeng,FANG Jinggui.Research progress of seedless grape[J].Plant Physiology Journal,2017,53(3):317-330.
[53] NWAFOR C C,GRIBAUDO I,SCHNEIDER A,WEHRENS R,GRANDO M S,COSTANTINI L.Transcriptome analysis during berry development provides insights into co-regulated and altered gene expression between a seeded wine grape variety and its seedless somatic variant[J].BMC Genomics,2014,15(1):1030.
[54] MEJÍA N,SOTO B,GUERRERO M,CASANUEVA X,HOUEL C,MICCONO MDE L,RAMOS R,LE CUNFF L,BOURSIQUOT J M,HINRICHSEN P,ADAM-BLONDON A F.Molecular,genetic and transcriptional evidence for a role of VvAGL11 in stenospermocarpic seedlessness in grapevine[J].BMC Plant Biology,2011,11(1):57.
[55] AHMAD B,ZHANG S,YAO J,RAHMAN M U,HANIF M,ZHU Y,WANG X.Genomic organization of the B3-Domain transcription factor family in grapevine(Vitis vinifera L.)and expression during seed development in seedless and seeded cultivars[J].International Journal of Molecular Sciences,2019,20(18):4553.
[56] COSTANTINI L,MORENO-SANZ P,NWAFOR C C,LORENZI S,MARRANO A,CRISTOFOLINI F,GOTTARDINI E,RAIMONDI S,RUFFA P,GRIBAUDO I,SCHNEIDER A,GRANDO M S.Somatic variants for seed and fruit set in grapevine[J].BMC Plant Biology,2021,21(1):135.
[57] SKENE K G M,BARLASS M.Studies on the fragmented shoot apex of Grapevine:IV.Separation of phenotypes in a periclinal chimera in vitro[J].Journal of Experimental Botany,1983,34(10):1271-1280.
[58] BOSS P K,THOMAS M R.Association of dwarfism and floral induction with a grape‘green revolution’mutation[J].Nature,2002,416(6883):847-850.
[59] 解谜.山葡萄多倍体育种技术研究[D].长春:吉林农业大学,2008.XIE Mi.The Study on polyploid breeding technology of Vitis amurensis[D].Changchun:Jilin Agricultural University,2008.
[60] 温晓敏,张娜,月丫,田淑芬.葡萄多倍体育种成果及影响因素概述[J].中外葡萄与葡萄酒,2017(4):95-99.WEN Xiaomin,ZHANG Na,YUE Ya,TIAN Shufen.Summary of the achievements and influencing factors of grape multiplicity[J].Sino-Overseas Grapevine&Wine,2017(4):95-99.