红树莓(Rubus idaeus L.)是蔷薇科(Rosaceae)悬钩子属的小浆果类果树[1],其果实柔嫩多汁,甜而芳香,富含多种维生素和矿质元素,氨基酸、铁、钾、磷含量均高于苹果、葡萄等传统水果[2],是第三代水果的代表树种之一,被称为“生命之果”[3]。果实除鲜食外,还适于加工果酱、果酒、果汁饮料。此外,红树莓的果实、茎、根皆可入药,具有很高的药用价值。华北地区为红树莓适宜栽培区[4]。京津冀地区双季型红树莓花期约在6月,果实初熟期在7月,果实采收期长,直至霜降。而波尔卡在河南黄河沿岸地区采果期可到11月底[3],在该区域以北,则因秋季气温降低,叶片受冻而导致果实不能正常发育,严重影响红树莓果实的产量。因此,亟须通过喷施外源物质等措施缓解初冬低温冷害对树体发育的影响,尤其对延长冷棚红树莓栽培采收期具有重要意义。使用外源物质提高植物的抗逆性,是一种可以有效缓解植物逆境胁迫的方法[5]。褪黑素(melatonin,MT)是一类重要的吲哚类激素物质,广泛存在于动植物体内并作为内源性自由基清除剂,具有极强的直接或间接的抗氧化作用[6]。近年来,随着对褪黑素不断深入研究,发现其不仅能促进植物生长发育[7],还可以调节植物体内代谢过程从而提高植物抗逆性,有效缓解植物受到的多种胁迫,如低温胁迫[8]、高温胁迫[9]、干旱胁迫[10]、盐碱胁迫[11]等逆境损伤[12]。针对低温胁迫,也有部分研究表明褪黑素可通过调节一些植物的代谢反应、光合反应,来增强抗氧化防御能力,如辣椒、黑麦草、拟南芥[13-15],从而提高作物耐冷性。但针对褪黑素调控红树莓耐冷性的相关研究鲜有报道。
因此,笔者在初冬开始降温时,设置不同浓度褪黑素对盆栽红树莓进行叶面喷施,研究外源褪黑素在低温胁迫下对红树莓生理特性的影响,以期为合理利用外源褪黑素缓解红树莓抵御低温伤害提供科学依据。
1 材料和方法
1.1 材料
以2年生盆栽苗双季型红树莓品种波尔卡为试材。
1.2 试验地点
试验地位于河北省保定市河北农业大学校内苗圃,地理坐标为东经115°26′36.28″、北纬38°49′18.62″,海拔17.2 m。
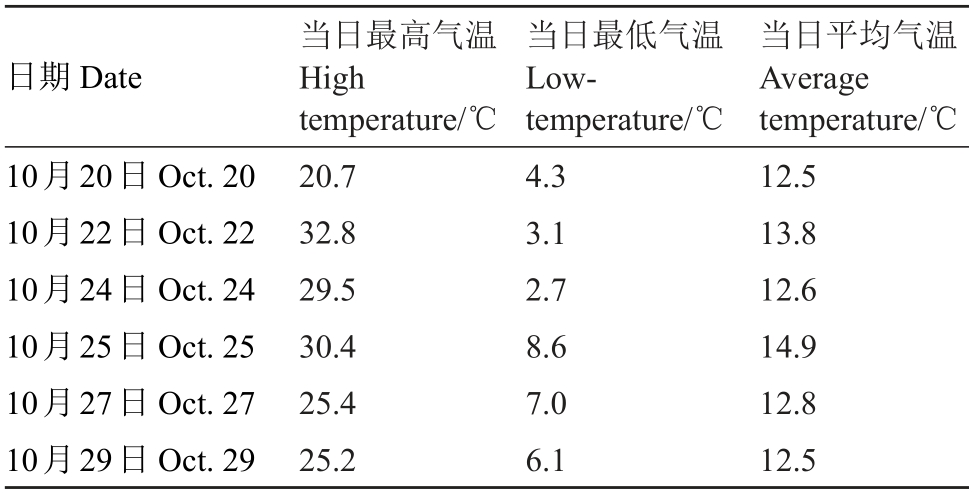
试验期间温度记录如表1所示。
表1 试验期间温度情况
Table 1 Temperature condition during the test
1.3 试验设计
选取长势一致的2 年生红树莓波尔卡盆栽苗,花盆上口径44 cm、下口径25 cm、高30 cm。在处理前进行常规管理,保证其生长良好。于2020年10月20日进行褪黑素喷施处理,以喷施等量蒸馏水为对照(CK),分别进行50、100、150、200 μmol∙L-1浓度的褪黑素喷叶处理,每个处理设3次重复。在傍晚17:30充分喷施相应浓度褪黑素于每个叶片正反面,以叶面滴液为准。每隔1 d处理1次,共处理3次。最后一次叶面喷施褪黑素后的1、3、5 d取相同部位、长势一致的叶片测定相关指标。
1.3.1 样品采集 采集中上部功能性叶片,用冰盒带回实验室用于生理指标的测定;每个处理3株,3次重复。
1.3.2 测定指标和方法(1)细胞膜透性测定方法。叶片相对电导率用电导仪测定,叶片丙二醛含量采用硫代巴比妥酸法测定[16]。
(2)叶绿素测定方法。叶片叶绿素含量采用乙醇浸提法测定[15]。
(3)渗透调节物质测定方法。叶片可溶性蛋白质含量采用考马斯亮蓝G-250 染色法测定[16],可溶性糖和淀粉的含量采用蒽酮比色法测定[16]。
(4)抗氧化酶活性测定方法。过氧化物酶(POD)活性采用愈创木酚法测定[17],过氧化氢酶(CAT)活性采用过氧化氢法测定[18],超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光还原法测定[19]。
1.3.3 数据处理 使用Microsoft Excel 2010软件进行数据统计,采用Duncan 新复极差法进行数据分析。
2 结果与分析
2.1 外源褪黑素对低温胁迫下红树莓叶片细胞膜透性的影响
2.1.1 外源褪黑素对低温胁迫下红树莓叶片相对电导率的影响 喷施外源MT对低温胁迫下红树莓叶片相对电导率的影响如图1 所示,自然低温胁迫条件下,喷施不同浓度MT 降低了植物叶片相对电导率,且随着MT 浓度增加呈先下降后上升趋势。处理后的第1天,4 个处理的叶片电导率显著低于对照,分别较对照降低了6.29%、7.73%、13.71%、13.03%。处理后的第3天和第5天各处理间相对电导率变化趋势与第1天一致,外源MT处理(50、100、150、200 μmol·L-1)叶片的相对电导率比对照分别降低5.54%、8.60%、12.97%、10.98%和3.77%、10.41%、13.69%、11.26%。150 μmol·L-1褪黑素处理叶片相对电导率最低,显著低于对照和50 μmol·L-1的褪黑素处理。
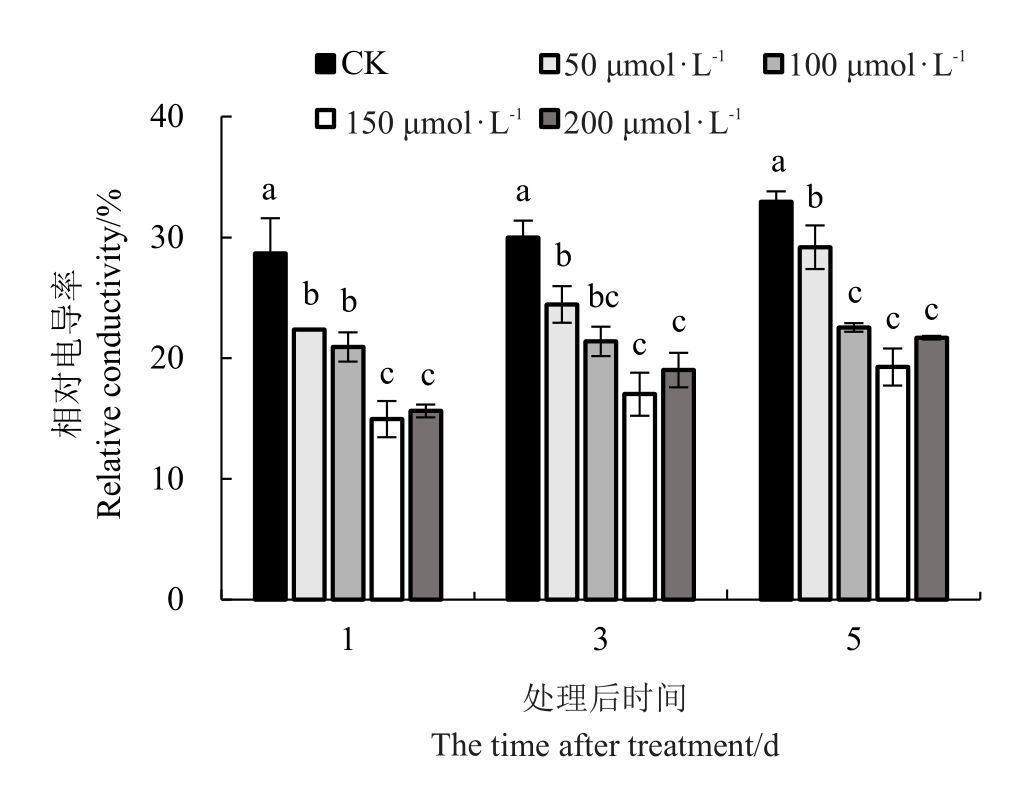
图1 低温胁迫下褪黑素对叶片相对电导率的影响
Fig.1 Effect of melatonin on relative electrical conductivity under low-temperature stress
不同小写字母表示不同处理间差异显著(p <0.05)。下同。
Different small letters show significant differences among different treatments(p <0.05).The same below.
2.1.2 外源褪黑素对低温胁迫下红树莓叶片丙二醛含量的影响 喷施外源MT对低温胁迫下红树莓叶片丙二醛(MDA)含量的影响情况如图2所示,低温胁迫下,随着胁迫时间的延长叶片MDA 含量逐渐增加,MT 处理的叶片中MDA 含量显著低于对照。处理后的第1天,外源MT 处理(50、100、150、200 μmol·L-1)叶片中的MDA 含量分别比对照降低了19.01%、19.40%、27.49%、20.85%,但是不同浓度外源MT 处理之间无显著性差异。处理后第3 天和第5 天不同处理间MDA 含量变化趋势一致。对照的MDA含量显著高于外源MT处理,150、200 μmol∙L-1褪黑素处理的叶片MDA 含量显著低于其他3 个处理,二者之间无明显差异。处理后的第3天,不同浓度外源MT 处理叶片中的MDA 含量分别较对照降低了23.39%、23.63%、41.93%、38.98%。处理后的第5天,不同浓度外源MT 处理叶片中的MDA 含量分别较对照降低了29.00%、29.29%、46.04%、40.90%。随着低温胁迫时间的延长叶片MDA 含量不断增加,不同浓度外源MT处理叶片后的第5天分别较第1 天增加了61.89%、41.92%、42.02%、20.46%和20.87%。
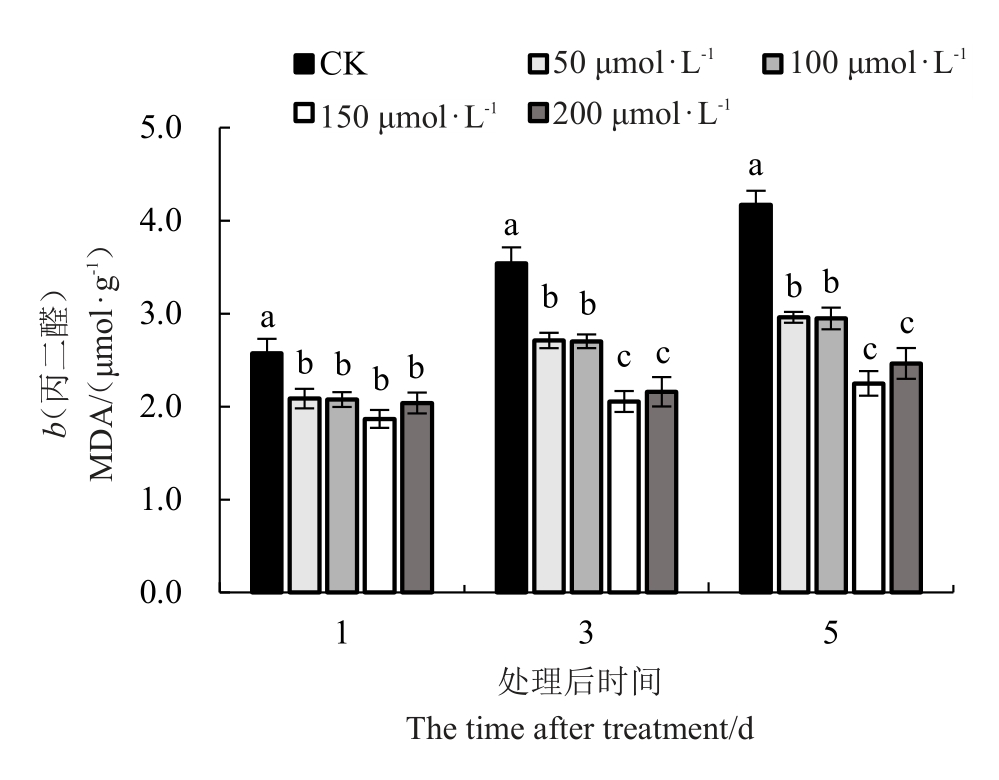
图2 低温胁迫下褪黑素对叶片丙二醛含量的影响
Fig.2 Effect of melatonin on MDA content under lowtemperature stress
2.2 外源褪黑素对低温胁迫下红树莓叶片叶绿素含量的影响
低温胁迫条件下,喷施不同浓度MT 提高了植物叶片叶绿素a、b及总叶绿素含量,且随着MT浓度增加呈先上升后下降趋势。
喷施外源MT对低温胁迫下红树莓叶片叶绿素a含量的影响如图3所示,红树莓叶片中叶绿素a含量随着低温胁迫的时间增加总体呈下降趋势,处理后的第3 天和第5 天的对照叶绿素a 含量比处理后的第1 天分别降低了4.81%和8.77%。不同胁迫时间内不同浓度外源MT 处理的叶片叶绿素a 含量均高于对照,均以150 μmol·L-1 MT处理的叶绿素a含量最高,较对照分别高30%、20%和20%。
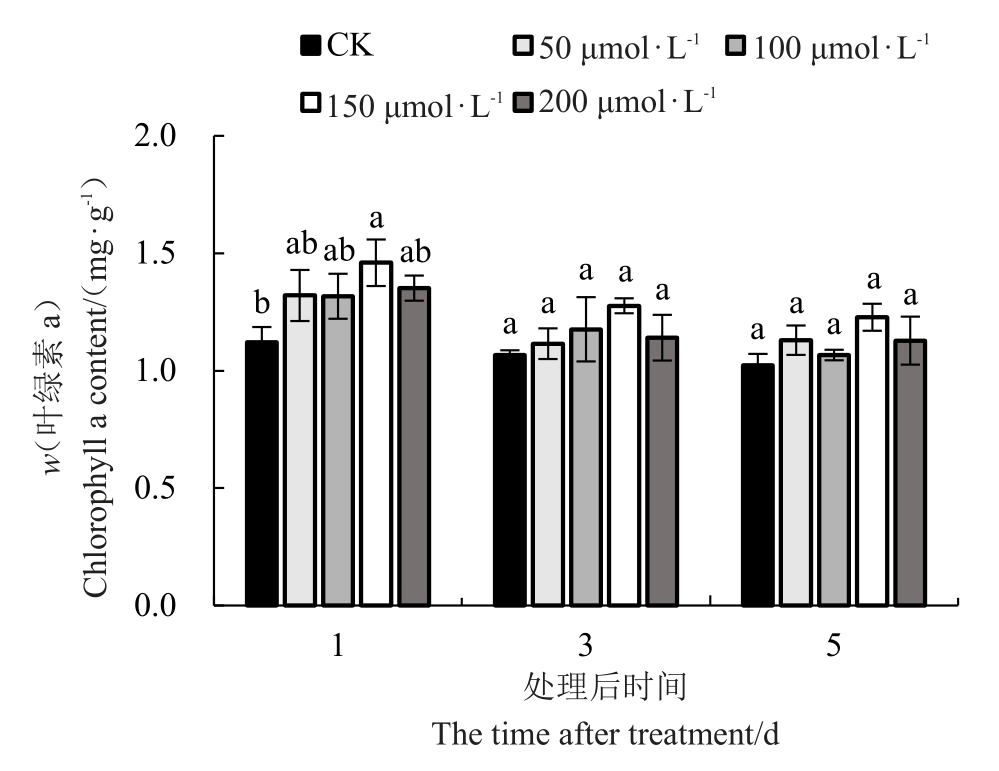
图3 低温胁迫下褪黑素对叶片叶绿素a 含量的影响
Fig.3 Effect of melatonin on chlorophyll a content under low-temperature stress
喷施外源MT对低温胁迫下红树莓叶片叶绿素b含量的影响如图4所示,红树莓叶片中叶绿素b含量随着低温胁迫的时间增加总体呈下降趋势,但趋势不明显。处理后的第3 天和第5 天的对照叶绿素b 含量比处理后的第1 天分别降低了0.93%和5.66%。不同胁迫时间均以100 μmol·L-1 MT处理的叶片叶绿素b 含量最高,对照显著低于不同浓度外源MT处理。处理后的第1天,不同浓度外源MT处理叶片中的叶绿素b 含量分别较对照增加了18.45%、29.31%、20.98%、18.71%;处理后的第3天,不同浓度外源MT 处理叶片中的叶绿素b 含量分别较对照增加了17.92%、26.97%、24.30%、17.72%;处理后的第5天,不同浓度外源MT处理叶片中的叶绿素b 含量分别比对照增加了21.42%、30.76%、23.72%、17.70%。
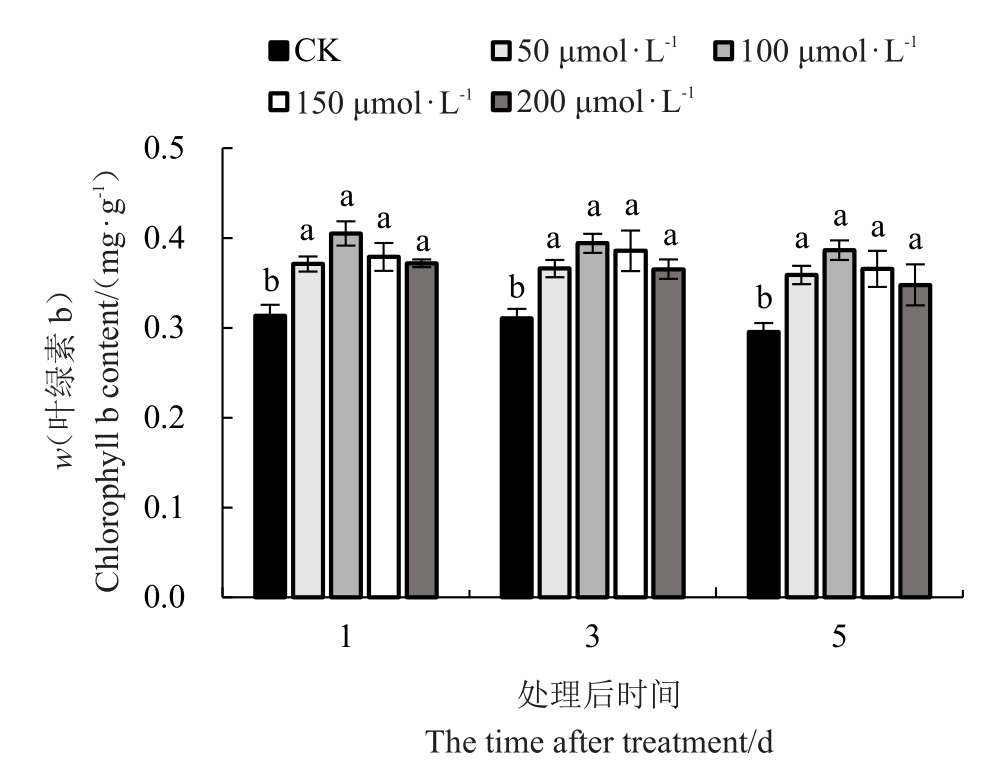
图4 低温胁迫下褪黑素对叶片叶绿素b 含量的影响
Fig.4 Effect of melatonin on chlorophyll b content under low-temperature stress
喷施外源MT对低温胁迫下红树莓叶片总叶绿素含量的影响如图5 所示,红树莓叶片中总叶绿素含量随着低温胁迫时间的延长总体呈下降趋势。不同胁迫时间均以150 μmol·L-1 MT 处理的叶片总叶绿素含量最高,对照显著低于不同浓度外源MT 处理。处理后的第1天,不同浓度外源MT处理的叶片总叶绿素含量较对照分别显著增加了18.07%、21.81%、28.74%和19.83%,而不同浓度外源MT 处理之间无显著性差异。处理后的第3天,不同浓度外源MT处理的叶片总叶绿素含量较对照分别显著增加了8.76%、14.39%、20.79%和9.09%,150 μmol·L-1 MT 处理的叶片总叶绿素含量较50、200 μmol·L-1 MT 处理的叶片总叶绿素含量分别显著增加了11.06%和10.72%。处理后的第5天,不同浓度外源MT处理的叶片总叶绿素含量较对照分别显著增加了8.08%、8.97%、16.69%和8.37%,150 μmol·L-1 MT处理的叶片总叶绿素含量较其他浓度MT处理的叶片总叶绿素含量分别显著增加了7.97%、7.08%和7.68%。
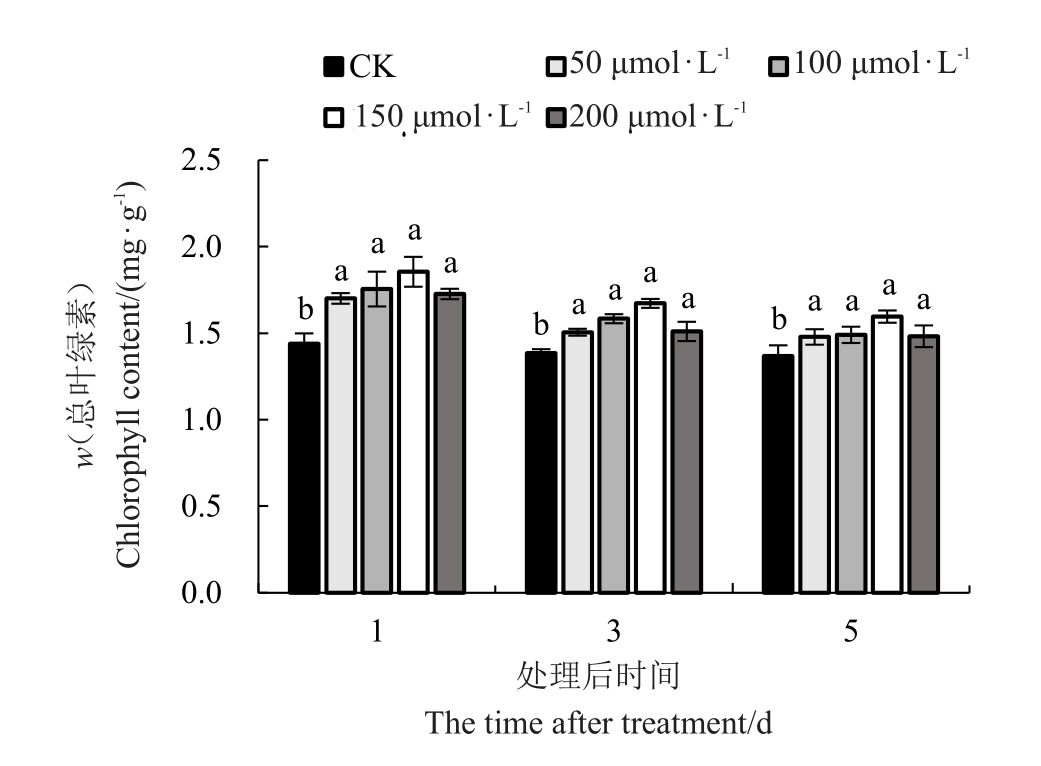
图5 低温胁迫下褪黑素对叶片总叶绿素含量的影响
Fig.5 Effect of melatonin on chlorophyll content under low-temperature stress
2.3 外源褪黑素对低温胁迫下红树莓叶片渗透调节物质含量的影响
2.3.1 外源褪黑素对低温胁迫下红树莓叶片可溶性蛋白质含量的影响 外源MT对低温胁迫下红树莓叶片可溶性蛋白质含量的影响情况如图6 所示,叶片中可溶性蛋白质含量随着低温胁迫时间的延长先上升后下降,外源MT 处理可增加低温胁迫条件下叶片内可溶性蛋白质含量,且随着MT 浓度的增加呈先上升后下降的趋势。
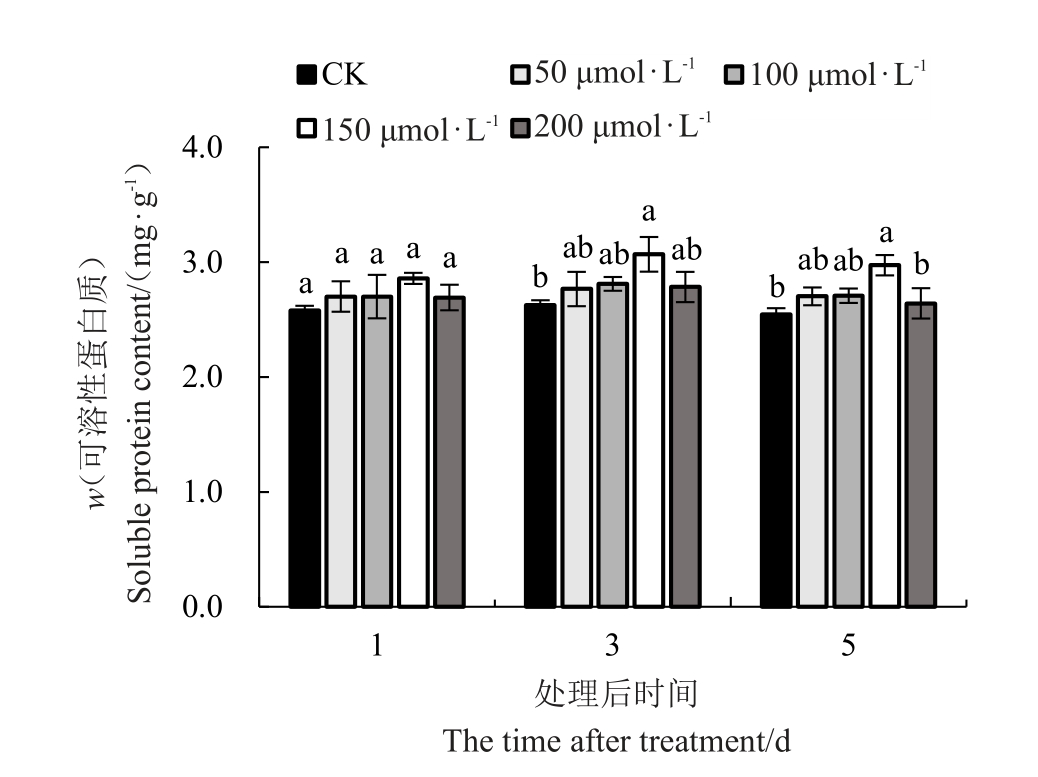
图6 低温胁迫下褪黑素对叶片可溶性蛋白质含量的影响
Fig.6 Effect of melatonin on soluble protein content under low-temperature stress
不同胁迫时间均以150 μmol·L-1 MT 处理的叶片可溶性蛋白质含量最高,对照最低。处理后的第1天,不同浓度外源MT处理的叶片中可溶性蛋白质含量分别较对照增加了4.78%、4.75%、10.90%和4.44%,但是不同浓度外源MT处理之间均无显著性差异。处理后的第3天,150 μmol·L-1 MT 处理的叶片可溶性蛋白质含量较对照显著增加16.84%,但二者与其他浓度外源MT处理均无显著性差异。处理后的第5天,150 μmol·L-1 MT 处理的叶片可溶性蛋白质含量较对照和200 μmol·L-1 分别显著增加16.93%和12.57%,除150 μmol·L-1 MT处理外,其他不同浓度外源MT处理之间均无显著性差异。
2.3.2 外源褪黑素对低温胁迫下红树莓叶片可溶性糖含量的影响 喷施外源MT对低温胁迫下红树莓叶片可溶性糖含量的影响如图7 所示,叶片中可溶性糖含量随着低温胁迫时间的延长而下降,且随着MT浓度的增加呈先下降后上升的趋势。不同胁迫时间均以100、150 μmol·L-1MT 处理的叶片可溶性糖含量显著低于其他处理。处理后的第1天,100、150 μmol·L-1 MT 处理的叶片中可溶性糖含量分别较其他3 个处理显著降低37.73%、29.55%、18.15%和38.44%、30.36%、19.08%。50、200 μmol·L-1 MT处理的叶片中可溶性糖含量分别比对照显著降低16.55%、20.38%。处理后的第3天,100、150 μmol·L-1 MT 处理的叶片中可溶性糖含量分别较其他3 个处理显著降低34.15%、22.87%、14.53%和37.09%、26.31%、18.33% ;200 μ mol ·L-1 分别比对照 和50 μmol·L-1显著降低22.96%、9.76%;50 μmol·L-1比对照显著降低14.63%。处理后的第5天,100、150 μmol·L-1 MT 处理的叶片中可溶性糖含量分别较其他3 个处理显著降低37.73%、29.55%、18.15%和38.44%、30.36%、19.08%;200 μmol·L-1浓度的褪黑素处理分别比对照和50 μmol·L-1显著降低23.92%、13.94%。
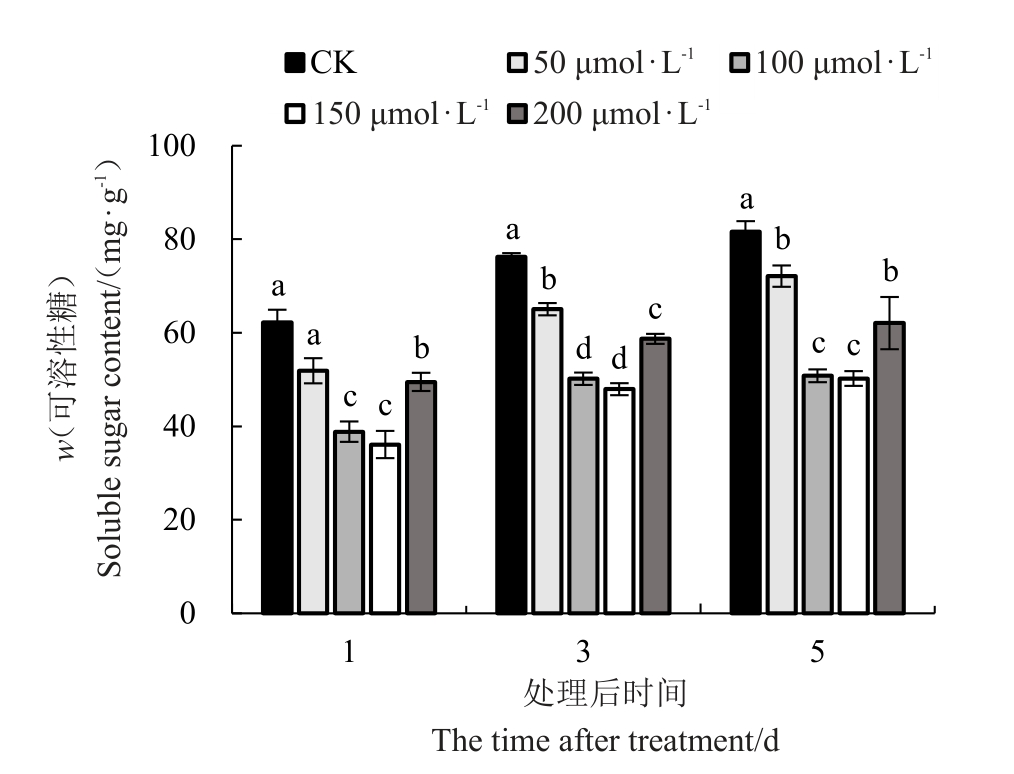
图7 低温胁迫下褪黑素对叶片可溶性糖含量的影响
Fig.7 Effect of melatonin on soluble sugar content under low-temperature stress
2.3.3 外源褪黑素对低温胁迫下红树莓叶片淀粉含量的影响 喷施外源MT对低温胁迫下红树莓叶片淀粉含量的影响如图8 所示,叶片中淀粉含量随着低温胁迫时间的延长而下降,且随着MT 浓度的增加呈先上升后下降的趋势。不同胁迫时间均以150 μmol·L-1 MT 处理的叶片中淀粉含量最高,对照最低。处理后的第1天,150 μmol·L-1 MT 处理的叶片中淀粉含量较对照显著增加43.70%;处理后的第3天,150 μmol·L-1 MT处理的叶片中淀粉含量较对照显著增加39.41%;处理后的第5天,100、150、200 μmol·L-1 MT 处理的叶片中淀粉含量分别较对照显著增加34.54%、46.10%、35.15%。
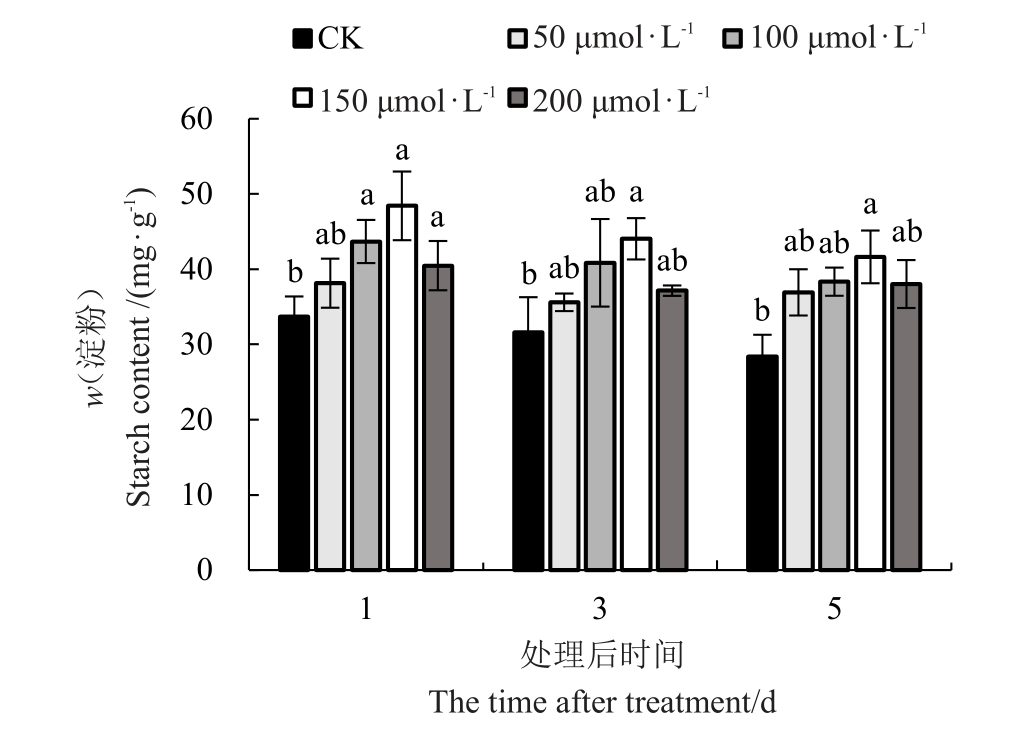
图8 低温胁迫下褪黑素对叶片淀粉含量的影响
Fig.8 Effect of melatonin on starch content under lowtemperature stress
2.4 外源褪黑素对低温胁迫下红树莓叶片抗氧化酶活性的影响
2.4.1 外源褪黑素对低温胁迫下红树莓叶片SOD(超氧化物歧化酶)活性的影响 喷施外源MT对低温胁迫下红树莓叶片SOD 活性由图9 可知,叶片中SOD活性随着低温胁迫时间的延长先下降后上升,且随着MT浓度的增加呈先上升后下降的趋势。不同胁迫时间100、150、200 μmol·L-1 MT 处理的叶片中SOD 活性均显著高于对照和50 μmol·L-1 MT 处理。处理后的第1天,外源MT 处理叶片中SOD 活性分别较对照提高17.99%、60.23%、60.14%、59.40%;处理后的第3天,外源MT处理叶片中SOD活性分别较对照提高37.06%、79.40%、102.72%、100.32%;处理后的第5天,外源MT 处理叶片中SOD活性分别较对照提高35.91%、73.22%、92.12%、75.51%。
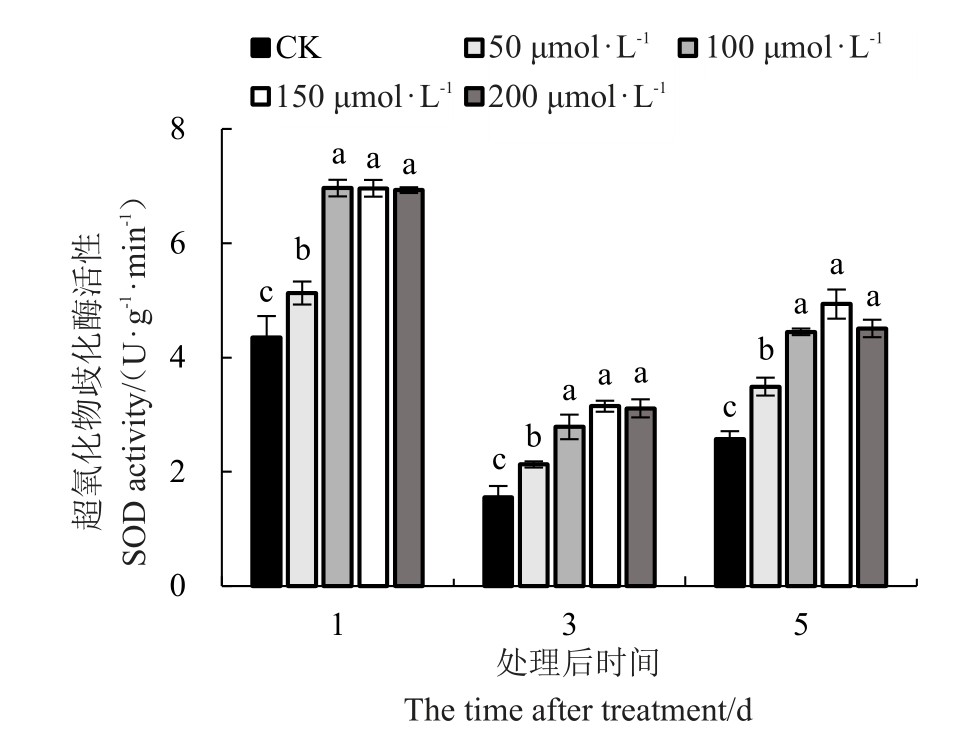
图9 低温胁迫下褪黑素对叶片SOD 活性的影响
Fig.9 Effect of melatonin on SOD activity under lowtemperature stress
2.4.2 外源褪黑素对低温胁迫下红树莓叶片POD(过氧化物酶)活性的影响 喷施外源MT对低温胁迫下红树莓叶片POD活性由图10可知,低温胁迫的时间越长叶片中POD 活性越高,且随着MT 浓度的增加POD 活性呈先上升后下降的趋势。不同胁迫时间均以150 μmol·L-1 MT处理的叶片POD活性最高,对照最低。处理后的第1天,150 μmol·L-1 MT处理的叶片POD活性较对照显著增加了49.07%,其他不同浓度外源MT 处理之间均无显著性差异;处理后的第3天,150、200 μmol·L-1 MT处理的叶片POD活性均较对照显著提高了38.05%和32.54%;处理后的第5天,100、150、200 μmol·L-1 MT 处理的叶片POD 活性均较对照显著提高了24.80%、61.29%和52.76%。
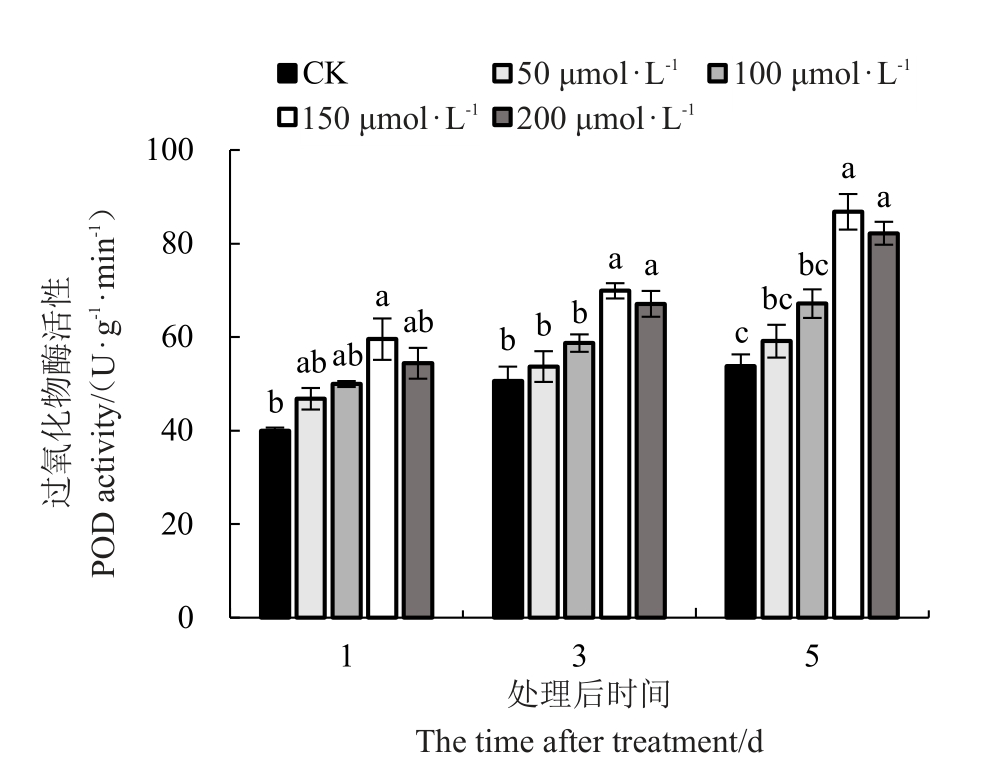
图10 低温胁迫下褪黑素对叶片POD 活性的影响
Fig.10 Effect of melatonin on POD activity under lowtemperature stress
2.4.3 外源褪黑素对低温胁迫下红树莓叶片CAT(过氧化氢酶)活性的影响 喷施外源MT对低温胁迫下红树莓叶片CAT活性由图11可知,低温胁迫的时间越长叶片中CAT 活性越高,且随着MT 浓度的增加CAT 活性呈先上升后下降的趋势。不同胁迫时间均以150 μmol·L-1 MT 处理的叶片中CAT 活性最高,对照显著低于其他处理。处理后的第1天,不同浓度外源MT处理的叶片中CAT活性分别较对照显著提高了51.29%、103.63%、145.46%和104.61%;150 μmol·L-1 MT 处理的叶片中CAT 活性较50、100和200 μmol·L-1 MT 处理的叶片中CAT 活性显著提高了62.25%、20.54%和19.96%;100、200 μmol·L-1 MT 处理的叶片中CAT 活性分别较50 μmol·L-1 MT处理的叶片中CAT 活性显著提高了34.60%和35.25%。处理后的第3天,不同浓度外源MT 处理的叶片中CAT 活性分别较对照显著提高29.58%、57.00%、83.85%和61.36%;150 μmol·L-1 MT 处理的叶片中CAT活性较50、100和200 μmol·L-1 MT处理的叶片中CAT 活性显著提高了41.88%、17.10%和13.94%;100、200 μmol·L-1 MT处理的叶片中CAT活性分别较50 μmol·L-1MT处理的叶片中CAT活性显著提高了21.16%和24.52%。处理后的第5天,不同浓度外源MT处理的叶片中CAT活性分别较对照显著提高32.91%、83.09%、95.52%和67.85%。150 μmol·L-1 MT 处理的叶片中CAT 活性较50、100 和200 μmol·L-1 MT 处理的叶片中CAT 活性显著提高了47.10%、6.79%和16.49%;100、200 μmol·L-1 MT处理的叶片中CAT活性分别较50 μmol·L-1 MT处理的叶片中CAT活性显著提高了37.75%和26.28%。
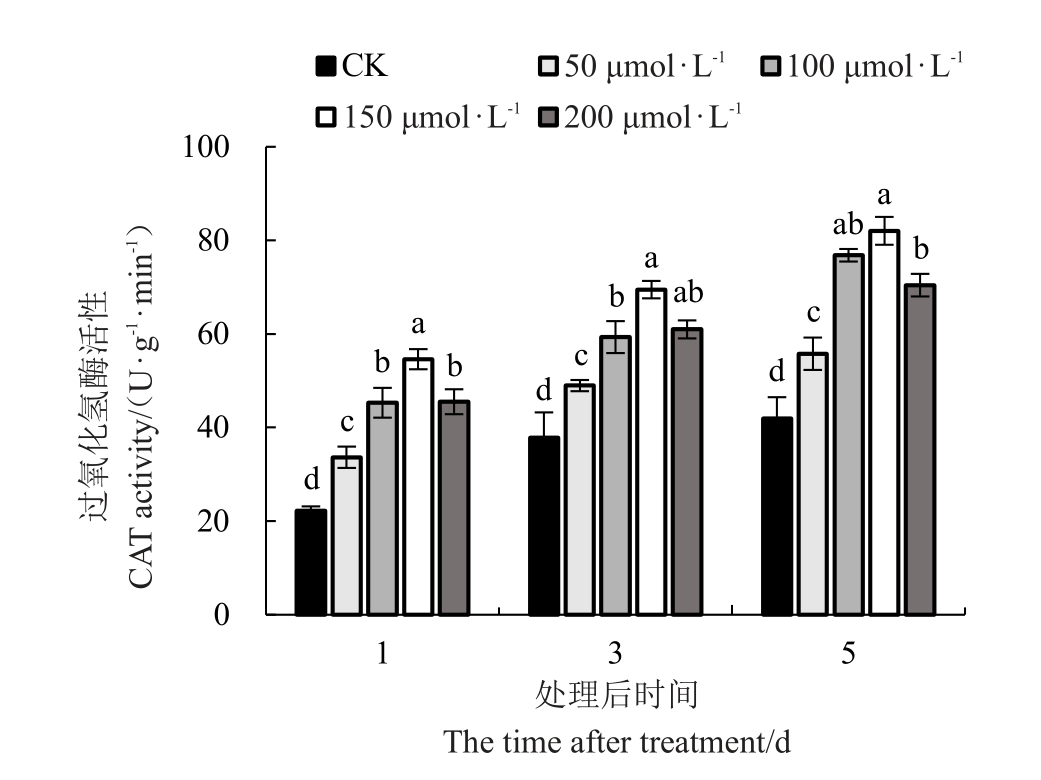
图11 低温胁迫下褪黑素对叶片CAT 活性的影响
Fig.11 Effect of melatonin on CAT activity under lowtemperature stress
3 讨论
低温胁迫会造成植物体内生理生化系统紊乱,影响植株正常生长发育,严重时会导致减产,造成不可避免的经济损失。本研究结果表明,外源褪黑素处理有效的缓解了低温对于红树莓生长的抑制作用,这与张俊康等[20]在外源褪黑素对软枣猕猴桃低温伤害的缓解效应中得出的结论一致。
植物细胞会因低温胁迫遭受伤害,最先冲击的就是细胞膜。低温胁迫可以使叶片细胞膜破裂,膜透性发生改变导致相对电导率升高[21-22]。尉欣荣等[14]研究表明,在不同胁迫强度下,喷施一定浓度的MT 会在一定程度上降低叶片相对电导率,与本研究结果一致。褪黑素可提高植物抗氧化酶活性和降低MDA 含量[23],在低温胁迫下,植物细胞膜质过氧化和膜蛋白间会加速聚合,致使膜系统受损,其表现出的特征就是细胞内MDA 含量增加,植物抗氧化酶系统中SOD、POD、CAT 3 种酶共同作用,清除植物体内ROS 并维持其动态平衡[24]。本试验中,外源褪黑素处理的红树莓叶片具有较低的SOD 活性和较高的CAT 活性,可以防止过氧化氢的积累,同时又避免了超氧阴离子和过氧化氢反应生成羟基自由基[24],在红树莓叶片喷施外源MT后不同时间,叶片相对电导率和MDA 含量均显著低于对照,而叶片SOD、POD、CAT 活性均高于对照,说明MT 能够激活植物的抗氧化系统,减轻或防止植物体受到ROS损伤,有效降低红树莓叶片细胞膜受损程度。
叶绿素是绿色植物的重要色素,是高等作物进行光合作用的首要物质。叶绿素含量也是判断植物生活活力的重要指标。近年研究发现,褪黑素可改善光周期、提高光合效率、保护叶绿素、促进果实成熟、延迟衰老,具有类似生长素的功能[25-26]。本试验结果表明,低温胁迫会使叶绿素含量下降,不同浓度MT 处理的红树莓叶片中叶绿素含量显著高于对照,且150 μmol·L-1 MT处理的效果最好。在低温条件下植物通常会累积渗透调节类物质,从而降低细胞内的水势,促进植物细胞吸收水分,保持细胞渗透平衡,来维持正常的生理功能[27]。有研究[28]表明细胞内可溶性蛋白含量与抗冻性呈显著的正相关,即外源MT能提高低温胁迫下叶片中可溶性蛋白质含量从而提高植物抗冻性。本试验表明,随着低温胁迫时间延长,150 μmol·L-1 MT处理的红树莓叶片可溶性蛋白含量显著高于对照。低温胁迫下,植物可以通过积累大量的可溶性糖,增加细胞液浓度,延缓细胞结冰伤害[29]。邹京南[30]等关于外源MT 对大豆干旱胁迫影响的研究表明,褪黑素处理叶片可溶性糖含量高于对照。但本研究中MT处理叶片内的可溶性糖含量低于对照,而树莓叶片中淀粉含量与可溶性糖含量变化趋势正好相反,可能是因为该时期叶片尚未启用淀粉转化为可溶性糖来抵抗低温。
内源褪黑素的合成和积累是红树莓应答低温胁迫的方式之一,具体的调节机制需要进一步研究。另外本研究及相关报道均表明MT是一种微量高效的植物生长调节剂,成本相对较高。因此,期待化学合成等技术的进一步成熟降低其成本,使MT 更广泛地应用于生产,以提高植物的逆境胁迫抗性。
4 结论
4种浓度MT 处理均降低了低温胁迫下红树莓叶片膜脂过氧化程度,缓解活性氧、自由基对叶片的氧化损伤。综合不同浓度的作用效果,筛选出缓解红树莓叶片低温胁迫的适宜MT浓度为150 μmol·L-1。
[1] 徐玉秀,王友升,王贵禧.红树莓的利用研究及其在我国的发展前景[J].经济林研究,2003,21(1):64-66.XU Yuxiu,WANG Yousheng,WANG Guixi.Utilization of Rubus corchorifolius and its development in China[J].Nonwood Forest Research,2003,21(1):64-66.
[2] 张群英,文光琴,李永霞,聂飞,王瑶.优良红树莓品种及当地野生红树莓的引种比较研究[J].种子,2015,34(1):100-103.ZHANG Qunying,WEN Guangqin,LI Yongxia,NIE Fei,WANG Yao.Comparative study on introduction between fine raspberry varieties and local wild raspberry[J].Seed,2015,34(1):100-103.
[3] 张清华.树莓栽培实用技术[M].北京:中国林业出版社,2013:3-4.ZHANG Qinghua.Practical techniques of raspberry cultivation[M].Beijng:China Forestry Press,2013:3-4.
[4] 张薇,张雪梅.树莓产业发展现状及对策分析[J].河北果树,2021(3):1-3.ZHANG Wei,ZHANG Xuemei.Analysis on current situation and countermeasures of raspberry industry development[J].Hebei Fruits,2021(3):1-3.
[5] 李贺,姜欣悦,陈忠诚,陈如男,王华美,曹亮,金喜军,任春元,王孟雪,张明聪,于高波,张玉先.外源褪黑素对低温胁迫下大豆V1 期幼苗光合荧光及抗氧化系统的影响[J].中国油料作物学报,2020,42(4):640-648.LI He,JIANG Xinyue,CHEN Zhongcheng,CHEN Runan,WANG Huamei,CAO Liang,JIN Xijun,REN Chunyuan,WANG Mengxue,ZHANG Mingcong,YU Gaobo,ZHANG Yuxian.Effects of exogenous melatonin on photosynthetic fluorescence and antioxidant system of soybean V1 seedlings under low temperature[J].Chinese Journal of Oil Crop Sciences,2020,42(4):640-648.
[6] 杜卓,侯雯,王丽,李林,张凯,陆运才.外源褪黑素对干旱胁迫下玉米幼苗的影响[J].中国农学通报,2020,36(27):14-19.DU Zhuo,HOU Wen,WANG Li,LI Lin,ZHANG Kai,LU Yuncai.Effects of exogenous melatonin on maize seedlings under drought stress[J].Chinese Agricultural Science Bulletin,2020,36(27):14-19.
[7] 周小婷.外源褪黑素对盐胁迫下生菜和番茄幼苗的光合作用调控机制[D].杨凌:西北农林科技大学,2017.ZHOU Xiaoting.The role of exogenous melatonin on regulation of photosynthesis in lettuce and tomato seedlings under salt stress[D].Yangling:Northwest A&F University,2017.
[8] 侯雯,杜卓,王丽,李林,张凯,陆运才.外源褪黑素对低温胁迫下玉米幼苗生长和生理特性的影响[J].中国糖料,2020,42(2):33-37.HOU Wen,DU Zhuo,WANG Li,LI Lin,ZHANG Kai,LU Yuncai.Effects of exogenous melatonin on growth and physiological characteristics of Maize seedlings under low temperature stress[J].Sugar Crops of China,2020,42(2):33-37.
[9] 偶春,张敏,姚侠妹,杨丽梅,刘宇,屈长青.褪黑素对盐胁迫下香椿幼苗生长及离子吸收和光合作用的影响[J].西北植物学报,2019,39(12):2226-2234.OU Chun,ZHANG Min,YAO Xiamei,YANG Limei,LIU Yu,QU Changqing.Effect of melatonin on growth,ion absorption and photosynthesis of toona sinensis seedlings under salt stress[J].Acta Botanica Boreali-Occidentalia Sinica,2019,39(12):2226-2234.
[10] POSMYK M M,KURAN H,MARCINIAK K,JANAS K M.Presowing seed treatment with melatonin protects red cabbage seedlings against toxic copper ion concentrations[J].Journal of Pineal Research,2008,45(1):24-31.
[11] ZHANG N,ZHAO B,ZHANG H J,WEEDA S,YANG C,YANG Z C,REN S X,GUO Y D.Melatonin promotes waterstress tolerance,lateral root formation,and seed germination in cucumber (Cucumis sativus L.)[J].Journal of Pineal Research,2013,54(1):15-23.
[12] NAWAZ M A,HUANG Y,BIE Z L,AHMED W,REITER R J,NIU M L,HAMEED S.Melatonin:current status and future perspectives in plant science[J].Front in Plant Science,2016,7:714.
[13] 牛云然.外源物质对低温下辣椒幼苗抗冷性的影响[D].邯郸:河北工程大学,2020.NIU Yunran.Effects of exogenous substances on the cold resistance of pepper seedlings at low temperature[D].Handan:Hebei University of Engineering,2020.
[14] 尉欣荣,张智伟,周雨,刘鹏,姚宏斌,苗彦军,付娟娟.褪黑素对低温和干旱胁迫下多年生黑麦草幼苗生长和抗氧化系统的调节作用[J].草地学报,2020,28(5):1337-1345.WEI Xinrong,ZHANG Zhiwei,ZHOU Yu,LIU Peng,YAO Hongbin,MIAO Yanjun,FU Juanjuan.Effects of melatonin on growth and antioxidant system of perennial ryegrass seedlings under cold and drought stresses[J].Acta Agrestia Sinica,2020,28(5):1337-1345
[15] YU Y,LV Y,SHI Y N,LI T,CHEN Y C,ZHAO D K,ZHAO Z W.The role of Phyto-Melatonin and related metabolites in response to stress[J].Molecules,2018,23(8):1887.
[16] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:184-260.LI Hesheng.Principle and technology of plant physiological and biochemical experiments[M].Bejing: Higher Education Press,2000:184-260.
[17] 陈耀兵,江念,孙紫薇,滕树锐,郑小江.藤茶不同繁殖方式有效成分测定及抗氧化酶活性分析[J].中成药,2018,40(2):399-403.CHEN Yaobing,JIANG Nian,SUN Ziwei,TENG Shuyue,ZHENG Xiaojiang.Determination of effective components and analysis of antioxidant enzyme activities of Ampelopsis grossedentata under different breeding modes[J].Chinese Traditional Patent Medicine,2018,40(2):399-403.
[18] 李文欣,李程,史瑞基,张雪梅,郭素萍,顾玉红.不同品种红树莓果实发育过程中抗氧化性的研究[J].河北农业大学学报,2018,41(3):67-71.LI Wenxin,LI Cheng,SHI Ruiji,ZHANG Xuemei,GUO Suping,GU Yuhong.Study on the antioxidant activity of different varieties of red raspberry fruit during the development process[J].Journal of Agricultural University of Hebei,2018,41(3):67-71.
[19] 王秀梅,安毅,秦莉,林大松,霍莉莉.镉胁迫下土壤理化因子与过氧化氢酶活性的通径分析[J].中国农学通报,2018,34(11):59-65.WANG Xiumei,AN Yi,QIN Li,LIN Dasong,HUO Lili.Path analysis of soil physicochemical factors and catalase activities under cadmium stress[J].Chinese Agricultural Science Bulletin,2018,34(11):59-65.
[20] 张俊康,马丽,吴姝青,王尧,陈学森,臧德奎,王玉杰,王延玲.外源褪黑素对软枣猕猴桃低温伤害的缓解效应[J].植物生理学报,2020,56(5):1081-1087.ZHANG Junkang,MA Li,WU Shuqing,WANG Yao,CHEN Xuesen,ZANG Dekui,WANG Yujie,WANG Yanling.AlleviatingeffectofexogenousmelatoninonchillinginjuryofKiwifruit[J].Plant Physiology Journal,2020,56(5):1081-1087.
[21] LYONS J M AND RAISON J K.Oxidative activity of mitochondria isolated from plant tissues sensitive and resistant to chilling injury[J].Plant Physiology,1970,45:386-389.
[22] 杨爱国,王漫,付志祥,毕庆玲,孙莹,王利,杜海波.电导法协同Logistic 方程测定不同品种桑树抗寒性[J].湖南林业科技,2018,45(1):28-31.YANG Aiguo,WANG Man,FU Zhixiang,BI Qingling,SUN Ying,WANG Li,DU Haibo.Cold resistance determination of different cultivars Morus alba with synergistic electrical conductivity method and Logistic equation[J].Hunan Forestry Science&Technology,45(1):28-31.
[23] 李瑞雪,金晓玲,胡希军,汪结明,罗峰,张方静.低温胁迫下6种木兰科植物的生理响应及抗寒相关基因差异表达[J].生态学报,2019,39(8):2883-2898.LI Ruixue,JIN Xiaoling,HU Xijun,WANG Jieming,LUO Feng,ZHANG Fangjing.Physiological responses and differential expression of cold resistance-related genes of six varieties of Magnoliaceae under low temperature stress[J].Acta Ecologica Sinica,2019,39(8):2883-2898.
[24] 吴彩芳,李红艳,刘琴,廖明安,刘磊,吕秀兰,梁东,王进,夏惠,林立金,陈栋,涂美艳.外源褪黑素对桃生长及果实品质的影响[J].果树学报,2021,38(1):40-49.WU Caifang,LI Hongyan,LIU Qin,LIAO Mingan,LIU Lei,LÜ Xiulan,LIANG Dong,WANG Jin,XIA Hui,LIN Lijin,CHEN Dong,TU Meiyan.Effects of exogenous melatonin on growth and fruit quality of peach(Prunus persica)[J].Journal of Fruit Science,2021,38(1):40-49.
[25] LIU B B,LI M,LI Q M,CUI Q Q,ZHANG W D,AI X Z,BI H G.Combined effects of elevated CO2 concentration and drought stress on photosynthetic performance and leaf structure of cu-cumber(Cucumis sativus L.)seedlings[J].Photosynthetica,2018,56(3):942-952.
[26] 张莹,雅蓉,徐伟荣,王佳慧,崔莹,李俊铎.褪黑素在‘霞多丽’葡萄种子体细胞胚诱导发生中的作用[J].果树学报,2021,38(6):922-933.ZHANG Ying,YA Rong,XU Weirong,WANG Jiahui,CUI Ying,LI Junduo.Role of melatonin in the induction of somatic embryogenesis from seeds of Vitis vinifera‘Chardonnay’[J].Journal of Fruit Science,2021,38(6):922-933.
[27] 付晴晴,谭雅中,翟衡,杜远鹏.NaCl 胁迫对耐盐性不同葡萄株系叶片活性氧代谢及清除系统的影响[J].园艺学报,2018,45(1):30-40.FU Qingqing,TAN Yazhong,ZHAI Heng,DU Yuanpeng.Effects of salt stress on the generation and scavenging of reactive oxygen species inleaves of grape strains with different salt tolerance[J].Acta Horticulturae Sinica,2018,45(1):30-40.
[28] 赵慧,尹砾,田长平,孙庆田.不同樱桃品种及砧木抗寒性评价[J].山东农业科学,2019,51(7):37-40.ZHAO Hui,YIN Shuo,TIAN Changping,SUN Qingtian.Evaluation on cold resistance of different varieties and rootstocks of cherry[J].Shandong Agricultural Sciences,2019,51(7):37-40.
[29] 李元生,徐珊珊,李强,杜海燕.外源褪黑素对高温胁迫下葡萄幼苗生理特性的影响[J].林业科技通讯,2021(4):66-69.LI Yuansheng,XU Shanshan,LI Qiang,DU Haiyan.Effects of exogenous melatonin on physiological characteristics of grape seedlings under high temperature stress[J].Forest Science and Technology,2021(4):66-69.
[30] 邹京南,曹亮,王梦雪,金喜军,任春元,王明瑶,于奇,张玉先.外源褪黑素对干旱胁迫下大豆结荚期光合及生理的影响[J].生态学杂志,2019,38(9):2709-2718.ZOU Jingnan,CAO Liang,WANG Mengxue,JIN Xijun,REN Chunyuan,WANG Mingyao,YU Qi,ZHANG Yuxian.Effects of exogenous melatonin on photosynthesis and physiology of soybean during podding stage under drought stress[J].Chinese Journal of Ecology,2019,38(9):2709-2718.