蔗糖是植物光合作用同化产物输出的主要物质,是植物必需的能量物质,同时也是水果中可溶性糖的主要组成部分,在植物胚胎发生、种子萌发和幼苗早期生长、营养生长和生殖生长过程中起着重要作用[1-2]。蔗糖代谢是果实糖积累过程中重要的代谢途径,直接影响果实甜度,并决定果实风味和品质。蔗糖合酶(sucrose synthase,SS)为蔗糖代谢的关键酶,能够可逆地合成和分解蔗糖,使蔗糖参与到组织构建、物质贮藏和植物细胞新陈代谢等过程中[3-6],其反应为:蔗糖+尿苷二磷酸(UDP)↔果糖+尿苷二磷酸葡萄糖(UDP-G)。目前已在柑橘、草莓、桃、梨、葡萄等树种中鉴定出SS基因,如柑橘鉴定出6个SS基因[7],草莓鉴定出8 个SS 基因[8],桃鉴定出6 个SS基因[9]、葡萄鉴定出5个SS基因[10],梨鉴定出17个SS基因[11]。而且柑橘的SS 是糖分积累的关键酶,6 个CitSus 基因中,仅CitSus1 和CitSus2 在果肉中高表达[7]。草莓FaSS1可调控果实成熟,且FaSS1的表达受脱落酸和蔗糖抑制[8]。在草莓和番茄中,外源蔗糖可作为ABA信号通路的上游信号分子,在番茄和草莓果实的发育和成熟过程中起着重要作用[12-13]。上述研究暗示蔗糖/蔗糖合酶基因(SS)在果实发育与成熟过程中扮演着极其重要的角色[8,14]。
欧洲甜樱桃(Prunus avium L.)是目前北方落叶果树中栽培效益最好的树种之一,也是我国北方春季上市最早的鲜果,目前已广泛栽植在我国渤海湾沿岸和陇海铁路沿线等区域[15]。其色泽鲜艳、味道鲜美、营养丰富,且富含多种碳水化合物、蛋白质、维生素、铁、钙、钾等人体必需的营养元素和矿物质等,深受人们喜爱[16]。开展甜樱桃蔗糖合酶基因的功能鉴定,探明蔗糖合酶基因在甜樱桃果实发育和成熟过程中的作用机制,对于调控蔗糖合成能力及果实发育与成熟具有重要的指导意义,同时为进一步研究甜樱桃果实蔗糖积累、果实品质形成和果实成熟软化的分子机制奠定理论基础。
然而,关于PavSS 基因在甜樱桃果实发育和成熟过程中的分子机制尚不清楚,且PavSS 基因在甜樱桃基因组中存在多个家族成员,可能行使不同功能,哪一个(或几个)PavSS 基因在甜樱桃果实成熟软化过程中起重要作用等问题目前尚未报道。因此,为明确甜樱桃PavSS 基因家族在果实成熟软化过程中的功能,笔者从甜樱桃基因组数据库中分离了PavSS 家族基因,研究了它们在甜樱桃果实发育过程中的表达特性,并分析了外施蔗糖后PavSS 基因表达量的变化,进一步利用病毒诱导的基因沉默(VIGS)技术分析了2 个PavSS 基因(PavSS1 和PavSS6)在果实成熟软化过程中的功能,为进一步研究PavSS基因在甜樱桃果实成熟软化的分子机制提供理论基础。
1 材料和方法
1.1 试验材料
植物材料:欧洲甜樱桃栽培品种‘布鲁克斯’取自中国农业科学院郑州果树研究所樱桃种质资源圃,砧木为‘ZY-1’,树龄8 a(年),树体生长正常。
菌株和TRV 病毒载体:VIGS 载体烟草脆裂病毒载体(tobacco rattle virus,TRV)pTRV1 与pTRV2由清华大学刘玉乐教授惠赠,根癌农杆菌菌种GV3101由本实验室保存。
蔗糖处理:甜樱桃盛花期35 d后,进行外施蔗糖处理(每个果实注射50 mmol·L-1蔗糖1 mL,以注射50 mmol·L-1山梨醇1 mL 作为渗透势对照,阴性对照)。
1.2 PavSS蛋白的系统进化树分析
基于已经从拟南芥、番茄、桃、葡萄、草莓和柑橘基因组数据库鉴定出的SS家族基因,基因的序列号如下:拟南芥[AtSus1(At5g20830)、AtSus2(At5g-49190)、AtSus3(At4g02280)、AtSus4(At3g43190)、AtSus5(At5g37180)、AtSus6(At1g73370)]、番茄[SlSS1(NM_001247726.2)、SlSS3(NM_001247875.2)、SlSS4(HM180943.1)、SlSS5(XM_004243632.4)、SlSS6(XM_004235340.4)、SlSS7(XM_004232624.4)]、桃[PpSus1(JQ412752.1)、PpSus2(KJ493331.1)、Pp-Sus3(KJ493332.1)、PpSus4(KJ493333.1)、PpSus5(KJ493334.1)、PpSus6(KJ493335.1)]、葡萄[VvSS1(XM_010650590.2)、VvSS2(XM_002271494.4)、VvSS3(XM_002271860.3)、VvSS4(XM_010657782.2)、VvSS5(XM_019226319.1)]、草莓[FaSS1(XM_011462748.1)、FaSS2(XM_011464439.1)、FaSS3(XM_004290765.2)、FaSS4(XM_004287496.2)、FaSS5(XM_004289518.2)、FaSS6(XM_004299431.2)、FaSS7(XM_004301177.2)]、柑橘[CitSus1(XM_025097291.1)、CitSus2(XM_006474620.3)、CitSus3(XM_006479940.3)、CitSus4(XM_015530185.2)、CitSus5(XM_006481888.3)、CitSus6(XM_0064889-70.3)],利用软件MEGA 5.01中的邻接法(Neighborjoining)绘制甜樱桃及其他物种的SS家族氨基酸序列的系统进化树,Bootstrap值设置为1000。
1.3 实时荧光定量PCR(qPCR)分析甜樱桃果实发育过程中PavSS1-6基因的表达
分别收集栽培品种‘布鲁克斯’的果实不同发育期的样品,提取总RNA,并反转录成cDNA,设计特异性引物(表1),进行3次独立的荧光定量PCR,分析甜樱桃PavSS1-6基因的差异表达模式。qPCR反应在ABI7500 PCR 热循环仪(Applied Biosystems,Foster City,CA,United States)上进行,使用TransStart Top Green qPCR SuperMix(北京全式金生物技术有限公司,北京,中国)试剂盒进行反应,以甜樱桃的Histone2(Pav_sc0000671.1)基因为内参进行分析,并进行3次生物学重复,取平均值。
表1 本研究所需的引物信息
Table 1 Primers used in this study

?
1.4 VIGS-PavSS1、VIGS-PavSS6 重组载体的构建及农杆菌转化
pTRV2-PavSS1 和pTRV2-PavSS6 重组载体构建采用In-Fusion Cloning技术。以甜樱桃果实的总RNA 为模板,分别设计带有16 个重叠区域(与经EcoRⅠ和KpnⅠ线性化的pTRV2 片段互为反向互补的接头)的PavSS1 和PavSS6 基因特异性引物对PavSS1-RNAi-F/R和PavSS6-RNAi-F/R(表1),扩增靶标基因片段。然后利用In-FusionTM HD Cloning kit(Clontech,Mount- ain View,CA,United States)分别将PavSS1 和PavSS6 基因的靶标片段连接到经EcoRⅠ和KpnⅠ双酶切线性化的pTRV2 载体上,构建成重组载体,分别命名为pTRV2-PavSS1和pTRV2-PavSS6,并转入大肠杆菌DH5α 感受态中,挑取阳性菌株,经PCR鉴定,双酶切鉴定和测序正确后,分别将pTRV2-PavSS1和pTRV2-PavSS6载体转入农杆菌菌种GV3101中,-80 ℃保存备用。
1.5 VIGS技术瞬时转化甜樱桃果实
甜樱桃果实的VIGS技术参照齐希梁等[17]和Fu等[18]的方法进行,选取花后25 d的甜樱桃果实,采用注射压迫法将含有pTRV2、pTRV2-PavSS1 或pTRV2-PavSS6与pTRV1的混合菌液从果实果柄处注射,看到果实表面颜色改变,表示注射液扩散到果实组织,注射后的甜樱桃果实发育阶段的温度和湿度要相对低,温度不宜超过25 ℃,湿度控制在30%~70%,同时对注射过的果实进行套袋处理,3 d后去除果袋。每次选择1 株健壮的植株,每次每种混合菌液注射60 个果实以上,并进行3 次独立的生物学重复。
1.6 半定量RT-PCR检测
提取甜樱桃果实样品的总RNA,并反转录成cDNA,以甜樱桃的Histone2(Pav_sc0000671.1)基因为内参,对不同样品的cDNA含量进行调节,然后分别利用PavSS1 和PavSS6 基因特异性引物对PavSS1-J-F/R 和PavSS6-J-F/R(表1)检测沉默后相关PavSS1或PavSS6基因的表达水平。
1.7 TRV侵染的甜樱桃果实的果实硬度及花青素、可溶性糖和ABA含量的测定
果实硬度采用GY-4 型硬度计测定,单位为kg·cm-2。每次随机选取5 个果实(不削果皮),每个果实不同部位选2 个点测定,P/2 柱状探头(直径1 mm),测前速度为0.5 mm·s-1,测定速度为1 mm·s-1,测后速度为1 mm·s-1,穿刺深度为10 mm,设3 次重复,取平均值。可溶性固形物含量(%,w)采用手持式糖度仪(PAL-1,爱拓,日本)测定,设3 次重复,取平均值。
花青素的测定参考Cheng等[19]的方法,用1%预冷的盐酸-乙醇溶液在冰上萃取果皮,随后10 000 g离心30 min,4 ℃。利用差异pH测定法测定上清液中总花青素含量。结果用每1 g 鲜质量果实中矢车菊素-3-葡萄糖苷当量表示。
ABA 含量的测定采用高效液相色谱法。准确称取在液氮中研磨成粉末的果肉样品1 g,加入80%(φ,后同)甲醇溶液5 mL,静止10 min,10 000 g离心20 min,上清液过活化后(15 mL 100%甲醇和15 mL 0.4%乙酸预处理过)的C18 Sep-Pak 固相净化柱(Waters Ltd,Mississauga,ON,Canada),用15 mL 10%甲醇-0.4%乙酸从Sep-Pak C18 柱上洗脱下ABA。过0.22 μm 膜过滤后,用HPLC(岛津)进行ABA含量的测定。测定条件为:柱温:35 ℃,流动相为A(甲醇)∶B(水,含1%乙酸)=4∶6;流速:1.0 mL·min-1。ABA约在22 min出现峰值。
可溶性糖(蔗糖、葡萄糖和果糖)含量的测定参考Jia等[20]的方法,并有所改动。称取0.5 g在液氮中充分研磨的樱桃果实粉末,加入80%乙醇的溶液10 mL,80 ℃水浴浸提20 min,10 000 g离心10 min,上清液收集到25 mL的容量瓶中,剩余沉淀重复上述步骤1次。取提取液2 mL 于10 000 g 离心10 min,上清液过0.45 µm HPLC 尼龙网(MEMBRANA,Germany)。然后采用高效液相色谱法(HPLC)测定葡萄糖、果糖和蔗糖含量。糖检测条件:色谱柱:6.5 mm× 300 mm Sugar-Pak TM-1 column(Waters);柱温:60 ℃;检测温度:50 ℃;流动相:超纯水;流速:0.5 mL·min-1;进样体积:20µL。
甜樱桃果实中的花青素、ABA 和可溶性糖(蔗糖、葡萄糖和果糖)含量测定,进行6次生物学重复,每次生物学重复进行3次重复,取平均值。
1.8 数据处理
使用Microsoft Excel 2010软件对所获数据处理并绘图;使用SPSS 17.0软件进行相关性分析和差异显著性(p <0.05)分析。
2 结果与分析
2.1 甜樱桃PavSS家族基因的克隆、系统进化树分析和表达模式分析
为了获得甜樱桃果实的PavSS 家族基因成员,分别以拟南芥的7 个SS 基因(AT1G05560、AT1G73370、AT3G43190、AT4G02280、AT5G20830、AT5G37180 和AT5G49190)的氨基酸序列为Query序列,在甜樱桃基因组数据库(http://cherry.kazusa.or.jp/map.html)中进行BLASP 寻找,获得7 个PavSS 基因家族成员,分别命名为PavSS1(Pav_sc0000129.1_g1710)、PavSS2(Pav_co4071539.1_g010)、PavSS3(Pav_sc0000174.1_g950)、PavSS4(Pav_sc0000130.1_g850)、PavSS5(Pav_sc0000174.1_g960)、PavSS6(Pav_sc0000103.1_g1530)和PavSS7(Pav_sc0001124.1_g380)。
为了确定甜樱桃的PavSS家族基因成员与其他物种的SS 家族成员的进化关系,构建了系统进化树。结果显示,甜樱桃7个PavSS蛋白被聚类到3个亚家族中,其中PavSS1和PavSS2属于一个亚家族,且PavSS1 和PavSS2 同源性极高,相似度达100%;PavSS3、PavSS4和PavSS5属于另外一个亚家族,且PavSS3 和PavSS5 同源性也极高,相似度达100%;PavSS6 和PavSS7 属于第三个亚家族,二者在进化树上位于不同分枝上(图1)。与其他物种的进化树比较发现,PavSS1/PavSS2 与PpSus1、FaSS1、Cit-Sus1 和CitSus2 紧密关联,同源度极高。PavSS3/PavSS5 与PpSus2、PpSus4 和FaSS2 同源度高,PavSS4 与PpSus3 和FaSS3 相似度极高,PavSS6 与PpSus6、FaSS6 和FaSS7 相似度极高,PavSS7 与PpSus5和FaSS5相似度极高(图1)。
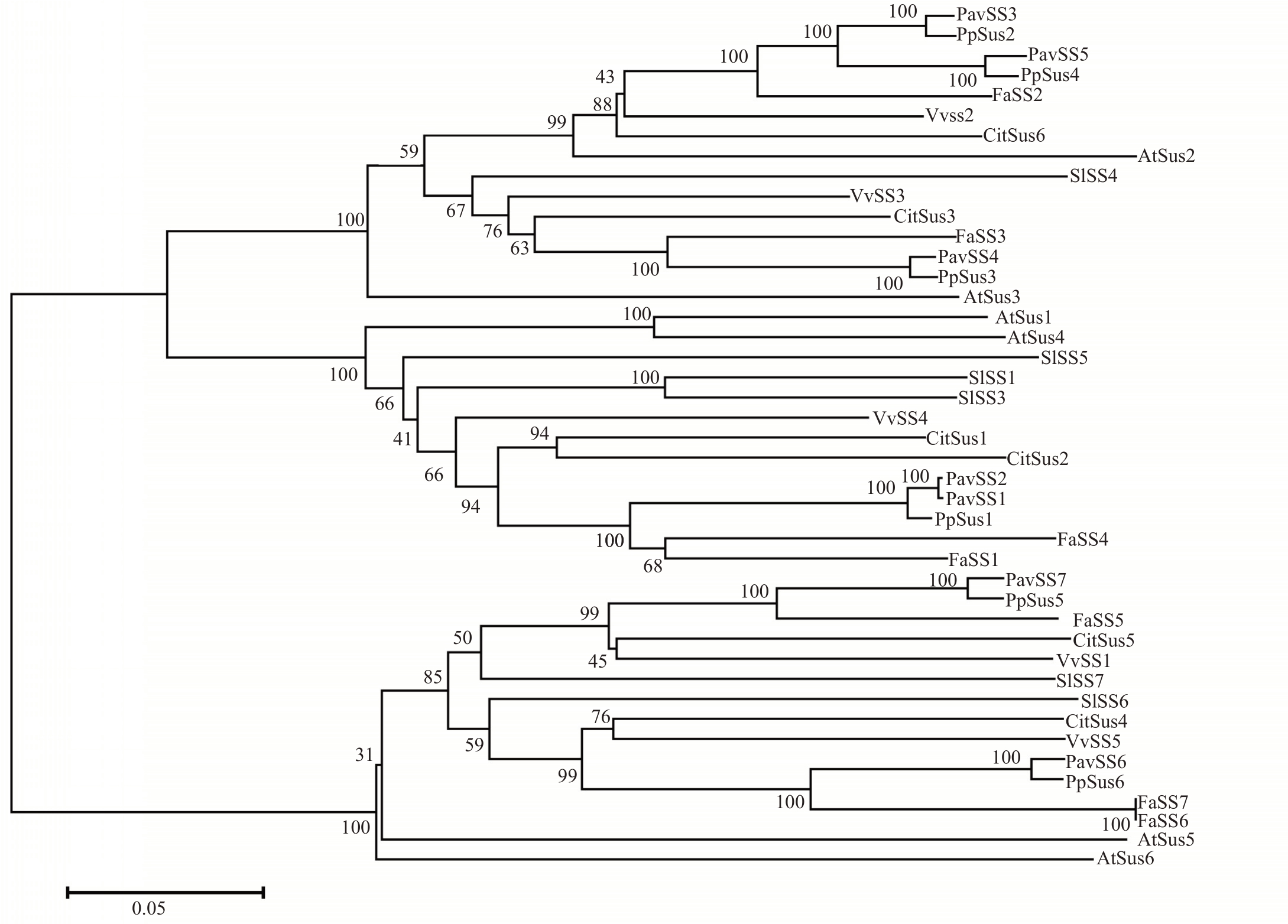
图1 甜樱桃PavSS 与其他植物的SS 家族氨基酸的系统进化树分析
Fig.1 Phylogenetic analysis of the Prunus avium PavSS proteins and SS orthologs in other plant species
利用实时荧光定量(qRT-PCR)分析甜樱桃果实发育与成熟过程中PavSS1-7 基因的表达特征。结果显示,PavSS1基因在甜樱桃整个果实发育和成熟过程中均高表达,从花后7 d开始,表达量逐渐升高,花后21 d 表达量有个峰值,随后在果实发育后期和成熟过程中表达量逐渐降低(图2-A)。PavSS2基因表达模式与PavSS1基因基本类似,表现为前期逐渐升高,后期逐渐降低,但在甜樱桃果实成熟和发育过程中表达量均较低,是PavSS1 基因表达的1/10(图2-B)。PavSS3 和PavSS5 基因在甜樱桃果实发育和成熟过程中均表达,但表达量均较低,且在整个果实发育和成熟过程中表达量差异不显著(图2-C,E)。PavSS4 基因在果实发育初期表达量较高(0~14 d),在花后14 d 表达量最高,在果实发育后期和成熟过程中,表达量都较低,在花后42 d表达量最低(图2-D)。PavSS6基因在果实发育初期表达量较低(0~35 d),在果实发育后期表达量逐渐升高,花后49 d 表达量最高(图2-F)。PavSS7基因在整个果实发育过程中均表达,但表达量均较低,在花后7 d和花后28 d出现两个峰值,果实成熟过程中,表达量较低(图2-G)。综上,PavSS1、PavSS2和PavSS6基因的表达模式与甜樱桃果实的成熟过程较吻合,可能在果实成熟中起重要作用。

图2 PavSS1-7 基因在果实发育中的表达模式
Fig.2 Expression profile of PavSS1-7 during fruit growth and development of sweet cherry
2.2 外施蔗糖对甜樱桃PavSS 基因表达模式的影响
前期研究证实外源蔗糖可作为一个信号分子,促进番茄和草莓果实成熟[12-13]。为了进一步确定哪一个(或几个)PavSS 基因影响甜樱桃果实成熟软化,通过外施蔗糖调控甜樱桃果实PavSS 基因的表达进而影响果实的成熟软化。结果显示,与山梨醇处理(阴性对照)的甜樱桃果实相比,蔗糖处理6 h后,甜樱桃果实中PavSS1 的表达上调,是阴性对照的1.4倍;随后蔗糖处理12 h、24 h和48 h后,甜樱桃果实中PavSS1 的表达下调,是阴性对照的70%~80%(图3)。类似地,蔗糖处理的甜樱桃果实中PavSS6基因的表达与阴性对照相比,表达趋势也是先上调后下调。而蔗糖处理的甜樱桃果实中PavSS2、PavSS3、PavSS4、PavSS5 和PavSS7 基因的表达与阴性对照相比,均无变化(图3)。上述结果表明,PavSS1、和PavSS6 基因可能是蔗糖合成过程中的关键基因,或许影响甜樱桃果实成熟。

图3 蔗糖对PavSS1-7 家族基因表达的影响
Fig.3 Effect of sucrose on the PavSS1-7 gene expression
*表示达到显著性差异水平(p <0.05)。下同。
*indicates significant differences at p <0.05.The same below.
2.3 TRV 介导PavSS1 和PavSS6 基因沉默的表型观察
为了确定PavSS1 和PavSS6 基因是否调控甜樱桃果实成熟软化功能,通过病毒诱导基因沉默技术,将含有TRV::00(空白对照)和TRV::PavSS1 和TRV::PavSS6的农杆菌菌液分别侵染甜樱桃栽培种‘布鲁克斯’。14 d 后提取侵染果实的总mRNA 进行半定量PCR 检测。结果发现,与TRV::00 侵染的甜樱桃果实相比,TRV::PavSS1 和TRV::PavSS6 侵染甜樱桃果实中PavSS1 和PavSS6 基因的表达量显著降低(图4-A),基因沉默效率超过85%,表明PavSS1 和PavSS6基因分别被有效地沉默。
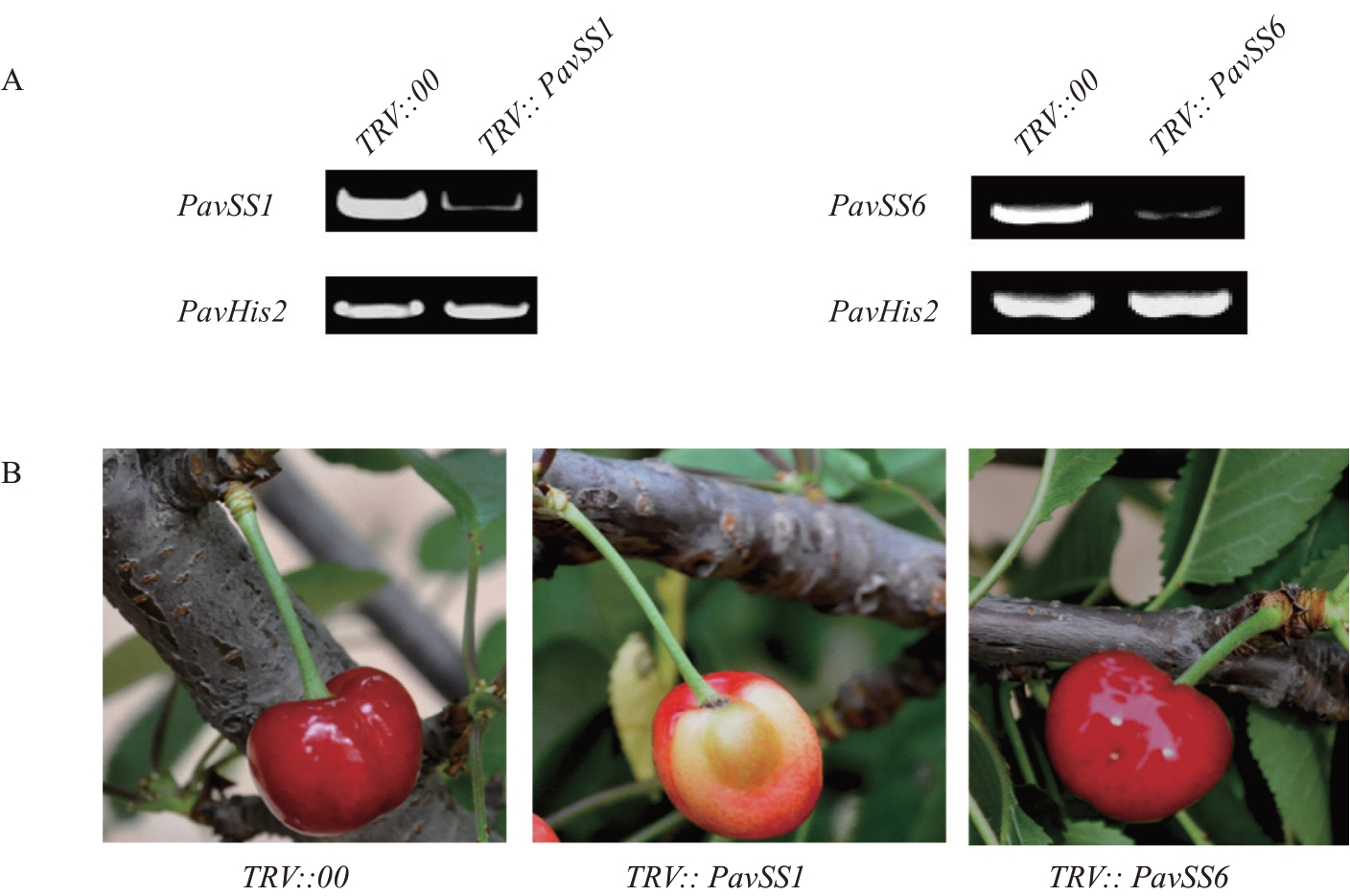
图4 甜樱桃果实PavSS1 和PavSS6 基因相对表达量变化及基因沉默后甜樱桃果实的表型
Fig.4 Quantify of PavSS1 and PavSS6 genes in sweet cherry fruit using semi-quantitative RT-PCR and Phenotype observation of TRV::00-,TRV::PavSS1-,and TRV::PavSS6-silenced sweet cherry fruit
侵染21 d,表型观察发现:TRV::PavSS1 侵染的甜樱桃果实与对照TRV::00 相比,表皮呈浅红色或者黄白色(黄绿色),TRV::00侵染的果实的表皮颜色呈深红色。而TRV::PavSS6侵染的甜樱桃果实的表皮颜色也呈深红色,与对照相比,果实表型没有显著变化(图4-B)。上述结果表明,沉默PavSS1 基因延迟果实着色和果实成熟,暗示PavSS1可能调控甜樱桃果实成熟。
2.4 TRV 介导PavSS1 和PavSS6 基因沉默的甜樱桃果实成熟软化的功能分析
为了进一步明确PavSS1 是否调控甜樱桃果实成熟软化,笔者分析了花后55 d(空载对照侵染的甜樱桃完全成熟),TRV::PavSS1 和TRV::PavSS6 侵染的甜樱桃果实成熟软化的特征指标,包括花青素含量、ABA 含量、可溶性糖(果糖、葡萄糖、蔗糖)含量和果实硬度。还评估了与成熟相关的一些基因的表达量变化,包括ABA 合成与降解的关键基因PavNCED1,影响果实硬度的相关基因PavPG1、PavXYL1 和PavPL1,影响花青素合成的相关基因PavPAL、PavCHS、PavANS 和PavDFR。结果显示,与对照TRV::00 相比,TRV::PavSS1 侵染的甜樱桃果实中花青素含量与ABA含量显著降低(图5-A~B),表明PavSS1 基因控制甜樱桃的果皮着色。可溶性糖(果糖、葡萄糖、蔗糖)含量的测定结果表明,与对照TRV::00 相比,TRV::PavSS1 侵染的甜樱桃果实中蔗糖含量显著降低,相反地,果糖含量显著提高,而葡萄糖含量变化不显著(图5-C),表明PavSS1 是调控蔗糖合成的关键基因。TRV::PavSS1 侵染的甜樱桃果实的果实硬度显著低于空白对照TRV::00侵染的甜樱桃果实(图5-D),表明PavSS1 基因影响甜樱桃果实软化。然而TRV::PavSS6侵染的甜樱桃果实的花青素含量、ABA 含量、果实硬度以及可溶性糖(果糖、葡萄糖、蔗糖)含量与空白对照TRV::00侵染的甜樱桃果实相比,没有显著变化。
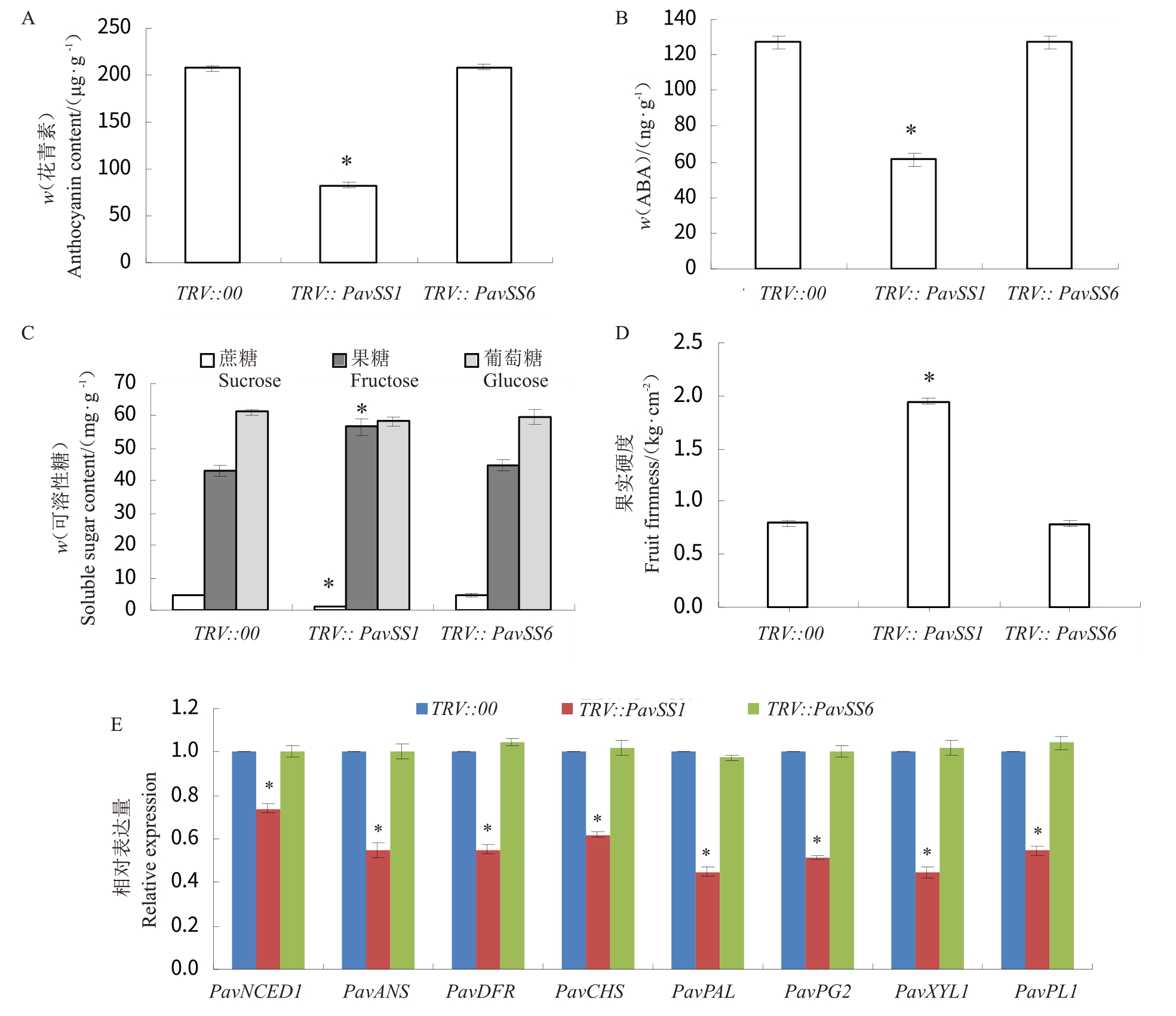
图5 PavSS1 和PavSS6 沉默的甜樱桃果实中花青素含量(A)、ABA 含量(B)、可溶性糖含量(C)、果实硬度(D)以及成熟相关基因的表达量(E)的变化
Fig.5 Effect of silencing of PavSS1 and PavSS6 in sweet cherry fruits on anthocyanin content(A),ABA content(B),
soluble sugar content(C),fruit firmness(D)and expression of the ripening-related genes(E)compared with levels in control fruit
与对照TRV::00 相比,TRV::PavSS1 侵染的甜樱桃果实中成熟相关的基因PavNCED1、PavPG1、PavXYL1、PavPL1、PavPAL、PavCHS、PavANS 和PavDFR的表达显著下调,而TRV::PavSS6侵染的甜樱桃果实中成熟相关的基因表达没有显著变化(图5-E)。上述研究结果表明,甜樱桃PavSS1调控果实着色和成熟软化。
3 讨 论
甜樱桃果实发育过程中,可溶性糖含量随果实的生长发育不断增加,尤其在果实成熟期间增加幅度更大,暗示糖积累在果实发育和品质形成过程中起着重要的作用[13]。笔者分析了蔗糖代谢过程中蔗糖合成的关键酶——蔗糖合成酶(SS)在甜樱桃果实发育与成熟过程中的分子功能。研究结果表明,PavSS1 与PavSS2 基因在甜樱桃果实膨大与成熟过程中一直稳定且持续表达,PavSS1基因的表达量是PavSS2 基因的10 倍以上;PavSS6 基因在果实发育后期与成熟过程中高表达,与甜樱桃果实成熟有较好的关联。而且外源蔗糖可抑制PavSS1 和PavSS6基因表达,进一步通过VIGS 技术沉默甜樱桃果实PavSS1 和PavSS6 基因表达,仅沉默PavSS1 基因抑制了果实成熟,包括果实硬度、ABA含量、花色苷含量和可溶性糖含量发生显著变化以及成熟相关基因的表达量显著下调。由此笔者确定PavSS1 基因是甜樱桃果实蔗糖合酶的关键基因,调控甜樱桃果实成熟。在草莓和番茄等园艺作物的研究中确定外源蔗糖可通过调控果实中ABA 信号途径促进果实成熟,而且明确了多个蔗糖代谢过程中的关键基因影响果实成熟,如草莓的FaSS1[8]、FaSUT1[12]、FaCHLH/ABAR[20]和FaASR[13]基因,番茄的SlVIF[21]和SlASR1[13]等基因。外施蔗糖下调了草莓蔗糖代谢过程中FaSS1 和FaSUT1 基因的表达[8,12],笔者发现外施蔗糖后,甜樱桃果实中PavSS1 和PavSS6 基因的表达先上调,然后显著下调,这可能与蔗糖合酶的双功能酶(合成和分解蔗糖)的属性有关,外施蔗糖可能先激活了蔗糖合酶的分解功能,表现为上调表达,随后表现出蔗糖合酶的合成功能,基因下调表达。
植物激素与糖的积累在果实成熟过程中起决定性的作用,且在果实成熟过程中,果实中ABA和蔗糖含量逐渐升高[20,22- 23]。笔者研究发现PavSS1 基因在甜樱桃转色期(花后30 d)表达急剧下调,随后表达量上调,并维持在较高的表达水平。PavSS1 基因急剧下调暗示了PavSS1 基因在果实发育中的重要作用,笔者推测其急剧下调可能与甜樱桃果实中ABA 和蔗糖含量急速升高有关,因为PavSS1 基因的表达受蔗糖和ABA 的抑制,同时在沉默PavSS1 基因的甜樱桃果实中,ABA 和蔗糖含量降低,导致了延迟甜樱桃果实成熟,表明蔗糖或许是调控甜樱桃果实成熟的信号分子。类似地,草莓中FaSS1 基因表达量在果实转白期间也急剧下降,或许与果实中ABA 和蔗糖含量升高有关。进一步研究确定蔗糖可充当一种信号分子,诱导果实成熟和ABA 积累,位于ABA信号通路的上游,但是蔗糖信号途径仅是辅助ABA 信号途径调控果实成熟[12-13,20]。
4 结 论
探明了甜樱桃PavSS1 基因是果实蔗糖合成酶关键基因,其在甜樱桃果实着色和果实成熟软化过程中起极其重要的作用,为研究甜樱桃果实成熟软化的分子机制奠定理论基础。
[1] WIND J,SMEEKENS S,HANSON J. Sucrose: metabolite and signaling molecule[J]. Phytochemistry,2010,71(14/15): 1610-1614.
[2] JIANG Y,GUO W,ZHU H,RUAN Y L,ZHANG T. Overexpression of GhSusA1 increases plant biomass and improves cotton fiber yield and quality[J]. Plant Biotechnology Journal,2012,10(3):301-312.
[3] KOCH K E,WU Y,XU J. Sugar and metabolic regulation of genes for sucrose metabolism: potential influence of maize sucrose synthase and soluble invertase responses on carbon partitioning and sugar sensing[J]. Journal of Experimental Botany,1996,47:1179-1185.
[4] RUAN Y L,CHOUREY P S,DELMER D P,PEREZ-GRAU L.The differential expression of sucrose synthase in relation to diverse patterns of carbon partitioning in developing cotton seed[J].Plant Physiology,1997,115(2):375-385.
[5] HOU J,JIANG Q,HAO C,WANG Y,ZHANG H,ZHANG X.Global selection on sucrose synthase haplotypes during a century of wheat breeding[J].Plant Physiology,2014,164:1918-1929.
[6] LI J,BAROJA-FERNÁNDEZ E,BAHAJI A,MUÑOZ F J,OVECKA M,MONTERO M,SESMA M T,ALONSOCASAJÚS N,ALMAGRO G,SÁNCHEZ-LÓPEZ A M,HIDALGO M,ZAMARBIDE M,POZUETA-ROMERO J. Enhancing sucrose synthase activity results in increased levels of starch and ADP-glucose in maize (Zea mays L.) seed endosperms[J].Plant and Cell Physiology,2013,54(2):282-294.
[7] ISLAM M Z,HU X M,JIN L F,LIU Y Z,PENG S A.Genomewide identification and expression profile analysis of citrus sucrose synthase genes: investigation of possible roles in the regulation of sugar accumulation[J]. PLoS One,2014,9(11):e113623.
[8] ZHAO C,HUA L,LIU X,LI Y,SHEN Y,GUO J.Sucrose synthase FaSS1 plays an important role in the regulation of strawberry fruit ripening[J]. Plant Growth Regulation,2017,81(1):175-181.
[9] ZHANG C,YU M,MA R,SHEN Z,ZHANG B,KORIR N K.Structure,expression profile,and evolution of the sucrose synthase gene family in peach(Prunus persica)[J].Acta Physiologiae Plantarum,2015,37(4):81.
[10] ZHU X,WANG M,LI X,JIU S,WANG C,FANG J. Genomewide analysis of the sucrose synthase gene family in grape(Vitis vinifera): Structure,evolution,and expression profiles[J].Genes,2017,8(4):111.
[11] 吕佳红,王英珍,程瑞,王国明,张绍铃,吴俊,张虎平.梨蔗糖合成相关酶SUS 和SPS 基因家族的鉴定与表达分析[J].园艺学报,2018,45(3):421-435.LÜ Jiahong,WANG Yingzhen,CHENG Rui,WANG Guoming,ZHANG Shaoling,WU Jun,ZHANG Huping. Genome-wide identification and expression analysis of sucrose synthase (SUS)and sucrose phosphate synthase (SPS) gene families in pear[J].Acta Horticulturae Sinica,2018,45(3):421-435.
[12] JIA H,WANG Y,SUN M,LI B,HAN Y,ZHAO Y,LI X,DING N,LI C,JI W,JIA W. Sucrose functions as a signal involved in the regulation of strawberry fruit development and ripening[J].New Phytologist,2013,198(2):453-465.
[13] JIA H,JIU S,ZHANG C,WANG C,TARIQ P,LIU Z,WANG B,CUI L,FANG J. Abscisic acid and sucrose regulate tomato and strawberry fruit ripening through the abscisic acid-stress-ripening transcription factor[J].Plant Biotechnology Journal,2016,14(10):2045-2065.
[14] TIAN L,JIA H,LI C,FAN P,XING Y,SHEN Y.Sucrose accumulation during grape berry and strawberry fruit ripening is controlled predominantly by sucrose synthase activity[J]. Journal of Horticultural Science and Biotechnology,2012,87:661-667.
[15] LI B,XIE Z,ZHANG A,XU W,ZHANG C,LIU Q,LIU C,WANG S.Tree growth characteristics and flower bud differentiation of sweet cherry (Prunus avium L.) under different climate conditions in China[J].Horticultural Science,2010,37(1):6-13.
[16] PRINSI B,NEGRI A S,ESPEN L,PIAGNANI M C. Proteomic comparison of fruit ripening between‘Hedelfinger’sweet cherry (Prunus avium L.) and its somaclonal variant‘HS’[J]. Journal of Agricultural and Food Chemistry,2016,64(20): 4171-4181.
[17] 齐希梁,李明,刘聪利,宋露露. TRV 介导欧洲甜樱桃果实VIGS 体系的建立[J].果树学报,2018,35(11):1309-1315.QI Xiliang,LI Ming,LIU Congli,SONG Lulu. Construction of TRV-mediated virus induced gene silencing (VIGS) system in sweet cherry fruit[J]. Journal of Fruit Science,2018,35(11):1309-1315.
[18] FU D Q,ZHU B Z,ZHU H L,JIANG W B,LUO Y B.Virus-induced gene silencing in tomato fruit[J].The Plant Journal,2005,43(2):299-308.
[19] CHENG G W,BREEN P J.Activity of phenylalanine ammonialyase (Pal) and concentrations of anthocyanins and phenolics in developing strawberry fruit[J]. Journal of the American Society for Horticultural Science,1991,116(5):865-869.
[20] JIA H,CHAI Y,LI C,LU D,LUO J,QIN L,SHEN Y.Abscisic acid plays an important role in the regulation of strawberry fruit ripening[J].Plant Physiology,2011,157(1):188-199.
[21] QIN G,ZHU Z,WANG W,CAI J,CHEN Y,LI L,TIAN S.A tomato vacuolar invertase inhibitor mediates sucrose metabolism and influences fruit ripening[J]. Plant Physiology,2016,172(3):1596-1611.
[22] CHAI Y,ZHANG Q,TIAN L,LI C,XING Y,QIN L,SHEN Y.Brassinosteroid is involved in strawberry fruit ripening[J]. Plant Growth Regulation,2013,69:63-69.
[23] SUN J,DONG Y,LI C,SHEN Y. Transcription and enzymatic analysis of beta-glucosidase VvBG1 in grape berry ripening[J].Plant Growth Regulation,2015,75(1):67-73.