葡萄是世界上栽培面积最为广泛、人们最喜爱和加工产品最为丰富的水果之一。一年两收栽培是通过打破葡萄的正常生理周期,将本应在第二年春季萌发的冬芽在当年夏季修剪并用破眠剂打破休眠,当年抽生新梢,开启第二个生育周期并获得第二季冬果[1-3],达到增产与延长葡萄供应期等目的的有效途径[4]。广西地处亚热带气候区,冬季较短,夏季较长,年平均气温为16~23 ℃,≥10 ℃的有效年积温为5 036.7~8 017.4 ℃,全年无霜期多在300 d 以上,适合研究和推广葡萄一年两收栽培技术[5-6]。但是由于受到广西上半年多雨、少日照等自然条件的限制,部分品种生长旺盛,二季果成花不稳定或成花很少,在一定程度上阻碍了葡萄一年两收栽培技术的推广和优良品种的引进[7]。‘夏黑’葡萄是一年两收栽培种植较广的早熟葡萄品种之一,但是冬芽分化不良、成花不稳定,严重影响两收栽培的稳产、丰产[6,8-9]。林玲等[10]通过切片观察发现,‘夏黑’葡萄新梢第5~6节位冬芽分化集中,成花率较高,且从初花期到盛花期,大多数冬芽处于始分化期(始原基形成关键期),坐果期冬芽处于花原始体发育期到花序第一穗轴发育期(始原基分化关键期)。
葡萄成花诱导中的激素含量分析结果表明,细胞分裂素(CK)和赤霉素(GAs)是影响葡萄冬芽形成的两种主要激素。CK 会诱导离体培养的幼嫩卷须分枝,并长出花序样组织,而且在施加到茎尖时,CK 会促进新形成的始原基发育成花序而不是卷须[11-12]。此外,高浓度的GA3会造成主芽坏死,从而使副芽代替主芽而间接影响成花,因此,新梢旺长时坏死芽多[13]。前期研究结果表明,矮壮素(CCC)作为GAs的一种拮抗剂,用其对‘夏黑’葡萄叶片进行喷施处理,可以在花前3 d 和花后4 d 降低新梢5~6节位冬芽内ZR/GAS比例,在花后11 d 提高ZR/GAs比例,最终增加二季果的成花率[14]。但CCC处理增加二季果成花率的分子机制尚不明确,因此笔者通过转录组测序技术对CCC 处理后‘夏黑’葡萄二季果冬芽分化关键时期的差异基因进行分析,以期从分子生物学的角度进一步深入研究葡萄成花调控的机制,为葡萄的产期调节,尤其是一年两收栽培模式下二季果的生产提供理论指导,更好地为葡萄产业服务。
1 材料和方法
1.1 材料
供试品种为2014 年定植在广西壮族自治区农业科学院明阳双季葡萄示范园内的‘夏黑’葡萄,V形架避雨栽培,整形方式为“一”字形,栽植密度为2.5 m×1.5 m,南北行向,滴灌。CCC(纯度98%)购自北京索莱宝科技有限公司。RNA 提取试剂盒为SpectrumTMPlant Total RNA Kit 50 Prep,Sigma。
1.2 方法
1.2.1 CCC 处理和样品采集 CCC 处理‘夏黑’葡萄叶片2次,分别在花前10 d和花前1 d进行,对‘夏黑’葡萄全株叶片喷施0.5 g·L-1 CCC。对照植株喷施纯净水。在对照和CCC处理的植株上,当主梢第14 枚叶片展平时,摘除其顶端,所有副梢全部抹除。于第一次CCC 处理后7、14 和21 采样,分别为一季果花前3 d,花后4 d 和11 d(DAF 表示花后天数,-3 DAF和4 DAF是始原基形成关键期,11 DAF是始原基分化关键期)。采集‘夏黑’葡萄用于二季果生长的第5、6节位的冬芽,每个时间点从6株植株上采集60 个冬芽作为1 个样品,每个处理3 次重复。所有冬芽采集后迅速在液氮中速冻,并保存在-80 ℃冰箱中。所有样品用来进行RNA-Seq建库和测序分析。
1.2.2 葡萄RNA 的提取 葡萄冬芽总RNA 采用SpectrumTM植物总RNA 提取试剂盒进行提取,然后用不含RNA酶的DNA酶去除基因组DNA。
1.2.3 转录组文库构建及测序 转录组文库构建参照Zhong 等[15]的方法,利用dUTP 法构建Strand specific RNA-Seq 文库,并使用Illumina HiSeq 2000 平台对所建文库进行转录组测序。
1.2.4 差异表达基因的鉴定和比较分析 首先,利用Top Hat 对转录组测序最终获得的高质量序列与葡萄参考基因组进行比对,根据比对结果参照V0版本的基因模型计算每个基因的原始表达量[16]。其次根据比对得到的mapped reads数与基因长度及比对到所有基因上的总reads数计算FPKM(fragments per kilobase of transcript per million fragments mapped)值,分析差异基因的表达量。然后应用DESeq 软件包处理原始表达数据[17],获得两个时间点之间每个基因的原始P 值,经false discovery rate(FDR)多重校正获得corrected P 值[18]。最后将corrected P 值<0.05,两个时间点之间的FPKM比值≥2或者≤0.5的基因鉴定为上调或者下调的差异表达基因。
利用在线分析工具Calculate and draw custom Venn diagrams (http://bioinformatics.psb.ugent.be/webtools/Venn/)获得不同样品间差异表达基因的交集和差集。
1.2.5 差异表达基因Gene Ontology(GO)分析和富集分析 将差异表达基因提交到在线分析工具Plant Met Gen MAP 和Blast2Go 系统计算每个GO term 的基因数,从而得到具有某个GO 功能的基因列表及基因数目。然后应用超几何检验,找出与整个基因组背景相比,在差异表达基因中显著富集的GO条目。计算得到的P-value通过FDR校正之后,以P-value≤0.05 为阈值,满足此条件的GO term 定义为在差异表达基因中显著富集的GO term。通过GO功能显著性富集分析来确定差异表达基因行使的主要生物学功能。
1.2.6 差异表达基因KEGG Pathway分析和富集分析 在生物体内,不同基因相互协调行使其生物学功能,基于Pathway 的分析有助于更进一步了解基因的生物学功能。KEGG 是有关Pathway 的主要公共数据库。Pathway显著性富集分析以KEGG Pathway为单位,应用超几何检验,找出与整个基因组背景相比,在差异表达基因中显著性富集的Pathway。经过多重检验校正后,选择P value≤0.05 的Pathway定义为在差异表达基因中显著富集的Pathway。
1.2.7 差异基因表达模式聚类分析 对不同处理同一个时间点之间的差异表达基因取并集,利用Genesis 软件中的K-means 方法[19]对这些差异表达基因进行表达模式聚类分析,了解CCC处理对‘夏黑’葡萄冬芽分化过程中基因表达水平的影响。
1.3 差异基因实时荧光定量PCR验证
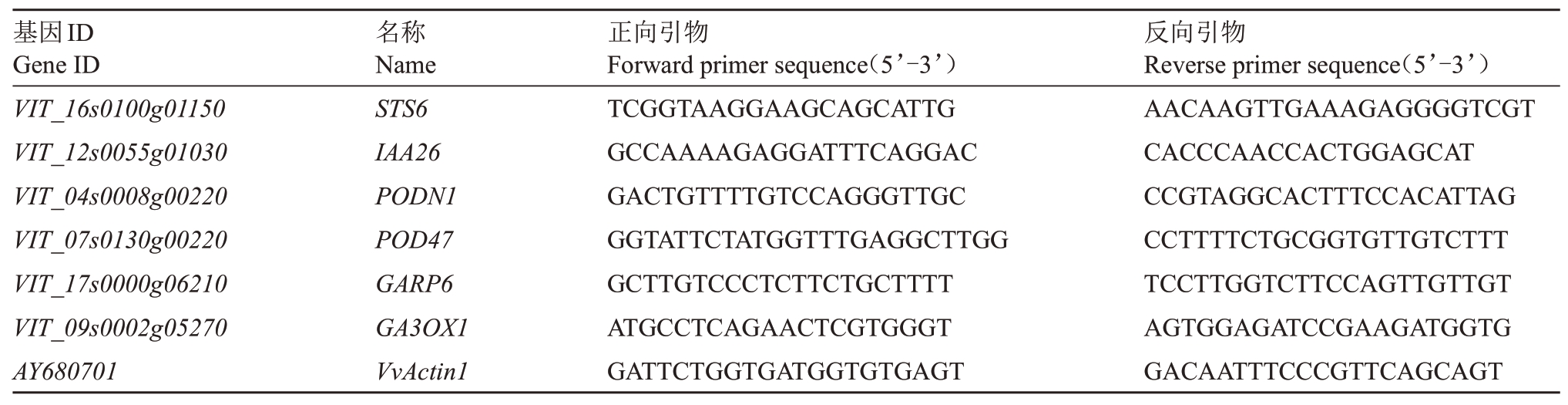
用PrimeScriptTM RTase 试剂盒(TaKaRa,大连)反转录合成cDNA,qRT-PCR 使用LightCycler®480 SYBR® Green 1 Master 试剂盒(Roche,瑞士),采用20 μL 反应体系:cDNA 模板1 μL,2×SYBR Green Mix 10 μL,上下游引物(10 μmol·L-1)各1 μL,超纯水7 μL。qRT-PCR 在LightCycler®480 Real-Time PCR仪(Roche,瑞士)上进行,反应程序为:95 ℃预变性1 min,95 ℃10 s,55 ℃30 s,72 ℃30 s,40个循环。利用Primer 6 软件设计qRT-PCR 引物,设计好的引物(表1)由奥科公司合成。内参基因为葡萄Actin1。基因的表达量采用相对定量的方法,即2-ΔΔCT法[20]。
表1 CCC 处理后‘夏黑’葡萄二季果冬芽qRT-PCR 引物序列
Table 1 The sequences of the primers for qRT-PCR of latent bud differentiation of the second crop
of CCC treated‘Summer Black’
?
2 结果与分析
2.1 CCC 处理后‘夏黑’葡萄二季果冬芽分化不同时期的转录组测序结果统计
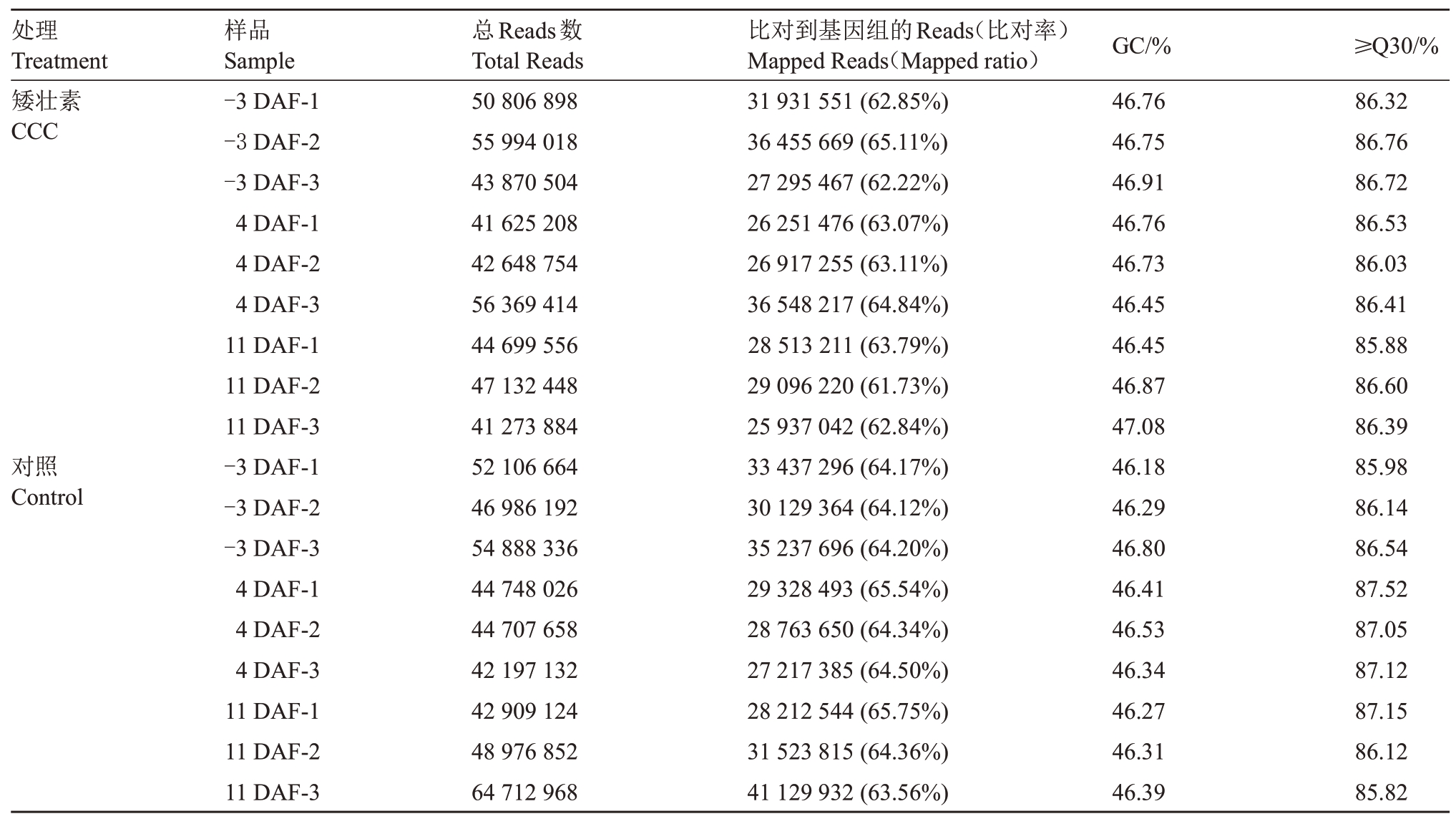
转录组测序结果显示,对照在3 个时期分别获得153 981 192、131 652 816 和156 598 944 总Reads数,CCC 处理在3 个时期分别获得150 671 420、140 643 376 和133 105 888 总Reads 数,这些高质量的reads与‘黑比诺’葡萄基因组的匹配率为61.73%~65.75%(表2)。CCC处理和对照3个时期共18个样本的GC 含量为46.18%~47.08%,较为一致(表2)。18个样本Q30百分比(评价质量值≥30的cycle所占的比例)≥85.82%,测序数据质量较高,可以满足后续分析的要求。
表2 CCC 处理和对照二季果冬芽分化不同时期转录组测序样本Reads 数量和序列比对率
Table 2 Number of clean reads and mapping ratio at different stages of latent bud differentiation of the second crop of control and CCC treated‘Summer Black’
?
2.2 CCC 处理后‘夏黑’葡萄二季果冬芽分化关键时期差异表达基因筛选
在-3 DAF,4 DAF 和11 DAF,CCC 处理和对照之间差异表达的基因数目分别为395、557 和97个。在3 个时期,CCC 处理后上调表达的基因数分别是52、21、39 个,下调表达的基因数分别是343、536、58 个,下调表达的基因数均比上调表达的基因数高,且CCC 处理对冬芽内基因表达水平的影响在4 DAF 最强,然后逐渐减弱(图1-A)。同一时期CCC 处理和对照之间的差异基因重叠情况如图1-B~C所示。
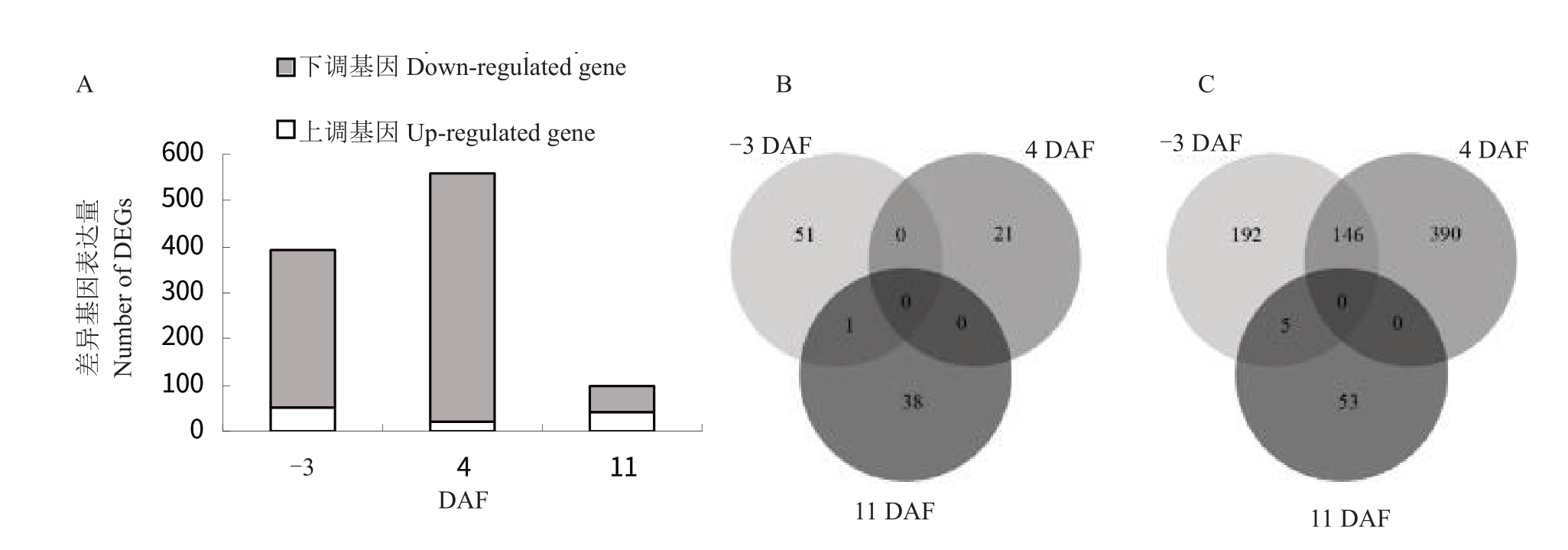
图1 ‘夏黑’葡萄二季果冬芽分化不同时期CCC 处理和对照之间基因表达比较
Fig.1 Comparison of gene expression at different stages of latent bud differentiation of the second crop between CCC treated‘Summer Black’and control
A.不同时期CCC 处理和对照之间差异基因的数量(P 值≤0.05,倍数≥2);B.不同时期CCC 处理后上调表达基因的韦恩图;C.不同时期CCC 处理后下调表达基因的韦恩图。
A.Number of differentially expressed genes(DEGs,P value ≤0.05 and fold-change≥2)between CCC treated Summer Black and control;B.Venn diagram showing the relationship of up-regulated DEGs identified in the CCC treated Summer Black at different stages; C. Venn diagram showing the relationship of down-regulated DEGs identified in the CCC treated Summer Black at different stages.
2.3 CCC 处理后‘夏黑’葡萄二季果冬芽分化关键时期差异基因的表达模式聚类分析
从图2 可以看出,对CCC 处理和对照之间不同时期的所有差异基因取并集,共获得879 个差异基因,cluster 1、5、6、7 和8 中的基因在-3 DAF 和4 DAF下调表达,cluster 2、3、4和9中的基因在4 DAF下调表达。CCC 处理后差异基因的表达趋势与对照相似,大多数差异基因的表达量比对照低。
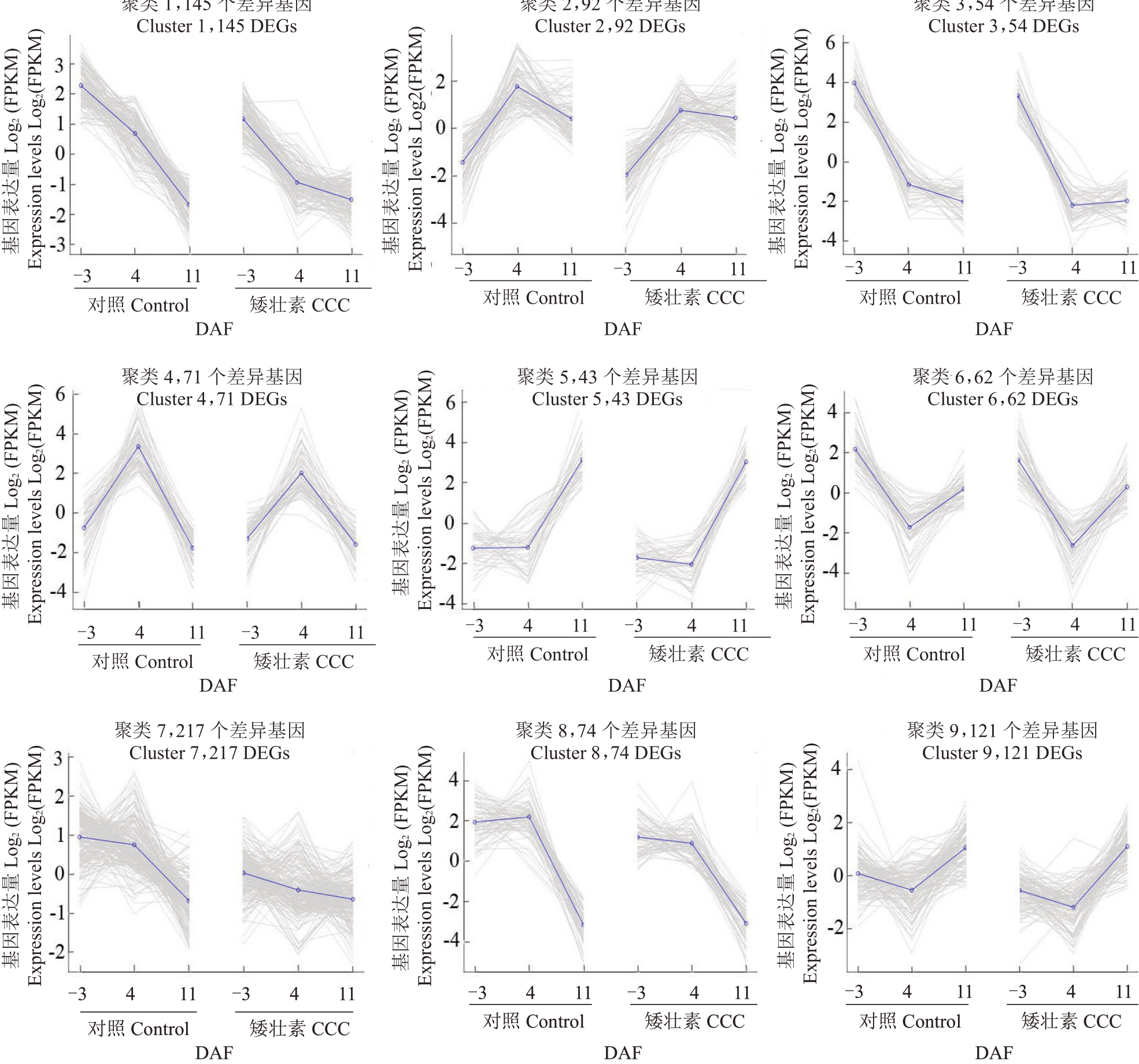
图2 CCC 处理后‘夏黑’葡萄二季果冬芽分化不同时期差异基因的表达模式聚类分析
Fig.2 Clustering of the expression profiles of DEGs at different stages of latent bud differentiation of the second crop between CCC treated‘Summer Black’and control
X 轴表示处理和采样时期,Y 轴表示经过Log2 转换的差异基因表达量,每一类编号后面的数值表示该类中差异基因的数目。
The X-axis indicates treatments and sampled stages,the Y-axis indicates the Log2-transformed expression levels of DEGs,the number of genes in each cluster is listed after each cluster ID.
2.4 CCC 处理后‘夏黑’葡萄二季果冬芽分化不同时期差异表达基因的GO功能分类
对CCC 处理后‘夏黑’葡萄二季果冬芽分化不同时期与对照之间的差异表达基因进行GO生物过程功能分类,并将其分为生物学过程、分子功能和细胞成分3 类(图3)。结果表明,在CCC 处理后‘夏黑’葡萄二季果冬芽分化的不同时期,参与细胞组分的差异表达基因数目最多,参与细胞和细胞过程的差异表达基因数目次之,还有一些参与信号-生物过程、代谢过程、刺激响应、细胞器、结合、催化活性、生物调节、发育过程、定位、细胞成分组成或生物合成、多细胞生物过程、多生物过程、信号和膜等的差异基因。
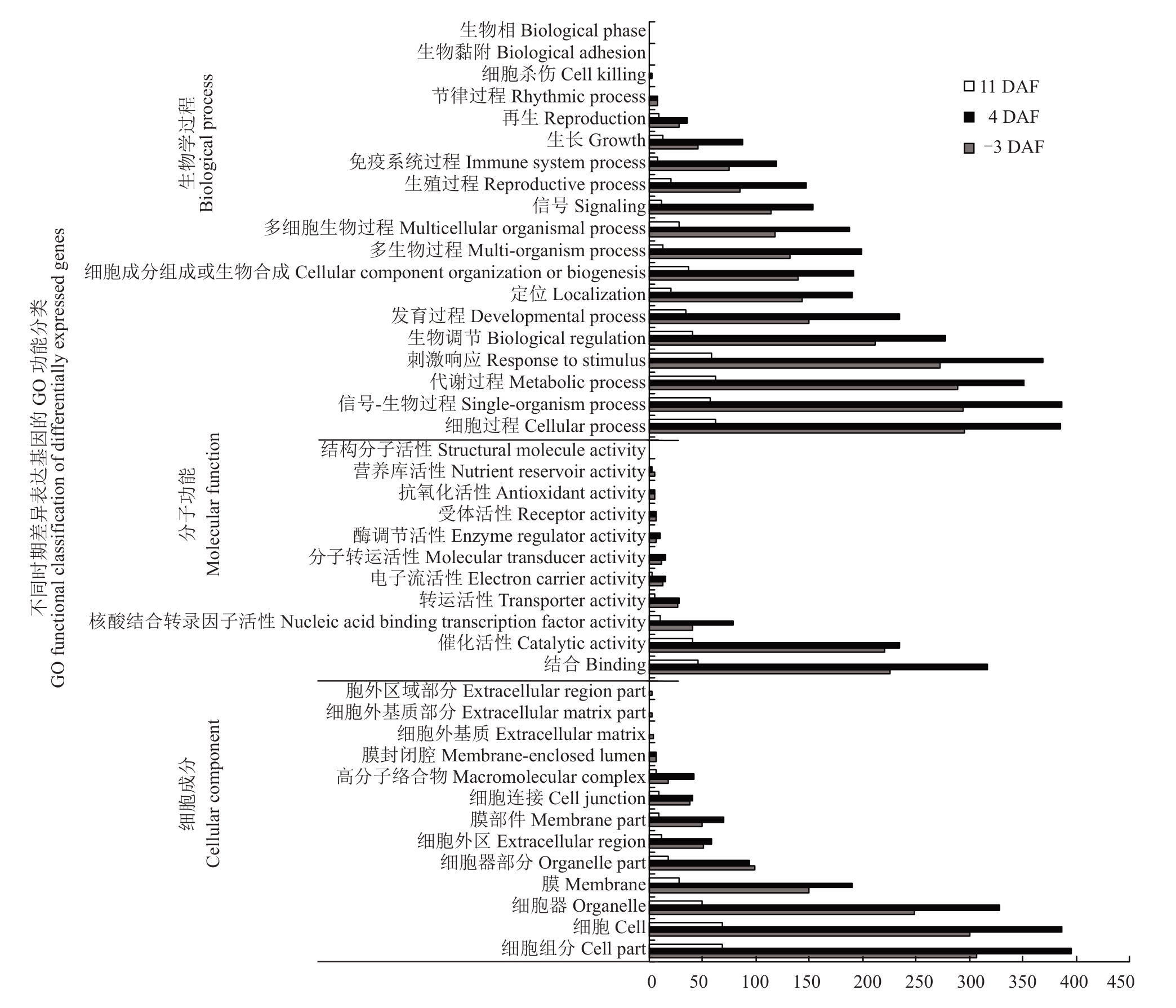
图3 CCC 处理后‘夏黑’葡萄二季果冬芽分化不同时期差异表达基因的GO 功能分类
Fig.3 Functional categorization of DEGs at different stages of latent bud differentiation of the second crop between CCC treated‘Summer Black’and control based on Gene Ontology(GO)
2.5 CCC 处理后‘夏黑’葡萄二季果冬芽分化不同时期差异表达基因的代谢通路富集性分析
对CCC 处理后‘夏黑’葡萄二季果冬芽分化不同时期与对照之间的差异表达基因进行了合成和代谢通路富集性分析。如图4 所示,-3 DAF 时,CCC处理与对照之间的差异表达基因显著富集的通路大多数与苯丙素生物合成、植物激素信号转导、α-亚麻酸代谢、苯丙氨酸代谢、谷胱甘肽代谢、植物与病原菌互作以及植物生物钟相关。4 DAF 时,CCC 处理与对照之间的差异表达基因显著富集的合成和代谢通路大多数与植物-病原菌互作、植物激素信号转导、氨基酸合成、苯丙素生物合成、碳代谢、植物生物钟以及类黄酮生物合成有关。11 DAF时,CCC处理与对照之间的差异表达基因显著富集的合成和代谢通路大多数与内质网中的蛋白质加工和植物-病原菌互作有关。

图4 CCC 处理后‘夏黑’葡萄二季果冬芽分化不同时期之间差异表达基因的通路富集性分析
Fig.4 Pathway enrichment analysis at different stages of latent bud differentiation of the second crop between CCC treated‘Summer Black’and control
2.6 CCC 处理后‘夏黑’葡萄二季果冬芽分化重要响应基因分析
根据上述对所有差异表达基因的GO功能分类和通路富集分析,发现可能参与CCC处理后冬芽分化的主要有花发育、正调控花发育及负调控花发育等GO 功能分类,可能参与的主要通路有植物生物钟、植物激素信号转导、苯丙素合成、类黄酮生物合成等。笔者对这些功能分类和通路中重要响应的差异基因及差异表达的转录因子进行了详细分析。
2.6.1 苯丙素合成和类黄酮合成相关差异基因筛选及表达模式分析 笔者发现CCC 处理会影响‘夏黑’葡萄二季果冬芽分化过程中相关基因的表达水平(图5)。如图5-A所示,在-3 DAF时,CCC处理会降低苯丙素生物合成通路中过氧化物酶25(VIT_11s0016g05280)和N1(VIT_12s0055g01030)以及苯丙氨酸脱氨酶基因(PAL,VIT_16s0039g01100,VIT_16s0039g01110,VIT_16s0039g01120,VIT_16s0039-g01130,VIT_16s0039g01170,VIT_16s0039g01300)的表达水平,此外,苯丙素生物合成通路中的甘露醇脱氢酶(VIT_00s0371g00050)和类黄酮生物合成通路中的芪合成酶3[STS3(VIT_16s0100g01030)、STS4(VIT_16s0100g00900,VIT_16s0100g01000)、STS6(VIT_16s0100g01150)]基因的表达水平也下调;4 DAF 时,苯丙素生物合成通路中PAL(VIT_16s0039g01120,VIT_16s0039g01170)、过氧化物酶47(VIT_07s0130g00220)和阳离子过氧化物酶2(VIT_12s0055g00990)基因的表达下调,苯丙素生物合成通路和类黄酮生物合成通路中的莽草酸O-羟基肉桂转移酶(VIT_11s0037g00440),以及苯丙素生物合成通路中的甘露醇脱氢酶基因(VIT_00s0346g00110,VIT_00s0371g00050)和类黄酮生物合成通路中的STS3(VIT_16s0100g01030)、STS4(VIT_16s0100g01000, VIT_16s0100g00810, VIT_16s0100g00860)、STS5(VIT_10s0042g00870)基因的表达水平也下调;而在11 DAF时,苯丙素生物合成通路中的过氧化物酶N1(VIT_12s0055g01030)和过氧化物酶47(VIT_07s0130g00220)、阳离子过氧化物酶2(VIT_12s0055g00990)以及类黄酮生物合成通路中的STS4(VIT_16s0100g00900)和STS6(VIT_16s010-0g01150)基因的表达上调,苯丙素生物合成通路中的过氧化物酶25(VIT_11s0016g05280)和PAL(VIT_16s0039g01100,VIT_16s0039g01110,VIT_16s0039-g01130,VIT_16s0039g01170,VIT_16s0039g01300),以及类黄酮生物合成通路中的STS3(VIT_16s0100g01030)、STS4(VIT_16s0100g01000)和查尔酮合酶17(VIT_16s0022g01000)等基因的表达下调。
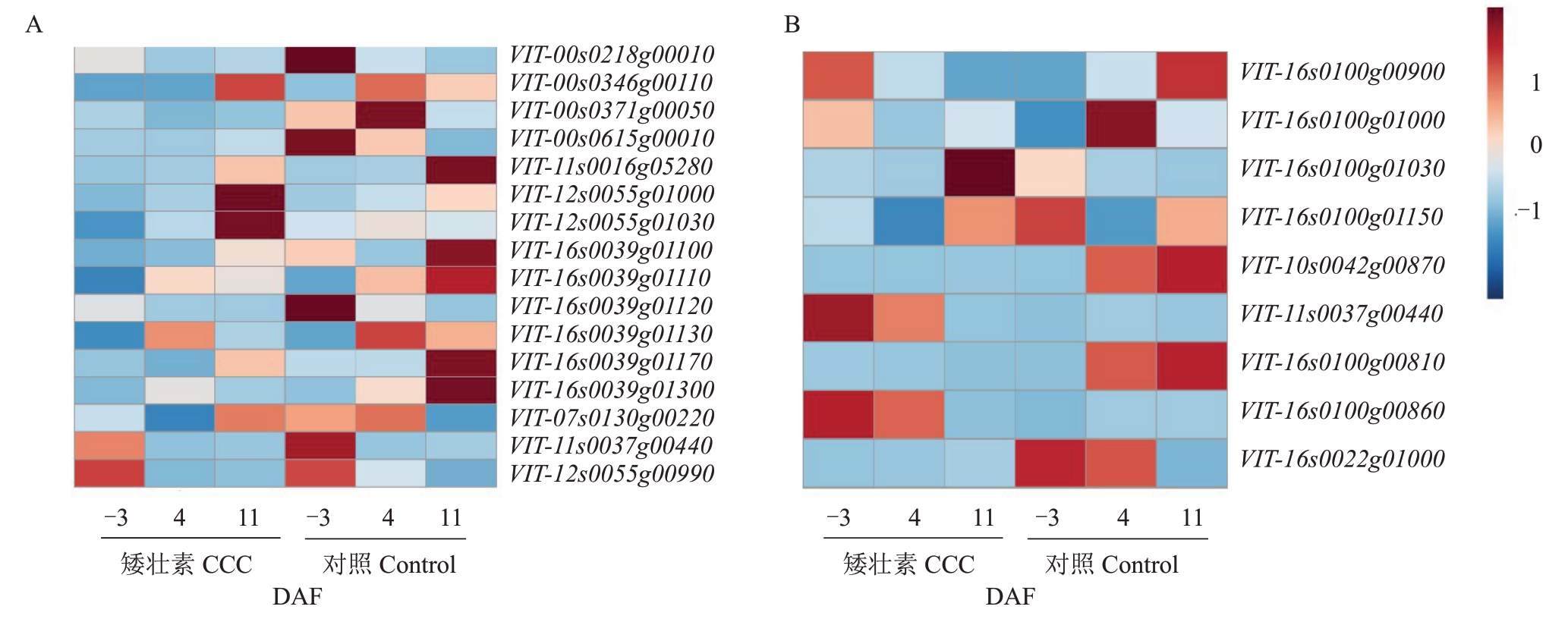
图5 CCC 处理后‘夏黑’葡萄二季果冬芽分化过程中苯丙素合成(A)和类黄酮合成(B)相关差异基因表达特性
Fig.5 Expression profiles of phenylpropanoid biosynthesis(A)and flavonoid biosynthesis(B)related DEGs in latent bud differentiation of the second crop of‘Summer Black’post CCC treatment
2.6.2 植物激素信号途径相关差异基因筛选及表达模式分析 笔者筛选出了脱落酸、生长素、赤霉素、细胞分裂素和乙烯等5种可能涉及CCC处理促进葡萄二季果成花的调控途径,对CCC处理后激素信号途径相关基因的表达水平进行分析。
研究结果(图6)表明,ABA 信号途径中的ABA受体PYL1 基因(VIT_02s0012g01270)在-3 DAF 上调;ABA 8’-羟化酶4 基因(VIT_18s0001g10500)在11 DAF 上调。生长素信号途径中的生长素诱导蛋白X10A 基因(VIT_04s0023g00580)在-3 DAF 上调,生长素诱导蛋白22D(VIT_07s0141g00270)和生长素响应蛋白IAA26 基因(VIT_04s0008g00220)在11 DAF上调。细胞分裂素信号途径中的细胞分裂素羟化酶基因(VIT_16s0050g00480)在-3 DAF 下调,在11 DAF 上调。赤霉素信号途径中的赤霉素调节蛋白6 基因(VIT_17s0000g06210)在-3 DAF 上调,赤霉素3-β-双加氧酶1(VIT_09s0002g05270)和赤霉素调节蛋白6 基因(VIT_17s0000g06210)在11 DAF上调。乙烯信号途径中DEGs数目较多,其中,RAP2- 11(VIT_08s0007g07250)和 ERF5(VIT_16s0013g01000)在- 3 DAF 上调,ABR1(VIT_07s0031g01980)在-3 DAF 下调;ERF017(VIT_04s0008g02230,VIT_11s0016g00660)、ERF109(VIT_07s0031g00710,VIT_07s0031g00720)、ERF016(VIT_11s0016g00670)、ERF022(VIT_18s0001g05850)、ABR1(VIT_18s0072g00260)和1 个AP2 类的乙烯响应转录因子(VIT_11s0037g00870)在4 DAF显著下调;ERF2(VIT_16s0013g00890)、ERF5(VIT_16s0013g01000)、ERF109(VIT_07s0031-g00710)和ABR1(VIT_18s0072g00260)在11 DAF上调。

图6 CCC 处理后‘夏黑’葡萄二季果冬芽分化过程中激素信号途径相关差异基因表达特性
Fig.6 Expression profiles of hormone signal pathway-related DEGs in latent bud differentiation of the second crop of‘Summer Black’post CCC treatment
2.6.3 成花相关差异基因筛选及表达模式分析 为进一步明确‘夏黑’葡萄二季果的成花调控机制,笔者对CCC 处理后冬芽分化关键时期成花相关基因的表达水平进行了分析。结果显示,CCC 处理后,在-3 DAF 时花发育相关基因bHLH93(VIT_00s1312g00010)的表达水平上调。在4 DAF 时,生物钟途径中的查尔酮合酶17 基因(VIT_16s0022g01000)上调表达,生物钟途径中的STS4(VIT_16s0100g00810,VIT_16s0100g00860)和STS5(VIT_10s0042g00870)、花发育相关基因bHLH93(VIT_00s1312g00010)下调表达。在11 DAF 时,生物钟途径中的STS4(VIT_16s0100g00900)和STS6(VIT_16s0100g01150),花发育相关基因细胞色素P450(VIT_11s0065g00130),正调控花发育的bHLH63(VIT_03s0038g04760)、BEE1(VIT_14s0006-g02850)和ABA 8’-羟化酶4(VIT_18s0001g10500),以及负调控花发育的 TEM1 基因(VIT_01s0011g03070)上调表达(图7)。
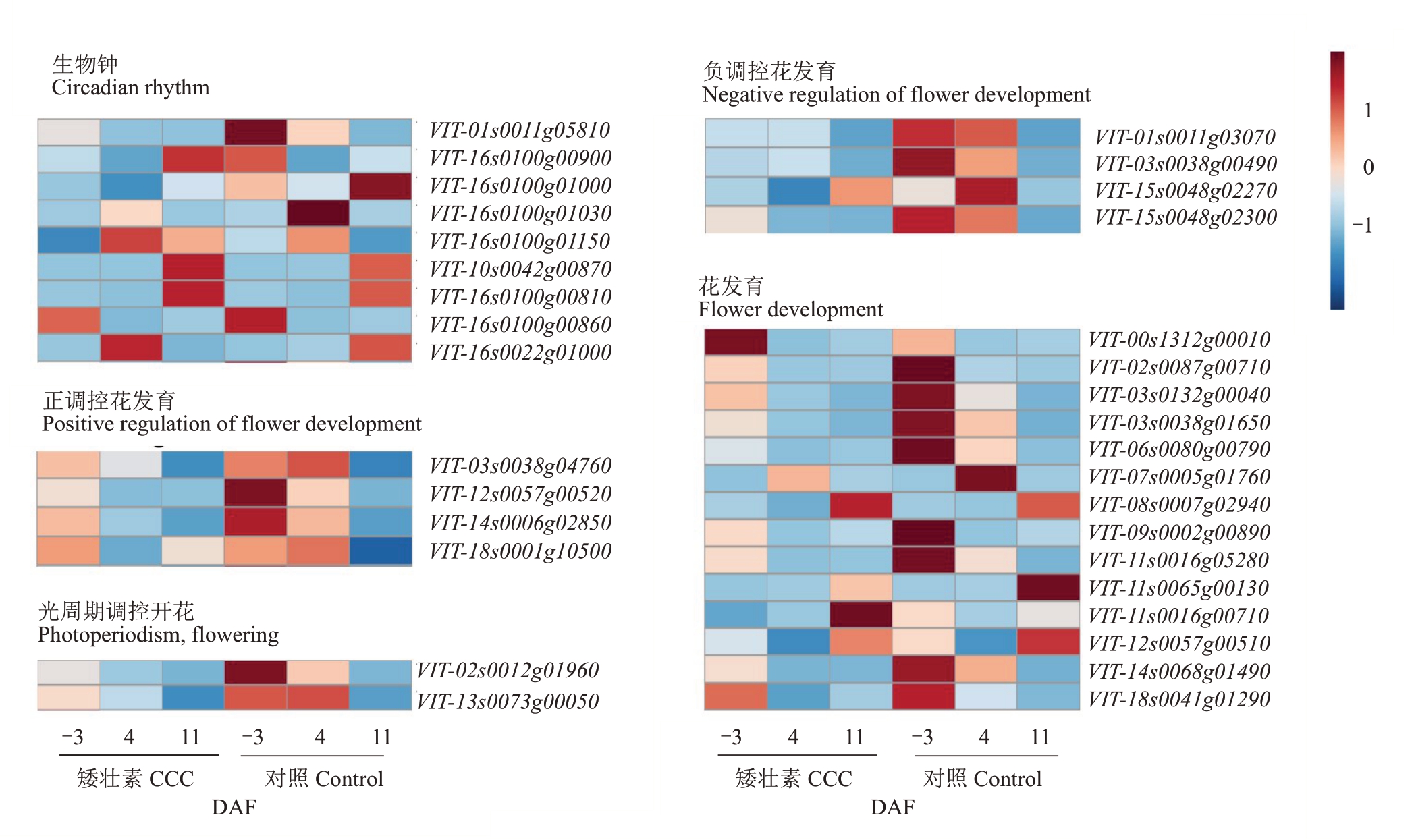
图7 CCC 处理后‘夏黑’葡萄二季果冬芽分化过程中成花相关差异基因表达特性及功能注释
Fig.7 Expression profiles of flower-related DEGs in latent bud differentiation of the second crop of‘Summer Black’post CCC treatment
2.6.4 差异表达转录因子筛选及表达模式分析 转录因子在植物的生长发育中起重要作用。通过分析‘夏黑’葡萄二季果冬芽分化关键时期CCC 处理后差异表达的转录因子,发现有23个转录因子家族的112 个基因响应CCC 处理。其中,编码差异基因数目最多的转录因子为AP2/ERF-ERF家族成员,其次是WRKY、NAC、bHLH、MYB 和Tify 家族成员。在-3 DAF时,1个C3H家族成员受CCC诱导显著上调表达;此外,有2个AP2/ERF-ERF、1个bHLH、1个HSF、1 个LOB、1 个Tify 和1 个WRKY 基因显著下调表达。在4 DAF时,只有Trihelix家族的1个差异基因在CCC 处理后上调表达,下调表达倍数<1/8 的DEGs 包含1 个AP2/ERF-AP2、4 个AP2/ERF-ERF、1个C2H2、1 个NAC 和1 个Tify 基因。在11 DAF 时,1 个bZIP 家族成员在CCC 处理后显著上调表达(图8)。
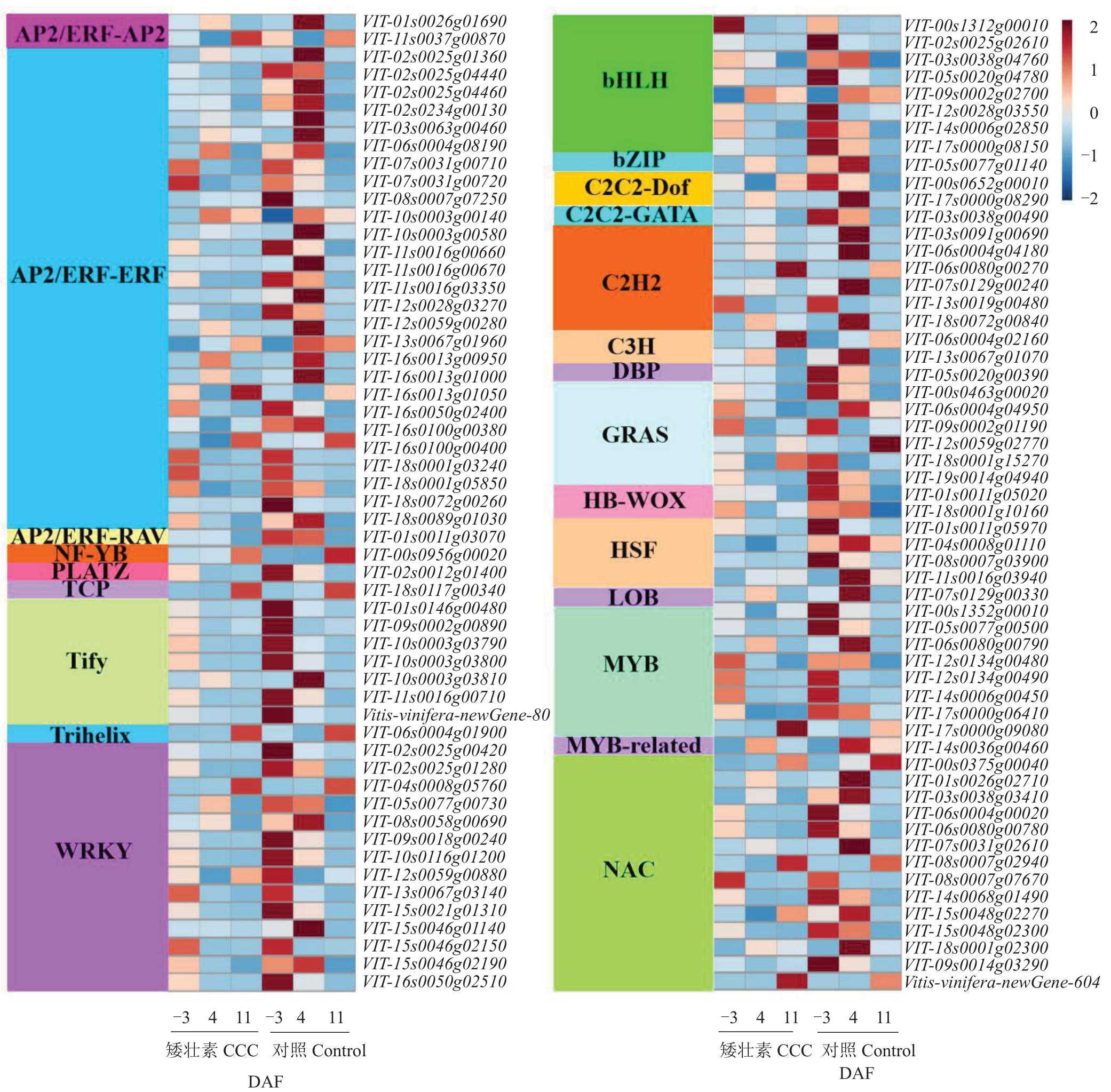
图8 CCC 处理后‘夏黑’葡萄二季果冬芽分化过程中差异表达的转录因子表达特性
Fig.8 Expression profiles of differentially expressed transcription factors in latent bud differentiation of the second crop of‘Summer Black’post CCC treatment
2.6.5 CCC 处理后‘夏黑’葡萄二季果冬芽差异基因qRT-PCR 验证转录组结果 从代谢通路中筛选出6 个相关的候选基因POD47、PODN1、STS6、IAA26、GARP6、GA3OX1,通过qRT-PCR分析它们在CCC处理后不同采样时期的表达水平,并与转录组结果进行比较。结果如图9 所示,Pearson 相关分析显示,有5 个候选基因的qRT-PCR 与转录组测序结果的相关性>0.8,1 个候选基因的qRT-PCR 与转录组测序结果的相关性为0.785,基因表达趋势基本一致,说明转录组FPKM值相对准确。
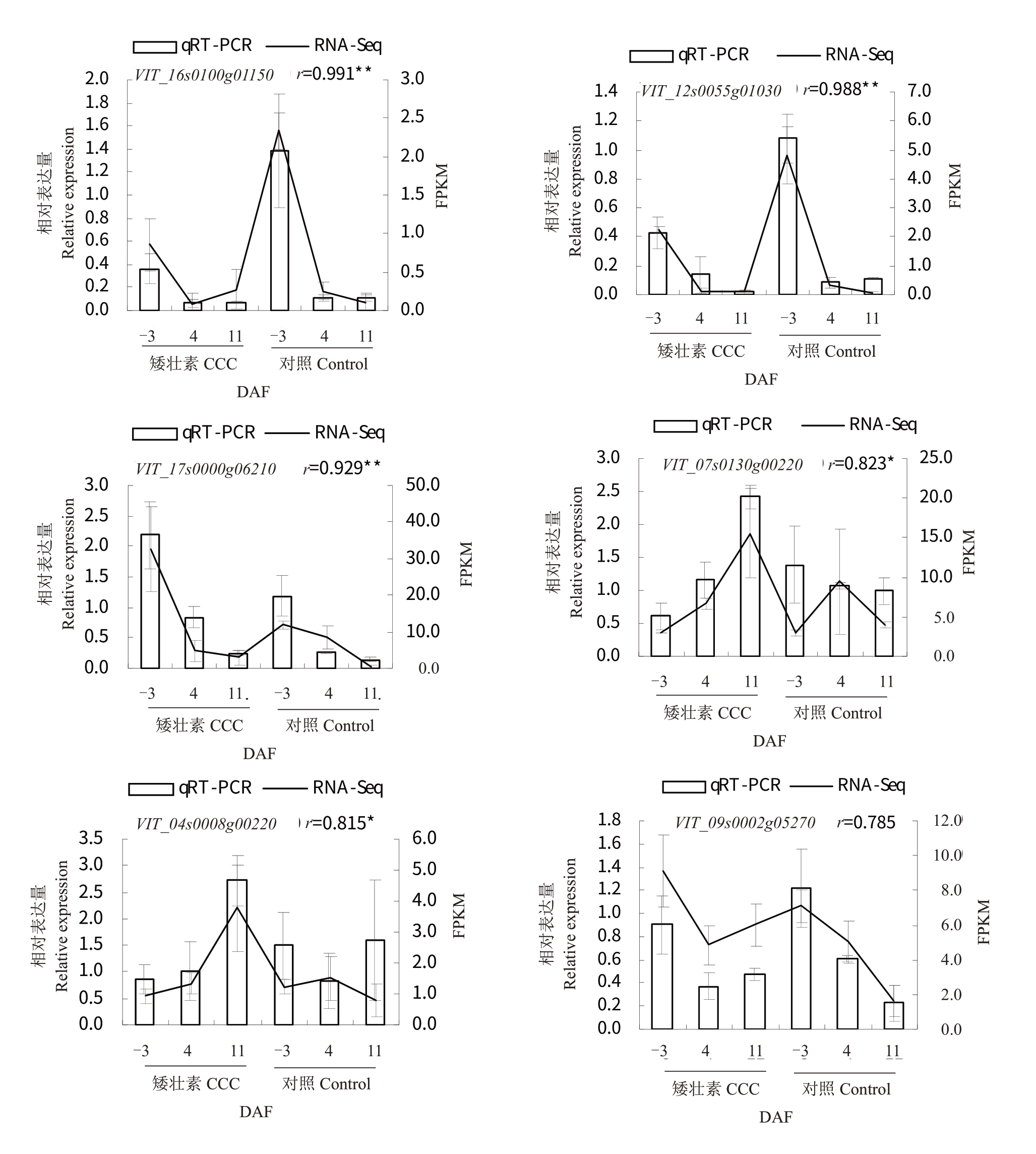
图9 CCC 处理后‘夏黑’葡萄二季果冬芽差异基因qRT-PCR 验证转录组结果
Fig.9 The qRT-PCR validation of RNA-Seq data DEGs in latent bud differentiation of the second crop of‘Summer Black’post CCC treatment
X 轴表示处理和采样时期,左Y 轴表示相对表达量,右Y 轴表示FPKM 值。r 表示Pearson 相关系数,*表示在0.05 水平下相关性显著。
The X-axis indicates treatments and sampled stages,the left Y-axis indicates the relative expression,and the right Y-axis indicates the FPKM value.r indicates Pearson correlation coefficient,and*and**represent significant correlation at the level of 0.05 and 0.01,respectively.
3 讨 论
近年来,葡萄一年两收栽培技术在我国南方地区得到了大面积的推广和应用,但是南方大部分地区春季阴雨天气较多,易造成冬芽分化不好的问题,最终影响二季果的成花和产量。前人研究表明,CCC 处理会促进葡萄花序诱导[21]。笔者以CCC 处理后的‘夏黑’葡萄二季果生产关键节位的冬芽为试材,通过Illumina HiSeq 2000 高通量测序技术揭示CCC处理促进葡萄成花的机制。
笔者发现在‘夏黑’葡萄二季果冬芽分化关键时期,CCC处理会诱导苯丙素合成和类黄酮合成通路中部分基因的上调或下调表达,表明这两个通路可能参与调控葡萄冬芽分化,但其具体的调控机制还需要进一步研究。
前人研究发现植物激素在木本植物芽生长发育、成花诱导及树体生长发育中有重要作用[10,22-23]。拟南芥内源GA 合成受阻或GA 在体内的信号转导过程被破坏,开花进程均会受到影响[24];GA对苹果、梨、‘红灯’樱桃等多年生果树的花芽分化有抑制作用,而CTK则促进其花芽分化[25-28];ZT/GA3、IAA/ABA高比值有利于蒿柳花芽的形态分化[29]。Xing等[30]通过分析苹果花芽形成不同时期的转录组数据,发现CK、ABA和GA信号转导途径组成的调控网络参与苹果的成花诱导。筛选响应CCC 处理与植物激素信号途径相关的差异表达基因,可以进一步解释CCC促进‘夏黑’葡萄二季果成花调控的分子机制。
葡萄花序的形成主要在两个时期受到调节:始原基的形成时期和始原基的分化时期,其中GA 和CK 是成花的关键调节剂[14,31]。CK 会促进始原基分化为花序而不是卷须[11]。前期研究结果表明,在-3 DAF 和4 DAF 时,CCC处理会通过降低ZR含量及ZR/GAs的比值,促进始原基形成,而在11 DAF时,CCC处理会使ZR/GAs的比值增高,从而促进始原基分化为花序[14]。笔者发现CCC 处理后,在-3 DAF时,赤霉素调节蛋白6基因的表达上调,细胞分裂素羟化酶基因的表达下调;而在11 DAF 时,赤霉素3-β-双加氧酶1、赤霉素调节蛋白6和细胞分裂素羟化酶基因均上调表达,进一步表明CCC处理会通过调控GA和CK信号途径中相关基因的表达水平,从而改变这两种激素的含量,进而调控始原基的形成和分化方向。
芽内IAA 含量较高会刺激芽的生长并促进成花[32]。与不易成花的‘长富2号’相比,易成花的‘秦冠’苹果芽内IAA 生物合成的关键基因表达上调[33]。笔者发现,CCC 处理后‘夏黑’葡萄二季果成花关键节位芽内IAA 诱导蛋白X10A 和22D,以及IAA 响应蛋白IAA26 基因的表达有所上调,表明IAA在调控‘夏黑’葡萄二季果冬芽成花的过程中发挥作用。
作为TCA循环的下游信号通路,ABA信号转导通路调控成花诱导和花形成中的主要功能包括调控植物生物钟及光周期相关基因的表达[34-35]。笔者发现CCC处理后,在-3 DAF时ABA受体PYL1基因的表达上调;4 DAF 时生物钟途径中的查尔酮合酶17基因的表达上调;11 DAF 时ABA 8’-羟化酶4 以及生物钟途径中的芪合成酶4 和6 基因的表达上调。此外,ABA 相关的糖信号还会影响植物的营养生长、开花时间及胁迫响应[36],表明ABA 在调控植物成花的过程中是多个信号通路的中心因子,如糖代谢、光周期和生物钟通路。
CCC处理后,除了生物钟途径中的部分基因在4 DAF 或11 DAF 上调表达外,在-3 DAF 时花发育相关基因bHLH39 的表达水平轻微上调;11 DAF时,花发育相关基因细胞色素P450,正调控花发育的bHLH63、BEE1 和ABA 8’-羟化酶4,以及负调控花发育的TEM1基因均上调表达。表明CCC处理可能会通过上调或下调成花相关基因的表达来调控始原基的形成和分化。
转录因子在植物生长发育中发挥重要作用。Tsai 等[37]构建了小兰屿蝴蝶兰成熟花芽的cDNA 文库,通过分析鉴定出来的ESTs序列,发现C3H和trihelix 基因家族成员数占鉴定出的转录因子总数的25%。通过分析腊梅中的两个C3H类锌指转录因子CzCPF1和CzCPF2在花发育中的功能,发现这两个基因的表达模式与花原基的分化有关[38]。笔者通过分析CCC 处理后‘夏黑’葡萄二季果冬芽分化关键时期差异表达转录因子的表达模式,共鉴定到23个转录因子家族的112个差异表达转录因子。部分差异表达的转录因子在多个开花途径中直接调控开花,如C2H2 家族的IDD 转录因子参与蔗糖途径中的开花调控[39-40],NF-YB 调控光信号途径中的开花[41]。因此,CCC 处理后‘夏黑’葡萄二季果成花关键节位芽内差异表达的转录因子可能参与多个生物学过程中的成花调控。
4 结 论
通过对CCC 处理后‘夏黑’葡萄二季果冬芽分化关键时期(始原基形成关键期和始原基分化关键期)18 个样本的RNA-Seq 数据分析和qRT-PCR 验证,发现响应CCC处理的差异表达基因主要涉及苯丙素生物合成(POD47和PODN1)、类黄酮生物合成(STS6)、激素信号途径(IAA26、GARP6 和GA3OX1)等,表明CCC 处理作为一种化学措施,其促进成花的功能可能是通过改变树体内激素的含量及比值,次级代谢产物的合成和代谢,以及成花相关基因的表达模式来实现的。这些响应CCC 处理的差异表达基因形成了系统的、相互联系的复杂基因调控网络,共同促进葡萄二季果的成花。
[1] 白先进,王举兵.广西葡萄一年两收栽培关键技术[J].广西农学报,2009,24(5):69.BAI Xianjin,WANG Jubing. Key techniques of grape cultivation two-crop-a-year in Guangxi[J].Journal of Guangxi Agriculture,2009,24(5):69.
[2] 曹雄军,时晓芳,郭荣荣,王博,林玲,张瑛,周咏梅,谢太理,白先进. 南方葡萄一茬果采收后光合特性初探[J]. 南方园艺,2016,27(6):8-11.CAO Xiongjun,SHI Xiaofang,GUO Rongrong,WANG Bo,LIN Ling,ZHANG Ying,ZHOU Yongmei,XIE Taili,BAI Xianjin. Preliminary study on the photosynthetic characteristics of the first harvest of Southern grape[J]. Southern Horticulture,2016,27(6):8-11.
[3] CHENG G,ZHOU S H,ZHANG J,HUANG X Y,BAI X J,XIE T L,GUO R R,LIU J B,YU H,XIE L J. Comparison of transcriptional expression patterns of phenols and carotenoids in‘Kyoho’grapes under two-crop-a-year cultivation system[J].PLoS One,14(1):e0210322.
[4] 房经贵,蔡斌华,魏延英.葡萄一年多次结果的研究与利用及应注意的问题[J].中外葡萄与葡萄酒,2000(1):36-37.FANG Jinggui,CAI Binhua,WEI Yanying.Research and utilization of grape’s multiple results in one year and problems to be noticed[J].Sino-Overseas Grapevine&Wine,2000(1):36-37.
[5] 白先进,李阳瑞,谢太理,黄江流,曹慕明,梁声记.广西一年两熟葡萄栽培的气候基础[J].广西农学报,2008,23(1):1-4.BAI Xianjin,LI Yangrui,XIE Taili,HUANG Jiangliu,CAO Muming,LIANG Shengji.The climate elements for two-crop-ayear grape cultivation in Guangxi[J]. Journal of Guangxi Agriculture,2008,23(1):1-4.
[6] 郭荣荣,王博,成果,林玲,曹雄军,张瑛,谢太理,白先进.我国葡萄一年两收栽培的区划研究进展[J]. 南方农业学报,2016,47(12):2091-2097.GUO Rongrong,WANG Bo,CHENG Guo,LIN Ling,CAO Xiongjun,ZHANG Ying,XIE Taili,BAI Xianjin. Research advances in regionalization for two-crop-a-year grape cultivation in China [J]. Journal of Southern Agriculture,2016,47(12):2091-2097.
[7] 黄璐.巨峰葡萄不同芽节位夏季花芽分化规律及相关影响因子的研究[D].南宁:广西大学,2015.HUANG Lu. Study on the law of flower bud differentiation and related influencing factors in summer at different bud nodes of Kyoho grape[D].Nanning:Guangxi University,2015.
[8] 何建军,王博,陈爱军,曹慕明,娄兵海,宋雅琴,白先进,陈德元.广西不同生态区域葡萄一年两收栽培区划研究[J].南方园艺,2016,27(5):6-8.HE Jianjun,WANG Bo,CHEN Aijun,CAO Muming,LOU Binghai,SONG Yaqin,BAI Xianjin,CHEN Deyuan. Study on the regionalization of grapes in two ecological regions in Guangxi in different ecological[J]. Southern Horticulture,2016,27(5):6-8.
[9] 蒙忠.夏黑葡萄一年两熟栽培技术探析[J].南方农业,2015,9(27):12-13.MENG Zhong. Analysis on the cultivation techniques of Summer Black grapes in two years[J]. South China Agriculture,2015,9(27):12-13.
[10] 林玲,曹慕明,郭荣荣,谢蜀豫,韩佳宇,盘丰平,陈国品,王世平,白先进,王博.桂南一年两收栽培夏黑葡萄花芽分化进程调控[J].南方农业学报,2017,48(1):49-57.LIN Ling,CAO Muming,GUO Rongrong,XIE Shuyu,HAN Jiayu,PAN Fengping,CHEN Guopin,WANG Shiping,BAI Xianjin,WANG Bo. Regulation of flower bud differentiation process of Summer Black grape cultivated in two-crop-a-year mode in southern Guangxi[J]. Journal of Southern Agriculture,2017,48(1):49-57.
[11] SRINIVASAN C,MULLINS M G. Control of flowering in the grapevine: Formation of inflorescences in vitro by isolated tendrils[J].Plant Physiology,1978,61(1):127-130.
[12] ZHANG K,WANG R Z,ZI H L,LI Y P,CAO X W,LI D M,GUO L,TONG J H,PAN Y Y,JIAO Y L,LIU R Y,XIAO L T,LIU X G.AUXIN RESPONSE FACTOR3 regulates floral meristem determinacy by repressing cytokinin biosynthesis and signaling[J].Plant Cell,2018,30(2):324-346.
[13] LAVEE S,MELAMUD H,ZIV M,BERNSTEIN Z. Necrosis in grapevine buds. III. Endogenous gibberellin levels in leaves and buds[J].Vitis,1987,26:225-230.
[14] GUO R R,WANG B,LIN L,CHENG G,ZHOU S H,XIE S Y,SHI X F,CAO M M,ZHANG Y,BAI X J.Evolutionary interaction and expression analysis of floral meristem identity genes in inflorescence induction of the second crop in two-crop-a-year grape culture system[J]. Journal of Genetics,2018,97(2): 439-451.
[15] ZHONG S L,JOUNG J G,ZHENG Y,CHEN Y R,LIU B,SHAO Y,XIANG J Z,FEI Z G,GIOVANNONI J J. Highthrough put illumina strand specific RNA sequencing library preparation[J]. Cold Spring Harbor Protocols,2011,2011(8):940-949.
[16] TRAPNELL C,PACHTER L,SALZBERG S L. Top Hat: discovering splice junctions with RNA- Seq[J]. Bioinformatics,2009,25:1105-1111.
[17] ADERS S,HUBER W. Differential expression analysis for sequence count data[J].Genome Biology,2010,11(10):1-10.
[18] BENJAMINI Y,HOCHBERG Y.Controlling the false discovery rate: A practical and powerful approach to multiple testing[J].Journal of the Royal Statistical Society,1995,57(1):289-300.
[19] STURN A,QUACKENBUSH J,TRAIANOSKI Z. Genesis:cluster analysis of microarray data[J]. Bioinformatics,2002,18:207-208.
[20] 唐永凯,贾永义.荧光定量PCR 数据处理方法的探讨[J].生物技术,2008,18(3):89-91.TANG Yongkai,JIA Yongyi.Discussion on the processing method of quantitative fluorescent PCR data[J]. Biotechnology,2008,18(3):89-91.
[21] NAOKI U,AKIRA S,TAKASHI T. Effects of CCC and pinching treatment on the inflorescence induction and development on lateral shoots in grapevine[J].Journal of the Japanese Society for Horticultural Science,1978,47(2):151-157.
[22] MUTASA-GOTTGENS E,HEDDEN P. Gibberellin as a factor in floral regulatory networks[J]. Journal of Experimental Botany,2009,60(7):1979-1989.
[23] CURABA J,SINGH M B,BHALLA P L. miRNAs in the crosstalk between phytohormone signalling pathways[J]. Journal of Experimental Botany,2014,65(6):1425-1438.
[24] WLISON R N,HECHAMNG J W,SOMERVILLE C R.Gibberellin is required for flowering in Arabidopsis thaliana under short days[J].Plant Physiology,1992,100(1):403-408.
[25] 马玲,张鑫,孟莹,赵静,张满让.喷施GA3 和6-BA 对‘富士’苹果顶芽内源激素及成花成枝的影响[J]. 西北植物学报,2018,38(5):873-884.MA Ling,ZHANG Xin,MENG Ying,ZHAO Jing,ZHANG Manrang. Influence of spraying GA3,and 6-BA on endogenous hormone content and the flowering rate of‘Fuji’apple[J].Acta Botanica Boreali-Occidentalia Sinica,2018,38(5):873-884.
[26] 闫婕.转录组分析两种树形对‘烟富3 号’苹果成花相关基因表达变化的影响[D].杨凌:西北农林科技大学,2019.YAN Jie. Transcriptome analysis of the effects of tree shape on the expression of flower-related genes in‘Yanfu No. 3’apple[D].Yangling:Northwest A&F University,2019.
[27] 刘丙花,姜远茂,彭福田,隋静,赵凤霞.花期喷激素对红灯樱桃坐果率的影响[J].落叶果树,2007(2):10-11.LIU Binghua,JIANG Yuanmao,PENG Futian,SUI Jing,ZHAO Fengxia. Effect of hormone spraying on fruit setting rate of red cherry[J].Deciduous Fruits,2007(2):10-11.
[28] 曹尚银,汤一卒,江爱华.GA3 和PP333 调控苹果花芽孕育机制的研究[J].园艺学报,2001,28(4):339-341.CAO Shangyin,TANG Yizu,JIANG Aihua.Study on the mechanism of GA3 and PP333 regulating apple flower bud formation[J].Acta Horticulturae Sinica,2001,28(4):339-341.
[29] 彭向永,程运河,李振坚,于永畅,邹竣竹,孙振元.蒿柳成花过程中内源激素和多胺含量变化特征[J].林业科学,2018,54(8):39-47.PENG Xiangyong,CHENG Yunhe,LI Zhenjian,YU Yongchang,ZOU Junzhu,SUN Zhenyuan. Variations of endogenous hormones and polymines during flowering process in male and female Salix viminalis[J]. Scientia Silvae Sinicae,2018,54(8):39-47.
[30] XING L B,ZHANG D,LI Y M,SHEN Y W,ZHAO C P,MA J J,AN N HAN M Y.Transcription profiles reveal sugar and hormone signaling pathways mediating flower induction in apple[J].Plant Cell Physiology,2015,56(10):2052-2068.
[31] VASCONCELOS M C,GREVEN M,WINEFIELD C S,TROUGHT M C T,RAW V.The flowering process of Vitis vinifera:A review[J].American Journal of Enology and Viticulture,2009,60(4):411-434.
[32] BALZAN S,JOHAL G S,CARRARO N. The role of auxin transporters in monocots development[J]. Frontiers in Plant Science,2014,5:393.
[33] CHEN X L,QI S Y,ZHANG D,LI Y M,AN N,ZHAO C P,ZHAO J,SHAH K,HAN M Y ,XING L B.Comparative RNAsequencing-based transcriptome profiling of buds from profusely flowering‘Qinguan’and weakly flowering‘Nagafu No. 2’apple varieties reveals novel insights into the regulatory mechanisms underlying floral induction[J].BMC Plant Biology,2018,18:370.
[34] KAZAN K,LYONS R. The link between flowering time and stress tolerance[J]. Journal of Experimental Botany,2016,67(1):47-60.
[35] KOOPS P,PELSER S,IGNATZ M,KLOSE C,MARROCCOSELDEN K,KRETSCH T. EDL3 is an F-box protein involved in the regulation of abscisic acid signalling in Arabidopsis thaliana[J]. Journal of Experimental Botany,2011,62(15): 5547-5560.
[36] TSAI Y L GAZARRINI S. Trehalose-6-phosphate and SnRK1 kinases in plant development and signaling:the emerging picture[J].Plant Physiology,2014(5):119.
[37] TSAI W C,HSIAO Y Y,LEE S H,TUNG C W,WANG D P,WANG H C,CHEN W H,CHEN H H. Expression analysis of the ESTs derived from the flower buds of Phalaenopsis equestris[J].Plant Science,2005,170(3):426-432.
[38] LIU H M,HUANG R W,MA J,SUI S Z,GUO Y L,LIU D F,LI Z N,LIN Y C,LI M Y. Two C3H type zinc finger protein genes,CpCZF1 and CpCZF2,from Chimonanthus praecox affect stamen development in Arabidopsis[J]. Genes,2017,8(8):199.
[39] CUI D Y,ZHAO J B,JING Y J,FAN M Z,LIU J,WANG Z C,XIN W,HU Y X. The Arabidopsis IDD14,IDD15,and IDD16 cooperatively regulate lateral organ morphogenesis and gravitropism by promoting auxin biosynthesis and transport[J]. PLoS Genetics,2013,9:e1003759.
[40] JEONG E Y,SEO P J,WOO J C,PARK C M.AKIN10 delays flowering by inactivating IDD8 transcription factor through protein phosphorylation in Arabidopsis[J]. BMC Plant Biology,2015,15:110.
[41] KUMIMOTO R W,ADAM L,HYMUS G J,REPEPTTI P P,REUBER T L,MARION C M,HEMPEI F D,RATCLIFFE O J.The nuclear factor Y subunits NF-YB2 and NF-YB3 play additive roles in the promotion of flowering by inductive long-day photoperiods in Arabidopsis[J].Planta,2008,228(5):709-723.