葡萄具有重要的经济价值和丰富的营养价值,在我国被种植广泛。西北地区是我国葡萄的主栽区[1],但由于该地区降雨量少,蒸发量大,因此干旱成了制约葡萄种植的主要问题[2]。对于葡萄来说,调亏灌溉可以改变树势、果实大小和风味组成[3],是目前公认的提高葡萄品质最安全的措施之一[4],也是提高果实品质的必要条件[5]。
光合作用是绿色植物制造有机物的重要途径,叶片是高等植物进行光合作用的主要场所[6]。水分是影响光合作用的重要因素之一,当土壤水分减少时,气孔为了保存水分而关闭[7],植物净光合速率下降[7-8]。Yuan 等[9]研究表明,水分胁迫会降低番茄各生育期净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr),导致番茄产量下降。核酮糖-1,5-二磷酸羧化/加氧酶(Rubisco)、果糖1,6-二磷酸酯酶(FBPase)等是光合系统中的关键酶,这些酶活性的高低决定了CO2固定速率的大小[10]。大部分光合作用过程的变化均可通过叶绿素荧光反映出来,且测量时不会伤害到生物体。唐婧文等[11]研究发现,水分胁迫下多花黄精PSⅡ最大荧光(Fm)、PS Ⅱ最大光化学效率(Fv/Fm)、PSⅡ的有效量子产量(Yield)、光化学淬灭系数(qP)均有所下降,而初始荧光(Fo)、非光化学淬灭系数NPQ均上升,且重度水分胁迫会显著抑制其光合作用。
叶龄是衡量叶片生命活动长短的标尺,是影响光合作用重要的内部因素之一[12-13]。不同叶位叶片的净光合速率会因叶龄的不同而存在差异,壮龄叶对光的利用能力远高于幼龄叶和老龄叶,在光合生产中起主要作用[14-15]。目前关于水分胁迫对葡萄不同叶龄叶片光合特性的研究较少,为探究葡萄不同叶龄叶片对水分胁迫的响应机制,笔者以‘赤霞珠’葡萄为试材,对不同程度水分胁迫下不同叶龄叶片的光合和荧光参数及相关酶活性进行测量,以期为酿酒葡萄节水栽培管理提供理论依据。
1 材料和方法
1.1 试验地与试验材料
试验于2018 年4—9 月在宁夏农垦集团玉泉营农场(国家葡萄产业技术体系水分生理与节水栽培岗位试验基地)的玻璃温室中进行,玻璃温室内温度变化范围:24~38 ℃,空气相对湿度变化范围:38%~58%,空气CO2浓度变化范围:300~500 μmol·mol-1。供试材料为3 a(年)生欧亚种‘赤霞珠’葡萄(Vitis vinifera‘Cabernet Sauvignon’),定植于长4.0 m、宽0.8 m、高0.5 m木槽中(底部设有回流装置),生长基质V 蛭石∶V 珍珠岩∶V 草木灰为1∶1∶1,株距50 cm,杯状整形,每株留6个结果新梢。
1.2 处理方法
2018年4月中旬,葡萄萌芽后新梢生长期内,分别在4 月20 日、4 月30 日、5 月10 日、5 月20 日、5 月30日对梢尖初展开的叶片进行挂牌标记,命名为叶1、叶2、叶3、叶4、叶5,以天数(d)作为叶龄的计量单位,展开日期即为初始叶龄(0 d),以此类推至6 月20日时,叶1~5叶龄分别为60、50、40、30、20 d。
水分胁迫处理于6 月20 日进行,通过时控仪控制每日灌水时长,以黎明前叶水势(Ψb)[16]反映胁迫程度,分别设置对照(无水分胁迫,CK,植株黎明前水势-0.2 MPa≤Ψb)、中度水分胁迫(T1,植株黎明前叶片水势-0.60 MPa≤Ψb≤-0.40 MPa)、重度水分胁迫(T2,植株黎明前叶片水势Ψb≤-0.60 MPa)3个水分处理。于7月5日、7月20日、8月5日、8月20日采样,每处理随机选取挂牌标记的不同叶龄叶片,采集后装入自封袋中,迅速带回实验室,将叶片清洗干净并用剪刀剪除主叶脉,使用液氮冷冻处理后放入超低温冰箱(-80 ℃),保存备用。
1.3 测定指标与方法
1.3.1 黎明前叶片水势及土壤含水量测定 黎明前(4:30—5:00)选取各处理健康成熟叶片装入自封袋中,迅速带回实验室,用3005型植物水分压力室(美国Soil Moisture Equipment公司)测定叶片水势。采用土壤水分测量仪(英国DELTA-T 公司)测定不同处理土壤基质的含水量。
1.3.2 水分胁迫下‘赤霞珠’葡萄生理生化指标的测定 随机选取‘赤霞珠’葡萄新梢上、中、下部位叶片,每个部位选取10 片,共30 片。叶面积采用小方格法[17]计算,使用米尺测量叶主脉长(cm)、叶宽(cm)。将叶长×叶宽(Χ)、实测叶面积(S)进行回归分析。从6月20日起每隔30 d测量各处理已挂牌标记叶片的主脉长、叶宽,计算乘积后代入回归方程(S=8.756 1+0.812 6Χ),计算叶面积。
1.3.3 水分胁迫下‘赤霞珠’不同叶龄叶片光合参数及光合关键酶活性的测定 采用便携式叶绿素测定仪SPAD0-502PLUS(日本Konika-Minolta 公司)测定已标记叶片的SPAD值,从6月20日开始,每15 d测定1次,每个叶片3次重复。
使用浙江托普云农公司生产的3051D光合测定仪测定净光合速率(Pn)(以CO2计)、蒸腾速率(Tr)(以H2O 计)、气孔导度(Gs)(以H2O 计)。对已标记的不同叶龄叶片进行测定,从6月20日开始,每15 d测定1 次,使每组叶片在相对一致的光强下完成光合测定,于晴天上午9:00—11:00进行。
RuBP 羧化/加氧酶(Rubisco)活性测定参照Cheng等[18]的方法。
酶提取液制备:50 mmol·L-1 Hepes-KOH(pH=7.5),10 mmol·L- 1 MgCl2,2 mmol·L- 1 EDTA,10 mmol·L-1 DTT,10%(φ)甘油,1%(m/V)BSA,1%(φ)Triton X-100和1.5%PVPP(m/V)。
酶反应液制备:100 mmol·L-1 N,N-双(2-羟乙基)甘氨酸(pH=8.0),25 mmol·L-1 KHCO3,20 mmol·L-1 MgCl2,3.5 mmol·L-1 ATP,5 mmol·L-1磷酸肌酸,5 U 3-磷酸甘油醛脱氢酶,5 U 3-磷酸甘油酸磷酸激酶,17.5 U磷酸肌酸激酶,0.25 mmol·L-1 NADH。
酶活性测定:准确称取鲜样0.2 g,迅速放入-20 ℃预冷的磨钵中,并加入适量液氮研磨,然后再加入3 mL提取液,研磨匀浆,吸取1 mL至新离心管中,4 ℃14 000 r·min-1离心10 min,转移上清液,并立即进行酶活性测定。取50 μL酶提取液加入到含900 μL反应介质的半微量比色皿中,迅速加入50 μL RuBP 吸打混匀,用紫外分光光度计测定340 nm 下的吸光度值,每隔10 s自动读取1次,共2 min。
果糖-1,6-二磷酸酶(FBPase)活性测定参照Rao等[19]的方法。
酶提取液制备:100 mmol·L-1 Hepes-NaOH,10 mmol·L-1 MgCl2,0.4 mmol·L-1 EDTA,1% PVPP,100 mmol·L-1 抗坏血酸钠,0.1%BSA。
酶反应液制备:30 mmol·L- 1 Hepes-KOH,5 mmol·L-1 DTT,0.5 mmol·L-1 NADP,2 U·mL-1 葡萄糖-6磷酸脱氢酶(G6PD),2 U·mL-1 磷酸葡萄糖异构酶(PGI)。
酶活性测定:40 μL 酶提取液加入752 μL 预保温30 ℃的反应液中,加入8 μL 的300 mmol·L-1 果糖-6-磷酸(FBP)启动反应,UV-2450 紫外分光光度计测定340 nm下1 min内的吸光度值的变化。
1.3.4 叶绿素荧光参数测定 使用OS5p+便携式脉冲调制叶绿素荧光仪(美国Opti Sciences公司),从6月20日开始,各处理随机选择3株长势一致的植株,对已标记叶片每15 d测定1次,3次重复。测定前叶片暗适应30 min,荧光仪调至kinetic 荧光动力学模式,测定F0、Fm、Fv/Fm、Yield、ETR、qP、NPQ 等荧光参数,测定时的相关参数均为仪器默认设置。
1.4 数据统计与分析
采用Excel 2016进行数据处理和绘图,DPS 7.05统计分析,LSD 多重检验样本间的差异显著性(p <0.05),以3个生物学重复的(平均值±标准误)表示。
2 结果与分析
2.1 黎明前水势与土壤基质含水量
图1为黎明前叶水势和土壤基质含水量。6 月20 日即水分处理前,水势值Ψb为-0.36~-0.32 MPa,土壤含水量为30.53%~33.77%。随着水分胁迫的进行,T1 和T2 处理黎明前叶水势和土壤含水量逐渐下降,各处理叶水势基本处于试验设定范围内。
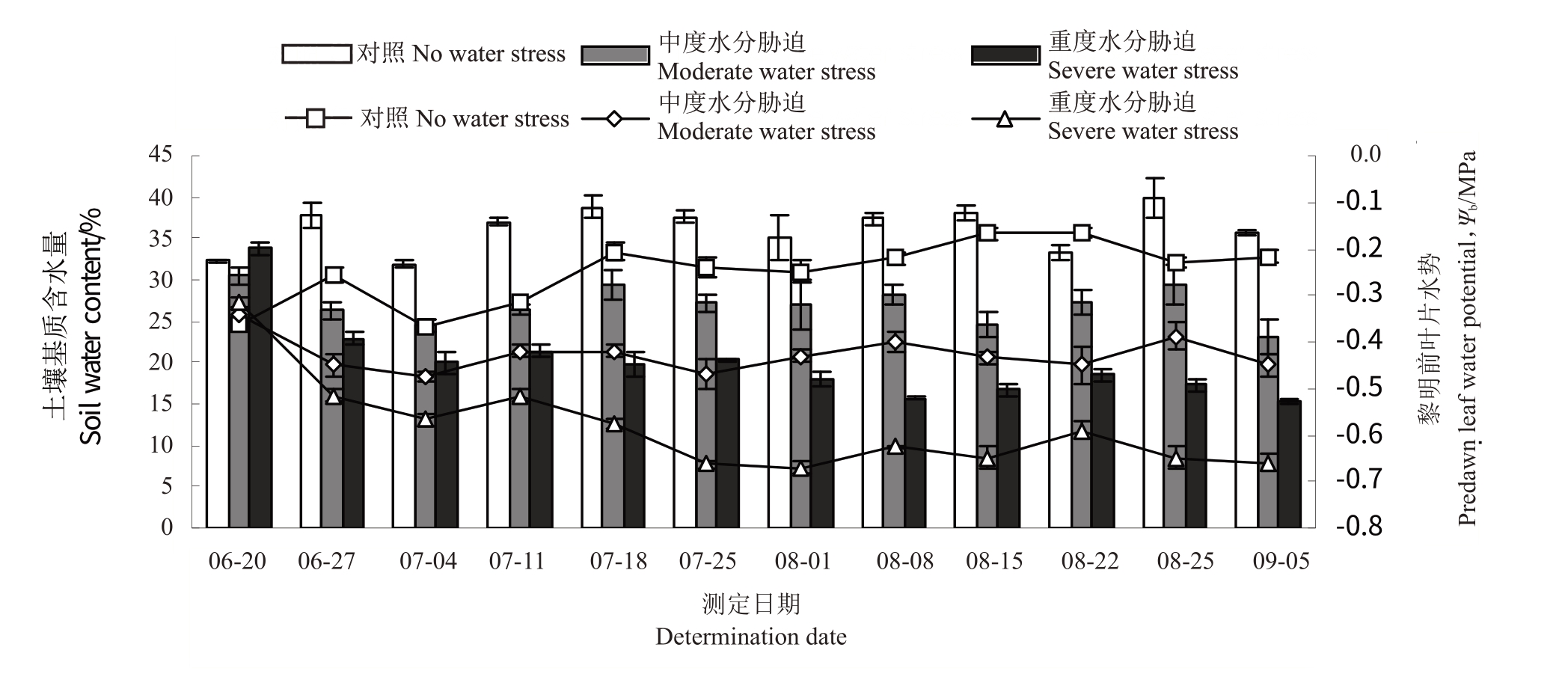
图1 不同水分处理下土壤含水量和黎明前叶片水势
Fig.1 The predawn leaf water potential and soil water content under different water treatments
柱形图表示土壤含水量,折线图表示叶片水势。
Histogram indicate soil water content,line chart indicate leaf water potential.
2.2 水分胁迫对‘赤霞珠’葡萄不同叶龄叶面积的影响
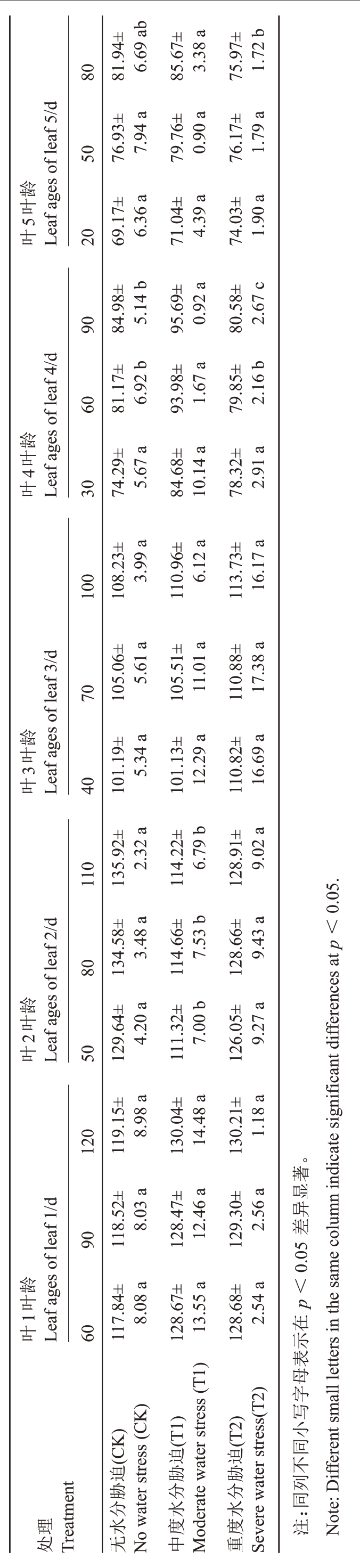
叶片是光合作用的主要器官,葡萄叶面积直接影响植株的光合产量。由表1 可知,葡萄叶面积随叶龄的增大而增加,且叶1>叶2>叶3>叶4>叶5。其中T1与CK差异不显著,T2显著延缓了各叶龄叶面积的增加(p <0.05),说明重度水分胁迫抑制了叶面积的增大。
表1 水分胁迫对‘赤霞珠’葡萄不同叶龄叶面积的影响
Table 1 Effects of water stress on leaf area of ‘Cabernet Sauvignon’ at different leaf ages 2 cm2
?
2.3 水分胁迫对‘赤霞珠’葡萄不同叶龄叶片SPAD值的影响
随着叶片叶龄的增加,不同叶龄叶片SPAD 值显著下降。T1增加了叶片SPAD值,而T2 在45 d后降低了叶片SPAD 值,差异显著(图2)。CK 处理下叶3 SPAD 值较高,叶5 较低。胁迫处理后,T1 叶2叶龄为110 d时的SPAD值最大(46.40)。T2处理下叶1叶龄为135 d时SPAD值最小(36.00)。
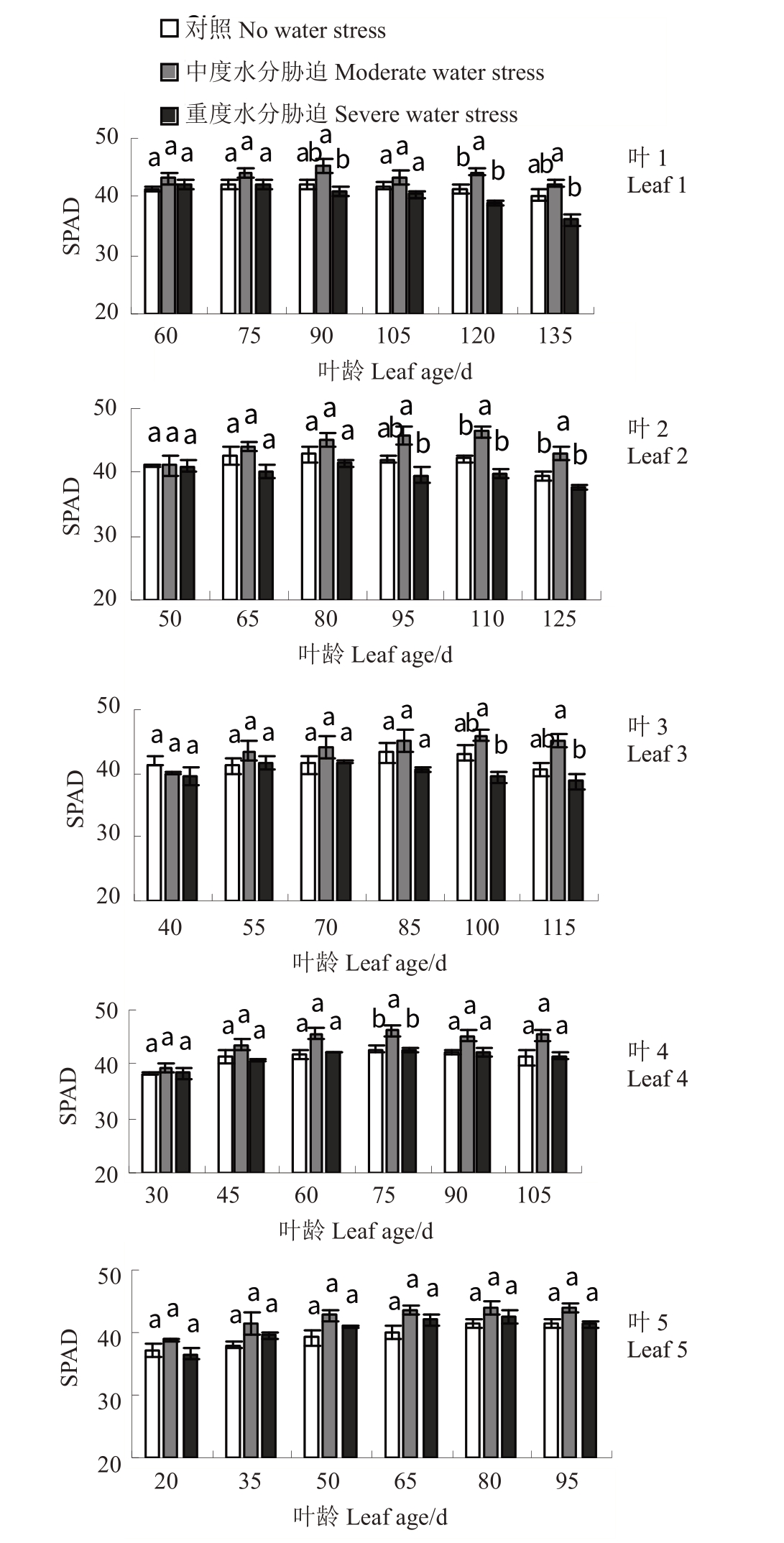
图2 水分胁迫对‘赤霞珠’葡萄不同叶龄叶片SPAD 值的影响
Fig.2 Effect of water stress on leaf SPAD value of‘Cabernet Sauvignon’at different leaf ages
不同小写字母表示p <0.05 差异显著。下同。
Different small letters indicate significant differences at p <0.05.The same below.
2.4 水分胁迫对‘赤霞珠’葡萄不同叶龄叶片光合参数和光合关键酶活性的影响
2.4.1 水分胁迫对‘赤霞珠’葡萄不同叶龄叶片光合参数的影响 各处理下‘赤霞珠’葡萄不同叶龄叶片Pn变化差异显著(p <0.05)(图3)。CK处理下,叶1~5在处理30 d后达到最大值,其中叶4(叶龄为60 d)最高(10.67 μmol·m-2·s-1),叶3 次之(叶龄为70 d 时Pn为10.23 μmol·m-2·s-1)。胁迫处理后,T1 与CK 变化趋势一致,且T1 低于CK。胁迫15 d 后,T2 显著低于其余两处理,其中叶1、叶2净光合速率最低,且叶1 在叶龄为120 d 时,Pn已下降为0 μmol·m-2·s-1,叶2叶龄为125 d时下降为0.07 μmol·m-2·s-1。

图3 水分胁迫对‘赤霞珠’不同叶龄叶片净光合速率Pn的影响
Fig.3 Effects of water stress on Pn of‘Cabernet Sauvignon’at different leaf ages
各处理下‘赤霞珠’葡萄不同叶龄叶片Tr和Gs的变化趋势与Pn一致(图4)。气孔导度不仅是影响植物净光合速率的因素之一,还影响蒸腾速率。CK叶3、叶4、叶5的Tr和Gs较大,叶3叶龄为70 d时,Tr和Gs均最大(0.80 mol·m-2·s-1,6.40 mol·m-2·s-1),叶1、叶2较小。随着胁迫处理的进行,Tr和Gs均下降,不同叶龄间差异显著(p <0.05),其中,T2后期叶1、叶2的Gs均下降为0 mol·m-2·s-1。
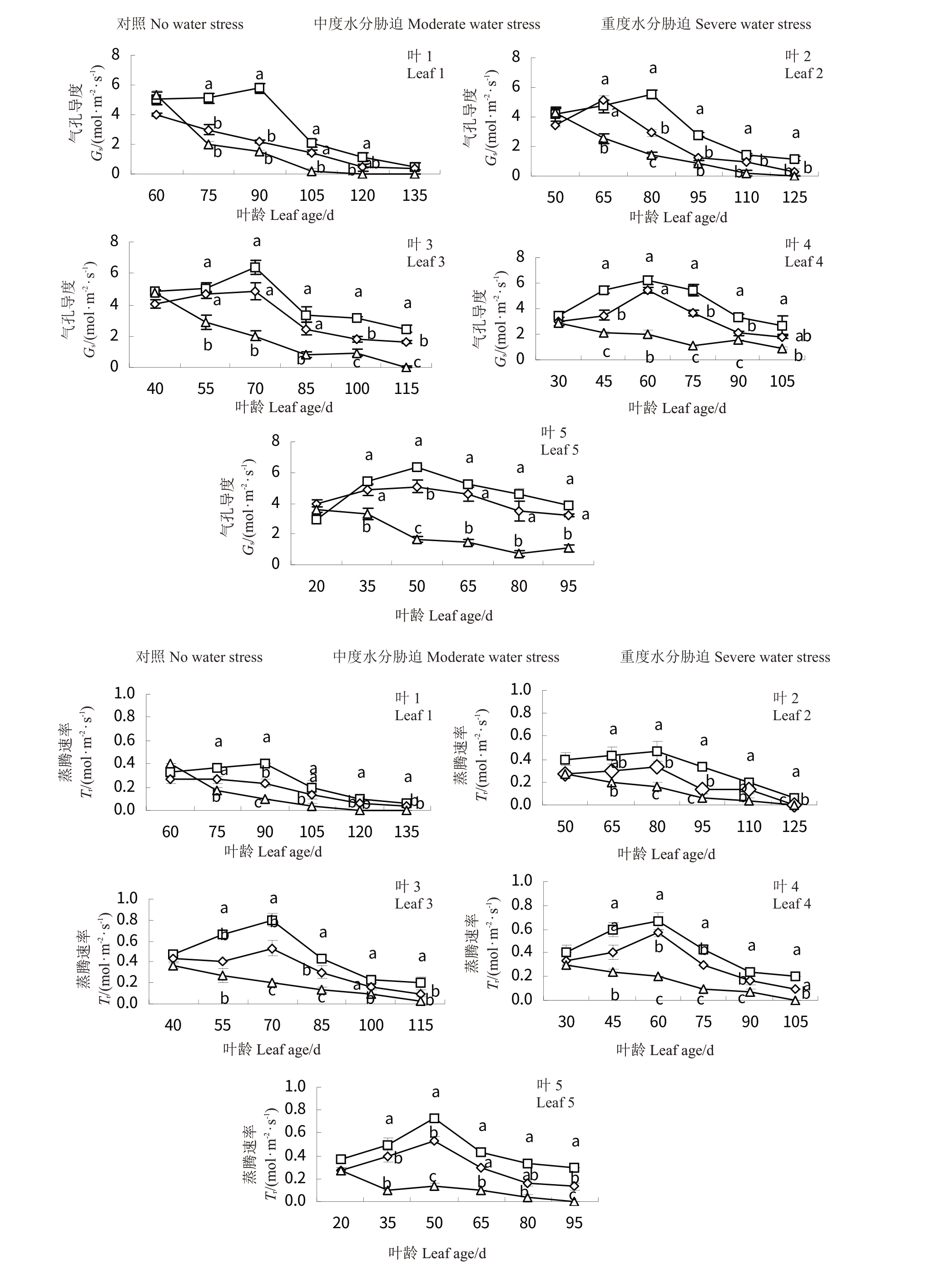
图4 水分胁迫对‘赤霞珠’不同叶龄叶片气孔导度Gs和蒸腾速率Tr的影响
Fig.4 Effects of water stress on Gs and Tr in‘Cabernet Sauvignon’at different ages
2.4.2 水分胁迫对‘赤霞珠’葡萄不同叶龄叶片光合关键酶活性的影响 Rubisco 活性随叶龄的增加呈先上升后下降的趋势(图5),其中T2 显著低于其余两处理,而T1与CK无显著差异。CK处理下叶5叶龄为65 d时,Rubisco活性最大(0.137 mmol·g-1·s-1),叶1叶龄为135 d时最小(0.079 mmol·g-1·s-1)。胁迫处理后,T2处理下叶5(叶龄为80 d)Rubisco活性最小(0.052 mmol·g-1·s-1),叶1 次之(叶龄为135 d 时Rubisco活性为0.056 mmol·g-1·s-1)。
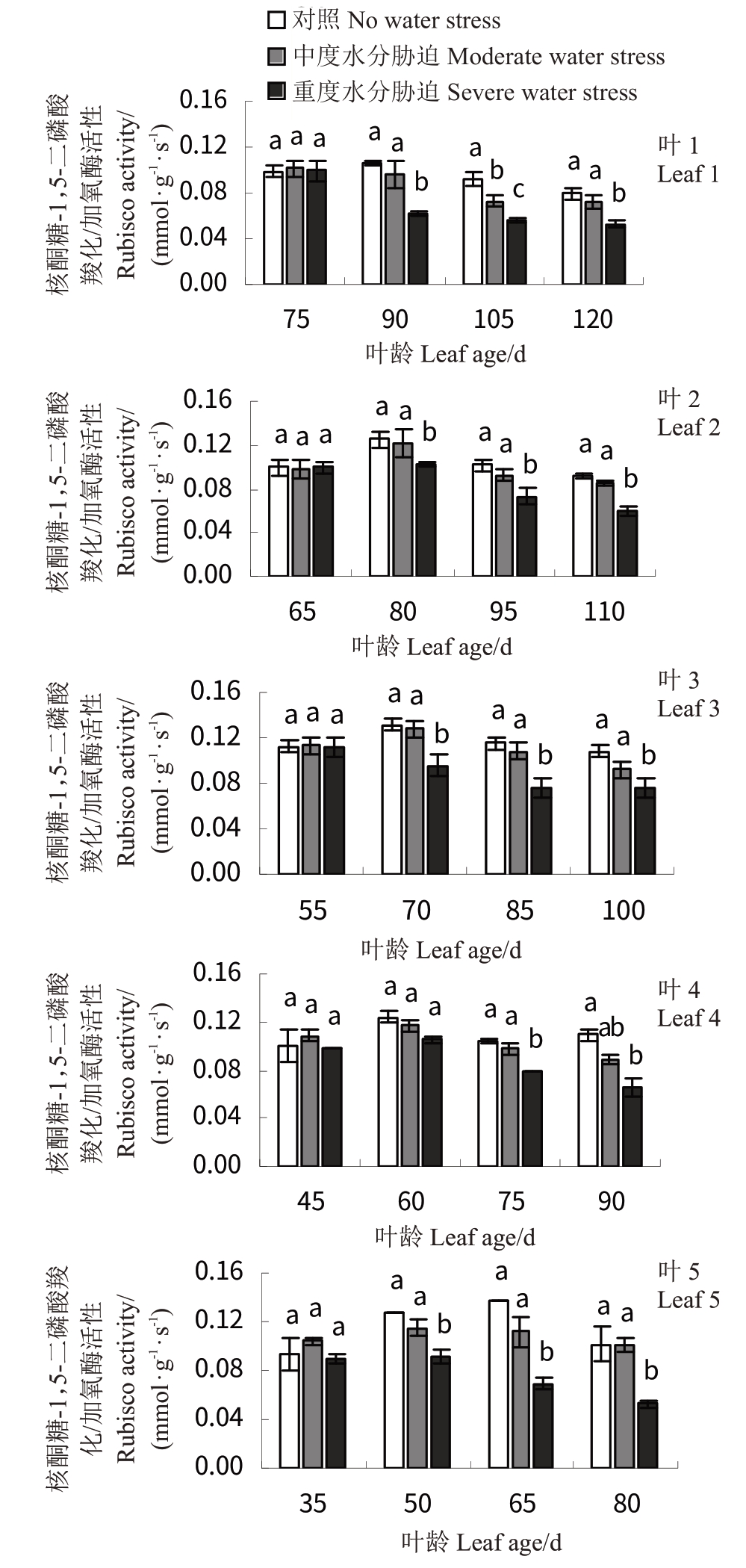
图5 水分胁迫对‘赤霞珠’不同叶龄叶片RuBP 羧化/加氧酶活性的影响
Fig.5 Effects of water stress on Rubisco activity in‘Cabernet Sauvignon’at different leaf ages
各处理叶1~5 FBPase 酶活性总体呈先增加后缓慢下降的趋势(图6)。T1 略低于CK 且差异不显著。其中T2 处理后期各叶龄叶片酶活性显著下降(p <0.05)。其中,CK处理下叶4(叶龄为60 d)和叶5(叶龄为50 d)酶活性最高(29.72 mmol·g-1·min-1,29.48 mmol·g- 1·min- 1),叶5(叶龄为35 d)最低(22.15 mmol·g-1·min-1)。T2处理下叶5(叶龄为35 d)酶活性最低(22.37 mmol·g-1·min-1)。
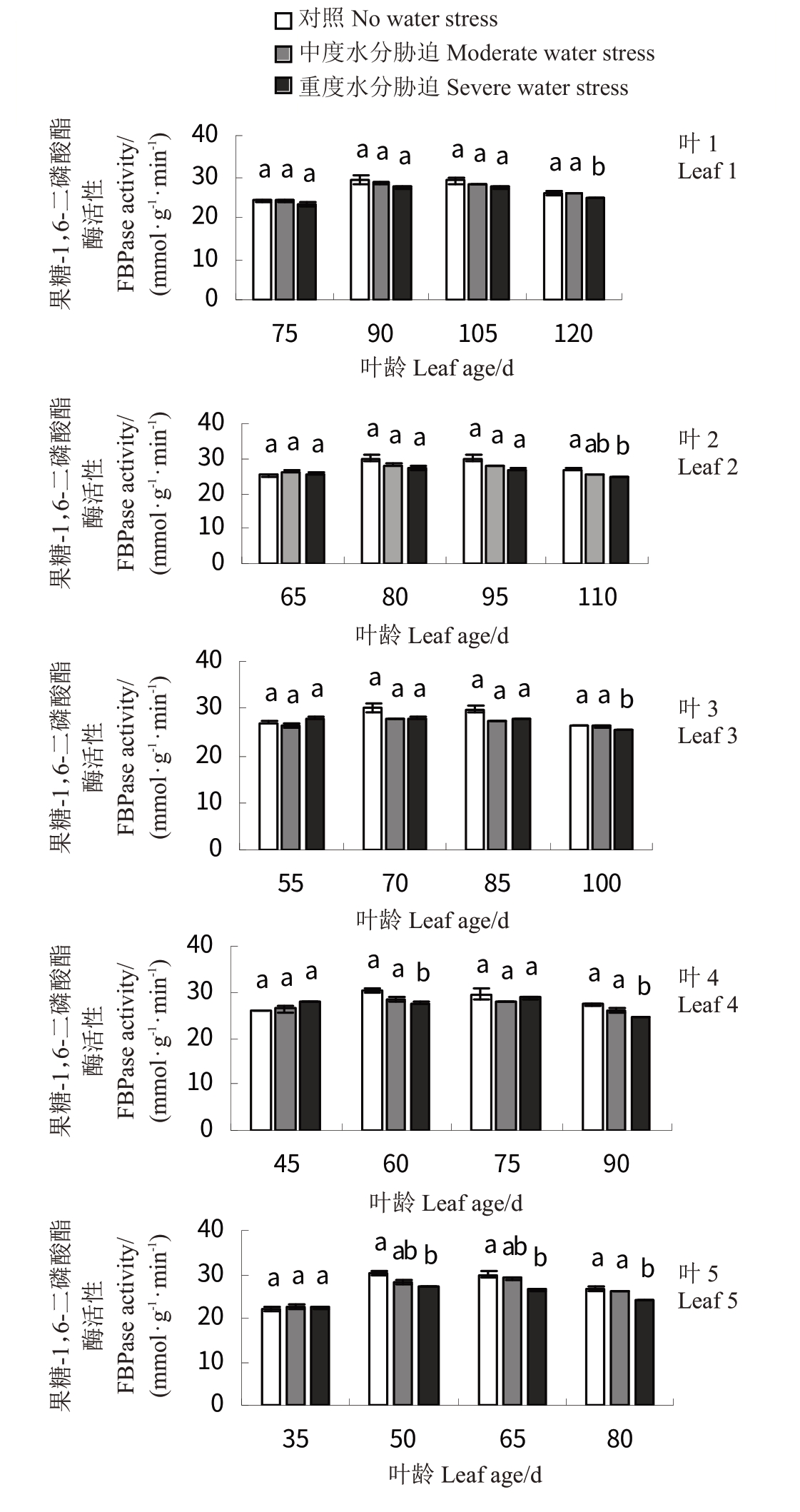
图6 水分胁迫对‘赤霞珠’不同叶龄叶片FBPase 活性的影响
Fig.6 Effect of water stress on FBPase activity in‘Cabernet Sauvignon’at different leaf ages
2.5 水分胁迫对‘赤霞珠’葡萄不同叶龄叶片光系统Ⅱ光反应的影响
2.5.1 水分胁迫对‘赤霞珠’葡萄不同叶龄叶片初始荧光(Fo)的影响 如图7所示,随着叶龄的增大,CK处理下叶1~5 的Fo变化趋于平缓,于75 d 后略有上升,T1 和T2 总体呈先升高后降低再略微升高的趋势,其中T1 与CK 差异不显著(p <0.05)。CK 处理下叶1 叶龄为90 d 时,Fo最高(238.00),同时期叶4叶龄为90 d 时,Fo最低(166.17)。T2 处理在30 d 后显著升高,其中叶1 升高最多(350.50),叶4 升高最少(296.50)。
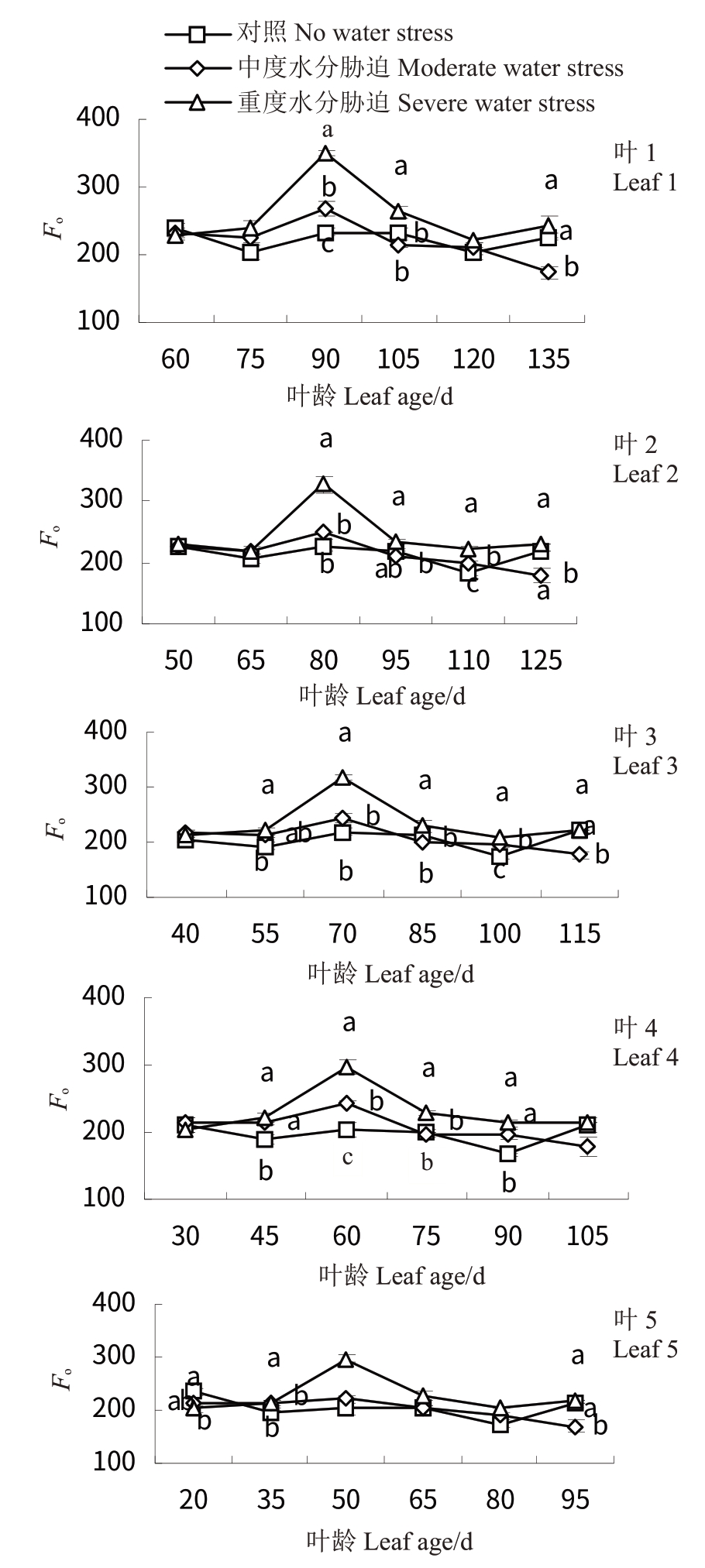
图7 水分胁迫对‘赤霞珠’不同叶龄叶片初始荧光Fo的影响
Fig.7 Effects of water stress on Fo of‘Cabernet Sauvignon’at different leaf ages
2.5.2 水分胁迫对‘赤霞珠’葡萄不同叶龄叶片最大光化学效率(Fv/Fm)的影响 如图8 所示,不同水分条件下各叶龄叶片Fv/Fm变化趋势相似。CK 处理下,随着叶龄的增大,各叶龄叶片Fv/Fm在30 d 后显著上升,之后下降,后期略微上升。叶4叶龄为60 d时,Fv/Fm最大(0.864),同时期叶5 叶龄为50 d 时,Fv/Fm 最小(0.765)。水分胁迫处理相似,均低于CK。各叶龄叶片在处理15 d 后Fv/Fm显著下降(p <0.05)。其中叶4叶龄为45 d时下降最多(0.715),同时期叶2 叶龄为75 d 时下降幅度最小(0.749)。

图8 水分胁迫对‘赤霞珠’不同叶龄叶片最大光化学效率(Fv/Fm)的影响
Fig.8 Effects of water stress on Fv/Fm of‘Cabernet Sauvignon’at different leaf ages
2.5.3 水分胁迫对‘赤霞珠’葡萄不同叶龄叶片PSⅡ光化学量子产额(Yield)的影响 如图9 所示,随着叶龄的增大,CK 和T1 处理叶1~5 叶片Yield 变化趋势相似,总体呈先上升后下降的趋势,而T2 处理下Yield 呈依次下降的趋势且低于其余两处理(p <0.05)。CK处理30 d后,各叶龄叶片Yield增至最大,其中叶5 叶龄为65 d 时最大(0.183),同时期叶1 叶龄为105 d 时最小(0.147)。T1 处理45 d 后,叶3~5Yield略微上升。
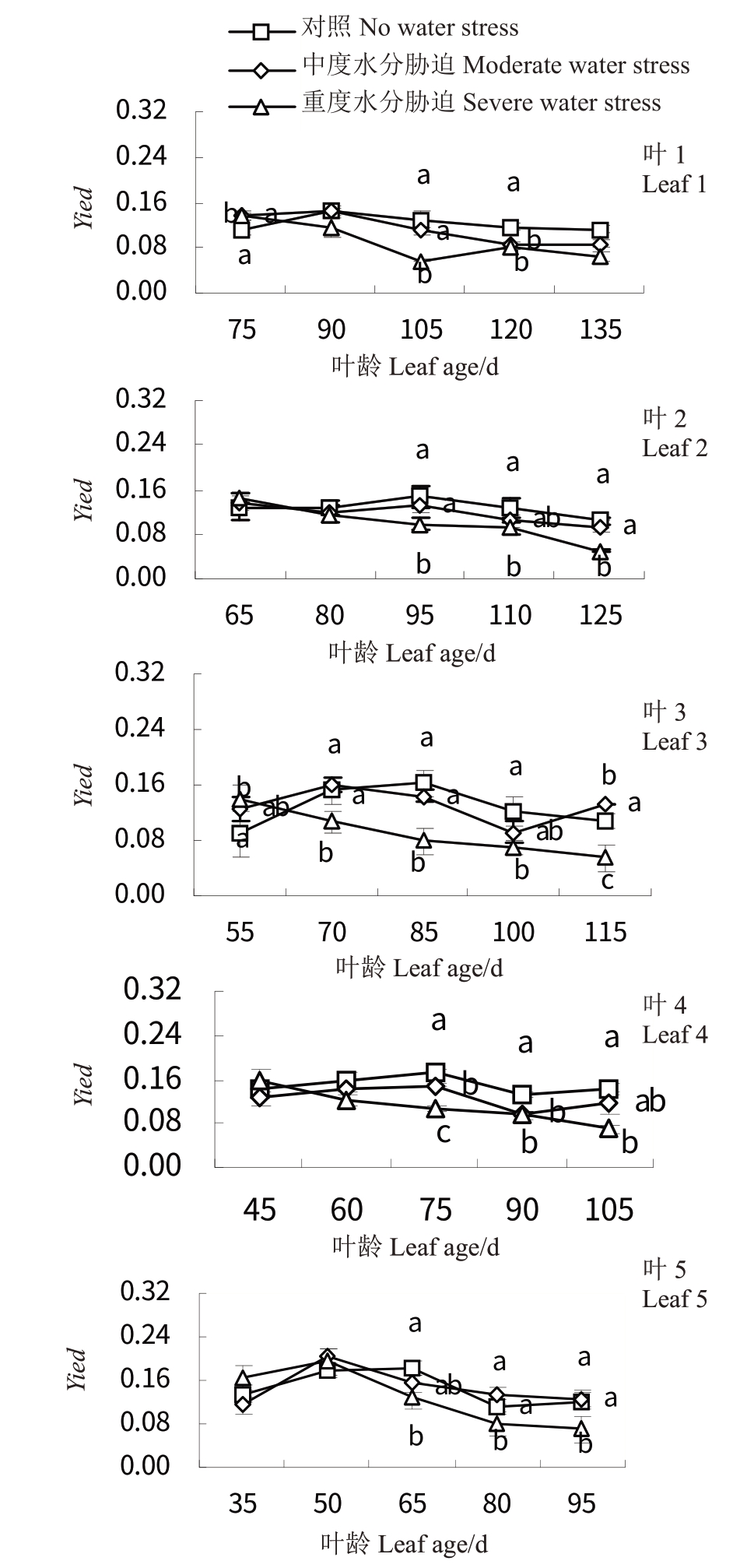
图9 水分胁迫对‘赤霞珠’不同叶龄叶片PSⅡ光化学量子产额(Yield)的影响
Fig.9 Effects of water stress on Yield of‘Cabernet Sauvignon’at different leaf ages
2.5.4 水分胁迫对‘赤霞珠’葡萄不同叶龄叶片表观电子传递速率(ETR)的影响 如图10所示,ETR与Yield 变化相似。CK 处理30 d 后,各叶龄叶片增加至最大,其中叶5 叶龄为65 d 时最大(7.40),同时期叶2叶龄为95 d时最小(4.20)。T2显著低于其余两处理(p <0.05)。T2 处理下,叶3、叶4 降幅最大,叶5(叶龄为50 d)在T2 处理15 d 后呈上升趋势,之后显著下降。此外,T1 处理下叶3 在叶龄为80、125 d时,叶片ETR均略有增加。
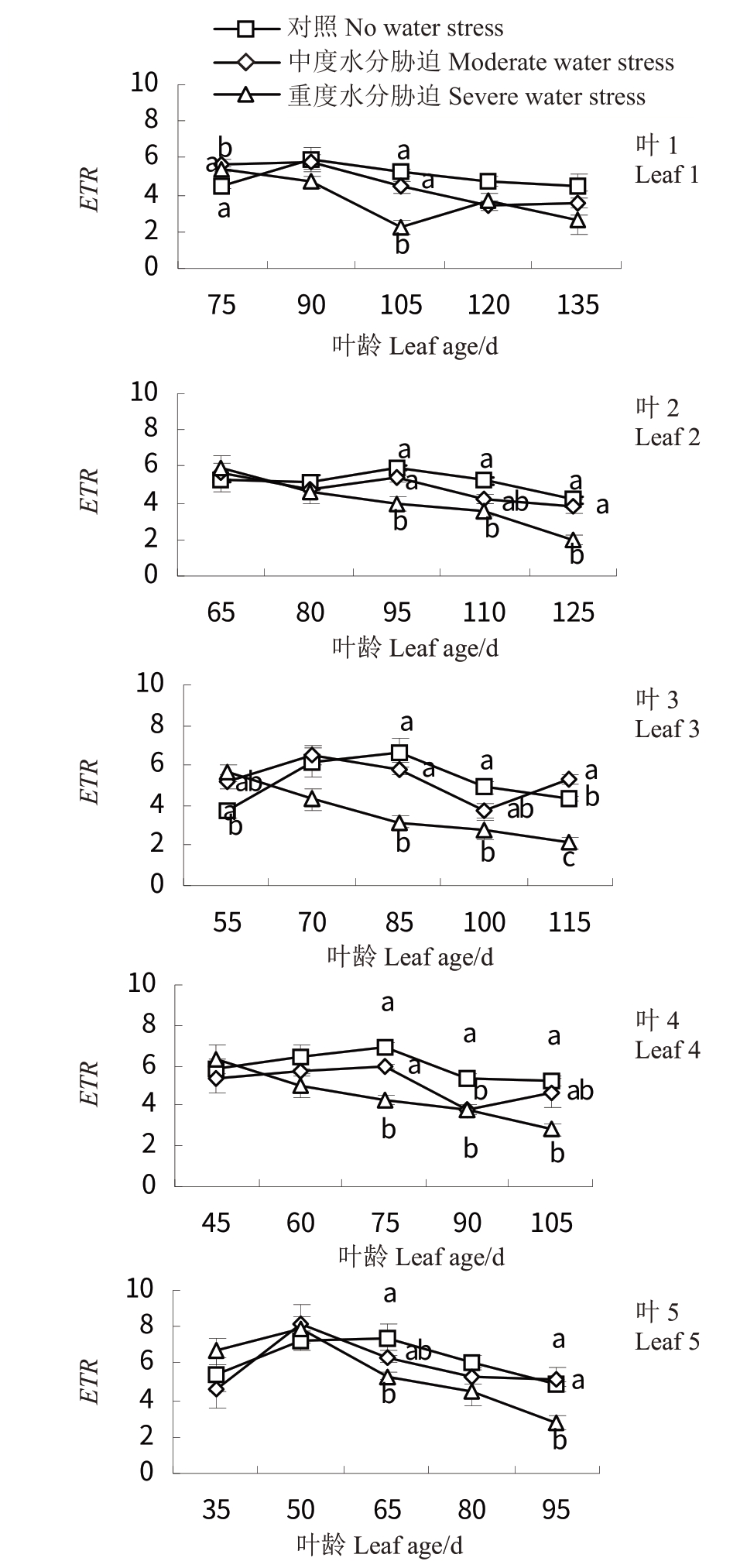
图10 水分胁迫对‘赤霞珠’不同叶龄叶片表观电子传递速率(ETR)的影响
Fig.10 Effects of water stress on ETR of‘Cabernet Sauvignon’at different leaf ages
2.5.5 水分胁迫对‘赤霞珠’葡萄不同叶龄叶片光化学淬灭系数(qP)的影响 如图11所示,随着叶龄的增大,CK 和T1 处理下叶1~5 叶片qP 呈先升高后降低的变化趋势,CK处理15 d后各叶龄叶片基本升至最大,其中,叶5 叶龄为50 d 时最大(0.458),同时期叶4 叶龄为60 d 时最小(0.406)。T2 处理15 d 之后叶5 显著升高至0.504(p <0.05),而后下降,其余叶龄叶片均显著下降。
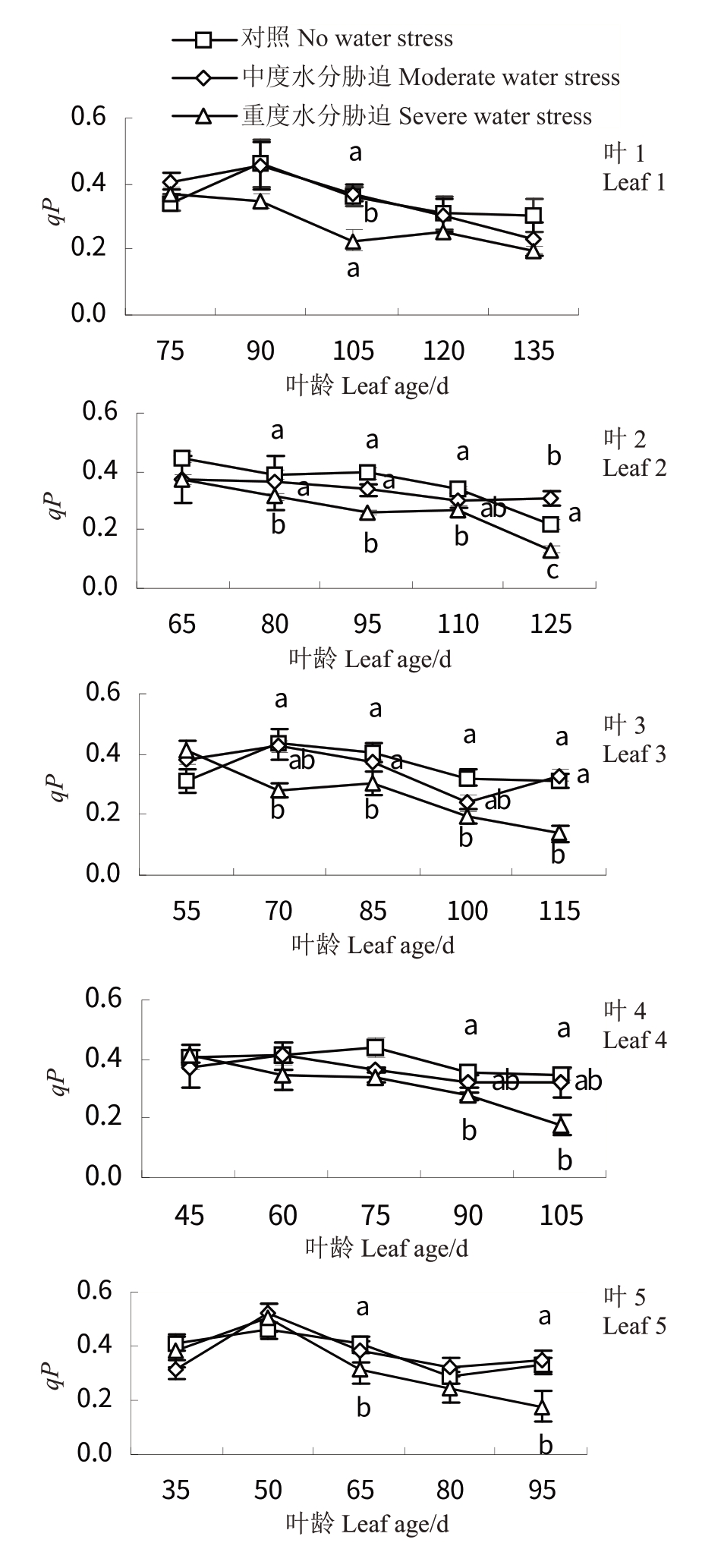
图11 水分胁迫对‘赤霞珠’不同叶龄叶片光化学淬灭系数(qP)的影响
Fig.11 Effects of water stress on qP of‘Cabernet Sauvignon’at different leaf ages
2.5.6 水分胁迫对‘赤霞珠’葡萄不同叶龄叶片非光化学淬灭系数(NPQ)的影响 如图12 所示,随着叶龄的增大,CK 与T1 变化较为平缓。CK 处理下叶1 叶龄为90 d 时最高(3.06)且与CK 差异显著(p <0.05),同时期叶5 叶龄为50 d 时最低(2.61)。T2 处理下叶1~5 的NPQ 则显著降低,叶2、4 降幅相对较小,叶5 在胁迫处理30 d 后下降较大(1.82)。
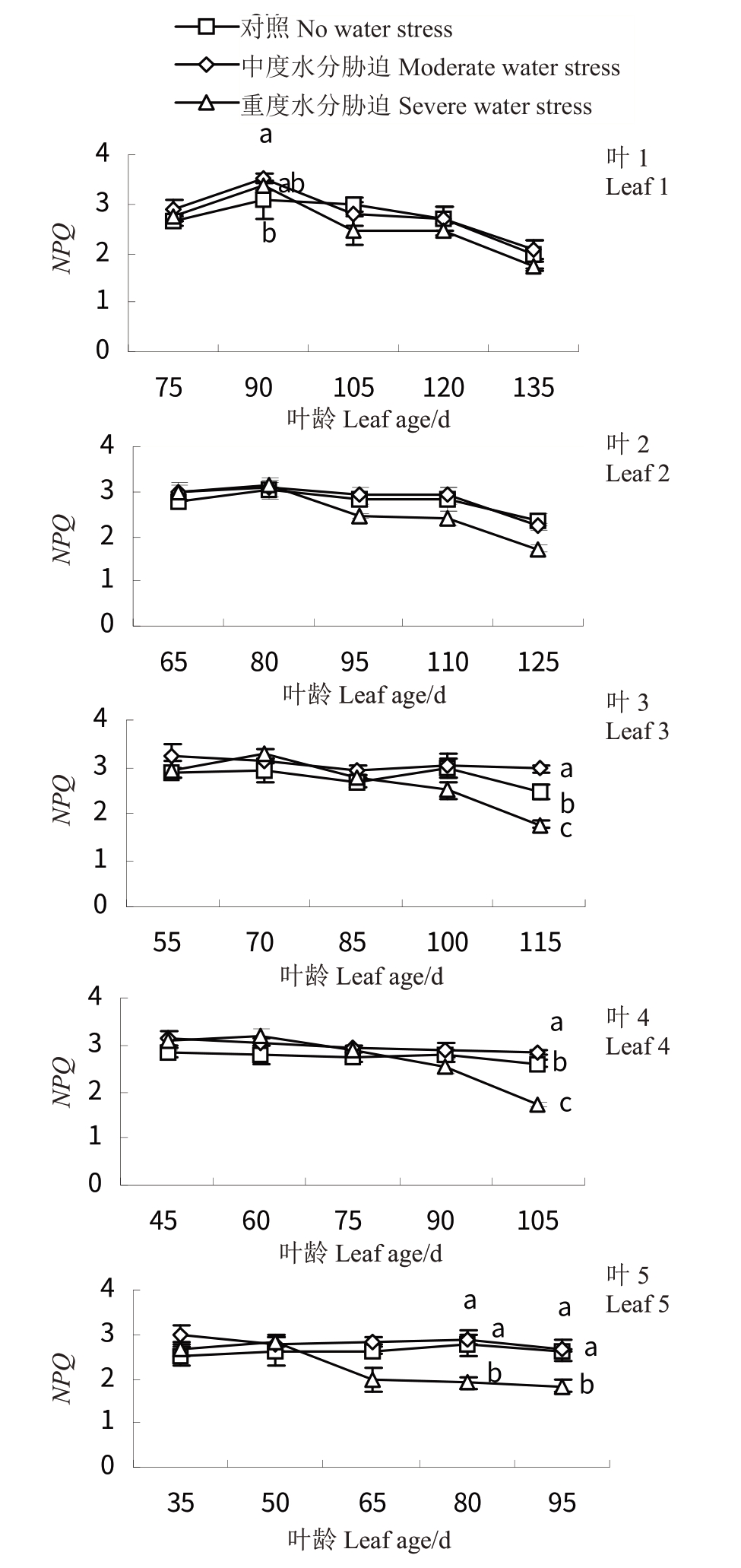
图12 水分胁迫对‘赤霞珠’不同叶龄叶片非光化学淬灭系数(NPQ)的影响
Fig.12 Effects of water stress on NPQ of‘Cabernet Sauvignon’at different leaf ages
3 讨 论
黎明前水势比土壤含水量更能真实地表现出植物的实际水分供应与耗损[20],所以本试验以黎明前水势来进行水分胁迫程度的划分。当植物缺水时,细胞膨胀压降低,细胞扩张变慢,细胞分裂停止,叶面积减小[21]。笔者发现中度水分胁迫对‘赤霞珠’各部位叶片面积无显著影响,而重度水分胁迫显著降低了中上部叶片(叶3~5)面积,这与李雅善等[22]研究的结论基本一致。
SPAD 值可以较好地反映植物叶片叶绿素浓度且其测定方法不会对植物叶片造成损害[23]。前人研究发现,外界环境对低叶龄叶片叶绿素含量的影响更大[15],这与本研究相似,‘赤霞珠’各部位叶片SPAD 值随着叶龄的增大而逐渐增加,除叶5 外,其他部位叶片SPAD值达到峰值后随着时间的推移均逐渐下降。本研究中,中度水分胁迫显著增加了‘赤霞珠’各部位叶片的SPAD 值,与之相反,重度水分胁迫显著降低了SPAD 值,表明适度的水分胁迫有助于‘赤霞珠’葡萄叶绿素的合成与积累,但持续的重度水分胁迫则会加速叶绿素的分解,最终导致植物光合色素含量下降[9,20]。光合作用下降是植物遭受干旱的主要生理表现之一[8-9],随着叶龄的增长,叶1~2的Pn逐渐下降的同时,叶3~5的Pn开始逐渐增加至较高水平,成为葡萄光合作用的主要功能部位。水分胁迫过程中幼龄叶片的Pn会有不同程度的下降,其中叶1、5 下降幅度较大。叶1 在叶龄135 d 时Pn已接近0,这与Xu 等[24]和程建军等[25]研究结果一致。持续的重度水分胁迫会加速新梢基部叶片老化,其光合能力的下降是不可恢复的[26]。王晶晶等[27]认为不同叶龄叶片气孔对水分胁迫的敏感度不同,这与本研究结果相同。叶1、叶2 和叶5 的Tr随着水分胁迫时间和程度的增加而不断下降。Gs和Pn呈现出相似的变化规律,这说明了叶片气孔导度可以作为衡量植物光合作用强弱的一个重要的指标[26]。Rubisco是植物碳同化过程中的关键酶,水分亏缺条件下Rubisco 活性降低是导致光合作用下降的主要因素[28-29]。笔者发现不同程度水分胁迫对‘赤霞珠’叶片光合酶影响不同,在中度水分胁迫下,除叶1 外,Rubisco 和FBPase 活性均未受到显著影响,而在重度胁迫下,叶1~5 叶片Rubisco 活性显著降低,而FBPase 活性在水分胁迫后期才受抑制,这与Bota 等[30]的研究结论一致。试验表明,叶1、5 受到水分胁迫影响最大,说明重度水分胁迫加速了基部老叶光合酶的降解,并且抑制了新梢上部叶龄较小叶片的正常发育,降低了光合同化效率。
荧光的变化说明了植物对环境胁迫的反应能力以及叶片损害程度[31]。重度水分胁迫下叶1~5 的Fo均在胁迫处理30 d时(叶1~5叶龄分别为90、80、70、60、50 d)显著增加后恢复至原来水平,说明重度水分胁迫处理前期PSⅡ反应中心受损或发生可逆失活,但随叶片叶龄的增加,热耗散增加,导致Fo降低,且叶1、叶2 和叶5 受伤害程度较大,这与前人研究结果一致[32]。Fv/Fm随着水分胁迫程度的加剧而减小,中度水分胁迫后期提高了叶1~4叶片的Fv/Fm值,说明胁迫后期叶1~4 光能利用率增加,这与前人研究结果一致[26]。重度水分胁迫显著降低了Yield 和ETR,其中叶1 和叶5 下降幅度较大,这与前人研究结果一致[11]。此外,中度和重度水分胁迫前期(处理0~15 d),可提高叶片Fv/Fm、Yield 和ETR 值,这与前人在香梨[33]的研究结论一致。
在中度水分胁迫处理前期,‘赤霞珠’葡萄叶1~5 叶片qP 值增加,重度水分胁迫NPQ 值增加,说明短期的中度水分胁迫会使叶片的荧光淬灭增加,而重度水分胁迫会显著提高热耗散带来的非光化学淬灭。随着重度水分胁迫的持续进行,叶1~5的qP和NPQ均显著降低,且叶1、2下降幅度较大,即叶片将光能转化为化学能和热能的能力均有所下降,说明持续的水分胁迫使叶绿素光保护能力减弱,PSⅡ光反应系统受到伤害[11,34]。
4 结 论
随着‘赤霞珠’葡萄叶片的生长发育,叶面积、叶绿素含量逐渐增大;光合能力呈单峰曲线变化,当葡萄叶片叶龄为60~90 d 时,光合能力最强。短期的水分胁迫可提高叶片的光合性能,但随着水分胁迫的持续进行,葡萄叶片光合效率逐渐下降。重度水分胁迫会阻碍葡萄幼龄叶片的正常发育,加速老龄叶片的衰老,从而降低其光合能力。
[1] JU Y L,XU G Q,YUE X F,ZHAO X F,TU T Y,ZHANG J X,FANG Y L. Effects of regulated deficit irrigation on amino acid profiles and their derived volatile compounds in Cabernet Sauvignon(Vitis vinifera L.)grapes and wines[J].Molecules,2018,23(8):1983.
[2] 刘军,齐广平,康燕霞,马彦麟,栗志.土壤水分胁迫对紫花苜蓿光合特性及其生物量的影响[J].干旱区研究,2019,36(4):893-900.LIU Jun,QI Guangping,KANG Yanxia,MA Yanlin,LI Zhi. Effects of soil water stress on photosynthetic characteristics and biomass of Medicago sativa[J]. Arid Zone Research,2019,36(4):893-900.
[3] CASASSA L F,KELLER M,HARBERTSON J F. Regulated deficit irrigation alters anthocyanins,tannins and sensory properties of Cabernet Sauvignon grapes and wines[J]. Molecules,2015,20(5):7820-7844.
[4] 蔺宝军,张芮,董博,温文,高彦婷,王引弟,杨昌钰,王腾飞.不同生育期干旱胁迫对温室葡萄WUE、产量及品质的影响[J].灌溉排水学报,2019,38(12):11-18.LIN Baojun,ZHANG Rui,DONG Bo,WEN Wen,GAO Yanting,WANG Yindi,YANG Changyu,WANG Tengfei.Effects of drought stress on WUE,yield and quality of greenhouse grape at different growth stages[J]. Journal of Irrigation and Drainage,2019,38(12):11-18.
[5] ROBY G,MATTHEWS M A.Relative proportions of seed,skin and flesh,in ripe berries from Cabernet Sauvignon grapevines grown in a vineyard either well irrigated or under water deficit[J].Australian Journal of Grape & Wine Research,2010,10(1):74-82.
[6] 张林,罗天祥.植物叶寿命及其相关叶性状的生态学研究进展[J].植物生态学报,2004,28(6):844-852.ZHANG Lin,LUO Tianxiang. Advances in ecological studies on leaf lifespan and associated leaf traits[J]. Chinese Journal of Plant Ecology,2004,28(6):844-852.
[7] SANTOS C M D,VERISSIMO V,FILHO H C D L W,FERREIRA V M,CAVALCANTE P G D S,ROLIM E V,ENDRES L. Seasonal variations of photosynthesis,gas exchange,quantum efficiency of photosystem II and biochemical responses of Jatropha curcas L. grown in semi-humid and semi-arid areas subject to water stress[J]. Industrial Crops & Products,2013,41(1):203-213.
[8] 陈凯利,李建明,贺会强,胡晓辉,姚勇哲,孙三杰.水分对番茄不同叶龄叶片光合作用的影响[J].生态学报,2013,33(16):4919-4929.CHEN Kaili,LI Jianming,HE Huiqiang,HU Xiaohui,YAO Yongzhe,SUN Sanjie.Effects of water on photosynthesis in different age of tomato leaves[J].Acta Ecologica Sinica,2013,33(16):4919-4929.
[9] YUAN X K,YANG Z Q,LI Y X,LIU Q,HAN W.Effects of different levels of water stress on leaf photosynthetic characteristics and antioxidant enzyme activities of greenhouse tomato[J].Photosynthetica,2016,54(1):1-13.
[10] WOODROW I E,BERRY J A. Enzymatic regulation of photosynthetic CO2,fixation in C3 plants[J].Annual Review of Plant Biology,1988,39(1):533-594.
[11] 唐婧文,梁文斌,邹辉,陈雪妮.土壤水分胁迫对多花黄精光合作用及叶绿素荧光参数的影响[J].中南林业科技大学学报,2019,39(5):110-118.TANG Jingwen,LIANG Wenbin,ZOU Hui,CHEN Xueni. Effects of water stress on photosynthesis and chlorophyll fluorescence parameters of Polygonatum cyrtonema[J].Journal of Central South University of Forestry & Technology,2019,39(5):110-118.
[12] 史为民,陈青云,乔晓军.日光温室黄瓜叶片光合速率模型及其参数确定的初步研究[J].农业工程学报,2005,21(5):113-118.SHI Weimin,CHEN Qingyun,QIAO Xiaojun. Preliminary study on the model for the photosynthesis rate of cucumber leaves at different ages and determination of parameters in sunlight greenhouse[J].Transactions of the Chinese Society of Agricultural Engineering,2005,21(5):113-118.
[13] TACONO F,SOMMER K J. Response of electron transport rate of water stress-affected grapevines: Influence of leaf age[J]. Vitis,2000,39(4):137-144.
[14] 牛歆雨,刘林,张良英.室内盆栽葡萄的光合特性研究[J].安徽农业科学,2012,40(28):13740-13741.NIU Xinyu,LIU Lin,ZHANG Liangying. Study on photosynthetic characteristics of indoor potted grape[J]. Journal of Anhui Agricultural Sciences,2012,40(28):13740-13741.
[15] 理挪,王培,PEGGY C A E,林思祖,陈宇.不同叶龄杉木叶片形态及光合特性分析[J].亚热带农业研究,2018,14(3):167-171.LI Nuo,WANG Pei,PEGGY C A E,LIN Sizu,CHEN Yu. Leaf morphology and photosynthetic characteristics at different leaf ages in Chinese fir[J]. Subtropical Agriculture Research,2018,14(3):167-171.
[16] ACEVEDO-OPAZO C,ORTEGA-FARIAS S,FUENTES S.Effects of grapevine (Vitis vinifera L.) water status on water consumption,vegetative growth and grape quality: An irrigation scheduling application to achieve regulated deficit irrigation[J].Agricultural Water Management,2010,97(7):956-964.
[17] 吴玉德,刘继生.苹果梨单叶面积的测定方法[J].延边大学农学学报,2006,28(4):259-262.WU Yude,LIU Jisheng. Mensuration methods for single leaf area of apple-pear[J].Agricultural Science Journal of Yanbian University,2006,28(4):259-262.
[18] CHENG L L,FUCHIGAMI L H. Rubisco activation state decreases with increasing nitrogen content in apple leaves[J].Journal of Experimental Botany,2000,51:1687-1694.
[19] RAO I M,TERRY N.Leaf phosphate status,photosynthesis and carbon partitioning in sugar beet:Ⅰ.Changes in growth,gas exchange,and calvin cycle enzymes[J].Plant Physiology,1989,90(3):814-819.
[20] 胡宏远,王振平.水分胁迫对赤霞珠葡萄光合特性的影响[J].节水灌溉,2016(2):18-22.HU Hongyuan,WANG Zhenping.The effects of water stress on photosynthetic characteristics of Cabernet Sauvignon[J]. Water Saving Irrigation,2016(2):18-22.
[21] PANTIN F,SIMONNEAU T,MULLER B. Coming of leaf age:control of growth by hydraulics and metabolics during leaf ontogeny[J].The New phytologist,2012,196(2):349-366.
[22] 李雅善,李华,王华,南立军.设施栽培下不同灌溉处理对‘希姆劳特’植株生长及果实的影响[J].中国农业科学,2014,47(9):1784-1792.LI Yashan,LI Hua,WANG Hua,NAN Lijun.Effects of different irrigation treatments on the growth and fruit quality of Himrod in protected cultivation[J]. Scientia Agricultura Sinica, 2014, 47(9):1784-1792.
[23] 苏云松,郭华春,陈伊里.马铃薯叶片SPAD 值与叶绿素含量及产量的相关性研究[J]. 西南农业学报,2007,20(4):690-693.SU Yunsong,GUO Huachun,CHEN Yili. Relationship between SPAD readings chlorophyll contents and yield of potato (Solanum tubersosum L.)[J]. Southwest China Journal of Agricultural Sciences,2007,20(4):690-693.
[24] XU Z Z,ZHOU G S,WANG Y L,HAN G X,LI Y J. Changes in chlorophyll fluorescence in maize plants with imposed rapid dehydration at different leaf ages[J]. Journal of Plant Growth Regulation,2008,27(1):83-92.
[25] 程建军,高照全,吴晓云.不同叶龄草莓叶片光合能力比较研究[J].安徽农业科学,2012,40(26):12793-12794.CHENG Jianjun,GAO Zhaoquan,WU Xiaoyun. Comparative study of strawberry (Fragaria ananassa Duchesne) leaves photosynthetic capacity at different ages[J]. Journal of Anhui Agricultural Sciences,2012,40(26):12793-12794.
[26] 张栋.干旱胁迫对苹果光合作用和叶绿素荧光的影响及叶片衰老特性研究[D].杨凌:西北农林科技大学,2011.ZHANG Dong. Effects of drought stress on photosynthesis and fluorescence chlorophyll parameters of apple leaves and leaf senescence characterisitics[D].Yangling:Northwest A&F University,2011.
[27] 王晶晶,莫伟平,贾文锁,刘国杰.干旱条件下葡萄叶片气孔导度和水势与节位变化的关系[J]. 中国农业科学,2013,46(10):2151-2158.WANG Jingjing,MO Weiping,JIA Wensuo,LIU Guojie.The relationship of grape leaf stomatal conductance and water potential with leaf position under drought conditions[J].Scientia Agricultura Sinica,2013,46(10):2151-2158.
[28] 胡梦芸,张正斌,徐萍.作物几种光合酶与抗旱节水的关系研究进展[J].干旱地区农业研究,2008,26(2):251-256.HU Mengyun,ZHANG Zhengbin,XU Ping. Research progress on important enzymes of crop photosynthesis and its relations to resisting drought and saving water[J]. Agricultural Research in the Arid Areas,2008,26(2):251-256.
[29] 江力,刘义新,张荣铣.烟叶成熟衰老过程中光合电子传递和光合酶活性变化的研究[J].华中农业大学学报,2000,19(6):533-536.JIANG Li,LIU Yixin,ZHANG Rongxian.Study on the changes of activities of photosynthetic electron transport and photosynthetic enzyme during the maturation and senescence of tobacco leaves[J].Journal of Huazhong Agricultural University,2000,19(6):533-536.
[30] BOTA J,MEDRANO H,FLEXAS J. Is photosynthesis limited by decreased Rubisco activity and RuBP content under progressive water stress?[J].New Phytologist,2004,162(3):671-681.
[31] 尤鑫,龚吉蕊.叶绿素荧光动力学参数的意义及实例辨析[J].西部林业科学,2012,41(5):90-94.YOU Xin,GONG Jirui. Significance and application of chlorophyll fluorescence dynamics process parameters[J]. Journal of West China Forestry Science,2012,41(5):90-94.
[32] 李敏敏,袁军伟,韩斌,刘长江,孙艳,尹勇刚,贾楠,郭紫娟,赵胜建.干旱和复水对两种葡萄砧木叶片光合和叶绿素荧光特性的影响[J].干旱地区农业研究,2019,37(1):221-226.LI Minmin,YUAN Junwei,HAN Bin,LIU Changjiang,SUN Yan,YIN Yonggang,JIA Nan,GUO Zijuan,ZHAO Shengjian.Effect of drought and rewatering on the photosynthesis and chlorophyll fluorescence of two grape rootstock leaves[J]. Agricultural Research in the Arid Areas,2019,37(1):221-226.
[33] 武阳,王伟,赵智,黄兴法,范云涛,苏柳芸.调亏灌溉对香梨叶片光合速率及水分利用效率的影响[J]. 农业机械学报,2012,43(11):80-86.WU Yang,WANG Wei,ZHAO Zhi,HUANG Xingfa,FAN Yuntao,SU Liuyun. Photosynthesis rate and leaf water use efficiency of Korla Fragrant pear tree under regulated deficit irrigation[J].Transactions of the Chinese Society for Agricultural Machinery,2012,43(11):80-86.
[34] 刘军,齐广平,康燕霞,马彦麟,银敏华,李晓敏,栗志.不同灌溉处理下紫花苜蓿光合特性、叶绿素荧光参数及生物量的变化[J].草地学报,2019,27(6):1569-1576.LI Jun,QI Guangping,KANG Yanxia,MA Yanlin,YIN Minhua,LI Xiaomin,LI Zhi. Photosynthetic characteristics, chlorophyll fluorescence parameters and biomass of alfalfa under different irrigation treatments[J].Acta Agrestia Sinica,2019,27(6):1569-1576.